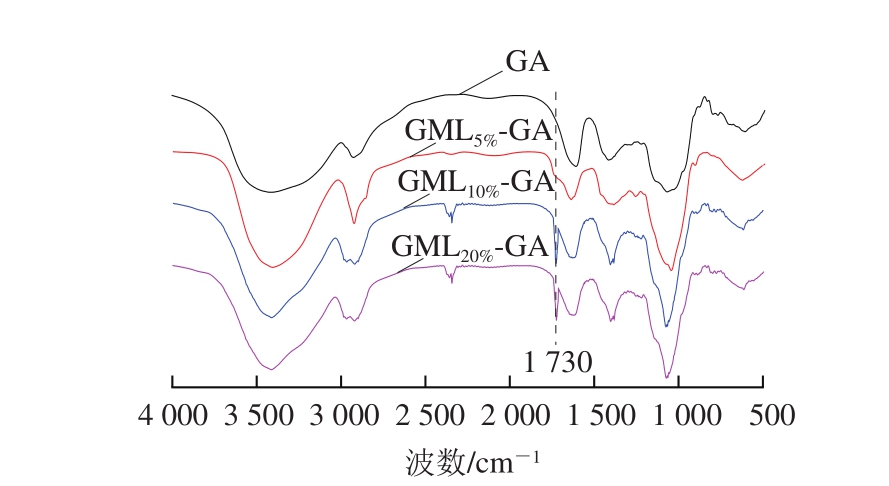
图1 未改性和改性阿拉伯胶(GA, GML5%-GA, GML10%-GA,GML20%-GA)的傅里叶变换红外光谱图
Fig. 1 FTIR spectra of native and grafted gum arabic (GA,GML5%-GA, GML10%-GA, and GML20%-GA)
阿拉伯胶(gum arabic,GA)来源于金合欢属植物枝干所分泌的树胶,其应用历史悠久,也是最早由美国食品及药品管理局(Food and Drug Administration,FDA)批准用于食品的亲水胶体之一[1-2]。GA功能多样,作为天然的乳化剂、黏合剂、稳定剂、成膜剂、悬浮剂以及水溶性膳食纤维,已被广泛应用于食品、日化、医药等诸多领域[3]。天然GA含有少量蛋白质,是多组分高度支化的杂多糖,含有3 种主要组分,即阿拉伯半乳聚糖(arabinogalactan,AG)、阿拉伯半乳聚糖蛋白(arabinogalactan protein,AGP)和糖蛋白(glycoprotein,GP),3 种组分分别约占胶体总量的88%、10%和2%。其中AGP分子结构为多个AG连接于多肽链上,具有“编花状”结构[4-5],其疏水肽链和亲水多糖链段使AGP具备两亲性,能够吸附在油水界面形成界面膜,减小油水两相间的界面张力。尽管AGP组分仅约占胶体总量的10%,但被认为是赋予阿拉伯胶乳化特性的最重要组分[7-8];高含量组分AG具有高度支化结构,其主链由(1→3)糖苷键连接的β-D-吡喃半乳糖组成,侧链主要为2~5 个经(1→3)糖苷键连接的β-D-吡喃半乳糖,经由(1→6)糖苷键连接于主链糖单元的C6位上。此外,AG的主链和侧链上还含有阿拉伯糖、鼠李糖和葡萄糖醛酸单元[9-10]。
GA水溶性高、溶液黏度低、乳化性能好,且具有良好的耐酸性和热稳定性,是应用最为广泛的一种天然高分子食品乳化剂。然而实际使用中,通常需采用较高浓度(15%~25%)才能有效稳定油水乳液[6,11-12]。此外,世界上大部分金合欢树都生长在非洲萨赫勒地区,因此GA的供给也常受到该地区气候、经济和政策的影响。为满足工业上对提高GA乳化性能的更高需求,已有研究从不同角度开展了通过改性增强GA乳化特性的工作,如采用辛烯基琥珀酸酐[12-14]、十二烯基琥珀酸酐[15]改性GA提高其乳化性能。
单月桂酸甘油酯(glyceryl monolaurate,GML)分子结构中含有亲水的羟基和亲油的脂肪酸链,是一类亲脂性的非离子型表面活性剂,1977年即被美国FDA批准为“一般认为安全类”食品添加剂,我国也于2005批准其用于食品[16]。由于GML本身具有良好的乳化性能,且有防腐、抑菌功能,能够抑制多种原生动物和病毒,故常被作为乳化剂或抑菌剂添加于食品、化妆品以及日用品中[17]。但水溶性差的不足在很大程度上限制了GML的更广泛应用。
本研究采用GML作为疏水组分经酯化反应接枝于GA分子上以提高GA的乳化性能,研究不同GML取代程度对GA乳化性的影响,并探讨改性产物乳化作用提高的机理。
阿拉伯胶(RE-PCO281A) 英国Agrigum International公司;GM、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC) 日本TCI公司;4-二甲氨基吡啶(4-dimethylaminopyridine,DMAP) 国药集团上海化学试剂有限公司;大豆油 益海嘉里公司;尼罗红 上海萨恩化学技术公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、无水乙醇均为国产分析纯试剂。
HAAKE MARS III旋转流变仪 美国赛默飞世尔科技公司;T25(S25N-10G)数显高速分散均质机 德国IKA公司;LUMiSizer稳定性分析仪 德国LUM. GmbH公司;Zetasizer Nano-ZS90粒径分析仪 英国Malvern仪器公司;MZ3004磁力搅拌器 上海志威电器有限公司;Leica TCS SP8激光共聚焦显微镜 德国莱卡公司;FA1004精密电子天平 上海天平仪器公司;Simplicity超纯水系统 彤迪科学仪器(上海)有限公司;SZ-93A自动双重纯水蒸馏器 上海亚荣生化仪器厂;LGJ-10型冷冻干燥机 北京四环仪器厂。
1.3.1 接枝改性产物GML-GA的制备
精确称取2.0 g GA溶于混合溶剂(水-DMSO,4∶6,V/V)中,室温搅拌至完全溶解;随后加入340 mg EDC和215 mg DMAP作为催化剂,搅拌1 h活化羧基;根据不同投料比(GML/GA为5%、10%、20%,m/m)分别称取适量GML加入上述GA溶液,35 ℃反应24 h;所得反应液用DMSO透析24 h,再用去离子水透析4 d;最后冷冻干燥,制备得到3 种不同投料比的改性产物(GML-GA),分别记为GML5%-GA、GML10%-GA和GML20%-GA。
1.3.2 傅里叶变换红外光谱表征
采用定量称量溴化钾压片法,将上述3 种改性物分别与溴化钾粉末以1∶100的质量比加入研钵后进行研磨后压片。采用傅里叶变换红外光谱仪进行测试,扫描波数范围为4 000~500 cm-1。
1.3.3 多糖溶液和大豆油乳液制备
分别称取适量GA和改性物GML5%-GA、GML10%-GA以及GML20%-GA加入超纯水中,搅拌至完全溶解,配制质量浓度分别为0.005、0.015、0.03 g/mL的溶液,配制中还加入了适量叠氮化钠(0.005%)作为抑菌剂;将适量大豆油加入上述GA和GML-GA的溶液中,用高速剪切均质机在15 000 r/min均质20 min,制备5%的水包油乳液。
1.3.4 表观黏度测定
采用Haake控制应力型旋转流变仪对改性GML-GA和未改性GA的溶液表观黏度进行测定。实验测试夹具为直径60 mm的平行板,板间隙0.5 mm,测试温度为25 ℃。上样后,样品暴露外围用轻质硅油封样以防止水分挥发,静置5 min后开始测试,剪切速率范围为10~1 000 s-1。
1.3.5 乳液物理稳定性测试
采用稳定性分析仪LUMiSizer对新鲜大豆油乳液的物理稳定性进行测试。测试参数为:光源865 nm,转速3 000 r/min,温度25 ℃,取线时间间隔30 s,测试时间1 h。
1.3.6 乳液粒径、Zeta电位测试
将新鲜制备好的大豆油乳液用超纯水稀释100 倍后,通过Zetasizer Nano-ZS90粒径分析仪测试乳液中液滴的粒径、Zeta电位。测试温度为25 ℃。每个样品平行测3 次取平均值。
1.3.7 激光共聚焦显微镜观察
采用激光共聚焦显微镜观察大豆油乳液的液滴形貌。首先配制质量分数为0.5%的尼罗红-乙醇溶液,取适量该尼罗红染料对乳液染色后,再取约2 μL乳液滴加在载玻片上,然后盖上盖玻片,选择40 倍物镜观察液滴形貌并采集图像。尼罗红的激发波长为488 nm,发射波长为580 nm。

图1 未改性和改性阿拉伯胶(GA, GML5%-GA, GML10%-GA,GML20%-GA)的傅里叶变换红外光谱图
Fig. 1 FTIR spectra of native and grafted gum arabic (GA,GML5%-GA, GML10%-GA, and GML20%-GA)
对GA及改性GA的结构采用傅里叶变换红外光谱进行表征。图1中,3 426 cm-1处的宽吸收峰为—OH的伸缩振动峰[18],2 925 cm-1处为C-H键的伸缩振动峰[19-20],1 630 cm-1和1 420 cm-1两处吸收峰分别为羧基上C=O键的不对称伸缩振动和对称伸缩振动峰[21],1 040 cm-1处为C—O键的伸缩振动[22]。对比GA,改性后的GML-GA在1 730 cm-1处出现了一个明显的吸收峰。该特征峰为改性反应生成的酯羰基的不对称伸缩振动峰[18,23],表明GML被成功地通过酯化反应接枝于GA分子上。此外,随着GML/GA投料比的增加,该峰强度也依次增强(GML20%-GA>GML10%-GA>GML5%-GA)。显然,随着投料比的增加,产物的GML取代程度增加。
本研究采用EDC/DMAP催化酯化反应。DMAP的作用主要是活化羧基,而EDC主要起到缩水剂的作用。EDC/DMAP活化羧基不具有选择性,因此EDC/DMAP可以同时活化AG和AGP上的羧基,最终GML的羟基在EDC/DMAP催化下可以同时与AG和AGP上的羧基发生酯化反应。尽管难以区分GML主要接枝于GA中的AG组分还是AGP组分分子上,但由于体系中AG组分含量(约占阿拉伯胶体总量的88%)远大于AGP含量(约占阿拉伯胶体总量的10%),因此,GML应主要接枝于AG组分上。
对多糖的疏水改性往往会影响其水溶液流变性质,例如对透明质酸[24]和果胶[25]的烷基化改性可使其流变学性质发生变化。对于GA,引入辛烯基琥珀酸酐改性会导致其水溶液的表观黏度上升[12]。由于乳化剂水溶液的剪切流变行为可反映相应乳液体系的流变性质[26],因此考察不同质量浓度(0.005、0.01、0.015 g/mL)条件下,GA和GML-GA乳化剂水溶液的流动行为。测试发现,改性前后GA溶液均表现出牛顿流体性质,且相同质量浓度下不同投料比制备GML-GA与GA溶液的流动曲线几乎重合(图2a~c)。该结果表明,接枝GML后的GA与未改性GA溶液的流变性质相同。由于接枝改性并不改变GA分子结构高度支化的特点,而高度支化的分子链不易发生缠结,因而低质量浓度下溶液黏度很低且呈牛顿流体行为[27];而当多糖质量浓度增大时,由于分子间相互作用增强,致使溶液表观黏度有所上升(图2d)。
乳液体系的黏度是决定其稳定性的关键因素之一。乳液体系黏度的增加可使液滴自由运动时所受阻力增大,从而有效减缓凝聚或聚集等不稳定现象的发生[28]。但另一方面,由于高黏度也会迟滞乳化剂分子的运动,在乳液制备或破乳时影响其在界面的富集和乳化膜形成动力学,从而削弱乳化作用。在需要具有乳化膜形成快速动力学和乳液体系低黏度的情况下,本研究所得GMLGA能体现出与GA相同的优势。

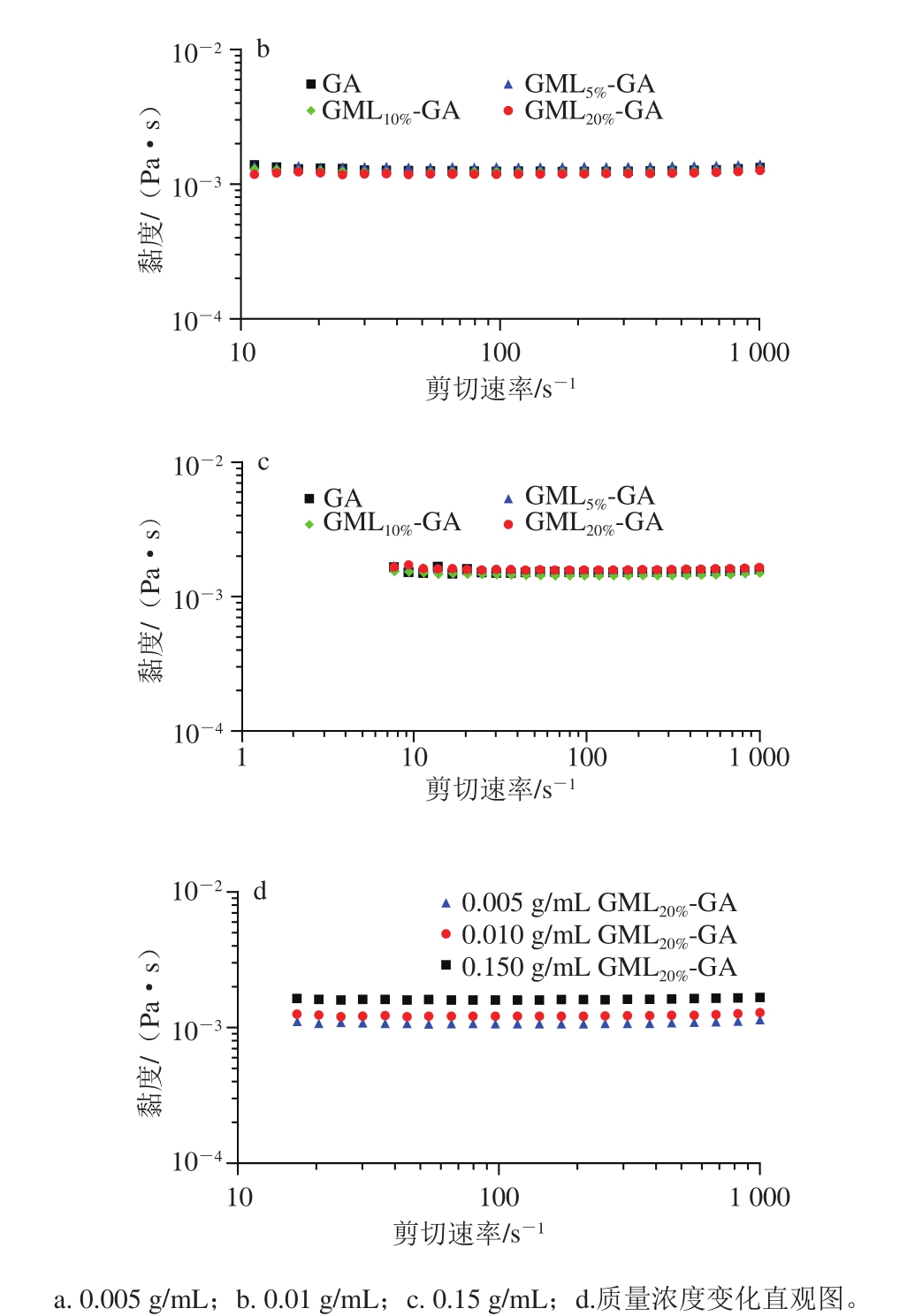
图2 未改性和改性阿拉伯胶溶液的表观黏度随剪切速率和质量浓度的变化(25 ℃)
Fig. 2 Shear rate and concentration dependence of apparent viscosity of native and grafted gum arabic aqueous solutions at different concentrations (25 ℃)
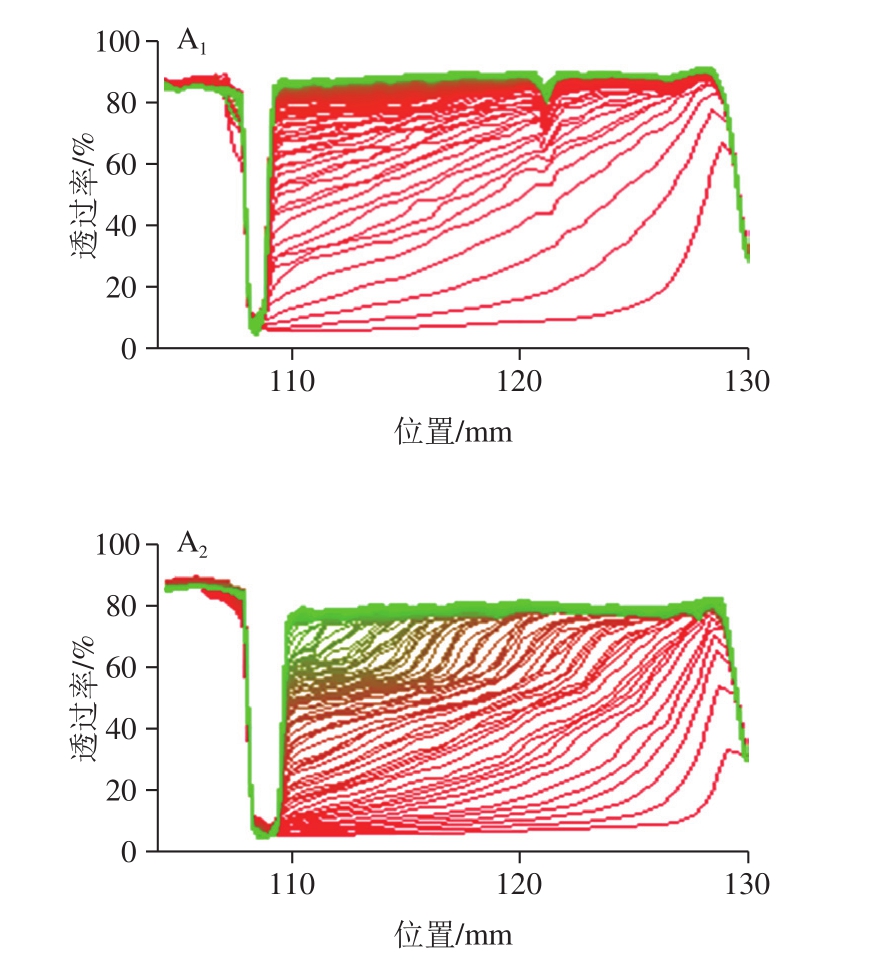

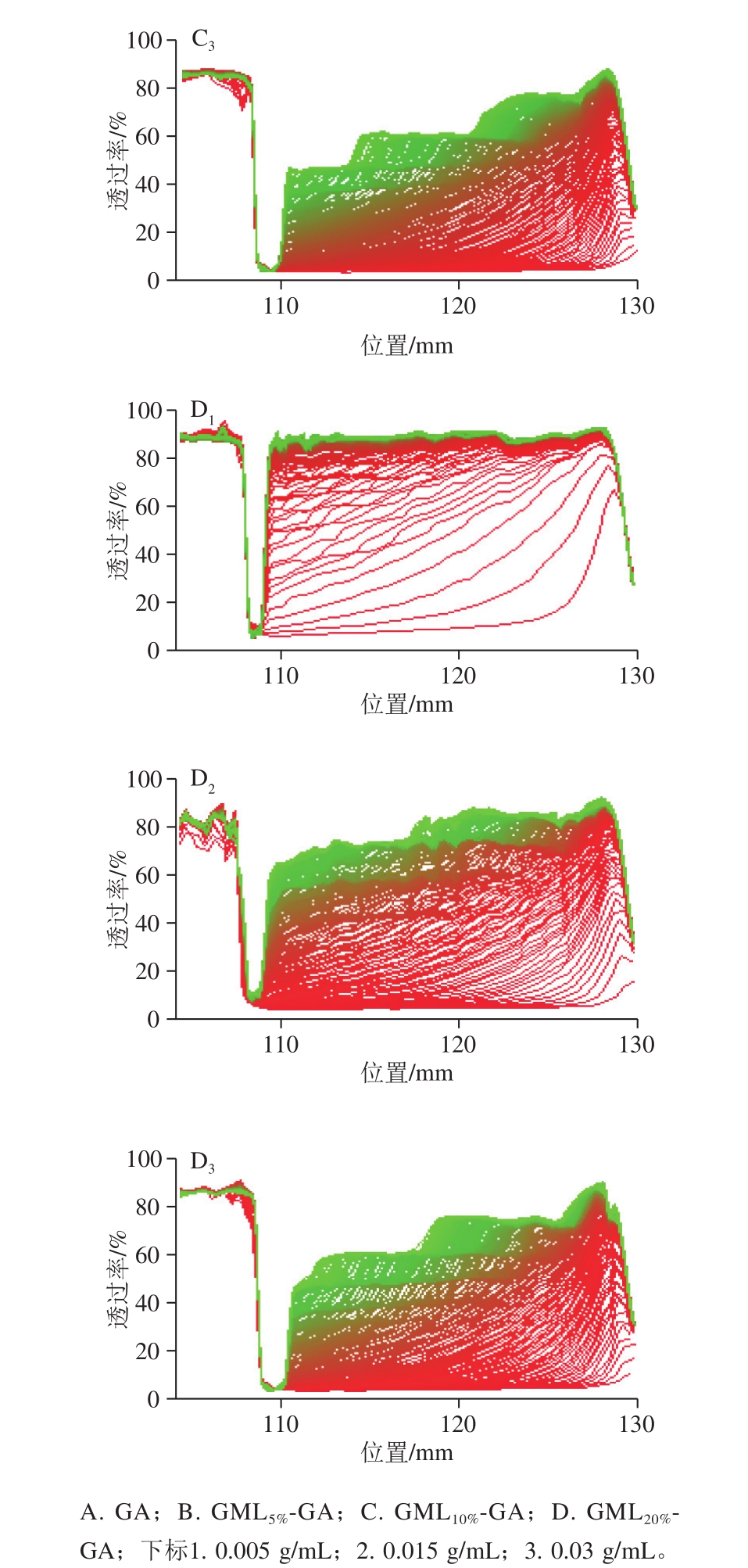
图3 不同质量浓度未改性和改性阿拉伯胶制备的5%大豆油乳液的LUMiSizer透射曲线演化图(25 ℃)
Fig. 3 Temporal evolution of transmission profiles of soybean oil emulsions stabilized by native and grafted gum arabic at different concentrations and 25 ℃
表1 不同质量浓度下未改性和改性阿拉伯胶制备的大豆油乳液的不稳定指数
Table 1 Instability index of 5% soybean oil emulsions stabilized by native and grafted gum arabicat different concentrations (25 ℃)
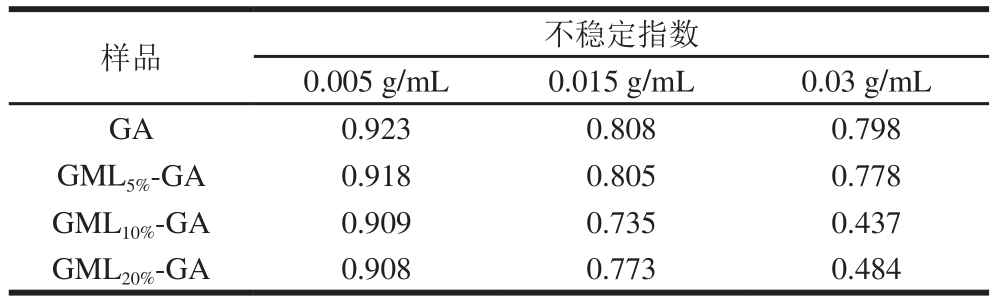
样品 不稳定指数0.005 g/mL 0.015 g/mL 0.03 g/mL GA 0.923 0.808 0.798 GML5%-GA 0.918 0.805 0.778 GML10%-GA 0.909 0.735 0.437 GML20%-GA 0.908 0.773 0.484
由图3可知,对于乳化剂质量浓度仅为0.005 g/mL的GA和GML5%-GA、GML10%-GA、GML20%-GA 4 组乳液样品,随着离心时间的延长,样品池的透过率迅速增加,测试1 h后的最终透过率达90%。乳液的不稳定指数值均大于0.9(表1)。这说明添加质量浓度很低时,4 组乳液样品的稳定性均较差,不能反映各乳化剂乳化性能的高低;当乳化剂质量浓度增加至0.015 g/mL时,GA组和GML5%-GA组乳液的不稳定指数略微减小,分别为0.808和0.805,而GML10%-GA组和GML20%-GA组乳液的不稳定指数降低至0.735和0.773,其透过率曲线随着离心时间延长逐渐发生变化,样品池底部的透过率逐渐增加,而样品池顶部的透过率逐渐递减。这是因为乳液中的油滴发生聚集,油滴密度低而向上移动,样品池底部水相逐渐澄清,因此透过率逐渐增加。而当质量浓度继续增大至0.03 g/mL时,GA和GML5%-GA、GML10%-GA、GML20%-GA 4 组乳液样品的不稳定指数依次降低至0.798、0.778、0.437、0.484。相比未改性GA,投料比为10%和20%的改性GA的乳液不稳定指数大幅减小,乳化稳定性显著提高。可见,GML对GA疏水改性有效地调节了GA的两亲性,进而提高了其乳化能力。当GML投料5%时(轻度改性GA),所制备乳液的稳定性仅略有提高;当投料比增加至10%时,改性GA的乳化稳定性显著增强;然而当投料比继续增大至20%,GML20%-GA组乳液的不稳定指数相比GML10%-GA组略微增加,这可能归因于改性程度较大,使GA分子中疏水组分含量过多,反而导致乳化稳定作用有所减弱。本研究的5%、10%、20% 3 个投料比中,最佳投料比为10%。
油水体系在均质作用下主要发生以下3 个过程:1)油相被破碎形成小液滴;2)乳化剂吸附在新形成的油滴表面,疏水链段伸入油相,亲水端伸入连续相;3)液滴相遇时,乳化剂分子通过静电排斥或空间位阻作用阻止液滴聚集[29-30]。均质后乳液中液滴粒径尺寸是评价乳化剂乳化性能的重要参数,而Zeta电位则反映了相邻液滴双电层之间静电排斥效应对体系稳定性的贡献。
表2 不同质量浓度未改性和改性阿拉伯胶制备的大豆油乳液的平均粒径、Zeta电位
Table 2 Droplet size and zeta-potential of 5% soybean oil emulsions stabilized by native and grafted gum arabic at different concentrations
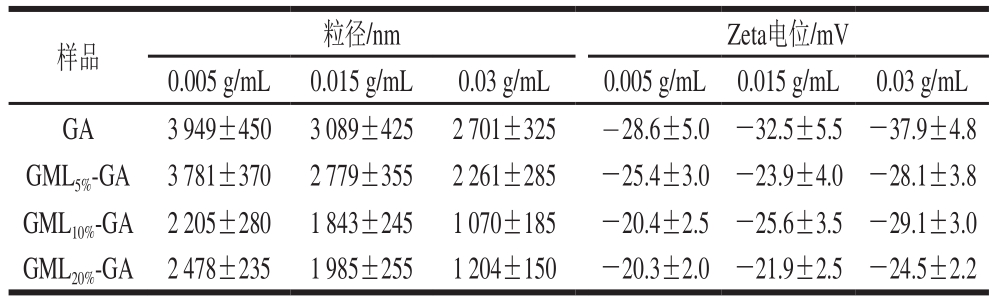
样品 粒径/nm Zeta电位/mV 0.005 g/mL 0.015 g/mL 0.03 g/mL 0.005 g/mL 0.015 g/mL 0.03 g/mL GA 3 949±450 3 089±425 2 701±325 -28.6±5.0 -32.5±5.5 -37.9±4.8 GML5%-GA 3 781±370 2 779±355 2 261±285 -25.4±3.0 -23.9±4.0 -28.1±3.8 GML10%-GA 2 205±280 1 843±245 1 070±185 -20.4±2.5 -25.6±3.5 -29.1±3.0 GML20%-GA 2 478±235 1 985±255 1 204±150 -20.3±2.0 -21.9±2.5 -24.5±2.2
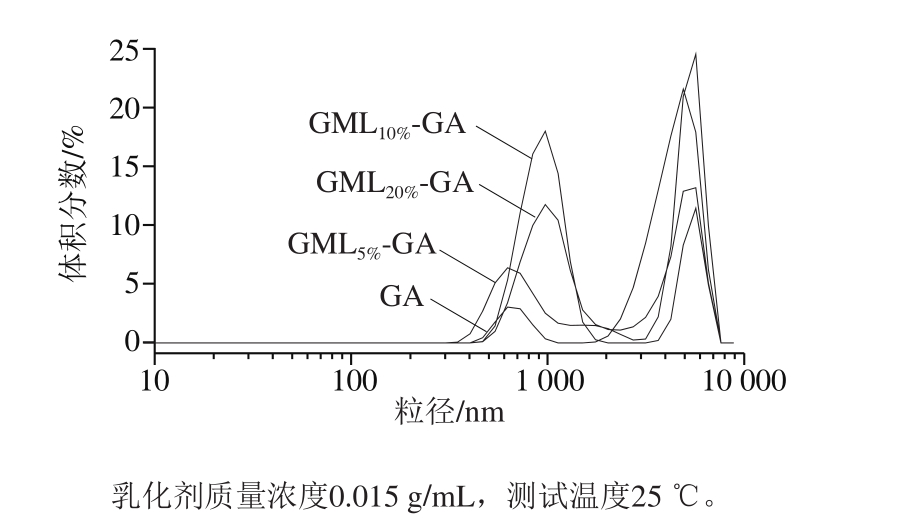
图4 未改性和改性阿拉伯胶制备的0.015 g/mL大豆油乳液的粒径分布图
Fig. 4 Particle size distribution of soybean oil emulsions stabilized by native and grafted gum arabic at a concentration of 0.015 g/mL
如表2所示,一方面,乳液中液滴的平均粒径与添加的乳化剂浓度呈负相关,即随着乳化剂浓度增加,液滴粒径降低,如对于GML10%-GA,粒径由添加量为0.005 g/mL时的2 205 nm大幅下降到0.03 g/mL时的1 070 nm;另一方面,在乳化剂添加量一定时,粒径随GA改性程度增大而减小。以乳化剂添加质量浓度0.015 g/mL为例,由添加未改性GA和轻度改性GML5%-GA时的2 779 nm,降至添加GML10%-GA和GML20%-GA时的约2 000 nm。液滴粒径的减小明显反映出改性乳化剂较高的乳化能力。其中GML20%-GA组乳液的粒径略高于GML10%-GA,这是因为疏水改性程度高时,改性分子之间疏水作用增强,反而不利于乳化剂分子扩散并吸附在油/水界面,从而导致液滴平均粒径的增大。如图4所示,改性后的液滴粒径呈双峰分布的趋势更明显。这可能由于改性引入的疏水链段主要接枝在AG上,赋予了原本没有乳化作用的AG组分界面活性,使得乳滴可能由不同组分稳定,形成了明显的双峰粒径分布。
Zeta电位反映乳液中颗粒表面的带电性质。一般而言,Zeta电位绝对值越高,颗粒间静电作用越强,液滴间抗凝聚和聚集能力越强[31]。由表2可知,所有样品的Zeta电位均为负值且随质量浓度增加而绝对值增大。这是由于GA结构中含有羧酸根带电基团,Zeta电位的绝对值与乳化剂质量浓度成正相关。实验发现,改性后阿拉伯胶的Zeta电位绝对值有所减小。这是由于GML与GA酯化反应消耗了GA分子上的羧基,因此液滴表面所带电荷减少。影响乳液稳定性的因素多而复杂,如液滴大小、Zeta电位、连续相黏度及吸附膜强度等。本研究中,添加改性GA乳液的Zeta电位绝对值仍较高,介于20~30 mV,特别是对于GML10%-GA乳化的体系,其Zeta电位绝对值可达约30 mV,因此液滴间静电排斥作用仍较强。
利用尼罗红对脂类及蛋白质类物质染色,通过荧光标记脂类和蛋白,可采用激光共聚焦显微镜更直观地观察乳液中油滴的尺寸和分散情况[32-33]。如图5所示,相同条件下,未改性天然GA制备的乳液中液滴平均粒径较大,其中部分液滴还容易发生聚集而形成大液滴,而改性后GML-GA乳化剂制备的乳液油滴粒径明显变小,特别是对于GML10%-GA乳化的乳液体系,液滴粒径最小且分散更均匀。共聚焦荧光显微镜观察的乳液液滴尺寸,与表2中测量所得粒径结果相吻合,均表明GML改性能够明显提高GA的乳化效果。显微观察中的液滴粒径大小分布,也印证了上述粒径测试的多分散性(图4),可能是因为改性后使得原先没有乳化效果的AG组分也具有界面活性,不同乳化活性组分在乳化过程中形成了粒径不同的液滴。该结果还预示着AGP组分与改性AG组分的乳化作用有所不同。
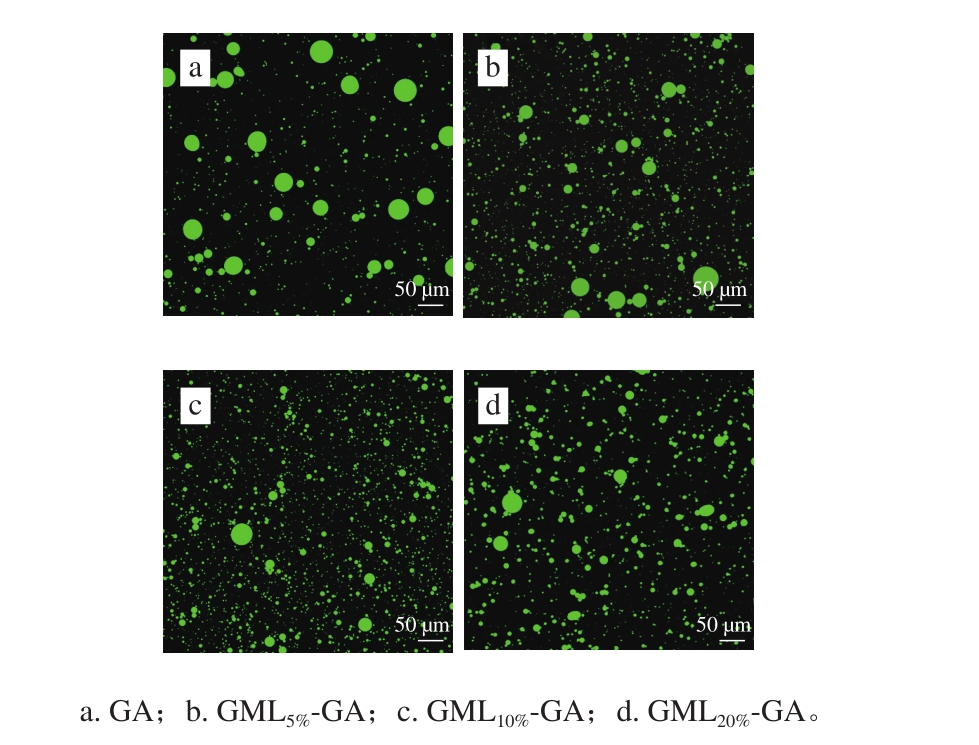
图5 质量浓度为0.015 g/mL的未改性和改性阿拉伯胶制备的大豆油乳液的共聚焦显微镜图像
Fig. 5 Representative confocal laser microscopy images of soybean oil emulsions stabilized by native and grafted gum arabic at a concentration of 0.015 g/mL
乳液粒径的减小和乳液稳定性的增强反映出改性后GA乳化作用的提高。阿拉伯胶中的羧基主要源于葡萄糖醛酸,而葡萄糖醛酸主要以侧基的形式连接在半乳糖主链上[3]。由于阿拉伯胶中AG组分质量占比高达88%,因此可以认为阿拉伯胶中的羧基主要由AG组分提供。由于本研究涉及的改性反应为阿拉伯胶上的羧基与GML上的羟基发生酯化反应,故认为GML主要接枝在AG上。本研究认为改性后乳化作用的提高可能主要得益于接枝改性使得原本对乳化作用无贡献但质量占比很高的AG组分得以被充分利用。因而,改性后的GA中存在了2 种有乳化作用的组分,即改性AG和AGP。尽管可能部分AGP也被接枝,但考虑到其质量占比较小,只可能少部分AGP发生酯化反应。因此,改性后GA乳化能力的提高主要来源于改性的AG。
对比天然GA,通过接枝改性引入GML,总体上增加了高水溶性GA分子的疏水性。接枝反应可能主要发生于GA中的AG组分和GML之间,使得原本对乳化作用贡献很小但占比很大的AG组分成为两亲性分子,从而显著提高GA乳化剂的水油界面活性。在本实验研究的3 个投料比中,GML10%-GA乳化制备的大豆油乳液呈现出最小的液滴尺寸和最佳物理稳定性。水溶液流变性质还显示,接枝GML分子并未改变GA牛顿流体的流变特性。接枝改性不仅能显著提高GA的乳化性能和乳液稳定性,同时还赋予了阿拉伯胶GML所具有的防腐、抑菌特性。GMLGA乳化剂在需要低添加量、低黏度、长周期稳定性的乳液领域具有潜在的积极应用价值。
[1] 张洪斌. 多糖及其改性材料[M]. 北京: 化学工业出版社, 2014: 252-265.
[2] ISLAM A M, PHILIPS G O, SLJIVO A, et al. A review of recent developments on the regulatory, structural and functional aspects of gum arabic[J]. Food Hydrocolloids, 1997, 11(4): 493-505.DOI:10.1016/S0268-005X(97)80048-3.
[3] KENNEDY J F, PHILLIPS G O, WILLIAMS P A. Gum arabic[M].RSC Publishing, 2012: 155-168.
[4] IDRIS O H M, WILLIAMS P A, PHILIPS G O. Characterisation of gum from Acacia senegal trees of different age and location using multidetection gel permeation chromatography[J]. Food Hydrocolloids,1998, 12(4): 379-388. DOI:10.1016/S0268-005X(98)00058-7.
[5] QI W, FONG C, LAMPORT D T A. Gum arabic glycoprotein is a twisted hairy rope 12[J]. Plant Physiology, 1991, 96(3): 848-855.DOI:10.1104/pp.96.3.848.
[6] RANDALL R C, PHILIPS G O, WILLIAMS P A. The role of the proteinaceous component on the emulsifying properties of gum arabic[J]. Food Hydrocolloids, 1988, 2(2): 131-140. DOI:10.1016/S0268-005X(88)80011-0.
[7] RENARD D, LAVENANT-GOURGEON L, RALET M C, et al.Acacia senegal gum: continuum of molecular species differing by their protein to sugar ratio, molecular weight, and charges[J].Biomacromolecules, 2006, 7(9): 2637-2649. DOI:10.1021/bm060145j.
[8] RANDALL R C, PHILIPS G O, WILLIAMS P A. Fractionation and characterization of gum from Acacia senegal[J]. Food Hydrocolloids,1989, 3(1): 65-75. DOI:10.1016/S0268-005X(89)80034-7.
[9] ANDERSON D M W, STODDART J F. Studies on uronic acid materials: part XV. The use of molecular-sieve chromatography in studies on Acacia senegal gum (gum arabic)[J]. Carbohydrate Research, 1966, 2(2): 104-114. DOI:10.1016/S0008-6215(00)81474-3.
[10] SIDDIG N E, OSMAN M E, AL-ASSAF S, et al. Studies on acacia exudate gums, part IV. Distribution of molecular components in Acacia seyal, in relation to Acacia senegal[J]. Food Hydrocolloids,2005, 19(4): 679-686. DOI:10.1016/j.foodhyd.2004.09.005.
[11] LEROUX J, LGANENDORFF V, SCHICK G, et al. Emulsion stabilizing properties of pectin[J]. Food Hydrocolloids, 2003, 17(4):455-462. DOI:10.1016/S0268-005X(03)00027-4.
[12] SHI Y, LI C, ZHANG L, et al. Characterization and emulsifying properties of octenyl succinate anhydride modified Acacia seyal gum(gum arabic)[J]. Food hydrocolloids, 2017, 65: 10-16. DOI:10.1016/j.foodhyd.2016.10.043.
[13] PAN J, YANG L, QIU D. Optimization of a synthesis process for octenylsuccinic anhydride modified gum arabic[J]. Food Science &Biotechnology, 2015, 24(1): 7-13. DOI:10.1007/s10068-015-0002-6.
[14] SARKAR S, SINGHAL R S. Esterification of guar gum hydrolysate and gum Arabic with n-octenyl succinic anhydride and oleic acid and its evaluation as wall material in microencapsulation[J].Carbohydrate Polymers, 2011, 86(4): 1723-1731. DOI:10.1016/j.carbpol.2011.07.003.
[15] WANG H, WILLIAMS P A, SENAN C. Synthesis, characterization and emulsification properties of dodecenyl succinic anhydride derivatives of gum arabic[J]. Food Hydrocolloids, 2014, 37(2): 143-148. DOI:10.1016/j.foodhyd.2013.10.033.
[16] 卫生部. 中华人民共和国卫生部公告2005年第7号[J]. 中国食品卫生杂志, 2006, 18(1): 12-13.
[17] SCHIEVERT P M, PETERSON M L. Glycerol monolaurate antibacterial activity in broth and biofilm cultures[J]. PLoS ONE,2012, 7(7): e40350. DOI:10.1371/journal.pone.0040350.
[18] ZHANG H, YOSHIMURA M, NISHINARI K, et al. Gelation behaviour of konjac glucomannan with different molecular weights[J]. Biopolymers, 2015, 59(1): 38-50. DOI:10.1002/1097-0282(200107)59:1<38::AID-BIP1004>3.0.CO;2-A.
[19] ESPINOSA-ANDREWS H, SANDOVAL-CASTILLA O,VAZQUEZ-TORRES H, et al. Determination of the gum arabicchitosan interactions by Fourier transform infrared spectroscopy and characterization of the microstructure and rheological features of their coacervates[J]. Carbohydrate Polymers, 2010, 79(3): 541-546.DOI:10.1016/j.carbpol.2009.08.040.
[20] PAULINO A T, GUILHERME M R, MATTOSO L H C, et al. Smart hydrogels based on modified gum arabic as a potential device for magnetic biomaterial[J]. Macromolecular Chemistry & Physics, 2010,211(11): 1196-1205. DOI:10.1002/macp.200900657.
[21] DE VASCONCELOS C L, BEZERRIL P M, DOS SANTOS D E,et al. Effect of molecular weight and ionic strength on the formation of polyelectrolyte complexes based on poly(methacrylic acid) and chitosan[J]. Biomacromolecules, 2006, 7(4): 1245-1252. DOI:10.1021/bm050963w.
[22] MIAO M, LI R, JIANG B, et al. Structure and physicochemical properties of octenyl succinic esters of sugary maize soluble starch and waxy maize starch[J]. Food Chemistry, 2014, 151(20): 154-160.DOI:10.1016/j.foodchem.2013.11.043.
[23] XU J, ZHOU C W, WANG R Z, et al. Lipase-coupling esterification of starch with octenyl succinic anhydride[J]. Carbohydrate Polymers,2012, 87(3): 2137-2144. DOI:10.1016/j.carbpol.2011.10.035.
[24] CREUZET C, KADI S, RINAUDO M, et al. New associative systems based on alkylated hyaluronic acid. Synthesis and aqueous solution properties[J]. Polymer, 2006, 47(8): 2706-2713. DOI:10.1016/j.polymer.2006.02.052.
[25] LIANG R H, WANG L H, CHEN J, et al. Alkylated pectin: synthesis,characterization, viscosity and emulsifying properties[J]. Food Hydrocolloids, 2015, 50: 65-73. DOI:10.1016/j.foodhyd.2015.04.007.
[26] DOKIĆ P, DOKIĆ L, DAPČEVIĆ T, et al. Colloid characteristics and emulsifying properties of OSA starches[J]. Colloids and Polymer Science, 2008, 135: 48-56. DOI:10.1007/2882_2008_116.
[27] LI X, FANG Y, SAPHWAN A A, et al. Rheological study of gum arabic solutions: interpretation based on molecular self-association[J].Food Hydrocolloids, 2009, 23(8): 2394-2402. DOI:10.1016/j.foodhyd.2009.06.018.
[28] XU Y F, QIANG H, XIONG F, et al. Modification of starch octenylsuccinate by β-amylase hydrolysis in order to increase its emulsification properties[J]. Food Hydrocolloids, 2015, 48: 55-61.DOI:10.1016/j.foodhyd.2015.02.010.
[29] WALSTRA P. Principles of emulsion formation[J]. Chemical Engineering Science, 1993, 48(2): 333-349. DOI:10.1016/0009-2509(93)80021-H.
[30] JAYME M L, DUNSTAN D E, GEE M L. Zeta potentials of gum arabic stabilised oil in water emulsions[J]. Food Hydrocolloids, 1999,13(6): 459-465. DOI:10.1016/S0268-005X(99)00029-6.
[31] YI J, ZHU Z, MCCLEMENTS D J, et al. Inf l uence of aqueous phase emulsifiers on lipid oxidation in water-in-walnut oil emulsions[J].Journal of Agricultural and Food Chemistry, 2014, 62(9): 2104-2111.DOI:10.1021/jf404593f.
[32] MOSCHAKIS T, MURRAY B S, DICKINSON E. Particle tracking using confocal microscopy to probe the microrheology in a phaseseparating emulsion containing nonadsorbing polysaccharide[J].Langmuir, 2006, 22(10): 4710-4719. DOI:10.1021/la0533258.
[33] KHALLOUFI S, ALEXANDER M, GOFF H D, et al.Physicochemical properties of whey protein isolate stabilized oilin-water emulsions when mixed with flaxseed gum at neutral pH[J].Food Research International, 2008, 41(10): 964-972. DOI:10.1016/j.foodres.2008.07.019.
Emulsifying Properties of Glyceryl Monolaurate Grafted Gum Arabic
XIE Yanping, ZHANG Xiuqi, CAI Zhixiang, et al. Emulsifying properties of glyceryl monolaurate grafted gum arabic[J].Food Science, 2019, 40(18): 28-34. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20181031-375.http://www.spkx.net.cn