
大豆分离蛋白(isolated soy protein,SPI)是大豆的典型商业产品,广泛用作食品加工。长期以来,一直认为SPI由两种主要的储存蛋白组成,即大豆球蛋白(11S)和β-伴大豆球蛋白(7S)[1]。然而,最新的研究发现大豆储存蛋白组分中亲脂性蛋白质(lipophilic protein,LP)含量占据SPI的30%左右,因此SPI的组成和功能特性有待深入研究[2]。有文献表明SPI的溶解度必须通过11S、7S和LP三种蛋白质组分之间的相互作用调控,而不是简单地将11S和7S的性质加在一起[3]。因此,SPI的其他功能特性也应该基于这3 种蛋白质组分的性质重新考虑。现有的文献对11S和7S的相关研究较多,但是缺乏对LP的相关研究。
LP的主要成分是油体蛋白-磷脂,它是油体的原始成分并且具有较强的亲油性。在添加高浓度盐和表面活性剂(吐温20)的情况下,LP乳液表现出较好的热稳定性,而对于11S和7S的乳液观察到有絮凝现象产生[4]。这些数据表明LP的表面活性优于11S和7S,可作为优异的乳化剂使用。此外,大部分植物蛋白在紧密分子结构中缺少明显的疏水性和亲水性分区,很少用于运载疏水性生物活性物质,LP乳液有望解决这一问题[5]。
除了小分子质量表面活性剂以外,利用多糖稳定蛋白质乳液得到越来越多的关注[6]。与通过表面活性剂稳定的常规乳液相比,颗粒稳定乳液具有避免一些小分子质量表面活性剂的不利影响的优点,如组织刺激,代谢综合征和环境污染等。对于最可用的生物聚合物,纤维素是一个很好的候选者,因为它营养丰富,成本低,无毒无害并且有益于身心健康,具有可生物降解性和生物相容性。羟丙基甲基纤维素(hydroxypropyl methylcellulose,HPMC)又是一种可食用性纤维素,其资源丰富、健康无毒,而且有良好的水溶性和成膜性,是制备水包油乳液的理想原料[7]。
本实验拟探究由HPMC稳定的LP乳液的制备和表征,并研究不同均质压力和HPMC质量分数对LP乳液稳定性的影响,以期提供一种更稳定的LP乳剂的制备方法。
大豆 东北农业大学大豆研究所;羟丙基甲基纤维素(I型,黏度30 mPa·s),磷酸二氢钠、磷酸氢二钠天津市东丽区天大化学试剂厂;多力葵花籽油 市售;氯化钠 天津市光复精细化工研究所;硫酸 北京新光化工试剂厂;其他试剂为分析纯。
ULTRA-TURRAX UTL 2000高压均质机 上海标本模型有限公司;LGR20-W台式高速冷冻离心机 北京京立离心机有限公司;Mastersizer 2000激光粒度仪 英国马尔文仪器有限公司;DELTAVISIONTM OMX SR超分辨显微镜 德国徕卡公司;OCA20视频接触角测量仪德国Data Physics仪器股份有限公司;UV-5100型高性能紫外-可见分光光度计 上海奥析科学仪器;MAGNAIR560傅里叶变换红外光谱仪 美国Nicolet仪器股份有限公司。
1.3.1 LP的提取
大豆LP组分的分离由Samoto等[8]的方法经修改后使用。大豆磨粉,过60 目筛,正己烷脱脂制备低变性大豆脱脂粉,在70 ℃干热处理2 h,此时氮溶指数降至75%。50 g干热处理后的脱脂豆粉加入到400 mL蒸馏水中,用NaOH溶液调节pH值到8.0。在20 ℃搅拌1 h后3 000 r/min离心10 min。分离上清液并加入10 mmol/L Na2SO3,然后用H2SO4调节pH值至5.8,3 000 r/min离心10 min,接着用H2SO4调节上清液pH值至5.0,并在55 ℃处理15 min。然后加入50 mmol/L NaCl并用NaOH溶液调节pH值到5.5,3 000 r/min离心10 min,沉淀即为LP组分。
1.3.2 LP-HPMC乳液的制备
用pH 7.4的10 mmol/L磷酸盐缓冲溶液制备由HPMC稳定的LP水包油乳液。通过将适量的LP分散在磷酸盐缓冲液中,并室温下搅拌2 h后进行超声处理以确保蛋白质的完全溶解以制备LP溶液。将0.5% LP溶液分别加入到0%、0.01%、0.05%、0.1%、0.2% HPMC溶液中,边滴加边磁力搅拌,形成复合物搅拌30 min后,加入25%(V/V)葵花籽油,在1 000 r/min条件下粗均3 min后,在均值压力60、100、140 MPa下高压均质制备出不同类型的乳液,4 ℃条件下贮藏[9]。
1.3.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
采用Laemmli[10]的方法,为适应本实验样品,稍作一些改动。分离胶、浓缩胶分别为12%和5%,样品与上样缓冲液共同混合并水浴加热后,用移液枪吸取质量浓度为1 mg/mL的混合样品10 μL。加压后开始跑胶,并在实验过程中适时调节电压大小,实验结束后将胶片取出,采用实验前配制好的考马斯亮蓝溶液染色,而后进行3~5 次脱色,即得到样品电泳条带。
1.3.4 动态光散射
使用Mastersizer2000仪器进行蛋白质颗粒的尺寸分布,Zeta电位的测量。在装入比色杯(PCS8501)之前,用10 mmol/L磷酸盐缓冲液(pH 7.4)将样品稀释至质量分数0.1%。所有测量均在25 ℃进行3 次。对于分散体(LP)使用1.450的折射率,对于连续相(10 mmol/L磷酸盐缓冲液,pH 7.4)使用1.331的折射率[11]。
1.3.5 EAI和ESI测定
参考Li Chen等[12]的方法。从乳液样品底部取样50 μL a(0 min)和b(10 min),经SDS稀释200 倍,充分混合后在500 nm处测定吸光度A,以SDS做空白对照。乳化活性(emulsification activity,EAI)和乳化稳定性(emulsification stability,ESI)分别表示如下:

式中:T=2.303,N为稀释倍数200,θ为油相体积分数0.25,L为比色杯厚度1 cm;C为乳化液形成前蛋白质水溶液中蛋白质质量浓度(5 mg/mL);A0、A10为乳状液在0~10 min的吸光度,T10-T0为时间差10 min。
1.3.6 超分辨显微镜
采用尼罗蓝和尼罗红对样品液滴进行染色,尼罗红染料在大多数极性溶剂中不发荧光,但可以在富含脂质的环境中以微红的颜色强烈地发荧光,尼罗蓝则在含蛋白环境中显绿色荧光,利于观察。使用DELTAVISIONTM OMX SR超分辨显微镜检查不同压力处理下的乳剂的结构。将5 μL的染色乳液置于显微镜载玻片上,然后用盖玻片轻轻盖上。在633 nm的激发波长下操作的He-Ne激光成像油滴和蛋白质。使用60 倍放大率的油浸物镜进行观察。
1.3.7 贮藏稳定性分析
复合体系乳层析指数(creaming index,CI)的测定参考Zisu等[13]的方法。将水包油型乳状液样品于室温下静置35 d,每天记录乳状液所在具塞比色管分层界面的刻度,即可衡量乳状液相分离的程度。清液高度HC和乳液总高度HE的比值代表CI。按以下公式计算:
1.3.8 接触角测定
使用接触角分析仪在25 ℃通过座滴的方法测定。简而言之,乳液涂抹于载玻片制备成直径为13 mm且厚度为2 mm的薄膜。使用高精度注射器将一滴水(5 μL)沉积在薄膜的表面上。在通过摄像机从注射器下落之后立即记录液滴图像,并且液滴的轮廓被数值求解并且适合于Laplace-Young方程,可确定其界面张力。每个样品在3 个颗粒中的每一个上测量接触角,并对每个颗粒进行3 次测量[14]。
1.3.9 红外光谱分析
将乳液直接进行冻干,冻干后的样品置于干燥器中用P2O5充分干燥,取样品1.5 mg与200 mg溴化钾研磨混匀后压片进行红外光谱测定。在实验过程中,为了减少水蒸汽的干扰,用干燥的N2持续注入测量室。测定时波数范围为4 000~400 cm-1,扫描次数64,分辨率4 cm-1,得到的红外吸收曲线采用“peak fitting”软件和高斯曲线拟合,分析蛋白在不同均质压力的情况下二级结构含量的变化[15]。
本实验数据均为3 个平行样的平均值,结果采用SPSS 22.0分析软件和Origin 8.0软件进行处理,采用ANOVA对数据进行差异显著性分析(P<0.05)。

图1 亲脂蛋白的凝胶电泳图
Fig. 1 SDS-PAGE analysis of lipophilic protein
本实验方法所提LP是一组由多种蛋白质组合的复合物,包括11S、7S和脂氧合酶(Lx)的残余亚基。如图1所示,34 kDa蛋白质最初被认为是大豆油脂蛋白,因为它可以紧密地与油体结合,但后来被认为位于蛋白质储存液泡中,也同样属于LP的一部分。这与Gao Zhiming等[4]的研究结果一致,证明所提取的LP质量良好。但如图1所示有些条带出现很明显的不清晰的情况,这可能是由于LP部分中存在相对含量较高的磷脂,导致相对较差的考马斯亮蓝染色效果,正如Samoto等[16]报道。也正是由于大量磷脂的存在增加了LP的表面活性,为后续稳定乳液的形成提供理论依据。
表1 不同均质压力和纤维素质量分数下乳液的动态光散射
Table 1 Particle size and potential of emulsions at different homogenization pressures and cellulose concentrations

HPMC质量分数/%均质压力/MPa 粒径/nm 电位/mV 0 60 330.7±1.23a -19.0±0.12a 100 302.5±0.08a -24.0±1.01c 140 298.5±0.47b -20.8±0.72b 0.01 60 416.2±2.07b -26.0±0.63b 100 351.4±1.98c -31.6±0.24d 140 368.5±2.01a -30.8±0.83a 0.05 60 445.5±1.67b -28.3±0.21a 100 375.3±0.04a -34.5±0.73b 140 370.2±0.28d -38.7±1.29d 0.1 60 425.0±1.36a -29.0±0.36c 100 406.3±1.11c -40.4±0.02a 140 399.2±0.29d -38.3±0.24b 0.2 60 486.4±2.27c -10.3±0.37c 100 494.3±2.74d -15.6±1.42d 140 446.7±1.48a -18.4±0.28c
表1为不同均质压力和不同HPMC质量分数下所形成乳液的粒径和电位大小。粒径越小、越均匀,越有利于乳液的稳定;同样电位的绝对值越大表明乳液稳定性越好[17]。LP-HPMC复合乳液的粒径与复合物的特性有关,经不同均质压力处理后的LP-HPMC复合乳液的体积平均粒径D4,3的变化趋势如表1所示,未添加HPMC所形成的乳液的D4,3值大部分分布在300 nm左右,而添加HPMC的乳液随着HPMC质量分数的改变在不同压力的均质条件下粒径发生不同的变化。均质压力的不断升高,相同HPMC质量分数的情况下粒径不断减小,不同均质压力的条件下,纤维素质量分数为0.1%时,粒径相对其他添加量较小,电位绝对值也最大,证明在HPMC质量分数为0.1%时所形成乳液的稳定性是最好的,这与LP-HPMC复合物的结合度有直接关系。并且在均质压力为100 MPa,纤维素质量分数为0.1%时电位绝对值达到最大值40.4 mV,说明此时的乳液达到最稳定的状态。
EAI代表LP-HPMC复合物形成油-水界面的能力,它结合了蛋白质在水相中的溶解能力以及纤维素能够强烈吸附在油-水界面形成乳化层的能力;ESI是指乳状液形成小液滴的稳定能力[18]。由图2可知,在60、100、140 MPa三种情况下,HPMC质量分数在0.1% EAI都表现出最大值,证明纤维素质量分数为0.1%时对于乳液体系最有利,与前面结论一致。而在60 MPa时,ESI随纤维素质量分数的增加呈现先升高后降低的趋势,在质量分数为0.1%时呈现忽然的升高趋势,可能在较低均质压力的情况下,纤维素的添加对乳液稳定性起关键作用,反而更容易形成互不相容的两相,对乳液乳化性起到不利的影响[19]。而达到0.2%时,ESI明显降低说明纤维素浓度过高也不利于乳液的稳定,添加0.1%的HPMC较为合适。100 MPa时,ESI随着纤维素质量分数0%~0.1%的增加呈现上升的趋势,可以推测100 MPa可能是有利于纤维素作用于乳液的最佳均质压力。140 MPa时,ESI与60 MPa时趋势类似,在纤维素质量分数0.1%时ESI值最高。

图2 不同均质压力和纤维素质量分数下乳液的ESI和EAI
Fig. 2 Emulsifying activity and emulsion stability at different homogenization pressures and cellulose concentrations
超分辨显微镜经常用于分析乳液微观结构,能够直观地反映出乳液颗粒大小、分散状况及产生的不稳定情况。图3是不同HPMC质量分数在不同均质压力下形成的乳液的微观结构。60 MPa均质的情况下,乳液液滴粒径较大且分布不均匀,出现了乳滴聚集,这主要是由于均质压力不够导致乳液的乳化性较差,形成的乳滴不均匀,而且单独的大豆蛋白所形成乳液的界面膜不够稳定,发生了更为明显的油滴之间的絮凝或聚集[20]。100 MPa和140 MPa的超分辨图对比下,可以发现,100 MPa均质压力下乳液的状态最好,粒径较小且最为均匀,HPMC质量分数为0.1%时乳液最为稳定。140 MPa时,部分乳滴较大,同时也存在较小的乳滴分布,这主要是由于LP和HPMC在高压下发生分离,没有较好地复合,使油滴部分由单独多糖稳定[21]。结果证明,100 MPa是LP-HPMC乳液形成的最佳均质压力,而最佳HPMC质量分数为0.1%。
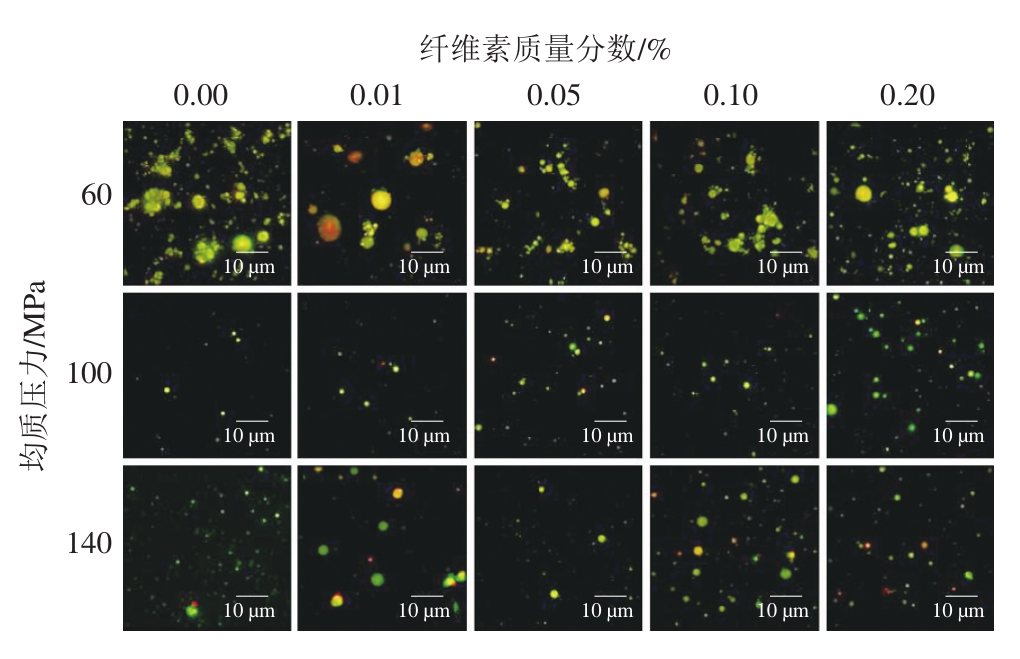
图3 不同均质压力和纤维素质量分数下乳液的超分辨显微镜图
Fig. 3 Super-resolution micrographs of emulsions at different homogenization pressures and cellulose concentrations

图4 不同均质压力和纤维素质量分数下乳液的CI
Fig. 4 Milk chromatography index of emulsions at different homogenization pressures and cellulose concentrations
乳液的乳化是由乳液中各相之间的不同密度引起的,通常是油相和水相[22]。因此,CI提供了关于乳液中油滴与水相的聚集和分离程度的信息。不同均质压力和不同HPMC质量分数处理条件下形成乳液的CI如图4所示,对不同乳液35 d的贮藏稳定性实验结果表明,乳液的分层现象随时间变化有所不同,其中HPMC质量分数为0.01%的LP-HPMC复合乳液CI最高,说明乳液的稳定性最差,这与之前分析的EAI、ESI得出结果一致,再次证明较低质量分数HPMC的添加不能很好的与LP结合,反而会形成互不相容的两相,不利于乳液的稳定。其次是未添加HPMC的LP乳液CI较高,证明单独的LP也不足以形成较稳定的乳液。CI最低的是HPMC质量分数为0.1%的乳液,再次得出结论,纤维素质量分数为0.1%时最有利于乳液的形成与稳定。

图5 不同纤维素质量分数下乳液的接触角
Fig. 5 Contact angle of emulsions at different cellulose concentrations

图6 不同纤维素质量分数下乳液界面张力
Fig. 6 Interfacial tension of emulsions at different cellulose concentrations
接触角是指在气、液、固三相交点处所作的气-液界面的切线,此切线在液体一方,与固-液交界线之间的夹角为θ,是润湿程度的量度[23]。若θ<90°,则固体表面是亲水性的,即液体较易润湿固体,其角越小,表示润湿性越好;若θ>90°,则固体表面是疏水性的[24]。实验发现接触角的改变主要受纤维素质量分数的影响,与均质压力的改变并无太大关系,可能是由于亲水性纤维素吸附在乳液的表面增加了乳液的亲水性。从图5可以看出,所有乳液都呈亲水性,只是亲水效果有所差异。在不添加HPMC的情况下,由LP包裹葵花籽油所形成的乳液夹角为67.5°,明显高于添加HPMC后形成乳液的夹角。另一方面,蛋白乳液的稳定性与界面张力和界面压的大小密切相关,界面张力越小,界面压越大,乳状液越稳定。由图6可见,纤维素质量分数为0.1%时,接触角低至19.6°,亲水性最好。同时,在此条件下界面张力值也是最小的,说明质量分数0.1%时乳液最稳定。说明在此浓度下LP与HPMC结合度最高,HPMC亲水性部分吸附在乳液表面,增加了乳液的亲水性。
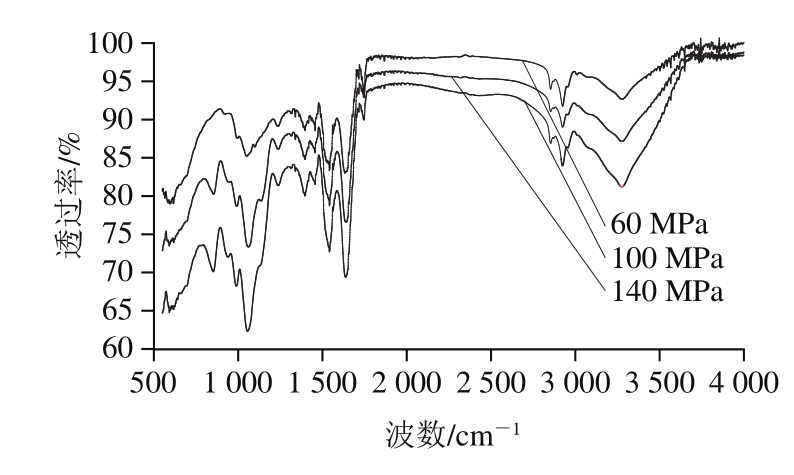
图7 不同均质压力下乳液中蛋白的红外光谱
Fig. 7 Infrared spectra of protein in emulsions at different homogenization pressures
表2 不同均质压力下乳液中蛋白的二级结构
Table 2 Secondary structures of protein in emulsions at different homogenization pressures

均质压力/MPa含量/%α-螺旋 β-折叠 β-转角 无规卷曲60 29.3±0.1b 37.2±0.3e 16.8±0.1b 43.1±0.2b 100 24.1±0.1d 40.5±0.1c 15.6±0.1a 28.4±0.1a 140 39.2±0.1a 35.7±0.2d 20.0±0.1c 15.7±0.2c
通过红外光谱表征在不同均质压力下HPMC质量分数为0.1%时乳液中蛋白质二级结构的含量(图7),蛋白质红外光谱的1 600~1 700 cm-1属于肽键吸收范围,包含了蛋白质主链构象的信息[25]。利用Peak Fit拟合软件对得到的图谱进行分析计算,得到不同均质压力处理LP-HPMC乳液中LP的二级结构含量如表2所示。由此可见,随着均质压力的升高,α-螺旋、β-转角和无规卷曲结构都呈现先降低后升高的趋势,而β-折叠结构在100 MPa时含量高达40.5%。说明LP经高压均质处理后对α-螺旋、β-折叠、β-转角和无规卷曲结构都产生一定的影响,LP的二级结构被破坏,其柔性结构增加,蛋白质分子由有序结构变得无序。LP的α-螺旋和β-折叠结构是主要由氢键维持,高压均质处理后可能破坏了二级结构中的氢键作用,使蛋白质分子展开,二级结构破坏,蛋白质不同程度的改变和伸展,可能会影响LP与其他物质的结合程度[26],这与前面得出的结论,均质压力在100 MPa时乳液最稳定相一致。
经100 MPa高压均质处理的LP-HPMC复合物所形成乳液粒径均匀稳定,乳滴的形状规则,表现较好的EAI和ESI。同时,高压均质改变了LP二级结构,从而使乳化能力得以提高,100 MPa时β-折叠结构含量最高,LP构象发生转变,此时LP无序构象的组成、柔性结构的展开影响蛋白质整体构象的柔韧性[27],使其更易与HPMC形成功能特性较好的复合物,增加乳液稳定性;超过或者低于100 MPa都会对乳液稳定性造成不利的影响。HPMC质量分数也同样对乳液产生一定的影响,质量分数为0.1%时,乳液的ESI和亲水性最好,由超分辨显微镜观察到的乳液形貌也最为稳定。因此,本实验发现在HPMC质量分数为0.1%,均质压力100 MPa的条件下所形成的乳液最稳定。
[1] 张春红, 赵秋伟, 曹黎明, 等. 改性大豆分离蛋白产品功能性及机理的研究[J]. 中国油脂, 2004, 29(12): 56-61. DOI:10.3321/j.issn:1003-7969.2004.12.018.
[2] 高志明. 大豆亲脂性蛋白的界面吸附、乳化及输送特性研究[D].广州: 华南理工大学, 2014: 1-6.
[3] SIRISON J, MATSUMIYA K, SAMOTO M, et al. Solubility of soy lipophilic proteins: comparison with other soy protein fractions[J].Journal of the Agricultural Chemical Society of Japan, 2017, 81(4):790-802. DOI:10.1080/09168451.2017.1282808.
[4] GAO Z M, WANG J M, WU N N, et al. Formation of complex interface and stability of oil-in-water (O/W) emulsion prepared by soy lipophilic protein nanoparticles[J]. Journal of Agricultural & Food Chemistry, 2013, 61(32): 7838-7847. DOI:10.1021/jf4018349.
[5] 黄世杰. 脂蛋白对疏水性药物生物活性和配置的影响[J].国际药学研究杂志, 2008, 35(5): 392-395. DOI:10.3969/j.issn.1674-0440.2008.05.017.
[6] 张晋博. 多糖对大豆蛋白的修饰及其界面、乳化和凝胶性质的研究[D]. 广州: 华南理工大学, 2013: 3-10.
[7] 张艳平. 羟丙基甲基纤维素水溶性包装薄膜的制备及性能研究[D].杭州: 浙江理工大学, 2017: 2.8.
[8] SAMOTO M, MAEBUCHI M, MIYAZAKI C, et al. Abundant proteins associated with lecithin in soy protein isolate[J]. Food Chemistry,2007, 102(1): 317-322. DOI:10.1016/j.foodchem.2006.05.054.
[9] 丁俭, 马文君, 毕爽, 等. 超高压改性大豆蛋白与可溶性多糖复合物对乳液形成及稳定性的影响[J]. 食品科学, 2017, 38(7): 96-101.DOI:10.7506/spkx1002-6630-201707016.
[10] LAEMMLI B U K. Cleavage of structural proteins during assembly of head ofBacteriophage-T4[J]. Nature, 1970, 227: 680-685.DOI:10.1038/227680a0.
[11] 毕爽, 江连洲, 毛惠婷, 等. 超声波处理对大豆分离蛋白-磷脂相互作用及其复合物功能性质的影响[J]. 食品科学, 2016, 37(17): 1-6.DOI:10.7506/spkx1002-6630-201617001.
[12] LI C, HUANG X J, PENG Q, et al. Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J]. Ultrasonics-Sonochemistry, 2014, 21(5): 1722-1727.DOI:10.1016/j.ultsonch.2014.03.018.
[13] ZISU B, SCHLEYER M, CHANDRAPALA J. Application of ultrasound to reduce viscosity and control the rate of age thickening of concentrated skim milk[J]. International Dairy Journal, 2013, 31(1):41-43. DOI:10.1016/j.idairyj.2012.04.007.
[14] YANG T, ZHENG J, ZHENG B S, et al. High internal phase emulsions stabilized by starch nanocrystals[J]. Food Hydrocolloids, 2018, 82.DOI:10.1016/j.foodhyd.2018.04.006.
[15] MANTSCH H H. New insight into protein secondary structure from resolution-enhanced infrared spectra[J]. Biochimica et Biophysica Acta, 1988, 952(2): 115-130. DOI:10.1016/0167-4838(88)90107-0.
[16] SAMOTO M, MAEBUCHI M, MIYAZAKI C, et al. Abundant proteins associated with lecithin in soy protein isolate[J]. Food Chemistry,2007, 102(1): 317-322. DOI:10.1016/j.foodchem.2006.05.054.
[17] 陈浩, 张凯华, 刘世永, 等. 甜菜果胶乳化活性及稳定性[J]. 食品科学, 2018, 39(1): 65-72. DOI:10.7506/spkx1002-6630-201801010.
[18] 毕爽, 齐宝坤, 隋晓楠, 等. 超声处理对黑豆蛋白结构和功能性质的影响[J]. 中国食品学报, 2016, 16(6): 153-160. DOI:10.16429/j.1009-7848.2016.06.021.
[19] 邓若璇. 纳米纤维素作为乳化、稳定剂和膳食纤维的应用研究[D].无锡: 江南大学, 2017: 65-70.
[20] 王喜波, 于洁, 王小丹, 等. 基于美拉德反应的酶改性大豆蛋白冻融稳定性研究[J]. 农业机械学报, 2018(5): 361-367. DOI:10.6041/j.issn.1000-1298.2018.05.043.
[21] 谭慧. 高压处理对大豆分离蛋白-多糖体系功能特性及结构影响研究[D]. 哈尔滨: 东北农业大学, 2015: 54-59.
[22] CHAPLEAU N, LAMBALLERIE-ANTON M D. Improvement of emulsifying properties of lupin proteins by high pressure induced aggregation[J]. Food Hydrocolloids, 2003, 17(3): 273-280.DOI:10.1016/s0268-005x(02)00077-2.
[23] KINOSHITA T, MARUYAMA S, MATSUMOTO Y. In situ wettability characterization of chemically heterogeneous surfaces probed by ionic liquid contact angle in vacuum: pentacene on single-crystal SrTiO3(001)[J]. Journal of Physical Chemistry C, 2018, 122(15): 8390-8395. DOI:10.1021/acs.jpcc.8b01128.
[24] 彭长敏. 微液滴在均匀性和非均匀润湿性表面上的动力学与热力学特性研究[D]. 广州: 华南理工大学, 2015: 51-59.
[25] 郭庆丽. 近红外光谱分析技术用于两类辅料的鉴别分析与羟丙甲纤维素质量分析研究[D]. 济南: 山东大学, 2017: 36-44.
[26] 徐志雨. 傅里叶变换显微红外光谱仪在植物组织吸水与聚合反应机理探究方面的应用[D]. 北京: 北京理工大学, 2015: 52-58.
[27] 曹磊, 夏青, 宋玉, 等. 发芽糙米和羟丙基甲基纤维素对面包品质的影响[J]. 食品工业科技, 2017, 38(14): 55-60. DOI:10.13386/j.issn1002-0306.2017.14.012.
[28] PENG J, SUNT, XU J M, et al. Effect of high-pressure homogenization preparation on mean globule size and large-diameter tail of oil-inwater injectable emulsions[J]. Journal of Food & Drug Analysis, 2015,23(4): 828-835. DOI:10.1016/j.jfda.2015.04.004.
[29] STANKOVIĆ R, JOVANOVIĆ S, ILICLĆ L, et al. Study of aqueous dextran solutions under high pressures and different temperatures by dynamic light scattering[J]. Polymer, 1991, 32(2): 235-240.DOI:10.1016/0032-3861(91)90008-7.
[30] 郝红英, 邵自强, 冷小京. 羧甲基纤维素化学结构对乳蛋白稳定性影响[J]. 功能材料, 2014, 45(20): 8-10. DOI:10.3969/j.issn.1001-9731.2014.20.004.
Preparation and Stability of Soybean Lipophilic Protein-Hydroxypropyl Methylcellulose Emulsion
ZHONG Mingming, QI Baokun, ZHAO Tian, et al. Preparation and stability of soybean lipophilic protein-hydroxypropyl methylcellulose emulsion[J]. Food Science, 2019, 40(18): 41-47. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20181018-195. http://www.spkx.net.cn