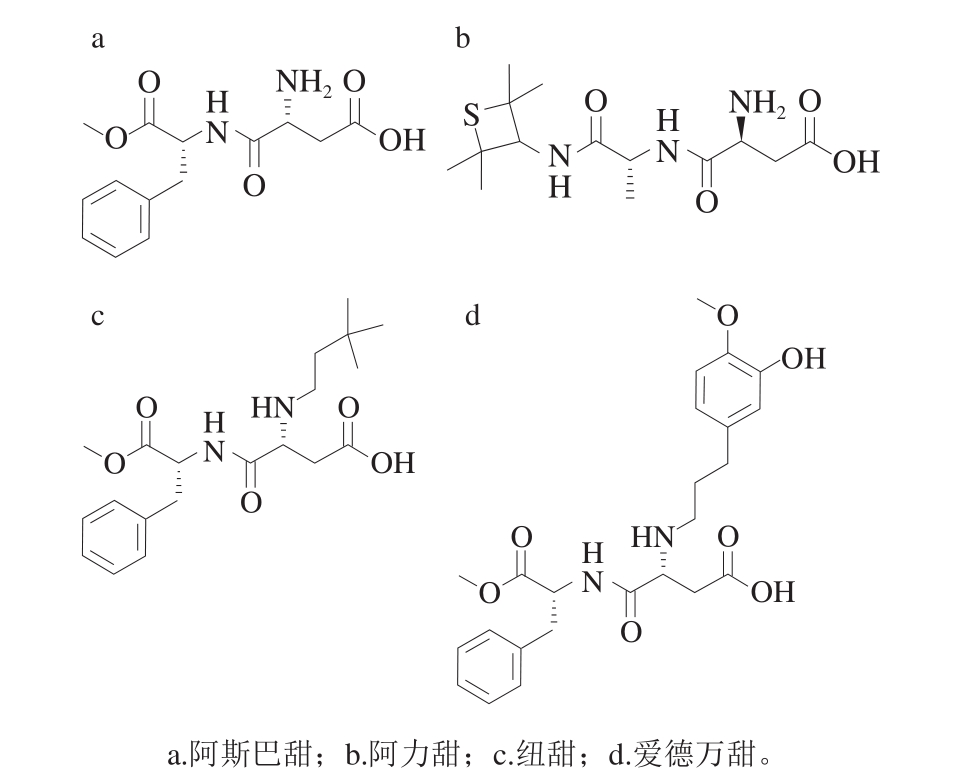
图1 4 种二肽甜味剂
Fig. 1 Four types of dipeptide sweetener
组成生命体蛋白质的20 种常见氨基酸及其衍生物,除疏水D型氨基酸具有较低的甜度,其他的氨基酸则不具有甜度[1-2]。20世纪初,科学家从植物中分离出的7 种高甜度的蛋白质分别为索马甜、莫利甜、马槟榔甜蛋白、潘塔亭、布那珍甜蛋白、仙茅甜蛋白、奇异果素,甜度可以达到蔗糖的500~10 000 倍[3]。目前研究表明,天然甜味剂的产业化程度还远不能满足现代食品工业的要求,其甜度以及口感也有提高和改善的必要。而二肽类甜味剂较易合成,具有甜度高、口感好、不产生热量、不产生龋齿、且对环境要求低等优点被广泛应用[4-5]。

图1 4 种二肽甜味剂
Fig. 1 Four types of dipeptide sweetener
1965年James Schlatter发现了阿斯巴甜,化学名为N-L-α-天冬氨酰-L-苯丙氨酸-1-甲酯,是第1代二肽甜味剂,甜度约为蔗糖的200 倍[6]。但是由于阿斯巴甜中含有苯丙氨酸对苯丙酮尿症患者存在潜在的风险。由于这些弊端促进高甜度二肽甜味剂的研究和开发,从而寻找更适合人体生理需求的高甜度二肽甜味剂[7]。1979年美国辉瑞公司研制出阿力甜,化学名为L-天门冬酰-N-(2,2,4,4-四甲基-3-硫杂环丁基)-D-丙氨酰胺,是第2代二肽类甜味剂,甜度约为蔗糖的2 000 倍[8]。阿力甜的稳定性和口感更好,热量更低,使用范围更广(相较于阿斯巴甜含有苯丙氨酸,阿力甜则可以适用于苯丙酮尿患者),然而化合物中含有硫元素而稍带有硫臭味。1991年Claude等研制出纽甜,化学名为N-[N-(3,3-二甲基丁基)-L-α-天冬氨酰]-1-苯丙氨酸-1-甲酯,属于第3代二肽甜味剂,甜度约为蔗糖的8 000 倍[9-10]。在代谢过程中,由于催化天冬氨酸和苯丙氨酸之间肽键的酶被3,3-二甲基丁基部分阻断,因而大大减少苯丙氨酸的产生[11],其稳定性也增加。2008年日本味之素公司研发出爱德万甜,化学名为N-{N-[3-(3-羟基-4-甲氧基苯基)丙基]-L-α-天冬氨酰}-L-苯丙氨酸-1-甲酯,被称为第4代二肽甜味剂,甜度约为蔗糖20 000 倍[12]。爱德万甜分子中的酚羟基,使其水溶性好,但也导致其吸水性较强,不适于长期储存。从二肽甜味剂的结构分析(图1),这类强力甜味剂主要以天冬氨酸和苯丙氨酸进行二肽母体结构的构建,进而用丙基衍生基团进行结构修饰,从而改善这类化合物的适用条件,增强甜度。
二肽的合成过程通常分为3 个步骤:氨基酸基团的选择性保护、肽键的形成、保护基的脱除。根据氨基酸上基团的不同反应活性,选择不同的化学方法保护其中不参与缩合反应的氨基、羧基以及其他活性基团(如巯基)。酰胺类、酯类以及形成唑啉等是最普遍的羧基保护方法;烷氧羰基类(Cbz苄氧羰基、叔丁氧羰基、9-芴基甲氧基羰基等)、酰基类(对甲苯磺酰基、三氟乙酰基等)、烷基类(对甲氧基苄基、苄基等)是常见用来保护氨基的方法[13]。二肽化合物的形成,主要是指2 个氨基酸通过脱水缩合的方式,合成分子间具有一个肽键的化合物。氨基酸脱水缩合的主要方式有:偶联试剂法(碳二亚胺法型[14]、磷正离子型、脲正离子型等)、固相多肽合成法等。N,N’-二环己基碳二亚胺、1-乙基-3-(3-二甲基氨基丙基)碳酰二亚胺、1-羟基苯并三唑水合物(1-hydroxybenzotriazole,HOBt)、O-苯并三氮唑-四甲基脲六氟磷酸酯、O-苯并三氮唑-N,N,N’,N’-四甲基脲四氟硼酸酯属于二肽缩合中是最常用的缩合试剂。1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDCI)可以使反应过程中所产生的副产物易溶于水,从而容易除去;而HOBt则可以防止二肽的消旋,反应条件温和,操作简便,并能够保证二肽的构型不会发生改变[15-16]。脱除保护基团,主要根据不同的基团的化学性质,从而选择不同的试剂(如三氟乙酸)或者催化氢化等方法脱除保护基,并且反应条件必须温和,避免产生较多的副产物。二肽化合物的修饰,主要手段是通过取代二肽氨基上的氨进行,即合成胺。合成胺一般醛、酮和胺类化合物通过亲核加成生成中间化合物席夫碱,进一步将碳氮双键还原形成胺是先通过形成烯胺(即席夫碱),进一步使用还原剂进行合成。常用的方法:还原胺化(常用还原剂:氰基硼氢化钠[17]、三乙酰基硼氢化钠、硼氢化钠等)、催化氢化(常温常压、高温高压等)、生物催化。还原胺化反应操作严苛且后处理复杂,容易消去醛酮的双键,且席夫碱生成过程中会产生水使得还原胺化过程变得难于操作且变得危险。催化氢化,主要是通过氢气分子和钯、铂、镍、钯碳、铂碳等进行加成反应,消去不饱和碳氮双键等,反应一般需要在高温高压的条件下进行,实验操作要求高且会导致更多的能耗损失[18]。生物催化具有反应条件温和、选择性高等优点,但需要寻找特定的微生物进行酶催化,如Dipeolu等[19]采用梭状芽孢杆菌将苯甲酰胺还原为苄胺。
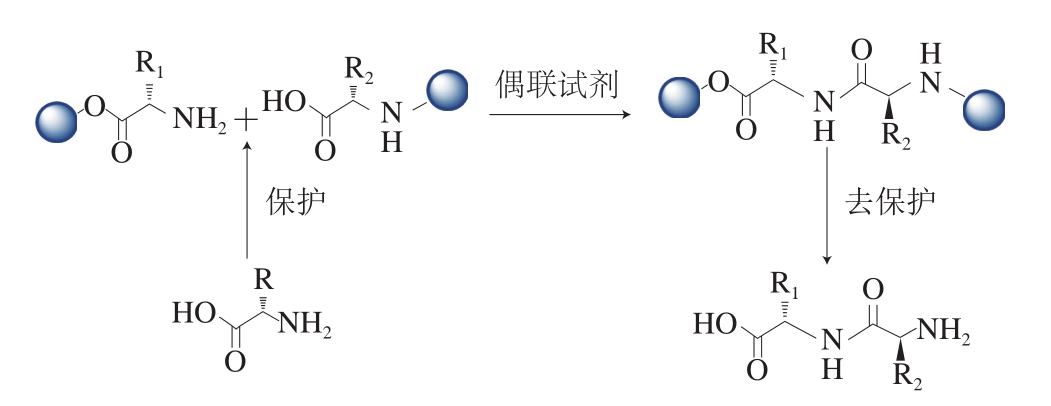
图2 二肽的合成策略
Fig. 2 Synthetic strategy for dipeptide
为开发甜度更高和更适合人体生理需求的二肽类甜味剂,同时丰富二肽甜味剂的结构类型。本实验设计一条新的合成路线,采用叔丁基保护半胱氨酸的巯基以及甲基保护半胱氨酸的羧基(化合物9),使用叔丁氧羰基和叔丁基分别保护天冬氨酸的氨基和羧基,即化合物10。合成的S-叔丁基-L-半胱氨酸甲酯(化合物9)与N-叔丁氧羰基-L-天冬氨酸-4-叔丁酯二环己胺盐(化合物10)通过EDCI-HOBt偶联试剂缩合,进行二肽母体结构的构建(图2)。原因是EDCI可以使反应过程中所产生的副产物易溶于水,易于除去;而HOBt则可以防止多肽的消旋,且二者参与缩合反应的条件温和,操作简洁,后处理方便,并能够保证二肽的构型不会发生改变。叔丁基、甲氧基、叔丁氧羰基,这些保护基团不仅有利于形成特定构型的目标二肽化合物;而且可以在酸性条件下较容易脱保护并产生低沸点杂质,反应完成后只需要进行减压蒸馏就可以使产物达到较高纯度。由于所合成的目标二肽化合物(化合物11)中含有叔丁基等对强酸敏感基团,三氟乙酸易于除去硫原子上的叔丁基,因此采用氯化氢-二氧六环溶液进行二肽的脱保护,形成所需要的目标二肽化合物(化合物12)。异香兰素(化合物5)经Wittig反应、催化氢化、二异丁基氢化铝(diisobutylaluminium hydride,DIBAL-H)还原合成二肽化合物的修饰物3-(3-羟基-4-甲氧基苯基)丙醛(化合物7),通过此修饰物和二肽反应合成目标二肽甜味剂中间体席夫碱,进一步通过常温常压催化氢化合成目标产物40 000 倍的二肽甜味剂N-{N-[3-(3-羟基-4-甲氧基苯基)丙基}-L-α-天冬氨酰基]-S-叔丁基-L-半胱氨酸-1-甲酯[20]。
异香兰素、甲氧甲酰基亚甲基三苯基膦、无水甲醇、无水二氯甲烷、DIBAL-H(1.0 mol/L四氢呋喃溶液)、S-叔丁基-L-半胱氨酸盐酸盐、5%钯碳、EDCI、HOBt、氯化氢-二氧六环溶液(4.0 mol/L的二氧六环溶液)、乙酸、茴香醛(均为分析纯) 萨恩化学技术(上海)有限公司;N-叔丁氧羰基-L-天冬氨酸-4-叔丁酯二环己胺盐(分析纯) 上海阿拉丁生化科技股份有限公司;甲醇、石油醚、乙酸乙酯、二氯甲烷(均为分析纯) 广州市光华科技股份有限公司;氘代氯仿、氘代甲醇 美国CIL公司;酒石酸钾钠、无水硫酸钠、氯化钠、柠檬酸、碳酸氢钠(均为分析纯) 天津市福晨化学试剂厂;硅胶 青岛海洋化工有限公司。
茴香醛显色剂:向350 mL的乙醇中依次加入15 mL冰乙酸、3.5 mL茴香醛(对甲氧基苯甲醛),然后向该混合液中缓慢滴加50 mL浓硫酸。
EQUI-NO×55型红外光谱仪、AVANCE III型核磁共振波谱仪(300、600 MHz) 瑞士布鲁克公司;N-1300型旋转蒸发仪 东京理化器械株式会社;MS-H-Pro磁力搅拌器 美国赛洛捷克公司;X Series 2电子轰击电离质谱仪 美国Thermo公司;PSL-1820低温反应仪 东京理化器械株式会社。
1.3.1 合成路线
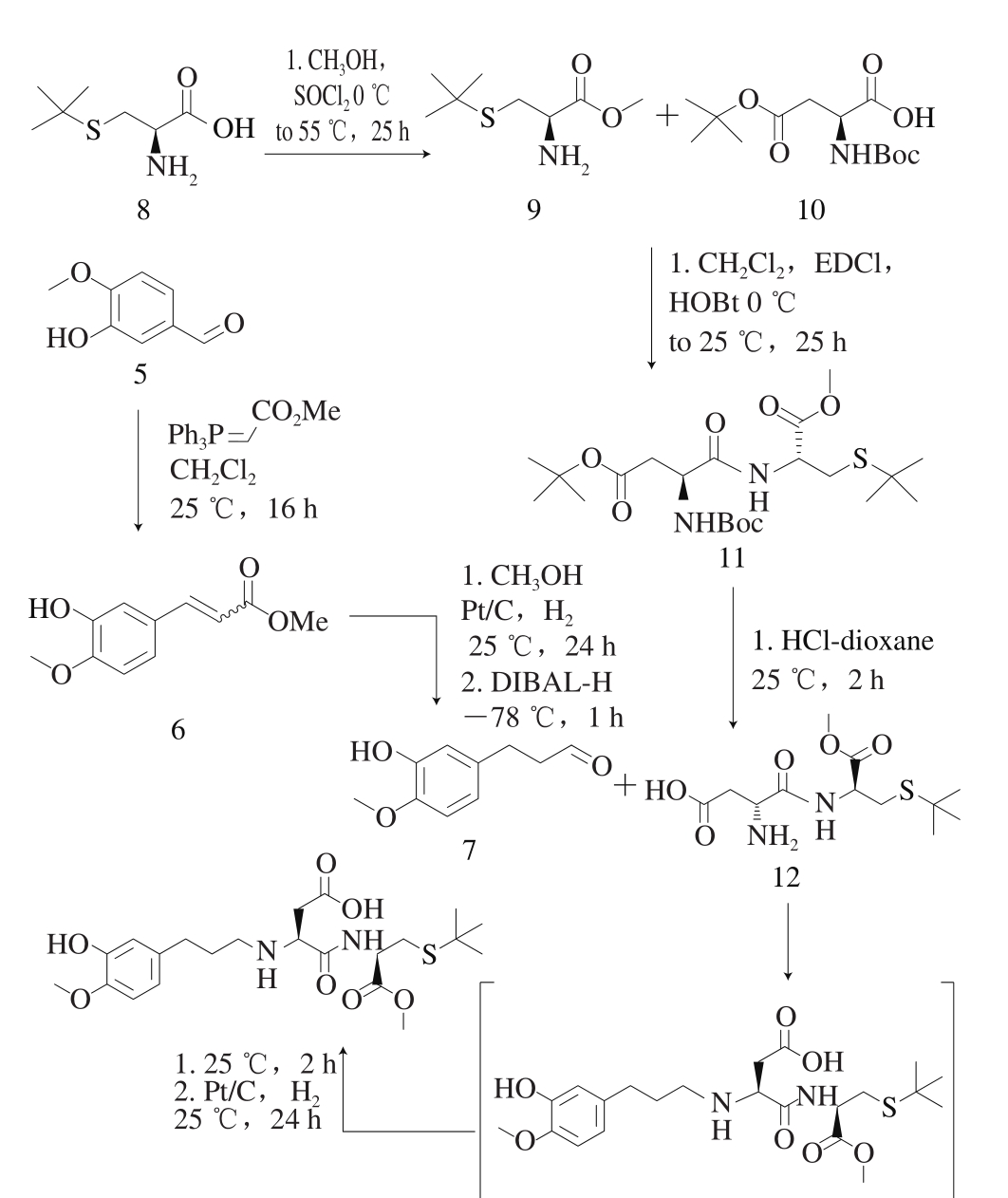
图3 N-{N-[3-(3-羟基-4-甲氧基苯基)丙基]-L-α-天冬氨酰}-S-叔丁基-L-半胱氨酸-1-甲酯的合成路线
Fig. 3 Synthesis route of N-{N-[3-(3-hydroxy-4-methoxyphenyl)propyl]-L-α-aspartyl}-S-tert-butyl-L-cysteine-1-methyl ester
首先利用Witting反应、催化氢化、DIBAL-H合成中间体3-(3-羟基-4-甲氧基苯基)丙醛,进一步通过3-(3-羟基-4-甲氧基苯基)丙醛和N-(L-α-天冬氨酰)-S-叔丁基-L-半胱氨酸-1-甲酯进行催化氢化(图3)合成终产物N-{N-[3-(3-羟基-4-甲氧基苯基)丙基]-L-α-天冬氨酰}-S-叔丁基-L-半胱氨酸-1-甲酯。
1.3.2 (E/Z)-3-(3-羟基-4-甲氧基苯基)丙烯酸甲酯的制备(化合物6)[21-22]
在250 mL圆底烧瓶中依次加入异香兰素(化合物5)(10.0 g,66.5 mmol)、无水二氯甲烷(125 mL)、甲氧甲酰基亚甲基三苯基膦(24.2 g,72.5 mmol),加热至55 ℃并冷凝回流,磁力搅拌18 h后,薄层层析色谱(thin layer chromatography,TLC)监测。待反应结束并冷却至室温,加入75 mL的干硅胶,减压除去溶剂,柱层析纯化(石油醚-乙酸乙酯,7∶3,V/V),得到白色固体化合物6(13.4 g,64.5 mmol),产率97%。
1.3.3 3-(3-羟基-4-甲氧基苯基)丙醛的制备(化合物7)[23-25]
在250 mL圆底烧瓶中依次加入(E/Z)-3-(3-羟基-4-甲氧基苯基)丙烯酸甲酯(化合物2)(13.2 g,63.4 mmol)、无水甲醇(150 mL)、10%钯碳(2.6 g,24.4 mmol),然后将反应瓶抽空,再加上氢气球(5×)。常温搅拌反应16 h后,TLC监测。反应结束,硅藻土过滤除去钯碳,并用二氯甲烷洗涤滤渣3 遍。减压除去溶剂,柱层析进一步纯化(石油醚-乙酸乙酯,4∶1~2∶1,V/V),得到白色颗粒化合物3-(3-羟基-4-甲氧基苯基)丙酸甲酯。
在250 mL圆底烧瓶中依次加入3-(3-羟基-4-甲氧基苯基)丙酸甲酯(11.0 g,52.4 mmol),无水二氯甲烷(140 mL),反应瓶置于-78 ℃搅拌5 min。氮气保护状态下,向反应瓶缓慢滴加DIBAL-H(1.0 mol/L的四氢呋喃溶液,20.6 mL,20.6 mmol)。-78 ℃剧烈搅拌反应1 h,TLC监测(石油醚-乙酸乙酯,4∶1,Rf=0.35,茴香醛显色)。待反应结束,向反应液中缓慢滴加甲醇(10 mL)以淬灭反应,0 ℃搅拌5 min。在常温下向已经淬灭的反应中加入酒石酸钾钠溶液(1.2 mol/L,250 mL)稀释反应液,常温搅拌2 h。搅拌结束之后,向稀释后的反应液中加水(250 mL)进一步稀释反应液,接着用二氯甲烷(250 mL×3)萃取稀释液。用饱和食盐水(500 mL)洗涤有机层,无水硫酸钠除水,减压除去溶剂,柱层析进一步纯化(石油醚-乙酸乙酯(10∶0~4∶1,V/V)),得到白色固体化合物7(9.9 g,47.1 mmol),两步合并产率为85.5%。
1.3.4 S-叔丁基-L-半胱氨酸甲酯的制备(化合物9)
在500 mL圆底烧瓶中加入无水甲醇(200 mL,4.9 mol),然后用一次性注射器缓慢向圆底烧瓶中加入二氯亚砜(21.3 mL,0.3 mol),并控制滴加的速度使反应温度不超过0 ℃。滴加完毕后在0 ℃反应1 h,等温度升至常温之后,向圆底烧瓶中加入S-叔丁基-L-半胱氨酸盐酸盐(化合物8)(6.3 g,35.3 mmol),反应回流过夜,TLC监测(二氯甲烷-甲醇,5∶1,V/V,Rf=0.35),待反应结束,减压蒸馏除去溶剂,柱层析进一步纯化(二氯甲烷-甲醇,100∶0~100∶15,V/V),得到黄色固体化合物9(6.5 g,34 mmol),产率为95%。
1.3.5 N-(N-叔丁氧羰基-4-叔丁酯-L-α-天冬氨酰)-S-叔丁基-L-半胱氨酸-1-甲酯的合成(化合物11)[26]
在5 0 0 m L圆底烧瓶中依次加入二氯甲烷(200 mL),S-叔丁基-L-半胱氨酸甲酯(化合物9)(5.6 g,29.0 mmol),N-叔丁氧羰基-L-天冬氨酸-4-叔丁酯二环己胺盐(化合物10)(13.7 g,29.04 mmol)。然后依次加入EDCI(6.1 g,31.9 mmol),HOBt(4.3 g,31.9 mmol),0 ℃搅拌1 h后,常温反应过夜。反应完成后,减压除去溶剂,向残余物中加入水(600 mL),用乙酸乙酯(200 mL×3)萃取。用5%的柠檬酸(300 mL×3)萃取合并的有机层,接着用饱和食盐水洗涤(200 mL×2)。用5%碳酸氢钠溶液萃取(300 mL×3),最后用饱和食盐水萃取(200 mL×2),然后用无水硫酸钠进行除水、过滤,减压除去溶液,柱层析进一步纯化(石油醚-乙酸乙酯(100∶0~20∶1,V/V)),得到白色固体化合物11(10.8 g,23.3 mmol),产率80%。
1.3.6 N-(L-α-天冬氨酰)-S-叔丁基-L-半胱氨酸-1-甲酯的合成(化合物12)[27]
在150 mL圆底烧瓶中依次加入N-(N-叔丁氧羰基-4-叔丁酯-L-α-天冬氨酰)-S-叔丁基-L-半胱氨酸-1-甲酯(化合物13)(2.1 g,4.5 mmol),然后在0 ℃缓慢加入氯化氢-二氧六环溶液(4.0 mol/L,20 mL),滴加完毕常温下反应2 h,TLC监测(二氯甲烷-甲醇-乙酸,10∶1∶0.1,V/V,Rf=0.10)。待反应完毕,减压除去溶剂得到白色固体,再用甲醇溶解(20×3)并减压除去溶剂,得到白色固体化合物12(1.2 g,4.1 mmol),产率91%。
1.3.7 N-[N-[3-(3-羟基-4-甲氧基苯基)丙基]-L-α-天冬氨酰]-S-叔丁基-L-半胱氨酸-1-甲酯的合成(化合物15)[28]
在150 mL圆底烧瓶中依次加入60%甲醇溶液(75 mL)、N-(L-α-天冬氨酰)-S-叔丁基-L-半胱氨酸-1-甲酯(化合物14)(100.0 mg,0.3 mmol)、3-羟基-4-甲氧基苯基丙醛(化合物9)(58.0 mg,0.3 mmol),氮气保护下常温搅拌2 h。然后将反应瓶抽真空,再向反应液中加入5%钯碳(100.0 mg,1.0 mmol),氢气氛围下常温反应24 h,TLC监测(二氯甲烷-甲醇-乙酸,10∶1∶0.1,V/V,Rf=0.2,碱性高锰酸钾显色)。待反应结束,过滤反应液,用甲醇洗涤滤渣(3×20 mL)。柱层析进一步纯化(二氯甲烷-甲醇-乙酸,100∶0∶0~8∶1∶0.01(V/V)),碱性高锰酸钾显色,得到白色固体化合物15(295.0 mg,0.6 mmol),产率66%。
采用ChemBioOffice 2014进行化合物结构式的绘制、化合物结构以及化学反应的分析;采用MestReNova 12.0进行化合物的谱图解析、结构确证。
1H-NMR(300 MHz,CDCl3)E型:δ 7.59(d,J=15.9 Hz,1H),7.13(d,J=2.1 Hz,1H),7.01(ddd,J=8.3,2.1,0.5 Hz,1H),6.83(d,J=8.3 Hz,1H),6.28(d,J=16.0 Hz,1H),5.78(s,1H),3.90(s,3H),3.78(s,3H);Z型:δ 7.32(d,J=2.2 Hz,1H),7.22(ddd,J=8.4,2.1,0.6 Hz,1H),6.79(d,J=6.7 Hz,1H),5.83(d,J=12.8 Hz,3H),3.89(s,3H),3.72(s,3H)。
从1H-NMR对2 种不同构型的化合物同时进行积分,可以得出2 种构型的同分异构体相对应的氢的积分之比为1/0.24=4.12,核磁数据与之前报道过的该物质的数据相符合[21-22]。
1H NMR(600 MHz,CDCl3)δ 6.77(d,J=1.9 Hz,1H),6.76(s,1H),6.67(dd,J=8.2,2.1 Hz,1H),3.86(s,3H),3.67(s,3H),2.85(t,J=7.9 Hz,2H),2.59(dd,J=8.5,7.2 Hz,2H)。
13C NMR(151 MHz,CDCl3)δ 173.75,145.88,145.40,134.16,119.95,114.82,111.04,56.32,51.95,36.21,30.69。
1H NMR(300 MHz,CDCl3)δ 9.82(t,J=1.5 Hz,1H),6.82~6.77(m,2H),6.69(dd,J=8.2,2.1 Hz,1H),5.65(s,1H),3.88(s,3H),2.89(dd,J=7.8,6.3 Hz,2H),2.80~2.72(m,2H)。
13C NMR(75 MHz,CDCl3)δ 201.81,145.65,145.10,133.58,119.63,114.48,110.80,56.02,45.38,27.58。
1H NMR(300 MHz,CDCl3)δ 3.73(s,3H),3.64(dd,J=7.6,4.6 Hz,1H),2.93(dd,J=12.5,4.6 Hz,1H),2.75(dd,J=12.5,7.6 Hz,1H),1.31(s,9H);13C NMR(75 MHz,CDCl3)δ 174.58,54.64,52.32,42.59,33.57,31.03。
1H NMR(600 MHz,CDCl3)δ 7.24(d,J=8.2 Hz,1H),5.67(d,J=8.4 Hz,1H),4.76(q,J=5.9 Hz,1H),4.57~4.32(m,1H),3.74(s,3H),3.03~2.53(m,4H),1.40(s,9H),1.38(s,9H),1.24(s,9H);13C NMR(151 MHz,CDCl3)δ 171.07,170.84,170.70,155.41,81.69,80.33,52.59,52.36,50.61,42.64,37.41,31.93,31.44,30.81,30.25,29.69,28.35,28.05。
1H NMR(600 MHz,MeOD)δ 4.65(dd,J=8.1,5.0 Hz,1H),4.26(dd,J=8.8,4.1 Hz,1H),3.75(s,3H),3.04(td,J=13.0,4.6 Hz,2H),2.98~2.84(m,2H),1.33(s,9H)。
13C NMR(151 MHz,MeOD)δ 172.65,171.92,169.28,54.64,53.08,50.83,43.47,36.01,31.18,28.29。
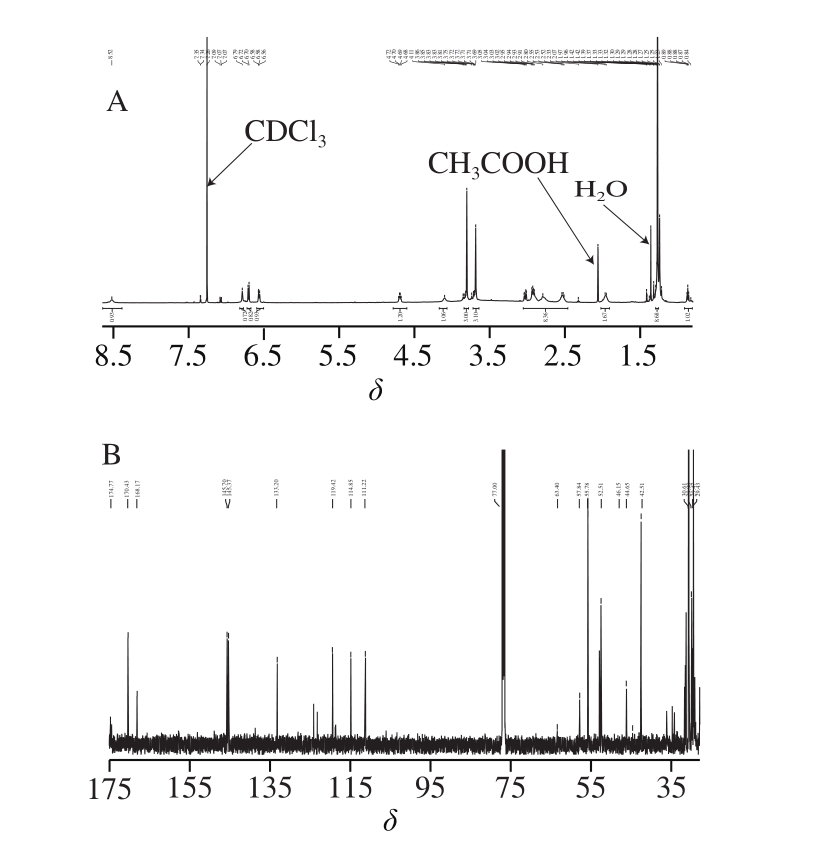
图4 化合物13的1H-NMR(A)和13C-NMR(B)
Fig. 41H-NMR (A) and13C-NMR (B) spectra of compond 13
1H NMR(600 MHz,CDCl3)δ 8.55(d,J=29.8 Hz,1H),6.79(s,1H),6.71(d,J=7.8 Hz,1H),6.57(d,J=7.8 Hz,1H),4.70(q,J=7.3 Hz,1H),4.11(s,1H),3.81(s,3H),3.69 (s,3H),3.06~2.47(m,8H),1.98(q,J=14.8 Hz,2H),1.28(s,J=2.8 Hz,9H),0.92~0.82 (m,1H)(图4A)。
13C NMR(151 MHz,CDCl3)δ 174.77,170.43,168.17,145.70,145.37,133.20,119.42,114.85,111.22,63.40,57.84,55.78,52.51,46.15,44.65,42.51,30.61,29.90,29.47,29.43(图4B)。
红外光谱(KBr):3 423、3 199、2 959、2 925、1 590、1 512、1 744、1 689、1 398、1 365、1 028、761、596 cm-1(图5A)。
质谱(电喷雾离子源)m/z 471.1 [(M+H)+],493.1[(M+Na)+](图5B)。
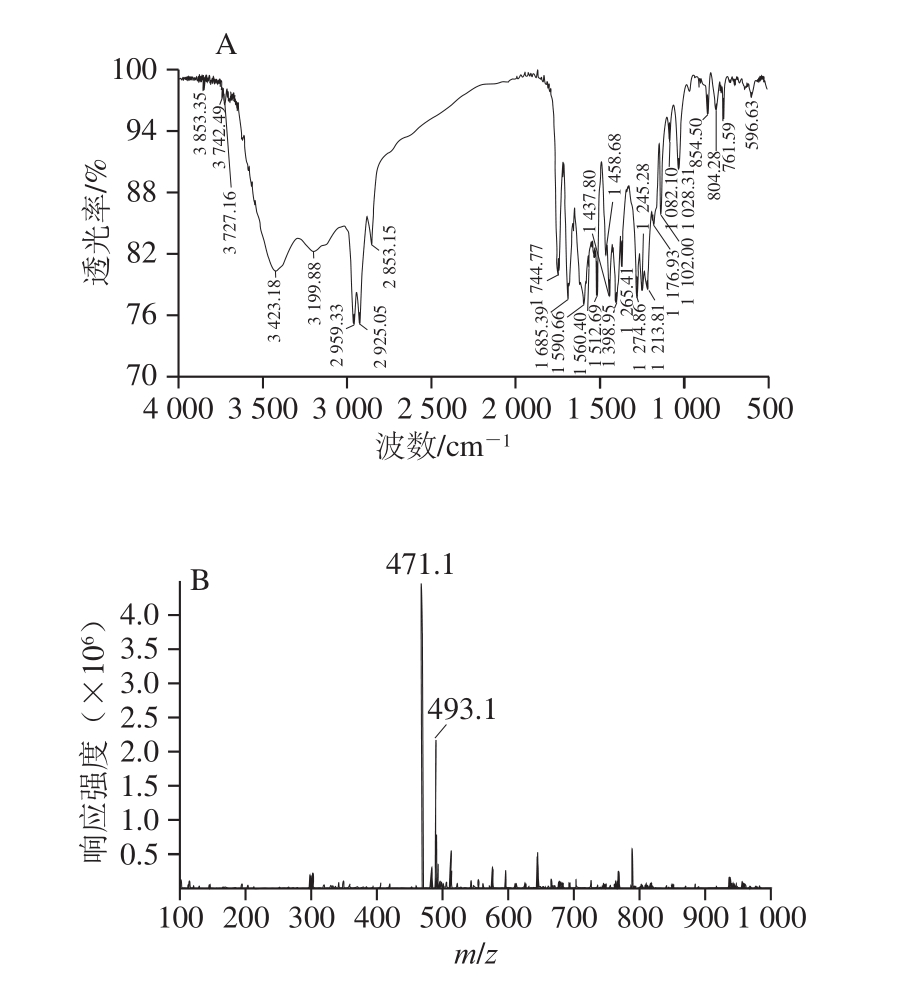
图5 化合物13的红外光谱(A)和质谱图(B)
Fig. 5 IR (A) and MS (B) spectra of compound 13
由氢谱数据可知,δ 8.55(d,J=29.8 Hz,1H)为S-叔丁基-L-半胱氨酰-甲酯上氨基的一个氢;6.79 (s,1H),6.71(d,J=7.8 Hz,1H),6.57(d,J=7.8 Hz,1H)分别为苯环上的3 个氢;4.70(q,J=7.3 Hz,1H)为S-叔丁基-半胱氨酰-甲酯上叔碳上的一个氢;4.11(s,1H)为L-α-天冬氨酰上叔碳上的一个氢;3.81(s,3H)为苯环上甲基的3 个氢;3.69(s,3H)为S-叔丁基-L-半胱氨酰-甲酯的甲基上的三个氢;3.06~2.47(m,8H),1.98(q,J=14.8 Hz,2H)为二肽和苯环上5 个亚甲基上的10 个氢;1.28(s,J=2.8 Hz,9H)为S-叔丁基-L-半胱氨酰-甲酯上的叔丁基的9 个氢;0.92~0.82(m,1H)为L-α-天冬氨酰上氨基上一个氢。
由碳谱数据可以看出(图4B),δ 174.77、170.43、168.17分别为3 个羰基上的碳;145.70、145.37、133.20、119.42、114.85、111.22分别为苯环上的6 个碳;62.40为L-α-天冬氨酰上的氨基相连的碳;57.84为苯环上甲氧基上的碳;55.78为S-叔丁基-半胱氨酰-甲酯上的叔碳;52.51为S-叔丁基-半胱氨酰-甲酯上甲基的碳;46.15为还原氨化对应醛基位置上的碳;44.65为叔丁基上季碳;42.51为L-α-天冬氨酰上的羧基相连的碳;30.61为叔丁基上的3 个碳;29.90为苯环苄基上的碳;29.47为S-叔丁基-L-半胱氨酰-甲酯的亚甲基上碳;29.43为苯环苄基相连的碳。
由红外光谱数据可以看出,3 423 cm-1和3 199 cm-1分别为O—H,N—H的振动;2 959 cm-1为—CH3的伸缩振动;2 925 cm-1为—CH2—的伸缩振动;1 590 cm-1和1 512 cm-1为苯环的骨架伸缩振动;1 744 cm-1和1 689 cm-1为C=O特征信号,1 245 cm-1为C—O伸缩振动;1 398 cm-1和1 365 cm-1为—C(CH3)3的振动;1 028 cm-1为饱和C—O伸缩振动;7 61 cm-1和596 cm-1弱吸收为S—C伸缩振动。
研究发现在60%的甲醇溶液中发生亚胺化,使用5%的钯碳进行催化氢化,可以使目标二肽甜味剂的产率达到最大。由于水的参与可以增大反应溶剂的介电常数,使得醛基的亲核加成更容易进行。同时研究发现,由于化合物中含有硫元素,不可避免的会产生与阿力甜一样的硫臭味。
传统甜味剂的合成主要在已有二肽甜味化合物的基础上进行基团修饰,从而提高化合物的甜度,而本实验则以氨基酸为原料,设计二肽合成,并进行基团修饰,从而完成了40 000 倍二肽甜味剂N-{N-[3-(3-羟基-4-甲氧基苯基)丙基]-L-α-天冬氨酰}-S-叔丁基-L-半胱氨-1-甲酯的全合成,将以天冬氨酸苯丙氨酸为主的二肽甜味剂扩展到天冬氨酸半胱氨酸,丰富了二肽甜味剂的类型,同时将目前甜味剂的甜度从20 000 倍提升到40 000 倍,在二肽类甜味剂的合成方面取得了明显的进步。本合成中的原料简便易得,合成步骤简单易行,且化合物中不含有苯丙氨酸,故适用于苯丙酮尿症患者,使用人群更为广泛,进而为开发绿色环保、甜度更高且符合人体生理要求的甜味剂提供了研究方向和目标。
[1] BACHMANOV A A, BOSAK N P, GLENDINNING J I, et al.Genetic of amino acid tasteand appetide[J]. Advances in Nutrition,2016, 7(4): 806-822. DOI:10.3945/an.115.011270.
[2] 曾广植. 氨基酸的味道及其甜味剂[J]. 化学通报, 1998(8): 1-9.DOI:10.14159/j.cnki.0441-3776.1980.08.001.
[3] KANT R. Sweet proteins-potential replacement for artificial low calorie sweeteners[J]. Nutrition Journal, 2005, 4(5): 1-6.DOI:10.1186/1475-2891-4-5.
[4] 杨双春, 刘慧芳, 王健, 等. 国内外人工合成的非能量型甜味剂研究现状[J]. 食品工业, 2013, 34(4): 181-184.
[5] CHATTOPADHYAY S, RAYCHAUDHURI U, CHAKRABORTY R.Artificial sweeteners: a review[J]. Journal of Food Science and Technology, 2014, 51(4): 611-621. DOI:10.1007/s13197-011-0571-1.
[6] MAZUR R H, GOLDKAMP A H, JAMS P A, et al. Structuretaste relationships of aspartic acid amides[J]. Journal of Medicinal Chemistry, 1970, 13(6): 1217-1221. DOI:10.1021/jm00300a046.
[7] 高玉婷, 张鹏, 杜刚, 李士明, 等. 人造甜味剂对人体健康的影响[J]. 食品科学, 2018, 39(7): 285-289. DOI:10.7506/spkx1002-6630-20180704.
[8] GLOWAKY R C, HENDRICK M E, SMILES R E, et al. Development and uses of alitame[J]. American Chemistry Society, 1991, 450(5): 57-67. DOI:10.1021/bk-1991-0450.ch005.
[9] NOFREA C, TINTI J M. Neotame: discovery, properties, utility[J].Food Chemistry, 2000, 69(3): 245-257. DOI:10.1016/S0308-8146(99)00254-x.
[10] PRAKASH I, BISHAY I, SCHROEDER S. Neotame: synthesis,stereochemistry and sweetness[J]. Synthetic Communications, 2007,29(24): 4461-4467. DOI:10.1080/00397919908086610.
[11] ANTHONY P, KALIDAS S, GOPINAHAN P, et al. Food biotechnilogy[M]. 2nd ed. Taylor & Francis Group, 2005: 921.
[12] AMINO Y, MORI K, TOMIYAMA Y, et al. Development of new, low calorie sweetener: new aspartame derivative[J]. American Chemistry Society, 2008, 979: 463-480. DOI:10.1021/bk-2008-0979.ch030.
[13] WUTS P G M, GREENE T W. Greene's protective groups in organic synthesis[M]. A John Willey & Sons, Inc., 2007: 538-645.
[14] BODANSZKY M. Synthesis of peptides by aminolysis of nitrophenyl esters[J]. Nature, 1955, 4459: 685-685. DOI:10.1038/175685a0.
[15] MONTALBETTI C A G N, FALQUE V. Amide bond formation and peptide coupling[J]. Tetrahedron, 2005, 61(46): 10827-10852.DOI:10.1016/j.tet.2005.08.031.
[16] LAWRENSON S B, ARAV R, NORTH M. The greening of peptide synthesis[J]. Green Chemistry, 2017, 7(19): 1685-1691. DOI:10.1039/c7gc00247e.
[17] BORCH F R, BERNSTEIN M D, DURST H D. The cyanohydridoborate anion as a selective reducing agent[J]. Journal of the American Chemical Society, 1970, 93(12): 2897-2903. DOI:10.1021/ja00741a013.
[18] GOLDBERG M, SARTAKOV D, BATS J W, et al. A chair analog of the bicyclic guanidine TBD: synthesis, structure and Brønsted base catalysis[J]. Beilstein Journal of Organic Chemistry, 2016, 12: 1870-1876. DOI:10.3762/boc.12.176.
[19] DIPEOLU O, GARDINER J, STEPHENS G. Biocatalytic amide reduction using Clostridium sporogens[J]. Biotechnology Letters,2005, 27(22): 1803-1807. DOI:10.1007/s10529-005-3730-5.
[20] HOSHIMOTO Y, KINOSHITA T, HAZRA S, et al. Main-groupcatalyzed reductive alkylation of multiply substituted amines with aldehydes using H2[J]. Journal of American Chemistry Society, 2018,140(23): 7292-7300. DOI:10.1021/jacs.8b03626.
[21] TISSOT M, PHIPPS R J, GAUNT M J, et al. Gram-scale enantioselective formal synthesis of morphine through an orthopara oxidative phenolic coupling strategy[J]. Angewandte Chemie International Edition, 2014, 53: 13498-13501. DOI:10.1002/anie.201408435.
[22] BARBUŠČÁKOVÁ Z, KOZUBÍKOVÁ H, ZÁLEŠÁK F, et al.General approach to neolignan-core of the boehmenan natural product family[J]. Monatshefte für Chemie-Chemical Monthly, 2018, 149(4):737-748. DOI:10.1007/s00706-017-2132-4.
[23] LUO D, SHARMA H, YEDLAPUDI D, et al. Novel multifunctional dopamine D2/D3 receptors agonists with potential neuroprotection and anti-alpha synuclein protein aggregation properties[J]. Bioorganic &Medicinal Chemistry, 2016, 24(21): 5088-5102. DOI:10.1016/j.bmc.2016.08.021.
[24] NOVAES L F T, AVILA C M, PELIZZARO-ROCHA K J, et al.(-)-Tarchonanthuslactone: design of new analogues, evaluation of their antiproliferative activity on cancer cell lines, and preliminary mechanistic studies[J]. Chemmedchem, 2015, 10(100): 1687-1699.DOI:10.1002/cmdc.201500246.
[25] GAO F, WEBB J D, HARTWIG J F. Chemo- and regioselective hydrogenolysis of diary ether C-O bonds by a robust heterogeneous Ni/C catalyst: applications to the cleavage of complex lignin-related fragments[J]. Angewandte Chemie International Edition, 2015, 55(4):1474-1478. DOI:10.1002/anie.201509133.
[26] LONG B, ZHANG J, TANG X, et al. Total synthesis of wewakazole B[J].Organic & Biomolecular Chemistry, 2016, 14: 9712-9715.DOI:10.1039/c6ob01783e.
[27] GONCALVES R S B, SILVA E T, SOUZA M V N. An envirometally friendly, scalable and higly efficient synthesis of (S,S)-ethambutol, a first line drug against tuberculosis[J]. Letters in Organic Chemistry,2015, 12(7): 478-481. DOI:10.2147/1570178612666150521235908.
[28] HAN G, TAMAKI M, HRUBY V J. Fast, efficient and selective deprotection of tert-butoxycarbonyl (Boc) group using HCl/dioxane(4 M)[J]. Chemical Biology & Drug Design, 2001, 58(4): 338-341.DOI:10.1034/j.1399-3011.2001.00935.x.
Synthesis and Characterization of High-Potency Dipeptide Sweetener
HU Nan, QIU Yun, GUO Dasan, et al. Synthesis and characterization of high-potency dipeptide sweetener[J]. Food Science,2019, 40(18): 48-54. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20181008-038. http://www.spkx.net.cn