植物乳杆菌具有益生特性,已被广泛应用于商业产品中[1]。益生菌只有通过口摄入并在人体胃肠道中定植足够的浓度,才能发挥其生物活性并赋予宿主健康[2]。因此为能在人体胃肠道中长期定植并发挥其益生功能,益生菌必须对黏膜有一定的黏附能力[3]。现普遍通过体外模拟实验近似反映益生菌在宿主体内的黏附情况,目前最广泛使用的体外黏附模型是人结肠癌腺细胞系[4]:Caco-2和HT-29。与其他乳酸菌相似,植物乳杆菌在产品生产和胃肠道中常遇到各种环境压力[5-6],其中乙醇胁迫是其存活的重要挑战之一。乙醇作为有机溶剂,主要通过破坏菌体细胞膜抑制植物乳杆菌的正常生长代谢。细胞膜作为胞内介质与外部环境之间的第一道屏障,在细胞生长、代谢、能量传导和维持恒定的胞内环境中起着重要作用[7]。乙醇渗入细胞膜中可以改变膜结构、破坏膜完整性,从而抑制膜功能,影响菌体的关键酶活性[8],致使菌体正常生理代谢调控异常,存活率降低。而且,由于细胞膜受损,可能造成菌体特异性黏附能力降低,影响其发挥益生功能。
然而,微生物具有许多自我保护机制以适应不利的环境,其中,膜状态的调节是细菌抵抗恶劣环境最常见的反应[9]。如Xiao Gong等[10]发现唾液乳杆菌对渗透压力的抗性与膜不饱和脂肪酸和饱和脂肪酸比例及油酸的环丙烷化有关。Heipieper等[11]发现,在乙醇胁迫下恶臭假单胞菌可通过改变顺式脂肪酸和反式脂肪酸的比例增加膜强度,提高耐受性。目前涉及乙醇胁迫下的乳杆菌益生能力及细胞膜生理应激反应尚未完全明确。因此,本研究以植物乳杆菌为研究对象,利用人体结肠癌细胞HT-29作为体外黏附模型,用不同体积分数的乙醇胁迫菌体,通过测定菌体对HT-29细胞的黏附能力及细胞膜表现出的应激反应,分析导致菌体失活及益生功能降低的主要因素,进一步探究乙醇胁迫损伤的机理。
植物乳杆菌(Lactobacillus planturam)ZLC-18,保藏于东北农业大学教育部乳品科学重点实验室。
14%三氟化硼(BF3)-甲醇溶液 上海北诺生物科技有限公司;结肠癌细胞HT-29 上海中科院;LIVE/DEAD BacLightTM Bacterial Viability Kit试剂盒 赛默飞世尔科技有限公司;无水乙醇及其他试剂均为分析纯。
SW-CJ-2FD超净工作台 苏州安泰公司;GI54WS高压灭菌器 厦门致微设备有限公司;GL-21M离心机上海市离心机械研究所;EVOS FL Auto 2荧光显微镜赛默飞-世尔科技有限公司;飞纳台式扫描电镜 上海复纳科学仪器有限公司;GC7890/MS5975C气相色谱-质谱联用仪 安捷伦(德国)有限公司。
1.3.1 菌种培养
将植物乳杆菌ZLC-18接种于MRS液体培养基中,37 ℃培养12~14 h,连续活化2 代。将活化好的供试菌株按体积分数2%的接种量接到MRS培养基中,37 ℃恒温培养至对数末期,调节对数末期菌液的OD600 nm值使菌体浓度为109 CFU/mL,备用。
1.3.2 乙醇胁迫下植物乳杆菌存活率的测定
取10 mL上述固定OD值的菌液,离心后重悬于等体积乙醇体积分数分别为0%、4%、6%、8%的MRS培养基中,于37 ℃恒温培养4 h,4 ℃、4 000 r/min离心10 min,弃去上清液,经磷酸盐缓冲液(phosphate buffered saline,PBS)(0.2 mol/L,pH 7.2~7.4)洗涤2 次并重悬于等体积生理盐水中,取1 mL重悬液,稀释不同梯度后涂布于MRS固体培养基上,37 ℃恒温培养48 h,测定0~4 h内菌体存活率。实验重复3 次,每次做3 个平行。按照NB/NA计算存活率,其中,NA为未受乙醇胁迫的活菌数,NB为经不同体积分数乙醇胁迫后的活菌数[12]。
1.3.3 乙醇胁迫处理实验
取生长到对数末期、浓度为109 CFU/mL的菌液10 mL,经4 ℃、4 000 r/min离心10 min收集菌泥,将菌泥加到等体积且乙醇体积分数分别为0%、4%、6%、8%的MRS培养基中培养4 h,调节OD600 nm值使菌液浓度为108 CFU/mL,用无菌PBS洗涤2 次后重悬于等体积PBS中,作为待测样品。
1.3.4 细胞膜完整性测定
使用LIVE/DEAD试剂盒测定。将荧光染料碘化吡啶和SYTO9以等体积混合,取3 μL混合染料加到1 mL待测样中,混合均匀后避光孵育15 min。取5 μL染色后的样液滴加在干净的载玻片上,轻轻盖上盖玻片,避免出现气泡,立即在荧光显微镜下观察。
1.3.5 超微结构测定
向不同体积分数乙醇胁迫4 h后的菌泥中加入2.5%的戊二醛(pH 6.8)固定样品,用0.1 mol/L的PBS(pH 6.8)反复冲洗3 次。用50%、70%、90%、100%乙醇溶液逐级脱水10 min。再用乙醇-丁叔醇(1∶1,V/V)混合液、叔丁醇各置换15 min,4 000 r/min离心3 min,弃去上清液,加入0.5 mL叔丁醇,于-20 ℃冰箱中放置30 min后进行冷冻干燥。在样品表面上镀一层金属膜,扫描电镜下观察细胞的表面结构。
1.3.6 黏附性改变
1.3.6.1 细胞培养
从液氮罐中取出HT-29细胞冻存管并置于37 ℃水浴中复苏,加入适量RPMI1640完全培养液(含10%胎牛血清、1%双抗),经1 000 r/min离心5 min,将细胞收集于培养瓶中,并加入4 mL RPMI1640完全培养液,在37 ℃、CO2体积分数为5%的培养箱中孵育,当细胞贴壁生长达到80%时,用0.25%胰酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)消化传代。2 d更换一次培养液,4 d传代一次,约传代5 次后可用于黏附实验。
1.3.6.2 乳杆菌对HT-29细胞的黏附观察
向细胞瓶中加入1 mL 0.25%胰酶-EDTA,将培养好的HT-29细胞消化3 min,再加入适量的RPMI1640不完全培养液(含血清,不含双抗)终止消化并调整细胞浓度约为5×105 个/mL。在无菌条件下,将细胞爬片置于6 孔培养板中,并在爬片上滴加1 mL细胞悬液,静置孵育1 h,补加1 mL不完全培养液继续孵育至细胞长至单层,用无菌PBS洗涤2 次,向每个培养孔中加入1 mL细菌待测样(108 CFU/mL),在培养箱中孵育2 h后取出细胞爬片,用PBS洗涤3 次去除未黏附的细菌,并用0.4%多聚甲醛固定细胞30 min,晾干后进行革兰氏染色,在显微镜下观察植物乳杆菌的黏附情况,每个实验做4 次平行。
1.3.6.3 乳杆菌对HT-29细胞的黏附计数[13]
细胞培养与处理同1.3.6.1、1.3.6.2节,除将细胞悬浮液滴在6 孔培养板上而不放置细胞爬片。经PBS洗涤后,向板中加入0.7 mL胰酶作用3 min,再加0.3 mL不完全培养液以终止消化。加入0.5 mL 0.1%的Triton X-100,混合均匀后静置10 min,以裂解细胞。将混合物梯度稀释后利用平板计数法计算黏附的细菌数。同时,选取长至单层的6 孔培养板,使用血球计数板计算每个孔板中的细胞数。每个处理做4 个平行,根据下式计算平均每个细胞黏附的细菌数:
1.3.7 细胞膜脂肪酸组成比较
1.3.7.1 膜脂肪酸的提取、甲酯化
细胞膜脂肪酸的提取、甲酯化及气相色谱-质谱检测条件参照文献[14-15],并稍作修改。取经不同体积分数乙醇胁迫4 h且浓度为108 CFU/mL的待测样各200 mL,经3 000 r/min离心5 min弃上清液,用Milii-Q水反复洗涤细胞3 次后进行液氮研磨,取0.3 g研磨后的菌体,加入1.5 mL氯仿和0.6 mL 0.05%乙酸溶液旋涡振荡4 min,再加入3 mL溶液B(氯仿(含0.01%二丁基羟基甲苯)-甲醇为2∶1的混合液)振荡4 min,2 000 r/min离心3 min,吸取下层清液于新的玻璃管中。此萃取过程(加入3 mL溶液B,振动离心并收集下层)重复3~5 次,直至细胞离心后沉降至离心管底。收集所有下层清液并加入1 mL 1 mol/L的KCl溶液,涡旋1 min,2 000 r/min离心1 min弃上清液。向保留的下层中加入2 mL水冲洗提取物,涡旋1 min,2 000 r/min离心1 min弃上清液。此时,下层清液中包含细胞总脂质(但主要为细胞膜中磷脂),将下清液置于33 ℃的水浴旋蒸,并用1 mL氯仿-甲醇(1∶1)混合溶液溶解蒸干的样品,冷冻干燥过夜。加入600 μL 14% BF3-甲醇溶液和10 μL十七烷酸(C17:0,溶于甲醇,2 mg/mL),于100 ℃沸水浴25 min后用流水使其迅速冷却,加入600 μL正己烷萃取,充分混匀,经2 000 r/min离心5 min,取正己烷相进行气相色谱-质谱分析,每个取样点取3 个平行样品。
1.3.7.2 脂肪酸检测
采用气相色谱-质谱对样品进行定性和定量分析。色谱柱:HP-5气相色谱柱(30 m×0.32 mm,0.25 μm);进样口温度:280 ℃;升温程序:70 ℃保持2 min,然后升至290 ℃(8 ℃/min),保持3 min;载气(He)流速1 mL/min;恒压9.1 kPa;进样量1 μL;不分流模式,流量50 mL/min;载气节省,15 mL/min。质谱参数:电子能量70 eV;离子源温度250 ℃;扫描范围m/z 50~800。
实验结果以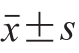 表示。使用Origin 8.6作图,运用SPSS 8.1软件,采用独立样本t检验进行数据分析(P<0.05)。
表示。使用Origin 8.6作图,运用SPSS 8.1软件,采用独立样本t检验进行数据分析(P<0.05)。
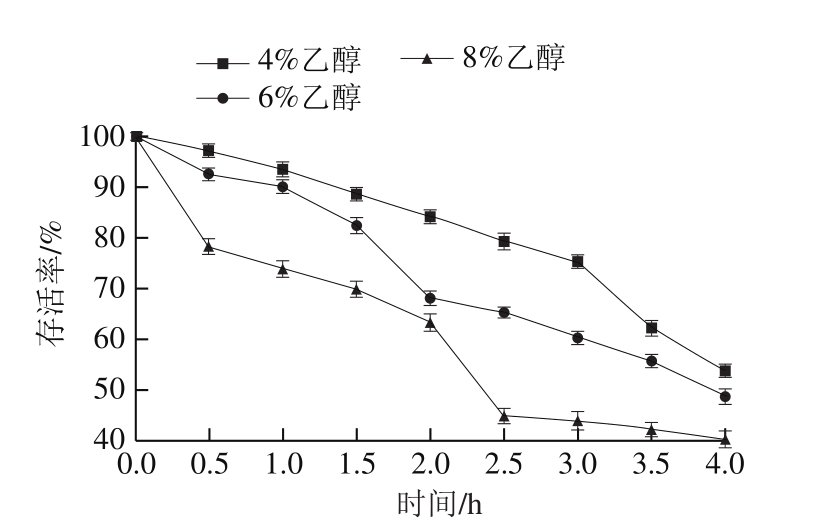
图1 乙醇胁迫对植物乳杆菌存活率的影响
Fig. 1 Effect of ethanol stress on the survival rate of L. plantarum
由图1可以看出,经不同体积分数乙醇胁迫0~4 h,植物乳杆菌的存活率均依次下降。经4%乙醇胁迫处理0~3 h,菌体的存活率下降相对缓慢,在胁迫3 h后大幅度下降,4 h处菌体存活率为53.8%;经6%乙醇胁迫处理1.5 h时,菌体存活率下降幅度较大,4 h处菌体存活率为48.7%;经8%乙醇胁迫处理0.5 h时,菌体的存活率下降了21.7%,在2~2.5 h间出现二次大幅度下降,在4 h时菌体存活率仅为40.2%。结果说明,经4%、6%乙醇处理1 h内,植物乳杆菌能迅速适应环境,维持自身活性,存活率在90%以上,但随着胁迫时间的延长,菌体存活率均逐渐降低,可见长时间低体积分数乙醇胁迫也会使菌体生长变缓,生长周期延长[16]。乙醇可引起细胞膜结构改变,破坏膜功能,导致细胞内中心碳代谢受阻。同时,乙醇可通过刺激细胞内活性氧的产生诱导细胞凋亡[17]。由乙醇胁迫引起的这些联合作用将抑制植物乳杆菌细胞的生长,但不一定杀死细胞;而经8%乙醇胁迫0.5 h时,菌体生长受到显著抑制,存活率明显降低,随后菌体产生适当应激反应抗环境压力,维持一定的存活率。然而,随着胁迫时间延长,菌体难以通过其自身的保护机制抵抗恶劣环境而造成二次大量死亡。这一结果与朱敏[18]、李爱霞等[19]研究结果一致,乙醇胁迫会影响菌体正常的生长代谢,高体积分数乙醇甚至会造成菌体大量死亡。

图2 乙醇胁迫对植物乳杆菌细胞膜完整性的影响
Fig. 2 Effects of ethanol stress on the cell membrane integrity of L. plantarum
细胞膜的完整性对维持细胞活力和代谢功能至关重要[20],因此,微生物会调动许多机制抵抗来自环境的压力,维持细胞膜的完整性。几乎所有的对照组菌体都发绿色荧光(图2a),说明其细胞膜完整性未受到损伤,菌体活力良好;经4%乙醇胁迫处理后,菌体大部分仍发绿色荧光,有少数发红色荧光(图2b),说明大部分菌体可维持自身细胞膜完整性不被破坏,只有少数细胞膜完整性受到了一定程度的损伤,甚至造成细胞死亡;而经6%、8%乙醇胁迫处理后,均有超过半数的菌体发红色荧光(图2c、d),说明菌体细胞膜完整性大部分都受到破坏,植物乳杆菌因难以抵御乙醇的毒害而造成大量死亡。细胞膜的稳定性主要与膜疏水基相互作用有关,乙醇对菌体的毒害主要是破坏细胞膜结构中的膜疏水核心,使这一区域的极性增强,破坏了细胞膜对极性分子自由通过的渗透屏障,导致细胞膜完整性受损[21]。此外,质膜ATP酶(H+-ATPase)是质膜中的主要蛋白质,它的作用是维持细胞质中离子的动态平衡[22],乙醇可能通过降低质膜ATP酶的活性使其功能失常,影响菌体膜的通透性,致使细胞膜完整性受损,细胞膜渗透性及流动性增强,细胞内物质外泄,菌体生长受到抑制。

图3 乙醇胁迫下植物乳杆菌形态变化的扫描电镜观察
Fig. 3 Scanning electron microscopy of the morphological changes of L. plantarum under ethanol stress
对照组菌体为长杆菌且结构基本完好,细胞表面没有明显的细胞碎片(图3a);与对照组相比,经4%乙醇胁迫后的菌体细胞表面粗糙、塌陷,有少数破裂,并出现许多稍粗且短的杆状细胞(图3b);经6%乙醇胁迫后,细胞表面更加粗糙,许多细胞破裂并有细胞质流出,细胞间出现黏连的情况(图3c);8%乙醇胁迫处理后,不仅观察到破碎的细胞,而且细胞周边变得模糊,细胞壁变薄,细胞聚集并彼此黏连(图3d)。结果表明,植物乳杆菌对抗环境压力的机制可能与菌体的形态变化有关[23]。低体积分数乙醇胁迫时,植物乳杆菌可通过改变自身的长度、宽度及凹陷程度减少与乙醇的接触面积,维持细胞的正常生命活动。随着乙醇体积分数的增加,细胞通过相互聚集抵抗乙醇胁迫,但部分菌体细胞膜结构及功能已被破坏,致使中心碳代谢受阻,胞内物质流出,菌体生长受到显著抑制,当乙醇体积分数达到一定值时可直接造成细胞裂解。
体外培养人体结肠癌细胞HT-29,当在6 孔培养板中长至单层时,由血球计数板计得细胞数为(1.15±0.3)×106 个。如图4所示,未受乙醇胁迫的植物乳杆菌能够很好地黏附在HT-29细胞周围;经4%乙醇胁迫后的乳杆菌仍能整齐地黏附在细胞周围;经6%、8%乙醇胁迫后,植物乳杆菌对HT-29细胞的黏附变得没有规则,黏附能力也显著低于对照组。这与平板计数的结果一致,见图5。其中,对照组黏附细菌数为(49.50±1.42)CFU/cell,经4%、6%、8%乙醇胁迫处理后黏附数量分别为(3 1.2 5±0.9 3)、(2 7.2 5±0.7 4)、(19.75±0.82)CFU/cell。细菌的黏附可分为特异性黏附和非特异性黏附[24]。特异性黏附是通过细菌表面的黏附素与细胞表面的受体特异性结合;非特异性黏附则与菌体的表面性质有关,特别是疏水性、表面电荷、自聚集能力等。乙醇等有机溶剂可以导致菌体细胞膜蛋白质的解聚或变性[25],使菌体与细胞表面的特异性黏附受到抑制,同时还会引起细胞膜上的磷脂双分子层变为相互交叉排列,降低细胞膜表面电荷密度,改变脂双分子层厚度,使疏水核心消失等[26],因此造成植物乳杆菌黏附HT-29细胞的能力降低。实际上,当益生菌进入宿主肠道后,首先黏附于覆盖在肠上皮细胞表面的黏液层,再结合在肠上皮细胞上。体外黏附模型没有考虑到覆盖在肠道上皮细胞最外层的黏液层,这点有异于人体肠道内的真实环境[24]。但采用人体结肠癌细胞HT-29作为黏附模型,能表现出人体成熟肠上皮细胞的特性,且具有快捷直观的优点。因此,由乙醇胁迫造成的植物乳杆菌对HT-29细胞的黏附能力降低可在一定程度上反映出植物乳杆菌在胃肠道中定植的能力下降,影响其益生功能的正常发挥。
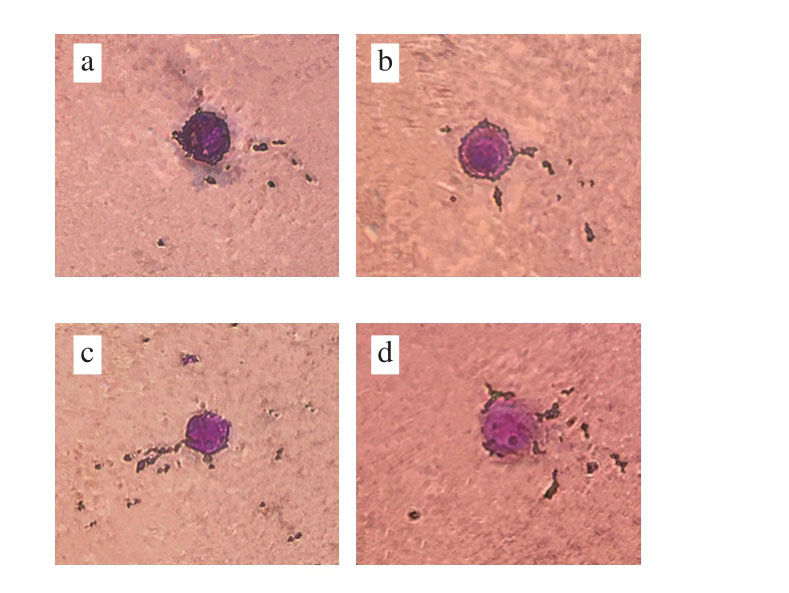
图4 植物乳杆菌对HT-29细胞的黏附能力(×1 000)
Fig. 4 Adhesion ability of L. plantarum to HT-29 cell (× 1 000)
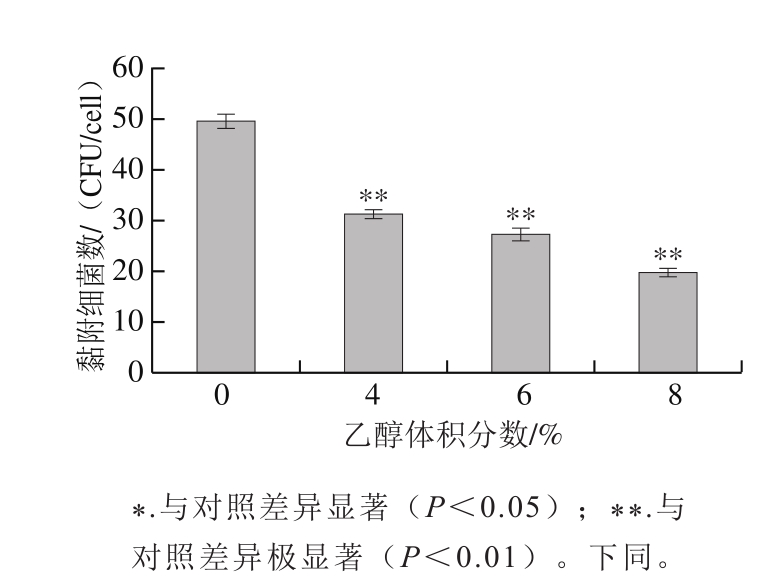
图5 植物乳杆菌对HT-29细胞的黏附分析
Fig. 5 Adhesion capacity of L. plantarum to HT-29 cells
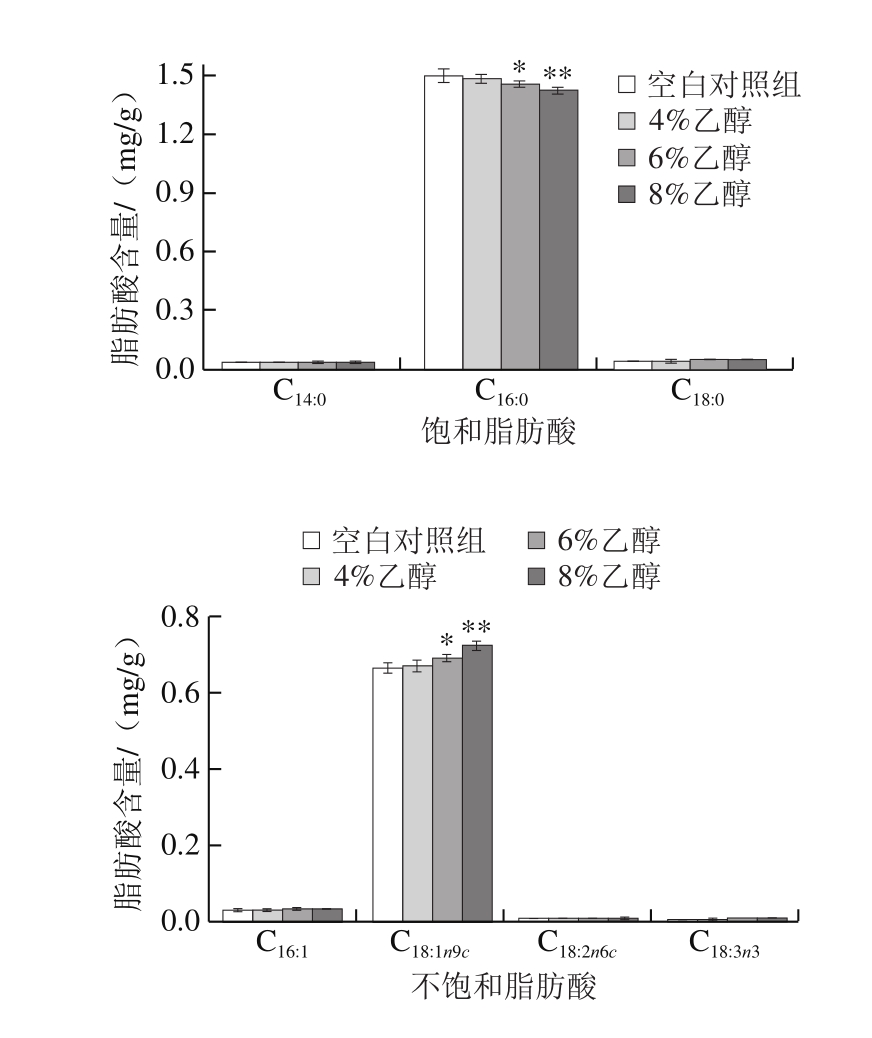
图6 乙醇胁迫下植物乳杆菌细胞膜中脂肪酸的分布
Fig. 6 Alteration in the distribution of fatty acids in the cell membrane of L. plantarum upon ethanol stress

图7 乙醇胁迫下植物乳杆菌细胞膜中不饱和脂肪酸与饱和脂肪酸比率(a)和平均碳链长度(b)
Fig. 7 Unsaturated fatty acid/saturated fatty acid ratio (a) and mean chain length (b) in the cell membrane of L. plantarum upon ethanol stress
不饱和脂肪酸与饱和脂肪酸比率的变化是用于调节膜流动性的最常见的细胞机制,脂肪酸链长度的增加是提高环境胁迫下菌体存活率的另一重要机制[27]。Guan Xueli等[28]通过破碎菌体细胞,选用极性提取溶剂,促使细胞膜中结合态脂类游离,并增大与磷脂等极性脂类的亲和性,提出总极性脂质(主要含有磷脂和鞘脂)作为细胞膜脂肪酸的提取方法。本实验选用氯仿-甲醇及0.05%乙酸溶液为提取液,提取菌体细胞膜脂肪酸。如图6所示,经不同体积分数乙醇胁迫4 h后,植物乳杆菌细胞膜中饱和脂肪酸与不饱和脂肪酸的组成发生了变化,其中最显着的变化是饱和脂肪酸含量的大幅度下降和不饱和脂肪酸含量的增加,反映了在胁迫条件下不饱和脂肪酸与饱和脂肪酸比率的显着变化(图7a),不饱和脂肪酸与饱和脂肪酸比率随着乙醇胁迫的体积分数增大而增大,而且膜脂肪酸的平均碳链长度在乙醇胁迫下也逐渐增大(图7b)。结果表明,植物乳杆菌通过增加其膜中长链不饱和脂肪酸的比例降低由乙醇诱导的细胞膜流动性增加,维持细胞膜的稳定。这些变化与许多其他细菌报道的相似[29-30]。造成这种现象的原因可能是由于乙醇诱导细胞膜饱和脂肪酸合成途径受阻[31],以及不饱和脂肪酸合成的增加,导致细胞膜中不饱和脂肪酸与饱和脂肪酸比率增大,而较长的链更容易跨越双层膜,促进酰基链填充并使膜环境更像凝胶状,通过减小游离酰基链末端的运动降低膜的流动性和不稳定性[32],使植物乳杆菌在乙醇胁迫下保持自身的稳定状态,维持细胞活力。
随着乙醇体积分数的增加,植物乳杆菌存活率依次降低,经8%乙醇胁迫处理后菌体的存活率仅为40.2%。乙醇胁迫引起的联合作用可改变细胞形态,破坏细胞膜完整性,阻断膜功能,造成菌体代谢活力减弱,降低黏附HT-29细胞的能力。通过比较不同体积分数乙醇胁迫下细胞膜的应激反应,可以看出植物乳杆菌的抗乙醇胁迫能力与细胞膜的完整性有关,细胞膜中不饱和脂肪酸与饱和脂肪酸比率及脂肪酸平均链长的增大在菌体抗乙醇胁迫的过程中发挥重要作用。本研究提供了植物乳杆菌在乙醇环境中所作出的应激反应及经不同体积分数乙醇胁迫后的菌体对HT-29细胞黏附性的影响,为提高该菌种在乙醇胁迫下的工业效用提供帮助。
[1] KOTZAMANIDIS C, KOURELIS A, LITOPOULOU-TZANETAKI E,et al. Evaluation of adhesion capacity, cell surface traits and immunomodulatory activity of presumptive probiotic Lactobacillus strains[J]. International Journal of Food Microbiology, 2010, 140(2):154-163. DOI:10.1016/j.ijfoodmicro.2010.04.004.
[2] 陈卫, 谭惠子, 胡斌, 等. 益生菌对消化道胃酸和胆盐胁迫的应激机理中[J]. 中国食品学报, 2010, 10(6): 1-6. DOI:10.16429/j.1009-7848.2010.06.035.
[3] MOUSSAVI M, ADAMS M C. An in vitro study on bacterial growth interactions and intestinal epithelial cell adhesion characteristics of probiotic combinations[J]. Current Microbiology, 2010, 60(5): 327-335. DOI:10.1007/s00284-009-9545-1.
[4] 陈臣, 周方方, 吴正钧, 等. 荧光标记法初探植物乳杆菌ST-III对Caco-2细胞的粘附机理[J]. 微生物学通报, 2010, 37(3): 355-361.DOI:10.13344/j.microbiol.china.2010.03.003.
[5] ENGSTRAND L, LINDBERG M. Helicobacter pylori and the gastric microbiota[J]. Best Practice & Research in Clinical Gastroenterology,2013, 27(1): 39-45. DOI:10.1016/j.bpg.2013.03.016.
[6] GUCHTE M V D, SERROR P, CHERVAUX C, et al. Stress responses in lactic acid bacteria[J]. Antonie Van Leeuwenhoek, 2002,82(1/2/3/4): 187-216. DOI:10.1023/a:1020631532202.
[7] ZHANG Y M, ROCK C O. Membrane lipid homeostasis in bacteria[J].Nature Reviews Microbiology, 2008, 6(3): 222-233. DOI:10.1038/nrmicro1839.
[8] SARDESSAI Y, BHOSLE S. Tolerance of bacteria to organic solvents[J]. Research in Microbiology, 2002, 153(5): 263-268.DOI:10.1016/S0923-2508(02)01319-0.
[9] KEWELOH H, DIEFENBACH R, REHM H J. Increase of phenol tolerance of Escherichia coli by alterations of the fatty acid composition of the membrane lipids[J]. Archives of Microbiology,1991, 157(1): 49-53. DOI:10.1007/BF00245334.
[10] XIAO G, YU H, CHEN J, et al. Cell surface properties of Lactobacillus salivarius, under osmotic stress[J]. European Food Research & Technology, 2012, 234(4): 671-678. DOI:10.1007/s00217-012-1677-z.
[11] HEIPIEPER H J, DE BONT J A. Adaptation of Pseudomonas putida S12 to ethanol and toluene at the level of fatty acid composition of membranes[J]. Applied and Environmental Microbiology, 1994,60(12): 4440-4444. DOI:10.1016/0922-338X(95)92742-U.
[12] 李宝坤. 乳酸杆菌冷冻干燥生理损伤机制及保护策略的研究[D].无锡: 江南大学, 2011: 16-24.
[13] 李清, 刘小莉, 王英, 等. 植物乳杆菌表面性质及对Caco-2细胞的黏附[J]. 食品科学, 2015, 36(9): 97-101. DOI:10.7506/spkx1002-6630-201509018.
[14] BO T, LIU M, ZHONG C, et al. Metabolomic analysis of antimicrobial mechanisms of ε-poly-L-lysine on Saccharomyces cerevisiae[J].Journal of Agricultural and Food Chemistry, 2014, 62(19): 4454-4465.DOI:10.1021/jf500505n.
[15] XIA J M, YUAN Y J. Comparative lipidomics of four strains of Saccharomyces cerevisiae reveals different responses to furfural,phenol, and acetic acid[J]. Journal of Agricultural and Food Chemistry,2009, 57(1): 99-108. DOI:10.1021/jf802720t.
[16] 吴晓英, 耐乙醇巴氏醋酸杆菌的构建及其胞内代谢物研究[D].天津: 天津科技大学, 2015: 2-4.
[17] MAGDALENO F, BLAJSZCZAK C C, NIETO N. Key events participating in the pathogenesis of alcoholic liver disease[J].Biomolecules, 2017, 7(1): 1-14. DOI:10.3390/biom7010009.
[18] 朱敏. 乙醇胁迫对乳酸杆菌代谢活力及膜结构的影响[D]. 石河子:新疆石河子大学, 2015: 11-12.
[19] 李爱霞, 王盼雪, 樊明涛, 等. 植物乳杆菌对pH、酒精浓度和SO2浓度耐受性的研究[J]. 中国酿造, 2013, 32(9): 42-46. DOI:10.3969/j.issn.0254-5071.2013.09.011.
[20] WU C, ZHANG J, WANG M, et al. Lactobacillus casei combats acid stress by maintaining cell membrane functionality[J]. Journal of Industrial Microbiology & Biotechnology, 2012, 39(7): 1031-1039.DOI:10.1007/s10295-012-1104-2.
[21] 吴培, 张毅, 许喜林. 有机溶剂对酵母细胞膜完整性的作用机制研究[J]. 食品工业科技, 2008, 29(1): 301-303. DOI:10.13386/j.issn1002-0306.2008.01.001.
[22] DING J, HUANG X, ZHANG L, et al. Tolerance and stress response to ethanol in the yeast Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology, 2009, 85(2): 253-263. DOI:10.1007/s00253-009-2223-1.
[23] CANETTA E, ADYA A K, WALKER G M. Atomic force microscopic study of the effects of ethanol on yeast cell surface morphology[J].Fems Microbiology Letters, 2006, 255(2): 308-315. DOI:10.1111/j.1574-6968.2005.00089.x.
[24] 陈臣. 植物乳杆菌ST-III对肠上皮细胞的粘附性质及机理的研究[D]. 无锡: 江南大学, 2008: 6-8.
[25] 乌日娜. 益生菌Lactobacillus casei Zhang蛋白质组学研究[D]. 呼和浩特: 内蒙古农业大学, 2009: 5-10.
[26] RE B D, SGORBATI B, MIGLIOLI M, et al. Adhesion,autoaggregation and hydrophobicity of 13 strains of Bifidobacterium longum[J]. Letters in Applied Microbiology, 2000, 31(6): 438-442.DOI:10.1046/j.1365-2672.2000.00845.x.
[27] FOZO E M, KAJFASZ J K, QUIVEY R G. Low pH-induced membrane fatty acid alterations in oral bacteria[J]. FEMS Microbiology Letters, 2006, 238(2): 291-295. DOI:10.1111/j1574-6968.2004.tb09769.x.
[28] GUAN X L, WENK M R. Mass spectrometry-based profiling of phospholipids and sphingolipids in extracts from Saccharomyces cerevisiae[J]. Yeast, 2010, 23(6): 465-477. DOI:10.1002/yea.1362.
[29] GUERZONI M E, LANCIOTTI R, COCCONCELLI P S. Alteration in cellular fatty acid composition as a response to salt, acid, oxidative and thermal stresses in Lactobacillus helveticus[J]. Microbiology,2001, 147(8): 2255-2264. DOI:10.1099/00221287-147-8-2255.
[30] FOZO E M, QUIVEY R G. The fabM gene product of Streptococcus mutans is responsible for the synthesis of monounsaturated fatty acids and is necessary for survival at low pH[J]. Journal of Bacteriology,2004, 186(13): 4152-4158. DOI:10.1128/JB.186.13.4152-4158.2004.
[31] MAGNUSON K, JACKOWSKI S, ROCK C O, et al. Regulation of fatty acid biosynthesis in Escherichia coli[J]. Microbiological Reviews,1993, 57(3): 522-542. DOI:10.1590/S0004-27492009000600012.
[32] LAN C H, MARECHAL P A, MAI L T, et al. Fluorescent probes to evaluate the physiological state and activity of microbial biocatalysts:a guide for prokaryotic and eukaryotic investigation[J]. Biotechnology Journal, 2010, 3(7): 890-903. DOI:10.1002/biot.200700206.
Effect of Ethanol Stress on Membrane Physiology and Adhesion of Lactobacillus plantarum
WANG Tingting, LI Chun, LI Jiadong, et al. Effect of ethanol stress on membrane physiology and adhesion of Lactobacillus plantarum[J]. Food Science, 2019, 40(18): 63-69. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20181009-059. http://www.spkx.net.cn