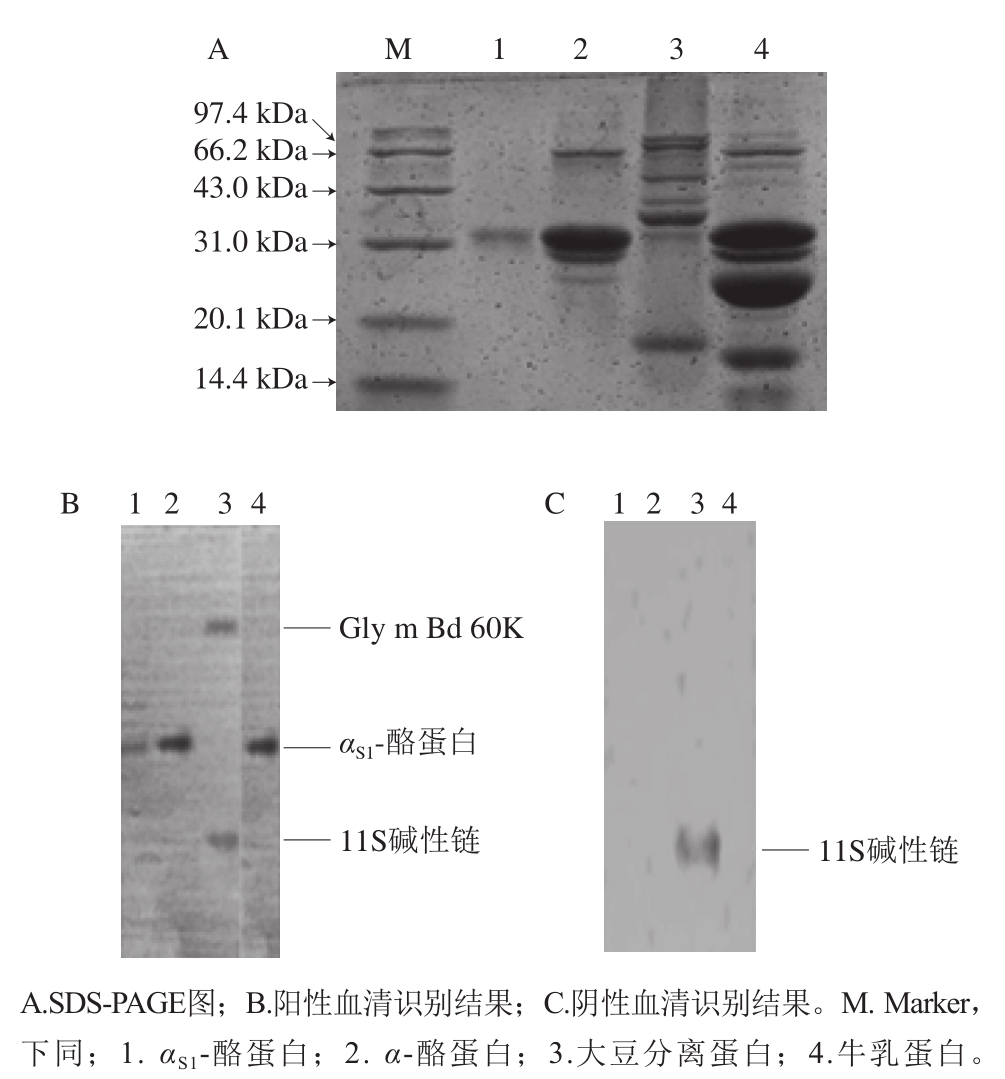
图1 牛乳过敏患者血清识别大豆蛋白交叉过敏原
Fig. 1 Identification of cross-reactive allergens with cow milk allergic patients' sera
世界粮农组织1995年报告,90%以上的食物过敏是由牛奶、鸡蛋、鱼、甲壳类动物、花生、大豆、坚果类和小麦引起。一些过敏患者对某种食物过敏,然后食用其他同源食物或非同源食物也可能产生过敏反应,这种现象称为食物的交叉过敏,但是与同源食物发生过敏的频率及强度显著高于非同源食物,比如牛乳与其他动物乳类、虾和贝壳海产品,花生和其他豆类食物等[1-3]。食物交叉过敏的普遍性和复杂性增加了食物过敏发生的概率,同时增加了建立精准高效的过敏原定量检测方法及开发低过敏食品的难度。过敏原的交叉反应研究一直是食品过敏学领域的重要研究课题,识别鉴定交叉过敏原,分析其结构与致敏特性的关系,对于过敏原检测、诊断以及过敏原脱敏疫苗设计,指导过敏患者合理饮食,开发新型低过敏食品,合理有效避免交叉过敏反应发生均具有重要的意义。
每100 mL牛乳约含有3 g蛋白质,包含至少25 种不同的蛋白质,是婴幼儿最理想的母乳替代品,但是牛乳中这些蛋白质都可能是潜在的过敏原[4],研究表明,酪蛋白中的4 种组分是主要过敏原,并且αS1-酪蛋白的致敏性要强于αS2-、β-、κ-酪蛋白[5-6]。大豆蛋白质的氨基酸组成平衡合理,可以提供婴幼儿正常的生长和免疫需求,并且成本低,适口性好,因此大豆蛋白质也被广泛应用于婴幼儿食品中。通常将大豆种子中的过敏原蛋白可分为5 大类,Gly m 5(β-伴大豆球蛋白)、Gly m Bd 30K/P34、Gly m Bd 28K/P28、Gly m 6(大豆球蛋白)和Gly m Ti(胰蛋白酶抑制剂)[7]。本课题组前期系统研究了牛乳主要过敏原αS1-酪蛋白的作用表位及关键氨基酸[8],而牛乳αS1-酪蛋白与大豆蛋白中的致敏蛋白是否存在交叉过敏反应是本研究的重点内容。
本研究以牛乳过敏婴幼儿血清、αS1-酪蛋白单克隆抗体为探针,通过免疫印迹实验识别鉴定大豆蛋白质交叉过敏原,并通过生物信息学软件进行序列比对,验证体外实验结果,最后深入探究了交叉过敏原的消化稳定性和热稳定性。
αS1-酪蛋白 美国Sigma公司;αS1-酪蛋白单克隆抗体 实验室自制;低分子质量标准蛋白 北京天根生物科技有限公司;HRP-鼠抗人IgE、HRP-羊抗小鼠IgG北京友谊中联生物技术有限公司;大豆分离蛋白 上海源叶生物科技有限公司;96 孔酶标板 北京拜尔迪生物技术有限公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜 美国密理博公司。
KHB ST-360酶标仪 上海科华实验系统有限公司;DYY-7C型电泳仪、电热恒温水浴锅 北京市六一仪器厂;SH-2磁力搅拌器 北京东方开物科学器材公司;BSA124S-CW电子天平 赛多利斯科学仪器有限公司。
1.3.1 牛乳过敏患者血清的收集
筛选8 名牛乳过敏患者(年龄在2~3 岁),4 男4 女,临床症状均为特异性皮炎,收集血清,血清IgE抗体含量为25~100 kU/L。5 名非牛乳过敏儿童(5~10 岁)血清作为阴性对照。阳性、阴性血清均等体积混合用以识别交叉过敏原。
1.3.2 牛乳αS1-酪蛋白单克隆抗体的制备、亚型鉴定及效价测定
牛乳αS1-酪蛋白单克隆抗体的制备按照Docena等[9]的方法,亚型鉴定采用IgG酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)试剂盒测定,间接ELISA法测定单抗效价[10],以5 μg/mL的αS1-酪蛋白(溶解液为50 mmol/L pH 9.6的碳酸盐缓冲液)作为包被抗原,抗体按1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000倍数稀释(稀释液为磷酸盐缓冲溶液),底物显色液为60 mg四甲基联苯胺溶于10 mL二甲基亚砜配制而成。以未被免疫的正常小鼠血清为阴性对照,测定450 nm波长处的OD值。
1.3.3 牛乳αS1-酪蛋白与大豆蛋白交叉反应原的鉴定
分别以牛乳过敏患者血清、αS1-酪蛋白单抗为探针,用免疫印迹法识别大豆蛋白交叉过敏原。首先用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)分离αS1-酪蛋白、α-酪蛋白、大豆分离蛋白、牛乳蛋白,然后将分离胶上的蛋白转印到PVDF膜上,进而在膜上完成免疫印迹反应,一抗为牛乳过敏患者混合血清(稀释倍数1∶10)或αS1-酪蛋白抗体(稀释倍数1∶16 000),二抗为HRP-鼠抗人IgE(稀释倍数1∶2 000)或HRP-羊抗小鼠IgG(稀释倍数1∶4 000),以4-氯-1-萘酚为底物显色液[11-13]。阴性血清作对照。
1.3.4 牛乳αS1-酪蛋白与大豆Gly m Bd 60K的氨基酸序列比对
通过GenBank检索αS1-酪蛋白与Gly m Bd 60K的基因序列,应用DNAStar软件导出各蛋白的氨基酸序列,利用NCBI网页工具中的BLASTp工具比对相似氨基酸序列[14-17]。
1.3.5 交叉过敏原在模拟胃液中的消化稳定性
胃蛋白酶活力的测定采用GB/T 23527-2009《蛋白酶制剂》[18]中的福林-酚法。消化稳定性实验参照国家标准农业部869号公告-2-2007《模拟胃肠液外源蛋白质消化稳定性试验方法》[19]进行。以国际公认的过敏原鸡蛋清白蛋白、大豆胰蛋白酶抑制剂为阳性对照,无致敏性的马铃薯酸性磷酸酶为阴性对照。将模拟胃液消化处理的样品进行SDS-PAGE。
1.3.6 加热对过敏原交叉反应特性的影响
以不同加热时间和加热温度对分离提取的大豆蛋白Gly m Bd 60K进行加热处理,分别于70、100 ℃对Gly m Bd 60K加热10、20、30、40、50、60 min。通过免疫印迹实验以αS1-酪蛋白单抗为探针评价加热对过敏原交叉反应性的影响。
采用微软Excel 2010软件进行图表制作,采用SPSS 17.0进行数据分析。

图1 牛乳过敏患者血清识别大豆蛋白交叉过敏原
Fig. 1 Identification of cross-reactive allergens with cow milk allergic patients' sera
如图1A所示,第3泳道大豆蛋白条带由上到下分别为α’亚基、α亚基、β亚基、A3、11S酸性链、38 kDa、11S碱性链、14.4 kDa蛋白,第4泳道牛乳蛋白条带由上到下分别为乳铁蛋白、血清白蛋白、免疫球蛋白、α-酪蛋白、β-酪蛋白、κ-酪蛋白、β-乳球蛋白和α-乳白蛋白。图1B为牛乳过敏患者混合血清识别4 种蛋白的结果,牛乳过敏患者混合血清与αS1-酪蛋白发生了特异性反应,说明患者血清中含有αS1-酪蛋白特异性IgE。牛乳过敏患者混合血清与大豆中的β-伴大豆球蛋白α亚基(Gly m Bd 60K)和11S碱性链发生了免疫反应。为排除假阳性反应,用小鼠阴性血清进行了免疫印迹实验,如图1C所示,阴性小鼠血清与αS1-酪蛋白、α-酪蛋白没有发生反应,与大豆分离蛋白反应了一个条带,分子质量为21 kDa的11S碱性链,说明11S碱性链为非特异性吸附。即牛乳过敏患者血清识别大豆蛋白的交叉过敏原为β-伴大豆球蛋白α亚基(Gly m Bd 60K)。
经鉴定αS1-酪蛋白单克隆抗体的亚型为IgG1,效价为1∶320 000。将凝胶上的蛋白条带成功转印到PVDF膜上后,然后通过免疫印迹实验鉴定抗体与大豆蛋白的交叉反应特性,结果见图2A,αS1-酪蛋白、α-酪蛋白、大豆分离蛋白与αS1-酪蛋白抗体均发生了免疫反应,与大豆分离蛋白反应结果显示出2 个条带,测定其分子质量分别为68、21 kDa,即为β-伴大豆球蛋白α亚基(Gly m Bd 60K)和11S碱性链。为排除假阳性反应,用小鼠阴性血清进行了免疫印迹抑制实验,如图2B所示,小鼠阴性血清与αS1-酪蛋白、α-酪蛋白没有发生反应,与大豆分离蛋白反应了1 个条带,分子质量为21 kDa,即为大豆11S碱性链。因此大豆β-伴大豆球蛋白α亚基与αS1-酪蛋白抗体发生了特异性免疫反应,为交叉过敏原。

图2αS1-酪蛋白单克隆抗体识别大豆分离蛋白的免疫印迹图
Fig. 2 Immunoblotting of soybean protein isolate identi fi ed by αS1-casein monoclonal antibodies
αS1-酪蛋白在GenBank的登录号为AAA30429.1,Gly m Bd 60K的登录号为BAA23360.2,应用DNAStar软件导出各蛋白的氨基酸序列。用BLASTp工具分析两种蛋白质的序列相似性为39%,两种蛋白的相似氨基酸序列如表1所示。
表1αS1-酪蛋白与Gly m Bd 60K的相似氨基酸序列
Table 1 Similar amino acid sequences betweenαS1-casein and Gly m Bd 60K

过敏原 第1组相似序列 第2组相似序列αS1-酪蛋白 K49EKVNELSKDIGSESTEDQAMED71 Q112LLRLKKYKVPQLEIVPNS130 Gly m Bd 60K K319EQIRALSKRAKSSSRKTISSED341 Q164LQNLRDYRILEFNSKPNT182

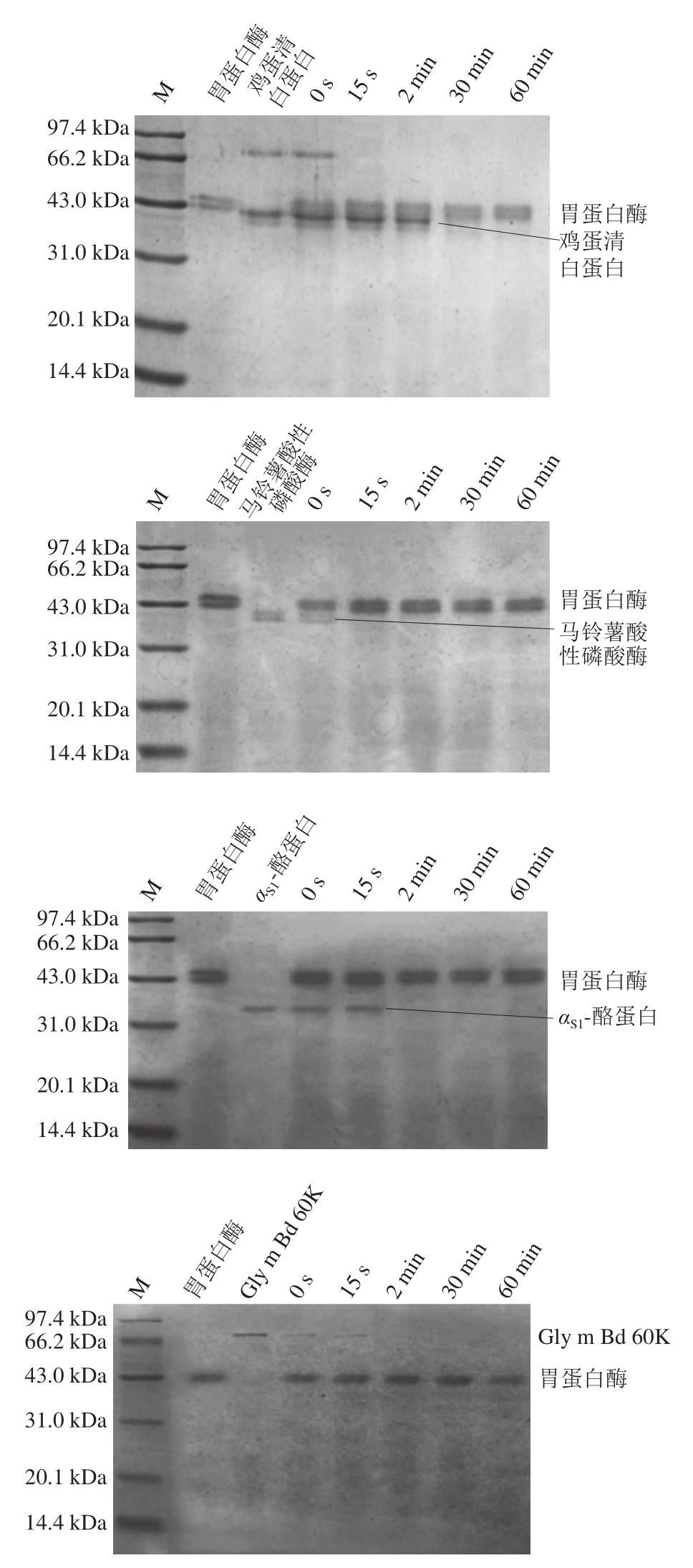
图3 过敏原在体外模拟胃液中消化性后的SDS-PAGE图
Fig. 3 SDS-PAGE profile of allergens digested in simulated gastric fluid
本实验以鸡蛋清白蛋白、大豆胰蛋白酶抑制剂为阳性对照,以马铃薯酸性磷酸酶为阴性对照,通过比较这5 种蛋白在体外模拟胃消化系统中的稳定性,探究交叉过敏原Gly m Bd 60K(β-伴大豆球蛋白的α亚基)的稳定性。如图3所示,大豆胰蛋白酶抑制剂到60 min仍未被胃蛋白酶消化,推测其具有很强的抗消化性;鸡蛋清白蛋白在30 min时条带完全消化;αS1-酪蛋白在2 min时条带完全消化;马铃薯酸性磷酸酶经过胃蛋白酶消化15 s时条带消失。交叉过敏原Gly m Bd 60K在15 s条带颜色虽然变浅,但仍清晰可见,2 min时条带消失,推测Gly m Bd 60K在模拟胃液中的消化时间为2 min。根据SDS-PAGE结果,消化稳定性由强到弱为大豆胰蛋白酶抑制剂>鸡蛋清白蛋白>αS1-酪蛋白= Gly m Bd 60K>马铃薯酸性磷酸酶,大豆交叉过敏原Gly m Bd 60K的消化稳定性比较好。

图4 70、100 ℃加热Gly m Bd 60K免疫印迹鉴定图
Fig. 4 Immunoblotting pattern of Gly m Bd 60K heated at 70 or 100 ℃
从图4可以看出,在70、100 ℃加热不同时间,Gly m Bd 60K与αS1-酪蛋白单克隆抗体发生了特异性免疫反应,阴性血清结果有效排除了假阳性反应,即加热没有影响Gly m Bd 60K与αS1-酪蛋白抗体的交叉反应性。
食物交叉过敏一般发生在同源性比较高或者是具有相似线性表位或构象表位的过敏蛋白之间,有研究表明构象表位在交叉过敏反应中贡献不大[20]。目前公认的预测交叉过敏反应标准为:在超过80 个氨基酸残基的过敏蛋白质中,其序列的同源性大于30%或者具有6 个连续相似的氨基酸序列,则认为有可能产生交叉过敏反应[21],但是预测的结果往往会出现假阳性,如果同源性大于35%,假阳性减少4%[22]。因此,过敏原之间序列的同源性的比较只作为一种预测交叉过敏的方法,体外实验检测以及临床的诊断才是确认过敏原是否存在交叉过敏的有效方法。本研究通过生物信息学工具和软件预测αS1-酪蛋白和Gly m Bd 60K蛋白序列相似性为39%,并找到两组相似氨基酸序列,两种蛋白可能会发生交叉过敏反应。
牛乳过敏发生率呈上升趋势,3 岁以内儿童牛乳过敏发生率超过8%[23],由于乳蛋白之间的抗原表位存在显著的同源性,目前已有研究表明,许多其他哺乳动物乳蛋白与牛乳蛋白存在较强的交叉反应。例如,在Restani等[24]的研究中,牛乳过敏患者血清的IgE能够识别水牛和羊的乳品蛋白,交叉过敏原主要是α-酪蛋白和β-乳球蛋白,而且在抗体血清IgE识别中,50%的羊乳与牛乳具有相同的亲和力,而抗体血清对骆驼乳或人乳的蛋白质没有免疫反应。大约50%的牛乳过敏患者对αS1-酪蛋白过敏[25]。根据国际免疫联合会对过敏原的统一命名,αS1-酪蛋白命名为Bos d 9,分子质量为25.2 kDa,为1 条单链的磷酸化蛋白质,由199 个氨基酸构成,脯氨酸含量较高,包括大约70%的无规则结构和小部分的二级结构,二级结构主要是α-螺旋和β-折叠,没有二硫键,三级结构比较简单[26]。对于牛乳过敏症的治疗方法主要是避免饮食中的牛乳蛋白质,为此对于牛乳过敏婴幼儿,基于大豆蛋白的配方粉是最理想的替代品。大豆基婴幼儿配方粉在全球的使用已有100 a左右,在美国、加拿大、中国等国占有一定的婴幼儿配方食品市场。然而,一些牛乳过敏婴幼儿也对大豆蛋白过敏[27]。因此开展牛乳蛋白与大豆蛋白交叉过敏原的研究具有重要的现实意义。
近几年国内外开始探究牛乳与大豆蛋白的交叉过敏原。Curciarello等[28]研究发现牛乳酪蛋白与大豆蛋白的交叉过敏原为Gly m 5,识别的IgE和IgG作用表位存在于α亚基,并且包括构象表位。进而,还发现大豆P34与牛乳酪蛋白也具有序列相似的作用表位[29]。Candreva等[30]用牛乳过敏患者血清识别到大豆交叉过敏原蛋白Gly m Bd 28K,其能够引起人外周血嗜碱性粒细胞脱颗粒,诱发免疫小鼠IL-13分泌。Candreva等[31]通过酶解的方法获得αS1-酪蛋白和Gly m 5的多肽,发现识别的αS1-酪蛋白的4 个作用表位与Gly m 5的3 个作用表位存在共同的序列区域。在此基础上,本研究以中国牛乳过敏婴幼儿血清为探针,通过免疫印迹方法识别鉴定大豆蛋白的交叉过敏原为β-伴大豆球蛋白α亚基,即Gly m Bd 60K蛋白,体外模拟胃液消化实验表明α亚基具有较强的抗消化性,热处理不会影响牛乳αS1-酪蛋白单克隆抗体与α亚基的免疫反应特性。
临床对过敏患者治疗时,要充分考虑食物之间的交叉反应性,既要找到可能造成高过敏风险的食物,还要避免不必要的食物限制。事实上,对于一些食物,即使体外检测呈阳性的交叉敏感性,但真正的交叉反应性识别并没发生,在研究中对这两个名词存在一些混淆,交叉反应性是用于定义真正的临床反应[32]。例如,腰果过敏患者对开心果具有交叉敏感性,大多数花生过敏患者可能对其他豆类会呈阳性反应,但可以毫无影响地食用。体内实验是验证食物过敏原具有交叉反应特性的最有效手段,这也是未来交叉过敏原研究的重点内容。目前,对于导致不同食物间交叉过敏的免疫病理学的详细机制尚不完全清楚,由于过敏原之间的交叉过敏受到越来越多的关注,对交叉过敏反应的机理研究也成为当务之急。
[1] KAZATSKY A M, WOOD R A. Classification of food allergens and cross-reactivity[J]. Current Allergy & Asthma Reports, 2016, 16(3):1-7. DOI:10.1007/s11882-016-0601-1.
[2] BEXLEY J, NUTTALL T J, HAMMERBERG B, et al.Co-sensitization and cross-reactivity between related and unrelated food allergens in dogs-a serological study[J]. Veterinary Dermatology,2017, 28: 31-37. DOI:10.1111/vde.12335.
[3] EISCHEID A C, STADIG S R. A group-specific, quantitative realtime PCR assay for detection of crab, a crustacean shellfish allergen,in complex food matrices[J]. Food Chemistry, 2018, 244: 224-231.DOI:10.1016/j.foodchem.2017.10.045.
[4] MARTORELL-ARAGONÉS A, ECHEVERRÍA-ZUDAIRE L,ALONSO-LEBRERO E, et al. Position document: IgE-mediated cow's milk allergy[J]. Allergol Immunopathol, 2015, 43(5): 507-526.DOI:10.1016/j.aller.2015.01.003.
[5] SHEK L P C, BARDINA L, CASTRO R, et al. Humoral and cellular responses to cow milk proteins in patients with milk-induced IgE-mediated and non-IgE-mediated disorders[J]. Allergy, 2005, 60: 912-919. DOI:10.1111/j.1398-9995.2005.00705.x.
[6] GAUDIN J C, RABESONA H, CHOISET Y, et al. Assessment of the immunoglobulin E-mediated immune response to milkspecific proteins in allergic patients using microarrays[J]. Clinical &Experimental Allergy, 2008, 38: 686-693. DOI:10.1111/j.1365-2222.2008.02952.x.
[7] TSAI J J, CHANG C Y, LIAO E C. Comparison of allergenicity at Gly m 4 and Gly m Bd 30K of soybean after genetic modification[J].Journal of Agricultural and Food Chemistry, 2017, 65(6): 1255-1262.DOI:10.1021/acs.jafc.6b05135.
[8] CONG Y J, YI H, QING Y T, et al. Identification of the critical amino acid residues of immunoglobulin E and immunoglobulin G epitopes on αS1-casein by alanine scanning analysis[J]. Journal of Dairy Science,2013, 96(11): 6870-6876. DOI:10.3168/jds.2012-5543.
[9] DOCENA G H, FERNANDEZ R, CHIRDO F G, et al. Identification of casein as the major allergenic and antigenic protein of cow's milk[J].Allergy, 1996, 51: 412-416. DOI:10.1111/j.1398-9995.1996.tb00151.
[10] HE S F, LI X, GAO J Y, et al. Development of sandwich ELISA for testing bovine β-lactoglobulin allergenic residues by specific polyclonal antibody against human IgE binding epitopes[J]. Food Chemistry, 2017, 227: 33-40. DOI:10.1016/j.foodchem.2017.01.060.
[11] LOU F, CONG Y J, IBRAHIM S A, et al. Allergenic and antigenic activity of cow milk substitutes by ELISA and basophil-activation assays[J]. Food and Agricultural Immunology, 2010, 21(2): 119-130.DOI:10.1080/09540100903443709.
[12] KALYANASUNDARAM A, SANTIAGO T C. Identification and characterization of new allergen troponin C (Pen m 6.0101) from Indian black tiger shrimp Penaeus monodon[J]. European Food Research and Technology, 2015, 240: 509-515. DOI:10.1007/s00217-014-2349-y.
[13] CONG Y J, LOU F, XUE W T, et al. Characterization of the IgE-binding immunodominant epitopes on Ara h1[J].Food and Agricultural Immunology, 2008, 19(3): 175-185.DOI:10.1080/09540100802172599.
[14] FOROUTAN M, GHAFFARIFAR F, SHARIFI Z, et al. Bioinformatics analysis of ROP8 protein to improve vaccine design against Toxoplasma gondii[J]. Infection, Genetics and Evolution, 2018, 62:193-204. DOI:10.1016/j.meegid.2018.04.033.
[15] LI J, WANG J, LI J. Improving allergen prediction in main crops using a weighted integrative method[J]. Interdisciplinary Sciences Computational Life Sciences, 2017, 9: 545-549. DOI:10.1007/s12539-016-0192-5.
[16] 李振兴, 林洪, 王晓斐, 等. 中国对虾过敏原基因特征的生物信息学分析[J]. 食品科学, 2009, 30(5): 175-178.
[17] 毛海燕, 蔡娜, 陈亨莉, 等. 拟穴青蟹新型过敏原肌质钙结合蛋白的纯化/鉴定及分子克隆[J]. 食品科学, 2014, 35(3): 122-127.DOI:10.7506/spkx1002-6630-201403025.
[18] 国家质量监督检验检疫总局, 国家标准化管理委员会. 蛋白酶制剂:GB/T 23527—2009[S]. 北京: 中国标准出版社, 2009.
[19] 中国国家标准化管理委员会. 模拟胃肠液外源蛋白质消化稳定性试验方法: 农业部869号公告-2-2007[S]. 北京: 中国标准出版社, 2007.
[20] CURIN M, GARMATIUK T, RESCH-MARAT Y, et al. Similar localization of conformational IgE epitopes on the house dust mite allergens Der p 5 and Der p 21 despite limited IgE-cross-reactivity[J].Allergy, 2018, 73(8): 1653-1661. DOI:10.1111/all.13398.
[21] GOODMAN R E. Practical and predictive bioinformatics methods for the identification of potentially cross-reactive protein matches[J].Molecular Nutrition & Food Research, 2006, 50(7): 655-660.DOI:10.1002/mnfr.200500277.
[22] MIRSKY H P, CRESSMAN R F, LADICS G S. Comparative assessment of multiple criteria for the in silico prediction of cross-reactivity of proteins to known allergens[J]. Regulatory Toxicology and Pharmacology, 2013, 67: 232-239. DOI:10.1016/j.yrtph.2013.08.001.
[23] VILLA C, COSTA J, OLIVEIRA M B P P, et al. Bovine milk allergens: a comprehensive review[J]. Comprehensive Reviews in Food Science and Food Safety, 2018, 17(1): 137-164. DOI:10.1111/1541-4337.12318.
[24] RESTANI P, GAIASCHI A, PLEBANI A, et al. Cross-reactivity between milk proteins from different animal species[J]. Clinical and Experimental Allergy, 1999, 29(7): 997-1004. DOI:10.1046/j.1365-2222.1999.00563.x.
[25] HOCHWALLNER H, SCHULMEISTER U, SWOBODA I, et al.Cow's milk allergy: from allergens to new forms of diagnosis,therapy and prevention[J]. Methods, 2014, 66: 22-33. DOI:10.1016/j.ymeth.2013.08.005.
[26] GOFF H D. The dairy science and technology[M]. Ontario: University of Guelph, 2016.
[27] AHN K M, HAN Y S, NAM S Y, et al. Prevalence of soy protein hypersensitivity in cow's milk protein-sensitive children in Korea[J]. Journal of Korean Medical Science, 2003, 18(4): 473-477.DOI:10.3346/jkms.2003.18.4.473.
[28] CURCIARELLO R, SMALDINI P L, CANDREVA A M, et al.Targeting a cross-reactive Gly m 5 soy peptide as responsible for hypersensitivity reactions in a milk allergy mouse model[J]. PLoS ONE, 2014, 9(1): 1-15. DOI:10.1371/journal.pone.0082341.
[29] CANDREVA A M, SMALDINI P L, CURCIARELLO R, et al. Crossreactivity between the soybean protein P34 and bovine caseins[J].Allergy Asthma & Immunology Research, 2015, 7(1): 60-68.DOI:10.4168/aair.2015.7.1.60.
[30] CANDREVA A M, SMALDINI P L, CURCIARELLO R, et al.The major soybean allergen Gly m Bd 28K induces hypersensitivity reactions in mice sensitized to cow's milk proteins[J]. Journal of Agricultural and Food Chemistry, 2016, 64: 1590-1599. DOI:10.1021/acs.jafc.5b05623.
[31] CANDREVA Á M, FERRER-NAVARRO M, BRONSOMS S, et al.Identification of cross-reactive B-cell epitopes between Bos d 9.0101 (Bos taurus) and Gly m 5.0101 (Glycine max) by epitope mapping MALDI-TOF MS[J]. Proteomics, 2017, 17(15/16): 1-11.DOI:10.1002/pmic.201700069.
[32] KAZATSKY A M, WOOD R A. Classification of food allergens and cross-reactivity[J]. Current Allergy and Asthma Reports, 2016, 16(3):1-7. DOI:10.1007/s11882-016-0601-1.
Identification and Characterization of Cross-Reactive Allergens between Cow Milk αS1-Casein and Soybean Proteins
CONG Yanjun, LÜ Xiaozhe, LI Ye, et al. Identification and characterization of cross-reactive allergens between cow milk αS1-casein and soybean proteins[J]. Food Science, 2019, 40(18): 70-75. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20181224-272. http://www.spkx.net.cn