
图1 重组表达质粒pMD18-pelD的构建
Fig. 1 Schematic illustration of pMD18-pelD construction
果胶酶是指降解果胶质的一类酶的总称,根据其作用机理可分为3 大类:聚半乳糖醛酸酶(E.C.3.2.1.2)、果胶甲酯酶(E.C.3.1.11.1)、果胶裂解酶(E.C.4.2.2.10)[1-3]。果胶裂解酶可直接作用于高度甲酯化果胶,不需要果胶甲酯酶的预先作用,从而避免了甲醇的生成[4]。酸性果胶裂解酶在果蔬汁加工行业中应用十分广泛,原因在于其最适反应pH值与大多数果汁天然pH值接近,都为酸性[5-6]。目前文献报道研究较多为最适反应pH值为碱性或中性的果胶裂解酶,其在酸性条件下极不稳定[7-10],而对酸性果胶裂解酶的研究主要集中在发酵过程优化和重组表达等方面[11-14],谢茂芳等[15]实现了黑曲霉果胶裂解酶在大肠杆菌的异源表达,由于形成包涵体未能检测到酸性果胶裂解酶活力;强慧妮等[16]将黑曲霉果胶裂解酶基因在毕氏酵母中进行表达,得到酸性果胶酶裂解酶活力仅为2.3 U/mL;此外,Kitamoto等[17]报道的酸性果胶裂解酶活力较高为4 060.0 U/mL。但总体说来,目前酸性果胶裂解酶表达水平不高,在较大程度上限制了其工业应用。
曲霉表达系统具有蛋白分泌量高、成本低、可进行蛋白翻译后修饰等优点,黑曲霉作为典型的丝状真菌,被广泛地用于重组蛋白的表达[18-20]。此外,黑曲霉作为Generally recognized as safe(GRAS)微生物被广泛用作食品行业酶制剂的生产菌株。本研究使用黑曲霉自身强启动子(PglaA)实现酸性果胶裂解酶基因pelD的过量表达,通过融合6×His标签实现重组果胶裂解酶的纯化,研究了重组果胶裂解酶的酶学性质,并测定了其对3 种不同果汁(橙汁、苹果汁和葡萄汁)的澄清效果,以期为酸性果胶裂解酶的工业化应用提供支持。
1.1.1 菌株与质粒
大肠杆菌Match 1T1感受态购自美国Invitrogen公司,黑曲霉(Aspergillus niger)菌株SH-2[21]、表达载体pMD18-TP均由本实验室构建并保藏。
1.1.2 试剂
聚半乳糖醛酸钠盐、苹果果胶(50%~75%酯化度)、柑橘果胶(≥85%酯化度) 美国Sigma-Aldrich公司;限制性内切酶、DNA聚合酶 日本TaKaRa公司;其他试剂均为分析纯。
1.1.3 培养基
酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose,YPD)培养基:2%葡萄糖,1%蛋白胨,1%酵母膏;察氏培养基(Czapek-Dox,CD)培养基:2%葡萄糖,0.3% NaNO3,0.2% KCl,0.05%MgSO4·7H2O,0.1% KH2PO4,0.001% FeSO4·7H2O,2%琼脂粉,pH 5.5;发酵培养基:5%玉米淀粉,3%玉米浆,2%豆粕粉。
多功能酶标仪 美国Thermo Fisher Scientific公司。
1.3.1 重组表达质粒的构建
以黑曲霉C B S 5 1 3.8 8 基因组为模板,使用特异性引物使用特异性引物(p 1:5’-ATGAAGTACGCTGCTGGCTCTC-3’;p2:5’-tagcg aaatggattgattgtTTAGTGATGATGATGATGATGCAGGT TACCCTGACAGCG-3’)扩增得到果胶裂解酶基因pelD(GenBank:M55657.1)。将目的基因pelD连接到表达载体pMD18-TP,得到重组表达质粒pMD18-pelD,并转化大肠杆菌。阳性转化子经抗性筛选及Apa I酶切验证,并经测序验证。
1.3.2 黑曲霉转化及发酵培养
将宿主菌黑曲霉SH-2接种至YPD培养基,30 ℃、250 r/min培养72 h。利用Apa I酶切线性化重组表达质粒pMD18-pelD,采用原生质体转化法将其转化宿主菌[22]。转化子在CD培养基上培养72 h,温度30 ℃。提取基因组进行聚合酶链式反应(polymerase chain reaction,PCR)鉴定及测序,将阳性转化子接种于装有100 mL发酵培养基的250 mL三角瓶中,30 ℃、250 r/min培养144 h,每隔24 h取样,测定酶活力。
1.3.3 酸性果胶裂解酶活力测定
参照Albersheim[23]方法进行并作适当调整。用浓度为1/15 mol/L KH2PO4-Na2HPO4 (pH 5.2)缓冲液配制0.5 g/100 mL苹果果胶。取500 μL底物预热至40 ℃,加入250 μL适当稀释的粗酶液,40 ℃反应10 min(pH 5.2),加入800 μL 0.02 mol/L H3PO4溶液终止反应,235 nm波长处测定其吸光度。1 个标准酶活力单位定义为:在测定条件下,每分钟使235 nm波长处吸光度增加0.01所需的酶量。
1.3.4 重组酸性果胶裂解酶纯化
由于重组酸性果胶裂解酶带有6×His标签,故采用镍柱亲和层析纯化重组蛋白,重组菌株经摇瓶培养144 h后,收集上清液用于纯化。使用的层析柱为HisTrapTM HP,上样量为30 mL,采用梯度洗脱法(咪唑浓度0~0.5 mol/L),流速2.0 mL/min。对收集到纯化样品进行酶活力测定,采用BCA蛋白浓度测定方法测定蛋白含量,以牛血清白蛋白作为标准蛋白。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)检测纯化效果并进行Western blot鉴定。
1.3.5 Western blot鉴定表达产物
对纯化后重组蛋白进行SDS-PAGE分析。SDS-PAGE结束后,将凝胶中的蛋白电转印迹至硝酸纤维素膜上,封闭液室温封闭1 h;Western杂交膜清洗液洗3 次,每次5 min;用His-Tag抗体作为一抗(稀释比例为1∶1 000)室温孵育2 h;Western杂交膜清洗液洗3 次,用辣根过氧化物酶标记的山羊抗鼠IgG作为二抗(稀释比例为1∶1 000)室温孵育1 h;Western杂交膜清洗液洗3 次后,用超敏ECL化学发光试剂盒检测免疫反应条带。
1.3.6 重组酸性果胶裂解酶酶学特性分析
为研究重组酶的底物特异性,在标准条件下,分别测定其对3 种不同酯化程度底物(聚半乳糖醛酸钠盐(酯化度为0%)、苹果果胶(酯化度50%~75%)、柑橘果胶(酯化度≥85%))的酶活力,其中底物质量浓度均为0.5 g/100 mL。
最适温度和pH值测定:在pH 5.2条件下,测定不同温度(20、30、40、50、60、70、80 ℃)条件下的酶活力;在测得的最适反应温度条件下,测定不同pH值(3.0~8.0)条件下的酶活力,其中底物用相应pH值的缓冲液溶解;以最大活力为100%。
温度和pH值稳定性测定:将酶液于不同温度(30~70 ℃)处理2 h,在标准条件下测定剩余酶活力,以未经处理组的酶活力为100%;将酶液置于不同pH值(3.0~7.0)磷酸盐-柠檬酸缓冲液中,40 ℃处理2 h后测定剩余酶活力;以未经处理组的酶活力为100%。
金属离子及表面活性剂SDS对酸性果胶裂解酶活力的影响:在标准测定体系中分别加入不同金属离子及表面活性剂SDS使其终浓度为1 mmol/L,测定酶活力,以未经处理组的酶活力为100%。
1.3.7 重组酸性果胶裂解酶在果汁澄清中的应用
将橙子(新奇士)、苹果(富士)和葡萄(巨峰)用榨汁机制成果汁,苹果汁需加0.2 g/100 mL抗坏血酸,3 种果汁的pH值分别为:橙汁3.76、苹果汁4.0、葡萄汁4.03。将不同量的重组酸性果胶裂解酶(0、1、2、5、10、25、50 U)分别加入至1 mL果汁中,37 ℃保温45 min后,2 000×g离心3 min,取上清测定在660 nm波长处的透光度(%),以灭活的酶液作为对照组。
以黑曲霉CBS513.88菌株基因组DNA为模板,PCR扩增得到酸性果胶裂解酶基因(pelD)序列。酸性果胶裂解酶基因pelD全长为1 369 bp,编码373 个氨基酸,经SignalP4.1在线预测分析,表明该蛋白具有N-端信号肽,信号肽切割位点在第19~20个氨基酸之间。

图1 重组表达质粒pMD18-pelD的构建
Fig. 1 Schematic illustration of pMD18-pelD construction

图2 重组菌发酵上清液酶活力测定(A)及SDS-PAGE分析(B)
Fig. 2 Enzymatic activity (A) and SDS-PAGE analysis (B) of the culture supernatant of the recombinant strain at different culture times
将pelD基因用infusion酶连接到表达载体,获得重组表达质粒pMD18-pelD,重组表达质粒示意图如图1所示,使用黑曲霉自身强启动子(葡萄糖淀粉酶启动子PglaA)实现酸性果胶裂解酶基因pelD的过量表达。将重组表达质粒pMD18-pelD转化宿主黑曲霉SH-2,获得重组工程菌SH2-PelD。将重组工程菌SH2-PelD接种至发酵培养基进行摇瓶发酵,每24 h离心取上清液测定酸性果胶裂解酶活力,结果如图2A所示。酸性果胶裂解酶活力随培养时间的延长而增加,在120 h时达到最高(8 822.6 U/mL)。同时,作为阴性对照的宿主菌未检测到酸性果胶裂解酶活力。此外,对发酵上清液进行SDS-PAGE检测(图2B),结果表明在大约40 kDa的位置出现一条明显的电泳条带,与预测的理论分子质量大小(39.0 kDa)一致,说明重组酸性果胶裂解酶在黑曲霉SH-2中成功实现了过量表达。

图3 纯化后重组酸性果胶裂解酶的SDS-PAGE分析(A)及Western blot鉴定(B)
Fig. 3 SDS-PAGE analysis (A) and Western blot (B) of purified rePelD
为更好地研究重组酸性果胶裂解酶的性质,对带有组氨酸标签的重组蛋白进行镍柱亲和层析纯化。经一步纯化后得到了单一条带(图3A)。经镍柱一步纯化后,重组酸性果胶裂解酶纯化倍数为4.9 倍,回收率为79.4%,比活力达到8 522.7 U/mg(表1)。此外,通过Western blot进一步验证了重组蛋白(图3B)。
表1 纯化发酵液上清中的重组酸性果胶裂解酶
Table 1 Purification of rePelD from the culture supernatant

活力/U总蛋白/mg比活力/(U/mg)回收率/%纯化倍数粗酶液 550 818.5 319.0 1 726.7 100.0 1.0镍柱亲和层析 437 472.0 51.3 8 522.7 79.4 4.9纯化步骤 总酶
2.4.1 重组酸性果胶裂解酶的底物特异性
分别以0.5 g/100 mL聚半乳糖醛酸钠盐(酯化度为0%)、苹果果胶(酯化度50%~75%)、柑橘果胶(酯化度≥85%)为底物,测定重组酶活力,以底物为柑橘果胶的酶活力为100%,计算其他底物的相对酶活力。如表2所示,重组酸性果胶裂解酶对柑橘果胶的酶活力最高为31 248.0 U/mL,其次为苹果果胶(11 164.1 U/mL),而对聚半乳糖醛酸钠盐仅有微弱的酶活力。表明重组酸性果胶裂解酶能够特异性降解高酯化程度的果胶。
表2 重组酸性果胶裂解酶的底物特异性
Table 2 Substrate specificity of rePelD

底物 酶活力/(U/mL) 相对酶活力/%聚半乳糖醛酸钠盐 213.1±14.1 0.7±0.1苹果果胶 11 164.1±279.5 35.7±0.9柑橘果胶 31 248.0±244.5 100.0±0.4
2.4.2 最适反应pH值及pH值稳定性
将重组酸性果胶裂解酶置于不同pH值(3.0~7.0)缓冲液中测定酶活力,结果表明该重组酶最适反应pH值为5.0,当pH值大于7时,酶活力基本为0(图4A)。将重组酸性果胶裂解酶置于不同pH值(3.0~7.0)缓冲液中,40 ℃保温2 h后测定残余酶活力,结果表明该重组酶在酸性条件下稳定性良好,在pH 3.0~6.5范围内能保持50%以上的相对酶活力(图4B)。
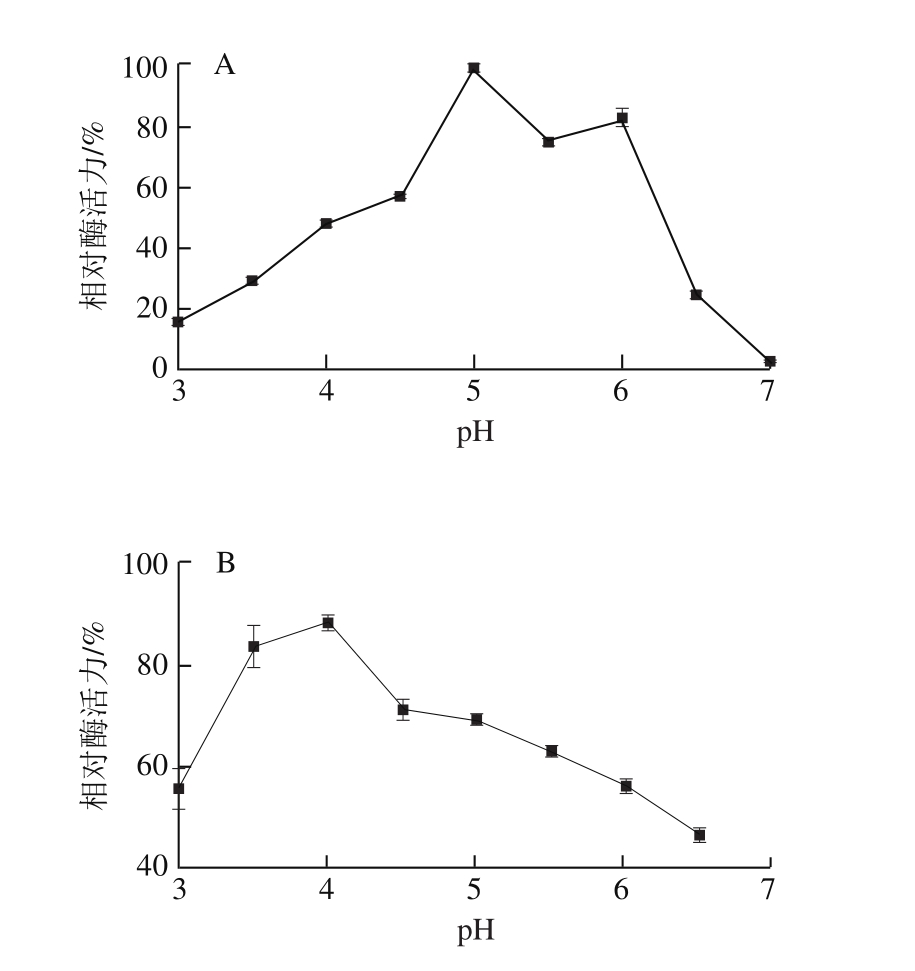
图4 重组酸性果胶裂解酶最适反应pH值(A)和pH值稳定性(B)
Fig. 4 Effect of pH on the activity (A) and stability (B) of rePelD
2.4.3 最适反应温度及热稳定性
将重组酶置于不同温度(20~80 ℃)下测定酶活力,结果表明该重组酶的最适反应温度为50 ℃(图5A)。将重组酸性果胶裂解酶置于不同温度(30~70 ℃)保温2 h后测定残余酶活力,结果表明该重组酶在30~50 ℃范围内稳定性较好,能保持80%以上的相对酶活力(图5B)。
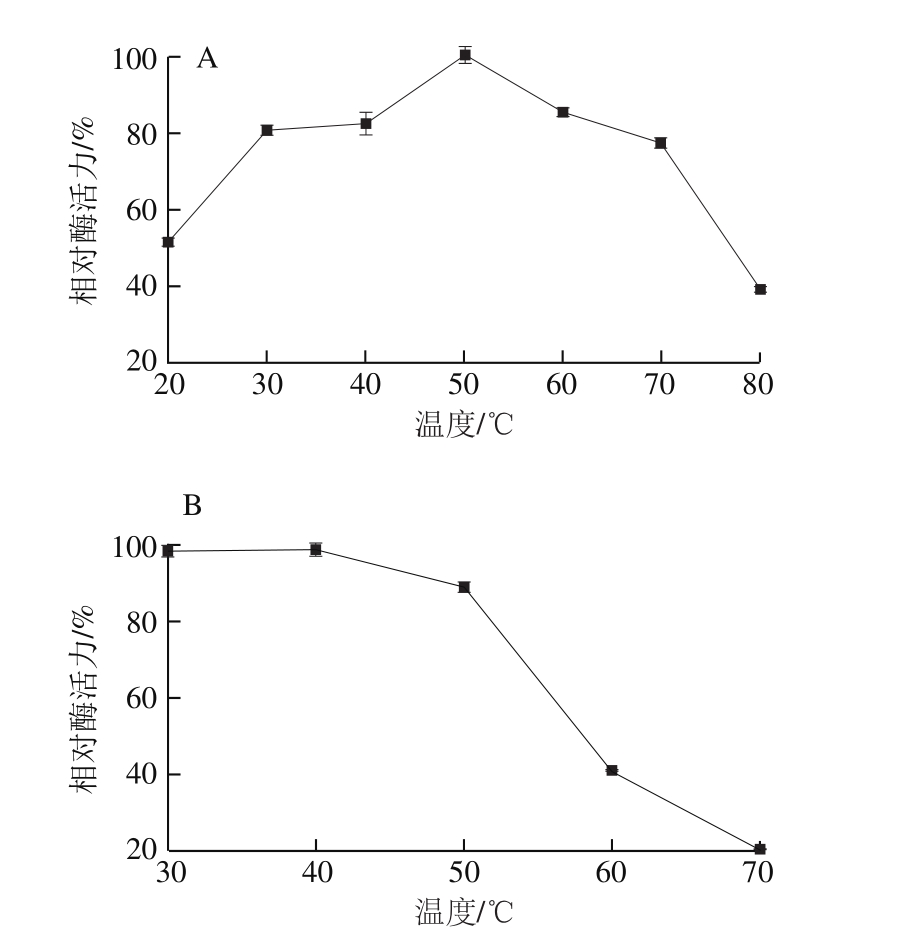
图5 重组酸性果胶裂解酶最适反应温度(A)和热稳定性(B)
Fig. 5 Effect of temperature on the activity (A) and stability (B) of rePelD
2.4.4 金属离子及化学试剂对重组酶的影响
表3 金属离子和化学试剂对重组酸性果胶裂解酶活力的影响
Table 3 Effects of metal ions and chemical reagents on the activity of rePelD
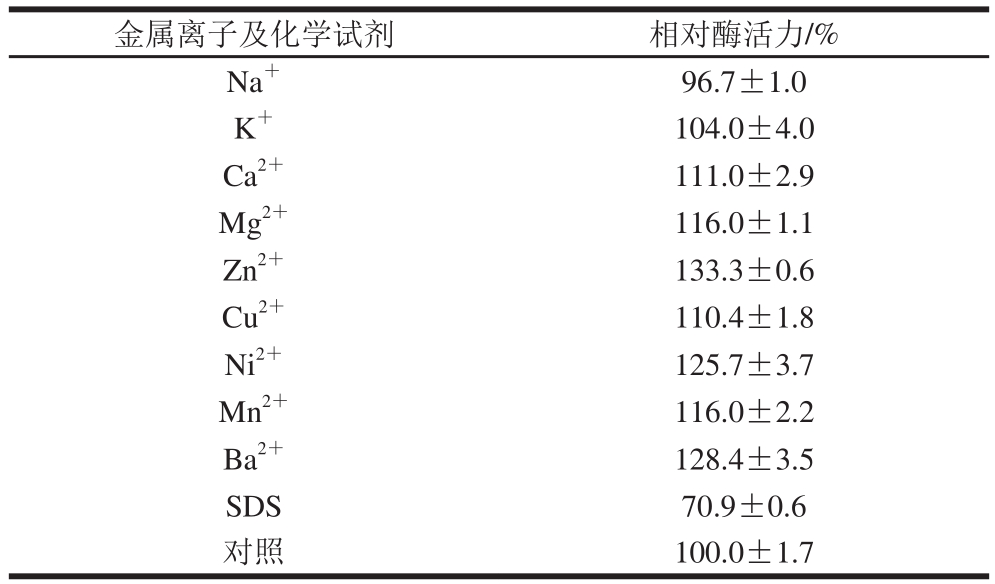
金属离子及化学试剂 相对酶活力/%Na+ 96.7±1.0 K+ 104.0±4.0 Ca2+ 111.0±2.9 Mg2+ 116.0±1.1 Zn2+ 133.3±0.6 Cu2+ 110.4±1.8 Ni2+ 125.7±3.7 Mn2+ 116.0±2.2 Ba2+ 128.4±3.5 SDS 70.9±0.6对照 100.0±1.7
表3表明,在1 mmol/L浓度下,Ca2+、Mg2+、Cu2+、Zn2+、Ni2+、Mn2+、Ba2+对该重组酶具有不同程度的激活作用,其中Zn2+、Ni2+、Ba2+激活作用较为显著;而表明活性剂SDS对重组酶有明显的抑制作用,其他金属离子对重组酶活力无明显影响。
图6表明,经重组酸性果胶裂解酶处理后,橙汁、苹果汁以及葡萄汁在660 nm波长处的透光度显著高于对照组,说明重组酸性果胶裂解酶对3 种果汁有显著的澄清效果。其中橙汁的透光度从1.7%增加到30.5%,提高了16.9 倍;而苹果汁的透光度从6.7%增加至77.0%,提高了10.5 倍;葡萄汁的透光度从13.9%增加至79.2%,提高了4.7 倍。此外,使橙汁、苹果汁以及葡萄汁达到较好的澄清效果的加酶量分别为10、5、1 U/mL。
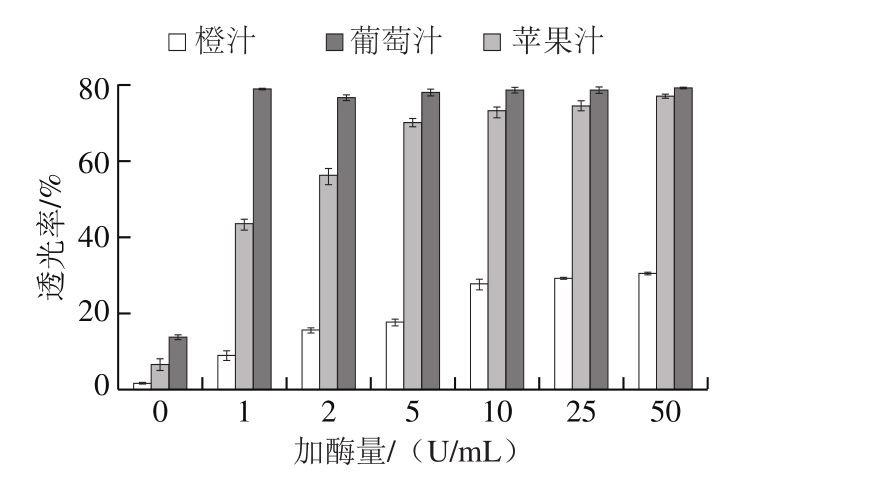
图6 重组酸性果胶裂解酶对3 种果汁(橙汁、苹果汁和葡萄汁)澄清应用
Fig. 6 Clarification of orange, apple and grape juice by using rePelD
黑曲霉作为重组蛋白表达的重要宿主,具有蛋白分泌量大、可进行蛋白翻译后修饰及高生物安全性等优点。本研究利用黑曲霉自身强启动子PglaA实现了黑曲霉酸性果胶裂解酶基因pelD的过量表达,使得酸性果胶裂解酶活力在摇瓶培养120 h达到8 822.6 U/mL,显著高于之前文献报道[16-17,24-25],为该重组酶的大规模工业化生产提供了理论支持。
此外,以黑曲霉为蛋白表达宿主在纯化方面存在一定的困难[26-27],本实验经一步亲和层析得到了高纯度目的蛋白,回收率为79.4%,比活力达到8 522.7 U/mg。对重组酶的底物特异性研究表明,重组酸性果胶裂解酶可特异性降解高度甲酯化果胶,这与已有报道一致[24,28]。该重组酶的最适反应温度为50 ℃,且在30~50 ℃范围内稳定性较好;与来源于米曲霉(最适反应pH 8.5)[29]和黄曲霉(最适反应pH 8.0)[30]果胶裂解酶相比,重组酸性果胶裂解酶的最适反应pH 5.0,接近大多数果汁的天然pH值,且在pH 3.0~6.5的范围内非常稳定;此外,重组酸性果胶裂解酶对橙汁、苹果汁和葡萄汁均表现出良好的澄清作用,且酶的添加量较少。综上所述,该重组酶在果蔬汁加工业中具有较大的应用潜力。
[1] KASHYAP D R, VOHRA P K, CHOPRA S, et al. Applications of pectinases in the commercial sector: a review[J]. Bioresource Technology, 2001, 77(3): 215-227. DOI:10.1016/S0960-8524(00)00118-8.
[2] 张媛媛, 郝林, 王倩, 等. 产聚半乳糖醛酸酶的黑曲霉诱变育种[J].食品科学, 2013, 34(7): 231-233.
[3] LATARULLO M B G, TAVARES E Q P, MALDONADO G P, et al.Pectins, endopolygalacturonases, and bioenergy[J]. Frontiers in Plant Science, 2016, 7: 1401. DOI:10.3389/fpls.2016.01401.
[4] LIMBERG G, BUCHHOLT H C, CHRISTENSEN T M I E, et al.Analysis of pectin structure part 1-analysis of different deesterification mechanisms for pectin by enzymatic fingerprinting using endopectin lyase and endopolygalacturonase II from A. niger[J].Carbohydrate Research, 2000, 327(3): 293-307. DOI:10.1016/S0008-6215(00)00067-7.
[5] SHARMA H P, PATEL H, SUGANDHA. Enzymatic added extraction and clarification of fruit juices: a review[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(6): 1215-1227. DOI:10.1080/1040839 8.2014.977434.
[6] BHARDWAJ V, DEGRASSI G, BHARDWAJ R K. Microbial pectinases and their applications in industries: a review[J].International Research Journal of Engineering and Technology, 2017,4: 829-836.
[7] HOONDAL G, TIWARI R, TEWARI R, et al. Microbial alkaline pectinases and their industrial applications: a review[J]. Applied Microbiology and Biotechnology, 2002, 59(4/5): 409-418.DOI:10.1007/s00253-002-1061-1.
[8] ZHOU C, XUE Y, MA Y. Cloning, evaluation, and high-level expression of a thermo-alkaline pectate lyase from alkaliphilic Bacillus clausii with potential in ramie degumming[J]. Applied Microbiology and Biotechnology, 2017, 101(9): 3663-3676. DOI:10.1007/s00253-017-8110-2.
[9] 李平, 景庆庆, 邵蔚蓝. 海栖热袍杆菌来源的极耐热碱性果胶裂解酶的表达、纯化及定性[J]. 生物工程学报, 2009, 25(2): 223-229.
[10] 刘晓肖, 郑学云, 梁书利, 等. 类芽孢杆菌碱性果胶裂解酶Pel在毕赤酵母中的高效表达[J]. 现代食品科技, 2015(11): 74-79.DOI:10.13982/j.mfst.1673-9078.2015.11.013.
[11] 张浩森. 几种因素对黑曲霉产果胶酶不同酶系的影响[J].食品工业科技, 2008, 29(1): 57-60. DOI:10.13386/j.issn1002-0306.2008.01.038.
[12] 张蕊, 陈慧洁, 章银军, 等. 黑曲霉果胶裂解酶和聚半乳糖醛酸酶合成的发酵调控[J]. 食品与发酵工业, 2008, 34(5): 43-47.DOI:10.13995/j.cnki.11-1802/ts.2008.05.008.
[13] 兰颖辉, 路福平. 果胶裂解酶液态发酵条件的研究[J]. 天津科技大学学报, 2 0 0 6, 2 1(2): 1 5-1 8. D O I:1 0.3 9 6 9/j.issn.1672-6510.2006.02.005.
[14] 宋立立, 顿宝庆, 张亚楠, 等. 果胶裂解酶基因与木聚糖酶基因的共表达[J]. 江苏农业科学, 2018, 46(17): 46-48. DOI:10.15889/j.issn.1002-1302.2018.17.011.
[15] 谢茂芳, 薛保国, 吴坤. 黑曲霉果胶裂解酶基因的克隆与原核表达[J]. 河南农业科学, 2013, 42(1): 82-85. DOI:10.15933/j.cnki.1004-3268.2013.01.002.
[16] 强慧妮, 杨欣伟, 田宝玉, 等. 黑曲霉果胶裂解酶基因在毕赤酵母Pichia pastoris GS115中的表达[J]. 生物工程学报, 2009, 25(12):1962-1968. DOI:10.13345/j.cjb.2009.12.024.
[17] KITAMOTO N, YOSHINOYASUDA S, OHMIYA K, et al.Sequence analysis and overexpression of a pectin lyase gene (pel1)from Aspergillus oryzae KBN616[J]. Bioscience, Biotechnology and Biochemistry, 2001, 65(1): 209-212. DOI:10.1271/bbb.65.209.
[18] MADHAVAN A, PANDEY A, SUKUMARAN R K. Expression system for heterologous protein expression in the fi lamentous fungus Aspergillus unguis[J]. Bioresource Technology, 2017, 245: 1334-1342.DOI:10.1016/j.biortech.2017.05.140.
[19] NEVALAINEN K M H, TÉO V S J, BERGQUIST P L, et al.Heterologous protein expression in filamentous fungi[J]. Trends in Biotechnology, 2005, 23(9): 468-474. DOI:10.1016/j.tibtech.2005.06.002.
[20] PUNT P J, ALBERS A, MANGNUS J, et al. Filamentous fungi as cell factories for heterologous protein production[J]. Trends in Biotechnology, 2002, 20: 200-206. DOI:10.1016/S0167-7799(02)01933-9.
[21] YIN C, WANG B, HE P, et al. Genomic analysis of the aconidial and high-performance protein producer, industrially relevant Aspergillus niger SH2 strain[J]. Gene, 2014, 541(2): 107-114. DOI:10.1016/j.gene.2014.03.011.
[22] VAN HARTINGSVELDT W, MATTERN I E, VAN ZEIJLL C M, et al. Development of a homologous transformation system for Aspergillus niger based on the pyrG gene[J]. Molecular and General Genetics MGG, 1987, 206(1): 71-75. DOI:10.1007/BF00326538.
[23] ALBERSHEIM P. Pectin lyase from fungi[J]. Methods in Enzymology, 1966, 8: 628-631. DOI:10.1016/0076-6879(66)08113-8.
[24] PEREZ-FUENTES C, RAVANAL M C, EYZAGUIRRE J.Heterologous expression of a Penicillium purpurogenum pectin lyase in Pichia pastoris and its characterization[J]. Fungal Biology, 2014,118(5/6): 507-515. DOI:10.1016/j.funbio.2014.04.002.
[25] KITAMOTO N, YOSHINO-YASUDA S, OHMIYA K, et al. A second pectin lyase gene (pel2) from Aspergillus oryzae KBN616: its sequence analysis and overexpression, and characterization of the gene products[J]. Journal of Bioscience and Bioengineering, 2001, 91(4):378-381. DOI:10.1016/S1389-1723(01)80155-9.
[26] MARTIAL-DIDIER A K, HUBERT K K. Partial purification and characterization of two pectinases (polygalacturonase and pectin lyase)from Papaya Pericarp (Carica papaya cv. solo 8)[J]. International Journal of Current Microbiology and Applied Sciences, 2017, 6: 2729-2739. DOI:10.20546/ijcmas.2017.606.326.
[27] 张帅, 曹庸, 梁晓莹, 等. 黑曲霉N5-5单宁酶的纯化及酶学性质测定[J]. 食品科学, 2017, 38(6): 142-146. DOI:10.7506/spkx1002-6630-201706022.
[28] PEDROLLI D B, CARMONA E C. Purification and characterization of a unique pectin lyase from Aspergillus giganteus able to release unsaturated monogalacturonate during pectin degradation[J]. Enzyme Research, 2014, 2014(3): 353915. DOI:10.1155/2014/353915.
[29] LIM J Y, FUJIO Y, UEDA S. Purification and characterization of pectinesterase and pectin lyase from Aspergillus oryzae A-3[J]. Journal of Applied Biochemistry, 1983, 5: 1-8.
[30] YADAV S, YADAV P K, YADAV D, et al. Purification and characterization of an alkaline pectin lyase from Aspergillus flavus[J]. Process Biochemistry, 2008, 43: 547-552. DOI:10.1016/j.procbio.2008.01.015.
High-Level Expression of Recombinant Acidic Pectin Lyase Gene from Aspergillus niger and Application of the Enzyme in Juice Clarification
HE Yulan, WANG Bin, PAN Li. High-level expression of recombinant acidic pectin lyase gene from Aspergillus niger and application of the enzyme in juice clarification[J]. Food Science, 2019, 40(18): 83-88. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20181005-024. http://www.spkx.net.cn