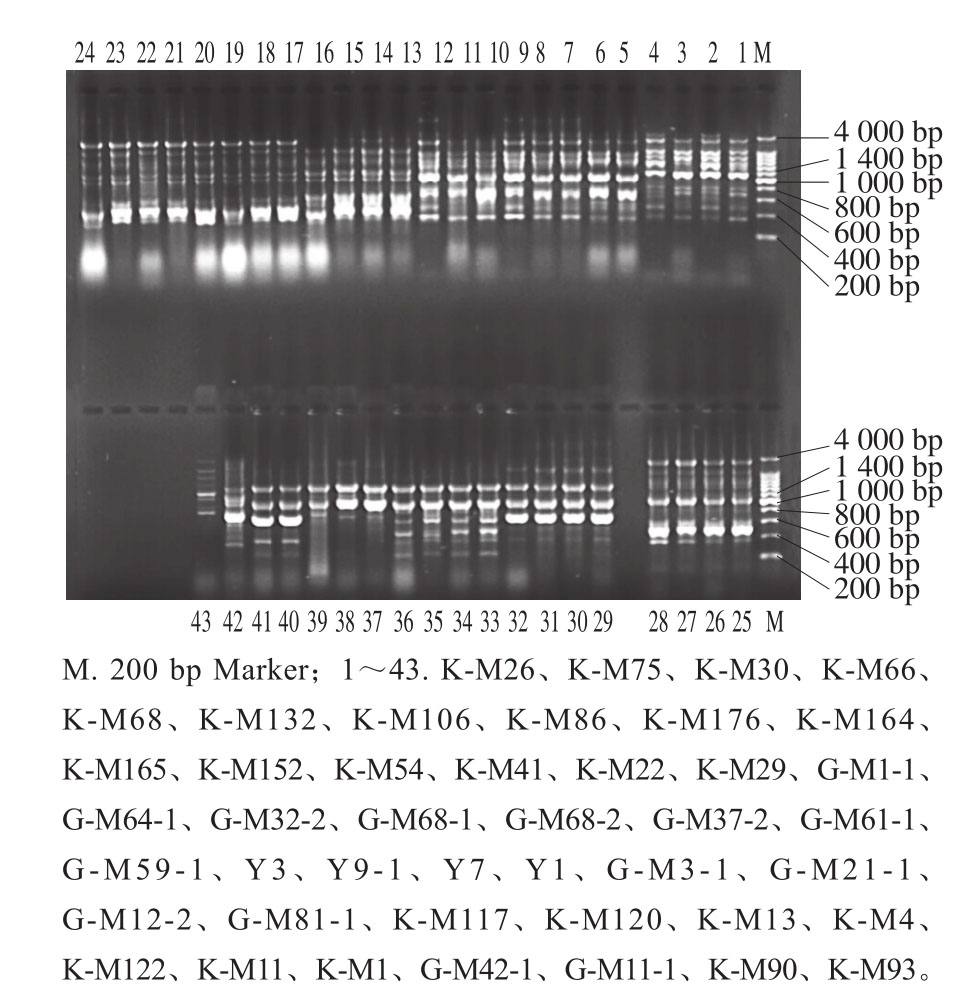
图1 代表菌株的rep-PCR指纹图谱
Fig. 1 rep-PCR fi ngerprint patterns of representative bacterial strains in 1% agarose
随着人们生活水平的提高和对健康食品需求的增加,乳及其制品在日常饮食中所占比例逐渐增大。尤其是发酵乳制品既富含营养物质,同时又提供了以乳酸菌为主的丰富益生菌,对于改善人体免疫力和提高全民身体素质发挥了至关重要的作用。乳酸菌是发酵碳水化合物产生大量乳酸的一类乳酸细菌,除能赋予乳制品细腻的口感、良好的风味、特殊的质地和更加全面的营养外,研究发现还具有一定的食疗作用[1]。乳杆菌是乳酸菌的主要类群,革兰氏阳性且无芽孢杆菌,细胞形态大多为链杆状或球杆状,耐酸性较强、厌氧或兼性厌氧。它不仅抑制病原菌的入侵和感染、增强机体免疫力、抗肿瘤作用,而且可以预防和抑制胃肠道肿瘤术后菌群失调和细菌移位的发生等作用[2]。研究发现,乳杆菌对抗生素引起的肠道菌群失衡也具有一定的调节作用[3]。
目前已发现的乳酸菌至少有23 个属[4],广泛存在于动物的肠道、泌尿生殖系统、口腔以及皮肤等[6] 。目前母乳中发现的细菌主要以乳杆菌(Lactobacillus)、葡萄球菌(Staphylococcus)、乳球菌(Lactococcus)和肠球菌(Enterorococcus)为主,已有描述的119 种乳杆菌中母乳占有25 种,如L. acidophilus、L. bulgari、L. dervis和L. fermentum等[5]。乳酸杆菌的益生特性早有文献报道[7],如Olivares等[8]证实了L. gasseri CECT5714不仅能增加病原菌感染实验小鼠的存活率,而且还具有抗感染的作用。
母乳是婴儿成长最自然、最安全的天然食物,它含有婴儿成长所需的所有营养物质和抗体,在提供给婴儿充分营养的同时也使其免疫系统得到最大保障。过去认为母乳中的微生物来源于外源环境污染[9],后来研究表明母乳本身就含有活性物质,其中,微生物是主要的活性成分,并作为益生菌发挥作用。而母乳中的益生菌作为首批进入到新生子代胃肠道的微生物,对婴儿肠道、免疫系统等有着深刻且长久的影响[10],越来越多的研究证实母乳喂养对于预防新生儿过敏、感染、营养不良等均具有显著作用[11-13],因此关于母乳微生物群落的相关研究也成为科学家关注的热点。李思奇等[14]研究发现母乳乳酸菌和发酵乳杆菌等能够定殖于婴儿肠道,通过促使婴儿肠道发育及免疫系统的成熟提高自身对病原菌的抵抗能力;且母乳中的细菌构成受泌乳时间的影响。因此,研究不同哺乳期母乳中益生乳杆菌的组成、变化规律和作用机理至关重要。研究发现无论是肠道菌群还是母乳菌群都与人类生活习惯、饮食习惯和地域性差异等均有密不可分的关系[15]。新疆以其异域风情和文化积累所形成的维吾尔族地域性、饮食文化和生活习惯等差异,加之维吾尔族妇女的分娩方式以顺产为主,这为母乳中乳杆菌的开发提供了独特丰富的样品来源[16]。本实验研究维吾尔族母乳中乳杆菌的种系组成及其变化,以确定不同哺乳期母乳中乳杆菌的分布规律和优势菌群及乳杆菌种群结构的复杂性,以期为母乳中益生菌资源的开发提供依据。
1.1.1 样品采集
45 个母乳样品来源于新疆喀什地区的健康妇女。其中,15 个样品来自伽师县人民医院均为初乳(0~5 d),其余30 个样品有15 个来自伽师县克勒鲁克乡,15 个来自伽师县克孜勒苏乡且均为成熟乳(10 d~19 个月)。母乳收集时,健康妈妈佩戴一次性无菌手套,用无菌生理盐水浸泡的纱布轻轻擦拭乳头及周围,随后小心手动挤出母乳,去掉第1滴,收集约4~5 mL的母乳于无菌离心管中,作好标记和记录,用封口膜将离心管口密封好并置于4 ℃保藏,12 h内运回实验室后储存于-20 ℃冰箱备用。
1.1.2 培养基
MRS培养基(改良版)购自北京博奥拓达科技有限公司,在MRS培养基[17]成分的基础上添加无菌膜过滤的0.05% L-半胱氨酸。
乳杆菌选择性培养基购自北京博奥拓达科技有限公司,胰酪蛋白胨10.0 g/L,酵母浸粉5.0 g/L,磷酸二氢钾6.0 g/L,柠檬酸铵2.0 g/L,乙酸钠25.0 g/L,硫酸镁0.575 g/L,硫酸锰0.12 g/L,亚硫酸铁0.034 g/L,吐温80 1.0 g/L,葡萄糖20.0 g/L,琼脂15.0 g/L,pH 5.5±0.2,25 ℃。
0.22 μm微孔滤膜 上海兴亚净化材料厂;聚合酶链式反应(polymerase chain reaction,PCR)扩增引物上海捷瑞生物有限公司;Marker 天根生化科技(北京)有限公司;PCR Master Mix、dd H2O 生工生物工程(上海)股份有限公司。
相差显微镜 上海光密仪器有限公司;厌氧箱(罐) 上海杰涵有限责任公司;HLR56495超高速控温离心机 美国Thermo公司;DK-8D水浴锅 金坛市医疗仪器厂;PHS-3D pH酸度计、PCR仪 上海精密科学有限公司;DOC XR凝胶成像仪 美国Bio-Rad公司。
1.3.1 菌株的分离及纯化
将配好的MRS(含半胱氨酸0.5 g/L)和乳杆菌选择性培养基灭菌后倒平板,凝固后将母乳样品用无菌水稀释,在10-3、10-4、10-5梯度的情况下各吸取100 μL于平板中涂布、编号并记录,于厌氧箱37 ℃倒置培养24~48 h。
每个样品选择适宜梯度的平板挑取色泽、大小、形状均不同的15~20 个单菌落观察细胞形态,将细胞形态呈杆状或短杆状的菌落划线厌氧培养,反复划线至同一平板中的菌落颜色、大小、形状均一致为止。纯菌种-20 ℃甘油保藏,长期保存应放置于-80 ℃冰箱中。
1.3.2 DNA的提取
采用十六烷基三乙基溴化铵(cetyltriethylammnonium bromide,CTAB)法对所纯化的菌株进行DNA的提取[18],并进行核酸含量的测定,根据核酸质量浓度的不同可将其分为小于20 ng/μL、20~100 ng/μL和大于1 0 0 n g/μ L三类,在进行多重聚合酶链式反应(repetitive polymerase chain reaction,rep-PCR)时按照需要取不同量达到相似质量(约50 ng)实现粗略的量化,使得构建的指纹图谱带型为同一亮度。并保存于-20 ℃冰箱待用。
1.3.3 rep-PCR指纹图谱分析
以BOXAIR(5’-CTACGGCAAGGCGACGCTGAC-3’)为引物进行rep-PCR[19],扩增体系为25 μL:2×EsTaq Master Mix 12.5 μL,BOX(0.12 μmol/μL)0.5 μL,双蒸水9.5 μL,模板DNA 3 μL。扩增程序:95 ℃预变性5 min,94 ℃变性1 min,52 ℃退火1 min,65 ℃延伸16 min(35 个循环),65 ℃终延伸16 min。PCR产物于1%~1.2%的琼脂糖凝胶100 V(2.5 V/cm)电泳分析约40 min后通过DOC XR凝胶成像仪上采集照片并记录,去重后得到带型完全不同的代表菌株进行测序。
1.3.4 16S rRNA基因测序及系统发育树的构建
利用27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-TACGGTTACCTTGTTACGACTT-3’)引物对代表菌株进行16S rRNA基因扩增[20]。PCR体系为25 μL:2×EsTaq Master Mix 12.5 μL,10 μmol/L的27F 0.5 μL,10 μmol/L的1492R 0.5 μL,双蒸水10.5 μL,模板DNA 1.5 μL。扩增程序为:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火40 s,72 ℃延伸1 min(35 次循环),72 ℃终延伸10 min。将3 μL PCR产物点样于1%凝胶电泳检测后将剩余的PCR产物作为样品送至生工生物工程(上海)股份有限公司进行测序。对所测的16S rRNA基因序列进行BLAST数据库比对,找出与所测序列相似度最高(97%~100%)的BLAST库的亲缘标准菌株,分析样品中微生物种群的结构及组成后利用Mega Align进行发育树的构建。
1.4.1 系统发育树的构建
将比对后的BLAST库中亲缘标准菌株序列与测序菌株序列保存于同一txt文本文件中,导入MEGA Align 5.0进行发育树的构建。
1.4.2 相对丰度图
将母乳样品按照分娩后的时间分为0~5 d(A阶段)、5 d~5 个月(B阶段)、5~10 个月(C阶段)、10~15 个月(D阶段)和15~19 个月(E阶段)5 个阶段,将数据导入Excel并作百分比堆积柱状图,以观察各阶段乳杆菌种群的相对丰度。
1.4.3 热图及韦恩图
使用R 3.5.1,载入p h e a t m a p包,使用colorRampPalette()函数定义渐变颜色向量,绘制热图;使用R 3.5.1载入VennDiagram包绘制韦恩图。
1.4.4 主成分分析(principal component analysis,PCA)
细菌和古菌群落结构的总体变异性用PCA检验,其优势在于通过计算PCA模式与环境约束的对应分析排序得分之间的Procrustes平方和,以及在R中严格执行的Procrustes函数,检验约束模型的拟合优度。从而利用分析调查的结果推断不同微生物群落结构的深度和环境变量的相关性。通过使用ggplot2包,它提供了两个功能:ggscreeplotv和ggbiplot。
指纹图谱如图1所示,以Marker为参照,连续泳道的相同带型为一种基因型,以不同基因型的菌株作为代表菌株进行测序。BLAST比对的亲缘标准菌株和细胞形态如表1所示,在97%的相似水平上确定可操作分类单元(operational taxonomic unit,OTU)数量并归类,共聚为11 个OTU。发育树如图2所示,测序菌株隶属于Lactobacillus、Enterococcus和Streptococcus三个属。其中Lactobacillus有5 个种,K-M66、K-M68、K-M86、K-M75、K-M132和K-M152隶属于L. brevis,G-M37-2和G-M1-1隶属L. fermentum,K-M4隶属L. oris,K-M93隶属L. vaginalis,K-M90隶属L. gasseri。

图1 代表菌株的rep-PCR指纹图谱
Fig. 1 rep-PCR fi ngerprint patterns of representative bacterial strains in 1% agarose
表1 NCBI BLAST比对结果
Table 1 Results of alignment based on NCBI BLAST
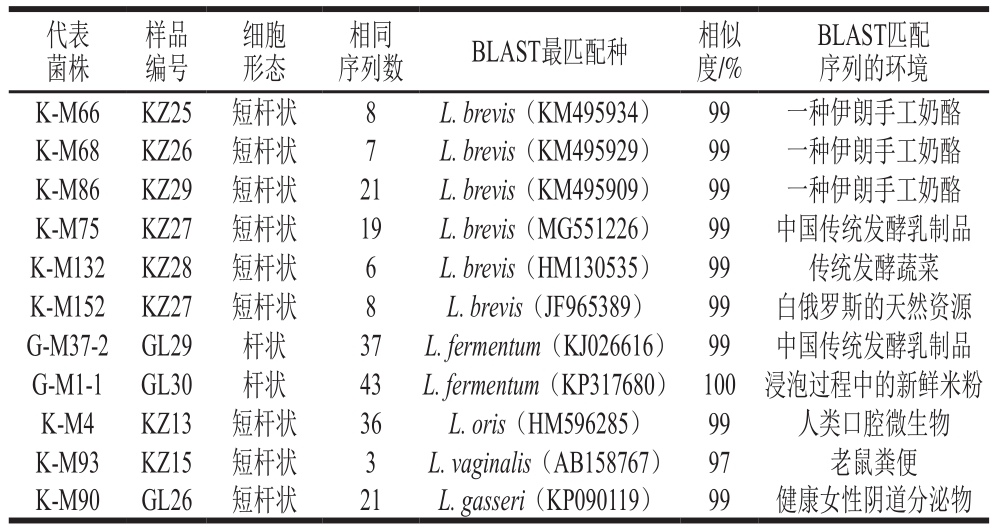
样品编号代表菌株细胞形态 序列数 BLAST最匹配种 相似度/%BLAST匹配序列的环境K-M66 KZ25 短杆状 8 L. brevis(KM495934) 99 一种伊朗手工奶酪K-M68 KZ26 短杆状 7 L. brevis(KM495929) 99 一种伊朗手工奶酪K-M86 KZ29 短杆状 21 L. brevis(KM495909) 99 一种伊朗手工奶酪K-M75 KZ27 短杆状 19 L. brevis(MG551226) 99 中国传统发酵乳制品K-M132 KZ28 短杆状 6 L. brevis(HM130535) 99 传统发酵蔬菜K-M152 KZ27 短杆状 8 L. brevis(JF965389) 99 白俄罗斯的天然资源G-M37-2 GL29 杆状 37 L. fermentum(KJ026616) 99 中国传统发酵乳制品G-M1-1 GL30 杆状 43 L. fermentum(KP317680) 100 浸泡过程中的新鲜米粉K-M4 KZ13 短杆状 36 L. oris(HM596285) 99 人类口腔微生物K-M93 KZ15 短杆状 3 L. vaginalis(AB158767) 97 老鼠粪便K-M90 GL26 短杆状 21 L. gasseri(KP090119) 99 健康女性阴道分泌物相同
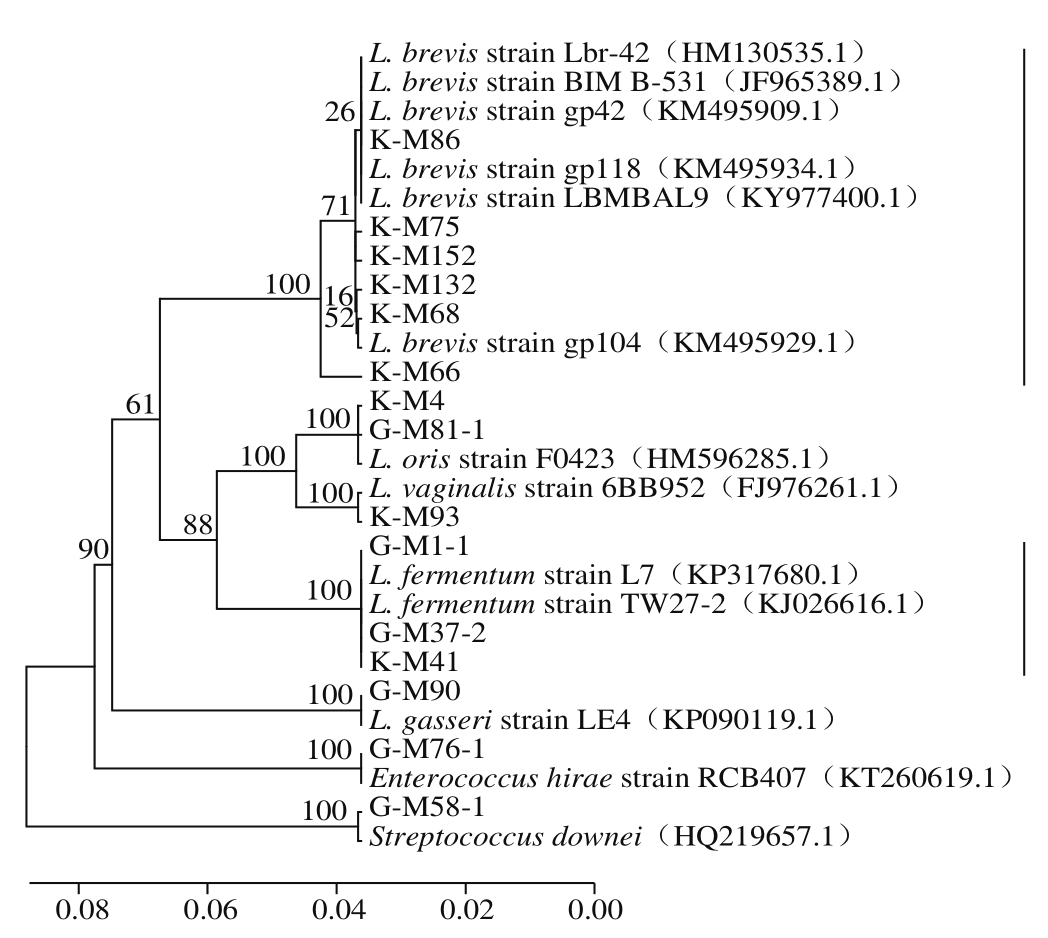
图2 基于16S rRNA测序的菌株系统发育图
Fig. 2 Phylogenetic tree of strains based on partial 16S rRNA gene sequence
统计结果显示220 株乳杆菌隶属于5 个种,分别为L. fermentum、L. brevis、L. oris、L. gasseri和L. vaginalis。其中L. fermentum所占比例最大,有82 株,占乳杆菌总数的37.3%,属于可培养乳杆菌中的优势菌种。其次分别为L. brevis 75 株(34.1%)、L. oris 37 株(16.8%)、L. gasseri 22 株(10.0%)和L. vaginalis 4 株(1.82% )。如图3所示,相对丰度较高且在5 个阶段均有分布的种群为L. fermentum,L. brevis在成熟乳和晚乳样中均有分布,且在15~19 个月阶段的相对丰度达到最大。不同阶段的Lactobacillus种群结构明显不同,0~5 d初乳的微生物种群结构相对比较单一,只分离得到L. fermentum;5 d~5 个月和5~10 个月阶段的成熟乳中乳杆菌种群结构最为复杂,分离得到5 个种的Lactobacillus分别为L. fermentum、L. brevis、L. oris、L. gasseri和L. vaginalis;10~15 个月和15~19 个月的晚乳次之。
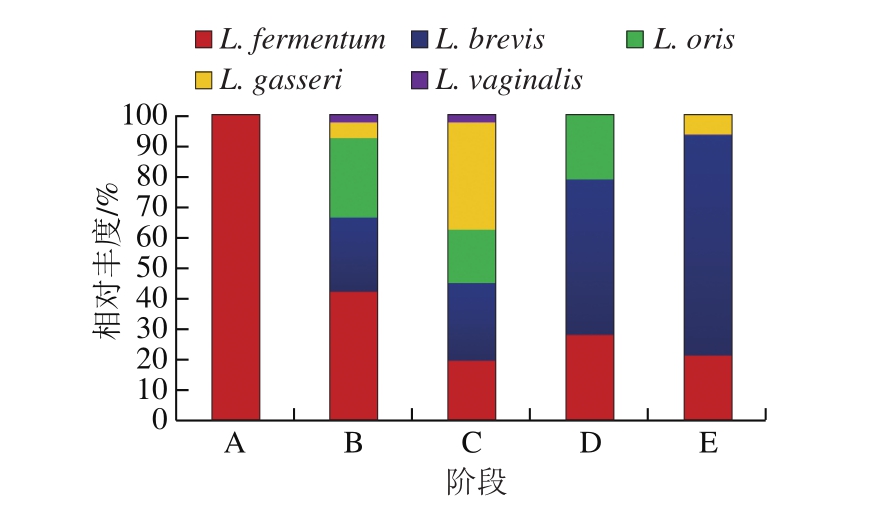
图3 乳杆菌在各阶段母乳中的相对丰度
Fig. 3 Relative abundance ofLactobacillus in breast milk samples at various lactation stages
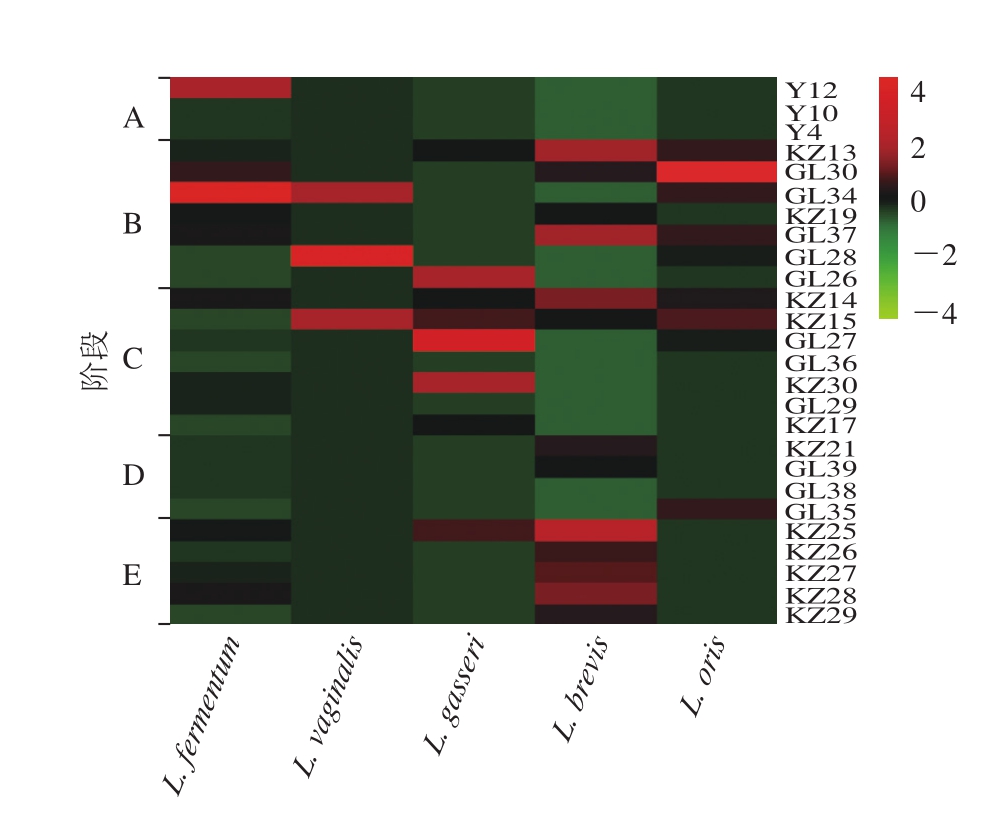
图4 不同哺乳期母乳中乳杆菌的组成及分布
Fig. 4 Composition and distribution ofLactobacillus in breast milk samples at different stages of lactation
如图4所示,从Heatmap中的颜色梯度和相似程度直观看出各个阶段的母乳样中Lactobacillus种群结构的相似性和差异性。按照哺乳期时间的不同将各阶段分为:初乳:A阶段;成熟乳:B、C阶段;晚乳:D、E阶段。数据显示B、C阶段的乳杆菌种类和数量居多,其中5 种乳杆菌主要分布于这两个阶段,数量属B阶段最多。A、D两阶段分离的乳杆菌数量相对较少。L. fermentum、L. vaginalis和L. oris主要集中于B阶段,L. gasseri主要集中于C阶段,L. brevis主要集中于E阶段。A阶段的初乳样中共分得16 株Lactobacillus且均为L. fermentum,B阶段的母乳样中共分得104 株,有5 个种,分别为L. fermentum 44 株、L. brevis25 株、L. oris27 株、L. gasseri5 株和L. vaginalis3 株;C阶段的母乳样共分得40 株,有5 个种,分别为L. fermentum8 株、L. brevis10 株、L. oris 7 株、L. gasseri14 株和L. vaginalis1 株;D阶段的母乳样中共分得14 株,有3 个种,分别为L. fermentum4 株、L. brevis7 株和L. oris3 株;E阶段的母乳样中共分得46 株,共3 个种,分别为L. fermentum10 株、L. brevis 33 株和L. gasseri3 株。

图5 各阶段母乳乳杆菌种群结构的PCA图
Fig. 5 Principal component analysis of the population structure of Lactobacillus at various stages of lactation
依据不同阶段的母乳样品乳杆菌菌群结构的数据,进行PCA(图5),不同阶段的母乳样品聚集在不同的区域且主要聚集在右侧,但并没有构成明显独立的组群,说明各个阶段的母乳样品中分离的乳杆菌种群结构尽管存在差异但也有一定的相似性。由图5可知,B阶段的各样品分布比较分散,说明该阶段母乳样品中乳杆菌的种群结构的相似性比较低;D和E阶段样品分离的乳杆菌种群结构的相似性相对较高;C阶段相似性最高。
通过图6中A、B、C、D、E阶段样品的乳杆菌种群结构交叉程度可以直观看出各阶段母乳样中乳杆菌种群的共有菌种和特有菌种。L. fermentum为5 个阶段母乳样中的共有菌种,共82 株,占Lactobacillus总数的37.3%;占总数34.1%(75 株)的L. brevis为B、C、D、E四个阶段的共有菌种;L. oris为B、C、D阶段共有菌种,共37 株(16.8%);L. gasseri为B、C、E阶段的共有菌种,共22 株(10%);L. vaginalis是B、C阶段的共有菌种,共4 株(1.8%);数据显示各个阶段母乳样品的特有的乳杆菌菌种数为0。
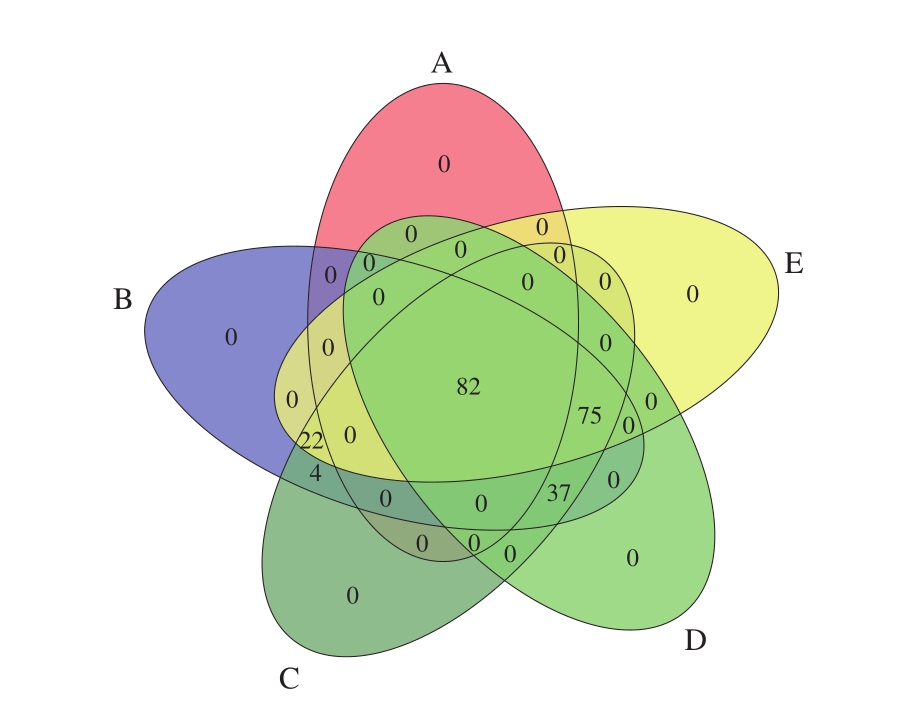
图6 各阶段母乳样中乳杆菌种群结构的Venn图
Fig. 6 Venn diagram of lactobacillus population structures in breast milk samples at different stages of lactation
从所有的母乳样品中分离的229 株乳酸菌菌株隶属于3 个属,分别为Lactobacillus、Enterococcus和Streptococcus。在属水平上主要以Lactobacillus spp.为主,所占总分离物的96%(220 株);在种水平上L.fermentum属于可培养乳杆菌中的优势菌种。Soto等[21]也通过MRS培养基分离培养的方法研究发现L.fermentum为优势菌种。Collado等[22]利用实时PCR方法在母乳样品中也检测到Lactobacillusspp.且为优势菌属,说明本研究分离方法比较可靠。
在不同的哺乳期阶段,母乳样品中乳杆菌的数量呈现成熟乳>初乳>晚乳的趋势,其种类呈现成熟乳>晚乳>初乳的趋势,其中成熟乳5 d~5 个月阶段的乳杆菌种群结构最为复杂。研究表明从成熟乳中分离的Lactobacillus菌株数相对初乳的较多[21]。Solís等[23]也研究发现成熟乳(10 d~3 个月)中Lactobacillusspp.的分离比例和种类相对初乳(1 d)要多,与本研究结果高度一致。说明不同哺乳期母乳中乳杆菌结构变化趋势明显,这为研究不同哺乳期的乳杆菌种群多样性做出了贡献。其原因可能是由于母亲分娩后与外界环境接触增多由环境转移而来的Lactobacillus菌种数增加,也可能是因为不同哺乳期母乳中营养物质的不同使成熟乳自身内生菌种相比初乳和晚乳要多[14],具体原因及作用机制有待进一步研究。
值得深究的是,4 株L. vaginalis集中分布于成熟乳样品中,Soto等[21]从27 个母乳样品的其中2 个母乳样品中也分离得到该菌种(数据并未显示样品阶段),但是没有与之对应的种特异性引物扩增,且相关的研究和报道较少,说明母乳中可培养的L. vaginalis比较罕见。此外,乳杆菌作为天然菌群除在母体口腔以及皮肤有分布外,泌尿生殖系统中也有分布[6],且有研究表明,在自然分娩的婴儿胎粪样品中发现有L. vaginalis和L. brevis的存在[24],因此其来源很可能是在分娩过程中由婴儿从产道携带出来再传递至母乳,也可能是母亲与周围环境的接触过程中由外界环境转移而来,但是相关报道比较少,其来源和益生特性还有待进一步研究。
本研究分离的L. fermentum、L. oris和L. gasseri等菌种据报道具有明显的益生特性。研究发现,母乳分离株L. fermentum CECT5716可以提高26~40 岁健康受试者对流感疫苗的敏感性,并减少流感疾病的发病率[25]。从母乳中分离的L. oris HMI68是一种具有降低胆固醇特性的共生细菌,能在人类胃肠道条件下生存[26]。也有研究表明分离自母乳的L. gasseri CECT5714对成人呼吸系统过敏症具有明显的改善作用[27]。且有研究表明L. fermentum、L. salivarius和L. gasseri均可由母乳传递并定殖于婴儿肠道中[28]。且本研究分离培养方法相比Collado等[22]的实时PCR检测方法的优势在于分离到的所有Lactobacillus都是可培养菌株并可用作后期益生特性的研究。目前,益生菌多用于功能性食品和临床,且大多数益生菌都来自动物肠道和婴幼儿粪便,有关母乳中益生菌的研究相对较少。因此,要深入研究新疆喀什地区维吾尔族母乳中益生菌资源和开发安全可靠的益生菌制剂,后续研究母乳中乳杆菌的益生特性至关重要。
研究显示,新疆喀什地区维吾尔族群体母乳中乳杆菌种群组成丰富,不同哺乳期母乳中乳杆菌变化趋势明显。L. fermentum为优势菌种,且为初乳、成熟乳和晚乳的共有菌种。成熟乳样品中分离的乳杆菌种群结构相对初乳和晚乳复杂,其中成熟乳5 d~5 个月阶段的乳杆菌种群结构最为复杂,且较罕见的L. vaginalis也主要集中于该阶段。表明乳杆菌种群结构的复杂性与不同的哺乳期有着密切联系,这为研究新疆喀什地区维吾尔族群体不同哺乳阶段的母乳中乳杆菌种群多样性的研究做出了贡献,同时也为乳源益生菌资源的开发提供了理论依据。
[1] HOOPER L V, GORDON J I. Commensal host-bacterial relationships in the gut[J]. Science, 2001, 292: 1115-1118. DOI:10.1126/science.1058709.
[2] 李理, 于宝丹, 徐军. 乳酸菌对尘螨致敏哮喘小鼠模型的免疫调节作用[J]. 医学研究生学报, 2006, 19(6): 515-520. DOI:10.16571/j.cnki.1008-8199.2006.06.010.
[3] 唐欢, 魏泓. 抗生素所致肠道菌群失衡及乳杆菌对其调节作用的研究[D]. 重庆: 第三军医大学, 2007: 3.
[4] 凌代文, 东秀珠. 乳酸细菌分类鉴定及实验方法[J]. 北京: 中国轻工业出版社, 1999: 117-210. DOI:10.13344/j.microbiol.china.1999.01.007.
[5] 杨振宇. 乳源乳杆菌菌株的分类鉴定[D]. 哈尔滨: 东北农业大学, 2007.
[6] 何亮, 熊礼宽, 曾忠铭. 乳杆菌的分类与分子鉴定方法研究进展[J].中国微生态学杂志, 2007(3): 312-313; 316. DOI:10.13381/j.cnki.cjm.2007.03.037.
[7] IARA-VILLOSLADA F, OLIVERES M, SIERRA S, et al.Beneficial effects of probiotic bacteria isolated from breast milk[J].British Journal of Nutrition, 2007, 98: 96-100. DOI:10.1017/S0007114507832910.
[8] OLIVERES M, DIAZ-POPERO M P, MARTIN R, et al. Antimicrobial potential of four Lactobacillus strains isolated from breast milk[J].Journal of Applied Microbiology, 2006, 101(1): 72-79. DOI:10.1111/j.1365-2672.2006.02981.x.
[9] PU Z Y, DOBOS M, LIMAOWTIN G K Y, et al. Integrated polymerase chain reaction-based procedures for the detection and identification of species and subspecies of Gram-positive bacterical genus Lactobacillus[J]. Journal of Applied Microbiology, 2002, 93(2):353-361.
[10] 陈文新. 细菌系统发育[J]. 微生物学报, 1998(3): 240-243.
[11] REYESS A, HAYNES M, HANSON N, et al. Viruses in the faecal microbiota of monozygotic twins and their mothers[J]. Nature, 2010,466: 334-338. DOI:10.1038/nature09199.
[12] KOENIG J E, SPOR A, SCALFONE N, et al. Succession of microbial consortia in the developing infant gut microbiome[J]. Proceedings of the National Academy of Sciences, 2011, 108(Suppl 1): 4578-4585.DOI:10.1073/pnas.1000081107.
[13] DOMINGUEZ-BELLO M G, COSTELLO E K, CONTRERAS M,et al. Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns[J]. Proceedings of the National Academy of Sciences, 2010, 107: 11971-11975.DOI:10.1073/pnas.1002601107.
[14] 李思奇, 马守庆, 余凯凡, 等. 母乳微生物种类和来源及其对新生子代作用的研究进展[J]. 世界华人消化杂志, 2016(12): 1846-1852.
[15] 李正华. 罗伊氏乳杆菌生物学特性及功能性发酵乳的研究[D].无锡: 江南大学, 2008.
[16] 黄卫强. 中国四个地区人母乳中微生物多样性研究[D]. 呼和浩特:内蒙古农业大学, 2015.
[17] 李梅花. 中国部分地区人体粪便中双歧杆菌的分离鉴定及具潜在益生特性菌株的筛选[D]. 呼和浩特: 内蒙古农业大学, 2012.
[18] 倪亚雯, 兰国伟, 杨尚娇, 等. 新疆不同地域发酵乳品中Lactobacillus多样性的研究[J]. 现代食品科技, 2016, 32(6): 104-109.DOI:10.13982/j.mfst.1673-9078.2016.6.017.
[19] 韩英. DNA指纹图谱技术在土壤微生物多样性研究中的应用[J].内蒙古教育(职教版), 2012(5): 68-69.
[20] 刘朝军, 沈定霞. 16S rDNA序列测定在细菌鉴定中的应用[J]. 军医进修学院学报, 2011(7): 774-776; 779.
[21] SOTO A, MARTÍN V, JIMÉNEZ E, et al. Lactobacilli and bifidobacteria in human breast milk: influence of antibiotherapy and other host and clinical factors[J]. Nutrition, 2014, 59: 78-88.DOI:10.1097/MPG.0000000000000347.
[22] COLLADO M C, DELGADO S, MALDONADO A, et al. Assessment of the bacterial diversity of breast milk of healthy women by quantitative real-time PCR[J]. Letters in Applied Microbiology, 2009,48(5): 523-528. DOI:10.1111/j.1472-765X.2009.02567.x.
[23] SOLÍS G, DE LOS REYES-GAVILAN C G, FEMÁNDEZ N,et al. Establishment and development of lactic acid bacteria and bifidobacteria microbiota in breast-milk and the infant gut[J].Anaerobe, 2010, 16(3): 1-3. DOI:10.1016/j.anaerobe.2010.02.004.
[24] 席晓霞. 初生婴儿肠道菌群与母体各部位菌群相关性研究[D]. 呼和浩特: 内蒙古农业大学, 2017.
[25] OLIVERES M, DL'AZ-ROPERO M P, SIERRA S, et al. Oral intake of Lactobacillus fermentum CECT5716 enhances the effect of influenza vaccination[J]. Nutrition, 2007, 23(3): 254-260.DOI:10.1016/j.nut.2007.01.004.
[26] ANANDHARAJ M, SIVASANKARI B. Isolation of potential probiotic Lactobacillus oris HMI68 from mother's milk with cholesterol-reducing property[J]. Journal of Bioscience and Bioengineering, 2014, 118(2): 5-7. DOI:10.1016/j.jbiosc.2014.01.015.
[27] JIMENEZ E, FERNANDEZ L, MALDONADO A, et al. Oral administration of Lactobacillus strains isolated from breast milk as an alternative for the treatment of infectious mastitis during lactation[J].Applied and Environmental Microbiology, 2008, 74(15): 4650-4655.DOI:10.1128/AEM.02599-07.
[28] MARTÍN R, LANGA S, REVIRIEGO C, et al. Human milk is a source of lactic acid bacteria for the infant gut[J]. Pediatr, 2003, 143:754 -758. DOI:10.1016/j.jpeds.2003.09.028.
Diversity ofLactobacillus Species in Breast Milk Samples from Uygur Mothers at Different Lactation Stages in Kashi, Xinjiang
倪永清(1969—)(ORCID: 0000-0003-4876-589X),男,教授,博士,研究方向为食品微生物。E-mail: niyqlzu@sina.com
张艳(1987—)(ORCID: 0000-0002-6296-3588),女,讲师,博士,研究方向为食品微生物。E-mail: zhangyanzqgh@163.com
LI Xiaojuan, NI Yongqing, ZHANG Yan. Diversity of Lactobacillus species in breast milk samples from Uygur mothers at different lactation stages in Kashi, Xinjiang[J]. Food Science, 2019, 40(18): 89-94. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180901-003. http://www.spkx.net.cn