耐热木聚糖酶菌株的筛选鉴定及发酵条件分析
杨 然1,2,张笑雨2,3,刘朋肖2,3,范光森1,2,李秀婷1,3,*
(1.北京食品营养与人类健康高精尖创新中心(北京工商大学),北京 100048;2.北京市食品风味化学重点实验室,北京 100048;3.食品添加剂与配料北京高校工程研究中心,北京 100048)
摘 要:从山东淄博酒曲中筛选得到1 株产耐热木聚糖酶菌株FSD0302,经鉴定为疏绵状丝孢菌(Thermomyces lanuginosus)。对该菌进行单因素优化产酶条件考察,结果显示:当玉米芯木聚糖粒度20~40 目、质量浓度4 g/100 mL、初始培养基pH 6.0、发酵温度50 ℃、转速200 r/min时,T. lanuginosus FSD0302所产木聚糖酶活力高达5 357.1 U/mL,比活力为10 493.72 U/mg,较初筛时产酶量提高了2.9 倍;该菌可产2 种木聚糖酶,分子质量分别约为20 kDa和60 kDa,酶学性质考察结果表明,该菌所产木聚糖酶粗酶的最适温度为75 ℃,最适pH值分别为5.5及7.5且在pH 3.5~9.0范围内可保留50%以上酶活力。综上所述,来源于T. lanuginosus FSD0302的耐热木聚糖酶可在低聚木糖生产中具有一定的应用前景。
关键词:疏绵状丝孢菌;耐热木聚糖酶;发酵条件;酶学性质
作为一种高效、绿色、安全的半纤维素水解酶,木聚糖酶在食品焙烤及添加剂[1]、饲料工业[2]、助漂纺织[3]以及能源转化方面[4]一直得到良好的开发与应用。如今,现代化工业生产环境对木聚糖酶特性的要求越来越严苛,从环境中筛选具有不同特性的木聚糖酶成为解决工业生产需求的途径之一[5]。耐热木聚糖酶作为一类可在高温环境下对半纤维素进行特性降解的水解酶,其应用前景广阔且市场需求强烈。目前,利用传统筛选技术已获得来源于细菌、真菌等耐热木聚糖酶并对其发酵条件进行了研究。张晓元等[6]从土壤样品中筛选获得1 株芽孢杆菌,该菌可利用玉米芯发酵生产耐热木聚糖酶,酶活力高达1 664.9 U/mL;吴小建等[7]从木薯废弃物中分离得到1 株嗜热真菌,经鉴定为嗜热子囊菌,固体发酵产木聚糖酶效果较理想;而来源于疏绵状嗜热真菌的木聚糖酶分泌量较低,仅为68.5 U/mL[8]。随着分子生物学技术的不断更新,利用异源表达手段及分子改造技术已逐步获得适宜工业生产需求的耐热木聚糖酶。来源于GH11家族的中温木聚糖酶XynZF-2,经理性设计后,在其结构中引入芳香族氨基酸残基,突变酶最适温度较原酶提高8 ℃且pH值稳定性更加宽泛[9];吴芹等[10]对来源于米曲霉的木聚糖酶分子结构进行改造,在酶分子N端引入3 对盐桥并在毕赤酵母中进行表达,突变酶的最适反应温度提升至58 ℃且温度稳定性得到了明显的改善。可见,关于耐热木聚糖酶的研究已成为木聚糖酶应用领域关注的新热点,而寻求高产、新型、热性能优良的木聚糖酶生产菌株是加快我国木聚糖酶深度工业化应用的基础。
本研究旨在从酒曲中筛选获得高产耐热木聚糖酶菌株,并对其发酵产酶条件进行考察,以期进一步提高木聚糖酶活力,对其酶学特性进行探讨,为木聚糖酶的扩大生产及工业应用提供新资源及基础数据。
1 材料与方法
1.1 材料与试剂
样品分别来自于山东淄博酒曲、山东淄博中酒曲库、衡水老白干酒曲、福建红曲、福建白药酒曲、古大曲;榉木木聚糖 美国Sigma公司;木糖及其他试剂均为国产分析纯。
初筛培养基:胰蛋白胨0.3%,酵母浸粉0.2%,MgSO4 0.05%,K2HPO4 0.15%,KH2PO4 0.6%,琼脂2%,200 目水不溶性自提玉米芯木聚糖1%,自然pH值,121 ℃灭菌20 min。
马铃薯葡萄糖培养基:土豆200 g,煮沸20 min,4 层纱布过滤,加入葡萄糖20 g,补足水1 000 mL,固体培养基加2%琼脂,自然pH值,115 ℃灭菌30 min。
发酵摇瓶培养基:胰蛋白胨1%,酵母浸粉0.3%,硝酸钠0.2%,KH2PO4 0.6%,K2HPO4 0.15%,MgSO4 0.05%,玉米芯(80 目)2%,自然pH值,121 ℃灭菌20 min。
1.2 仪器与设备
TCYQ型台式恒温振荡器 苏州市培英实验设备有限公司;雷磁pHS-3C型pH计 上海仪电科学股份有限公司;UV-2600型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;BOXUN立式压力蒸汽灭菌锅、BSC-130IIA2型洁净工作台 上海博迅实业有限公司医疗设备厂;Mini-PROTEAN Tetra System小型垂直电泳 美国Bio-Rad公司。
1.3 方法
1.3.1 自提玉米芯木聚糖的制备[11]
取经粉碎过80 目筛的玉米芯加入氢氧化钠溶液中,固液比1∶10,煮沸后保持微沸2 h,4 层纱布过滤,弃滤渣,滤液冷却后用浓盐酸调pH 7.0,静置过夜,10 000 r/min离心15 min得沉淀,用去离子水反复洗涤、离心,直至电导率小于100 μS/cm,将沉淀置于50 ℃条件下烘干并研磨,收集备用。
1.3.2 耐热木聚糖酶产生菌的筛选
称取不同来源样品0.2 g于800 μL高纯水中振荡,依次稀释至10-2、10-3浓度梯度,取200 μL上清液均匀涂布于初筛培养基平板上,分别标记,于50 ℃培养箱中培养3~4 d。从初筛培养基平板中挑选有透明圈的单菌落(菌株所产木聚糖酶可分解培养基中底物木聚糖,因此菌落周围呈现透明圈现象),划线分离。纯化后的菌株转接至发酵摇瓶培养基中(摇瓶容积250 mL,装液量为50 mL),在50 ℃、200 r/min条件下恒温发酵5 d,发酵液离心后取上清液在不同温度(70、75、80 ℃)下测定木聚糖酶活力。
1.3.3 耐热木聚糖酶产生菌的鉴定
将目标菌株接种于马铃薯葡萄糖培养基中,观察菌株形态及生长状态,并进行显微镜结构观察;真菌试剂盒提取菌株FSD0302总DNA,利用通用引物(NS1:5’-GTAGTCATATGCTTGTCTC-3’;NS8:5’-TCCGCAGGTTCACCTACGGA-3’),扩增该菌的保守核苷酸序列,扩增程序:94 ℃、5 min;94 ℃、30 s;45~60 ℃、30 s;72 ℃、2 min;循环36 次;72 ℃延伸l0 min。获得的保守序列与NCBI上检索的同源序列进行比对,构建系统发育树,最终确定该菌种属。
1.3.4 单因素发酵条件优化
以发酵产酶培养基为基础,逐步优化培养基中的玉米芯木聚糖粒度、玉米芯木聚糖质量浓度、培养基初始pH值、温度和转速等培养条件(摇瓶容积250 mL,装液量为50 mL)。玉米芯木聚糖粒度:选择粒度分别为8~20、20~40、40~60、60~80、80~120、120~200 目配制液体发酵培养基,添加量1%,于50 ℃、200 r/min培养5 d后测定发酵液木聚糖酶活力,确定最佳碳源粒度;玉米芯木聚糖质量浓度:选择玉米芯木聚糖质量浓度分别为2.0、3.0、4.0、5.0、6.0、7.0 g/100 mL配制液体发酵培养基,于50 ℃、200 r/min培养5 d后测定发酵液木聚糖酶活力,确定最佳碳源质量浓度;培养基初始pH值:在碳源粒度、碳源质量浓度确定的基础上,分别将液体发酵培养基的初始pH值调至5.0、5.5、6.0、6.5、7.0、7.5,于50 ℃、200 r/min培养5 d后测定发酵液木聚糖酶活力,以确定培养基的最适初始pH值;温度:在上述条件确定的基础上,改变发酵发酵温度,采用不同温度(40、45、50、55、60 ℃)对菌株进行发酵培养,200 r/min发酵5 d,测定发酵液木聚糖酶活力,确定最适发酵温度;转速:选择150、175、200、225、250 r/min转速于50 ℃培养5 d后测定发酵液木聚糖酶活力,确定最适培养转速。
1.3.5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)及酶谱分析
SDS-PAGE分离胶为12.5%(加入2%榉木木聚糖),浓缩胶为4.5%,考马斯亮兰染色显示蛋白带,标准蛋白与样品在同一条件下进行电泳。木聚糖酶样品经电泳后,在25%的异丙醇溶液中复性,随后用适宜缓冲液浸泡数次以洗去异丙醇,于30 ℃反应15 min,1%刚果红染色20 min,1 mol/L NaCl溶液脱色至透明水解条带出现。
1.3.6 木聚糖酶活力的测定
参照3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法。20 μL适当稀释的酶溶液,加入到180 μL用0.05 mol/L、pH 5.0的柠檬酸钠缓冲液配制的1%榉木木聚糖底物溶液中,60 ℃反应10 min,用DNS法测定释放的还原糖量,同时以木糖作标准。木聚糖酶活力单位(U)的定义为:在上述条件下,每分钟水解木聚糖生成1 μmoL木糖所需要的酶量[12]。
1.3.7 蛋白含量的测定
参照Lowry等[13]的方法,以牛血清蛋白作为标准蛋白绘制标准曲线。
1.3.8 酶学性质分析
1.3.8.1 最适反应pH值及pH值稳定性
采用实验室缓冲体系(pH 2.0~12.0)将粗酶液稀释至合适浓度,参照1.3.6节方法测定木聚糖酶活力,确定最适反应pH值,定义最适反应pH值下测得的酶活力为100%;采用适当体积上述缓冲液体系与粗酶液混合,60 ℃保温30 min后立即冰水冷却,测定剩余木聚糖酶活力(未经处理的酶液为对照)。
1.3.8.2 最适反应温度及温度稳定性
粗酶液在50、55、60、65、70、75、80、85、90 ℃条件下按照1.3.6节方法测定酶活力,以确定最适反应温度;将粗酶液与pH 5.5的底物分别置于不同温度(55、60、65、70 ℃)下反应0.3、0.6、1、2、3、4 h,测定木聚糖酶活力,考察粗酶液的热稳定性。
1.4 数据处理
图像采用PowerPoint软件处理;实验数据采用Excel 2013软件处理,发酵条件优化实验每组数据设置3 次平行,结果取平均值并计算标准偏差;而关于酶学特性实验设2 次重复,每组数据设置3 次平行,结果取平均值并计算标准偏差。
2 结果与分析
2.1 耐热木聚糖酶产生菌的筛选
本实验从众多酒曲样品中分离纯化得到具有降解木聚糖能力的菌株40余株,进一步对其进行摇瓶发酵测定木聚糖酶活力,产酶量大于10 U/mL的菌株有10 株(表1),其中来源于山东淄博酒曲II编号为Z3-2的菌株所产木聚糖酶活力最高,达1 378.9 U/mL,且粗酶液最适温度为75 ℃,初步选定该菌株为目标菌株,且按本实验室菌株编号规则改写标号为菌株FSD0302。
表1 木聚糖酶产生菌初筛
Table 1 Primary screening of strains for producing xylanase

霉菌 样品来源 编号 酶活力/(U/mL) 细菌 样品来源 编号 酶活力/(U/mL)1 山东淄博酒曲I Z2-7 351.1±21.3 1 衡水老白干酒曲 Z1-1 41.0±1.2 2 山东淄博酒曲II Z3-2 1 378.9±15.6 2 古大曲 Z8-9 21.0±5.6 3 山东淄博酒曲III Z4-3 1 127.7±30.5 3 福建红曲 Z9-5 71.8±3.4 4 山东淄博酒曲IV Z5-14 910.6±50.2 4 山东淄博曲库后方 Z7-16 10.3±0.1 5 山东淄博曲库 Z7-6 135.7±11.1 5 福建白酒药酒曲 Z10-1 17.0±1.2
2.2 菌株FSD0302的鉴定
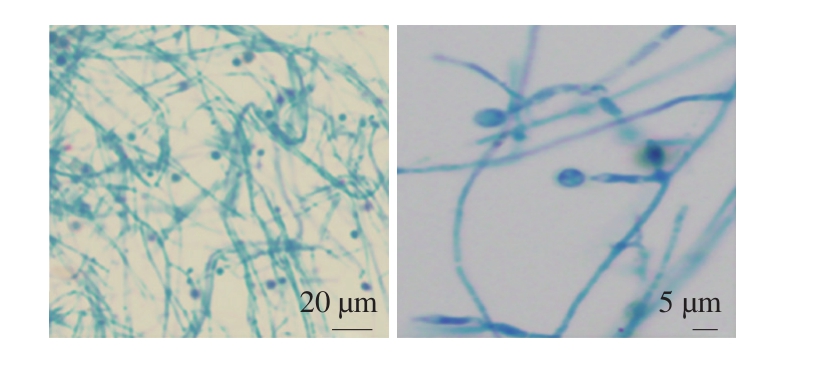
将菌株FSD0302接种于PDA培养基中,50 ℃培养2 d后肉眼可见白色絮状绒毛菌落,随着培养时间的延长,菌落增大且由绿灰色渐变至黑色。显微镜观察结果如图1所示,菌丝蓬松细长,具分隔;分生孢子垂直侧生,孢子为球形单孢子,无孢子囊结构。
为进一步确定该菌种类,结合分子生物学手段,提取菌株FSD0302核糖体18S rDNA保守序列进行聚合酶链式反应扩增。纯化扩增产物后测序,在NCBI中进行序列同源性比对,并从GenBank数据库中检索挑选与目标序列同源性高的基因序列,采用邻近相连法构建系统发育树,结果如图2所示,菌株FSD0302与疏绵状丝孢菌(Thermomyces lanuginosus)ATCC 200065位于基因进化数中的同一分支且序列同源性达70%。最终结合菌落形态、显微结构及分子生物学鉴定结果,确定菌株FSD0302为疏绵状丝孢菌,并命名为T. lanuginosus FSD0302。
2.3T. lanuginosusFSD0302发酵产酶条件优化
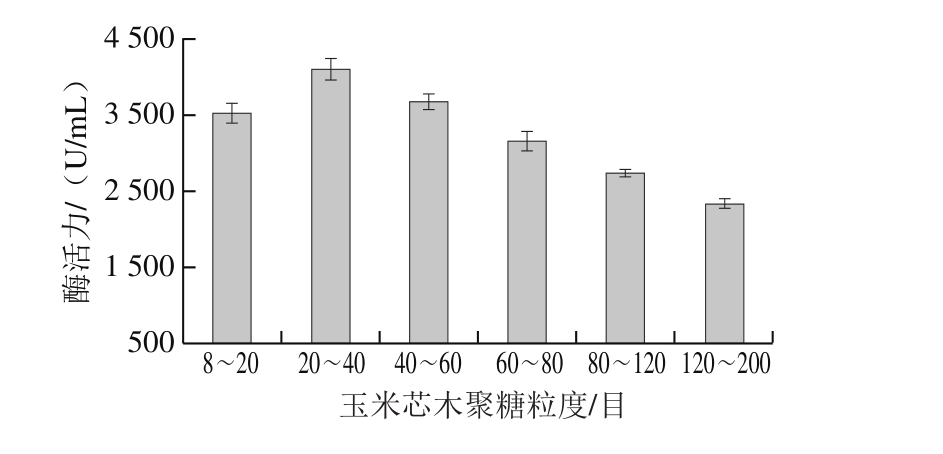
2.3.1 碳源粒度对T. lanuginosus FSD0302产酶的影响
微生物来源木聚糖酶的产生需要木聚糖底物的诱导,因此在产酶条件优化时用自提玉米芯木聚糖替换玉米芯作为发酵碳源以期获得高产量酶活力。实验选取不同粒度的玉米芯木聚糖诱导T. lanuginosusFSD0302产酶,图3结果表明,当玉米芯木聚糖粒度为20~40 目时,菌株所产酶活力最高为4 096.8 U/mL,且随着碳源粒度的降低酶活力逐渐降低。分析原因可知,当碳源粒度过小时,微生物可快速分解碳源用于自身生长而导致摇瓶中溶氧量的不足,影响后期产酶[14];另一方面,碳源颗粒过细会与其他营养物质形成的悬浊液黏度较大,影响菌株代谢产物的产生,使产酶水平降低[15]。玉米芯是我国主要的农业废弃物之一,以玉米芯或玉米芯来源的木聚糖作为碳源进行生物质转化,一方面可解决农业废弃物废置污染的问题,另一方面为生物质能源的转化利用及农业附加值的创收都具有积极意义。
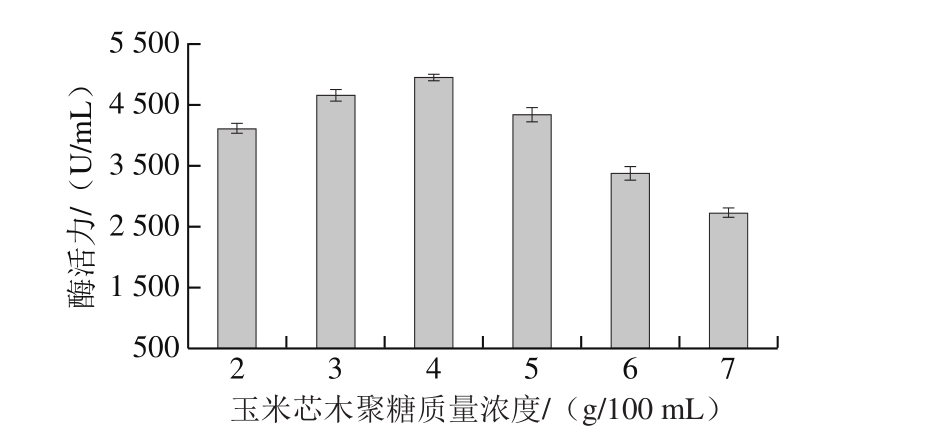
2.3.2 碳源质量浓度对T. lanuginosus FSD0302产酶的影响
如图4所示,该菌产木聚糖酶活力随碳源质量浓度的增加而升高,当碳源质量浓度增加至4.0 g/100 mL时,木聚糖酶活力最高。而当碳源质量浓度过高时,菌株产酶量反而降低,其原因可能是过多的碳源在发酵过程中形成了较厚的悬浮物,使发酵营养素混合不均,影响微生物对营养物质的利用,另外过高的碳源质量浓度降低了发酵环境中的溶氧量,不利于发酵产[16]。
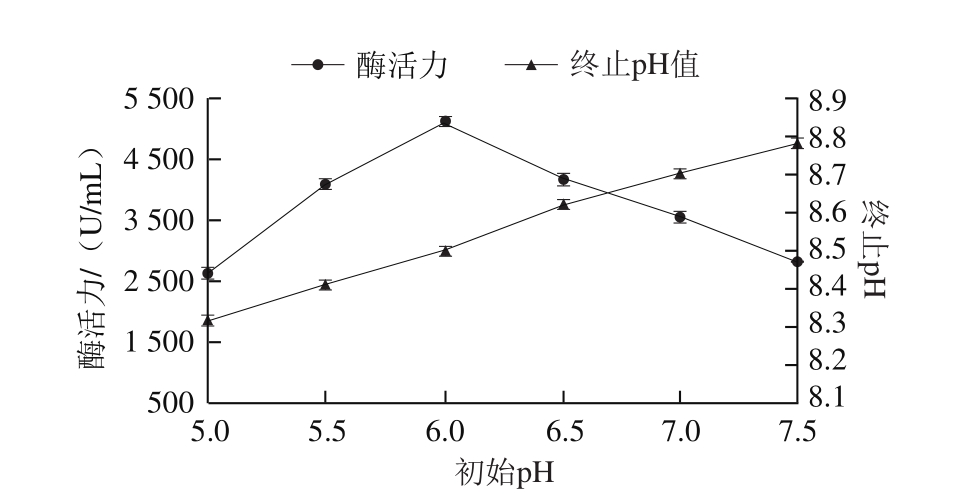
2.3.3 培养基初始pH值对T. lanuginosus FSD0302产酶的影响
如图5所示,随着pH值的升高,T. lanuginosus FSD0302产酶活力逐渐上升,在pH 6.0时,木聚糖酶活力最高可达5 077.2 U/mL,之后随着pH值的上升酶活力反而急剧下降。在微生物生长繁殖和代谢的过程中,由于营养物质的消耗及代谢产物的形成和积累,会导致培养基的pH值发生改变,因此发酵液初始pH值对菌株生长及产酶起着重要作用。疏绵状丝孢菌CBS28854-M18发酵产木聚糖酶条件确定的最适pH值为7.0,高于本实验结果,而发酵液终止pH值变化与本研究结果类似,均处于偏碱性(pH 8.1~8.9)范围[17]。
2.3.4 温度对T. lanuginosus FSD0302产酶的影响
温度对嗜热菌株发酵生长及代谢产物的产生和积累起着至关重要的作用,因此考察不同发酵温度对T. lanuginosusFSD0302产木聚糖酶的影响。图6表明,当发酵温度为50 ℃时,木聚糖酶活力最高,这一结果与同类研究疏绵状丝孢菌发酵产木聚糖酶的结果相同[17-18]。而当温度低于或高于50 ℃时,菌株产酶能力明显降低,即发酵温度为45 ℃及55 ℃时菌株产酶活力分别为最高酶活力的83.2%和79.5%,较低的发酵温度,延缓了菌体的生长及发酵周期,不利于酶蛋白的产生及积累;而较高的温度,使微生物孢子快速萌发,菌体生长过快,加速菌丝体老化,酶产量降低。
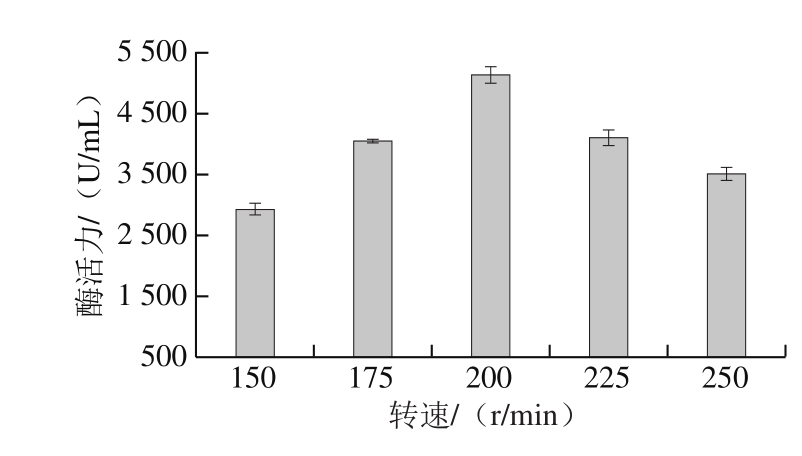
2.3.5 转速对T. lanuginosus FSD0302产酶的影响
转速对发酵溶氧、热传递、菌丝体状态起着重要作用。随着转速的增加,T. lanuginosusFSD0302产木聚糖酶趋势呈现先上升后下降的现象,在转速为200 r/min时木聚糖酶活力最高(图7)。滕超等[19]研究摇床转速对嗜热真菌FL12产木聚糖酶影响时发现,当转速达到205 r/min时,菌株产酶能力最优,与本实验结果相近,而当摇床转速达到225 r/min以上时可导致真菌菌丝体破碎自溶,不利于木聚糖酶的产生及积累。因此,适宜的转速是菌株发酵产酶的必要条件。
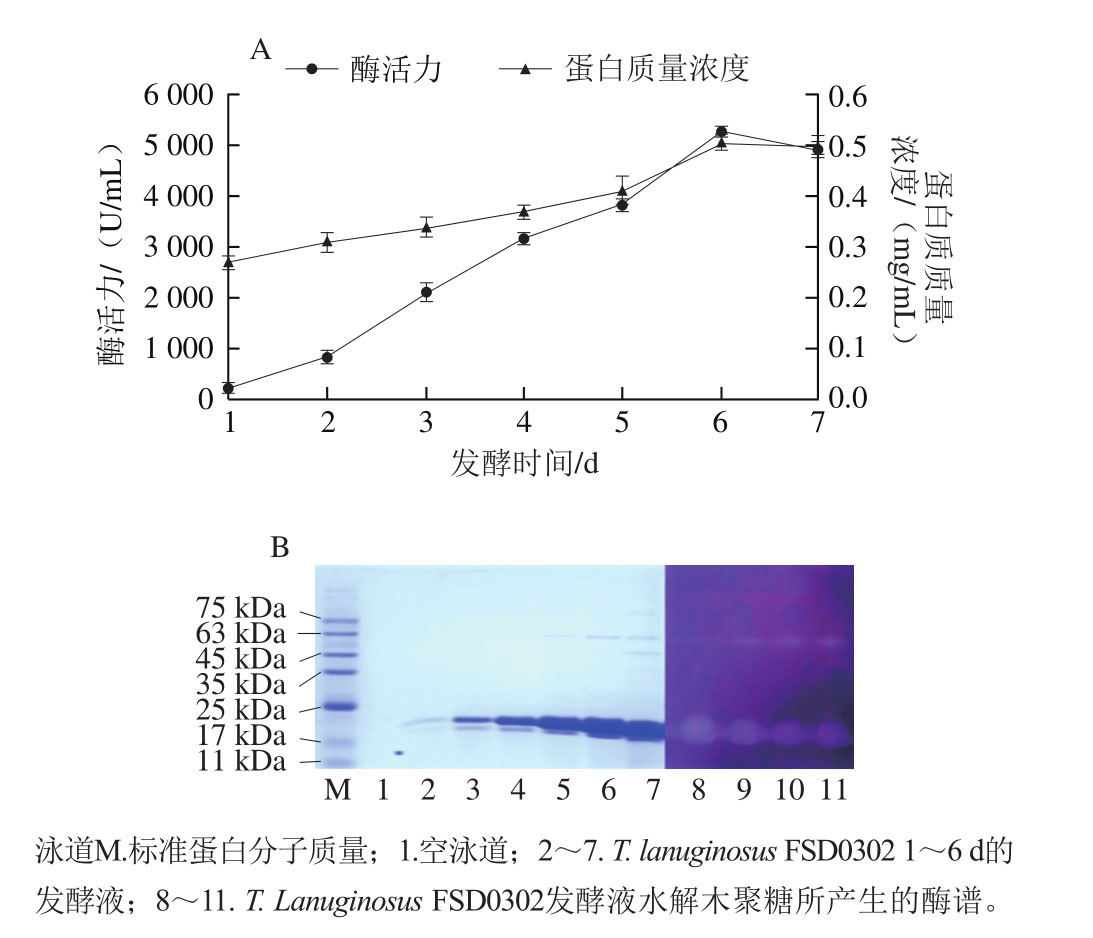
采用优化条件,即玉米芯木聚糖粒度20~40 目、质量浓度4 g/100 mL、培养基初始pH 6.0、发酵温度50 ℃、摇床转速200 r/min,对T. lanuginosusFSD0302产木聚糖酶历程进行探究,结果如图8A所示,从第2天起T. lanuginosusFSD0302产木聚糖酶水平呈直线上升趋势,至第6天达到产酶高峰,即产酶量高达5 357.1 U/mL,蛋白质量浓度为0.51 mg/mL,而此时酶比活力达10 493.72 U/mg,是目前已报道疏绵状丝孢菌液体发酵产木聚糖酶同类研究最高水平[20-22]。结合SDS-PAGE及酶谱(图8B)分析可知,T. lanuginosusFSD0302产2 种木聚糖酶,分子质量约为20 kDa及60 kDa,且以低分子质量木聚糖酶为主。本研究结果与同类研究结果不同,大多数疏绵状丝孢菌产单一组分木聚糖酶且分子质量较低(20~29 kDa)[17-18,23-24],少数研究报道有高分子质量木聚糖酶产生[25],而T. lanuginosusFSD0302可产两种组分木聚糖酶,从分子质量初步判断分属GH10及GH11家族[26]。因此本研究筛选获得的T. lanuginosusFSD0302具有可深入研究的价值。
2.4T. lanuginosus FSD0302所产木聚糖酶的酶学性质
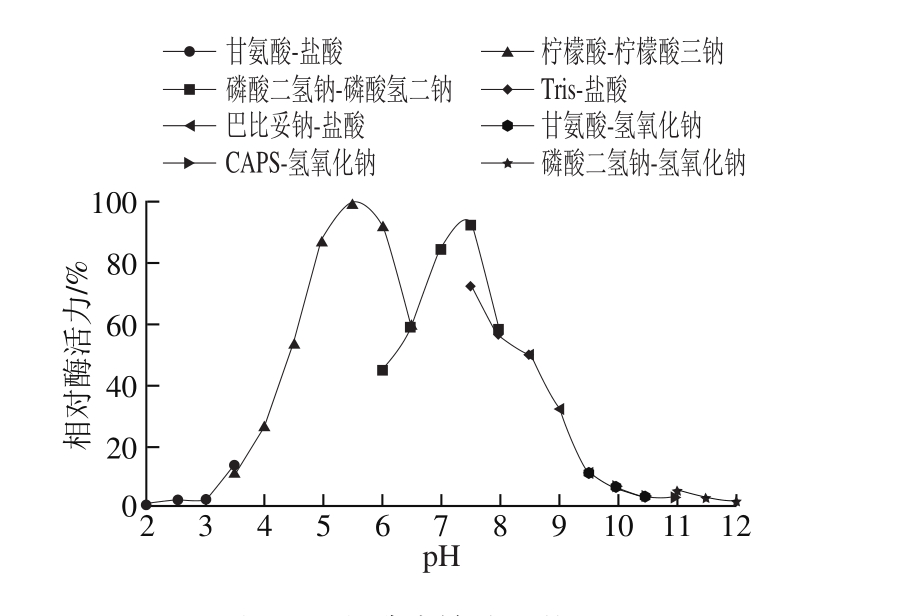
2.4.1 粗酶液最适pH值及pH值稳定性
相关疏绵状丝孢菌产木聚糖酶的研究指出,该类菌所产木聚糖酶的最适pH值在6.0~7.0居多[27-28],而T. lanuginosus FSD0302所产木聚糖酶粗酶液在pH 5.5及pH 7.5时表现出较高的相对酶活力(图9),此结果可能与该菌同时可产两种类型木聚糖酶有关,这一发现对拓宽该类菌所产木聚糖酶的种类及耐热木聚糖酶的应用有积极意义。
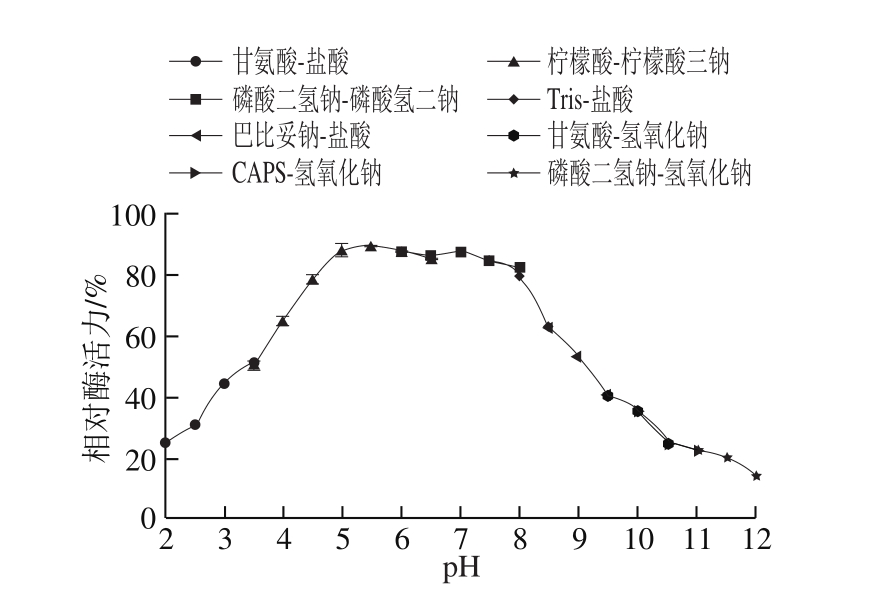
T. lanuginosus FSD0302所产木聚糖酶粗酶液在pH 4.0~9.0范围内表现出良好的稳定性,且在pH 5.0~8.0之间残留酶活力高达80%以上(图10)。目前报道的大多数疏绵状丝孢菌所产木聚糖酶的pH值稳定范围在5.0~9.0之间[29-31],其中T. lanuginosus W205所产单一组分木聚糖酶的pH值稳定范围为5.0~10.5,该酶可水解木聚糖生成以木二糖、木三糖为主的低分子质量木聚糖且无木糖产生[24]。
2.4.2 粗酶液最适反应温度及温度稳定性
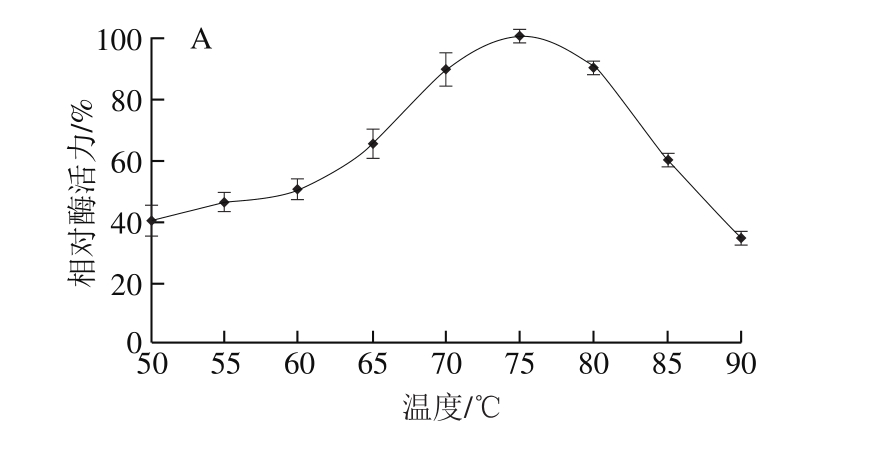
嗜热真菌的最适反应温度一般在65~70 ℃之间,不同菌株之间略有差异。T. lanuginosus FSD0302木聚糖酶粗酶液的最适反应温度为75 ℃(图11A),这一结果优于陈威威[23]及李文鹏[32]等的研究结果。该菌在55 ℃反应4 h后残余酶活力达60%以上,65 ℃反应40 min后仍能保留50%残余酶活力(图11B),说明T. lanuginosus FSD0302木聚糖酶具有较好的耐热性及热稳定性。
3 结 论
耐热木聚糖酶可在高温环境下发挥水解效力且表现出良好的温度稳定性而备受关注。从自然环境中筛选耐热菌株是获取耐热木聚糖酶的有效途径。目前,耐热木聚糖酶产生菌以细菌和真菌居多,而真菌由于其可高效胞外分泌而成为新的研究焦点。本研究以富含微生物菌群的酒曲为研究样品,筛选获得可产木聚糖酶的耐热菌40余株,经木聚糖酶活力及酶耐热性考察,最终确定了1 株目标菌株FSD0302。结合微生学物形态分析及分子生物学鉴定结果,确定该菌为疏绵状丝孢菌。目前关于该类菌产耐热木聚糖酶的研究较多,但天然菌株液体发酵产酶水平不高,本研究通过产酶条件优化,T. lanuginosus FSD0302所产木聚糖酶活力可达5 357.1 U/mL,比活力为10 493.72 U/mg,为疏绵状丝孢菌液体发酵产木聚糖酶的最高水平。一般而言,疏绵状丝孢菌所分泌的木聚糖酶为单一组分,而本研究的菌株FSD0302可产两种木聚糖酶分子,分子质量分别约为20 kDa和60 kDa,粗酶酶学性质考察结果表明该菌所产木聚糖酶的最适温度为75 ℃,55 ℃反应4 h后残余酶活力达60%以上,65 ℃反应40 min后仍能保留50%残余酶活力,粗酶的最适pH值分别为5.5及7.5,且在3.5~9.0范围内可保留50%以上酶活力。由此可知,T. lanuginosusFSD0302所产木聚糖酶具有良好的热稳定性且pH值耐受范围较宽泛,具有可深入研究的价值及一定的工业应用潜力。
参考文献:
[1] KUMAR V. Production of thermo-alkali-stable xylanase by a novel polyextremophilic Bacillus halodurans, TSEV1 in cane molasses medium and its applicability in making whole wheat bread[J].Bioprocess and Biosystems Engineering, 2014, 37(6): 1043-1053.DOI:10.1007/s00449-013-1075-3.
[2] 梁永, 陈中平, 杨洪森. 木聚糖酶在饲料应用上的研究进展[J]. 饲料研究, 2012, 4(12): 30-31. DOI:10.3969/j.issn.1002-2813.2012.04.010.
[3] 高秋芳, 阳辛凤, 孔华, 等. 果胶裂解酶和木聚糖酶双价工程菌在菠萝叶纤维脱胶中的应用[J]. 江苏纺织, 2010(3): 42-43. DOI:10.3969/j.issn.1005-6289.2010.03.016.
[4] COLLINS T, GERDAY C, FELLER G. Xylanase, xylanase families and extremophilic xylanase[J]. FEMS Microbiology Reviews, 2005,29(1): 3-23. DOI:10.1016/j.femsre.2004.06.005.
[5] 林小洪, 林娟, 王国增, 等. 产木聚糖酶菌株的筛选、鉴定及酶学性质研究[J]. 中国食品学报, 2016, 16(1): 115-122.
[6] 张晓元, 郝荣华, 刘飞, 等. 一株产耐热耐碱木聚糖酶菌株的筛选及酶学性质研究[J]. 食品与药品, 2017, 19(2): 77-83. DOI:10.3969/j.issn.1672-979X.2017.02.001.
[7] 吴小建, 吴圣进, 汪茜, 等. 一株产木聚糖酶菌株的鉴定及产酶条件研究[J]. 南方农业学报, 2016, 47(9): 1522-1527. DOI:10.3969/j.issn.2095-1191.2016.09.1522.
[8] 郑思玉, 马招堂, 王静, 等. 梳棉状嗜热真菌发酵产耐热木聚糖酶培养条件的优化[J]. 基因组学与应用生物学, 2017, 36(5): 1985-1990.DOI:10.13417/j.gab.036.001985.
[9] 李同彪, 周晨妍, 朱新术, 等. N-端二硫键芳香族氨基酸对木聚糖酶XynZF-2热稳定性的影响[J]. 食品与发酵工业, 2016, 42(1): 27-30.DOI:10.13995/j.cnki.11-1802/ts.201601005.
[10] 吴芹, 臧嘉, 李闯, 等. 引入盐桥改善木聚糖酶AoXyn11A的温度特性[J]. 食品与发酵工业, 2016, 42(7): 69-73. DOI:10.13995/j.cnki.11-1802/ts.201607012.
[11] 杨然, 朱培华, 姚君, 等. 重组木聚糖酶酶解玉米芯制备低聚木糖[J].食品与发酵工业, 2015, 41(4): 115-120. DOI:10.13995/j.cnki.11-1802/ts.201504022.
[12] BAILEY J M, BIELY P, POUTANEN K. Interlaboratory testing of methods for assay of xylanase activity[J]. Journal of Biotechnology,1992, 23(13): 257-270. DOI:10.1016/0168-1656(92)90074-J.
[13] LOWRY O H, ROUSEBROUGH N J, FARR A L, et al. Protein measurement with the Folin phenol reagent[J]. The Journal of Biological Chemistry, 1951, 193: 265-275.
[14] SINGH S, MADLALA A M, PRIOR B A. Thermomyces lanuginosus:properties of strains and their hemicellulases[J]. FEMS Microbiology Reviews, 2003, 27(1): 3-16. DOI:10.1016/S0168-6445(03)00018-4.
[15] 李娥, 李秀婷, 朱运平, 等. 链霉菌L2001利用农业废弃物产木聚糖酶条件及酶解产物[J]. 中国食品学报, 2011, 11(2): 24-33.DOI:10.3969/j.issn.1009-7848.2011.02.004.
[16] XU Z H, BAI Y L, XU X, et al. Production of alkali-tolerant cellulasefree xylanase by Pseudomonas sp. WLUN024 with wheat bran as the main substrate[J]. World Journal of Microbiology and Biotechnology,2005, 21(4): 575-581. DOI:10.1007/s11274-004-3491-7.
[17] 李秀婷, 李里特, 江正强. 嗜热真菌耐热木聚糖酶的产酶条件和酶谱分析[J]. 微生物学通报, 2004, 31(2): 49-54. DOI:10.3969/j.issn.0253-2654.2004.02.012.
[18] 范光森, 杨绍青, 闫巧娟, 等. 嗜热棉毛菌固体发酵产木聚糖酶条件的优化[J]. 食品工业科技, 2012, 33(6): 219-224.
[19] 滕超, 范园园, 查沛娜, 等. 嗜热真菌FL12产耐热木聚糖酶条件优化[J]. 食品工业科技, 2013, 34(11): 188-193.
[20] 管国强, 方华, 王美娟, 等. Thermoascus aurantiacus产耐热木聚糖酶水解活性的培养条件优化[J]. 饲料工业, 2018, 39(14): 40-46.DOI:10.13302/j.cnki.f i.2018.14.008.
[21] PUCHART V, KATAPODIS P, BIELY P, et al. Production of xylanase,mannanases, and pectimases by the thermophilic fungus Thermomyces lanuginosus[J]. Enzyme and Microbial Technology, 1999, 24(5/6):355-361. DOI:10.1016/S0141-0229(98)00132-X.
[22] VISHAL K, SHUKLA P. Extracellular xylanase production from T. lanuginosus VAPS24 at pilot scale and thermostability enhancement by immobilization[J]. Process Biochemistry, 2018, 71: 53-60.DOI:10.1016/j.procbio.2018.05.019.
[23] 陈威威, 江正强, 王瑞君. 绵毛嗜热丝孢菌木聚糖酶的纯化与性质[J].菌物学报, 2009, 28(4): 571-576.
[24] XIONG H R, NYYSSÖLÄ A, JÄNIS J, et al. Characterization of the xylanase produced by submerged cultivation of Thermomyces lanuginosus DSM 10635[J]. Enzyme and Microbial Technology, 2004,35(1): 93-99. DOI:10.1016/j.enzmictec.2004.04.003.
[25] IRFAN M, GONZALEZ C F, RAZA S, et al. Improvement in thermostability of xylanase from Geobacillus thermodenitrificans C5 by site directed mutagenesis[J]. Enzyme and Microbial Technology,2018, 111: 38-47. DOI:10.1016/j.enzmictec.2018.01.004.
[26] 孙超, 陈卫平. 微生物木聚糖酶及其应用研究进展[J]. 中国酿造,2013, 32(4): 24-29. DOI:110.3969/j.issn.0254-5071.2013.04.006.
[27] 谢凤珍, 华承伟, 牛宏阳. 耐热木聚糖酶源细菌筛选、鉴定及酶学性质[J]. 河南科技学院学报, 2014, 42(5): 7-10. DOI:103969/j.issn.1008-7516.2014.05.002.
[28] 赵新河, 王剑锋, 裴疆森. 嗜热真菌Thermomyces lanuginosus TP-1的培养及其产木聚糖酶性质研究[J]. 食品与发酵工业, 2009, 35(3):58-63.
[29] BENNETT N A, BIELY P, VRSANSKA M, et al. Biochemical and catalytic properties of an endoxylanase purified from the culture fi ltrate of Themomyces lanuginosus ATCC 46882[J]. Carbohydrate Research,1998, 306(3): 445-455. DOI:10.1016/S0008-6215(97)10076-3.
[30] CESAR T, MRSA V. Purification and properties of the xylanase produced by Thermomyces lanuginosus[J]. Enzyme and Microbial Technology, 1996, 19: 289-296.
[31] LIN J, NDLOVU L M, SINGH S, et al. Purification and biochemical characteristics of β-D-xylanase from a thermophilic fungus,Thermomyces lanuginosus SSBP[J]. Applied Microbiology and Biotechnology, 1999, 30: 73-79.
[32] 李文鹏, 陈静, 廖昌珑, 等. 疏棉状嗜热丝孢菌 Thermomyces lanuginosus YNUCC4154耐碱热稳定木聚糖酶的特性及其产生菌的系统发育分析[J]. 应用于环境生物学报, 2004, 10(4): 480-483.
Screening and Identification of Heat-Resistant Xylanase-Producing Strain and Investigation of Fermentation Conditions
YANG Ran1,2, ZHANG Xiaoyu2,3, LIU Pengxiao2,3, FAN Guangsen1,2, LI Xiuting1,3,*
(1. Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Technology and Business University,Beijing 100048, China; 2. Beijing Key Laboratory of Flavor Chemistry, Beijing 100048, China;3. Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients, Beijing 100048, China)
Abstract: In this research, we isolated a thermostable xylanase-producing strain FSD0302 from Jiuqu (a traditional Chinese liquor fermentation starter) from Zibo, Shandong, and we identified it as Thermomyces lanuginosus. The fermentation conditions for the production of xylanase by this strain were investigated by one-factor-at-a-time method. The results showed that a higher xylanase activity of 5 357.1 U/mL was obtained under the following conditions: particle size of corncob xylan 20-40 mesh, xylan concentration 4 g/100 mL, initial medium pH 6.0, fermentation temperature 50 ℃, and rotational speed 200 r/min,which was 3.9 times as much as that before the optimization. The specific activity was calculated as 10 493.72 U/mg.Strain FSD0302 produced two xylanases with different molecular masses of about 20 and 60 kDa, respectively. The enzymatic properties showed that the optimum temperature was 75 ℃ for both xylanases, and the optimum pH was 5.5 and 7.5, respectively. Over 50% of the xylanase activity could be retained in the pH range of 3.5-9.0. To sum up, the thermostable xylanase from T. lanuginosus FSD0302 is promising for application in the production of xylooligosaccharides.
Keywords: Thermomyces lanuginosus; thermostable xylanase; fermentation conditions; enzymatic properties
收稿日期:2018-09-03
基金项目:国家自然科学基金青年科学基金项目(31501416);北京市自然科学基金青年科学基金项目(6164029)
第一作者简介:杨然(1987—)(ORCID: 0000-0002-0399-8254),女,实验师,硕士,研究方向为功能微生物及酶蛋白质工程。E-mail: yangran@btbu.edu.cn
*通信作者简介:李秀婷(1970—)(ORCID: 0000-0001-6767-3582),女,教授,博士,研究方向为功能微生物及酶工程。E-mail: lixting@btbu.edu.cn
DOI:10.7506/spkx1002-6630-20180903-017
中图分类号:Q814
文献标志码:A
文章编号:1002-6630(2019)18-0101-07
引文格式:杨然, 张笑雨, 刘朋肖, 等. 耐热木聚糖酶菌株的筛选鉴定及发酵条件分析[J]. 食品科学, 2019, 40(18): 101-107.DOI:10.7506/spkx1002-6630-20180903-017. http://www.spkx.net.cn
YANG Ran, ZHANG Xiaoyu, LIU Pengxiao, et al. Screening and identification of heat-resistant xylanase-producing strain and investigation of fermentation conditions[J]. Food Science, 2019, 40(18): 101-107. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20180903-017. http://www.spkx.net.cn