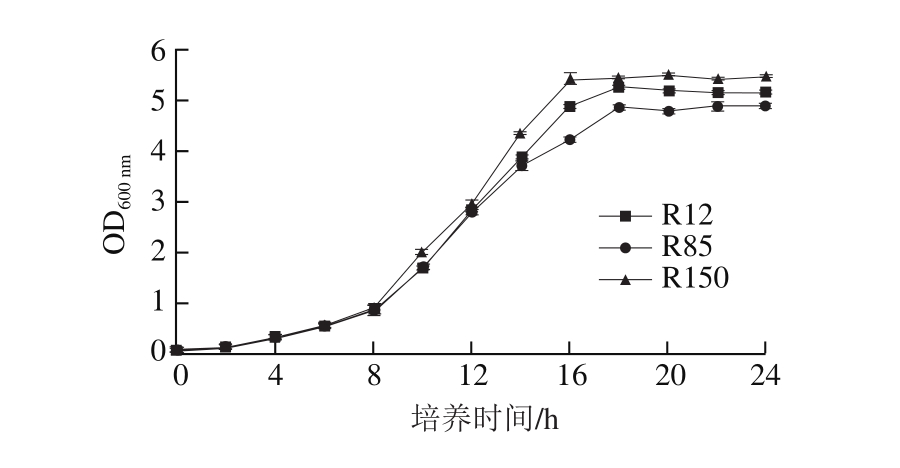
图1 T. delbrueckii菌株的生长曲线
Fig. 1 Growth curves of T. delbrueckii strains
葡萄酒发酵是一个复杂的过程,其中酵母菌起主要作用。在工业生产中,大多数的酿酒师倾向于添加商业酿酒酵母(Saccharomyces cerevisiae)完成发酵过程,以降低发酵风险。然而,传统的自然发酵并不是由单一S. cerevisiae完成的,非酿酒酵母群体在自然发酵前期占据的比例远超过S. cerevisiae。早期研究认为非酿酒酵母是葡萄酒中的败坏菌种。近年来,随着研究者对非酿酒酵母的深入研究,非酿酒酵母的潜在应用价值受到越来越多的关注,其中采用非酿酒酵母和S. cerevisiae混合发酵策略更是提升葡萄酒质量、突出葡萄酒典型性风格的重要手段。
戴尔有孢圆酵母(Torulaspora delbrueckii),也是软假丝酵母(Candida colliculosa)的无性型,广泛分布于葡萄园、葡萄表皮和酿酒环境中,是葡萄表面天然微生物群的典型代表。早在1954年,相关研究指明该菌具有高的乙醇发酵力,可作为发酵的启动菌。随后,CHR Hansen、Lallemand和Laffort公司纷纷推出了商业T. delbrueckii[1]。相对于S. cerevisiae,T. delbrueckii具有低产乙醇的特性,其产乙醇能力为8%~14%[2],相关研究表明其在低醇葡萄酒生产过程中具有积极作用[3]。T. delbrueckii在葡萄酒发酵过程中产生较少的乙酸、乙酸乙酯、乙醛等,并可以缓慢地发酵大量的糖,产生较多甘油[4-5]。另外,T. delbrueckii具有良好的环境耐受力,尤其是高糖耐受力。刘灿珍等[6]对T. delbrueckii耐受性进行分析,结果显示T. delbrueckii能够耐受18%乙醇、400 mg/L SO2和500 g/L糖;剧柠等[7]从枸杞果酒中分离获得1 株T. delbrueckiiGB-1在100~400 g/L糖、100~250 mg/L SO2的培养基中,24 h内可到达生长旺盛期;Bely等[4]将T. delbruecki运用于贵腐酒(原料含糖量350~450 g/L)酿造,不但能启动发酵,还保持着高产甘油和低产挥发酸的特性。
目前,关于优良T. delbrueckii菌株的筛选及其对葡萄酒品质的影响已成为国外研究者的热点。Renault等[5]发现接种T. delbrueckii的混合发酵提高了红葡萄酒的复杂性和果香风味。Whitener等[8]指出某些特定的戴尔有孢圆菌株可生成高浓度的萜烯化合物,包括α-萜品醇、芳樟醇、香叶醇等,从而提高琼瑶浆、雷司令等品种香气。Ramírez等[9]筛选出具有嗜杀性的T. delbrueckii,并与S. cerevisiae混合发酵,结果显示T. delbrueckii显著提高了赤霞珠成品酒的口感以及香气复杂度和浓郁度。
我国疆域辽阔,葡萄酒产区气候变化多样,优越的自然条件孕育着丰富的酵母资源,来自不同地区的酵母对葡萄酒质量的影响具有独特的地理特征[10],因此充分利用本土酵母资源,可以提高葡萄酒的“风土”特征。然而,我国关于本土酵母对葡萄酒品质影响的相关研究较少,具有葡萄酒酿造特色的本土酵母资源的分离、保藏和菌种库的建立仍然十分欠缺,对本土非酿酒酵母的开发利用更是寥寥无几。T. delbrueckii作为优良非酿酒酵母之一,具有多种应用潜力。目前我国对T. delbrueckii的关注度不高,少有的关于T. delbrueckii的研究也是泛泛介绍了非酿酒酵母的发酵特性[7,11],或是以商业T. delbrueckii为原材料[12],仅针对其对香气的影响[13],至今鲜见关本土T. delbrueckii在葡萄酒中应用的详细报道。
本实验以从甘肃祁连酒厂冰酒酿造过程中分离得到的3 株T. delbrueckii为材料,对其耐受性和发酵性能进行研究;按照小容器酿造工艺法,选取性能优良的菌株T. delbrueckii R12与S. cerevisiaeNX11424混合发酵酿造干红葡萄酒,探究不同接种方式和接种比例对发酵过程的影响,为T. delbrueckii在葡萄酒生产实践中的应用提供参考,为优质葡萄酒的风格塑造和本土葡萄酒的风土多样性表达提供理论支持。
T. delbrueckiiR12、R85、R150分离自甘肃祁连酒厂;S. cerevisiaeNX11424保藏于西北农林科技大学葡萄酒学院。
酵母基础培养基(yeast extract protein dextrose,YEPD)、WLN(Wallerstein laboratory nutrient)培养基、YEPD-亚甲基蓝(methylene blue,MB)培养基分别参照文献[14-16]。Triple M模拟汁[17]:1.25% Tween80,3.75% 95%乙醇溶液,0.012 5%麦角固醇,10%葡萄糖,10%果糖,0.6%L-(+)-酒石酸,0.3%L-(-)-苹果酸,0.05%柠檬酸,0.17% YNB,0.2%酸水解酪蛋白,0.000 6%肌醇,0.02%无水氯化钙,0.08%L-精氨酸,0.1%L-脯氨酸,0.01%DL-色氨酸,0.1%磷酸铵,氢氧化钾调pH 6.4。300 g/L和400 g/L高糖模拟汁参照Triple M模拟汁调整总糖质量浓度,葡萄糖和果糖均按照1∶1添加,其余物质质量浓度不变。
UV1800紫外分光光度计 日本岛津公司;ZHWY-2102C恒温培养振荡器 上海智城分析仪器制造有限公司;BK1301生物显微镜 重庆光电仪器有限公司。
1.3.1 菌种培养
将甘油管保藏菌划线于YEPD固体培养基,28 ℃培养2 d。在YEPD固体培养基上挑取菌落特征明显的单菌落接种于YEPD液体培养基,于28 ℃、150 r/min条件下培养24 h制成种子液。
1.3.2 生长曲线的测定
将活化菌株按2%的接种量接种于40 mL YEPD液体培养基中,28 ℃静置培养,每株菌设3 组重复。每隔2 h取样测定OD600 nm,以未接种的YEPD培养基作为空白对照。
1.3.3 耐受性实验
在试管中添加不同耐受基质(YEPD培养基)并加入杜氏管,按2%接种量接入活化菌株,28 ℃培养,设3 组重复,通过监控产气情况以确定接种菌株的生长到达稳定期后测定OD600 nm。
1.3.3.1 乙醇耐受性
灭菌之后的YEPD培养基调整初始乙醇体积分数为8%、10%、12%、14%进行实验。
1.3.3.2 SO2耐受性
灭菌之后的YEPD培养基调整SO2质量浓度为100、200、300、400、500、600 mg/L进行实验。
1.3.3.3 高糖耐受性
调整YEPD培养基初始葡萄糖质量浓度为200、300、400 g/L进行实验。
1.3.4 酵母絮凝性测定
参照文献[18]方法进行测定。
1.3.5 酵母嗜杀性检验[16]
将5 μL T. delbrueckii菌液点样于均匀涂有S. cerevisiae NX11424的YEPD-MB培养基上,25 ℃培养2~3 d。若待测菌为嗜杀菌,其周围会形成蓝色的死菌带和透明抑菌圈。
1.3.6 模拟发酵实验
配制不同糖质量浓度的模拟汁,先将酵母种子液以2%的接种量接种于50 mL模拟汁中,于25 ℃、90 r/min预培养24 h。随后将预培养的酵母细胞,以5×105 CFU/mL接种量接种于装有300 mL模拟汁的发酵瓶中,20 ℃静置发酵。发酵过程中每24 h监测CO2质量损失,连续3 d CO2质量损失不变示为发酵结束。每组重复3 次。发酵结束后,参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》[19]测定乙醇、残糖、总酸和挥发酸。
1.3.7 小容器发酵酿造干红葡萄酒
赤霞珠葡萄于2016年采自陕西张裕瑞那城堡酒庄,其总糖质量浓度为270.1 g/L,可滴定酸质量浓度为5.0 g/L(以酒石酸计),pH 3.14。
按干红葡萄酒的小容器酿造法(2 L),葡萄破碎后添加60 mg/L SO2和600 mg/L二甲基二碳酸盐杀菌处理,静置24 h。将T. delbrueckii R12与S. cerevisiae NX11424按1∶1、10∶1和20∶1的比例同时接种或顺序接种(间隔2 d接入S. cerevisiae)进行混合发酵,其中R12接种量为1×106 CFU/mL(血球板计数法),NX11424的接种量按比例计算;以R12和NX11424单独发酵为对照,接种量均为1×106 CFU/mL。发酵温度25 ℃,每个处理3 组重复。采用WLN平板计数法[15,20],依据酵母生长状况及发酵进程对发酵过程中4 个阶段(发酵启动时、糖消耗1/2时、糖消耗3/4时、发酵结束)的菌落数进行监控,其中S. cerevisiae NX11424菌落呈乳白色锥状凸起,T. delbrueckii R12菌落呈奶油色球状凸起,顶端呈绿色。通过测定还原糖监控发酵进程,发酵结束后参照GB/T 15038—2006测定葡萄酒基本理化指标。
采用Excel 2010软件进行数据统计;SPSS 16.0进行数据分析,多组间比较采用One-Way ANOVA法;Origin 8.5软件进行作图。

图1 T. delbrueckii菌株的生长曲线
Fig. 1 Growth curves of T. delbrueckii strains
如图1所示,3 株T. delbrueckii在经过约2 h的延滞期后,于接种后8 h进入生长对数期,16 h后菌体数量基本保持稳定。其中R150在YEPD培养基中的生长能力优于其他两株,生长最快,稳定期菌体数最大。
在自然发酵的早期,非酿酒酵母是葡萄汁中的优势菌,然而随着发酵的进行,其优势地位逐渐被S. cerevisiae所取代,多数非酿酒酵母在乙醇发酵旺盛期时消失。非酿酒酵母的生长主要受到发酵温度、乙醇体积分数、SO2添加量、低pH值、葡萄汁渗透压及营养等条件的影响[21]。因此,非酿酒酵母对糖、SO2、乙醇的耐受性将决定它们在葡萄酒发酵中所起的作用。
2.2.1 乙醇耐受性
在葡萄酒的生产过程中,酵母菌的主要作用是将糖代谢生成乙醇,但是当培养基中的乙醇累积到一定体积分数时,会对酵母细胞产生有毒效应。酵母的乙醇耐受性很大程度上影响了其在整个发酵过程中的存活时间和发酵活性。本研究考察T. delbrueckii在8%~14%乙醇体积分数范围内的生长状况。如图2所示,随着乙醇体积分数的增加,OD600 nm持续下降,酵母生长受到的影响越大。当乙醇体积分数在10%以内时,3 株菌均能保持一定的生长量,其中R150的生长量显著高于另外两株(P<0.05)。当乙醇体积分数升高到12%时,3 株T. delbrueckii的生长才受到明显抑制,说明本土T. delbrueckii具有较强的乙醇耐受性。相关研究也表明,与葡萄汁有孢汉逊酵母、东方伊萨酵母等多数非酿酒酵母相比,T. delbrueckii具有更强的乙醇耐受力[22],这也就确保了其在发酵过程中持续保持良好的发酵活性和正常的代谢活动。
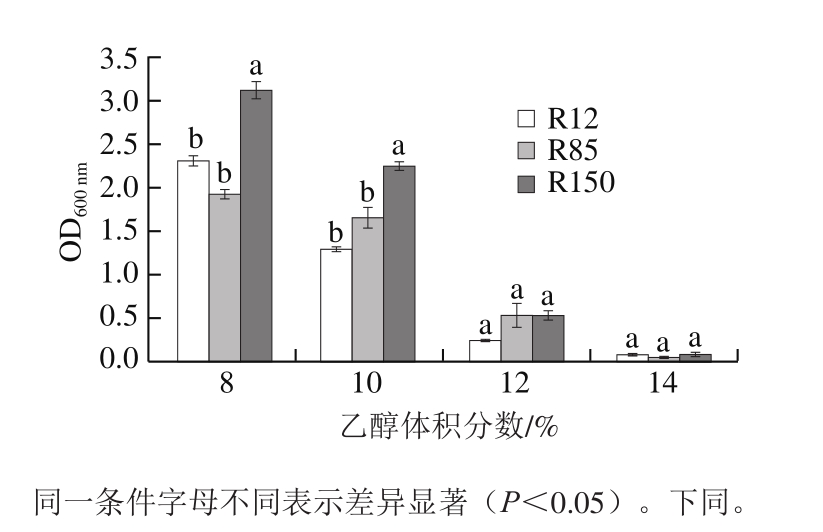
图2T. delbrueckii菌株的乙醇耐受性
Fig. 2 Ethanol tolerance ofT. delbrueckii strains
2.2.2 SO2耐受性
葡萄酒的酿造过程中,一般需要在葡萄汁中添加60 mg/L的SO2以达到抗氧化和杀菌的目的,足够的SO2耐受力能确保酵母在发酵初期快速生长繁殖。如图3所示,3 株T. delbrueckii对SO2具有较强的耐受性。当SO2质量浓度小于200 mg/L时,3 株T. delbrueckii均能很好地生长,生长状况受SO2含量影响不大。当SO2质量浓度在200~400 mg/L之间,3 株T. delbrueckii的生长随着SO2质量浓度的增大而减弱,但仍能保持一定的生物量水平(OD600 nm>2.5),其中R150的生长量高于其他两株。当SO2质量浓度大于500 mg/L,三者的生长均受到明显抑制。

图3T. delbrueckii的SO2耐受性
Fig. 3 SO2 tolerance ofT. delbrueckii strains
2.2.3 高糖耐受性
葡萄汁高糖质量浓度不仅抑制酵母生长,同时影响细胞代谢[23]。如图4所示,R150随着糖质量浓度的增加,OD600 nm呈上升趋势,400 g/L糖质量浓度下依然保持着良好的生长状况。R12和R85对糖的耐受力无显著差异,糖质量浓度为400 g/L时R85具有更大的生长量,而R12在300 g/L和400 g/L糖质量浓度下均可保持良好的生长(OD600 nm>2.5)。事实上,在高质量浓度糖发酵的初期,细胞所受到的糖抑制作用大于乙醇的作用,当糖度达到25°Brix时,乙醇发酵出现延滞;高于30°Brix时,单位糖的乙醇产率显著降低[24]。此外,高质量浓度糖造成的高渗透压促使酵母菌产生更多的乙酸,使得冰酒、贵腐等甜型葡萄酒面临挥发酸含量超标的风险[4,25]。从以上结果可见,本实验从冰葡萄汁中筛选获得的3 株T. delbrueckii对于高糖均具有很好的耐受性,这对于高糖葡萄汁发酵的顺利进行以及挥发酸含量的控制具有重要意义。

图4T. delbrueckii菌株的高糖耐受性
Fig. 4 High sugar tolerance ofT. delbrueckii strains
在葡萄酒的酿造过程中,酵母良好的絮凝性可使葡萄酒发酵液澄清速度加快,降低酵母分离的能量消耗,同时防止酵母细胞因长时间悬浮在发酵液中导致细胞自溶而影响葡萄酒风味[26],也避免因絮凝性过强而造成发酵度低[27]。在酵母菌絮凝性评价中,絮凝值为70%~100%,属于低絮凝性;絮凝值为30%~70%,属于中絮凝性;絮凝值为0%~30%,属于高絮凝性[18]。由图5可知,3 株T. delbrueckii的絮凝值为48%~68%,均满足葡萄酒酿造的需求。
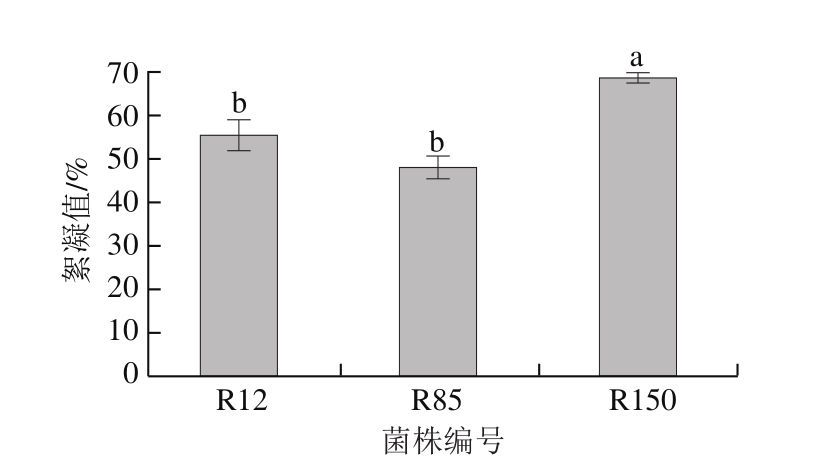
图5T. delbrueckii菌株的絮凝性
Fig. 5 Flocculation levels ofT. delbrueckii strains
嗜杀酵母在葡萄酒发酵过程中能够分泌毒素,抑制或杀死敏感细胞[16]。由图6可知,3 株T. delbrueckii周围均无蓝色死菌帯和透明圈,说明3 株T. delbrueckii均对S. cerevisiaeNX11424无嗜杀作用。
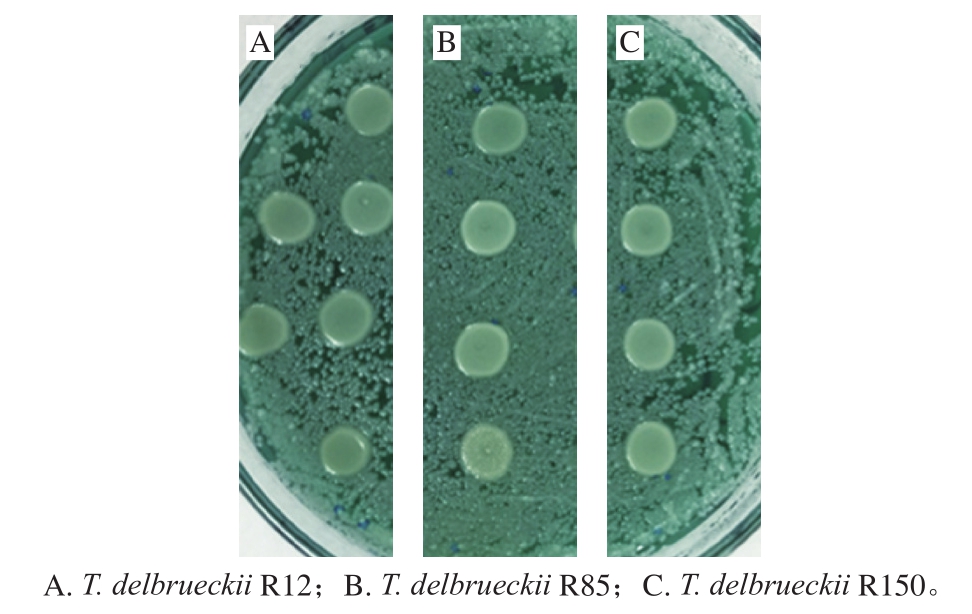
图6T. delbrueckii菌株的嗜杀性
Fig. 6 Killer activity of T. delbrueckii strains
2.5.1 发酵速率
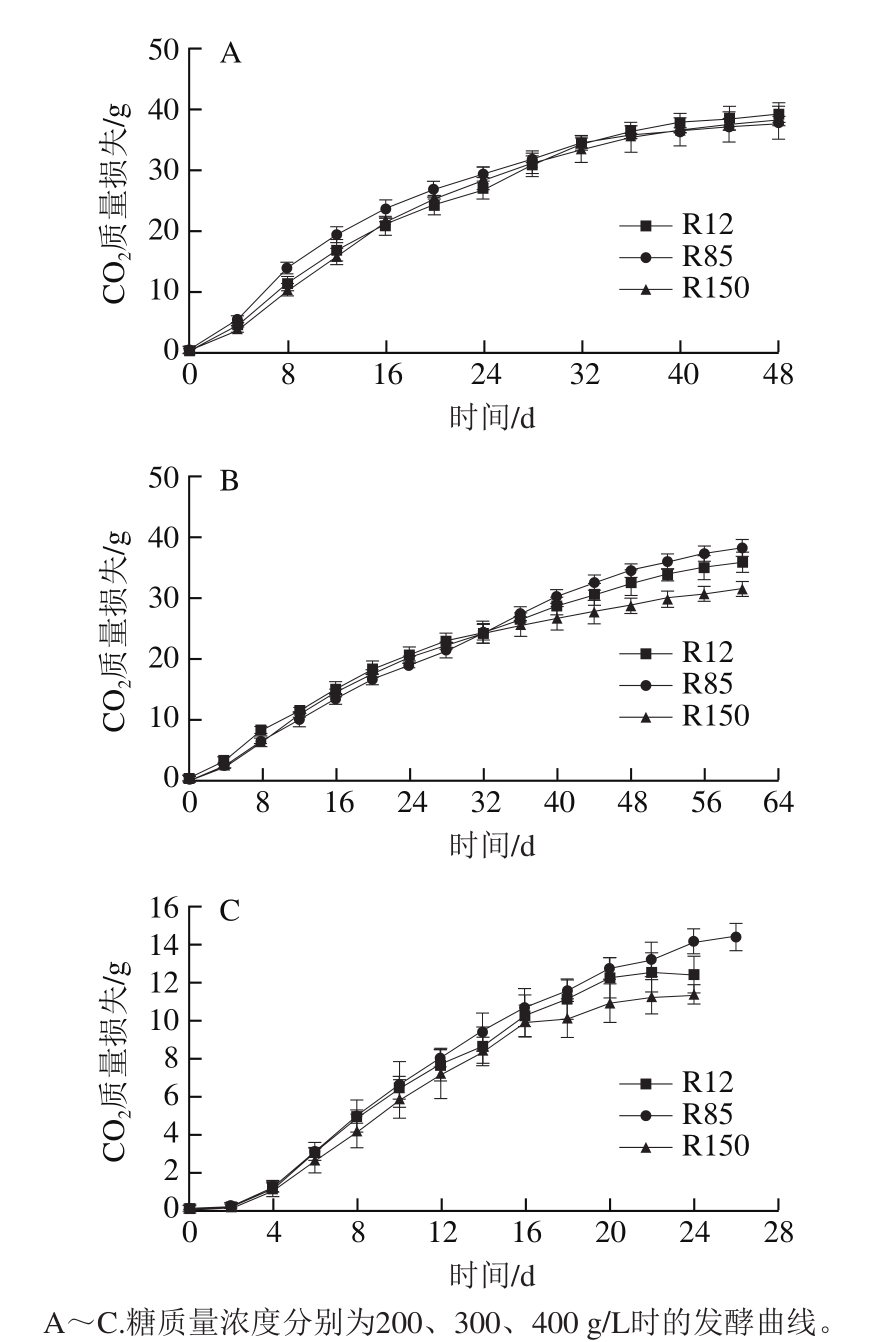
图7 不同糖质量浓度下T. delbrueckii的发酵曲线
Fig. 7 Fermentation curves ofT. delbrueckii strains at different sugar concentrations
在葡萄酒酿造过程中,期望适宜的发酵速率,因为过快的发酵速度会导致温度上升,生香过程缩短,葡萄酒品质下降[28]。本实验通过检测CO2质量损失监控模拟汁的发酵进程。由图7可知,在3 种糖质量浓度下,3 株T. delbruecki单独接种发酵时间均较长,发酵效率低,且随着糖质量浓度的升高,发酵力不断降低。这符合一般非酿酒酵母相对低发酵力的特性。在糖质量浓度为200 g/L的发酵液中,3 株菌株的发酵能力没有显著差异。在糖质量浓度为300 g/L和400 g/L的发酵液中,3 株菌的发酵能力差异显著,表现为R85>R12>R150。当糖质量浓度达到400 g/L时,3 株菌株的发酵均受到明显抑制,总CO2质量损失较另外2 个质量浓度的处理降低将近一半。
2.5.2 理化指标
表1 不同糖质量浓度下T. delbrueckii菌株发酵酒样的理化指标
Table 1 Physicochemical properties of wines fermented with three T. delbrueckii strains at different initial sugar concentrations

注:数据进行单独的Duncan检验,同一指标及糖含量的不同字母表示差异显著(P<0.05)。
糖质量浓度/(g/L) 菌株 乙醇体积分数/%残糖量/(g/L)总酸产量/(g/L)挥发酸产量/(g/L) pH 200 R12 11.51±0.03a 0.90±0.06a 4.75±0.14a 0.67±0.04a 3.01±0.02a R85 11.70±0.01a 0.94±0.01a 4.75±0.19a 0.78±0.08a 3.02±0.03a R150 11.70±0.03a 0.76±0.13b 4.84±0.14a 0.73±0.06a 3.06±0.02a 300 R12 15.23±0.02b46.10±7.23ab 4.38±0.48b 0.73±0.09a 3.38±0.01b R85 15.76±0.02a36.60±3.43b 4.90±0.16a 0.78±0.05a 3.50±0.03a R150 13.40±0.01c69.05±11.27a4.84±0.14a 0.70±0.08a 3.44±0.05a R12 5.80±0.03c295.11±9.77ab4.54±0.36a 0.43±0.04a 3.05±0.03a R85 6.75±0.01a264.99±8.66b4.72±0.27a 0.44±0.08a 3.06±0.02a R150 4.52±0.01b315.65±16.34a4.63±0.18a 0.42±0.07a 3.06±0.03a 400
如表1所示,当模拟汁糖质量浓度为200 g/L时,三者均能完成发酵,残糖量低于2 g/L,乙醇体积分数在11%左右。相较于其他两株菌,R12的挥发酸产量更低。当糖质量浓度为300 g/L时,3 株T. delbrueckii的发酵力受到不同程度的影响,残糖量均大于30 g/L,其中R12和R85发酵结束后残糖量分别为46.10 g/L和36.60 g/L,乙醇体积分数均在15%左右,R150发酵结束后残糖量则高达69.05 g/L。当糖质量浓度为400 g/L时,3 株T. delbrueckii的发酵能力急剧下降,即使是发酵能力最强的R85发酵液中残糖仍达264.99 g/L,乙醇体积分数6.75%,发酵能力较弱的R12和R150残糖量分别为295.11 g/L和315.65 g/L,乙醇体积分数分别为5.80%和4.52%。总体来看,R85对糖的利用率更高,尤其是在高糖条件下。虽然T. delbrueckii在400 g/L YEPD高糖培养基中生长良好,但在同样糖质量浓度的葡萄模拟汁中并不能很好地完成发酵,这与菌株处于不同的生长条件有关,在模拟汁的发酵过程中,酵母除受高糖渗透压胁迫,还同时受到乙醇、低pH值等多因素的影响[23]。相关研究认为T. delbrueckii作为非酿酒酵母中具有较强发酵力的菌株,能将大量的糖转化为乙醇,可独立完成乙醇度较低的某些特殊啤酒和起泡酒的酿造[29-30],这与本实验的研究结论一致。
从上述研究结果可见,T. delbrueckii单独接种进行乙醇发酵往往耗时长,且在含糖量较高的情况下难以完成发酵。因此采用混合发酵,对不同菌种“取长补短”是当前研究的一个热点,也是提高葡萄酒品质的有效方法之一。本研究综合考虑耐受性、适宜的发酵力以及对模拟汁发酵后的感官香气评价,选取香气浓郁度更强的T. delbrueckii R12与S. cerevisiae NX11424进行赤霞珠葡萄酒的混合发酵。发酵曲线如图8所示,NX11424纯种发酵的发酵速率最快,于第7天完成发酵。R12纯种发酵耗时最长,于第14天结束发酵。同时接种的3 组处理均于第9天左右完成发酵,其中处理T1发酵速率最快。顺序接种的3 组处理的发酵曲线基本一致,共耗时11 d左右完成发酵。

图8 不同接种方式和接种比例下的混合发酵曲线
Fig. 8 Time-course curves of mixed-culture fermentation with different inoculums and inoculation methods
分别在发酵过程中的4 个时期取样,采用WLN涂板计数的方法对菌株定植能力进行考察,结果如图9所示。不同处理下,T. delbrueckii和S. cerevisiae的数量在发酵过程中均呈现先上升后下降的趋势。相比于同时接种,顺序接种处理中R12的最大增值量显著提高(最大值S20约为4.0×107 CFU/mL),且一直保持到发酵结束,而对应的NX11424的最大增殖量则显著降低,但发酵结束时不同处理的数量差别不大。在不同比例的处理中,NX11424接种量的增加均导致R12增殖数量的降低。在同时接种处理中,两种酵母相互竞争,生长能力及耐受性更强的S. cerevisiae迅速占据主导地位,处于弱势地位的T. delbrueckii种群数量下降较快。从图9A、B可知,同时接种处理中,R12在st2时数量开始下降,而顺序接种处理的R12可增殖至st3。在顺序接种处理中,由于T. delbrueckii的生长空间更大,S. cerevisiae接入时T. delbrueckii数量已经到达一定的水平,再加上此时营养物质已被消耗,S. cerevisiae的增殖空间有限,较难成为优势菌群,在st3时,NX11424的数量低于R12。本实验结果表明,本土T. delbrueckii在葡萄酒酿造过程中具有良好的定植能力,在发酵初期可快速增殖,整个发酵过程中均能保持一定的生物量水平,可以影响葡萄酒的质量风格。相关研究也表明,T. delbrueckii在发酵过程中的强定植能力还能在一定程度上抑制其他有害微生物的生长,有助于提升葡萄酒的质量[31]。
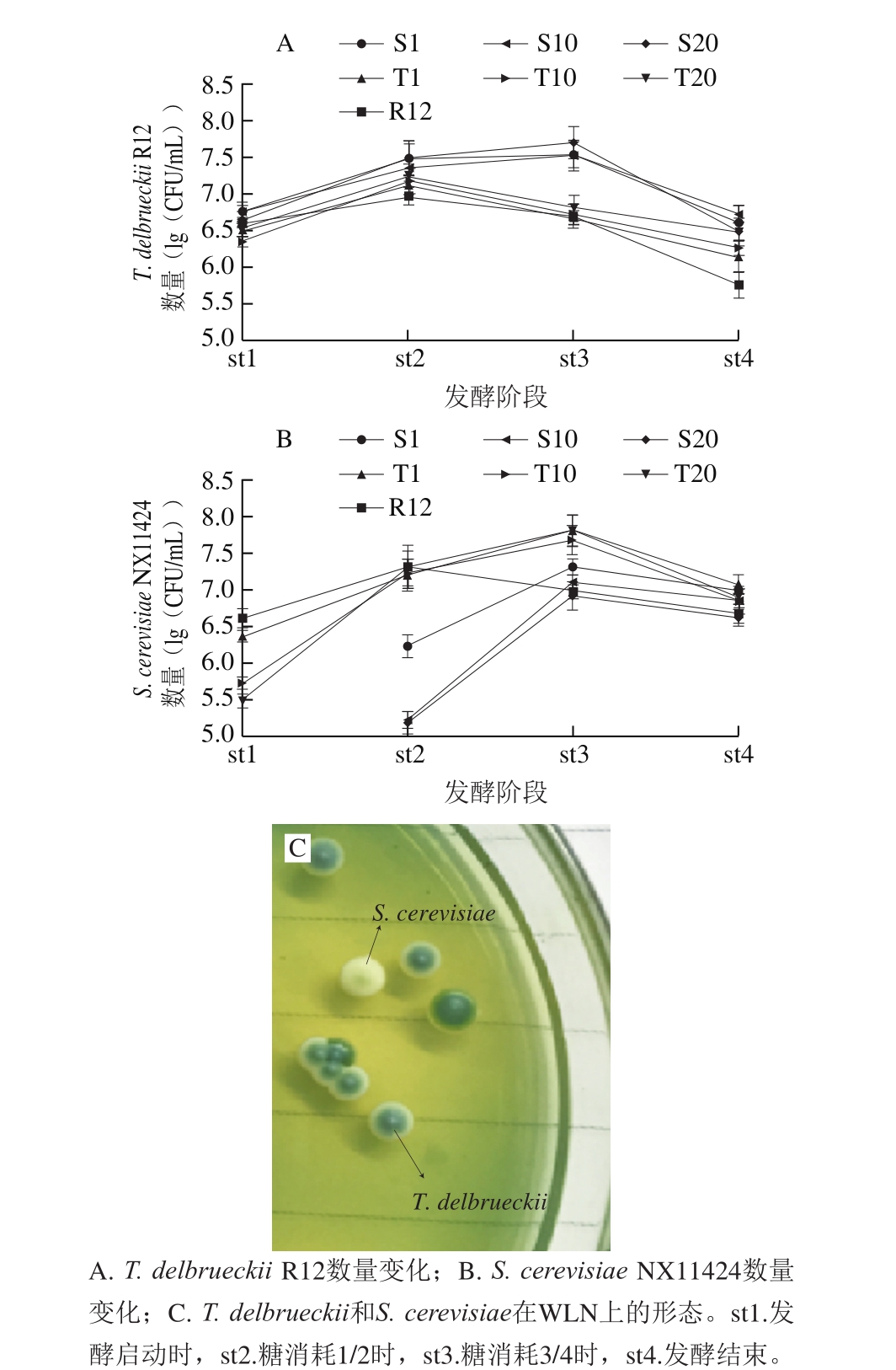
图9 不同接种处理发酵中T. delbrueckii与S. cerevisiae菌株在不同阶段的数量变化
Fig. 9 Populations of T. delbrueckii and S. cerevisiae at different stages of fermentation
表2 发酵结束后基本理化指标
Table 2 Physicochemical properties of wines fermented with pure and mixed starter cultures
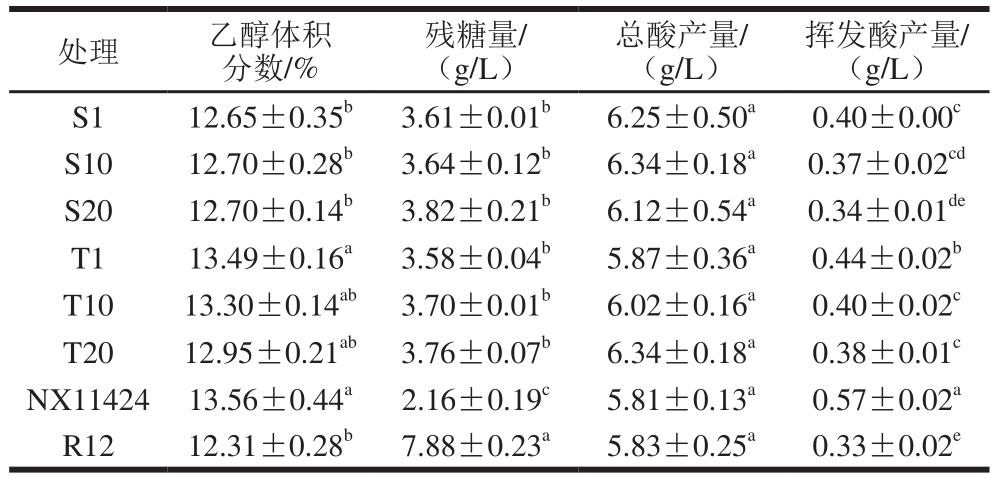
挥发酸产量/(g/L)S1 12.65±0.35b 3.61±0.01b 6.25±0.50a 0.40±0.00c S10 12.70±0.28b 3.64±0.12b 6.34±0.18a 0.37±0.02cd S20 12.70±0.14b 3.82±0.21b 6.12±0.54a 0.34±0.01de T1 13.49±0.16a 3.58±0.04b 5.87±0.36a 0.44±0.02b T10 13.30±0.14ab 3.70±0.01b 6.02±0.16a 0.40±0.02c T20 12.95±0.21ab 3.76±0.07b 6.34±0.18a 0.38±0.01c NX11424 13.56±0.44a 2.16±0.19c 5.81±0.13a 0.57±0.02a R12 12.31±0.28b 7.88±0.23a 5.83±0.25a 0.33±0.02e处理 乙醇体积分数/%残糖量/(g/L)总酸产量/(g/L)
如表2所示,除R12单独发酵,其余7 组处理发酵结束后残糖量均小于4 g/L。8 组处理的乙醇体积分数在12.0%~13.5%之间,其中NX11424单独发酵和处理T1乙醇体积分数最高,R12单独发酵乙醇体积分数最低。8 组处理的挥发酸均小于0.6 g/L,其中T. delbrueckii纯种发酵和混合发酵挥发酸产量均显著低于S. cerevisiae纯种发酵,且随着T. delbrueckii所占比例的增加,挥发酸降低幅度增大。这也与Chen Kai等[32]报道的T. delbrueckii是低挥发酸生产者的研究一致。
目前大多数葡萄酒酿造多选用商业S. cerevisiae接种发酵,其优点是发酵周期短、成品酒质量稳定。但这种同一化使酒体单一,缺乏个性。加强本土酵母资源和非酿酒酵母的开发利用有助于酿造具有地方特色、风格独特的葡萄酒。本实验以甘肃祁连产区筛选出的3 株T. delbrueckii为研究对象,通过对其生长特性、絮凝性以及乙醇、SO2、高糖耐受性的分析发现,3 株T. delbrueckii均具有良好的生长能力以及较好的高乙醇、高糖质量浓度等逆境耐受性和中等絮凝性。为进一步探究本土T. delbrueckii在实际葡萄酒酿造中的应用潜能,本研究选择T. delbrueckii R12与S. cerevisiae NX11424按照不同接种方式和接种比例混合发酵酿造赤霞珠干红葡萄酒。混合发酵6 组处理均能完成乙醇发酵,且R12在发酵过程中,均保持了良好的定植能力,其中顺序接种处理中R12的增殖量更大。另外,T. delbrueckii的接种比例对挥发酸含量有显著影响,R12接种比例越大,发酵酒样中挥发酸的含量则越低,这对甜型葡萄酒的酿造具有重要意义。
充分利用本土酵母资源,合理运用混菌发酵策略,既降低了发酵过程中的不可预测性,又保留了非酿酒酵母的代谢足迹,是有效解决成品酒风格单一的方法之一。本研究结果表明本土T. delbrueckii在葡萄酒的酿造中具有较大的应用价值,在后续研究中,将进一步研究其与S. cerevisiae互作及对不同类型葡萄酒品质指标的全面影响,以期为我国优良本土S. cerevisiae的选育工作及酿造风格多样化的葡萄酒提供指导。
[1] BENITO S. The impact of Torulaspora delbrueckii yeast in winemaking[J]. Applied Microbiology & Biotechnology, 2018, 102(7):3081-3094. DOI:10.1007/s00253-018-8849-0.
[2] CONTRERAS A, HIDALGO C, HENSCHKE P A, et al. Evaluation of non-Saccharomyces yeasts for the reduction of alcohol content in wine[J]. Applied & Environmental Microbiology, 2014, 80: 1670-1678. DOI:10.1128/aem.03780-13.
[3] CANONICO L, AGARBATI A, COMITINI F, et al. Torulaspora delbrueckii in the brewing process: a new approach to enhance biof l avour and to reduce ethanol content[J]. Food Microbiology, 2016,56: 45-51. DOI:10.1016/j.fm.2015.12.00.
[4] BELY M, STOECKLE P, MASNEUF-POMARÈDE I, et al.Impact of mixed Torulaspora delbrueckii-Saccharomyces cerevisiae culture on high-sugar fermentation[J]. International Journal of Food Microbiology, 2008, 122: 312-320. DOI:10.1016/j.ijfoodmicro.2007.12.023.
[5] RENAULT P, COULON J, DE REVEL G, et al. Increase of fruity aroma during mixed T. delbrueckii/S. cerevisiae wine fermentation is linked to specific esters enhancement[J]. International Journal of Food Microbiology, 2015, 207: 40-48. DOI:10.1016/j.ijfoodmicro.2015.04.037.
[6] 刘灿珍, 董书甲, 姜凯凯, 等. 5 株非酿酒酵母的耐受性及发酵特性研究[J]. 中国酿造, 2017, 36(10): 42-46. DOI:10.11882/j.issn.0254-5071.2017.10.010.
[7] 剧柠, 赵梅梅, 柯媛, 等. 枸杞果酒用非酿酒酵母的分离筛选及香气成分分析[J]. 食品与发酵工业, 2017, 43(11): 125-131.DOI:10.13995/j.cnki.11-1802/ts.014953.
[8] WHITENER M E B, STANSTRUP J, CARLIN S, et al. Effect of non-Saccharomyces yeasts on the volatile chemical profile of Shiraz wine[J]. Australian Journal of Grape & Wine Research, 2017, 23(2):179-192. DOI:10.1111/ajgw.12269.
[9] RAMÍREZ M, VELÁZQUEZ R, MAQUEDA M, et al. Inf l uence of the dominance of must fermentation by Torulaspora delbrueckii on the malolactic fermentation and organoleptic quality of red table wine[J].International Journal of Food Microbiology, 2016, 238: 311-319.DOI:10.1016/j.ijfoodmicro.2016.09.029.
[10] 刘宁. 本土酿酒酵母对葡萄酒质量的影响及优良菌株的筛选[D].杨凌: 西北农林科技大学, 2015.
[11] 王曦, 田瑞华, 万永青, 等. 两株野生沙棘酵母菌株的分子生物学鉴定及其发酵特性[J]. 酿酒科技, 2012(5): 60-64. DOI:10.13746/j.njkj.2012.05.026.
[12] 原苗苗, 姜凯凯, 孙玉霞, 等. 戴尔有孢圆酵母对葡萄酒香气的影响[J]. 食品科学, 2018, 39(4): 99-105. DOI:10.7506/spkx1002-6630-201804015.
[13] ZHANG B Q, LUAN Y, DUAN C Q, et al. Use of Torulaspora delbrueckii co-fermentation with two Saccharomyces cerevisiae strains with different aromatic characteristic to improve the diversity of red wine aroma profile[J]. Frontiers in Microbiology, 2018, 9: 606.DOI:10.3389/fmicb.2018.00606.
[14] 李丽, 李莹, 冯莉, 等. 酿酒酵母单倍体的分离及其产高级醇和乙酯类化合物的特性[J]. 中国食品学报, 2018, 18(6): 83-92.DOI:10.16429/j.1009-7848.2018.06.012.
[15] 杨莹, 徐艳文, 薛军侠, 等. WL营养琼脂对葡萄酒相关酵母的鉴定效果验证[J]. 微生物学杂志, 2007, 27(5): 75-78. DOI:10.3969/j.issn.1005-7021.2007.05.017.
[16] 李丽, 冯莉, 秦义, 等. 野生嗜杀白假丝酵母LFA418的产毒条件优化及其毒素粗提物特性[J]. 食品科学, 2017, 38(12): 50-56.DOI:10.7506/spkx1002-6630-201712008.
[17] SPIROPOULOS A, TANAKA J, FLERIANOS I, et al.Characterization of hydrogen sulfide formation in commercial and natural wine isolates of Saccharomyces[J]. American Journal of Enology & Viticulture, 2000, 51(3): 233-248.
[18] 张博润, 陈蔚. 酵母菌絮凝的分型及其生理生化特性的研究[J].微生物学报, 1999, 49(6): 527-532.
[19] 国家质量监督检验检疫总局. 葡萄酒、果酒通用分析方法: GB/T 15038—2006[S]. 北京: 中国标准出版社, 2006.
[20] 王华. 葡萄酒分析检验[M]. 杨凌: 西北农林科技大学出版社, 2004.
[21] 娜日苏, 苏亚拉图, 高凤芹. 耐高温耐酸耐酒精酵母的筛选与鉴定[J]. 草叶科学, 2013, 30(10): 1625-1632.
[22] 王晓昌, 李京宁, 张惠玲, 等. 优良非酿酒酵母的分离与发酵性能研究[J]. 酿酒科技, 2016(6): 57-60. DOI:10.13746/j.njkj.2015474.
[23] 朱宝生, 刘功良, 白卫东, 等. 耐高糖酵母筛选及其高糖胁迫机制的研究进展[J]. 中国酿造, 2016, 35(6): 11-14. DOI:10.11882/j.issn.0254-5071.2016.06.003.
[24] 杨经洲, 童忠东. 红酒生产工艺与技术[M]. 北京: 化学工业出版社,2014.
[25] HEIT C, MARTIN S J, YANG F, et al. Osmoadaptation of wine yeast(Saccharomyces cerevisiae) during icewine fermentation leads to high levels of acetic acid[J]. Journal of Applied Microbiology, 2018,124(6): 1506-1520. DOI:10.1111/jam.13733.
[26] 韩北忠, 李双石, 陈晶瑜, 等. 葡萄酒酿酒酵母菌基因工程改良[J].中国酿造, 2007, 26(5): 1-3. DOI:10.3969/j.issn.0254-5071.2007.05.001.
[27] 牟玉艳. 啤酒酵母絮凝性的讨论[J]. 啤酒科技, 2007(2): 36; 38.DOI:10.3969/j.issn.1008-4819.2007.02.020.
[28] 庄齐斌. 基于ANSYS在干红葡萄酒发酵过程中对发酵罐内温度场的模拟分析研究[D]. 杨凌: 西北农林科技大学, 2011.
[29] CANONICO L, COMITINI F, CIANI M. Torulaspora delbrueckii contribution in mixed brewing fermentations with different Saccharomyces cerevisiae strains[J]. International Journal of Food Microbiology, 2017, 259: 7-13. DOI:10.1016/j.ijfoodmicro.2017.07.017.
[30] CANONICO L, COMITINI F, CIANI M. Torulaspora delbrueckii,for secondary fermentation in sparkling wine production[J]. Food Microbiology, 2018, 74: 100-106. DOI:10.1016/j.fm.2018.03.009.
[31] SIMONIN S, ALEXANDRE H, NIKOLANTONAKI M, et al.Inoculation of Torulaspora delbrueckii as a bio-protection agent in winemaking[J]. Food Research International, 2018, 107: 451-461.DOI:10.1016/j.foodres.2018.02.034.
[32] CHEN K, ESCOTT C, LOIRA I, et al. Use of non-Saccharomyces yeasts and oenological tannin in red winemaking: inf l uence on colour,aroma and sensorial properties of young wines[J]. Food Microbiology,2018, 69: 51-63. DOI:10.1016/j.fm.2017.07.018.
Oenological Potential of Indigenous Torulaspora delbrueckii for Winemaking
叶冬青(1986—)(ORCID: 0000-0002-1727-0811),女,助理研究员,博士,研究方向为发酵微生物与食品风味。E-mail: yedongqing@nwafu.edu.cn
刘延琳(1966—)(ORCID: 0000-0001-5652-0003),女,教授,博士,研究方向为酿酒微生物。E-mail: yanlinliu@nwsuaf.edu.cn
YANG Shini, YE Dongqing, JIA Hongshuai, et al. Oenological potential of indigenous Torulaspora delbrueckii for winemaking[J]. Food Science, 2019, 40(18): 108-115. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180914-142. http://www.spkx.net.cn