藏灵菇(又称开菲尔粒)是由多种乳酸菌、酵母菌和醋酸菌稳定共生形成的特殊粒状或片状化合物[1],能够同时进行乳酸、乙酸、乙醇发酵[2],是开菲尔传统乳制品的发酵剂,同时也是潜在功能性乳品发酵剂来源[3]。研究表明,藏灵菇发酵乳中含有大量的乳酸菌胞外多糖(exopolysaccharide,EPS),该类多糖对机体安全无毒副作用[4]且具有多种生理功能,如调节血脂血压、提高免疫力[5]、减少氧化损伤[6]、抗肿瘤、改善调节肠道微生态环境[7]、抑制有害菌的黏附等。产EPS的乳酸菌应用到发酵食品中,可以改善食品的质构、口感、流变学特性和风味等指标,如防止乳清析出、提高黏稠度、凝乳强度等,同时赋予产品一定的营养保健功效[8-9]。除了可以对肠道微生物起到益生元的作用外,Russo等[10]发现将乳酸菌EPS加入培养基中,能够对植物乳杆菌WCFS1和嗜酸乳杆菌NCFM的生长起促进作用。这些功能使得乳酸菌EPS在食品和非食品工业倍受青睐,正日益引起人们的广泛关注。
近年来,研究表明菊粉、低聚半乳糖等糖类物质能够在发酵乳制品中对发酵菌株起到促进作用[11-13],而乳酸菌EPS受限于实际生产中转化效率较低[8],目前研究主要集中在EPS的生理活性以及高产乳酸菌EPS的筛选应用上,关于EPS直接应用于乳制品发酵的研究比较少见,尤其是EPS对发酵乳风味的贡献还没有明确结论。因此,本研究分离纯化藏灵菇发酵产生的EPS,采用红外光谱、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用、扫描电镜、原子力显微镜等研究其结构特性,并将此EPS应用于切达干酪中,进一步研究其对发酵过程以及干酪品质的影响,以期为深入研究藏灵菇EPS在发酵乳制品中的应用提供参考。
藏灵菇 实验室保藏;生牛乳(蛋白质3.09%,脂肪3.43%,乳糖3.91%) 北京市沙河春山奶牛场;脱脂乳粉 新西兰恒天然乳业集团;商品发酵剂R-704、商品凝乳酶CHY-MAX 丹麦科汉森公司;单糖标准品(鼠李糖、阿拉伯糖、木糖、果糖、甘露糖、葡萄糖、半乳糖) 美国Sigma公司;DEAE-Sepharose Fast Flow离子色谱柱 英国Waterman公司;Sepharose CL-6B凝胶柱美国Amersham Bioscience公司;透析袋(截流分子质量为8 000~14 000 Da) 北京鼎国生物技术有限公司。
高压蒸汽灭菌锅 日本Sanyo公司;恒温培养箱上海一恒仪器科技有限公司;数显pH计 上海Mettler-Toledo仪器有限公司;SU8020场发射扫描电子显微镜、紫外-可见分光光度计、高速冷冻离心机 日本Hitachi公司;TENSOR 27红外光谱仪、原子力显微镜 德国布鲁克仪器公司;7890A-7000 GC-MS联用仪 美国Agilent公司。
1.3.1 培养基的配制
脱脂乳培养基 将质量分数10%的脱脂乳粉用蒸馏水还原制成脱脂乳培养基,115 ℃灭菌15 min。
SDM液体培养基(1 L):胰蛋白胨10 g、YNB(酵母氮源)6.7 g、K2HPO4 2 g、无水乙酸钠5 g、柠檬酸钠5 g、MgSO4·7H2O 0.2 g、MnSO4·H2O 0.05 g、葡萄糖20 g、吐温80 1 mL,1 mol/L乙酸调pH值为6.6,121 ℃灭菌15 min。
1.3.2 EPS的提取与产量测定
在实验室保藏藏灵菇中,根据藏灵菇发酵乳凝乳时间、黏度及拉丝长度选取7 个较优样品,使用脱脂乳培养基活化后,取5 g于100 mL无菌SDM液体培养基中37 ℃恒温发酵18 h,然后100 ℃水浴加热15 min以灭活可能降解多糖的酶类。EPS的提取参考Rimada等[14]的方法,向藏灵菇发酵液中加入80%的三氯乙酸溶液至终质量分数为4%,室温下搅拌2 h后,10 000 r/min、4 ℃条件下离心45 min,去除细胞和蛋白。取上清液并加入两倍体积的无水乙醇,4 ℃冷藏静置12 h,10 000 r/min、4 ℃条件下离心30 min。沉淀用蒸馏水溶解,装入透析袋中透析24 h,每8 h换一次蒸馏水。之后使用苯酚-硫酸法测定EPS产量。
1.3.3 EPS的分离纯化与鉴定
1.3.3.1 DEAE-Sepharose Fast Flow阴离子色谱柱纯化EPS
使用超纯水配制20 mg/mL的粗多糖冻干粉,依次用超纯水(第1~30管)、0.2 mol/L NaCl缓冲液(第31~70管)、0.5 mol/L的 NaCl缓冲液(第71~100管)在阴离子交换柱上以1 mL/min的流速进行洗脱,洗脱液收集量为5 mL/管,检测每管洗脱液的OD490 nm,合并含有多糖的洗脱液,透析冻干,4 ℃保存。
1.3.3.2 Sepharose CL-6B凝胶柱层析纯化EPS
将上一步得到的多糖组分使用0.9%的NaCl缓冲液配制成2 mg/mL的多糖溶液。使用0.9% NaCl溶液在Sepharose CL-6B凝胶柱上以1 mL/min的流速对多糖样品再进一步纯化,每管收集5 mL并检测OD490 nm,合并含有多糖的洗脱液,透析冻干,4 ℃保存。
1.3.3.3 红外光谱分析
将2 mg纯化的EPS冻干粉末和200 mg溴化钾粉末混合均匀,并用压片法压成薄片状,记录并观察4 000~400 cm-1范围内EPS样品的红外光谱。
1.3.3.4 扫描电镜观察EPS分子形貌
将5 mg纯化的EPS冻干粉样品,均匀粘在云母片表面,喷金后使用扫描电镜在2 000 倍和4 000 倍下观察多糖分子形貌。
1.3.3.5 原子力显微镜观察EPS分子形貌
使用超纯水制备质量浓度为1 mg/mL的纯化EPS,在氮气保护下搅拌至充分溶解后,梯度稀释成10 μg/mL的溶液并使用原子力显微镜进行观察。
1.3.3.6 单糖组成
单糖组成的分析方法采用Wang Ji等[15]的方法。
1.3.4 EPS对发酵剂的作用研究
1.3.4.1 EPS对发酵剂生长的影响
在EPS添加量分别为0%、0.5%的MRS液体培养基中添加0.1 g/100 mL的商品发酵剂R-704,连续培养24 h并检测OD630 nm值[12]。
1.3.4.2 EPS含量对发酵乳pH值的影响
在生牛乳中分别添加0%、0.5%、1%、1.5%、2%、2.5%和3%的EPS,65 ℃杀菌30 min,冷却至室温,加入质量分数0.1%的商品发酵剂R-704,37 ℃培养6 h后测定pH值。
1.3.5 干酪的理化及微生物指标测定
1.3.5.1 切达干酪的制作
切达干酪制作参考郝晓娜等[16]的方法。生牛乳65 ℃杀菌30 min,室温冷却至31 ℃后添加0.1%的商品发酵剂R-704,并在菊粉组、EPS组分别添加1%的菊粉和EPS。在37 ℃保温发酵,pH值降至6.5后以0.002 5 g/L的比例添加凝乳酶CHY-MAX,32 ℃静置40 min待乳凝固后用干酪刀切割成小块,升温至41 ℃顺时针缓慢搅拌30 min,便于乳清析出,当pH值降至6.2时排乳清,并于40 ℃堆酿,当pH值为5.5时,绞碎凝块,加入质量分数1.5%的食盐,然后装入干酪模具压榨。真空包装,并于4 ℃条件下成熟12 周。
1.3.5.2 干酪得率的测定
干酪得率作为判断干酪制作方法、设置工艺参数是否合理,是否适合生产应用的重要指标,其计算公式如下:
式中:M0为干酪质量;M1为牛乳质量;M2为发酵剂质量;M3为盐质量。
1.3.5.3 干酪含水量的测定
干酪含水量的测定:参考GB 5009.3—2016《食品中水分的测定》[17]。
1.3.5.4 干酪保水率的测定
各组取3 g干酪样品,4 500 r/min离心15 min,去上清液,称量并作记录,计算公式如下:
式中:M0为空离心管质量;M1为离心管加样品的质量;M2为样品离心除去上清液后的离心管加样品质量。
1.3.5.5 干酪微生物指标与pH值的测定
干酪成熟期间每2 周取样一次,采用MRS平板涂布法检测干酪样品中乳酸菌的活菌数。准确称取1 g干酪磨碎后加入9 mL无菌生理盐水中搅拌至溶解,梯度稀释至一定倍数,吸取100 μL稀释液均匀涂布于MRS培养基,37 ℃静置培养48 h后进行菌落计数。
准确称取10 g磨碎的干酪加入12 mL的蒸馏水中,匀浆处理使其混合均匀后,4 500 r/min离心15 min后去除上层脂肪,取下层溶液测pH值。
1.3.5.6 干酪风味的测定
固相微萃取(solid-phase microextraction,SPME)法提取挥发性风味物质:萃取前将SPME纤维置于GC-MS进样口老化。取10 g干酪和1 μL内标物2-甲基-3-庚酮于30 mL萃取瓶中,内标物质量浓度为0.816 μg/μL,加盖密封,在60 ℃恒温水浴下平衡30 min后,将SPME萃取纤维通过瓶盖插入样品中的顶空部分,推出纤维,顶空吸附30 min后拔出;快速插入GC-MS进样口解吸5 min,进行GC-MS联用分析。
GC条件:采用DB-5(30 m×0.25 mm,0.25 μm)色谱柱进行分析。升温程序:起始柱温40 ℃,保持3 min;以5 ℃/min升温到200 ℃;以10 ℃/min升至230 ℃,保持3 min;载气(He)流速1.2 mL/min,不分流进样。
MS条件:电子电离源,电子能量70 eV,传输线温度280 ℃,离子源温度230 ℃,四极杆温度150 ℃,质量扫描范围m/z 40~250。
1.3.5.7 风味物质香气活性值(odor activity value,OAV)的计算:
式中:Ci为化合物的含量/(μg/g);OTi为该化合物在水中的嗅觉阈值/(mg/kg)。
综合藏灵菇发酵乳的凝乳时间、黏度及拉丝长度,从30 种藏灵菇样品中筛选出的7 个较优样品的EPS产量如图1所示,确定藏灵菇KW1具有最高的EPS产量,为624.82 mg/L,与其他组有显著差异(P<0.05)。在相似培养、检测条件下,与其他类似研究报道的EPS产量相比[15,18-20],也处于较高水平,同时Bouzar等[21]指出乳酸菌EPS的产量一般都比较低(50~425 mg/L),因此藏灵菇KW1具有良好的EPS生产前景。
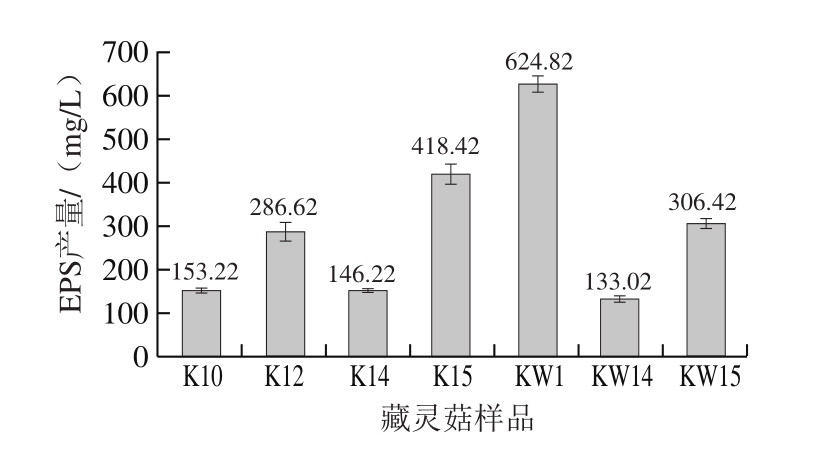
图1 藏灵菇EPS产量
Fig. 1 Production of EPS from Tibet kefir
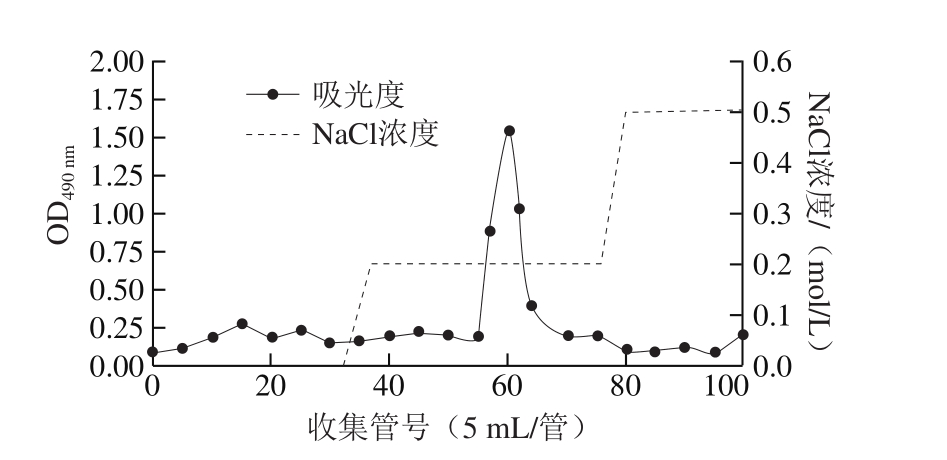
图2 EPS经阴离子交换色谱柱分离得到的洗脱曲线
Fig. 2 Elution curve of the EPS separated by anion exchange chromatography

图3 EPS经Sepharose CL-6B凝胶柱纯化的洗脱曲线
Fig. 3 Elution curve of the EPS purified by Sepharose CL-6B gel permeation chromatography
如图2所示,藏灵菇KW1发酵培养物经除蛋白处理、醇沉、透析和冷冻干燥后得到的粗多糖,在阴离子交换色谱层析中被0.2 mol/L NaCl盐溶液洗脱下来,表明此EPS是酸性多糖或者带有酸性基团[22]。通过Sepharose CL-6B凝胶色谱柱进一步纯化,不同大小的分子被洗脱分开,产生单一洗脱峰(图3),获得纯化EPS并用于后续理化分析。

图4 藏灵菇KW1纯化EPS的红外光谱图
Fig. 4 IR spectrum of the purified EPS from Tibet kefir KW1
图4 显示了藏灵菇KW1 EPS的红外光谱分析结果。在3 420 cm-1附近的峰主要是由羟基的伸缩振动引起的峰,可能是来源于样品吸附的水分、样品分子内的羟基或分子间氢键的拉伸峰[23];在2 925 cm-1附近的峰主要是由甲基或亚甲基的C—H键的伸缩振动引起的峰;在1 645 cm-1附近的峰主要是由羰基的伸缩振动引起的峰,这个峰是多糖的特征吸收峰[24];1 563 cm-1和1 384 cm-1处的峰是羧基中C=O的对称伸缩振动峰[25];1 231 cm-1和1 076 cm-1处的峰是C—O键的伸缩振动峰,其来源可能为C—O—H,或是糖环中的C—O—C,也有可能为缩醛键[23];874 cm-1说明可能存在α-糖苷键[26]。
对藏灵菇KW1提取纯化后的EPS进行水解和乙酰化后,得到相应的衍生物,并通过气相色谱测得藏灵菇KW1产EPS的气相色谱图(图5B),与标准单糖色谱图(图5A)对比后可知,藏灵菇KW1 EPS由鼠李糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖组成,相对物质的量比为1∶3.02∶2.12∶1.59∶3.04,与红外光谱结果一致。其他EPS组成的研究发现,植物乳杆菌KF5所产EPS是由甘露糖、葡萄糖和半乳糖按照物质的量比例1∶4.99∶6.90组成[23];来自双歧杆菌22-5的EPS主要含有木糖、半乳糖、葡萄糖、阿拉伯糖、鼠李糖和岩藻糖[27];副干酪乳杆菌34-1产生的EPS只含有半乳糖,清酒乳杆菌O-1产生的EPS则含有葡萄糖和鼠李糖[28]。刘翠平等[29]发现,干酪乳杆菌LC2W使用葡萄糖作为碳源得到的EPS由鼠李糖、葡萄糖、半乳糖组成,而使用乳糖作为碳源得到的EPS则是由甘露糖、葡萄糖、半乳糖组成。因此EPS的单糖组成受到菌株类型、培养条件等因素的影响,藏灵菇KW1在其他培养条件下可能能够产生不同组成的EPS。

图5 单糖标准品(A)和藏灵菇KW1纯化EPS(B)的GC-MS联用分析图
Fig. 5 GC-MS analysis of monosaccharide standards (A) and the puri fi ed EPS (B)
藏灵菇KW1 EPS的扫描电镜观察如图6所示,EPS显示出相对稳定的三维微观结构(图6A),EPS表面粗糙呈颗粒状,整体上呈致密的网状结构,内部分布着许多大小形状相似的球形结构和不规则片状结构。进一步放大倍数可以看出(图6B),EPS表面结构紧致光滑,这种较为稳定的结构,可以赋予EPS特殊的流变学性质,例如提升产品的黏度、改善质构和保水特性[30]。据报道,从藏灵菇中筛选分离出的L. kefiranofaciens ZW3所产的EPS也具有类似的分子形貌[31]。而另一株从藏灵菇中筛选分离的植物乳杆菌KF5,其所产的EPS呈不规则片状[23]。

图6 藏灵菇KW1纯化EPS的扫描电镜图
Fig. 6 Scanning electron micrographs of the purified EPS
平面图像(图7A)显示,EPS分布不均匀,在某些区域EPS结构紧密呈膜状,这说明EPS发生了聚集,在多糖质量浓度大的区域,羟基数目多,分子间的氢键缔合作用增强,多糖聚合较紧密,形成膜状结构[32]。在立体图像(图7B)中,可以观察到EPS表现出高低不平、分布不均的状态,平面图像中的膜状区域呈现出紧密的簇状结构,而在其他区域可以看到多糖分子形貌如尖锥状结构,高度在2.4 nm左右。

图7 藏灵菇KW1 EPS的原子力显微图像
Fig. 7 Atomic force microscopy images of the purified EPS
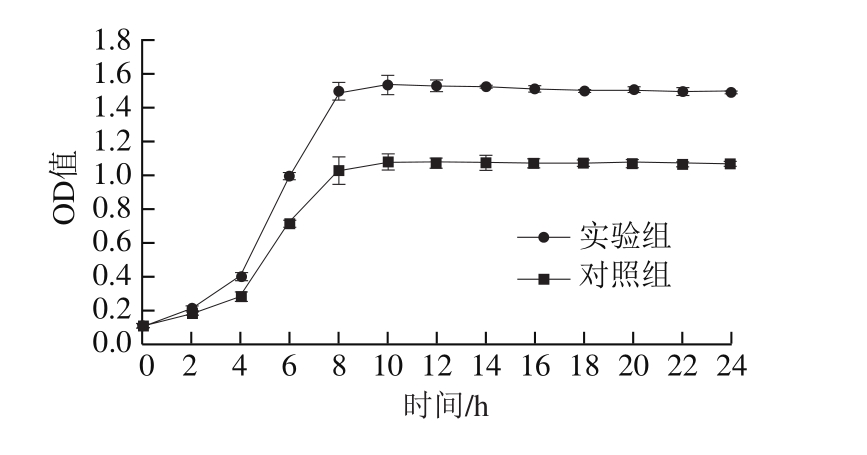
图8 EPS对发酵剂菌株生长的影响
Fig. 8 Effect of EPS on growth of the starter culture
如图8所示,在两组液体培养基中,发酵剂菌株在调整期都生长缓慢,曲线较接近,3~4 h之后均进入对数生长期,菌株生长速度加快,但实验组菌株的生长情况明显要优于对照组,并且进入稳定期后,实验组发酵液OD值显著高于对照组(P<0.05),表明EPS可能起到益生元的作用,从而促进发酵剂菌株的生长,也有可能EPS被微生物利用,为其稳定期的生长补充培养基营养的不足。
从图9可以看出,EPS的添加量对发酵剂产酸有着显著影响。随着EPS添加量的提高,发酵乳产酸呈现先升后降的趋势;在添加量为1%时,pH值降至约4.5,产酸达到最大值,说明在EPS的低添加量范围内,随着添加量的增加,其对发酵剂菌株的生长具有逐步增强的促进作用;添加量高于1%时,EPS对菌株的促生长作用随着其添加量的升高而逐渐减弱,甚至可能抑制菌株的生长。这点与菊粉类似,曹永强等[33]发现,菊粉对乳酸菌有促生长作用,但是浓度过高会抑制乳酸菌的生长。

图9 EPS添加量对发酵乳pH值的影响
Fig. 9 Effect of different amounts of EPS addition on pH of fermented milk
2.7.1 EPS对干酪得率、保水率的影响
表1 干酪得率、保水率
Table 1 Yield and water retention rate of cheese

注:不同字母表示差异显著(P<0.05)。
组别 空白组 菊粉组 EPS组得率 7.92±0.21a 8.23±0.26b 8.19±0.22b保水率 72.19±0.70a 81.45±1.23b 80.13±0.80b
如表1所示,空白组干酪的得率、保水率与实验组干酪有显著差异(P<0.05),而菊粉组和EPS组得率、保水率无显著差异(P>0.05),均能有效提高干酪得率,增加干酪保水率,这可能与菊粉和EPS能够一定程度上改善干酪内部三维结构稳定性有关[11]。
2.7.2 EPS对干酪理化指标和微生物指标的影响
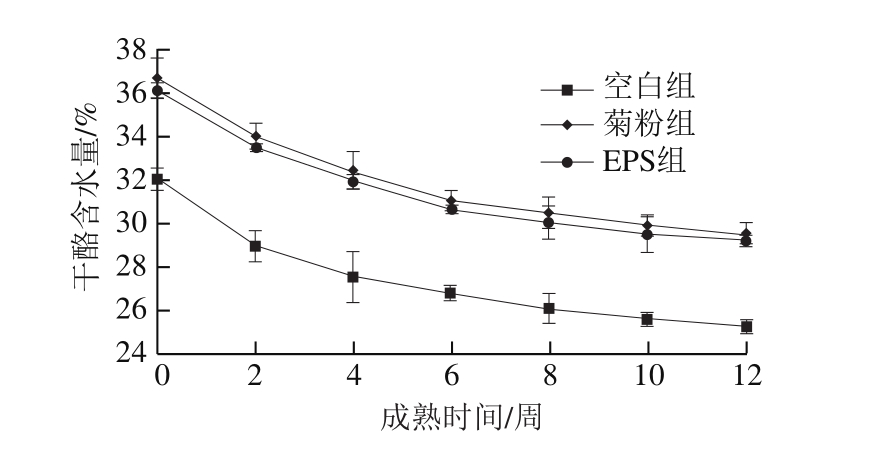
图10 干酪成熟期间含水量变化
Fig. 10 Changes in moisture content during cheese ripening
如图10所示,在干酪成熟的过程中,干酪含水量随着成熟时间的延长而下降,下降速度逐渐减慢;添加有菊粉、EPS的实验组干酪含水量显著高于空白组(P<0.05),与郝晓娜等[16]添加产EPS菌株制备切达干酪的结果相似,这可能与菊粉、EPS强化干酪结构结合更多的水有关。而成熟期间各组干酪的pH值(图11)逐步降低,之后趋于稳定,菊粉的加入对干酪pH值的影响比较明显,而空白组与EPS组干酪pH值无显著差异(P>0.05),说明EPS的加入不会使干酪品质发生明显偏差。
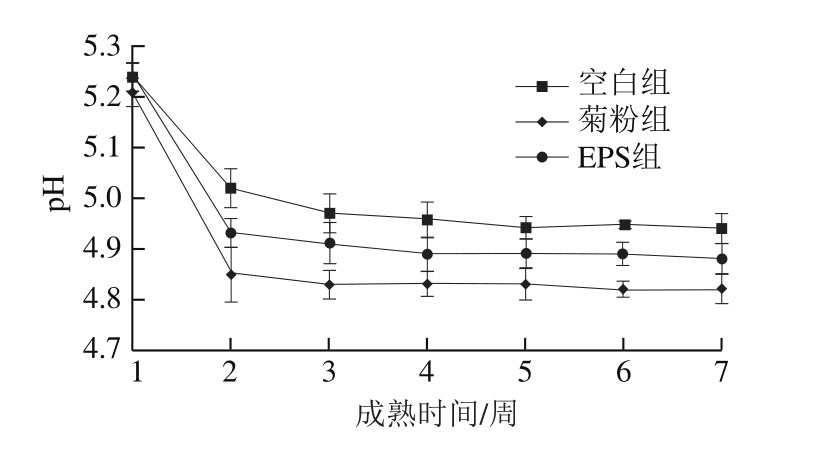
图11 干酪成熟期间pH值变化
Fig. 11 Changes in pH during cheese ripening
图12 显示干酪成熟期间活菌数的变化。成熟过程前6 周干酪中的微生物含量在不断增加,之后趋于稳定。菊粉组和EPS组的微生物含量与空白组比较有显著差异(P<0.05),说明EPS添加于干酪中能起到与菊粉一样的益生元作用,但是EPS组的活菌数对数值高于菊粉组,而产酸量却不如菊粉组,这可能是由于EPS和菊粉在结构组成上存在差异,直接影响其对微生物发酵增殖的作用[11]。
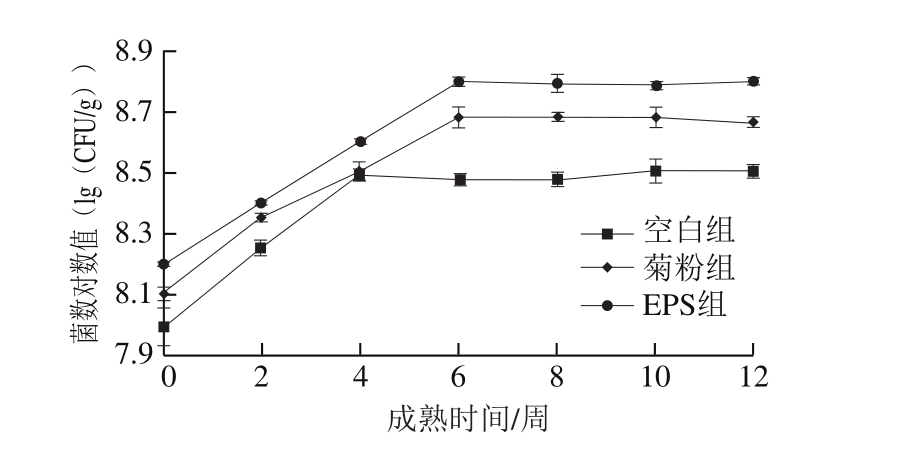
图12 干酪成熟期间乳酸菌含量变化
Fig. 12 Changes in number of lactic acid bacteria of during cheese ripening
2.7.3 EPS对切达干酪风味的影响
2.7.3.1 EPS干酪挥发性风味物质的GC-MS结果分析
风味是反映食品品质的一个重要因素,目前关于EPS对干酪风味影响的研究较少,郝晓娜等[16]考察了产EPS益生菌L. plantarum 1-2对切达干酪挥发性风味形成的影响,发现益生菌的加入增加了乙苯、十二烷、己醇和丙酮4 种风味物质,且其他共有风味物质在含量上也存在差异;Wang Ji等[15]指出产EPS植物乳杆菌SKT109能够通过增加乙酸乙酯,3-甲基-1-丁醇,3-羟基-2-丁酮和丁酮的含量来改善切达干酪风味特征。
如表2所示,采用SPME-GC-MS,从成熟12 周的EPS干酪中共鉴定出69 种挥发性风味物质,包括烃类14 种,醇类14 种,醛类4 种,酮类7 种,酸类8 种,酯类21 种,其他化合物1 种。其中含量最高的为酯类化合物,含量为5 042.44 μg/kg,其次为醇类、酮类、烃类、酸类、醛类以及其他化合物,但是风味物质含量高低并不能说明对风味的贡献度大小[34],二者不存在直接关联,因此需结合OAV法进一步分析各物质对干酪风味的贡献。
表2 EPS干酪挥发性组分的定性定量结果
Table 2 Qualitative and quantitative analysis results of volatiles in EPS-supplemented cheese
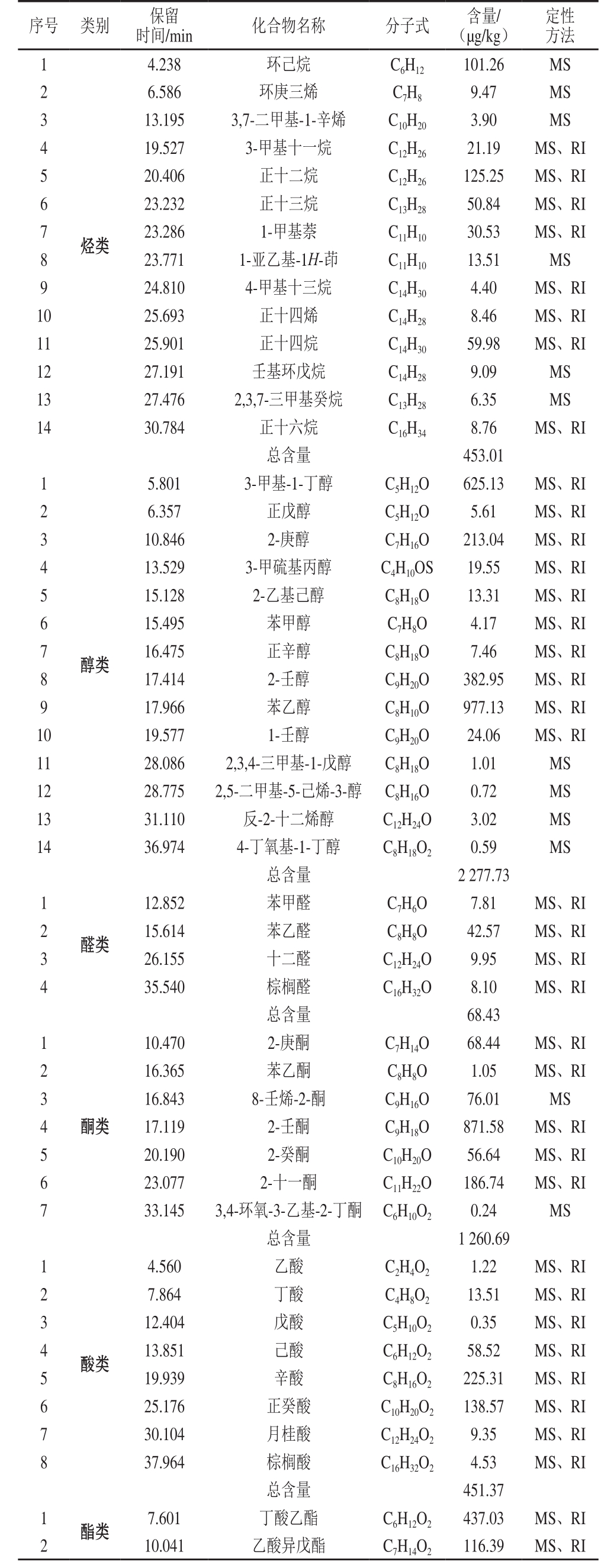
序号 类别 保留定性方法时间/min 化合物名称 分子式 含量/(μg/kg)1 19.527 3-甲基十一烷 C12H26 21.19 MS、RI 5 20.406 正十二烷 C12H26 125.25 MS、RI 6 23.232 正十三烷 C13H28 50.84 MS、RI 7 23.286 1-甲基萘 C11H10 30.53 MS、RI 8 23.771 1-亚乙基-1H-茚 C11H10 13.51 MS 9 24.810 4-甲基十三烷 C14H30 4.40 MS、RI 10 25.693 正十四烯 C14H28 8.46 MS、RI 11 25.901 正十四烷 C14H30 59.98 MS、RI 12 27.191 壬基环戊烷 C14H28 9.09 MS 13 27.476 2,3,7-三甲基癸烷 C13H28 6.35 MS 14 30.784 正十六烷 C16H34 8.76 MS、RI总含量 453.01 1 4.238 环己烷 C6H12 101.26 MS 2 6.586 环庚三烯 C7H8 9.47 MS 3 13.195 3,7-二甲基-1-辛烯 C10H20 3.90 MS 4烃类5.801 3-甲基-1-丁醇 C5H12O 625.13 MS、RI 2 6.357 正戊醇 C5H12O 5.61 MS、RI 3 10.846 2-庚醇 C7H16O 213.04 MS、RI 4 13.529 3-甲硫基丙醇 C4H10OS 19.55 MS、RI 5 15.128 2-乙基己醇 C8H18O 13.31 MS、RI 6 15.495 苯甲醇 C7H8O 4.17 MS、RI 7 16.475 正辛醇 C8H18O 7.46 MS、RI 8 17.414 2-壬醇 C9H20O 382.95 MS、RI 9 17.966 苯乙醇 C8H10O 977.13 MS、RI 10 19.577 1-壬醇 C9H20O 24.06 MS、RI 11 28.086 2,3,4-三甲基-1-戊醇 C8H18O 1.01 MS 12 28.775 2,5-二甲基-5-己烯-3-醇 C8H16O 0.72 MS 13 31.110 反-2-十二烯醇 C12H24O 3.02 MS 14 36.974 4-丁氧基-1-丁醇 C8H18O2 0.59 MS总含量 2 277.73 1醇类12.852 苯甲醛 C7H6O 7.81 MS、RI 2 15.614 苯乙醛 C8H8O 42.57 MS、RI 3 26.155 十二醛 C12H24O 9.95 MS、RI 4 35.540 棕榈醛 C16H32O 8.10 MS、RI总含量 68.43 1醛类10.470 2-庚酮 C7H14O 68.44 MS、RI 2 16.365 苯乙酮 C8H8O 1.05 MS、RI 3 16.843 8-壬烯-2-酮 C9H16O 76.01 MS 4 17.119 2-壬酮 C9H18O 871.58 MS、RI 5 20.190 2-癸酮 C10H20O 56.64 MS、RI 6 23.077 2-十一酮 C11H22O 186.74 MS、RI 7 33.145 3,4-环氧-3-乙基-2-丁酮 C6H10O2 0.24 MS总含量 1 260.69 1酮类4.560 乙酸 C2H4O2 1.22 MS、RI 2 7.864 丁酸 C4H8O2 13.51 MS、RI 3 12.404 戊酸 C5H10O2 0.35 MS、RI 4 13.851 己酸 C6H12O2 58.52 MS、RI 5 19.939 辛酸 C8H16O2 225.31 MS、RI 6 25.176 正癸酸 C10H20O2 138.57 MS、RI 7 30.104 月桂酸 C12H24O2 9.35 MS、RI 8 37.964 棕榈酸 C16H32O2 4.53 MS、RI总含量 451.37 1 酯类 7.601 丁酸乙酯 C6H12O2 437.03 MS、RI 2 10.041 乙酸异戊酯 C7H14O2 116.39 MS、RI酸类
续表2
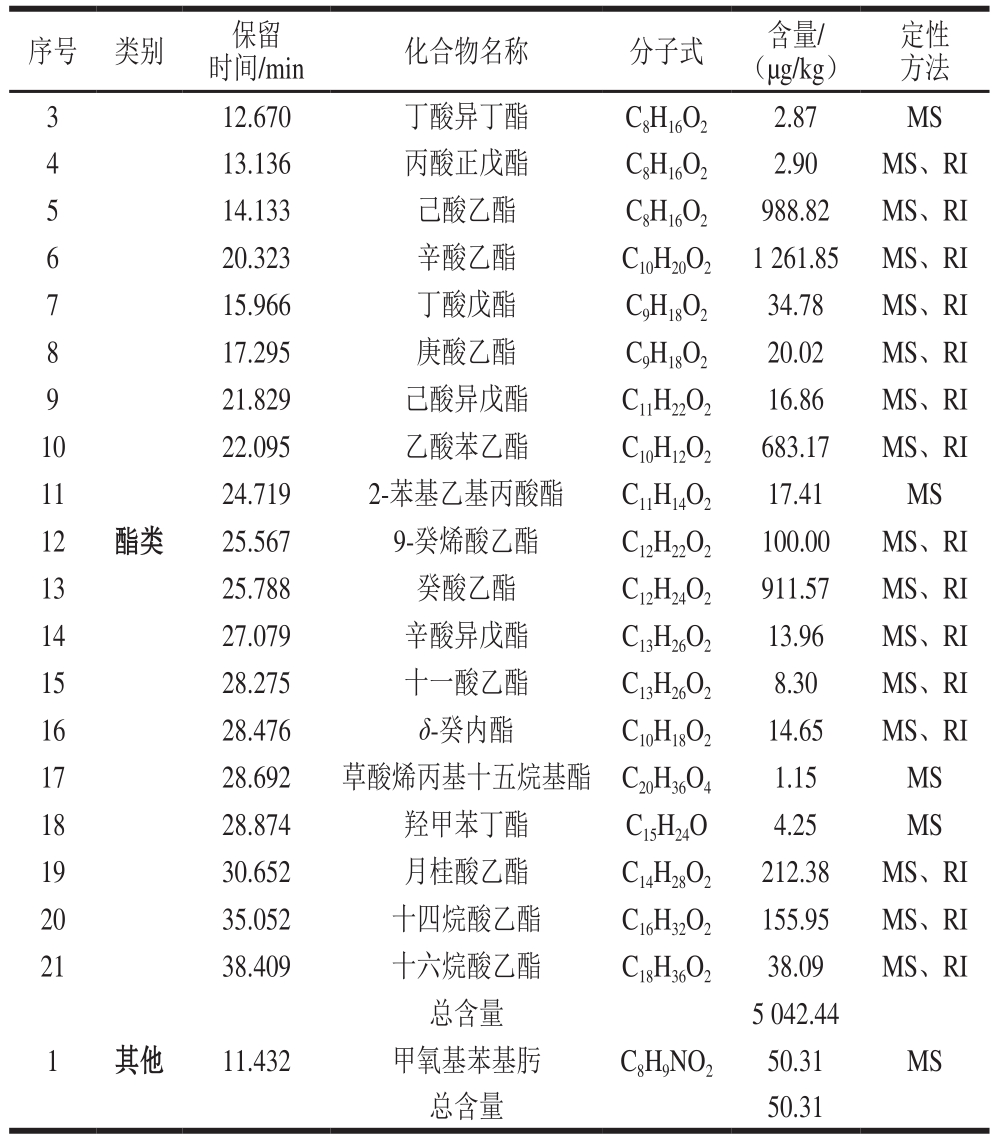
注:定性方法中,MS.质谱定性;RI.保留指数定性。
序号 类别 保留时间/min 化合物名称 分子式 含量/(μg/kg)13.136 丙酸正戊酯 C8H16O2 2.90 MS、RI 5 14.133 己酸乙酯 C8H16O2 988.82 MS、RI 6 20.323 辛酸乙酯 C10H20O2 1 261.85 MS、RI 7 15.966 丁酸戊酯 C9H18O2 34.78 MS、RI 8 17.295 庚酸乙酯 C9H18O2 20.02 MS、RI 9 21.829 己酸异戊酯 C11H22O2 16.86 MS、RI 10 22.095 乙酸苯乙酯 C10H12O2 683.17 MS、RI 11 24.719 2-苯基乙基丙酸酯 C11H14O2 17.41 MS 12 酯类 25.567 9-癸烯酸乙酯 C12H22O2 100.00 MS、RI 13 25.788 癸酸乙酯 C12H24O2 911.57 MS、RI 14 27.079 辛酸异戊酯 C13H26O2 13.96 MS、RI 15 28.275 十一酸乙酯 C13H26O2 8.30 MS、RI 16 28.476 δ-癸内酯 C10H18O2 14.65 MS、RI 17 28.692 草酸烯丙基十五烷基酯 C20H36O4 1.15 MS 18 28.874 羟甲苯丁酯 C15H24O 4.25 MS 19 30.652 月桂酸乙酯 C14H28O2 212.38 MS、RI 20 35.052 十四烷酸乙酯 C16H32O2 155.95 MS、RI 21 38.409 十六烷酸乙酯 C18H36O2 38.09 MS、RI总含量 5 042.44 1 其他 11.432 甲氧基苯基肟 C8H9NO2 50.31 MS总含量 50.31定性方法3 12.670 丁酸异丁酯 C8H16O2 2.87 MS 4
2.7.3.2 EPS干酪风味活性物质的OAV分析
表3 OAV确定EPS干酪中的风味活性物质
Table 3 Qualitative and quantitative analysis of volatile flavor compounds in EPS-supplemented cheese
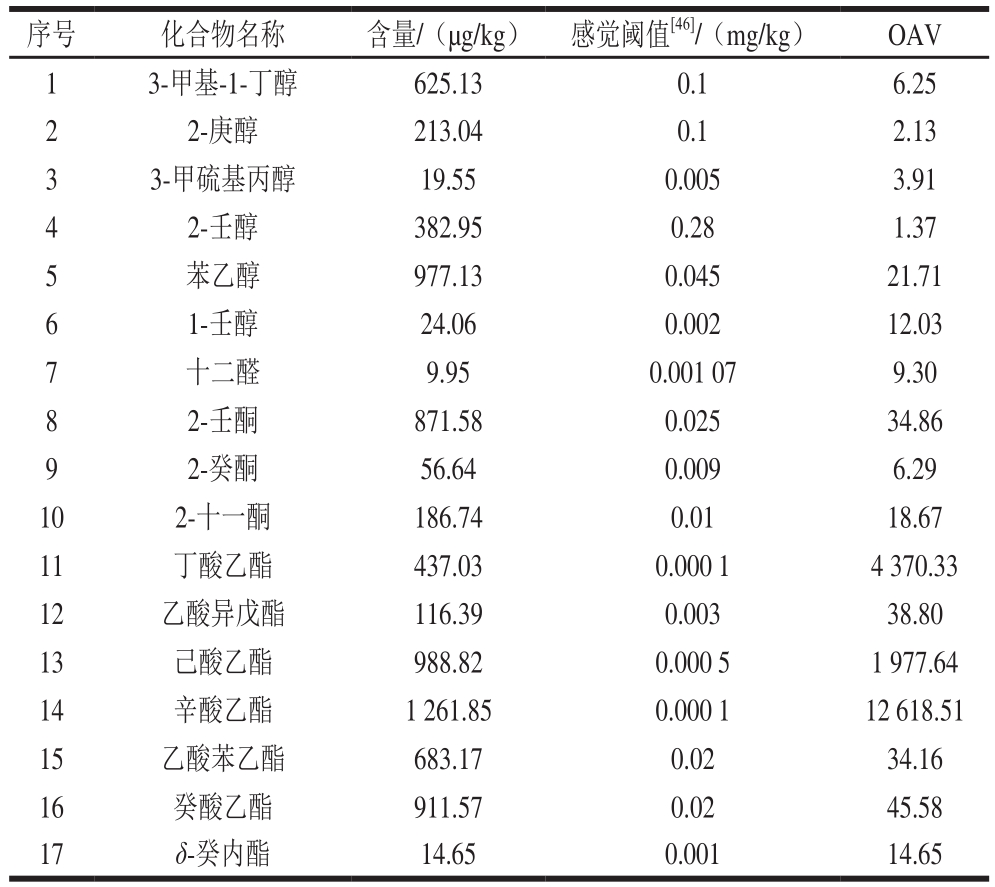
序号 化合物名称 含量/(μg/kg) 感觉阈值[46]/(mg/kg) OAV 1 3-甲基-1-丁醇 625.13 0.1 6.25 2 2-庚醇 213.04 0.1 2.13 3 3-甲硫基丙醇 19.55 0.005 3.91 4 2-壬醇 382.95 0.28 1.37 5 苯乙醇 977.13 0.045 21.71 6 1-壬醇 24.06 0.002 12.03 7 十二醛 9.95 0.001 07 9.30 8 2-壬酮 871.58 0.025 34.86 9 2-癸酮 56.64 0.009 6.29 10 2-十一酮 186.74 0.01 18.67 11 丁酸乙酯 437.03 0.000 1 4 370.33 12 乙酸异戊酯 116.39 0.003 38.80 13 己酸乙酯 988.82 0.000 5 1 977.64 14 辛酸乙酯 1 261.85 0.000 1 12 618.51 15 乙酸苯乙酯 683.17 0.02 34.16 16 癸酸乙酯 911.57 0.02 45.58 17 δ-癸内酯 14.65 0.001 14.65
OAV大于1的香气化合物被认为是食品的香气特征贡献组分,香气化合物的OAV越大,说明其对整体香气贡献越大[35]。如表3所示,在检测出的69 种挥发性风味物质中,有17 种化合物的OAV大于1,即对EPS干酪的风味有贡献作用,是EPS干酪中的风味活性物质,包括6 种醇类物质,1 种醛类物质,3 种酮类物质,7 种醛类物质。其中丁酸乙酯、己酸乙酯、辛酸乙酯的OAV大于200,说明它们对EPS干酪的风味有关键性贡献作用[36]。
发酵乳制品中醇类物质的来源主要有乳糖代谢、甲基酮类的还原、氨基酸的降解以及亚油酸、亚麻酸的降解这4 种。本实验检测出的6 种OAV大于1的醇类物质中,3-甲基-1-丁醇具有特殊不愉快气味、有辛辣而令人厌恶味[37];3-甲硫基丙醇具有典型的硫化物气息,稀释到一定程度后具有洋葱、甜的肉汤的气味[38];2-庚醇具有蘑菇香气,2-壬醇和1-壬醇分别具有黄瓜和青草气味;苯乙醇浓度最高,来自芳香族氨基酸的降解,具有玫瑰花香、紫罗兰香、茉莉花香等多种气味。
醛类是干酪中重要的挥发性风味物质之一,但本实验中仅有十二醛这1 种物质对干酪风味有贡献,这可能与醛类属于化学性质比较活泼的不稳定中间体化合物,在一定条件下易被还原成相应的醇有关[2]。
3 种OAV大于1的酮类化合物中,2-壬酮具有青香、脂肪香,2-十一酮具有脂肪香以及奶油、乳酪的味道[39]。一般认为酮类物质随着碳链的增长香气更加浓郁[40],其中甲基酮类化合物被认为是表面霉菌成熟干酪和蓝纹干酪的特征风味物质[41]。
酯类化合物是非常重要的一种呈香物质,在干酪中一般给人以甜的果香味,同时干酪中酯类化合物的存在还可以缓解短链酸类化合物引起的尖刺感,使整体风味变得柔和,但是过多的酯类化合物容易使得奶酪风味偏水果味[42]。在本实验中,酯类物质含量最高,同时对EPS干酪风味贡献最大。其中丁酸乙酯具有苹果香气;乙酸苯乙酯具有蜜糖、花香、果香、柑橘香气[43];癸酸乙酯呈现出葡萄气味;δ-癸内酯呈现出桃子、乳脂气味[39];乙酸异戊酯、己酸乙酯、辛酸乙酯也都能赋予食品水果香气。同时,王磊等[44]认为异戊醛、乙酸乙酯、辛酸乙酯是切达干酪的主体挥发性风味物质,与本实验结论部分相同,说明EPS的加入可能改变了干酪的风味特征。
在本实验中,烃类物质和酸类物质的含量都不低,但是其OAV均小于1,这可能主要与这些挥发性风味物质感觉阈值较高有关,同时由于实际香气组分之间在整体香气贡献中具有协同或拮抗效应,通常香气成分之间相互作用以加成为主,协同和掩盖作用较少[45],一些OAV小于1的物质可能通过与其他物质间的协同效应而使其香气被人们感知,因此这些物质也有可能对EPS干酪的整体风味有贡献。
本研究对藏灵菇发酵产EPS进行了分离纯化,确定该EPS由鼠李糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖组成,物质的量比1∶3.02∶2.12∶1.59∶3.04,在红外光谱下显示出典型的多糖吸收峰模式。扫描电镜结果表明,该EPS微观结构中分布着许多表面比较光滑的球状、片状结构;原子力显微观察,EPS呈现一定的聚集现象,具有膜状、簇状结构。藏灵菇EPS对发酵剂菌株的生长有促进作用,这种作用随着添加量的增加先增后减。同时还能够提高切达干酪得率、含水量、保水性以及成熟期间的活菌数。SPME-GC-MS分析结合OAV法表明,在69 种挥发性物质中,有17 种风味物质对EPS干酪整体风味有贡献,其中丁酸乙酯、己酸乙酯、辛酸乙酯是关键性风味物质。本研究将为藏灵菇EPS在乳酸菌发酵及干酪加工中的应用提供重要的技术参考。
[1] 邢书涵, 连正兴, 孙勇, 等. 藏灵菇源干酪乳杆菌KL1胞外多糖抑制人结肠癌细胞增殖的研究[J]. 食品科学, 2012, 33(7): 284-288.
[2] 郭婷, 余志坚, 陈超, 等. 基于快速成熟模型的藏灵菇发酵切达干酪挥发性风味物质分析[J]. 食品科学, 2018, 39(8): 90-96.DOI:10.7506/spkx1002-6630-201808015.
[3] 郭婷, 郝一江, 张健, 等. 传统藏灵菇发酵乳挥发性风味特征研究[J]. 中国乳品工业, 2017, 45(1): 8-11. DOI:10.3969/j.issn.1001-2230.2017.01.002.
[4] 李达, 张雪, 张莉, 等. 西藏灵菇中产胞外多糖嗜热链球菌的分离筛选及其发酵性能测定[J]. 食品科学, 2011, 32(13): 225-228.DOI:10.1016/j.anaerobe.2014.01.003.
[5] HIDALGOCANTABRANA C, NIKOLIC M, LOPEZ P, et al.Exopolysaccharide-producing Bifidobacterium animalis subsp. lactis strains and their polymers elicit different responses on immune cells from blood and gut associated lymphoid tissue[J]. Anaerobe, 2014,26(4): 24-30. DOI:10.1016/j.anaerobe.2014.01.003.
[6] ZHENG L P, ZOU T, MA Y J, et al. Antioxidant and DNA damage protecting activity of exopolysaccharides from the endophytic bacterium Bacillus cereus SZ1[J]. Molecules, 2016, 21(2): 174.DOI:10.3390/molecules21020174.
[7] 杜瑞平, 郭帅, 潘娜, 等. 乳酸菌胞外多糖益生功能研究进展[J].动物营养学报, 2018, 30(7): 2439-2444. DOI:10.3969/j.issn.1006-267x.2018.07.001.
[8] 吴彤, 房晓彬, 闵伟红, 等. 乳酸菌胞外多糖的理化特性及免疫调节机制研究进展[J]. 中国乳品工业, 2018(5): 36-38; 42. DOI:10.3969/j.issn.1001-2230.2018.05.008.
[9] 王辑, 田政, 赵笑, 等. 藏灵菇发酵产胞外多糖的影响因素及其应用研究[J]. 食品工业科技, 2015, 36(18): 203-208. DOI:10.13386/j.issn1002-0306.2015.18.032.
[10] PUSSO P, LÓPEZ P, CAPOZZI V, et al. Beta-glucans improve growth, viability and colonization of probiotic microorganisms[J].International Journal of Molecular Sciences, 2012, 13(5): 6026-6039.DOI:10.3390/ijms13056026.
[11] 曹楠. 益生元对低脂新鲜干酪品质影响的研究[D]. 哈尔滨: 东北农业大学, 2016: 33-36.
[12] 邢海楠, 姜颖越, 李艳茹, 等. 不同低聚糖对嗜酸乳杆菌增殖的影响研究[J]. 延边大学农学学报, 2014, 36(2): 155-159. DOI:10.13478/j.cnki.jasyu.2014.02.030.
[13] 卢玉容, 郭秀兰, 侯彩云, 等. 菊糖在食品加工中的特性及应用[J]. 食品研究与开发, 2018, 39(12): 194-199. DOI:10.3969/j.issn.1005-6521.2018.12.037.
[14] RIMADA P S, ABRAHAM A G. Comparative study of different methodologies to determine the exopolysaccharide produced by kefir grains in milk and whey[J]. Le Lait, 2003, 83(1): 79-87. DOI:10.1051/lait:2002051.
[15] WANG J, ZHAO X, TIAN Z, et al. Characterization of an exopolysaccharide produced by Lactobacillus plantarum YW11 isolated from Tibet Kefir[J]. Carbohydrate Polymers, 2015, 125:16-25. DOI:10.1016/j.carbpol.2015.03.003.
[16] 郝晓娜, 张健, 杨亚威, 等. 益生性植物乳杆菌对切达干酪挥发性风味形成的影响[J]. 食品科学, 2018, 39(4): 49-58. DOI:10.7506/spkx1002-6630-201804009.
[17] 国家卫生和计划生育委员会. 食品中水分的测定: GB 5009.3—2016[S]. 北京: 中国标准出版社, 2016.
[18] 杨晨璐, 周蕊, 饶晴, 等. 植物乳杆菌胞外多糖的分离纯化及其抗氧化性研究[J]. 中国乳品工业, 2018, 46(5): 9-13. DOI:10.3969/j.issn.1001-2230.2018.05.002.
[19] 于静, 曾小群, 王鸿飞, 等. 高产胞外多糖乳酸菌的筛选及其发酵条件优化[J]. 中国食品学报, 2015, 15(2): 93-98. DOI:10.16429/j.1009-7848.2015.02.014.
[20] 刘雯雯, 孙梦莹, 刘丽娜, 等. Lactobacillus plantarum-12菌株胞外多糖培养条件优化及功能特性研究[J]. 食品研究与开发, 2018, 39(7):180-186. DOI:10.3969/j.issn.1005-6521.2018.07.032.
[21] BOUZAR F, CERNING J, DESMAZEAUD M. Exopolysaccharide production in milk by Lactobacillus delbrueckii ssp. bulgaricus CNRZ 1187 and by two colonial variants[J]. Journal of Dairy Science, 1996,79(2): 205-211. DOI:10.3168/jds.S0022-0302(96)76352-X.
[22] GAN D, MA L, JIANG C, et al. Production, preliminary characterization and antitumor activity in vitro of polysaccharides from the mycelium of Pholiota dinghuensis Bi[J]. Carbohydrate Polymers,2011, 84(3): 997-1003. DOI:10.1016/j.carbpol.2010.12.058.
[23] WANG Y, LI C, LIU P, et al. Physical characterization of exopolysaccharide produced by Lactobacillus plantarum KF5 isolated from Tibet kefir[J]. Carbohydrate Polymers, 2010, 82(3): 895-903.DOI:10.1016/j.carbpol.2010.06.013.
[24] SHUHONG Y, MEIPING Z, HONG Y, et al. Biosorption of Cu2+,Pb2+ and Cr6+ by a novel exopolysaccharide from Arthrobacter ps-5[J].Carbohydrate Polymers, 2014, 101(1): 50. DOI:10.1016/j.carbpol.2013.09.021.
[25] WU Y, CUI S W, TANG J, et al. Preparation, partial characterization and bioactivity of water-soluble polysaccharides from boat-fruited sterculia seeds[J]. Carbohydrate Polymers, 2007, 70(4): 437-443.DOI:10.1016/j.carbpol.2007.05.010.
[26] SHINGEL K I. Determination of structural peculiarities of dexran,pullulan and gamma-irradiated pullulan by Fourier-transform IR spectroscopy[J]. Carbohydrate Research, 2002, 337(16): 1445.DOI:10.1016/S0008-6215(02)00209-4.
[27] 李伟欣, 陈倩, 李平兰, 等. 双歧杆菌22-5胞外多糖结构分析[J]. 食品科学, 2008, 29(4): 267-271.
[28] 张天琪, 杨贞耐, 孔保华. 乳杆菌胞外多糖及其在酸乳中的应用[J].食品科学, 2008, 29(9): 637-642.
[29] 刘翠平, 吴正钧. 不同碳源对干酪乳杆菌LC2W胞外多糖组成影响的研究[J]. 天然产物研究与开发, 2012(b12): 83-86. DOI:10.16333/j.1001-6880.2012.s1.020.
[30] HAN Y, LIU E, LIU L, et al. Rheological, emulsifying and thermostability properties of two exopolysaccharides produced by Bacillus amyloliquefaciens LPL061[J]. Carbohydrate Polymers, 2015,115: 230-237. DOI:10.1016/j.carbpol.2014.08.044.
[31] AHMED Z, WANG Y, ANJUM N, et al. Characterization of new exopolysaccharides produced by coculturing of L. kefiranofaciens with yoghurt strains[J]. International Journal of Biological Macromolecules,2013, 59(4): 377-383. DOI:10.1016/j.ijbiomac.2013.04.075.
[32] 邵丽, 吴正钧, 张灏, 等. 鼠李糖乳杆菌胞外多糖S2的原子力显微镜观察[J]. 食品科学, 2015, 36(13): 43-47. DOI:10.7506/spkx1002-6630-201513009.
[33] 曹永强. 干酪乳杆菌N1115产酸特性及其在发酵乳中的应用[D].北京: 北京工商大学, 2016:28-29.
[34] 刘笑生, 刘建斌, 刘梦雅, 等. SAFE与SDE法对金华火腿皮下脂肪气味活性物质研究[J]. 食品科学技术学报, 2014, 32(1): 40-46.DOI:10.3969/j.issn.2095-6002.2014.01.008.
[35] 庞雪莉, 胡小松, 廖小军, 等. FD-GC-O和OAV方法鉴定哈密瓜香气活性成分研究[J]. 中国食品学报, 2012, 12(6): 174-182.DOI:10.16429/j.1009-7848.2012.06.024.
[36] 谢恬, 王丹, 马明娟, 等. OAV和GC-O-MS法分析五香驴肉风味活性物质[J]. 食品科学, 2018, 39(8): 123-128. DOI:10.7506/spkx1002-6630-201808020.
[37] 王丽娟, 刘晓燕, 杨宋琪, 等. HS-GC-MS法和SDE-GC-MS法分析杜氏盐藻挥发性成分[J]. 食品研究与开发, 2018, 39(7): 136-142.DOI:10.3969/j.issn.1005-6521.2018.07.024.
[38] 孙啸涛, 张锋国, 董蔚, 等. 芝麻香白酒中3-甲硫基丙醇的GC-FPD分析[J]. 食品科学技术学报, 2014, 32(5): 27-34. DOI:10.3969/j.issn.2095-6002.2014.05.006.
[39] 刘南南, 郑福平, 张玉玉, 等. SAFE-GC-MS分析酸牛奶挥发性成分[J]. 食品科学, 2014, 35(22): 150-153. DOI:10.7506/spkx1002-6630-201422028.
[40] 舒宏福. 新合成食用香料手册[M]. 北京: 化学工业出版社, 2005.
[41] 罗俏俏, 马江, 曹磊, 等. 干酪中主要风味物质的研究进展[J].食品与发酵科技, 2018, 54(1): 96-100. DOI:10.3969/j.issn.1674-506X.2018.01-019.
[42] THOMSEN M, GOURRAT K, THOMAS-DANGUIN T, et al.Multivariate approach to reveal relationships between sensory perception of cheeses and aroma profile obtained with different extraction methods[J]. Food Research International, 2014, 62(8): 561-571. DOI:10.1016/j.foodres.2014.03.068.
[43] 黄丹, 刘有晴, 倪月, 等. 基于ROAV值的四川麸醋主体风味物质研究[J].食品工业, 2016, 37(9): 288-292.
[44] 王磊, 莫蓓红, 刘振民, 等. 8 种典型成熟干酪挥发性风味差异性研究[J]. 食品与机械, 2017, 33(4): 33-38. DOI:10.13652/j.issn.1003-5788.2017.04.007.
[45] 肖作兵, 朱建才, 牛云蔚, 等. 香气成分的协同作用研究进展[J].食品科学技术学报, 2018, 36(4): 1-7. DOI:10.3969/j.issn.2095-6002.2018.04.001.
[46] 里奥·范海默特. 化合物香味阈值汇编[G]. 北京: 科学出版社, 2015.
Physicochemical Properties of Exopolysaccharide from Tibet Kefir and Its Application in Cheddar Cheese
LUO Tianqi, GUO Ting, YU Zhijian, et al. Physicochemical properties of exopolysaccharide from Tibet kefir and its application in Cheddar cheese[J]. Food Science, 2019, 40(18): 121-129. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20181018-192. http://www.spkx.net.cn