表1 类胡萝卜素的标准曲线方程
Table 1 Standard curves for carotenoids

标准品 回归方程 相关系数β-胡萝卜素 Y=236 578X-20 600.6 0.998 7 α-胡萝卜素 Y=254 648X+400.32 0.998 5 β-隐黄素 Y=356 665X-3 25.38 0.999 4
杏(Prunus armeniaca L.)属蔷薇科(Rosaceae),原产中国。我国蕴藏着丰富的杏类胡萝卜素资源,据2016年统计,新疆杏种植面积达187.6万 亩,产量达119.8万 t[1],居全国首位,被称为世界四大杏产区之一[2],其中库买提杏因其具有香气浓郁、果肉厚、纤维少、可溶固形物含量高、甜酸适口、果肉细腻滑润等特点,最为出名,具有优良的加工品质和广阔的商业价值。
类胡萝卜素在预防心血管疾病、癌症以及黄斑变性等方面有重要作用,且必须通过饮食摄取[3-5]。杏是类胡萝卜素含量最为丰富的水果之一[6-8],也是人体摄取类胡萝卜素的重要来源[9]。Kurz等[10]应用高效液相色谱-大气压化学电离-质谱测定了来自法国和西班牙等地的6 个杏品种中的类胡萝卜素,结果表明不同杏品种在类胡萝卜素种类和含量上均有较大差异;Zaghdoudi等[11]应用高效液相色谱-二极管阵列检测-质谱技术分析比较了杏中类胡萝卜素种类的组成,发现杏中主要的类胡萝卜素为全反式-β-胡萝卜素;Ruiz等[12]研究了欧洲37 个杏品种果皮以及果肉中的类胡萝卜素种类及含量,结果表明杏中主要类胡萝卜素为β-胡萝卜素、β-隐黄素、γ-胡萝卜素。惠伯棣[13]、陈洁琼[14]和樊金玲[15]等鉴定了西瓜、玉米籽和榆树叶中类胡萝卜素,发现西瓜中类胡萝卜素组成主要为非极性类胡萝卜素,玉米籽和榆树叶中主要含极性类胡萝卜素;陶俊等[16]利用高效液相色谱法研究了53 个柑橘品种果实及果皮中主要类胡萝卜素成分及含量,结果表明果皮和果实中类胡萝卜素构成相同。综上所述,国外对杏中类胡萝卜素鉴定的研究多集中于欧洲杏品种,未涉及中国杏;国内对类胡萝卜素的研究还处于总量分析阶段,定性分析报道较少,且针对杏中类胡萝卜素的定性研究鲜有报道。
本实验以新疆库买提杏为研究对象,利用高效液相色谱-二极管阵列检测-大气压化学电离-质谱(high performance liquid chromatography-diode array detection-atmospheric pressure chemical ionization-mass spectrometry,HPLC-DAD-APCI-MS)技术,多反应监测(multiple reaction monitoring,MRM)模式检测,获取类胡萝卜素化合物HPLC、MS及光谱信息并与标准品比对,确定新疆库买提杏中主要类胡萝卜素成分,采用外标法进行类胡萝卜素定量,研究结果为提升新疆杏果及其产品品质和市场竞争力具有重要的意义,为合理开发和利用新疆杏资源提供理论依据。
库买提杏于2018年6月购于新疆乌鲁木齐市北园春水果市场,选取杏果果皮颜色由绿色自然转为全黄,并且大小均匀的完好无损的果实,用小刀切分为两瓣,去核,用液氮快速冷冻,置于-20 ℃冰箱备用。
标准品:全反式-β-胡萝卜素(UV≥97%)、全反式-β-隐黄素(HPLC≥97%)、全反式-α-胡萝卜素(HPLC≥98%),甲基叔丁基醚(methyl tert-butyl ether,MTBE)、甲醇(均为色谱纯) 美国Sigma公司;丙酮、石油醚、抗氧化剂2,6-二叔丁基-4-甲基苯酚(2,6-ditertbutyl-4-methylphenol,BHT)、无水硫酸钠(均为分析纯) 天津市光复科技发展有限公司。
TGL-16G高速冷冻离心机 上海安亭科学仪器厂;KQ-300DE数控超声波清洗器 江苏昆山超声仪器有限公司;FA2104N电子天平 上海民桥精密科学仪器有限公司;InertsilC30色谱柱 日本岛津(中国)公司;N-1001旋转蒸发仪 上海爱朗仪器有限公司;Triple Quad LC/MS 6410 HPLC-DAD-APCI-MS联用仪(HPLC仪、真空脱气机、四元梯度洗脱泵、柱温箱、DAD、三重四极杆串联质谱仪、APCI离子源) 美国安捷伦科技公司。
1.3.1 类胡萝卜素的提取
用液氮快速冷冻已去核杏果并研磨至粉末,精确称取10 g至磨口锥形瓶中,加入85%丙酮溶液[7]150 mL(含0.1% BHT)避光超声浸提15 min,重复浸提至残渣无色后合并浸提液,离心15 min(4 ℃、8 000 r/min),将上清液收集于分液漏斗中,加500 mL石油醚进行萃取,待分层后分流水相,有机相用盛有40 g无水硫酸钠的漏斗收集至圆底烧瓶中,真空25 ℃旋转蒸发近干,流动相复溶最终产物并定容至5 mL棕色容量瓶,低温避光保存待用,进样前使用0.22 μm有机滤膜过滤。
1.3.2 类胡萝卜素的HPLC-DAD-APCI-MS定性分析
HPLC条件参照Huang Wenshu[7]和Etzbach[17]等的方法,并略作改进。流动相A为甲醇-MTBE-水(81∶15∶4,V/V),流动相B为甲醇-MTBE-水(7∶90∶3,V/V),AB相中分别含0.1% BHT;流速1 mL/min;线性梯度洗脱,B相在0~100 min内体积分数由0%增至100%;C30色谱柱(4.6 mm×250 mm,5 μm);进样量10 μL;柱温30 ℃;检测波长450 nm;DAD光谱收集范围300~500 nm。
MS条件:APCI正离子源;MRM扫描;质谱流速1 mL/min;干燥气体流速4 L/min;毛细管电压2 500 V;雾化气压力30 psi;汽化温度350 ℃;蒸汽温度320 ℃;电晕电流4 μA。
1.3.3 库买提杏中类胡萝卜素的定量分析
采用1.3.2节HPLC条件,有标准品的全反式类胡萝卜素组分,采用外标法定量分析类胡萝卜素,顺式类胡萝卜素组分无标准品,但其消光系数与全反式相似,故根据替换计算法[18]:采用对应的全反式类胡萝卜素曲线方程对类胡萝卜素的异构体进行定量,结果以库买提杏干质量计算(μg/g)。
分别准确配制质量浓度为500、400、200 μg/mL的β-胡萝卜素、α-胡萝卜素、β-隐黄素标准品储备液,各吸取1 000、125、50 μL并用流动相定容至10 mL容量瓶中,配制成混合标准溶液,再稀释为系列质量浓度工作液,重复3 次HPLC检测。以质量浓度(μg/mL)为横坐标,峰面积为纵坐标,绘制标准曲线方程(表1)。
表1 类胡萝卜素的标准曲线方程
Table 1 Standard curves for carotenoids

标准品 回归方程 相关系数β-胡萝卜素 Y=236 578X-20 600.6 0.998 7 α-胡萝卜素 Y=254 648X+400.32 0.998 5 β-隐黄素 Y=356 665X-3 25.38 0.999 4
采用SigmaPlot 12.5软件进行数据处理。
本研究综合类胡萝卜素HPLC、MS[19]及光谱信息,并结合文献对库买提杏中主要类胡萝卜素组分进行鉴定分析。
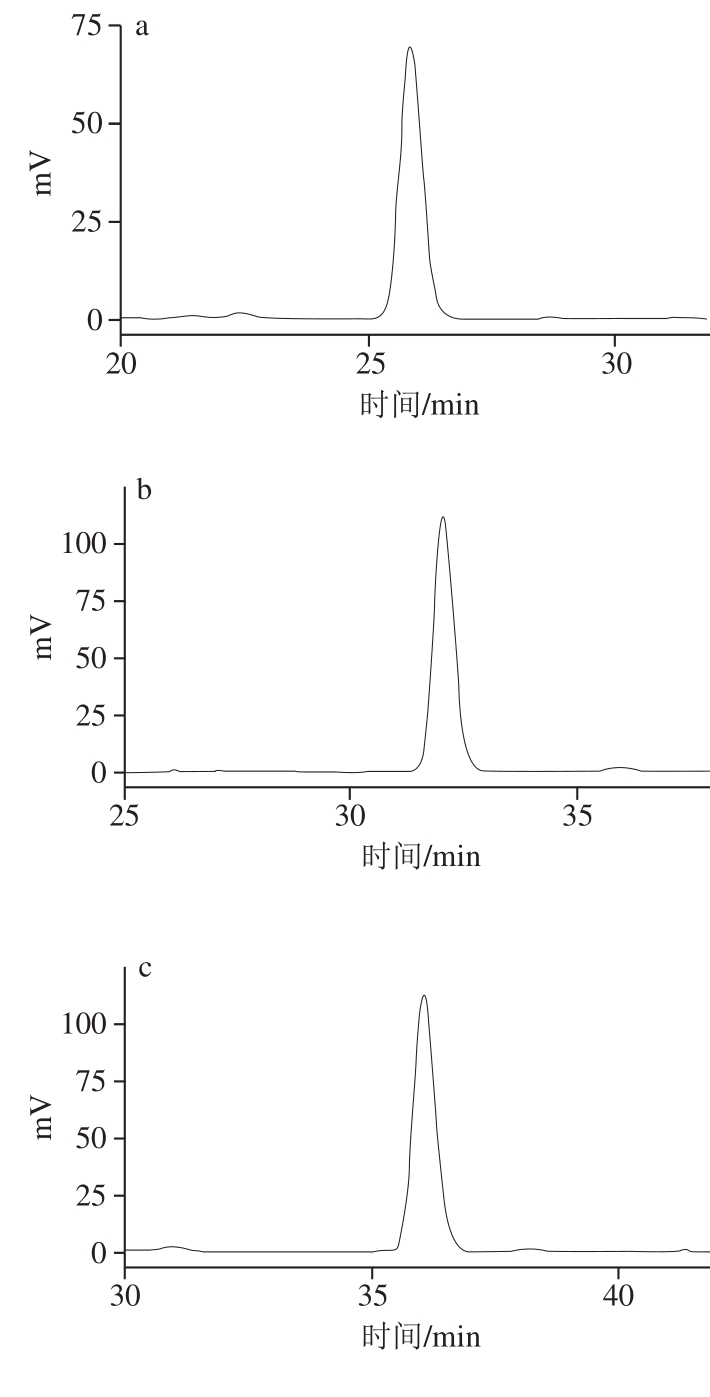
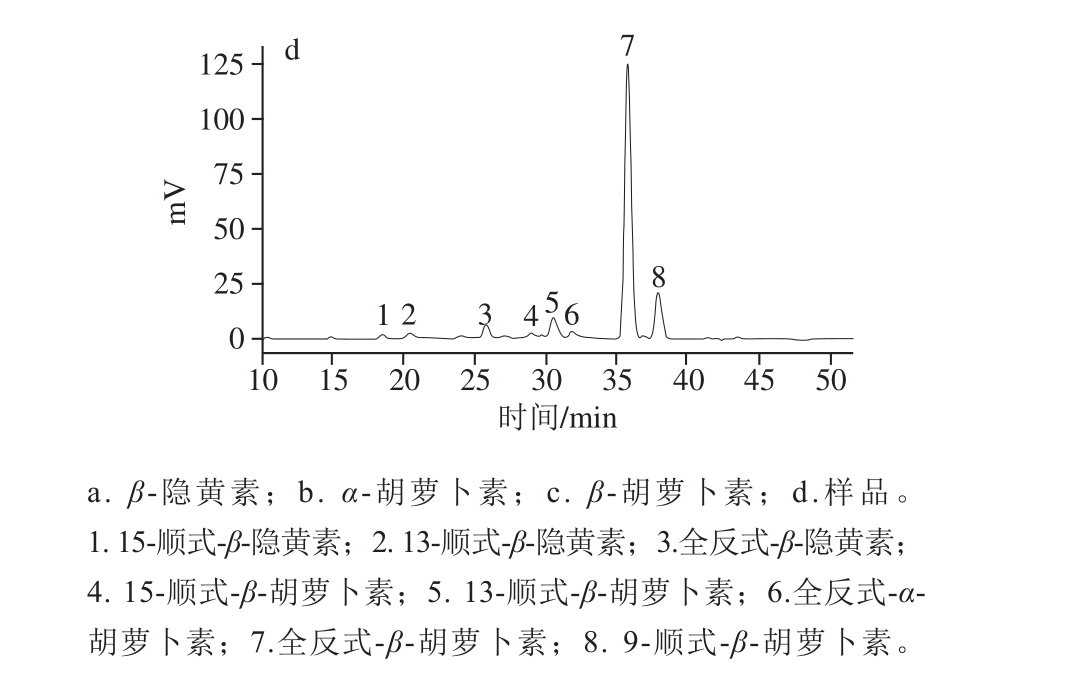
图1 类胡萝卜素标准品(a~c)和样品(d)HPLC图
Fig. 1 HPLC profiles of carotenoid standards (a-c) and carotenoids (d)in sample
与标准品(图1a~c)对比,图1d中峰3、6、7的保留时间分别为25.9、31.9、36.0 min,初步判断峰3、6、7分别为与全反式-β-隐黄素、α-胡萝卜素、β-胡萝卜素。
由图2a、b可知,β-隐黄素的分子离子峰为m/z 553.5,碎片离子峰为m/z 177.2、119.1;β-胡萝卜素的分子离子峰为m/z 537.5,碎片离子峰为m/z 177.2、119.1、413.4。选择m/z 553.5、537.5为母离子,进行选择离子监测扫描(selected ion monitoring,SIM),如图2c所示,其与图1峰形基本一致,而SIM扫描具有仅允许设定离子通过的特异性,这说明SIM图中峰1~8可能均为β-隐黄素和β-胡萝卜素的同分异构体;选择母离子-子离子定性离子对:m/z553.5~177.2,m/z553.5~119.1为β-隐黄素的定性离子对,选择m/z537.5~177.2、537.5~119.1、537.5~413.4为β-胡萝卜素的定性离子对,对样品进行MRM。如图2d所示,图2c、d峰形一致,而MRM扫描模式对母离子和子离子具有双重质量筛选,仅允许符合设定规则的离子通过[20],即仅对符合规则的离子进行信号记录,这进一步说明MRM中峰1~8均为β-隐黄素、β-胡萝卜素的同分异构体。对峰1~8提取离子获取其MS信息,由表2可知,峰1~3为β-隐黄素的同分异构体,峰4~8为β-胡萝卜素的同分异构体。
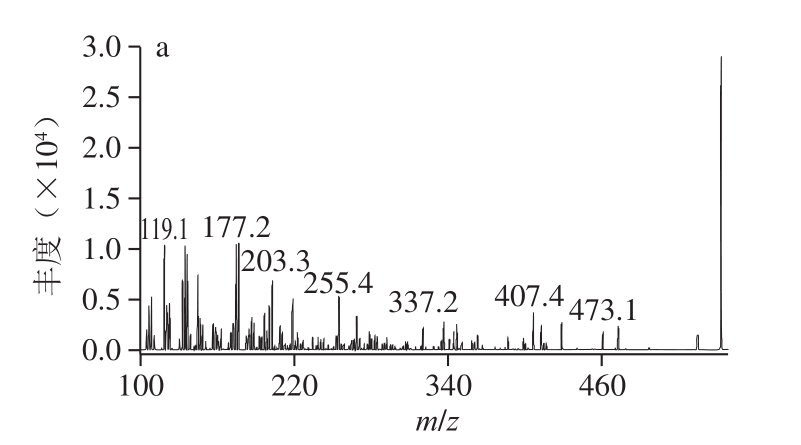
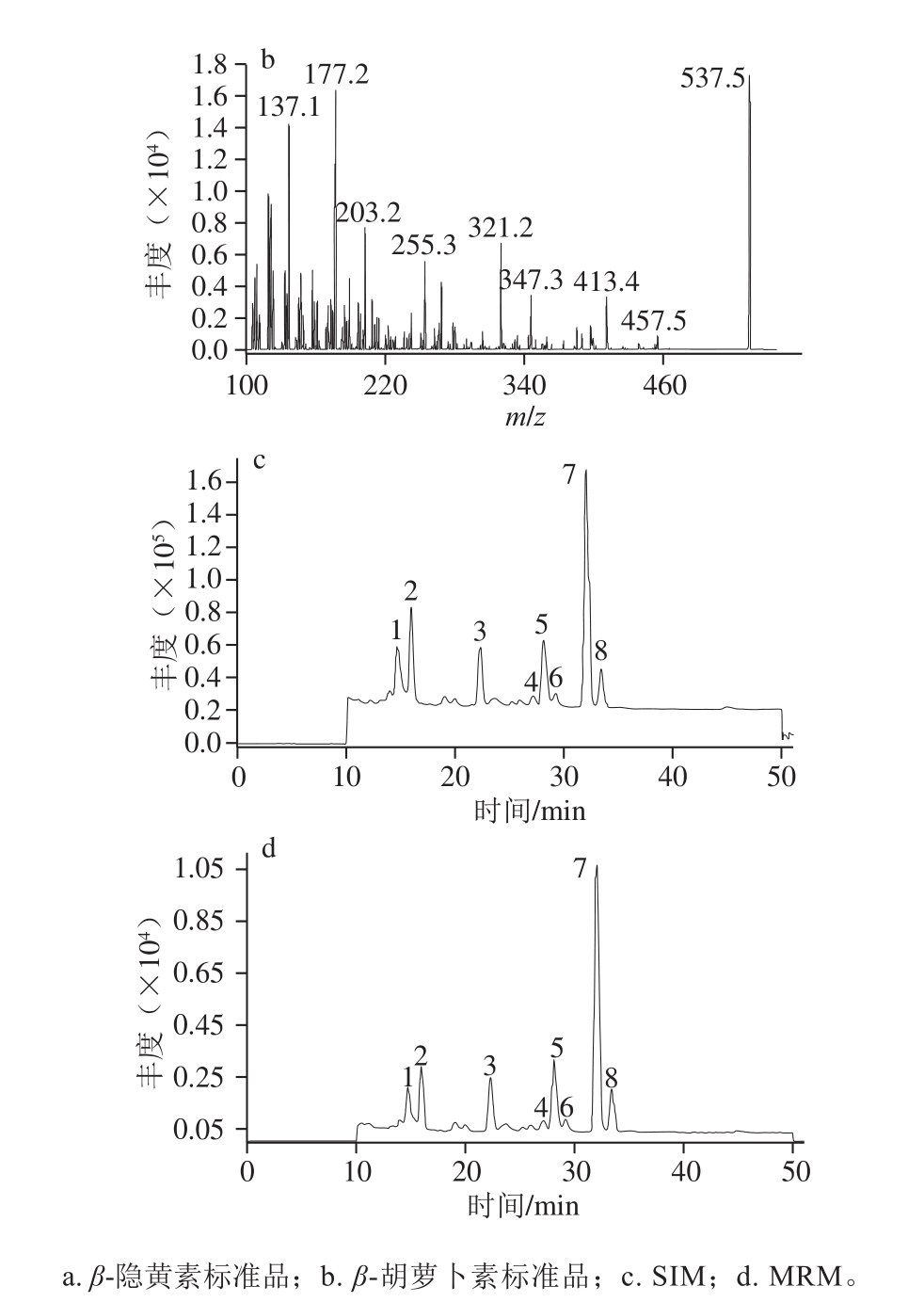
图2 类胡萝卜标准品(a、b)和库买提杏中类胡萝卜素(c、d)
HPLC-MS总离子流图
Fig. 2 Total ion current (TIC) chromatograms of carotenoid standards(a, b) and carotenoids (c, d) in Kumaiti apricot
表2 库买提杏中类胡萝卜素光谱和质谱信息
Table 2 Chromatographic, UV-visible spectroscopic and mass spectral characteristics of carotenoids from Kumaiti apricot
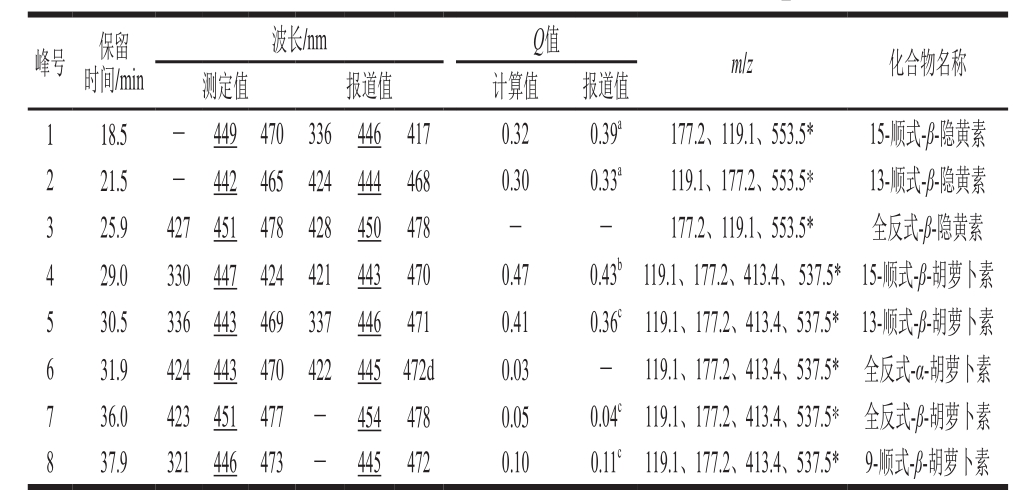
注:下划横线为组分最大吸收峰;*.母离子;a.流动相为1.5%乙酸铵水-MTBE-甲醇(5∶25∶70,V/V)[21];b.流动相为1-丁醇-乙腈(30∶70,V/V)[22];c.流动相为甲醇-MTBE-水(50∶45∶5,V/V)[23];d.流动相为甲醇-MTBE-水(85∶5∶10,V/V)[17]。-.未测出或无报道值。
峰号 保留时间/min波长/nm Q值 m/z 化合物名称测定值 报道值 计算值 报道值1 18.5 -446 417 0.32 0.39a 177.2、119.1、553.5* 15-顺式-β-隐黄素2 21.5 -449 470 336 444 468 0.30 0.33a 119.1、177.2、553.5* 13-顺式-β-隐黄素3 25.9 427 442 465 424 450 478 - - 177.2、119.1、553.5* 全反式-β-隐黄素4 29.0 330 451 478 428 443 470 0.47 0.43b119.1、177.2、413.4、 537.5*15-顺式-β-胡萝卜素5 30.5 336 447 424 421 446 471 0.41 0.36c119.1、177.2、413.4、537.5* 13-顺式-β-胡萝卜素6 31.9 424 443 469 337 445 472d 0.03 - 119.1、177.2、413.4、537.5* 全反式-α-胡萝卜素7 36.0 423 443 470 422 454 478 0.05 0.04c119.1、177.2、413.4、537.5* 全反式-β-胡萝卜素8 37.9 321 451 477 -446 473 -445 472 0.10 0.11c 119.1、177.2、413.4、537.5* 9-顺式-β-胡萝卜素
本实验中由于MRM只对选定的特异离子进行质谱信号的采集,显著降低了噪音干扰信号,提高了检测结果的灵敏性和重复性,其中测得类胡萝卜素特征碎片离子与文献报道相符,m/z 535.5表示含羟基的β-隐黄素分子[24],m/z 400表示含β-紫罗酮环的β-隐黄素分子[25],m/z 119.1表示β-隐黄素分子中C9—C10与C13’—C14’两个片段间断裂产生的特征离子[26]。m/z 119.1、177.2和359、400、445分别为β-胡萝卜素分子C9—C10断裂[27-28],一分子末端亚甲基环[M+H]-137[24,29],多烯链上失去一分子甲苯m/z 92所得[30]。

图3 库买提杏中β-胡萝卜素及其异构体紫外-可见吸收光谱
Fig. 3 UV-Visible absorption spectra ofβ-carotene and its isomers in Kumati apricot
由于类胡萝卜素异构体间分子质量相同,仅根据质谱图无法判别其归属,还需结合其紫外-可见光谱特征、HPLC洗脱顺序及相关文献进行鉴定[31]。首先获取到每个组分的质谱信息,明确分子质量后,再结合光谱特征判断归属[32],国内外研究中,广泛采用Q值作为异构体光谱特征的判定依据[33]。结合图3和图1可知,图1d中的HPLC峰4、5、6、8具有共同的特征离子峰[M+H]+(m/z 537.5),为β-胡萝卜素异构体。由表2可知,峰6的3 个最大吸收波长分别为424、443、470 nm,与α-胡萝卜素光谱特征相符[34],故峰6为α-胡萝卜素;峰4、5、8最大吸收波长分别为447、443、446 nm,与峰7(全反式-β-胡萝卜素)相比发生了4、8、5 nm左右的“紫移”,且其吸收光谱在近紫外区330~340 nm处有顺式吸收峰,与类胡萝卜素单顺式异构体特征相符。根据前人研究结果,在同一流动相中越早洗脱出的顺式异构体,其顺式双键的位置越靠近分子中心[35],顺式峰吸收强度越大(Q值越大),为中心异构体的概率越大[36],并且15-或13-顺-β-胡萝卜素具有约在340 nm波长处存在强吸收峰[37]的特点。结合峰4出峰顺序特征及光谱特征:峰4在β-胡萝卜素的异构体中HPLC最早出峰,具有最大Q值,且在340 nm波长处有顺式吸收峰,再结合其最大吸收波长,可判定峰4为中心异构体:15-顺式-β-胡萝卜素;由β-胡萝卜素异构体的洗脱规律[27,38]可知:13-和15-顺式异构体均在全反式之前出峰,9-顺式异构体在全反式之后出峰,结合Q值及光谱信息,可判定峰5为13-顺式-β-胡萝卜素,峰8为9-顺式-β-胡萝卜素。
峰1、2能提取到[M+H]+(553.5),为β-隐黄素的异构体。β-隐黄素结构相比β-胡萝卜素,紫罗酮环上多一个羟基基团,但二者具有相同的异戊二烯结构主链性质[39],故在同一流动相中其对应位置异构体的色谱洗脱顺序与β-胡萝卜素应具有一致性,结合其光谱信息,初步判定峰1、2分别为15-顺式-β-隐黄素、13-顺式-β-隐黄素。
Aman等[40]应用HPLC-MS-核磁共振技术分离并鉴定了9-顺式和13-顺式玉米黄素,Strohschein等[41]通过HPLC-1H核磁共振鉴定出7 种β-胡萝卜素顺式异构体。它们的洗脱顺序依次都为9-顺式、全反式、13-顺,与本研究结果一致;Koyama等[42]在顺式异构体的研究中发现最大吸收波长顺序依次为:全反式-β-胡萝卜素>15-顺式-β-胡萝卜素>13-顺式-β-胡萝卜素,与本实验结果一致,(全反式-β-胡萝卜素(451 nm)>15-顺式-β-胡萝卜素(447 nm)>13-顺式-β-胡萝卜素(443 nm))。
采用HPLC法、外标法测定了库买提杏(2018年6月)中各类胡萝卜素组分含量,库买提杏中总类胡萝卜素含量为170 μg/g,其中β-胡萝卜素和其异构体为158.3 μg/g,占总类胡萝卜素的比例为93.2%,β-隐黄素和其异构体含量为11.7 μg/g,其所占总类胡萝卜素的比例为6.8%。而顺式类胡萝卜素异构体约占总含量的24.8%,其中9-顺式-β-胡萝卜素是含量最高的顺式类胡萝卜素,是全反式α-胡萝卜素的2 倍,这与Kurz等[10]研究结果相近。顺式类胡萝卜素在热与光照的条件下生成[26],本实验在测定过程中均采用室温避光措施,因此鲜杏中顺式类胡萝卜素异构体含量较高可能是植物体中本身存在的,目前已有许多研究证明植物中存在顺式异构体,在众多水果中也有发现[6]。
顺式与反式异构体生理活性有较大差异。李京[43]、仇丹[44]等发现:小鼠血液中的总顺式番茄红素比例超过60%,其在体内的抗氧化性反而高于全反式异构体,9-顺-虾青素在清除自由基方面效果更优于全反式。但β-胡萝卜素作为最具有VA原活性的类胡萝卜素之一,其顺式异构体13-顺和9-顺的VA原活性则分别只有全反式-β-胡萝卜素的53%和38%[45],含有较高顺式类胡萝卜素异构体,将降低其生理活性。
库买提杏中主要的全反式类胡萝卜素为β-胡萝卜素(114 μg/g),其次为α-胡萝卜素(8.3 μg/g),含少量β-隐黄素(5.4 μg/g);主要的顺式类胡萝卜素异构体为β-胡萝卜素异构体(9-顺式、13-顺式和15-顺式)和β-隐黄素异构体(13-顺式和15-顺式)。其中9-顺式-β-胡萝卜素含量高达18.8 μg/g,是库买提杏中含量最高的顺式类胡萝卜素。
[1] 新疆维吾尔自治区统计局. 新疆统计年鉴[M]. 北京: 中国统计出版社, 2017.
[2] 钱龙. 新疆库买提杏子贮藏保鲜商品化处理技术关键点研究[D].乌鲁木齐: 新疆农业大学, 2010.
[3] ABDEL-AAL E S M, AKHTAR H, ZAHEER K, et al. Dietary sources of lutein and zeaxanthin carotenoids and their role in eye health[J].Nutrients, 2013, 5(4): 1169-1185. DOI:10.3390/nu5041169.
[4] 马少君. 柑橘皮类胡萝卜素提取、活性分析和应用研究[D]. 武汉:华中农业大学, 2012.
[5] MURILLO E, GIUFFRIDA D, MENCHACA D, et al. Native carotenoids composition of some tropical fruits[J]. Food Chemistry,2013, 140(4): 825-836. DOI:10.1016/j.foodchem.2012.11.014.
[6] 张同, 赵婷, 惠伯棣. 类胡萝卜素在食物中的分布[J]. 食品科学,2010, 31(17): 487-492.
[7] HUANG W S, BI X, ZHANG X, et al. Comparative study of enzymes,phenolics, carotenoids and color of apricot nectars treated by high hydrostatic pressure and high temperature short time[J]. Innovative Food Science & Emerging Technologies, 2013, 18(2): 74-82.DOI:10.1016/j.ifset.2013.01.001.
[8] ALBANESE D, CINQUANTA L, CUCCURULLO G, et al. Effects of microwave and hot-air drying methods on color, β-carotene and radical scavenging activity of apricots[J]. International Journal of Food Science & Technology, 2013, 48(6): 1327-1333. DOI:10.1111/ijfs.12095.
[9] 田明, 徐晓云, 范鑫, 等. 柑橘中主要类胡萝卜素及其生物活性研究进展[J]. 华中农业大学学报, 2015, 34(5): 138-144.
[10] KURZ C, CARLE R, SCHIEBER A. HPLC-DAD-MS characterisation of carotenoids from apricots and pumpkins for the evaluation of fruit product authenticity[J]. Food Chemistry, 2008, 110(2): 522-530.DOI:10.1016/j.foodchem.2008.02.022.
[11] ZAGHDOUDI K, PONTVIANNE S, FRAMBOISIER X, et al.Accelerated solvent extraction of carotenoids from: tunisian kaki (Diospyros kaki L.), peach (Prunus persica L.) and apricot(Prunus armeniaca L.)[J]. Food Chemistry, 2015, 184(5): 131-139.DOI:10.1016/j.foodchem.2015.03.072.
[12] RUIZ D, EGEA J, TOMÁSBARBERÁN F A, et al. Carotenoids from new apricot (Prunus armeniaca L.) varieties and their relationship with flesh and skin color[J]. Journal of Agricultural and Food Chemistry,2005, 53(16): 6368-6374. DOI:10.1021/jf0480703.
[13] 惠伯棣, 李京. 红和黄瓤西瓜中类胡萝卜素含量和组成比较[J]. 食品科学, 2008, 29(12): 587-591. DOI:10.3321/j.issn:1002-6630.2008.12.137.
[14] 陈洁琼, 宋江峰, 何美娟, 等. 鲜食玉米籽粒中主要类胡萝卜素鉴定与含量分析[J]. 食品科学, 2015, 36(18): 108-113. DOI:10.7506/spkx1002-6630-201518020.
[15] 樊金玲, 杨睿, 孙晓菲, 等. 榆树叶中类胡萝卜素的组成和含量[J]. 食品科学, 2015, 36(2): 155-159. DOI:10.7506/spkx1002-6630-201502030.
[16] 陶俊, 张上隆, 徐建国, 等. 柑橘果实主要类胡萝卜素成分及含量分析[J]. 中国农业科学, 2003, 36(10): 1202-1208. DOI:10.3321/j.issn:0578-1752.2003.10.015.
[17] ETZBACH L, PFEIFFER A, WEBER F, et al. Characterization of carotenoid profiles in goldenberry (Physalis peruviana L.) fruits at various ripening stages and in different plant tissues by HPLC-DADAPCI-MSn[J]. Food Chemistry, 2018, 245: 508-517. DOI:10.1016/j.foodchem.2017.10.120.
[18] ROSSO V V D, MERCADANTE A Z. HPLC-PDA-MS/MS of Anthocyanins and carotenoids from dovyalis and tamarillo fruits[J].Journal of Agricultural and Food Chemistry, 2007, 55(22): 9135-9141.DOI:10.1021/jf071316u.
[19] 刘茜, 张浩, 周瑶, 等. 液相色谱-串联质谱法检测辐照蛋白类功能食品中酪氨酸同分异构体[J]. 分析测试学报, 2014, 33(8): 946-950.DOI:10.3969/j.issn.1004-4957.2014.08.015.
[20] 侯桂雪, 王全会, 刘斯奇. 多重反应监测(MRM): 靶标蛋白质定量的新方法[J]. 中国科学(化学), 2014, 44(5): 746-752.
[21] 肖亚冬, 李大婧, 刘春泉, 等. 叶黄素、β-隐黄质及其异构体检测方法的研究[J]. 现代食品科技, 2016, 32(2): 330-335.
[22] CHEN J P, TAI C Y, CHEN B H. Improved liquid chromatographic method for determination of carotenoids in Taiwanese mango(Mangifera indica, L.)[J]. Journal of Chromatography A, 2004,1054(1/2): 261-268. DOI:10.1016/j.chroma.2004.08.100.
[23] 仇丹, 陈志荣, 李浩然. β-胡萝卜素异构体的定性分析[J]. 食品科学, 2008, 29(4): 50-53. DOI:10.3321/j.issn:1002-6630.2008.04.003.
[24] RIVERA S M, CANELAGARAYOA R. Analytical tools for the analysis of carotenoids in diverse materials[J]. Journal of Chromatography A, 2012, 1224: 1-10. DOI:10.1016/j.chroma.2011.12.025.
[25] MARIUTTI L R B, PEREIRA D M, ADRIANA Z M, et al. Further insights on the carotenoid profile of the echinoderm Marthasterias glacialis L.[J]. Marine Drugs, 2012, 10(7): 1498-1510. DOI:10.3390/md10071498.
[26] FRATIANNI A, ALBANESE D, MIGNOGNA R, et al. Degradation of carotenoids in apricot (Prunus armeniaca L.) during drying process[J]. Plant Foods for Human Nutrition, 2013, 68(3): 241-246.DOI:10.1007/s11130-013-0369-6.
[27] RIVERA S M, PAUL C, RAMON C G. Identification of carotenoids using mass spectrometry[J]. Mass Spectrometry Reviews, 2014, 33(5):353-372. DOI:10.1002/mas.21390.
[28] REN D, ZHANG S. Separation and identification of the yellow carotenoids in Potamogeton crispus L.[J]. Food Chemistry, 2008,106(1): 410-414. DOI:10.1016/j.foodchem.2007.05.074.
[29] VAN BREEMEN R B, DONG L, PAJKOVIC N D. Atmospheric pressure chemical ionization tandem mass spectrometry of carotenoids[J]. International Journal of Mass Spectrometry, 2012,312(2): 163-172. DOI:10.1016/j.ijms.2011.07.030.
[30] RIBEIRO J A A, ALMEIDA E S D, NETO B A D, et al. Identification of carotenoid isomers in crude and bleached palm oils by mass spectrometry[J]. LWT-Food Science and Technology, 2018, 89: 631-637. DOI:10.1016/j.lwt.2017.11.039.
[31] 李大婧, 刘春菊, 肖亚冬, 等. 叶黄素及其顺式异构体的快速检测[J].食品科学, 2016, 37(4): 206-211. DOI:10.7506/spkx1002-6630-201604037.
[32] 仇丹, 吴月婵, 金兴江, 等. 类胡萝卜素几何异构化反应的研究进展[J].食品科技, 2010, 35(11): 257-261.
[33] 李大婧, 王闯, 徐爱琴, 等. 高效液相色谱法测定叶黄素顺、反异构体[J]. 食品科学, 2012, 33(22): 186-190.
[34] GLASER T, LIENAU A, ZEEB D, et al. Qualitative and quantitative determination of carotenoid stereoisomers in a variety of spinach samples by use of MSPD before HPLC-UV, HPLC-APCI-MS, and HPLC-NMR on-line coupling[J]. Chromatographia, 2003, 57(Suppl 1):19-25. DOI:10.1007/BF02492079.
[35] TAI C Y, CHEN B H. Analysis and stability of carotenoids in the flowers of daylily (Hemerocallis disticha) as affected by various treatments[J]. Journal of Agricultural and Food Chemistry, 2000,48(12): 5962-5968. DOI:10.1021/jf000956t.
[36] 金兴江, 吴月婵, 仇丹, 等. 虾青素几何异构体的分离、鉴定及抗氧化性能研究[J]. 食品科技, 2010, 35(12): 224-227.
[37] 张颖, 陈华翰, 李春美. 番茄中类胡萝卜素及其顺式异构体的HPLC分析[J]. 分析测试学报, 2016, 35(4): 448-453. DOI:10.3969/j.issn.1004-4957.2016.04.013.
[38] LACKER T, STROHSCHEIN S, ALBERT K. Separation and identification of various carotenoids by C30 reversed-phase highperformanceliquid chromatography coupled to UV and atmospheric pressure chemical ionization mass spectrometric detection[J]. Journal of Chromatography A, 1999, 854(1/2): 37-44. DOI:10.1016/S0021-9673(99)00584-1.
[39] 惠伯棣. 类胡萝卜素化学及生物化学[M]. 北京: 中国轻工业出版社,2005.
[40] AMAN R, BIEHL J, CARLE R, et al. Application of HPLC coupled with dad, APCI-MS and NMR to the analysis of lutein and zeaxanthin stereoisomers in thermally processed vegetables[J]. Food Chemistry,2005, 92(4): 753-763. DOI:10.1016/j.foodchem.2004.10.031.
[41] STROHSCHEIN S, PURSCH M, ALBERT K. Hyphenation of high performance liquid chromatography with nuclear magnetic resonance spectroscopy for the characterization of β-carotene isomers employing a C30, stationary phase[J]. Journal of Pharmaceutical &Biomedical Analysis, 1999, 21(3): 669-677. DOI:10.1016/S0731-7085(99)00164-8.
[42] KOYAMA Y, TAKII T, SAIKI K, et al. Configuration of the carotenoid in the reaction centers of photosynthetic bacteria. 2.comparison of the resonance raman lines of the reaction centers with those of the 14 different cis-trans isomers of beta-carotene[J].Photobiochemistry & Photobiophysics, 1983, 5(3): 139-150.DOI:10.1016/0005-2728(82)90001-9.
[43] 李京, 惠伯棣, 裴凌鹏. 番茄红素: 被关注的功能因子[J]. 食品科学,2005, 26(8): 461-464.
[44] 惠伯棣, 李京, 贾宁, 等. 番茄果皮超临界流体萃取物中类胡萝卜素在大鼠血清中的积累[J]. 食品科学, 2008, 29(7): 408-411.DOI:10.3321/j.issn:1002-6630.2008.07.092.
[45] MELENDEZ M A J, STINCO C M, LIU C, et al. A simple HPLC method for the comprehensive analysis of cis/trans (Z/E) geometrical isomers of carotenoids for nutritional studies[J]. Food Chemistry,2013, 138(2/3): 1341-1350. DOI:10.1016/j.foodchem.2012.10.067.
Identification and Quantification of Major Carotenoids in Kumaiti Apricot
DU Binhua, AILA·Reheman, CHEN Qi, et al. Identification and quantification of major carotenoids in Kumaiti apricot[J].Food Science, 2019, 40(18): 189-194. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20181021-222.http://www.spkx.net.cn