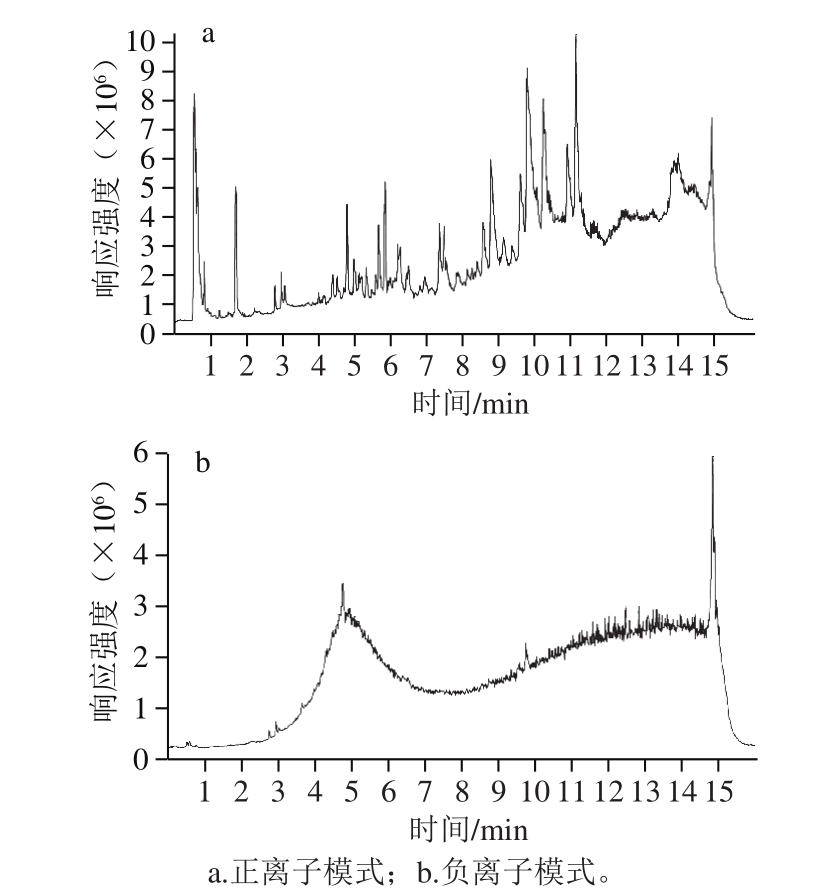
图1 QC样本的总离子流图
Fig. 1 Total ion current (TIC) chromatogram of QC samples
宁夏盐池滩羊是宁夏优势特色畜种,其肉脂肪分布均匀,肉质鲜美,风味独特,广受消费者欢迎[1-2]。冷鲜滩羊肉是指严格执行检疫制度,对屠宰后的畜胴体迅速进行冷却处理,使胴体温度在24 h内降为0~4 ℃,并在后续加工、流通和销售过程中始终保持0~4 ℃范围内的生鲜羊肉[3-4]。
随着人们生活质量的逐步提高,冷鲜肉正替代热鲜肉成为人们肉类消费中的主流。冷鲜肉保留了肉质绝大部分营养成分,具有鲜嫩多汁、易咀嚼等特点,因此随着社会经济发展,肉品产业的发展趋势将是品质佳的低温冷鲜肉[5-7]。冷鲜肉贮藏过程中脂肪代谢的变化,是肉成熟理论研究的重要领域。代谢组学技术是对代谢物的集合进行分析,是对代谢物的整体变化规律系统化[8-9]。现在主要的检测手段有:液相色谱-质谱(liquid chromatographymass spectrometry,LC-MS)联用技术、毛细管电泳-质谱联用技术以及气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)联用技术[10-13]。Abraham等[14]采用了GC-MS、LC-MS联用技术,结合主成分分析及偏最小二乘判别分析(partial least squaresdiscrimination analysis,PLS-DA),对牛腰最长肌和腰大肌的代谢物进行了检测。目前,对于宰后代谢的研究多集中在某个或某几个代谢物[15-21],如李永鹏等[22]采用GC-MS技术对比了宰后成熟过程中牦牛肉中挥发性风味化合物的变化情况表明,成熟后的牦牛肉中,含硫化合物(肉香味)比成熟前增加了24%,特别是2-乙酰基噻唑(肉香)、甲硫基丙醛(肉汤味)分别增加了100%和78%。朱荣生等[23]对冷藏期间猪肌肉中肌苷酸沉积规律进行的研究表明,肌苷酸与核糖在水和脂肪中加热能产生明显的鲜味,但肌肉中肌苷酸及其降解产物肌苷、次黄嘌呤含量在贮藏过程中呈动态变化。随贮藏期延长,肌苷酸含量先增加后逐渐降低,肌苷和次黄嘌呤在贮藏第5~6天时达到最高值。而对宰后贮藏过程中脂肪细胞的整个代谢过程报道较少。
脂质在肉类风味发展中起多重要的作用。Toldrá等[24]采用GC-MS检测了猪肉中糖及其相关物质的代谢情况,结果表明糖酵解,蛋白质水解和脂肪分解产生大量化合物如糖、肽、氨基酸、无机盐和有机酸等,以上化合物对肉类风味起很重要的作用,并且大多数内源性酶是引起这种反应的主要原因。文志勇等[25]研究了脂质氧化所产生的香味物质。表明,油酸、亚油酸等不饱和脂肪酸氧化生成挥发性醛如己醛、庚醛等,而油酸、亚油酸等脂肪酸被认为是产生风味物质的前体。本实验以滩羊宰后脂肪细胞为特殊生命系统,采用GC-MS、LC-MS技术研究宰后脂肪细胞0~4 ℃贮藏中可检测出的全部代谢物、代谢通路,及其厌氧呼吸条件下的相互关系及联动转化,分析时间推移中代谢网络变化。通过代谢组学研究宰后脂肪组织代谢物与风味物质前体、中间体的关联,进一步研究滩羊肉风味物质前体、中间体合成途径及其调控机制,为冷鲜滩羊肉生产技术改进提供理论指导。
所取样本均来自现宰杀的盐池滩羊 宁夏盐池县大夏牧场食品有限公司。
ACQUITY UPLC超高效液相色谱、色谱柱ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)美国Waters公司;AB Triple TOF 5600高分辨质谱美国应用生物系统公司;Pegasus 4D全二维气相色谱飞行时间质谱联用仪 美国Leco公司;色谱柱DB-5MS(30 m×250 μm,0.25 μm,J&W Scientific,Folsom,CA)。
1.3.1 样品采集
采集贮藏温度为0~4 ℃,相对湿度为85%的滩羊背最长肌上部皮下脂肪400 mg,封装于灭菌冷冻管中待用。采样周期为4 d,即采样时间点为第0、4、8、12天,每组样本做8 个平行。
1.3.2 样品前处理
1.3.2.1 GC-MS样品前处理
精密称取30 mg/组样本,放入1.5 mL的离心(EP)管中。依次加入两颗小钢珠,加入20 μL的内标(L-2-氯-苯丙氨酸,0.3 mg/mL,甲醇配制)和600 μL预冷的甲醇-水溶液(4∶1,V/V),在-80 ℃冰箱中放置2 min。随即放入研磨机中研磨(60 Hz,2 min),加入120 μL氯仿。再用冰水浴超声提取10 min,4 ℃静置10 min。4 ℃、12 000 r/min离心10 min,取300 μL的上清液装入玻璃衍生瓶中。质控样本(quality control,QC)由所有样本的提取液等体积混合制备而成,每个QC的体积与样本相同。采用冷冻浓缩离心干燥器挥干样本。随后向玻璃衍生小瓶中加入80 μL的甲氧胺盐酸盐吡啶溶液(15 mg/mL),涡旋振荡2 min后,于振荡培养箱中37 ℃中90 min进行肟化反应。将样本取出后再加入80 μL的(bis(trimethylsilyl) trifluoroacetamide,BSTFA,含1%TMCS)衍生试剂和20 μL的正己烷,涡旋振荡2 min后,于70 ℃反应60 min。取出样本后,在室温放置30 min,进行GC-MS代谢组学分析。
1.3.2.2 LC-MS样品前处理
精确称取30 mg/组样本于1.5 mL EP管中,加入20 μL内标(L-2-氯-苯丙氨酸0.3 mg/mL,甲醇配制),加入400 μL甲醇-水溶液(4∶1,V/V);加入两个小钢珠,在-80 ℃冰箱中放置2 min后,放入研磨机中研磨(60 Hz、2 min);冰水浴中超声提取10 min;-20 ℃静置30 min;4 ℃、13 000 r/min离心15 min,用注射器吸取150 μL的上清液,使用0.22 μm的有机相针孔过滤器过滤后,转移到LC进样小瓶,-80 ℃保存,直到进行LC-MS分析。QC由所有样本的提取液等体积混合制备而成,每个QC的体积与样本相同。
1.3.3 仪器测定条件
1.3.3.1 GC-MS条件
色谱条件:DB-5MS毛细管柱(30 m × 250 μm),载气为高纯氦气(纯度不小于99.999%),流速1.0 mL/min,进样口的温度260 ℃。进样量1 μL,不分流进样。程序升温:柱温箱的初始温度为80 ℃,保持2 min,以10 ℃/min程序升温至180 ℃ ,5 ℃/min升温至240 ℃;20 ℃/min升温至280 ℃保持9 min。
质谱条件:电子电离源,离子源温度220 ℃,四极杆温度150 ℃,电子能量70 eV。扫描方式为全扫描模式,质量扫描m/z 30~600。
1.3.3.2 LC-MS分析条件
色谱条件:色谱柱ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm);柱温45 ℃;流动相:水(含0.1%甲酸)、乙腈(含0.1%甲酸);流速0.4 mL/min;进样体积5 μL。
质谱条件:电喷雾;样品质谱信号采集分别采用正负离子扫描模式。
将所得的数据导入SIMCA软件包(version 14.0,Umetrics,Umeå,Sweden),先采用无监督的主成分分析(principal component analysis,PCA)观察各样本之间的总体分布和整个分析过程的稳定性,后用有监督的PLS-DA区分各组间代谢轮廓的总体差异,找到组间的差异代谢物。为防止模型过拟合,采用7 次循环交互验证和200 次响应排序检验的方法考察模型的质量。
1.4.1 GC-MS数据预处理
将采用GC-MS所得数据导入Chroma TOF(version 4.34,LECO,St Joseph,MI)软件进行预处理,峰提取、去噪音、反卷积等;而后采用内标法对数据进行归一化处理,经过滤后,检测到物质峰578 个,使用NIST和Fiehn数据库对代谢物进行定性,导出原始数据矩阵。
1.4.2 LC-MS数据预处理
对所有样本的基峰色谱图进行可视化检查,将原始数据转换为mzML格式,峰提取后,将内标峰从矩阵中删除。再进行归一化处理。将QC中相对标准偏差(relative standard deviation,RSD)大于30%的变量删除。图1a、b分别展示了质控样本正负离子模式下的总离子流图。

图1 QC样本的总离子流图
Fig. 1 Total ion current (TIC) chromatogram of QC samples
将正负离子数据合并成一个数据矩阵,该矩阵包含了原始数据提取到的所有可以用于分析的信息。从表1可以看出,对QC以RSD低于30%进行筛选,特征值得率大于75%,说明该代谢组学方法具有的良好重复性。
表1 QC样本筛选结果(RSD<30%)
Table 1 Filtering of QC samples for RSD < 30%
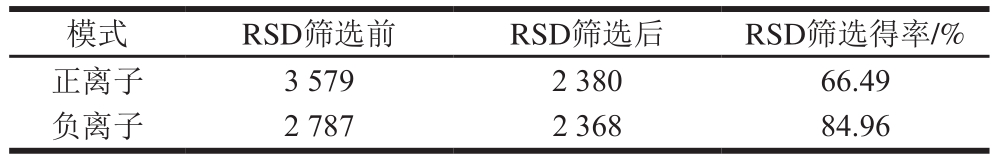
模式 RSD筛选前 RSD筛选后 RSD筛选得率/%正离子 3 579 2 380 66.49负离子 2 787 2 368 84.96
2.1.1 基于GC-MS对滩羊脂肪冷鲜贮藏不同组别的多元变量分析


图2 冷鲜滩羊脂肪贮藏不同组别的PCA得分图
Fig. 2 Score plots of PCA model obtained for differential metabolites of Tan sheep meat lipids stored for 0 versus 4 days, 4 versus 8 days, and 8 versus 12 days
应用PCA法分别对冷鲜滩羊脂肪贮藏0 d组和4 d组、4 d组和8 d组、8 d组和12 d组的代谢物进行GC-MS检测数据分析。PCA得分图如图2所示。
为了将上述组别更好地区分,又采用PLS-DA法将样本归类分析。在PLS-DA中,一般变量权重值(variable important in projection,VIP)大于1的变量被认为是差异变量,结果见图3。

图3 冷鲜滩羊脂肪贮藏不同组别的PLS-DA得分图
Fig. 3 Score plots of PLS-DA model obtained for differential metabolites of Tan sheep meat sotred for 0 versus 4 days, 4 versus 8 days,and 8 versus 12 days
由图3可见,滩羊脂肪贮藏0 d组和4 d组、4 d组和8 d组、8 d组和12 d组均可完全区分;但各组内呈现一定发散分布,这反映了滩羊脂肪贮藏4 d组、8 d组及12 d组组内存在明显差异。该模型的可解释变量R2X=0.512,模型可预测度Q2=0.092 2。表明该模型能很好地解释和预测两组样本之间的差异。采用随机多次的排列实验进一步检验实验的有效性,以分类变量y的不同排列顺序所对应不同的随机Q2值作为检验模型稳健性的评判标准。响应排序检验图如图4所示。

图4 冷鲜滩羊脂肪贮藏不同组别的响应排序检验图
Fig. 4 Permutation test of Tan sheep meat lipids stored for 0 versus 4 days, 4 versus 8 days, and 8 versus 12 days
由图4可得,滩羊脂肪贮藏0 d组和4 d组、4 d组和8 d组、8 d组和12 d组的响应排序检验截距分别为R2=0.774,Q2=-0.379、R2=0.789,Q2=-0.335及R2=0.811,Q2=-0.327体现了模型的稳健性,表明基于GC-MS技术建立的PLS-DA模型能较好的解释各组之间的差异。
2.1.2 基于LC-MS对滩羊脂肪冷鲜贮藏不同组别的多元变量分析
应用PCA法分别对冷鲜滩羊脂肪贮藏0 d组和4 d组、4 d组和8 d组、8 d组和12 d组的代谢物进行LC-MS检测数据分析。PCA得分图如图5所示。

图5 冷鲜滩羊脂肪贮藏不同组别的PCA得分图
Fig. 5 Score plots of PCA model obtained for differential metabolites of Tan sheep meat lipids stored for 0 versus 4 days, 4 versus 8 days, and 8 versus 12 days
为了将上述组别更好地区分,找到潜在的差异代谢物,又采用了PLS-DA法将样本归类分析,结果见图6。


图6 冷鲜滩羊脂肪贮藏不同组别的PLS-DA得分图
Fig. 6 Score plots of PLS-DA model obtained for differential metabolites of Tan sheep meat lipids stored for 0 versus 4 days, 4 versus 8 days, and 8 versus 12 days
由图6可见,滩羊脂肪贮藏0 d组与4 d组、4 d组与8 d组、8 d组与12 d组均可完全区分;其各组内呈现一定的分散分布,说明各组内存在明显的差异。该模型的可解释变量R2X=0.531,模型可预测度Q2=0.089 3。表明该模型能很好地解释和预测两组样本之间的差异。采用随机多次的排列实验进一步检验实验的有效性,以分类变量y的不同排列顺序所对应不同的随机Q2值作为检验模型稳健性的评判标准。响应排序检验图如图7所示。

图7 冷鲜滩羊脂肪贮藏不同组别的响应排序检验图
Fig. 7 Permutation test of Tan sheep meat lipids stored for 0 versus 4 days, 4 versus 8 days, and 8 versus 12 days
由图7可得,滩羊脂肪贮藏0 d组和4 d组、4 d组和8 d组、8 d组和12 d组的响应排序检验截距分别为R2=0.612,Q2=-0.707、R2=0.654,Q2=-0.798及R2=0.467,Q2=-0.426体现了模型的稳健性,表明基于LC-MS技术建立的PLS-DA模型能较好的解释各组之间的差异。
采用多维分析和单维分析相结合的方法,筛选组间差异代谢物,标准为PLS-DA模型第1主成分的VIP值高于1.2,t检验的P值低于0.05。
采用GC-MS技术筛选出冷鲜滩羊脂肪贮藏0 d组和4 d组、4 d组和8 d组、8 d组和12 d组的差异代谢物分别为64、65、27 种。采用LC-MS技术筛选出各组的差异代谢物分别为99、75、70 种。从差异代谢物种类变化可知,所获得的差异代谢物的种类随冷鲜滩羊脂肪贮藏时间的延长呈先升后降趋势。
采用GC-MS筛选出的饱和脂肪酸有花生酸、硬脂酸、棕榈酸;n-6不饱和脂肪酸有亚油酸、花生四烯酸;n-9不饱和脂肪酸有油酸、反油酸。采用LC-MS筛选出的饱和脂肪酸有硬脂酸;n-3不饱和脂肪酸有二十碳五烯酸。
将筛选出的差异代谢物中与糖酵解及脂质代谢的相关差异代谢物,做关联对比分析。在0 d组与4 d组中发现糖酵解原料葡萄糖、果糖相对含量显著上升相,说明宰后冷鲜贮藏4 d内,与葡萄糖、果糖相关的正常代谢途径受阻,导致二者含量积累。在此时,丙酮酸的相对含量下降,说明糖酵解生成丙酮酸的途径受阻或相关代谢通路关闭,而丙酮酸与生糖氨基酸的相互转化及进入三羧酸循环的相关代谢途径并未受到抑制,故丙酮酸的相对含量显著下降。在4 d组与8 d组中发现糖酵解的产物葡萄糖-6-磷酸、果糖-6-磷酸的相对含量显著上升,该现象说明经过一段冷鲜贮藏后,葡萄糖、果糖转化为葡萄糖-6-磷酸、果糖-6-磷酸的相关合成途径打开,这可能是由于与该途径相关的酶的活性提高[26-32]。
所筛选出的游离氨基酸在冷鲜贮藏第8天时相对含量发生变化,在之后的贮藏期内无变化;如苏氨酸、丙氨酸、D-丝氨酸、DL-正亮氨酸在贮藏第8天时相对含量显著上升,而天冬氨酸、谷氨酸、精氨酸相对含量显著下降。这说明大部分游离氨基酸在贮藏第8天时产生,而其中苏氨酸、丙氨酸、谷氨酸及天冬氨酸、精氨酸等属呈味氨基酸[33-34]。同时还发现了呈苦味物质次黄嘌呤[35-41],其由肌苷转化而来[42-43]。说明了在冷鲜贮藏第8天时,呈味小分子物质含量出现较大变化。
在贮藏第8天时,由GC-MS检测到油酸、硬脂酸、棕榈酸含量显著下降。结合LC-MS中检测到的L-肉碱代谢的变化,可知在第8天时肉碱相对含量增高,而丙酮酸的相对含量上升,这与油酸、硬脂酸、棕榈酸的相对含量下降相对应,说明在贮藏第8天时,脂肪酸的代谢较活跃,可能是与肉碱参线粒体中乙酰辅酶A的合成从而进一步使脂肪酸代谢活跃[27]。具体差异代谢物如表2、3所示。
13-羟基十八碳二烯酸(13-hydroxyoctadecadienoicacid,13-HODE)作为亚油酸的分解产物,其在贮藏4 d时的平均表达量显著升高,这种现象可能由于13-HODE的主要代谢方式是通过NAD+依赖性脱氢酶(13-HODE脱氢酶)氧化成2,4-二烯酮、13-HODE的过程受阻或亚油酸分解活跃所导致的。13-HODE是由亚油酸在动物体内合成的[44-45]。大多数与脂肪酸相关差异代谢物的相对含量变化均发生在4~8 d内,如油酸、棕榈酸、硬脂酸及二十碳五烯酸,而油酸、棕榈酸、硬脂酸在4 d与8 d组中相对含量均下降,而二十碳五烯酸相对含量上升。该现象说明,在贮藏期第8天时,与脂肪酸相关的代谢途径受到抑制,虽然第4天时并没有检测到相关脂肪酸相对含量的变化,亦可能是由于此类代谢物在4 d时并无表达量差异所致。
所筛选出的游离脂肪酸在冷鲜贮藏第8天时相对含量发生显著变化,该现象的原因可以解释为脂质氧化降解所产生的香气物质如有烤肉味的反,反-2,4-癸二烯醛,具有油脂味的壬醛及有肥皂味的2-庚酮,有青草味的1-己醇等的前体物质为棕榈酸、亚麻酸、亚油酸、油酸及其组合[46-51]。这也进一步证明在冷鲜贮藏过程中,风味物质的前体就已经产生。
表2 采用GC-MS筛选的冷鲜滩羊脂肪贮藏12 d主要差异代谢物种类及平均表达量变化
Table 2 Changes in average expression levels of main differential metabolites in chilled Tan sheep meat lipids during 12-day storage determined by GC-MS

注:P值由t检验的结果得出,评价变量在两组样本之间差异是否显著;FC值为代谢物在两组样本中平均表达量的比值;↑.上调,↓.下调。-.对比组内样本无差异。下同。
类别 英文名称 中文名称0 d组与4 d组 4 d组与8 d组 8 d组与12 d组P值 FC值 变化 P值 FC值 变化 P值 FC值 变化糖类glucose 葡萄糖 2.68×10-5 5.50 ↑ - - - - - -fructose 果糖 2.81×10-5 3.53 ↑ 3.38×10-5 2.56 ↑ 5.13×10-31.73 ↑糖代谢衍生物pyruvic acid 丙酮酸 6.59×10-3 0.349 ↓ 2.89×10-3 3.27 ↑ 4.98×10-21.83 ↑fructose-6-phosphate 果糖-6-磷酸 - - - 2.60×10-37.35 ↑ - - -glucose-6-phosphate 葡萄糖-6-磷酸 - - - 5.98×10-38.79 ↑ - - -ribose-5-phosphate 5-磷酸核糖 2.23×10-60.059 3 ↓ - - - - - -游离氨基酸aspartic acid 天冬氨酸 - - - 1.92×10-60.066 6 ↓ - - -threonine 苏氨酸 - - - 8.70×10-32.81 ↑ - - -alanine 丙氨酸 - - - 1.42×10-31.72 ↑ - - -glutamine 谷氨酸 - - - 3.48×10-30.847 ↓ - - -脂肪酸oleic acid 油酸 - - - 3.61×10-20.53 ↓ - - -palmitic acid 棕榈酸 - - - 4.04×10-20.609 ↓ - - -stearic acid 硬脂酸 - - - 6.98×10-30.613 ↓ - - -Arachidic acid 花生酸 3.04×10-2 2.33 ↑ 5.22×10-30.264 ↓ 3.51×10-23.26 ↑arachidonic acid 花生四烯酸 - - - 5.79×10-30.498 ↓ - - -
表3 采用LC-MS筛选的冷鲜滩羊脂肪贮藏12 d内主要差异代谢物种类及平均表达量变化
Table 3 Changes in average expression levels of main differential metabolites of chilled Tan sheep meat lipids during 12-day storage determined by LC-MS
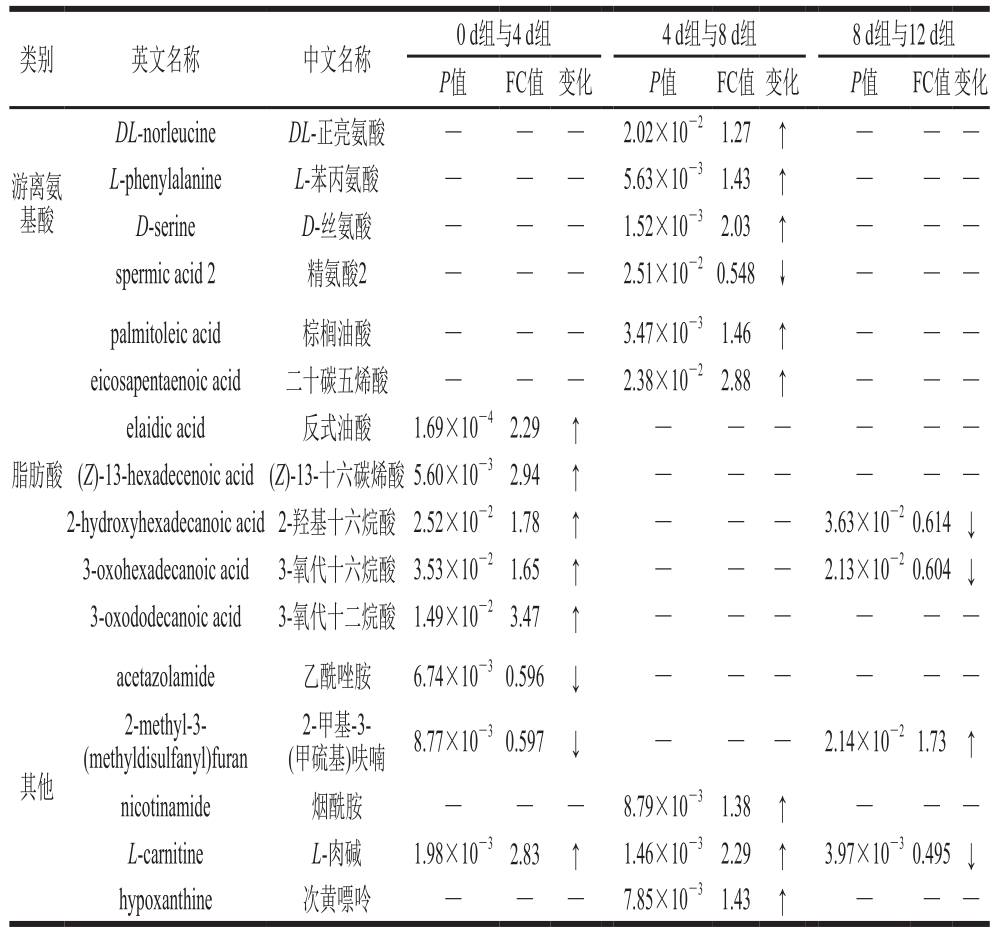
类别 英文名称 中文名称0 d组与4 d组 4 d组与8 d组 8 d组与12 d组P值 FC值 变化 P值 FC值 变化 P值 FC值变化游离氨基酸DL-norleucine DL-正亮氨酸 — — — 2.02×10-21.27 ↑ — — —L-phenylalanine L-苯丙氨酸 — — — 5.63×10-31.43 ↑ — — —D-serine D-丝氨酸 — — — 1.52×10-32.03 ↑ — — —spermic acid 2 精氨酸2 — — — 2.51×10-20.548↓ — — —脂肪酸palmitoleic acid 棕榈油酸 — — — 3.47×10-31.46 ↑ — — —eicosapentaenoic acid 二十碳五烯酸 — — — 2.38×10-22.88 ↑ — — —elaidic acid 反式油酸 1.69×10-42.29 ↑ — — — — — —(Z)-13-hexadecenoic acid(Z)-13-十六碳烯酸5.60×10-32.94 ↑ — — — — — —2-hydroxyhexadecanoic acid 2-羟基十六烷酸 2.52×10-21.78 ↑ — — — 3.63×10-20.614 ↓3-oxohexadecanoic acid 3-氧代十六烷酸 3.53×10-21.65 ↑ — — — 2.13×10-20.604 ↓3-oxododecanoic acid 3-氧代十二烷酸 1.49×10-23.47 ↑ — — — — — —acetazolamide 乙酰唑胺 6.74×10-30.596 ↓ — — — — — —2-methyl-3-(methyldisulfanyl)furan 2-甲基-3-(甲硫基)呋喃 8.77×10-30.597 ↓ — — — 2.14×10-21.73 ↑其他nicotinamide 烟酰胺 — — — 8.79×10-31.38 ↑ — — —L-carnitine L-肉碱 1.98×10-32.83 ↑ 1.46×10-32.29 ↑ 3.97×10-30.495 ↓hypoxanthine 次黄嘌呤 — — — 7.85×10-31.43 ↑ — — —
冷鲜滩羊脂肪贮藏过程中差异代谢物的种类随贮藏时间的延长总体呈下降趋势。宰后机体内很快处于缺氧状态,但细胞仍企图维持其ATP在一个较高水平,机体利用糖酵解代替氧化磷酸化而提供ATP以及利用磷酸肌酸和ADP的转化补充ATP,于是构成了一个宰后供能反应体系。0 d组与4 d组,与糖代谢有关的物质如葡萄糖,含量上升,说明这段时间内,细胞处于无氧环境中,在0~4 ℃的温度下,并没有立即进行糖酵解过程。4 d组与8 d组,细胞在低温环境下,利用氨基酸、糖等能源物质供能,同时,脂肪代谢的途径也被激活,在此时大量的呈味物质产生,如呈苦味及鲜味的次黄嘌呤、丙氨酸及苏氨酸,以及脂肪代谢产生的种风味物质前体的油酸、棕榈酸、硬脂酸。脂肪细胞中检测出次黄嘌呤、丙氨酸及苏氨酸等呈味物质的现象可以解释为,氨基酸、糖、脂肪酸之间的转化体系在屠宰时突然停止,虽然机体死亡,但组织、细胞的代谢活动并未停止,只是在机体死亡后,正常的三者之间的转换途径突然关闭,而经过一段时间的冷鲜贮藏后,其相互转换的途径重新开启所致。贮藏8 d作为宰后细胞代谢活动的分水岭,风味物质前体如油酸、棕榈酸、硬脂酸在此时段内产生,但其含量在8 d后就处于下降状态。而采用GC-MS和LC-MS法检测全部代谢产物,更深入的了解了宰后代谢的整体变化情况,结果表明,两种方法下测出的差异代谢物有互补作用。因此,研究宰后脂肪代谢随贮藏时间的推移变化,能为冷鲜滩羊肉生产技术改进提供理论指导。
[1] 张未风, 赵改名, 张春晖, 等. 小尾寒羊发酵香肠挥发性风味成分的分离与鉴定[J]. 现代食品科技, 2012, 28(11): 1575-1580.DOI:10.13982/j.mfst.1673-9078.2012.11.043.
[2] 王林兰, 赵成章. 宁夏手抓羊肉的生产工艺[J]. 肉类工业, 2007(11):10-12.
[3] 郇延军, 许伟, 赵雅娟, 等. 冷鲜肉品质评价指标的探讨[J]. 食品科学, 2012, 33(21): 107-110.
[4] 周光宏. 畜产品加工学[M]. 北京: 中国农业出版社, 2011: 79-83.
[5] 程述震, 王晓拓, 王志东. 冷鲜肉保鲜技术研究进展[J]. 食品研究与开发, 2017, 38(16): 194-198.
[6] KOUTSIDIS G, ELMORE J S, ORUNA-CONCHA M J, et al. Water soluble of beef flavor. Part II: effect of post-mortem conditioning[J].Meat Science, 2007, 79: 270-277.
[7] HUGHES J M , OISETH S K , PURSLOW P P, et al. A structural approach to understanding the interactions between colour, waterholding capacity and tenderness[J]. Meat Science, 2014, 98(3): 520-532.
[8] 刘思洁, 吴永宁, 方赤光, 等. 代谢组学技术在食品安全中的应用[J].食品安全质量检测学报, 2014, 5(4): 1082-1086.
[9] 王稳航, 肜祺, 李得旺, 等. 畜禽屠宰后肌肉细胞死亡机制研究进展[J]. 现代食品科技, 2013, 29(2): 429-433. DOI:10.13982/j.mfst.1673-9078.2013.02.040.
[10] 李娟, 任路静, 孙冠男, 等. 气相色谱-质谱联用技术及其在代谢组学中的应用[J]. 生物工程学报, 2013, 29(4): 434-446. DOI:10.13345/j.cjb.2013.04.009.
[11] YI L Z, HE J, LIANG Y Z, et al. Plasma fatty acid metabolic profiling and biomarkers of type 2 diabetes mellitus based on GC/MS and PLSLDA[J]. FEBS Letters, 2006, 580(30): 6837-6845.
[12] MUROYA S, OE M, NAKAJIMA Y I, et al. CE-TOFMS-based metabolomic profiling revealed characteristic metabolic pathways in postmortem porcine fast and slow type muscles[J]. Meat Science,2014, 98(4): 726-735. DOI:10.1016/j.meatsci.2014.07.018.
[13] HUANG H, LARSEN M R, LAMETSCH R. Changes in phosphorylation of myofibrillar proteins during postmortem development of porcine muscle[J]. Food Chemistry, 2012, 134(4):1999-2006.
[14] ABRAHAM A, DILLWITH J W, MAFI G G, et al. Metabolite profile differences between beeflongissimus andpsoas muscles during display[J]. Meat and Muscle Biology, 2017, 1(1): 18-27.
[15] 郭冰. 肉类风味形成及羊肉香精的风味研究[J]. 北京工商大学学报(自然科学版), 2011, 29(2): 70-74.
[16] WONG E, NIXON L N, JOHNSON C B. Volatile medium chain fatty acids and mutton flavor[J]. Journal of Agricultural and Food Chemistry[J]. 1975, 23(3): 495-498.
[17] 王娟, 张万刚, 刘念, 等. 梅山猪与三元杂交猪肉宰后成熟过程品质变化比较[J]. 食品科学, 2015, 36(8): 254-259. DOI:10.7506/spkx1002-6630-201508048.
[18] MUROYA S, OE M, OJIMA K. Thiamine accumulation and thiamine triphosphate decline occur in parallel with ATP exhaustion during postmortem aging of pork muscles[J]. Meat Science, 2018, 137:228-234. DOI:10.1016/j.meatsci.2017.11.035.
[19] MOYA V J, FLORES M, ARISTOY M C, et al. Pork meat quality affects peptides and amino acid profiles during the aging process[J].Meat Science, 2001, 58: 197-206.
[20] 牛珺, 张丽, 孙宝忠, 等. 青海高原牦牛肉宰后成熟过程中脂肪酸组成及含量变化分析[J]. 食品工业科技, 2017, 38(8): 338-345.DOI:10.13386/j.issn1002-0306.2017.08.058.
[21] TIKK M, TIKK K, TORNGREN M A, et al. Development of inosine monophosphate and its degradation products during aging of pork of different qualities in relation to basic taste and retronasal flavor perception of the meat[J]. Journal of Agricultural and Food Chemistry,2006, 54(20): 7769-7777.
[22] 李永鹏, 余群力. 宰后成熟过程对牦牛肉中挥发性风味化合物的影响[J]. 食品科学, 2011, 32(5): 1-5.
[23] 朱荣生, 王怀中, 林松, 等. 冷藏期间猪肌肉中肌苷酸沉积规律研究[J].山东农业科学, 2017, 49(2): 147-150.
[24] TOLDRÁ F, FLORES M. The use of muscle enzymes as predictors of pork meat quality[J]. Food Chemistry, 2000, 69(4): 387-395.
[25] 文志勇, 孙宝国, 梁梦兰, 等. 脂质氧化产生香味物质[J]. 中国油脂,2004(9): 41-44.
[26] CRUZEN S M, PAULINO P V, LONERGAN S M, et al.Postmortem proteolysis in three muscles from growing and mature beef cattle[J]. Meat Science, 2014, 96(2): 854-861. DOI:10.1016/j.meatsci.2013.09.021.
[27] 高星, 李欣, 李铮, 等. 宰后肌肉中肌球蛋白磷酸化调控肌动球蛋白解离作用机制[J]. 中国农业科学, 2016, 49(16): 3199-3207.
[28] 张爽, 张楠, 朱良齐, 等. 宰后早期猪肉、牛肉和鸡肉中能量代谢及蛋白质磷酸化[J]. 食品科学, 2017, 38(9): 72-78. DOI:10.7506/spkx1002-6630-201709012.
[29] 曹锦轩. 宰后牛肉成熟过程中肌细胞死亡生理研究[D]. 南京: 南京农业大学, 2010.
[30] MOTTRAM D S. Flavour formation in meat and meat products: a review[J]. Food Chemistry, 1998, 62(4): 415-424. DOI:10.1016/S0308-8146(98)00076-4.
[31] WANG H J, LIU B, ZHANG Y, et al. A study on the degradative changes of acetylcholin esterase (AChE) of the skeletal muscle motor end-plates at various postmortem intervals: a quantitative enzyme histochemical analysis[J]. 中国组织化学与细胞化学杂志, 2000(4):479-484. DOI:10.3870/j.issn.1004-1850.2000.04.032.
[32] YAMAMOTO H, MIWA H, KUNISHIMA N. Crystal structure of glucose-6-phosphate isomerase from Thermus thermophilus HB8 showing a snapshot of active dimeric state[J]. Journal of Molecular Biology, 2008, 382(3): 747-762.
[33] 武彦文, 欧阳杰. 氨基酸和肽在食品中的呈味作用[J]. 中国调味品,2001(1): 19-22.
[34] 黄梅丽. 食品化学[M]. 北京: 中国人民大学出版社, 1986: 28-35.
[35] LI C, ZHOU G, XU X, et al. Phosphoproteome analysis of sarcoplasmic and myofibrillar proteins in bovine longissimus muscle in response to postmortem electrical stimulation[J]. Food Chemistry,2015, 175: 197-202.
[36] GREASER M L. Conversion of muscle to meat[J]. Muscle as Food,1986, 23(2): 37-102. DOI:10.1007/BF01086604.
[37] KOOHMARAIE M. Muscle proteinases and meat aging[J]. Meat Science, 1994, 36(1/2): 93-104. DOI:10.1016/0309-1740(94)90036-1.
[38] LAMETSCH R, LARSEN M R, ESSEN-GUSTAVSSON B, et al.Postmortem changes in pork muscle protein phosphorylation in relation to the RN genotype[J]. Journal of Agricultural and Food Chemistry, 2011, 59(21): 11608-11615.
[39] 王翠丽, 王永, 徐亚欧, 等. 山羊、藏系绵羊和黄牛肉中次黄嘌呤核苷酸含量比较[J]. 湖北农业科学, 2010, 49(11): 2859-2860; 2863.DOI:10.14088/j.cnki.issn0439-8114.2010.11.076.
[40] 郑敏. 猪肉嘌呤含量表型变异及其遗传基础研究[D]. 南昌: 江西农业大学, 2017.
[41] RONG S Z, ZOU L N, ZHANG U N, et al. Determination of purine contents in different parts of pork and beef by high performance liquid chromatography[J]. Food Chemistry, 2015, 170: 303-307.DOI:10.1016/j.foodchem.2014.08.059.
[42] 王晓方, 常文环, 刘国华, 等. 畜禽肌肉肌苷酸研究进展[J]. 中国畜牧兽医, 2012, 39(5): 221-225.
[43] 吴莹莹, 李文英, 谢明. 高效液相色谱法测定肌肉中肌苷酸的含量[J]. 食品科学, 2005, 26(12): 191-193.
[44] MD SAKHAWAT H, SHUNSUKE K, MANABU I, et al. Effects of dietary administration of inosine on growth, immune response,oxidative stress and gut morphology of juvenile amberjack, Seriola dumerili[J]. Aquaculture, 2017, 468: 534-544. DOI:10.1016/j.aquaculture.2016.11.020.
[45] 岳颖, 刘国华, 郑爱娟, 等. 生长动物脂肪代谢关键酶基因表达调控[J]. 动物营养学报, 2012, 24(2): 232-238.
[46] 单安山, 徐奇友. 动物脂肪代谢与调控[J]. 东北农业大学学报,2004(2): 216-221.
[47] 杨改青, 王林枫, 朱河水, 等. 杜仲叶对绵羊脂肪代谢的影响及其机理[J]. 动物营养学报, 2017, 29(10): 3635-3647.
[48] 姜春姣, 江芸, 耿志明, 等. 亚油酸氧化产物: 羟基十八碳二烯酸的研究进展[J]. 食品科学, 2018, 39(7): 278-284. DOI:10.7506/spkx1002-6630-201807041.
[49] 宋慧, 耿志明, 任双, 等. 腌腊肉制品中13-HODE、9,10-DHODE、9,10-EPODE、9,10,13-THODE的HPLC-MS/MS检测[J]. 食品科学,2016, 37(18): 133-140. DOI:10.7506/spkx1002-6630-201618022.
[50] 吴娜, 王锡昌, 陶宁萍, 等. 动物源食品中脂质氧化降解对香气物质形成的作用[J]. 中国食品学报, 2016, 16(7): 209-215. DOI:10.16429/j.1009-7848.2016.07.028.
[51] DUCKETT S K, KUBER P S. Genetic and nutritional effects on lamb flavor[J]. The Journal of Animal Ecology, 2001, 79: 249-254.DOI:10.2527/jas2001.79E-SupplE249x.
Differential Lipid Metabolite Profiles during Storage of Tan Sheep Meat Determined by Gas Chromatography-Mass Spectrometry and Liquid Chromatography-Mass Spectrometry
YUAN Yudong, YOU Liqin, LUO Ruiming, et al. Differential lipid metabolite profiles during storage of Tan sheep meat determined by gas chromatography-mass spectrometry and liquid chromatography-mass spectrometry[J].Food Science, 2019, 40(18): 195-202. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180724-297.http://www.spkx.net.cn