超高效液相色谱-串联质谱测定干红葡萄酒中18 种花色素单体方法的建立
金 刚1,2,杨志伟3,王圣仪3,王昶森1,马 雯1,2,张进杰3,张 昂3,*,张军翔1,2,*
(1.宁夏大学葡萄酒学院,宁夏 银川 750021;2.葡萄与葡萄酒教育部工程研究中心,宁夏葡萄与葡萄酒研究院,宁夏葡萄与葡萄酒工程技术研究中心,宁夏 银川 750021;3.秦皇岛出入境检验检疫局检验检疫技术中心,河北 秦皇岛 066004)
摘 要:目的:利用超高效液相色谱-串联质谱技术同时测定干红葡萄酒中18 种花色素单体。方法:将酒样用5%酸化甲醇溶液(含1%甲酸,V/V)稀释500 倍后,滤液经Phenyl-Hexyl色谱柱梯度洗脱,电喷雾离子源正离子模式检测,多反应监测,气帘气压力30 psi,离子喷雾电压5 500 V,离子源温度500 ℃,分析时间20 min。结果:18 种花色素单体在10.0、20.0、50.0 μg/L添加水平的加标回收率在95%~100%之间,R2大于0.999,相对标准偏差在1.71%~2.87%之间,检出限在0.2~3.5 μg/L之间,定量限在0.4~11.5 μg/L之间。结论:该方法前处理简便、灵敏度高、分析时间短,精密度和准确性良好,可用于干红葡萄酒中18 种花色素单体的同时检测。
关键词:花色素单体;干红葡萄酒;超高效液相色谱-串联质谱
花色素是葡萄果皮的重要次生代谢产物,具有抗氧化的作用,针对老年病有着特殊的功效[1],在抗糖尿病、预防老年痴呆、抗高血压、抗炎、保护血管、动脉,抗突变、抗肿瘤[2-3]和癌症等方面效果显著[4]。花色素随着葡萄酒酿制过程中的果实处理浸入干红葡萄酒,是干红葡萄酒中主要呈色物质,常以糖苷形式存在,使其呈现出不同颜色,对葡萄酒颜色与颜色的稳定性造成影响[5-6]。同时干红葡萄酒中花色素的组成特征同样包含品种产地、年份以及酿酒工艺、栽培方式、生态条件、陈酿时间等信息[7-8],可以作为区分不同品种干红葡萄酒的化学标志,因此鉴定干红葡萄酒中花色素的种类和含量对葡萄酒真伪鉴别及等级评定起重要作用。
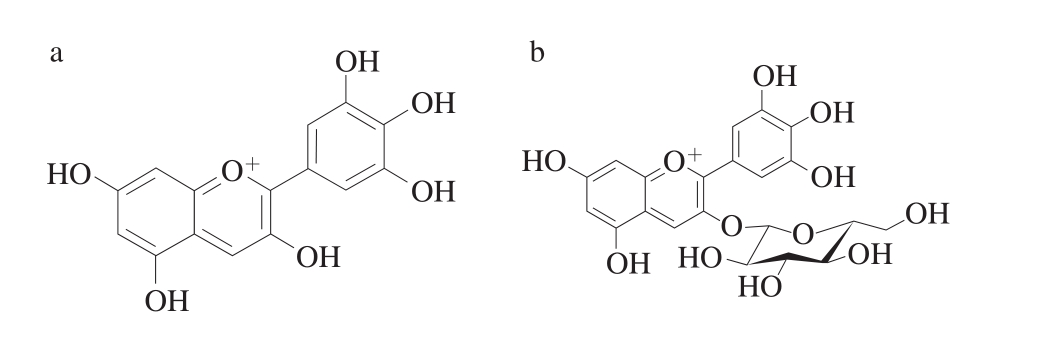
花色素按照结构可分为基本花色苷、酰化花色苷、吡喃花色苷、聚合花色苷4 类[9-12],其中基本花色苷主要有五锦葵花色素苷、芍药花色素苷、矢车菊花色素苷、飞燕草花色素苷和矮牵牛花色素苷5 种形式[13],分属5 种糖苷配基。研究表明[14],葡萄主要含有5 种花色素,分别为花青素(矢车菊素)、花翠素(飞燕草素)、3’-甲花翠素(矮牵牛素)、青甲酰花翠素(芍药素)和二甲花翠素(锦葵素),以锦葵色素占主要比例,种类和含量根据葡萄所属种和品种的不同而有所变化。在此基础上,本实验共整理出共18 种常见花色素单体作为干红葡萄酒中检测项。
目前国内关于花色素的研究多为分离纯化,对快速定量检测研究较少,常见检测方法包括pH示差法[15]、分光光度计法、液相色谱(liquid chromatography,LC)技术、高效液相色谱-质谱[16-20](high performance liquid chromatography-mass spectrometry,HPLC-MS)技术等,蒋宝等[21]以晋西黄土高原地区4 个品种的干红葡萄酒为研究对象,利用HPLC-MS对多种聚合花色苷及衍生物成分进行分析,仅以二甲花翠素葡萄糖苷做内标物进行了定量分析;季梅等[22]通过HPLC-全波长紫外扫描-串联质谱技术对葡萄皮中花色苷进行检测,检测的基本花色苷种类较少且未定量检测;He Fei等[23]对欧亚种葡萄酒花色苷种类的检测,利用HPLC-MS技术在葡萄酒样品中共检出36 种花色苷类物质,未定量测定;Violeta等[24]利用基质辅助激光解吸电离飞行时间质谱技术鉴定花色苷结构,未进行定量检测。
干红葡萄酒中利用超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)技术测定基础花色苷单体及含量的研究鲜有报道,UPLC-MS/MS技术可以在HPLC-MS的基础上进行2 次质量数筛选,尽可能降低背景噪音,提高检测灵敏度,使定量更为准确,以缩短检测时间、分离能力强等优点迅速发展[25-26]。本实验采用UPLC-MS/MS技术建立定性定量分析干红葡萄酒中18 种花色素单体及含量的方法,以期为产地干红葡萄酒相应溯源标准的制定提供新思路,为干红葡萄酒生产企业和质量检测机构提供技术支持。
1 材料与方法
1.1 材料与试剂
秦皇岛市售120 种干红葡萄酒。
18 种花色素单体标准品(纯度≥99.5%):飞燕草色素(delphinidin,Del)、飞燕草素-3-葡萄糖苷(delphinidin-3-glucoside,Del-3-G)、飞燕草素-3,5-二葡萄糖苷(delphinidin-3,5-diglucoside,Del-3,5-D)、飞燕草素鼠李葡萄糖苷(delphinidin-3-O-rutinoside,Del-3-R)、矢车菊素(cyanidin,Cya)、矢车菊素-3-O-葡萄糖苷(cyanidin-3-glucoside,Cya-3-G)、矢车菊素-3,5-二葡萄糖苷(cyanidin-3,5-diglucoside,Cya-3,5-D)、天竺葵色素苷(pelargonin,Pel)、天竺葵素(pelargonidin,Pel-3-gal)、天竺葵素-3-葡萄糖苷(pelargonidin-3-O-glucoside,Pel-3-G)、芍药素(peonidin,Peo)、芍药苷-3-O-葡萄糖苷(peonidin-3-O-glucoside,Peo-3-G)、芍药素-3,5-二葡萄糖苷(peonidin-3,5-di-O-glucoside,Peo-3,5-D)、锦葵色素(malvidin,Mal)、锦葵色素-3,5-二葡萄糖苷(malvidin-3,5-diglucoside,Mal-3,5-D)、锦葵色素-3-半乳糖苷(malvidin-3-galactoside,Mal-3-G)、矮牵牛素(petunidin,Pet)、矮牵牛素-3-D-葡萄糖苷(petunidin-3-O-β-D-glucoside,Pet-3-G)美国Extrasynthese SA公司。
1.2 仪器与设备
30A UPLC仪 日本岛津公司;SCIEX QTRAP 4500三重四极杆质谱仪(配有电喷雾离子源、Turbo V离子源和Analyst 1.5数据处理系统) 美国AB Sciex公司;Phenyl-Hexyl色谱柱(2.1 mm×150 mm,3.5 μm) 美国Waters公司;Milli-Q去离子水机 美国Millipore公司。
1.3 方法
1.3.1 样品前处理
取1 mL干红葡萄酒样,用含5%甲醇的1%甲酸溶液稀释500 倍,涡旋混合后吸取1 mL移至样品瓶,为减少目标物损失,未过滤膜。
1.3.2 标准液配制
分别称取适量标准品置于100 mL容量瓶中,用含5%甲醇的1%甲酸溶液溶解并定容至刻度,摇匀,制得100 mg/L的标准储备液,于-20 ℃避光保存。
1.3.3 基质液配制
将150 mL乙醇和3 g酒石酸移入1 L的容量瓶中,用去离子水定容,得到模拟酒样,使用时取出适量模拟酒样,再加入目标浓度的花色素单体的单标或混标使用。
1.3.4 UPLC条件
柱温40 ℃,进样体积30 μL,流速0.25 mL/min,用Phenyl-Hexyl色谱柱(2.1 mm×150 mm,3.5 μm)分离,根据花色素单体性质确定流动相A为含5%甲醇的1%甲酸溶液,流动相B为1%甲酸-甲醇溶液。洗脱程序:0~3.1 min,0%~65% B;3.1~8.0 min,65% B;8.0~8.5 min,65%~100% B;8.5~12.5 min,100% B;12.5~13 min,100%~0% B;13~20 min,0% B。
1.3.5 MS条件
电雾喷离子源,正离子模式;反应监测;离子扫描范围m/z 100~1 000;雾化器压力345 kPa;辅助气流速10 L/min;干燥气温度350 ℃;气帘气压力30 psi;碰撞气Mediun;离子喷雾电压5 500 V;离子源温度500 ℃。
2 结果与分析
2.1 质谱参数优化
采用注射泵直接将标准溶液注入离子源的方式对18 种花色素单体质谱条件进行优化。分别将质量浓度为1 mg/L的18 种花色素单体标准工作液以10 μL/min流速注入离子源中,电雾喷离子源,正离子模式模式下对每种花色素单体进行一级质谱分析,对碰撞室射出电压和去簇电压进行充分优化,以确定准分子离子峰。再进行目标离子二级扫描,优化碰撞电压,得到碎片离子。
分别选取经碰撞后所得丰度较高、碎片结构合理的2 个子离子作为定量和定性离子,确定其最佳碰撞能量。
2.2 色谱条件优化
为提高花色素单体的离子化效率[27],选择含5%甲醇的0.5%~1.5%甲酸溶液作为流动相同时分析18 种花色素单体的峰形,确定在添加1%甲酸溶液时花色素单体的峰形最好,但保留时间基本相同,分离效果差。
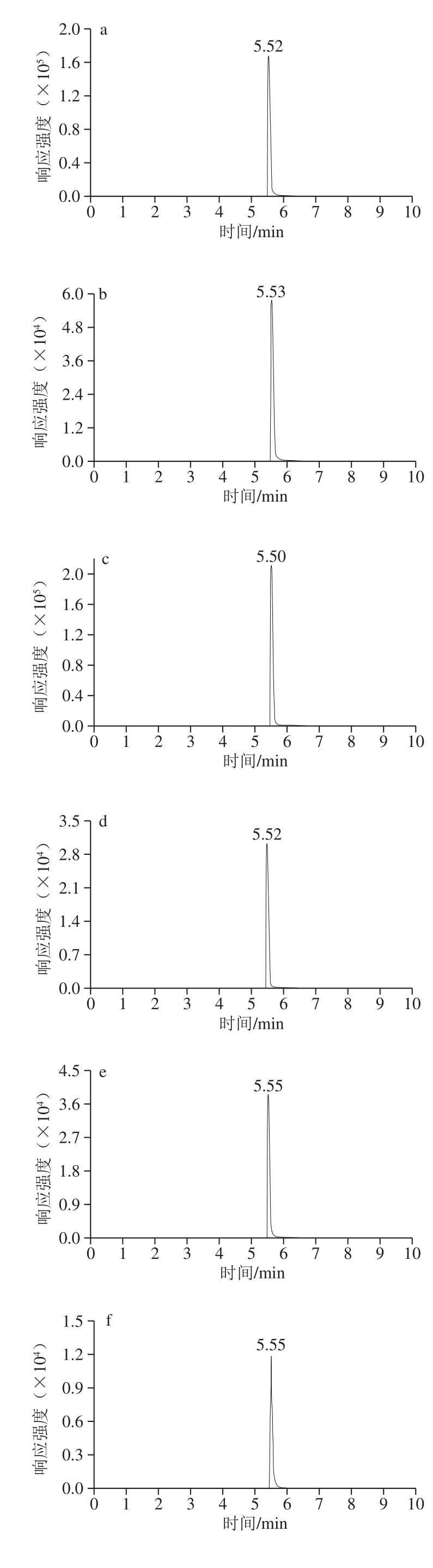
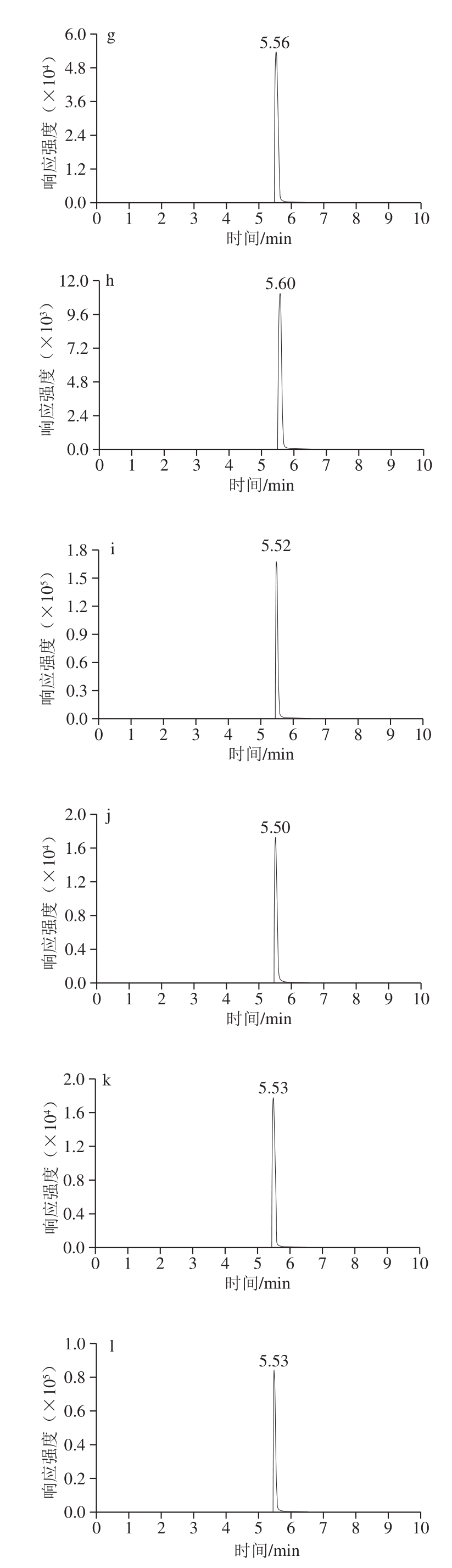
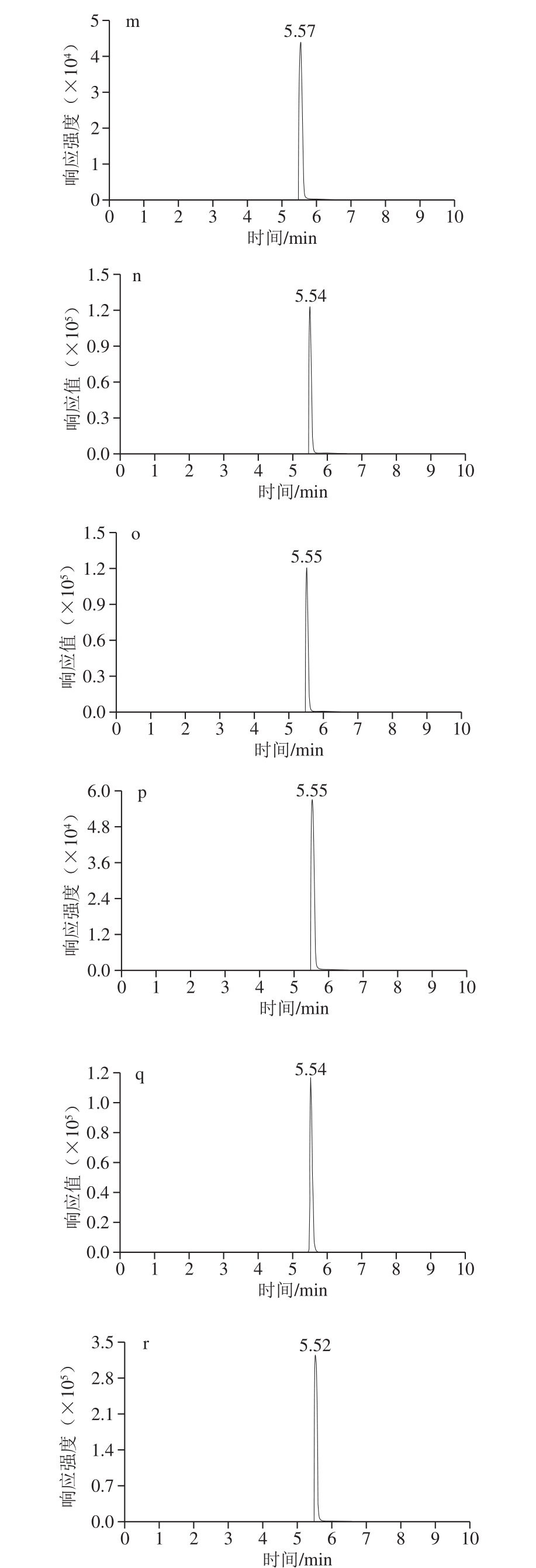
在电雾喷离子源,正离子模式下,18 种花色素单体的质谱参数见表1,分子结构式见图1,总离子流图见图2。
表1 18 种花色素单体质谱参数
Table 1 Mass spectrometric parameters of 18 anthocyanin monomers
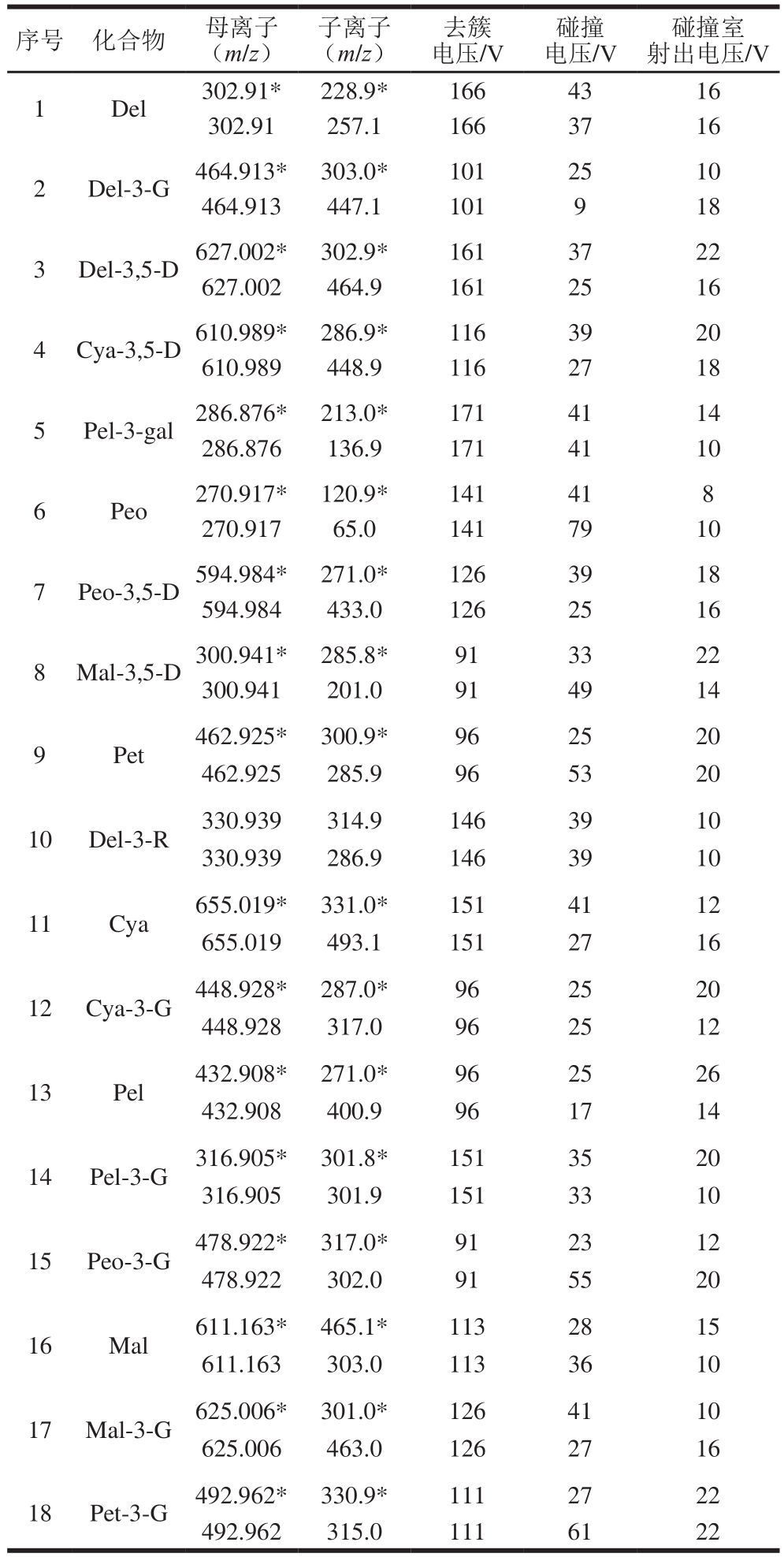
序号 化合物 母离子(m/z)碰撞室射出电压/V 1 Del 302.91* 228.9* 166 43 16 302.91 257.1 166 37 16 2 Del-3-G 464.913* 303.0* 101 25 10 464.913 447.1 101 9 18 3 Del-3,5-D627.002* 302.9* 161 37 22 627.002 464.9 161 25 16 4 Cya-3,5-D610.989* 286.9* 116 39 20 610.989 448.9 116 27 18 5 Pel-3-gal286.876* 213.0* 171 41 14 286.876 136.9 171 41 10 6 Peo 270.917* 120.9* 141 41 8 270.917 65.0 141 79 10 7 Peo-3,5-D594.984* 271.0* 126 39 18 594.984 433.0 126 25 16 8 Mal-3,5-D300.941* 285.8* 91 33 22 300.941 201.0 91 49 14 9 Pet 462.925* 300.9* 96 25 20 462.925 285.9 96 53 20 10 Del-3-R 330.939 314.9 146 39 10 330.939 286.9 146 39 10 11 Cya 655.019* 331.0* 151 41 12 655.019 493.1 151 27 16 12 Cya-3-G 448.928* 287.0* 96 25 20 448.928 317.0 96 25 12 13 Pel 432.908* 271.0* 96 25 26 432.908 400.9 96 17 14 14 Pel-3-G 316.905* 301.8* 151 35 20 316.905 301.9 151 33 10 15 Peo-3-G 478.922* 317.0* 91 23 12 478.922 302.0 91 55 20 16 Mal 611.163* 465.1* 113 28 15 611.163 303.0 113 36 10 17 Mal-3-G 625.006* 301.0* 126 41 10 625.006 463.0 126 27 16 18 Pet-3-G 492.962* 330.9* 111 27 22 492.962 315.0 111 61 22子离子(m/z)去簇电压/V碰撞电压/V
由表1和图1、2可知,优化后的18 种花色苷单体总离子流图出峰响应值高、灵敏度高、峰形标准,但这18 种花色素单体由于结构极性相近,在色谱柱上无法得到分离,色谱柱仅起到将干扰物与待测物分离的作用,因此可以通过不同质谱信息对这18 种花色素单体进行鉴定和含量计算。
2.3 线性关系、检出限及定量限测定结果
向1.3.4节模拟酒基质液中定量添加18 种花色素单体的混合标准溶液,分别在0.00、1.00、10.00、20.00、50.00、100.00、200.00、500.00 μg/L 8 个水平下测定,以目标化合物的峰面积(y)对其相应的质量浓度(x)分别绘制标准曲线。按照1.3.5节样品前处理方法制备干红葡萄酒样品,平行6 次实验,分别在10.0、20.0、50.0 μg/L添加水平进行添加,计算加标回收率和相对标准偏差,按3 倍信噪比得到目标化合物的检出限,10 倍信噪比得到目标化合物的定量限,结果见表2。从表2可以看出,线性回归系数R2均大于0.999,说明该种方法测定18 种花色素单体在1~500 μg/L范围内线性关系良好,为减小误差,在实际样品检测时可根据实际情况取其中一段线性进行定量。在低、中、高的添加水平范围内,18 种花色素单体回收率均在95%以上,相对标准偏差均低于3%,说明上述样品预处理方法可行,可以满足日常样品分析要求。
表2 方法学验证
Table 2 Methodological verification
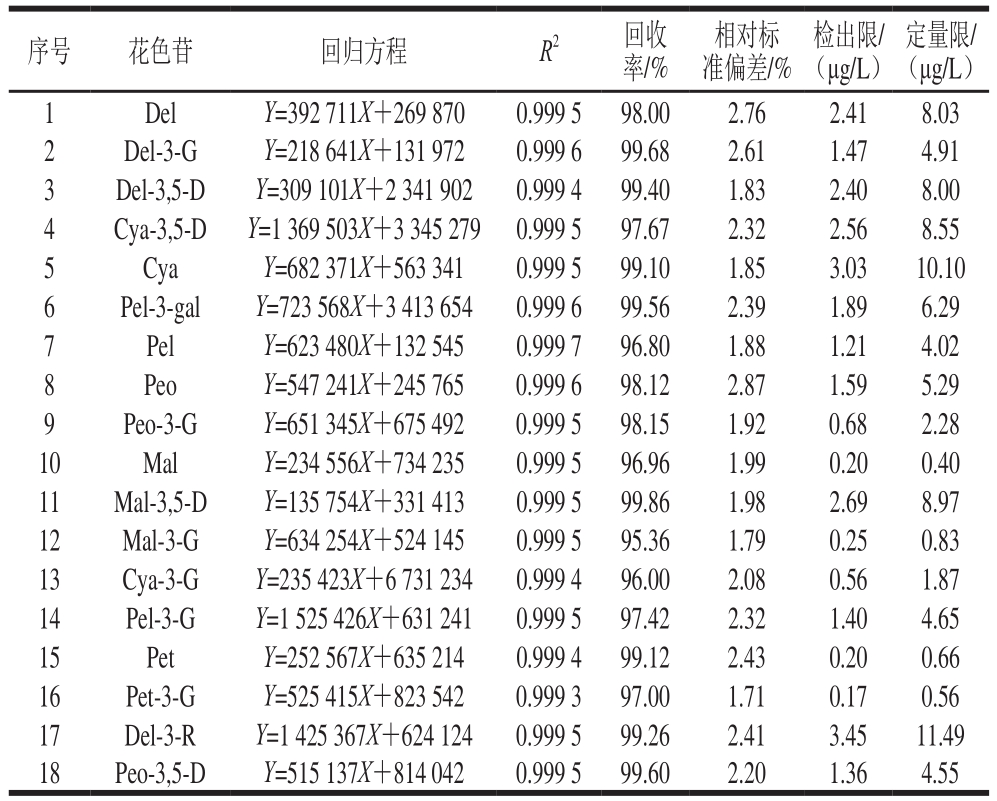
序号 花色苷 回归方程 R2 回收率/%相对标准偏差/%检出限/(μg/L)定量限/(μg/L)1 Del Y=392 711X+269 870 0.999 5 98.00 2.76 2.41 8.03 2 Del-3-G Y=218 641X+131 972 0.999 6 99.68 2.61 1.47 4.91 3 Del-3,5-D Y=309 101X+2 341 902 0.999 4 99.40 1.83 2.40 8.00 4 Cya-3,5-D Y=1 369 503X+3 345 279 0.999 5 97.67 2.32 2.56 8.55 5 Cya Y=682 371X+563 341 0.999 5 99.10 1.85 3.03 10.10 6 Pel-3-gal Y=723 568X+3 413 654 0.999 6 99.56 2.39 1.89 6.29 7 Pel Y=623 480X+132 545 0.999 7 96.80 1.88 1.21 4.02 8 Peo Y=547 241X+245 765 0.999 6 98.12 2.87 1.59 5.29 9 Peo-3-G Y=651 345X+675 492 0.999 5 98.15 1.92 0.68 2.28 10 Mal Y=234 556X+734 235 0.999 5 96.96 1.99 0.20 0.40 11 Mal-3,5-D Y=135 754X+331 413 0.999 5 99.86 1.98 2.69 8.97 12 Mal-3-G Y=634 254X+524 145 0.999 5 95.36 1.79 0.25 0.83 13 Cya-3-G Y=235 423X+6 731 234 0.999 4 96.00 2.08 0.56 1.87 14 Pel-3-G Y=1 525 426X+631 241 0.999 5 97.42 2.32 1.40 4.65 15 Pet Y=252 567X+635 214 0.999 4 99.12 2.43 0.20 0.66 16 Pet-3-G Y=525 415X+823 542 0.999 3 97.00 1.71 0.17 0.56 17 Del-3-R Y=1 425 367X+624 124 0.999 5 99.26 2.41 3.45 11.49 18 Peo-3,5-D Y=515 137X+814 042 0.999 5 99.60 2.20 1.36 4.55
2.4 实际样品检测
表3 实际样品中花色素的测定结果(n=120)
Table 3 Summary of analytical results for the determination of anthocyanins in real samples by the proposed method (n= 120)
注:—.未检出。
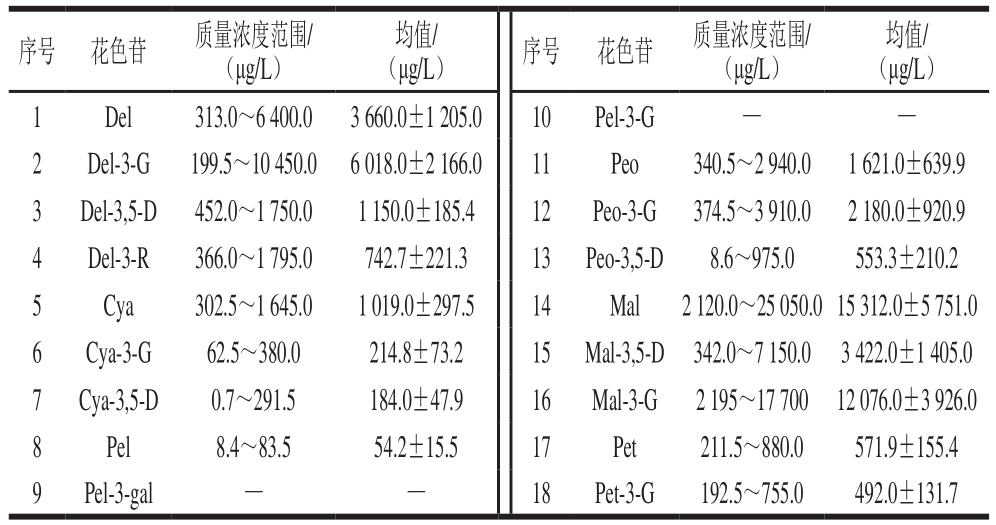
均值/(μg/L)1 Del 313.0~6 400.0 3 660.0±1 205.0 10 Pel-3-G — —2 Del-3-G 199.5~10 450.0 6 018.0±2 166.0 11 Peo 340.5~2 940.0 1 621.0±639.9 3 Del-3,5-D 452.0~1 750.0 1 150.0±185.4 12 Peo-3-G 374.5~3 910.0 2 180.0±920.9 4 Del-3-R 366.0~1 795.0 742.7±221.3 13 Peo-3,5-D 8.6~975.0 553.3±210.2 5 Cya 302.5~1 645.0 1 019.0±297.5 14 Mal 2 120.0~25 050.0 15 312.0±5 751.0 6 Cya-3-G 62.5~380.0 214.8±73.2 15 Mal-3,5-D 342.0~7 150.0 3 422.0±1 405.0 7 Cya-3,5-D 0.7~291.5 184.0±47.9 16 Mal-3-G 2 195~17 700 12 076.0±3 926.0 8 Pel 8.4~83.5 54.2±15.5 17 Pet 211.5~880.0 571.9±155.4 9 Pel-3-gal — — 18 Pet-3-G 192.5~755.0 492.0±131.7序号 花色苷 质量浓度范围/(μg/L) (μg/L) 序号 花色苷 质量浓度范围/(μg/L)均值/
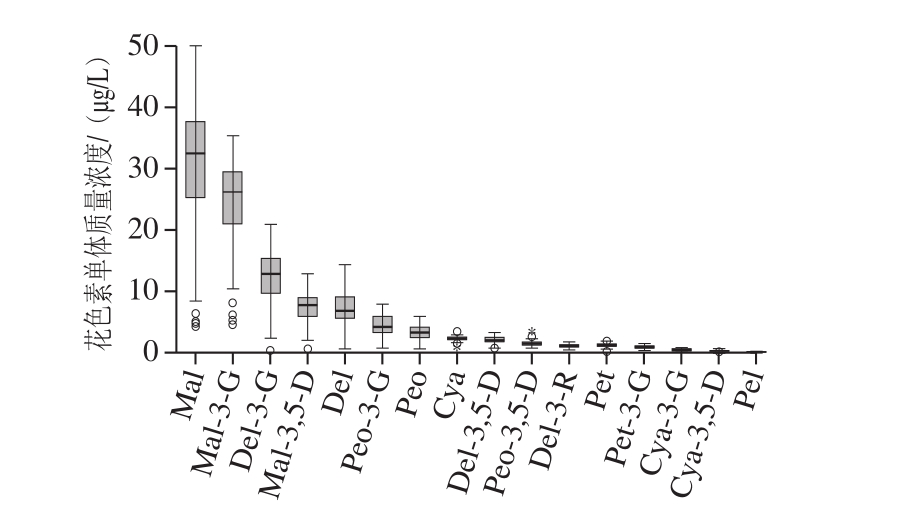
为判定该方法的普遍性,对秦皇岛市售120 种干红葡萄酒进行测定,测定结果见表3,根据已检测花色素单体在干红葡萄酒中含量,绘制含量箱线图,见图3。
由表3可知,120 种干红葡萄酒中共检出16 种花色素单体,未检出的花色苷单体为Pel-3-gal和Pel-3-G,花色苷单体总量在15 000~60 000 μg/L之间。干红葡萄酒中花色苷含量从高到低排序为Mal、Mal-3-G、Del-3-G、Del、Mal-3,5-D、Peo-3-G、Peo、Del-3,5-D、Cya、Del-3-R、Pet、Peo-3,5-D、Pet-3-G、Cya-3-G、Cya-3,5-D、Pel。
由图3可知,16 种检出花色素单体含量的中位数位置、四分位间距框的位置与高度基本相同,说明数据具有良好的对称性,正常值分布比较集中,从16 种花色素单体含量的Whisker上限和下限看,Mal和Mal-3-G在红葡萄酒中含量分布范围很广。
李琪等[28]利用HPLC技术测定甘肃地区9 种酿酒葡萄中花色素单体含量,认为锦葵色素为酿酒葡萄中含量最高的花色素单体,与本实验结论相同;张世杰等[29]利用HPLC技术同样得到锦葵色素是干红葡萄酒中主要花色素单体。
本实验结果与前人研究结果基本一致,并在此基础上,发现另外2 种在干红葡萄酒中含量较高的花色素单体,为Mal-3-G以及Del-3-G。Mal、Mal-3-G和Del-3-G在干红葡萄酒中分别占花色素单体总量的31.01%、24.50%和12.22%,根据相关文献[24]可知Mal在欧亚种酿酒葡萄酿制的干红葡萄酒中含量约占50%,Mal-3-G在山葡萄酿制的红葡萄酒中含量较高,由此可以推测,120 种市售干红葡萄酒有部分葡萄酒在酿制过程中加入山葡萄酿造。
3 结 论
本实验采用UPLC-MS/MS技术建立干红葡萄酒中18 种花色素单体定性定量的检测方法,通过仪器条件、稀释液和流动相、色谱柱的优化,最终得到方法的检出限在0.2~3.5 μg/L之间,定量限在0.4~11.5 μg/L之间,加标回收率在95%~100%之间。
这种检测方法操作简便、灵敏度高、实用性强,相比于已有方法[30],检测时间短且检出限低,经方法学验证,该方法能满足干红葡萄酒中18 种花色素单体的日常检测要求,可应用于干红葡萄酒日常监测工作。
参考文献:
[1] 张波, 韩舜愈, 马腾臻, 等. 红葡萄酒中花色苷衍生物结构研究进展[J].食品科学, 2018, 39(5): 284-295. DOI:10.7506/spkx1002-6630-201805043.
[2] 崔建, 李晓岩. 花青素抗肿瘤作用机制研究进展[J]. 食品科学, 2014,35(13): 310-315. DOI:10.7506/spkx1002-6630-201413060.
[3] 姜伟伟. 花色苷的抗肿瘤效应研究进展[J]. 食品科学, 2009, 30(9):281-284. DOI:10.3321/j.issn:1002-6630.2009.09.066.
[4] 焦岩. 蓝靛果花色苷超声波辅助提取优化及其降血脂作用[J]. 中国食品学报, 2010, 10(2): 52-59. DOI:10.3969/j.issn.1009-7848.2010.02.008.
[5] 吴敏. 天然花青素稳定性研究现状[J]. 中国食品添加剂, 2008(5):50-53. DOI:10.3969/j.issn.1006-2513.2008.05.003.
[6] DE FREITAS V, MATEUS N. Formation of pyranoanthocyanins in red wines: a new and diverse class of anthocyanin derivatives[J].Analytical and Bioanalytical Chemistry, 2011, 401(5): 1463-1473.DOI:10.1007/s00216-010-4479-9.
[7] JIANG B, ZHANG Z W. Comparison on phenolic compounds and antioxidant properties of Cabernet Sauvignon and Merlot wines from four wine grape growing region in China[J]. Molecules, 2012, 17(8):8804-8821. DOI:10.3390/molecules17088804.
[8] JESSICA M C, JAMES A K. Effect of shading on accumulation of flavonoid compounds in (Vitis vinifera L.) pinot noir fruit and extraction in a model system[J]. Journal of Agricultural and Food Chemistry, 2006, 54(11): 8510-8852. DOI:10.1021/jf0616560.
[9] HAN F L, JIANG S M, HE J J, et al. The anthocyanins in Cabernet Gernischet (Vitis vinifera L. cv.) aged red wine and their color in aqueous solution analyzed by partial least square regression[J]. Food Science and Biotechnology, 2009, 28(3): 724-731. DOI:10.1007/s10068-010-0085-z.
[10] 丁燕, ROLAND H, RICHARD H, 等. 启瓶后不同储藏方法对葡萄酒中酚类物质及相关颜色指标的影响[J]. 酿酒科技, 2018(4): 26-32.DOI:10.13746/j.njkj.2017343.
[11] RENTZSCH M, SCHWARZ M, WINTERHALTER P. Pyranoanthocyanins-an overview on structures, occurrence, and pathways of formation[J]. Trends in Food Science & Technology, 2007, 18(5):526-534. DOI:10.1016/j.tifs.2007.04.014.
[12] KALLITHRAKA S, TSOUTSOURAS E, TZOUROU E, et al.Principal phenolic compounds in Greek red wines[J]. Food Chemistry,2006, 99(4): 784-793. DOI:10.1016/j.foodchem.2005.07.059.
[13] 彭祖茂, 邓梦雅, 严虞虞, 等. 植物中花青素含量测定及种类分布研究[J]. 食品研究与开发, 2018, 39(17): 100-104. DOI:10.3969/j.issn.1005-6521.2018.17.019.
[14] 张波, 韩舜愈, 马腾臻, 等. 红葡萄酒中花色苷衍生物结构研究进展[J]. 食品科学, 2018, 39(5): 284-295. DOI:10.7506/spkx1002-6630-201805043.
[15] 杨兆艳. pH示差法测定桑椹红色素中花青素含量的研究[J]. 食品科技, 2007, 32(4): 201-203. DOI:10.3969/j.issn.1005-9989.2007.04.060.
[16] 殷丽琴, 彭云强, 钟成, 等. 高效液相色谱法测定8 个彩色马铃薯品种中花青素种类和含量[J]. 食品科学, 2015, 36(18): 143-147.DOI:10.7506/spkx1002-6630-201518026.
[17] JESÚS M, GONZÁLEZ-JARTÍN, AMPARO A, et al. A QuEChERS based extraction procedure coupled to UPLC-MS/MS detection for mycotoxins analysis in beer[J]. Food Chemistry, 2019, 275: 703-710.DOI:10.1016/j.foodchem.2018.09.162.
[18] 成果, 黄羽, 杨莹, 等. ‘桂葡6号'葡萄酒花色苷组分HPLC-MS分析[J]. 食品科学, 2018, 39(10): 269-275. DOI:10.7506/spkx1002-6630-201810041.
[19] 林丽, 李进, 丁成丽. 高效液相色谱法测定黑果枸杞果实中花色苷的含量[J]. 食品科学, 2013, 34(6): 164-166. DOI:10.7506/spkx1002-6630-201306036.
[20] 王维茜, 邓洁红, 刘永红. 半制备型高效液相色谱法分离刺葡萄花色苷单体[J]. 食品科学, 2016, 37(18): 71-76. DOI:10.7506/spkx1002-6630-201618012.
[21] 蒋宝, 张振文. 黄土高原地区葡萄酒花色苷成分的HPLCMS分析[J]. 陕西农业科学, 2015, 61(4): 13-17. DOI:10.3969/j.issn.0488-5368.2015.04.005.
[22] 季梅, 李强, 娄红祥. 高效液相色谱-质谱检测红葡萄皮中花色苷[J].药物分析杂志, 2011, 31(12): 2240-2243. DOI:10.16155/j.0254-1793.2011.12.006.
[23] HE F, LIANG N N, MU L, et al. Anthocyanins and their variation in red wines I. Monomeric anthocyanins and their color experession[J]. Molecules, 2012, 17(2): 1571-1601. DOI:10.3390/molecules17021571.
[24] VIOLETA I, ÁGNES D, MARINA S, et al. Rapid MALDI-TOF-MS detection of anthocyanins in wine and grape using different matrices[J].Food Analytical Methods, 2011, 4(1): 108-115. DOI:10.1007/s12161-010-9143-7.
[25] XIA Z, BO W, KAIZHOU X, et al. Development and comparison of HPLC-MS/MS and UPLC-MS/MS methods for determining eight coccidiostats in beef[J]. Journal of Chromatography B, 2018,1087/1088: 98-107. DOI:10.1016/j.jchromb.2018.04.044.
[26] 陈晓鹏, 顾采琴, 綦艳, 等. QuEChERS-UPLC-MS/MS同时测定牛奶和奶粉中42 种类固醇激素[J]. 食品科学, 2018, 39(8): 314-321.DOI:10.7506/spkx1002-6630-201808049.
[27] 黄丽英, 邹圆, 陆强, 等. 分散固相萃取-超高效液相色谱-串联质谱法测定禽蛋中4 种内外源性孕激素[J]. 食品科学, 2018, 39(16): 295-300. DOI:10.7506/spkx1002-6630-201816042.
[28] 李琪, 李广, 金丽琼, 等. HPLC法测定甘肃地产不同品种酿酒葡萄中的花色苷[J]. 中国酿造, 2014, 33(3): 132-136. DOI:10.3969/j.issn.0254-5071.2014.03.032.
[29] 张世杰, 袁春龙, 杨健, 等. 不同年份及产区红葡萄酒花色苷组成分析[J]. 西北农林科技大学学报(自然科学版), 2016, 44(3): 160-166. DOI:10.13207/j.cnki.jnwafu.2016.03.022.
[30] 豆一玲, 董新平, 王均光, 等. 新疆玛纳斯赤霞珠干红葡萄酒单体酚及花色素苷含量分析[J]. 中外葡萄与葡萄酒, 2010(3): 58-59.DOI:10.13414/j.cnki.zwpp.2010.03.002.
Establishment of Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry Method for Determination of 18 Individual Anthocyanins in Wine
JIN Gang1,2, YANG Zhiwei3, WANG Shengyi3, WANG Changsen1, MA Wen1,2, ZHANG Jinjie3, ZHANG Ang3,*, ZHANG Junxiang1,2,*
(1. School of Wine, Ningxia University, Yinchuan 750021, China;2. Engineering Research Center of Grape and Wine, Ministry of Education, Ningxia Grape and Wine Research Institute,Ningxia Engineering and Technology Research Center of Grape and Wine, Yinchuan 750021, China;3. Inspection and Quarantine Technique Centre, Qinhuangdao Entry-Exit Inspection and Quarantine Bureau, Qinhuangdao 066004, China)
Abstract: Objective: To simultaneously determine 18 anthocyanin monomers in red wine using ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). Methods: Wine samples were diluted 500 times with acidified methanol solution containing 1% formic acid (V/V) before being filtrated. The filtrate was separated by gradient elution chromatography on a phenyl-hexyl column. Detection was carried out using an electrospray ionization source in the positive ion mode with multiple reaction monitoring (MRM). The mass spectrometric conditions were as follows: curtain gas 30 psi, ion spray (IS) voltage 5 500 V, and ion source temperature 500 ℃. The analysis took 20 min. Results: The recoveries of the analytes at spiked levels of 10.0, 20.0 and 50.0 μg/L were between 95% and 100%, and the calibration curve for each analyte exhibited a correlation coefficient (R2) of greater than 0.999. The precision, expressed as relative standard deviation(RSD), ranged between 1.71% and 2.87%. The limits of detection (LOD) were between 0.2 and 3.5 μg/L, and the limits of quantitation (LOQ) were between 0.4 and 11.5 μg/L. Conclusion: This method was characterized by simple pretreatment,high sensitivity, short analysis time, shorter time and good precision and accuracy and could be applied to detect individual anthocyanins in red wine.
Keywords: monomer anthocyanin; red wine; ultra performance liquid chromatography-tandem mass spectrometry
收稿日期:2018-10-08
基金项目:宁夏回族自治区重点研发计划重大项目(2016BZ06);质检总局科技计划项目(2017IK253);宁夏高等学校科研项目(NGY2016066)
第一作者简介:金刚(1984—)(ORCID: 0000-0002-3012-6451),男,讲师,博士,研究方向为葡萄与葡萄酒学。E-mail: gjinwine@hotmail.com
*通信作者简介:
张昂(1982—)(ORCID: 0000-0002-1955-1430),男,高级工程师,博士,研究方向为葡萄与葡萄酒学。E-mail: zhanganggrape@hotmail.com
张军翔(1972—)(ORCID: 0000-0002-9487-0247),男,教授,博士,研究方向为葡萄与葡萄酒学。E-mail: zhangjunxiang@126.com
DOI:10.7506/spkx1002-6630-20181008-040
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2019)18-0229-07
引文格式:金刚, 杨志伟, 王圣仪, 等. 超高效液相色谱-串联质谱测定干红葡萄酒中18 种花色素单体方法的建立[J]. 食品科学,2019, 40(18): 229-235. DOI:10.7506/spkx1002-6630-20181008-040. http://www.spkx.net.cn
JIN Gang, YANG Zhiwei, WANG Shengyi, et al. Establishment of ultra performance liquid chromatography-tandem mass spectrometry method for determination of 18 individual anthocyanins in wine[J]. Food Science, 2019, 40(18): 229-235.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20181008-040. http://www.spkx.net.cn