超高效液相色谱-质谱联用技术解析沙棘果超临界CO2萃取物中黄酮类天然产物结构
丁丽娜1,邱亦亦1,束 彤2,阮 晖1,3,4,*
(1.浙江大学生物系统工程与食品科学学院,浙江 杭州 310058;2.青海省食品检验检测院,青海 西宁 810008;3.浙江省农产品加工技术研究重点实验室,浙江 杭州 310058;4.浙江大学宁波研究院,浙江 宁波 315100)
摘 要:采用超临界CO2萃取技术获得沙棘果油,通过超高效液相色谱-质谱联用技术和Peakview色谱工作站拟合、二级质谱解析和紫外光谱及质谱数据比对,确定有关化合物的组成和分子结构。共鉴定出沙棘果超临界CO2萃取物中含有18 种黄酮类化合物,其中包括8 种黄酮醇苷元及黄酮醇苷,3 种二氢黄酮醇苷元及二氢黄酮醇苷,5 种黄酮苷元及黄酮苷,1 种二氢黄酮苷元和1 种黄烷醇苷,其中芹菜素-6-C-葡萄糖苷-8-C-木糖苷、儿茶素-7-吡喃葡萄糖苷、苜蓿素、紫罗兰素、刺槐黄素这5 种黄酮首次被发现存在于沙棘中。
关键词:沙棘;黄酮;超临界CO2萃取技术;超高效液相色谱-质谱联用
沙棘(Hippophae rhamnoides L.)别称醋柳、酸刺、达日布,为胡颓子科沙棘属的多年生落叶性灌木或乔木,是一种喜光、耐水、耐旱、生长性极好的小浆果植物,多为橘黄色或橘红色[1-4]。我国是沙棘资源最丰富的国家,有“沙棘王国”之称,沙棘药食两用方面的研究和应用在我国具有悠久历史[5]。
沙棘果实中富含生物活性物质,如维生素、脂肪酸、黄酮类、酚类及有机酸、氨基酸和蛋白质、微量元素等。对其功效性天然产物的分离提取、结构解析和应用已开展较多研究,例如:沙棘油是沙棘果实中的最有价值的组分之一,对心脑血管、胃肠道、肝脏、皮肤组织等具有保护及修复作用[6]。并且,由于沙棘中含有大量氨基酸、有机酸、酚酸等多种营养物质,可以促进胃酸合成和分泌。因而其具有消食化滞、健脾养胃、疏肝利气的作用。对于消化不良、腹胀痛、胃炎、胃溃疡、肠炎、慢性便秘等均有极好作用。目前已有大量研究指出,沙棘及其提取物具有较强的抗脂质过氧化、清除自由基、对抗炎症、抗病毒、抗过敏、抗疲劳等作用[7-10]。
沙棘果富含黄酮[11-14],沙棘黄酮显示出抗氧化、免疫调理、抗肿瘤等多重功效[15-17]。从沙棘叶中分离到芦丁、槲皮素及其配糖体(3-O-葡萄糖苷)、山柰酚、异鼠李素等[18]。从沙棘籽中分离到芸香糖苷槲皮素、芸香糖苷异鼠李素、葡萄糖苷芸香糖苷槲皮素、山柰酚、异鼠李素等[17]。采用高效液相色谱和超高效液相色谱-质谱(ultra-high performance liquid chromatography-mass spectrometry,UPLC-MS)技术,建立了基于7 种黄酮组分的沙棘叶质量控制方法[19]。超临界CO2萃取技术在食品医药上应用较多,萃取剂CO2无毒、安全、廉价,其气液临界态温度为31.7 ℃,可以在较低温度下萃取,既节约能耗,又避免活性物质发生热降解和发生副反应[20]。由于其低温提取、无有毒残溶和可以选择性分离等优点,超临界CO2萃取技术成为提取纯化功效性天然产物的重要手段。之前的研究中,已采用超临界CO2萃取技术高效获取了沙棘果油[21-22],但对其中所含黄酮类成分及结构尚未做过系统解析。本研究以青海产沙棘果为研究对象,采用超临界CO2萃取技术获得沙棘果油,通过UPLC-MS技术和Peakview软件拟合、二级质谱解析和紫外光谱及质谱数据比对,全面解析沙棘果中黄酮类成分及结构,为沙棘的高值化开发利用提供依据。
1 材料与方法
1.1 材料与试剂
实验用沙棘(Hippophae rhamnoides L.)产于青海省。
乙醇(一级色谱纯) 天津市四友精细化学品有限公司;所有黄酮类标品(色谱纯≥98%) 北京世纪奥科生物技术有限公司;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
HGC-12A氮吹仪 天津恒奥科技发展有限公司;Centrifuge 5417R高速冷冻离心机 德国Eppendorf公司;SFE-2超临界CO2萃取仪 美国Applied Separations公司;I-class UPLC仪 美国Waters公司;Triple TOF 5600+型飞行时间质谱仪(配有可变波长紫外检测器和Peakview色谱工作站) 美国AB Sciex公司。
1.3 方法
1.3.1 供试品溶液的制备
取适量沙棘干果,置于烘箱中以55 ℃烘干,再用粉碎机碎至粒状,过40 目筛,得沙棘粉末。取适量沙棘粉,装入50 mL提取釜中,设置提取条件:萃取压力35 MPa,萃取温度45 ℃,提取时间1 h,出口阀温度110 ℃。待萃取完毕,再以无水乙醇为夹带剂,流速0.8 mL/min,按照相同的萃取条件,更换新的萃取瓶来收集萃取液。待萃取完毕后,将萃取液溶解、浓缩、冷冻离心至合适浓度,过0.22 μm滤膜,待做UPLC-MS。
1.3.2 对照品溶液的制备
分别称取槲皮素、二氢槲皮素、山柰酚、橙皮素、异鼠李素对照品适量,精密称定,加甲醇溶解并配制成每个组分约0.05 mg/mL的混合对照品溶液,摇匀,过0.22 μm滤膜,备用。参考对照品的质谱裂解特征,解析黄酮类化合物的质谱裂解规律。
1.3.3 液相色谱-质谱联用方法
色谱条件:色谱柱为安捷伦ZORBAX-SBC18(100 mm×2.1 mm,3.5 μm);以0.1%甲酸溶液为流动相A,以0.1%甲酸-乙腈为流动相B,线性梯度洗脱,0 min 5% B,2 min 5% B,25 min 50% B,33 min 95% B;流速0.8 mL/min;柱温35 ℃;检测波长254 nm;进样量5 μL。
质谱条件:UPLC-Triple-TOF 5600+飞行时间液相色谱-质谱联用仪,正负离子扫描模式;扫描范围,m/z 100~1 500;雾化气(GS1)压力55 psi;雾化气(GS2)压力55 psi;气帘气压力35 psi;离子源温度:600 ℃(正),-550 ℃(负);离子源电压5 500 V(正),-4 500 V(负);一级扫描,去簇电压100 V,聚焦电压10 V;二级扫描,使用TOF MS~Product Ion~IDA模式采集质谱数据,CID能量为20、40 V和60 V,进样前,用CDS泵做质量轴校正,使质量轴误差小于2×10-6。
2 结果与分析
2.1 沙棘果超临界CO2萃取物中黄酮类化合物的结构鉴定
在已有文献基础之上,通过一级质谱给出化合物的准分子离子峰,得到化合物的相对分子质量,从而缩小鉴定化合物的范围。然后经Peakview色谱工作站拟合,对比黄酮的紫外吸收峰,结合文献,推测其可能的分子式和分子质量。进一步再做二级质谱解析,通过与标准品、已报道的紫外光谱及质谱数据的比对,确定黄酮化合物的分子结构或者其同分异构体。对于无相关标准品的黄酮化合物,则通过二级质谱解析推测其裂解途径,确定其分子结构。
实验共计发现18 种黄酮类化合物,按其结构类型可分为5 类,其中包括8 种黄酮醇苷元及黄酮醇苷,3 种二氢黄酮醇苷元及二氢黄酮醇苷,5 种黄酮苷元及黄酮苷,1 种二氢黄酮苷元和1 种黄烷醇苷。鉴定结果见表1。
表1 沙棘果超临界CO2萃取物中黄酮类化合物的鉴定结果
Table 1 Main flavonoids identified in the supercritical CO2 extract of sea buckthorn berries

注:*.此物质为首次报道。
编号 保留时间/min 化合物名称 化学式 理论值m/z测量值m/z误差(×10-6)一级离子m/z 二级离子 m/z 1* 9.88 芹菜素-6-C-葡萄糖苷-8-C-木糖苷 C26H28O14563.140 6 563.140 2 -0.7 563.14 353.07,383.08 2 10 山柰酚-3-葡萄糖苷 C21H20O11447.093 3 447.091 9 -3.2 447.09 327.05,357.06 3 12.06 二氢槲皮素 C15H12O7303.051 0 303.050 6 -1.6 303.05 125.02,285.04 4 13 异鼠李素-3-O-葡萄糖苷 C22H22O12477.103 9 477.102 2 -3.5 477.10 271.03,314.04 5 14.37 二氢异鼠李素 C16H14O7317.066 7 317.066 2 -1.5 125.02,152.01,289.07 6 16.21 山柰酚-3-O-鼠李糖苷 C21H20O10431.098 4 431.097 4 -2.3 431.10 257.05,285.04 7 16.25 二氢山柰酚 C15H12O6287.056 1 287.055 8 -1 287.06 135.04,151.00 8 16.55 5,7,4’-三羟基-3’-甲氧基黄酮-3-O-鼠李糖苷 C22H22O11461.108 9 461.108 4 -1.3 461.11 299.02,315.01 9 16.67 槲皮素 C15H10O7301.035 4 301.035 6 0.6 301.04 151.00,179.00 10* 17.51 儿茶素-7-鼠李糖苷 C21H24O11451.124 6 451.123 8 -1.8 451.12 151.00,242.06 11* 19.06 苜蓿素 C17H14O7329.066 7 329.066 1 -1.9 329.07271.02,299.02,314.04 12 19.07 橙皮素 C16H14O6301.071 8 301.071 2 -1.8 301.07 151.00,177.02 13 19.19 山柰酚 C15H10O6285.040 5 285.040 3 -0.6 285.04 187.04,229.05 14 19.21 香叶木素 C16H12O6299.056 1 299.026 0 -1.5 299.06 256.04,284.03 15 19.62 异鼠李素 C16H12O7315.051 0 315.050 7 -1 315.05 151.00,300.03 16 19.62 万寿菊素 C16H12O8331.045 9 331.045 6 -0.9 331.05 151.00,316.02 17* 23.4 紫罗兰素 C18H16O8359.077 2 359.076 3 -1.5 359.08 247.20,327.22 18* 24.22 刺槐黄素 C16H12O5283.061 2 283.060 8 -2.2 455.35 239.03,268.04
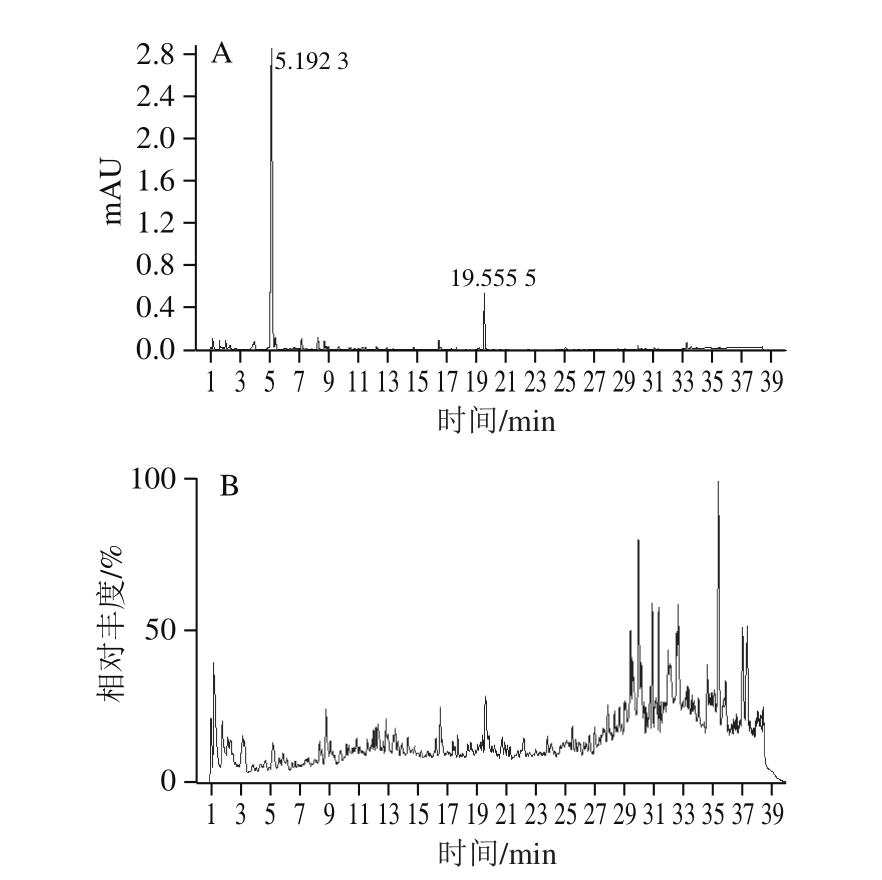
本研究采用的液相色谱-质谱条件使得超临界CO2流体萃取出的沙棘果萃取液中主要活性成分得到有效分离。图1为沙棘果超临界CO2萃取物的液相色谱图和质谱总离子图。黄酮类化合物在负离子模式下干扰较少,也易被离子化,碎片信息更为准确,故本实验采用负离子模式分析这些化合物。
采用质谱技术,根据二级质谱结果,解析化合物裂解途径,确定沙棘果超临界CO2萃取物中黄酮类成分的结构。
为方便讨论黄酮苷元及糖苷质谱断裂形成的碎片离子,本实验对黄酮类化合物裂解后的特征碎片离子进行了系统命名。如图2所示,其中,对黄酮苷元,i,jA和i,jB分别表示该黄酮苷元的碎片包含A-环和B-环,上标i和j显示了C环上键的断裂位置。对黄酮苷,k,lXj表示该碎片依然包括了黄酮苷元,j表示第j个糖基上键的断裂(从黄酮苷元数起),k和l显示了糖基环断裂的位置。
2.1.1 化合物2、4、6、8、9、13、15、16的断裂规律
化合物2、4、6、8、9、13、15、16皆为黄酮醇及其苷类,而其中化合物2经推断为紫云英苷,即山柰酚-3-O-葡萄糖苷,其分子式经Peakview色谱工作站模拟,为C21H20O11,相对分子质量为448。在负离子模式下,紫云英苷产生一级离子峰m/z 447 [M-H]-,m/z 447丢失一分子CH2O2后得到m/z 401,丢失一分子CH2O4得到碎片m/z 369,丢失一分子C3H6O3得到碎片m/z 367。这其中,m/z 357通过丢失一分子-C2H2-得到碎片m/z 331,通过丢失一分子CH2O得到m/z 327,而m/z 327丢失一分子CO得到m/z 299,再丢失1 个—CH2—得到m/z 285,再通过连续丢失一分子CO和—OH分别得到碎片m/z 257和m/z 240。而一级离子峰m/z 447通过丢失C12H16O6后得到碎片m/z 191,再丢失一分子—CHO得到m/z 162,或者通过丢失一分子C2H2O2得到m/z 133,m/z 133丢失一分子H2O得到碎片m/z 115。二级质谱中的碎片离子峰皆可由紫云英苷通过相应的键断裂而得,并且二级质谱得到的碎片离子峰和相关文献报道[23-24]一致。因此,化合物2推测为紫云英苷。
化合物4经推测为异鼠李素-3-O-葡萄糖苷,其分子式经Peakview色谱工作站模拟,为C22H22O12,相对分子质量为478。该物质二级碎片较集中且碎片离子丰度较大,在负离子模式下,产生一级离子碎片m/z 477 [M-H]-,m/z 477通过丢失一分子CO得到碎片m/z 433,通过丢失一分子葡萄糖—C6H10O5得到m/z 315,再丢失1 个H得到m/z 314,通过丢失一分子—CH3得到m/z 300,再连续丢失一分子—CHO和CO分别得m/z 271和m/z 243。而碎片m/z 315也可通过丢失一分子CH2O得到碎片m/z 285,再丢失一分子C6H4O4得到m/z 145。二级质谱中的碎片离子峰皆可由异鼠李素-3-O-葡萄糖苷通过相应的键断裂而得,并且二级质谱得到的碎片离子峰和相关文献报道[25]一致。因此,化合物4推测为异鼠李素-3-O-葡萄糖苷。
化合物6为山柰酚-3-O-鼠李糖苷,其分子式经Peakview色谱工作站模拟,为C21H20O10,相对分子质量为432。取代基R5、R7以及R4′为羟基,而R3被O-鼠李吡喃糖苷取代。在负离子模式下,山柰酚-3-O-鼠李吡喃糖苷产生m/z 431 [M-H]-,m/z 431丢失一分子—C6H10O4即鼠李吡喃糖苷得到m/z 285,m/z 285再脱去1 个H得到m/z 284,在质谱图中,m/z 285离子丰度要大于m/z 284,这说明前者离子比后者稳定。而m/z 285再丢失一分子CO得到m/z 257,碎片离子m/z 257丢失一分子CO2,得到m/z 213。如该化合物的裂解途径所示,碎片m/z 213极不稳定,因此在二级质谱中的含量也极低。此外,山柰酚-3-O-鼠李吡喃糖苷还发生了RDA反应,产生典型离子峰m/z 151。
化合物8为黄酮醇衍生物,其分子式经Peakview色谱工作站模拟,为C22H22O11,相对分子质量为462。取代基R5、R7和R4′为羟基,R3为O-鼠李糖苷,而R3′则被甲氧基取代。负离子条件下,产生分子离子峰为[M—H]- m/z 461,脱去鼠李糖基得到苷元离子m/z 315,接着脱去1 个H和2 个H分别得到m/z 314、313,在质谱图中,m/z 315离子丰度远大于m/z 314、313,证明m/z 315比后两个都要稳定。m/z 315丢失一分子—CH3得到m/z 300,m/z 300再脱去1 个H得到m/z 299,m/z 299也可由m/z 314丢失一分子—CH3得到,因此m/z 299的离子丰度稍大于m/z 300。紧接着m/z 300、299分别失去一分子CO,产生m/z 272、m/z 271,m/z 271再脱去一分子CO得到m/z 243,除此之外,m/z 461发生RDA裂解得到1,3A m/z 151。
化合物9为槲皮素,其分子式为C15H10O7,相对分子质量为302,属于黄酮醇类,其取代基R3、R5、R7、R3′、R4′为—OH,R6为H。产生典型离子有m/z 301 [M-H]-、273、245、229、179、151、149、121、107、93、83和65。m/z 301连续失去中性粒子CO产生m/z 273、m/z 245,m/z 245丢失1 个O产生m/z 229。除此之外,RDA裂解产生m/z 179(1,4B)、151(1,3A)和149(1,3B),m/z 151脱去1 个CO2得到m/z 107,m/z 149再连续脱去CO得到m/z 121、m/z 93。分子离子峰发生A环断裂则得到m/z 83(R8、R10),再脱去1 个H2O得到m/z 65。
化合物13为山柰酚,分子式为C15H10O6,相对分子质量为286,其取代基R3、R5、R7、R4′为—OH,R6、R8为H。除了生成分子离子峰m/z 285外,丢失1 个H2O产生m/z 267,再丢失1 个CO生成m/z 239,此外,A环上发生断裂,丢失C4H2O3重排生成离子碎片m/z 187。山柰酚二级碎片极少,但对照标准品的出峰时间以及二级碎片,基本可确定化合物13为山柰酚。
化合物15为异鼠李素,其分子式为C16H12O7,相对分子质量为316,其取代基R3、R5、R7、R4′为—OH,R6、R8为H,R3′则为甲氧基。因含有甲氧基,其分子离子峰m/z 315丢失甲基产生m/z 300,再丢失C4H4O2产生m/z 216,m/z 216丢失1 个—OH得到碎片离子m/z 199。m/z 300也可通过先丢失1 个—OH生成m/z 283,再连续丢失CO产生m/z 2 5 5和m/z 2 2 7。m/z 3 1 5也发生了C环常发生的断裂(脱去C O2)从而产生碎片离子m/z 2 7 1,再丢失1 个C O生成m/z 243,又或者丢失C6H4O2生成m/z 163,再丢失1 个—CH3,生成m/z 148。除此之外,分子离子峰m/z 315发生RDA断裂生成m/z 163(1,3B)和m/z 151(1,3A),碎片m/z 151丢失C3O2生成m/z 83。m/z 315的A环从C环上断裂,生成m/z 107,再失去1 个CO2生成m/z 63。化合物11的二级质谱碎片离子相当丰富,并且通过与异鼠李素标准品对比,可知沙棘果中异鼠李素含量丰富。
化合物16为万寿菊素,其分子式为C16H12O8,相对分子质量为332。其取代基R3、R5、R7、R3′、R4′为—OH,R6为甲氧基。因含有甲氧基,其分子离子峰m/z 331丢失甲基产生m/z 316,连续丢失CO生成m/z 303和m/z 275,而m/z 303和m/z 275再分别丢失1 个O生成m/z 287、m/z 259,m/z 259再丢失1 个O生成m/z 243。m/z 303也可通过失去C7H6O3生成m/z 165。分子离子峰m/z 331也可通过A环、B环以及C环的断裂,产生相应的碎片离子。如A环从C环上断裂,失去C9H4O5得到m/z 139,再失去1 个O生成m/z 123,最后失去—CH—并重排生成m/z 110。从C环上断裂失去C9H6O4生成m/z 153。也可通过失去C7H7O2生成m/z 208。除此之外,m/z 331也可发RDA断裂,生成m/z 180(1,3A)、m/z 151(1,3B)。
2.1.2 化合物3、5、7的断裂规律
化合物3、5、7皆为二氢黄酮醇,化合物3为二氢槲皮素,即R3、R5、R7、R3′、R4′全为—OH,其分子式经Peakview色谱工作站模拟,为C15H12O7,相对分子质量为304。其裂解规律具体如下:分子离子峰m/z 303失去1 个H2O生成m/z 285,再失去C9H4O5生成m/z 93;m/z 303失去1 个CO生成m/z 275;m/z 303失去1 个CO2生成m/z 259,m/z 259再失去1 个H2O生成m/z 241,也可通过失去C2H2O生成碎片离子m/z 217。而碎片m/z 217可通过丢失1 个H2O生成m/z 199,丢失1 个CO生成m/z 189,再丢失H4O2生成m/z 153,最后m/z 153丢失CO生成m/z 125,其中m/z 217还可通过再丢失1 个C2H2O生成m/z 175;m/z 303也可通过A环断裂,丢失C11H8O5生成m/z 83;最后,分子离子峰m/z 303还可通过RDA断裂生成m/z 151(1,3A)以及151(1,3B),m/z 151(1,3A)失去1 个CO2生成m/z 107,而151(1,3B)失去C5H2O2生成碎片m/z 57。
化合物5为3,5,7,3′-四羟基-4′-甲氧基黄酮,即二氢异鼠李素,其分子式为C16H14O7,相对分子质量为318。其裂解规律具体如下:分子离子峰m/z 317失去1 个H2O生成m/z 299;m/z 317失去1 个CO生成m/z 289,而m/z 289可以通过丢失C4H2O2生成m/z 207,再丢失1 个—CH3生成m/z 192,或是m/z 289丢失C9H8O3生成m/z 125,或是C环发生断裂生成m/z 165(1,3B),而m/z 165通过分别丢失C4H5O、C6H4O2和CH4生成m/z 96、m/z 57和m/z 149;m/z 317还可通过A环、C环的断裂生成相应的碎片离子,如丢失C7H5O3生成m/z 180,丢失C12H10O5生成m/z 83;m/z 317还可通过丢失1 个CO2生成m/z 273,而m/z 273可通过丢失C2HO生成m/z 232,丢失CO生成m/z 245,丢失—CH3生成m/z 258;m/z 317还能发生RDA断裂,生成相应的碎片离子,比如RDA1,3断裂生成m/z 151(1,3A)以及m/z 167(1,3B)这些很典型的二级碎片,而m/z 167(1,3B)丢失1 个甲基生成m/z 152。
化合物7为二氢山柰酚,即跟山柰酚相比较,连接C环上R2、R3的是C—C单键,而非双键。其分子式经Peakview色谱工作站模拟,为C15H12O6,相对分子质量为287。二氢山柰酚的二级碎片较少,除了分子离子峰m/z 287外,还产生几个比较典型的二级碎片离子,如经RDA断裂生成m/z 135(1,3B)和m/z 151(1,3A),或是A环从C环上断裂,丢失C9H8O4生成m/z 107。
2.1.3 化合物1、11、14、17、18的断裂规律
化合物1、11、14、17、18皆为黄酮苷元及其苷类,其中化合物1为芹菜素-6-C-葡萄糖苷-8-C-木糖苷,其分子式经Peakview色谱工作站模拟,为C26H28O14,相对分子质量为564,该物质在沙棘果中是首次报道。芹菜素-6-C-葡萄糖苷-8-C-木糖苷在沙棘中含量较低,因此二级碎片丰度也较小。除了出现明显的分子离子峰[M-H]- m/z 563外,二级裂解后通过丢失一分子C6H12O6得到碎片m/z 383,再丢失一分子CH2O得到m/z 353。除此之外,m/z 563通过丢失C13H14O6后得到m/z 297,再丢失一分子CH2O得到碎片m/z 267。m/z 563还可通过丢失一分子CH2O2得到碎片m/z 517,再连续丢失一分子CO2和CH2O分别得到碎片m/z 473和m/z 443。二级碎片皆可由芹菜素-6-C-葡萄糖苷-8-C-木糖苷通过丢失相应的碎片得到,并且二级质谱得到的碎片离子峰和相关文献报道[27]一致,所以推测基本正确。
化合物11为苜蓿素,其分子式经Peakview色谱工作站模拟,为C17H14O7,相对分子质量为330,属于黄酮苷元。在负离子模式下,产生分子离子峰[M-H]-m/z 329,因存在两个—CH3,因此在二级质谱上产生明显的两个丢失—CH3的碎片,分别为m/z 314和m/z 299,再连续丢失CO得到碎片m/z 271、m/z 243、m/z 215,碎片m/z 243丢失1 个O得到m/z 227。除此之外,m/z 329通过丢失C6H6O3重排得到m/z 203。
化合物14为香叶木素,其分子式经Peakview色谱工作站模拟,为C6H12O6,相对分子质量为300,属于黄酮苷元。取代基R5、R7、R3′为羟基,R4′被甲氧基取代。香叶木素除了出现明显的分子离子峰[M-H]- m/z 299外,进行二级质谱裂解后,丢失—CH3得到m/z 284,再脱去1 个CO得到m/z 256。二级质谱碎片离子较少,可能与香叶木素在萃取物中的浓度有关,但根据其裂解规律,可推断该化合物为香叶木素。
化合物17推测为紫罗兰素,为黄酮苷元,其分子式经Peakview色谱工作站模拟,为C18H16O8,相对分子质量为360。在负离子模式下,产生一级分子离子峰[M-H]-m/z 359,二级裂解途径有以下几种:m/z 369通过丢失一分子C4H6O2生成m/z 273,再通过丢失一分子—CH3生成碎片m/z 258,再通过连续丢失CO生成m/z 230、m/z 202、m/z 174;m/z 369通过连续丢失一分子—CH3生成m/z 344、m/z 329,而m/z 329通过丢失一分子CO生成碎片m/z 301,或通过丢失一分子—OH生成碎片m/z 327,再连续丢失一分子H2O生成碎片m/z 309、m/z 291,m/z 291再丢失一分子CO2生成碎片m/z 247。
化合物18推测为刺槐黄素,其分子式经Peakview色谱工作站模拟,为C16H12O5,相对分子质量为284。该物质在负离子模式下,主要以一级分子离子峰[M-H]-m/z 283直接裂解产生的二级碎片为主,如发生RDA断裂,生成碎片离子m/z 151(1,3A),或丢失一分子—CH3生成m/z 268,丢失一分子CO2生成碎片m/z 239,一分子H2O生成m/z 265,再丢失一分子C2O3生成碎片m/z 193,或通过B环的断裂,丢失C5H6O生成碎片m/z 183。二级碎片都能通过刺槐黄素断裂相应的键得到,因此,化合物18可基本推断为刺槐黄素。
2.1.4 化合物12的断裂规律
化合物12为3,5,7-三甲基-4′-甲氧基黄酮,即橙皮素,为二氢黄酮苷元类,其分子式经Peakview色谱工作站模拟,为C16H14O6,相对分子质量为302。除了产生分子离子峰m/z 301外,质谱图还产生了一系列二级碎片,如m/z 164、m/z 201就是由m/z 301分别丢失C7H5O3、C4H4O5而产生的。除此之外,m/z 301还能通过丢失1 个—CH3生成碎片离子m/z 286,再丢失C7H2O4生成m/z 136。m/z 301还能通过RDA断裂生成m/z 177(1,4B),m/z 151(1,3A)以及m/z 149(1,3B),而m/z 149丢失1 个—CH3生成碎片m/z 134,m/z 151(1,3A)丢失1 个CO2生成m/z 107,再丢失2 个C生成m/z 83,最后失去1 个H2O生成m/z 65。
2.1.5 化合物10的断裂规律
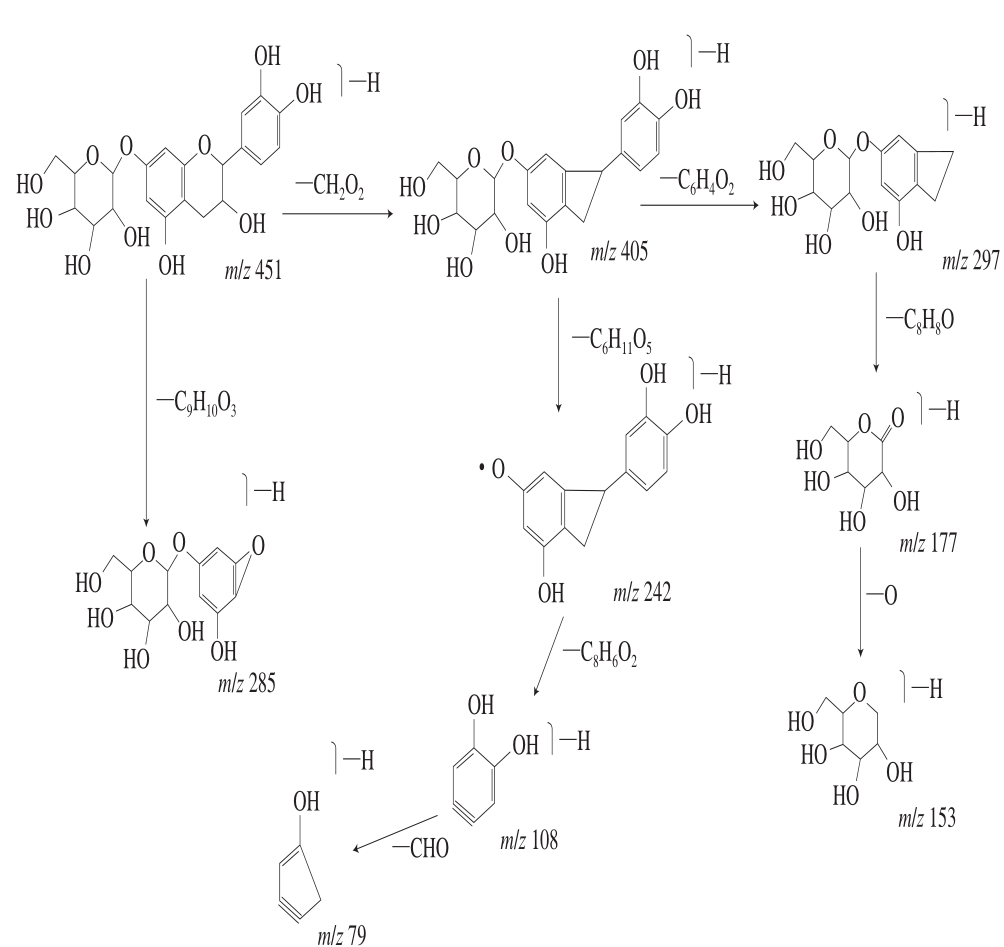
化合物10是此次定性分离中发现的唯一一个黄烷醇类黄酮,推测为儿茶素-7-葡萄糖苷,经Peakview色谱工作站模拟,分子式为C21H24O11,相对分子质量为452,除产生一级分子离子峰[M-H]- m/z 451外,通过C环的断裂,丢失CH2O2生成碎片m/z 405,再通过丢失C6H4O2生成m/z 297,丢失C8H8O得到碎片m/z 177,最后丢失1 个O得到m/z 153;碎片m/z 405还可通过丢失葡萄糖苷C6H11O5得到碎片m/z 242,再丢失C8H6O2得到碎片m/z 108,再接着丢失一分子—CHO得到m/z 79。m/z 451也可发生RDA断裂,生成碎片离子m/z 285(1,4A)。但由于该化合物相关文献较少以及液相色谱-质谱联用技术的局限性,无法确定该化合物所带的六碳糖,所以只能通过分析相应的裂解途径进行化合物的推测。
2.2 结构图及相关裂解途径
沙棘果超临界CO2萃取物中黄酮化合物的化学结构式如图3所示。以下是几种典型化合物(化合物3:二氢槲皮素;化合物9:槲皮素;化合物10:儿茶素-7-吡喃葡萄糖苷)的裂解途径解析如图4~6所示。
3 结论与讨论
本研究采用超临界CO2萃取技术获得沙棘果油,通过UPLC-MS和Peakview色谱工作站拟合、二级质谱解析和紫外光谱及质谱数据比对,解析有关化合物的裂解途径,鉴定出沙棘果油中含有18 种黄酮类化合物,包括8 种黄酮醇苷元及黄酮醇苷,3 种二氢黄酮醇苷元及二氢黄酮醇苷,5 种黄酮苷元及黄酮苷,1 种二氢黄酮苷元和1 种黄烷醇苷,其中芹菜素-6-C-葡萄糖苷-8-C-木糖苷、儿茶素-7-葡萄糖苷、苜蓿素、紫罗兰素、刺槐黄素这5 种黄酮首次被发现存在于沙棘果中。
超临界CO2萃取技术具有低温提取、无有毒残溶和可以选择性分离的优点,并且特别适合分离提取微量及稳定性低的活性组分,这也是本研究能够在沙棘果中发现5 种新黄酮化合物的重要原因。UPLC-MS是目前针对天然产物最常用的手段之一,可研究单体化合物的质谱裂解途径,并在此基础上进行结构解析。针对黄酮苷类的质谱裂解途径的研究已经较为成熟,可快速鉴定黄酮化合物[27-30]。
本研究所确定的技术途径原材料用量较少,分离简便,所针对化合物覆盖面广、灵敏度高,特别是能够分离到含量很低的黄酮类化合物,并且在没有相关黄酮标品的情况下也能够进行结构解析,从而系统地完成了沙棘果中黄酮类化合物组分谱分析和结构解析。但由于液相色谱-质谱联用技术的局限性,无法精确地确定黄酮糖苷所连接的糖苷位置,也无法准确判断五碳糖和六碳糖的同分异构体,如木糖和阿拉伯糖以及葡萄糖和半乳糖,还需借助相关文献和其他鉴定技术更好地确定相应的化合物。但是,液相色谱-质谱联用技术能够快速且方便地进行黄酮苷元的分析鉴定,这也是其一大特色。本研究结果不仅可为沙棘果中的黄酮类天然产物的高值化开发提供理论依据,而且为其他生物资源中天然产物组分谱分析和相关结构解析提供了有效的技术平台。
参考文献:
[1] 樊金玲. 沙棘籽原花色素的研究[D]. 无锡: 江南大学, 2006: 1-3.
[2] 李晓花. 沙棘有效成分动态变化研究[D]. 长春: 吉林农业大学,2003: 1.
[3] 刘勇, 廉永善, 王颖莉, 等. 沙棘的研究开发评述及其重要意义[J]. 中国中药杂志, 2014, 39(9): 1547-1552. DOI:10.4268/cjcmm20140901.
[4] DULF F V. Fatty acids in berry lipids of six sea buckthorn (Hippophae rhamnoides L. subspecies carpatica) cultivars grown in Romania[J].Chemistry Central Journal, 2012, 6(1): 106. DOI:10.1186/1752-153X-6-106.
[5] 吕恒慧. 沙棘果中活性物质的提取及其对心脏保护作用的研究[D].济南: 山东师范大学, 2016: 1.
[6] 丁健, 关莹, 阮成江, 等. 沙棘果油提取工艺的正交试验优化及其脂肪酸组分测定[J]. 食品科学, 2016, 37(2): 13-18. DOI:10.7506/spkx1002-6630-201602003.
[7] 赵思俊, 赵晓喆, 向欢, 等. 基于代谢通路调控的沙棘籽油抗抑郁作用机制研究[J]. 中草药, 2017, 48(13): 2682-2690. DOI:10.7501/j.issn.0253-2670.2017.13.015.
[8] 张佳婵, 史豆豆, 王昌涛, 等. 细胞水平评价沙棘粕醇提物的抗衰老功效[J]. 食品科学, 2017, 38(19): 164-170. DOI:10.7506/spkx1002-6630-201719026.
[9] LI Y, XU C, ZHANG Q, et al. In vitro anti-Helicobacter pylori action of 30 Chinese herbel medicines used to treat ulcer diseases[J].Journal of Ethnopharmacology, 2005, 98(3): 329-333. DOI:10.1016/j.jep.2005.01.020.
[10] CHO H, CHO E, JUNG H, et al. Antioxidant activities of sea buckthorn leaf tea extracts compared with green tea extracts[J]. Food Science & Biotechnology, 2014, 23(4): 1295-1303. DOI:10.1007/s10068-014-0178-1.
[11] 张荣泉, 张蓉. 高效液相色谱法测定沙棘提取物中总黄酮含量[J]. 天津药学, 2001, 13(3): 65-66. DOI:10.3969/j.issn.1006-5687.2001.03.037.
[12] 樊鑫梅, 申雪丽, 闫丽丽, 等. 高效液相色谱法同时测定沙棘果中槲皮素、山柰酚和异鼠李素的含量[J]. 中国医院药学杂志, 2012,32(17): 1343-1346.
[13] 焦岩. 大果沙棘黄酮分离纯化及生物活性研究[D]. 哈尔滨: 东北林业大学, 2010: 3.
[14] 周芳. 大果沙棘黄酮分离纯化及结构分析[D]. 哈尔滨: 东北林业大学, 2007: 2.
[15] JIANG F, GUAN H, LIU D, et al. Flavonoids from sea buckthorn inhibit the lipopolysaccharide-induced inflammatory response in RAW264.7 macrophages through the MAPK and NF-kappa B pathways[J]. Food & Function, 2017, 8(3): 1313-1322. DOI:10.1039/c6fo01873d.
[16] HOU D, WANG D, MA X, et al. Effects of total flavonoids of sea buckthorn (Hippophae rhamnoides L.) on cytotoxicity of NK92-MI cells[J]. International Journal of Immunopathology and Pharmacology,2017, 30(4): 353-361. DOI:10.1177/0394632017736673.
[17] ARIMBOOR R, ARUMUGHAN C. HPLC-DAD-MS/MS profiling of antioxidant flavonoid glycosides in sea buckthorn (Hippophae rhamnoides L.) seeds[J]. International Journal of Food Sciences and Nutrition, 2012, 63(6): 730-738. DOI:10.3109/09637486.2011.652075.
[18] CUI Q, LIU J, WANG L, et al. Sustainable deep eutectic solvents preparation and their efficiency in extraction and enrichment of main bioactive flavonoids from sea buckthorn leaves[J]. Journal of Cleaner Production, 2018, 184: 826-835. DOI:10.1016/j.jclepro.2018.02.295.
[19] DONG R, SU J, NIAN H, et al. Chemical fi ngerprint and quantitative analysis of flavonoids for quality control of Sea buckthorn leaves by HPLC and UHPLC-ESI-QTOF-MS[J]. Journal of Functional Foods,2017, 37: 513-522. DOI:10.1016/j.jff.2017.08.019.
[20] 徐响. 超临界二氧化碳萃取沙棘全果油及主要功效成分分析的研究[D]. 北京: 中国农业大学, 2007: 5-10.
[21] 魏贞伟, 邵弘, 王俊国, 等. 超临界CO2萃取沙棘籽油及热敏性物质分析[J]. 食品科学, 2012, 33(24): 97-100. DOI:10.7506/spkx1002-6630-201224020.
[22] 郑宏伟, 苏海建, 张帅, 等. 沙棘果油的超临界CO2萃取及其在卷烟中的应用研究[J]. 安徽农业科学, 2015(4): 286-288. DOI:10.3969/j.issn.0517-6611.2015.04.099.
[23] 曾明莹, 傅咏梅, 张蜀, 等. 不同产地辣木叶提取物的含量测定及指纹图谱相似性评价[J]. 云南农业大学学报(自然科学版), 2018, (3).DOI:10.12101/j.issn.1004-390X(n).201711056.
[24] 王远. 辣木叶黄酮的提取、分离纯化、结构鉴定及其生物活性研究[D]. 杭州: 浙江工商大学, 2017: 46-61.
[25] 左丽丽. 狗枣猕猴桃多酚的抗氧化与抗肿瘤效应研究[D]. 哈尔滨:哈尔滨工业大学, 2013: 56-60.
[26] 李晓亮, 汪豪, 刘戈, 等. 广金钱草的化学成分研究[J]. 中药材, 2007,30(7): 802-805. DOI:10.3321/j.issn:1001-4454.2007.07.016.
[27] 焦岩, 王振宇. 大孔树脂纯化大果沙棘果渣总黄酮的工艺研究[J]. 食品科学, 2010, 31(16): 16-20. DOI:10.7506/spkx1002-6630-201016004.
[28] 赵开径. 液相色谱-质谱联用技术在中药和化妆品分析中的应用[D]. 北京: 北京化工大学, 2010: 28-31.
[29] 李欣. 苦荞麦中黄酮类化合物分析方法的建立[D]. 北京: 中国农业科学院, 2010: 42-53.
[30] 陈勇. 荷叶黄酮提取、分离纯化及其抗氧化活性的研究[D]. 芜湖:安徽工程大学, 2014: 35-46.
Determination of Flavonoids in the Supercritical CO2 Extract of Sea Buckthorn Fruit by Using Ultra-High Performance Liquid Chromatography-Mass Spectrometry
DING Lina1, QIU Yiyi1, SHU Tong2, RUAN Hui1,3,4,*
(1. College of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310058, China;2. Qinghai Food Inspection and Testing Institute, Xining 810008, China; 3. Zhejiang Key Laboratory for Agro-Food Processing,Hangzhou 310058, China; 4. Ningbo Research Institute, Zhejiang University, Ningbo 315100, China)
Abstract: Sea buckthorn fruit oil was obtained by supercritical CO2 extraction, and its flavonoid components were analyzed by ultra-high performance liquid chromatography-mass spectrometry (UPLC-MS) through Peakview workstation matching followed by tandem mass spectrometric analysis and comparison of ultraviolet spectroscopic data and mass spectral data with those of reference standards as well as with literature data. A total of 18 flavonoid compounds were determined, including eight flavonol aglycones and flavonol glycosides, three dihydroflavonol aglycones and dihydroflavonol glycosides, five flavonoid aglycones and flavonoid glycosides, one dihydrof l avonoid aglycon and one flavanol glycoside. To our knowledge,apigenin-6-C-glucoside-8-C-xyloside, catechin-7-glucopyranoside, alizarin, violet and locustin were found in sea buckthorn for the fi rst time.
Keywords: sea buckthorn; flavonoid; supercritical CO2 extraction; ultra-high performance liquid chromatography-mass spectrometry
收稿日期:2018-10-15
基金项目:浙江省科技计划项目(2017C26004);青海省科技计划项目(2017-ZJ-Y06)
第一作者简介:丁丽娜(1993—)(ORCID: 0000-0002-7678-7984),女,硕士研究生,研究方向为天然产物与功能性食品。E-mail: 811146479@qq.com
*通信作者简介:阮晖(1968—)(ORCID: 0000-0002-1340-7489),男,副教授,博士,研究方向为天然产物与功能性食品。E-mail: andrewhruan@zju.edu.cn
DOI:10.7506/spkx1002-6630-20181015-138
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2019)18-0273-08
引文格式:丁丽娜, 邱亦亦, 束彤, 等. 超高效液相色谱-质谱联用技术解析沙棘果超临界CO2萃取物中黄酮类天然产物结构[J].食品科学, 2019, 40(18): 273-280. DOI:10.7506/spkx1002-6630-20181015-138. http://www.spkx.net.cn
DING Lina, QIU Yiyi, SHU Tong, et al. Determination of flavonoids in the supercritical CO2 extract of sea buckthorn fruit by using ultra-high performance liquid chromatography-mass spectrometry[J]. Food Science, 2019, 40(18): 273-280.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20181015-138. http://www.spkx.net.cn