
图1 串联卡平面示意图
Fig. 1 Schematic diagram of the dual assay
环境中的重金属难以被生物降解,会在土壤和水中富集,通过饮用水、植物、畜禽、水产、食用菌(包括野生食用菌)等多种途径,经膳食摄入进入人体,对机体产生慢性损害。据《2018年中国统计年鉴》统计,截至2017年,我国肉类中猪、牛、羊肉的产量已达到6 557.5万 t,全国居民人均主要肉类(猪、牛、样肉)消费量达到23.3 kg,禽类消费量达到8.9 kg[1]。我国各地区畜禽肉中重金属污染物水平的安全评价结果显示,2015—2017年猪肉中铅、镉、铬、汞、砷的平均超标率分别为1.19%、2.48%、1.29%、1.43%及0.62%,其中镉的超标情况较为严重,超标率是砷的4 倍,且华东及西北地区猪肉中的镉、西南地区猪肉中的铅超标率均在3%之上(含3%);2015—2017年鸡肉中铅、镉、铬、汞、砷的平均超标率分别为2.48%、1.48%、2.24%、0.95%及1.00%,其中铅和铬的超标率是汞和砷的2 倍,且华东、华南及西南地区的鸡肉中铅的超标率最高,均达到3.33%[2]。由此可见,鸡肉和猪肉中的铅镉污染已成为我国鸡肉和猪肉质量安全评价中备受关注的问题。
传统测定肉中铅和镉含量的国家标准方法是石墨炉原子吸收光谱法,测定结果准确,但仪器成本高,检测费用较昂贵,不适合现场大量快速检测。目前较常见的是胶体金试纸条,王亚楠[3]、朱旭东[4]和王玉珍[5]等相继建立Cd2+-Strip(胶体金法),但都属于定性试纸条,灵敏度较低,且一次测试只能检测单一重金属,针对Pb2+的很少。量子点的发现及应用,为开发快速、高敏、低成本的食品安全检测方法带来了更多的机会。
量子点为主要由II~VI族或III~V族元素组成的纳米颗粒,颗粒直径大约1~10 nm。由于量子点的电子和空穴被量子限域,连续的能带结构会变成具有分子特性的分立能级结构,受激发后可以发射荧光[6-7]。量子点的发射光谱窄,吸收光谱强,能够实现对不同物质同时进行分辨追踪,可以通过改变量子点的尺寸大小和化学组成使其发射光谱覆盖整个可见光区。较胶体金或普通荧光素,量子点比表面积更大,微球表面可偶联更多的生物活性分子,用于细胞定位、信号传导、胞内组分的迁移及临床诊断等研究[8-19],可作为最理想的荧光探针[20-22]。
孟元华等[23]通过量子点荧光探针实现了对大米中Cd2+的检测;邓超等[24]建立的CdSe量子点荧光探针,通过荧光淬灭强度测定水样中Pb2+和Hg2+的质量浓度。但是可同时检测2 种或2 种以上重金属的量子点研发还鲜有报道,检测2 种重金属离子的串联层析试剂卡迄今仍缺乏有效研究。本研究采用包载CdSe/CdS量子点的聚苯乙烯(polystyrene,PS)微球(CdSe/CdS@PS)作为荧光标记物,其表面含有大量羧基(—COOH),可高效偶联单克隆抗体,建立可同时检测肉中残留铅镉的串联卡,借助量子点荧光免疫分析仪,实现精准定量检测,有效提高试剂灵敏度和准确度。
金属离子标准溶液 中国国家标准物质中心;乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、碳二亚胺(1-ethyl-3-(3-dimethylaminopropyl)c a r b o d i i m i d e,E D C)、三羟甲基氨基甲烷trihydroxymethyl aminomethane,Tris)、4-羟乙基哌嗪乙磺酸(4-hydroxyethyl-ethanesulfonic acid,HEPES)、酪蛋白、聚维酮(polyvinylpyrrolidone K30,PVP-K30)、牛血清白蛋白(bovine serum albumin,BSA),吐温20美国Sigma公司;硝酸纤维素膜(HFC09002) 美国Millipore公司;ProClin300防腐剂(P300) 美国Supelco公司;棉浆纸、黏贴板(PVC板)、8965玻璃纤维、样品垫 上海捷宁生物科技有限公司;蔗糖、98%浓硝酸、浓硫酸 南京化学试剂股份有限公司;鼠抗Cd2+-IEDTA单克隆抗体(3.76 mg/mL)、鼠抗Pb2+-IEDTA单克隆抗体(5.1 mg/mL)、羊抗鼠IgG(5.2 mg/mL)、包载CdSe/CdS量子点的PS微球(CdSe/CdS@PS,5 mg/mL,荧光产率超过90%,包载率高达85%)、Cd2+-IEDTA-BSA(3.86 mg/mL)、Pb2+-IEDTA-BSA(4.47 mg/mL) 南京诺唯赞生物科技有限公司。
量子点稀释液(1 L):150 mg蔗糖、30 mg BSA、5 mL吐温20、2 mL P300,用Tris-HCl缓冲液(0.05 mol/L,pH 8.0)定容至1 000 mL,4 ℃保存;活化剂(1 L):23.4 mg NaCl、2 mL P300,用Tris-HCL缓冲液(0.05 mol/L,pH 8.0)定容至1 000 mL,4 ℃保存;封闭液(1 L):1 mL乙醇胺、30 mg BSA、2 mL P300,用Tris-HCl缓冲液(0.05 mol/L,pH 8.0)定容至1 000 mL,4 ℃保存;包被液(100 mL):HEPES缓冲液(0.2 mol/L,pH 8.0),加0.2 mg蔗糖、0.2 mL P300,定容至100 mL,4 ℃保存;玻璃纤维处理液(1 L):50 mg蔗糖、3 mg聚维酮、10 mL吐温20,用Tris-HCl缓冲液(0.05 mol/L,pH 8.0)定容至1 000 mL,4 ℃保存;样品垫处理液(1 L):20 mg蔗糖、5 mg酪蛋白、5 mL吐温20,用Tris-HCl缓冲液(0.05 mol/L,pH 8.0)定容至1 000 mL,4 ℃保存。
F96pro荧光分光光度计 上海棱光技术有限公司;5430R离心机 美国Eppendorf公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;JA1003A电子天平 上海精天电子仪器有限公司;WH-1微型旋涡混匀仪 江苏盛蓝仪器制造有限公司;HM3035三维平面点膜喷金仪、ZQ2000微电脑自动斩切机、YK725压壳机、双纠偏感应裁条机 上海金标生物科技有限公司;AFS-1000干式荧光免疫分析仪 广州蓝勃生物科技有限公司;Nexion 300D电感耦合等离子体-质谱(inductively coupled plasma-mass spectrometry,ICP-MS)仪 美国PE公司;Mars5 Xprass微波消解仪美国CEM公司;100 mL微波消解罐 南京瑞尼克科技开发有限公司。
1.3.1 试剂组成及原理

图1 串联卡平面示意图
Fig. 1 Schematic diagram of the dual assay
试剂基本组分包括样品垫、标记物垫、硝酸纤维素膜(NC膜)、棉浆纸和PVC板,其中样品垫和标记物垫均采用吸水玻璃纤维,结构如图1所示。实验所用试剂为串联试剂:标记物垫上是量子点标记的鼠抗Cd2+-IEDTA单克隆抗体、鼠抗Pb2+-IEDTA单克隆抗体;膜上包被2 种抗原T1和T2(T1为Cd2+-IEDTA-BSA,T2为Pb2+-IEDTA-BSA),上下串联,用于特异性结合单克隆抗体;C1和C2为羊抗鼠IgG,用于捕获未被包被抗原捕获的单克隆抗体,由于NC膜本身存在最大蛋白吸附量(2 mg/mL),为保证单克隆抗体能充分被捕获,故包被2 条C线;待测抗原是待测样本中的Cd2+-EDTA、Pb2+-EDTA,与标记物垫上的单克隆抗体会发生特异性结合。试剂的工作原理是竞争法,包被抗原与待测抗原竞争结合单克隆抗体,待测抗原越多,可优先竞争性结合更多的单克隆抗体,则包被抗原可结合的单克隆抗体就越少,结果导致T线信号值越低,C线信号值越高,信号值T/(C1+C2)与待测抗原含量呈反比。
1.3.2 膜包被
质控线1(C1线)、质控线2(C2线)均为羊抗鼠IgG,包被质量浓度为1.2 mg/mL;检测线1(T1线)为Cd2+-IEDTA-BSA抗原,检测线2(T2线)为Pb2+-IEDTA-BSA抗原,包被质量浓度为1.5 mg/mL;用划膜仪将抗原抗体包被于NC膜上(喷量0.8 μL/cm,检测线间距4 mm),37 ℃烘干2 h,收取后用铝箔袋封存,室温暂放。
1.3.3 玻璃纤维的处理
用裁条机对玻璃纤维进行裁切(30 cm×12 cm),用标记物垫预处理液进行浸泡处理10 min,每张玻璃纤维加液量为(22±0.05)mL,浸泡结束后转移到干燥网上,放入(37±2)℃鼓风干燥箱干燥16~24 h,收取后用铝箔袋封存,室温暂放。
1.3.4 样品垫的制备
用裁切机对样品垫进行裁切(30×1.5)cm,用加样枪取样品垫处理液进行操作(每条加液量约为(3.40±0.05)mL,加样结束后静置5~10 min,转移到干燥网上于(37±2)℃,鼓风干燥箱干燥16~24 h,收取后用铝箔袋封存,室温暂放。
1.3.5 标记物垫的制备
取出CdSe/CdS@PS原液(5 mg/mL),4 ℃超声10 min,监测粒径和分散系数,保证微球溶液分散均匀;超声后取1 mL微球原液于2 只15 mL离心管中,各加入4 mL活化剂混匀后,再加入EDC和待标记抗体(鼠抗Cd2+-IEDTA单克隆抗体和鼠抗Pb2+-IEDTA单克隆抗体)至终质量浓度分别为5 mg/mL和0.075 mg/mL,室温避光反应1 h;向2 只离心管中各加入1 mL封闭液封闭反应30 min,结束后离心(13 000 r/min,15 min),保留沉淀;用量子点稀释液重悬沉淀,定容至1 mg/mL,超声10 min,监测粒径和分散系数,分析标记情况。标记成功后,将两管标记溶液混合,重新定容使得混合标记物溶液质量浓度为0.4 mg/mL,混匀后借助喷金仪将溶液均匀喷涂在玻璃纤维上,过夜冻干。
1.3.6 串联卡的制备
在PVC板上依次黏贴棉浆纸和NC膜,再黏贴标记物垫和样品垫,用斩切机裁切成宽度为3.6 mm的试纸条,装壳、压壳,制备成试剂卡,铝箔袋密封后室温保存。
1.3.7 串联卡性能评价
Cd2+-EDTA/Pb2+-EDTA混合液的配制:将1 000 μg/mL的Cd2+和Pb2+标准溶液分别与1 mol/L的EDTA等体积混合,静置10 min后用0.01 mol/L的PBS(pH 7.2)稀释成所需的质量浓度2 000、1 000、800、600、400、200、100、40、20、10、5、2、0 ng/mL,再将同质量浓度的2 种溶液等体积混合,常温储存备用。
最优反应时间的评测:用试纸条检测质量浓度依次为100、10、0 ng/mL的混合溶液,每个质量浓度设3 个重复,用干式荧光免疫分析仪实时扫描监测并记录T1/(C1+C2)值和T2/(C1+C2)值均达到稳定状态所需的最少时间,确定不同试剂卡测定不同质量浓度样本的最优反应时间。
检测限和线性范围的评价:随着被测样品质量浓度的降低,C线信号值呈下降趋势,直至达到某一质量浓度点时,C线信号值达到最小有效值水平(干式荧光免疫分析仪说明书建议有效信号值大于3 000),此时对应的质量浓度点即为最低检测限;同理,随着被测样品质量浓度的升高,T线信号值达到最小有效值水平时所对应的质量浓度点即为检测上限。根据上述判定原理,用试纸条检测不同浓度的混合溶液,每个质量浓度设5 个重复,求C1均值、C2均值、T1均值、T2均值确定Cd2+和Pb2+的检测范围,并对范围内的质量浓度值及对应的T1/(C1+C2)值和T2/(C1+C2)值进行处理,分别建立质量浓度和T1/(C1+C2)值、T2/(C1+C2)值之间的Logit-log回归直线。
重复性评价:根据检测范围评价结果,参照美国临床实验室标准化协会EP5-A文件[25],用检测卡对高值和低值的混合溶液分别重复检测20 次,计算20 次测量结果的变异系数,结果应不大于10%。
特异性评价:用试纸条检测不同质量浓度的金属离子-EDTA溶液(Cu2+、Mn2+、Cr3+、Zn2+、Hg2+、Fe3+、Ca2+、Pb2+、Cd2+),配制方法同上,每个质量浓度平行检测3 次,根据检测结果评价试纸条特异性。
1.3.8 比对实验
实验室从江苏南京市栖霞区摄山星城集贸市场、玄武区孝陵卫集贸市场、江苏省句容市宝华花园农贸市场分别购买猪肉、鸡肉各3 份,总计18 份样本,分别标记为A1~A6、B1~B6、D1~D6(字母A代表摄山星城,B代表孝陵卫,D代表宝华;数字1~3代表不同的猪肉,4~6代表不同的鸡肉)。本实验采用GB 2762—2017《食品中污染物限量》对鸡肉和猪肉肉中铅、镉的合格情况进行判定。肉类(禽畜内脏除外)中铅和镉的限量分别为0.2、0.1 mg/kg。实验样本取样量少,为确保消解彻底,减少铅、镉的损失,利用微波消解法处理样本,消化后的样本用电感耦合等离子体-质谱(inductively coupled plasma-mass spectrometry,ICP-MS)法和串联卡检测样本,评价串联卡的准确率。
样本预处理:将肉粉碎成匀浆,称取粉碎后的样品2.0 g于微波消解罐内,依次加入10 mL HNO3和2 mL H2O2,盖上盖子密闭放置,过夜后进行微波消解(100 ℃恒温加热2 h,120 ℃恒温加热2 h,140 ℃恒温加热2 h,170 ℃恒温加热2 h)。待冷却后慢打开罐盖,用少量水冲洗内盖,将消解罐放在消解仪上,在150 ℃条件下赶酸,待溶液约剩1.0 mL时用水洗涤消解罐3~5 次,洗液全部转移入50 mL容量瓶中,用水定容至刻度,混匀直接进行ICP-MS测定。测定结束后取5 mL剩余混合液于离心管中,加入5 mL EDTA溶液(0.1 mol/L),反应30 min后离心10 min,取上清液用串联卡检测[26]。
以ICP-MS检测的Cd2+、Pb2+质量浓度结果分别为横坐标,对应的串联卡检测结果为纵坐标,用直线回归分析对数据作处理,计算回归方程。
标记前后对量子点的粒径和分散系数进行监测:从分散系数看,标记前分散系数较小(约为0.162),表明溶液中颗粒大小较均一,分散度好,标记后分散系数增加,可能是由于量子点表面修饰抗体后,由于表面电荷的改变产生颗粒凝集,造成凝集团的大小不均一[27];从粒径看,标记镉单抗前后粒径明显变化(345.7 nm→383.0 nm),粒径增大说明标记抗体成功。同理,标记铅单抗前后分散系数变大(0.162→0.203),粒径增大(345.0 nm→365.4 nm),表示标记抗体成功,结果见表1。
表1 粒径分析
Table 1 Particle size analysis
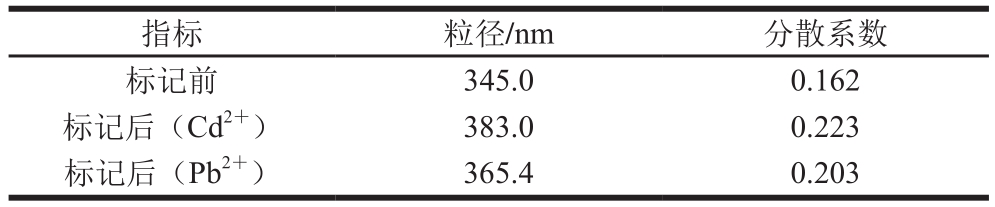
指标 粒径/nm 分散系数标记前 345.0 0.162标记后(Cd2+) 383.0 0.223标记后(Pb2+) 365.4 0.203
通过实时监测扫描发现,9 张检测卡都在1 min内完成跑板,T1/(C1+C2)值和T2/(C1+C2)值在5 min内均达到稳定状态不再变化,表示此时已反应充分,故试纸条的最佳反应时间定为5 min。
用试纸条检测不同质量浓度的混合溶液,当质量浓度小于1 ng/mL时,所对应的C1、C2值均小于3 000,不能排除信号值被背景干扰;当标准品质量浓度为1 ng/mL时,C1、C2值都达到最小有效水平,故可检测的Cd2+和Pb2+最低质量浓度均为1 ng/mL。混合溶液质量浓度为400 ng/mL时,T1值达到最小有效值水平,且随着质量浓度的增加,T1值小于3 000,故可检测的Cd2+上限为400 ng/mL;同理,混合溶液质量浓度为500 ng/mL时,T2值达到最小有效值,故可检测的Pb2+上限为500 ng/mL,结果见表2。
表2 检测限的评价
Table 2 Limit of detection of the assay
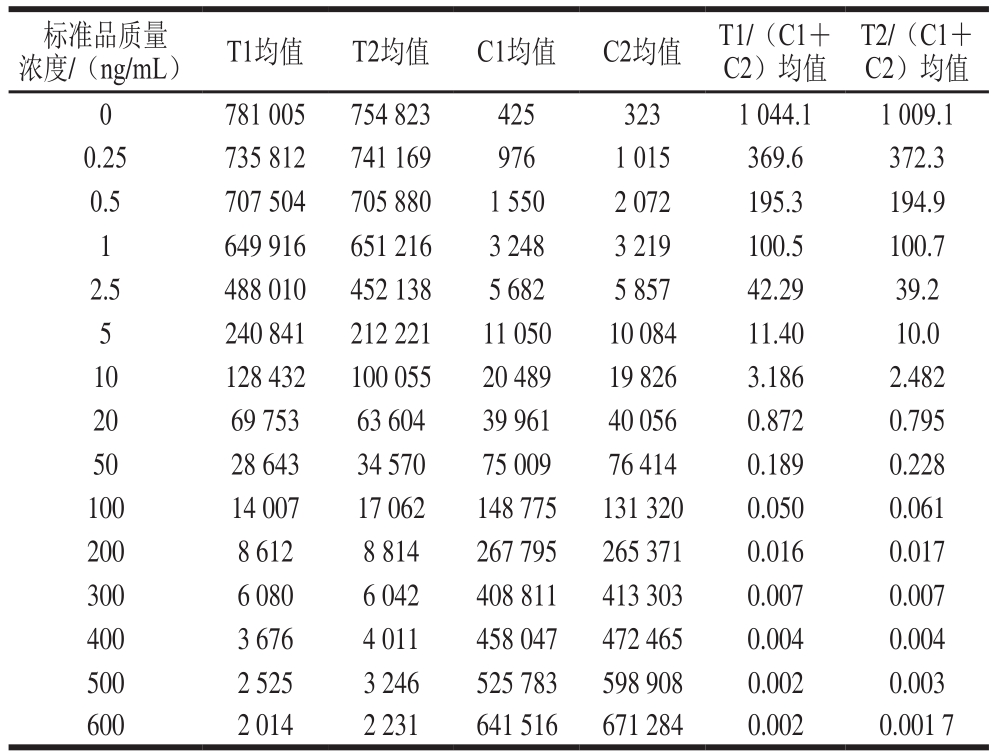
浓度/(ng/mL) T1均值 T2均值 C1均值 C2均值 T1/(C1+C2)均值标准品质量T2/(C1+C2)均值0 781 005 754 823 425 323 1 044.1 1 009.1 0.25 735 812 741 169 976 1 015 369.6 372.3 0.5 707 504 705 880 1 550 2 072 195.3 194.9 1 649 916 651 216 3 248 3 219 100.5 100.7 2.5 488 010 452 138 5 682 5 857 42.29 39.2 5 240 841 212 221 11 050 10 084 11.40 10.0 10 128 432 100 055 20 489 19 826 3.186 2.482 20 69 753 63 604 39 961 40 056 0.872 0.795 50 28 643 34 570 75 009 76 414 0.189 0.228 100 14 007 17 062 148 775 131 320 0.050 0.061 200 8 612 8 814 267 795 265 371 0.016 0.017 300 6 080 6 042 408 811 413 303 0.007 0.007 400 3 676 4 011 458 047 472 465 0.004 0.004 500 2 525 3 246 525 783 598 908 0.002 0.003 600 2 014 2 231 641 516 671 284 0.002 0.001 7
根据2.3节结果,对检测下限和检测上限之间的质量浓度值及对应的T1/(C1+C2)均值、T2/(C1+C2)均值分别作Logit-log回归直线,结果显示r12=0.997,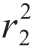 =0.998,且实测值与理论值检测偏差均在15%以内,符合准确度要求;将直线数据导入仪器作为标准曲线备用。具体数据如表3、4所示。
=0.998,且实测值与理论值检测偏差均在15%以内,符合准确度要求;将直线数据导入仪器作为标准曲线备用。具体数据如表3、4所示。
表3 Cd2+-strip线性范围评测
Table 3 Linear range of the Cd2+ strip
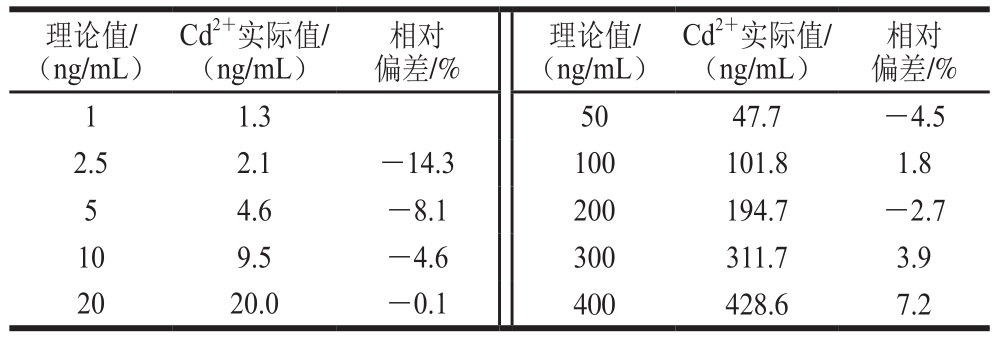
理论值/(ng/mL)相对偏差/%1 1.3 50 47.7 -4.5 2.5 2.1 -14.3 100 101.8 1.8 5 4.6 -8.1 200 194.7 -2.7 10 9.5 -4.6 300 311.7 3.9 20 20.0 -0.1 400 428.6 7.2 Cd2+实际值/(ng/mL)相对偏差/%理论值/(ng/mL)Cd2+实际值/(ng/mL)
表4 Pb2+-strip线性范围评测
Table 4 Linear range of the Pb2+ strip
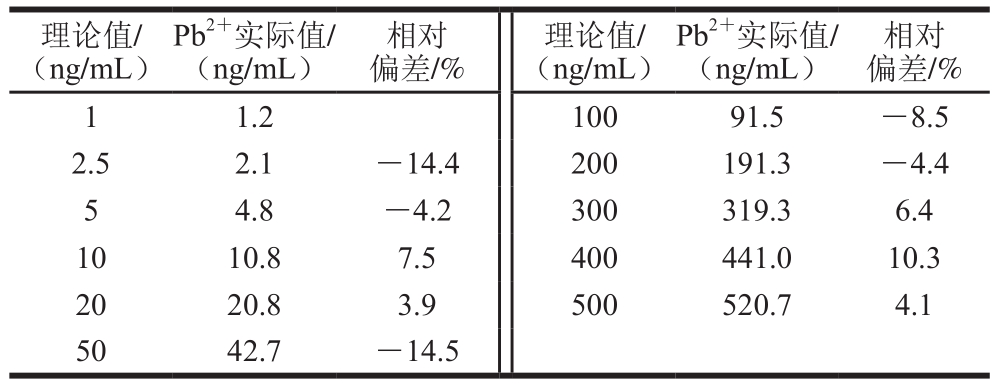
理论值/(ng/mL)相对偏差/%1 1.2 100 91.5 -8.5 2.5 2.1 -14.4 200 191.3 -4.4 5 4.8 -4.2 300 319.3 6.4 10 10.8 7.5 400 441.0 10.3 20 20.8 3.9 500 520.7 4.1 50 42.7 -14.5 Pb2+实际值/(ng/mL)相对偏差/%理论值/(ng/mL)Pb2+实际值/(ng/mL)
选取线性范围内的高值和低值,用串联卡分别重复检测20 次,精密性高,满足变异系数小于10%的要求,结果如表5所示。
表5 试纸条重复性评测
Table 5 Repeatability of the strip

项目 质量浓度/(ng/mL)100.0 5.0均值/(ng/mL) 103.5(Cd2+) 90.8(Pb2+) 5.2(Cd2+) 4.3(Pb2+)标准差/(ng/mL) 8.1(Cd2+) 4.2(Pb2+) 0.42(Cd2+) 0.41(Pb2+)变异系数/% 7.8(Cd2+) 4.6(Pb2+) 8.1(Cd2+) 9.5(Pb2+)
检测不同金属离子(Cu2+、Mn2+、Hg2+、Zn2+、Fe3+、Cr3+、Pb2+、Cd2+)的梯度样本,除Pb2+和Cd2+外检测结果均小于1 ng/mL,表明样本中不存在其他金属离子与Cd2+单抗、Pb2+单抗的非特异性结合,故无交叉反应,见表6。
表6 试纸条特异性评测
Table 6 Specificity of the strip

理论值/(ng/mL)实测值/(ng/mL)Cu2+ Mn2+ Cr3+ Zn2+ Hg2+ Fe2+ Ca3+ Pb2+ Cd2+400 <1.0 <1.0 <1.0 <1.0 <1.0 <1.0 <1.0 381.5 412.8 100 <1.0 <1.0 <1.0 <1.0 <1.0 <1.0 <1.0 92.1 104.5 50 <1.0 <1.0 <1.0 <1.0 <1.0 <1.0 <1.0 43.3 45.1 10 <1.0 <1.0 <1.0 <1.0 <1.0 <1.0 <1.0 17.6 18.9 5 <1.0 <1.0 <1.0 <1.0 <1.0 <1.0 <1.0 4.1 7.2 0 <1.0 <1.0 <1.0 <1.0 <1.0 <1.0 <1.0 <1.0 <1.0
表7 串联卡和ICP-MS的检测结果
Table 7 Comparison of results of the dual assay and ICP-MS
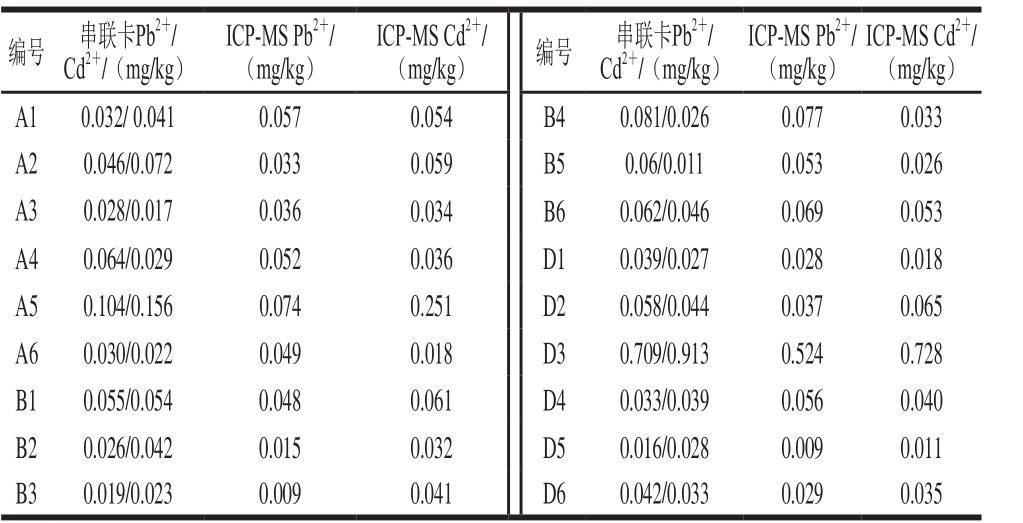
编号 串联卡Pb2+/Cd2+/(mg/kg)ICP-MS Cd2+/(mg/kg)A1 0.032/ 0.041 0.057 0.054 B4 0.081/0.026 0.077 0.033 A2 0.046/0.072 0.033 0.059 B5 0.06/0.011 0.053 0.026 A3 0.028/0.017 0.036 0.034 B6 0.062/0.046 0.069 0.053 A4 0.064/0.029 0.052 0.036 D1 0.039/0.027 0.028 0.018 A5 0.104/0.156 0.074 0.251 D2 0.058/0.044 0.037 0.065 A6 0.030/0.022 0.049 0.018 D3 0.709/0.913 0.524 0.728 B1 0.055/0.054 0.048 0.061 D4 0.033/0.039 0.056 0.040 B2 0.026/0.042 0.015 0.032 D5 0.016/0.028 0.009 0.011 B3 0.019/0.023 0.009 0.041 D6 0.042/0.033 0.029 0.035 ICP-MS Pb2+/(mg/kg)ICP-MS Cd2+/(mg/kg) 编号 串联卡Pb2+/Cd2+/(mg/kg)ICP-MS Pb2+/(mg/kg)
由表7可知,除了A5和D3样本被检出Cd2+或Pb2+超出限量外,其他被测样本中的Cd2+和Pb2+含量都比较低,不同来源的动物性食品中残留Cd2+和Pb2+含量不完全相同。根据线性相关结果,串联卡Pb2+检测结果与ICP-MS的相关系数为0.90,Cd2+检测结果与ICP-MS的相关系数为0.92,相关性良好。
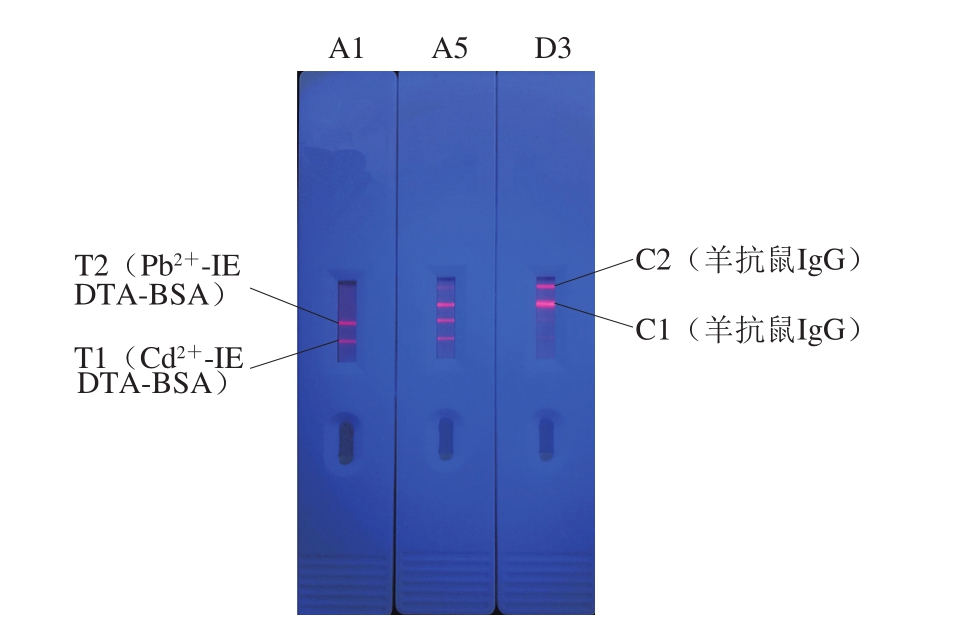
图2 紫外灯下异常样品串联卡检测结果
Fig. 2 Results obtained for abnormal samples using the dual assay under ultraviolet illumination
由图2可知,A1样本Cd2+和Pb2+均未超出限量,所以C1线和C2线都很浅,肉眼很难辨认;A5样本只有Cd2+检测结果超出限量,所以与A1相比,T1线条颜色略浅、C1线条颜色略深;D3样本Cd2+和Pb2+均超出限量,C1和C2线条颜色较深,T1和T2线条颜色浅。
Chen Jianlin等[28]发现经过L-半胱氨酸修饰的CdSe量子点,稳定性和荧光强度均明显提高,其表面基团与Hg2+的亲和力强,利用Hg2+浓度对量子点荧光强度的影响,建立了一种简便、快速测定Hg2+的方法,该方法对Hg2+的检出限可达6.0×10-9 mol/L;周华健等[29]利用量子点对金属离子具有荧光响应的特性,以CdTe量子点为荧光探针实现了对水溶液中Ni2+的检测。但以上所用的量子点均为单核量子点(CdSe或CdTe),其电子与空穴均处于离域状态,且大部分原子都以缺陷态存在,而这些缺陷态又具有捕获电子或者空穴的能力[30],会导致荧光不稳定,大大降低量子点的发光效率。实验所用的CdSe/CdS量子点为核壳型量子点,其电子与空穴都主要被限域在核内,抵御环境影响的能力会大大提升,同时可以提高核心材料的发光性能和稳定性能[30]。
文献[31]报道可以通过有机配体包载核壳量子点来保护绝大多数原子,同时配体可以使量子点相互间的距离加大防止聚集,使得量子点溶液更加稳定的存在。虽然普通的核壳量子点,荧光强度高,但表面含有大量疏水基团,无法与抗体等分子直接偶联。如何有效地将抗体偶联在量子点表面并保持其生物学活性,是量子点免疫分析应用中至关重要的一步。
孟元华等[23]研制的检测大米中的镉的CdSe/CdS量子点荧光探针,将经硼氢化钠还原的BSA修饰在CdSe/CdS量子点表面形成dBSA-量子点,量子点荧光在待测的Cd2+作用下会增强,通过荧光变化量来测定Cd2+含量,但所用荧光探针对温度和pH值有严格要求,特别是酸性条件下,量子点的荧光性能受较大干扰,会影响检测灵敏度。因此,如何提高其发光稳定性具有重要的科学意义[32]。
此外,以上所提及的量子点技术都是对单一重金属的检测。实验所用CdSe/CdS量子点包载在PS内部,能够避免量子点与外界环境的直接接触,量子点抗光漂白性能强;同时微球表面的亲水性集团易于生物分子偶联,可实现对不同种单克隆抗体的高效标记。此外,干式荧光免疫分析仪的使用,有效保证了定量检测的实现。仪器的内置光源(360 nm紫外光)可激发试剂卡上信号区聚集的量子点,测量系统运用光电扫描试剂卡信号区,然后对光电信号的强弱进行测量处理,定量分析出待测物的浓度,仪器检测变异系数小于1%,稳定性相对偏倚小于±2%。以上条件建立的串联检测卡,实现了对肉中铅、镉的同时检测,提高了试纸条的灵敏度(1.0 ng/mL)、准确度(检测变异系数小于10%)、检测时间(5 min)。将来甚至可建立同时检测3 种或3 种以上重金属的联卡,配套专用的小型量子点荧光定量分析仪,即可实现食品中重金属的日常定量检测。
[1] 统计局. 中国统计年鉴[M]. 北京: 中国统计出版社, 2018.
[2] 王雅洁, 杨冰, 何锦林, 等. 我国各地区畜禽肉中重金属污染物水平的安全评价及分布特征[J]. 食品安全质量检测学报, 2018, 5(9):2258-2266. DOI:CNKI:SUN:SPAJ.0.2018-09-055.
[3] 王亚楠, 王晓斐, 牛琳琳, 等. 食品中镉离子胶体金免疫层析快速检测方法的建立及应用[J]. 食品科学, 2016, 37(18): 152-158.DOI:10.7506/spkx1002-6630-201618025.
[4] 朱旭东, 赵小旭. 粮食中重金属镉定量快速检测方法的建立[J].粮食科技与经济, 2017, 42(3): 39-42. DOI:10.16465/j.gste.cn431252ts.20170311.
[5] 王玉珍, 周静清, 温雅琼, 等. 快速检测镉离子的免疫层析分析法的建立及应用[J]. 化学研究与应用, 2017, 29(12): 1916-1920.DOI:10.3969/j.issn.1004-1656.2017.12.024.
[6] 黄凯, 林匡飞, 张卫, 等. 水溶性CdTe量子点对斑马鱼胚胎发育的影响[J]. 环境科学学报, 2011, 31(4): 854-859. DOI:10.13671/j.hjkxxb.2011.04.029.
[7] 王贵青. 量子点的制备方法及在指纹检测中的应用现状[J].云南警官学院学报, 2012(4): 119-123. DOI:10.3969/j.issn.1672-6057.2012.04.027.
[8] ZHENG Z Z, ZHOU Y L, LI X Y, et al. Highly-sensitive organophosphorous pesticide biosensors based on nanostructured films of acetylcholinesterase and CdTe quantum dots[J]. Biosensors and Bioelectronics, 2011, 26(6): 3081-3085. DOI:10.1016/j.bios.2010.12.021.
[9] LIAO X X, ZHANG X W. Preparation, characterization and cytotoxicity of carbon nanotube-chitosan-phycocyanin complex[J].Nanotechnology, 2012, 23(3): 035101. DOI:10.1088/0957-4484/23/3/035101.
[10] YANG K, ZHANG F J, TANG H, et al. In-vivo imaging of oral squamous cell carcinoma by EGFR monoclonal antibody conjugated near-infrared quantum dots in mice[J]. International Journal of Nanomedicine, 2011, 6: 1739-1745. DOI:10.2147/ijn.s23348.
[11] ZHU H, SIKORA U, OZCAN A. Quantum dot enabled detection of Escherichia coli using a cell-phone[J]. Analyst, 2012, 137(11): 2541-2544. DOI:10.1039/c2an35071h.
[12] ZHANG Y, LIU K J, WANG T L, et al.Mapping DNA quantity into electrophoretic mobility through quantum dot nanotethers for highresolution genetic and epigenetic analysis[J]. ACS Nano, 2012, 6(1):858-864. DOI:10.1021/nn204377k.
[13] XU J, MULLER S, NANNAPANENI S, et al. Comparison of quantum dot technology with conventional immunohistochemistry in examining aldehyde dehydrogenase 1A1 as a potential biomarker for lymph node metastasis of head and neck cancer[J]. European Journal of Cancer,2012, 48(11): 1682-1691. DOI:10.1016/j.ejca.2011.12.029.
[14] TAK Y K, KIM W Y, KIM M J, et al. Highly sensitive polymerase chain reaction-free quantum dot-based quantification of forensic genomic DNA[J]. Analytica Chimica Acta, 2012, 721: 85-91.DOI:10.1016/j.aca.2012.01.056.
[15] WANG X, LI S, SHI Y, et al. The development of site-specific drug delivery nanocarriers based on receptor mediation[J].Journal of Controlled Release, 2014, 193: 139-153. DOI:10.1016/j.jconrel.2014.05.028.
[16] SANTOS A R, MIGUEL A S, MACOVEI A, et al. CdSe/ZnS quantum dots trigger DNA repair and antioxidant enzyme systems in Medicago sativa cells in suspension culture[J]. BMC Biotechnology, 2013, 13(1):111. DOI:10.1186/1472-6750-13-111.
[17] FARKHANI S M, VALIZADEH A, KARAMI H, et al. Cell penetrating peptides: efficient vectors for delivery of nanoparticles,nanocarriers, therapeutic and diagnostic molecules[J]. Peptides, 2014,57(7): 78-94.
[18] VAN VEGGEL F C. Near-infrared quantum dots and their delicate synthesis, challenging characterization, and exciting potential applications[J]. Chemistry of Materials, 2014, 26(1): 111-122.DOI:10.1002/chin.201409233.
[19] WANG E C, WANG A Z. Nanoparticles and their applications in cell and molecular biology[J]. Integrative Biology, 2014, 6(1): 9-26.DOI:10.1039/c3ib40165k.
[20] LI Z H, WANG Y, WANG J, et al. Rapid and sensitive detection of protein biomarker using a portable fluorescence biosensor based on quantum dots and a lateral flow test strip[J]. Analytical Chemistry,2010, 2(16): 7008-7014. DOI:10.1021/ac101405a.
[21] SHAMSIPUR M, SHANEHASZ M, KHAJEH K, et al. A novel quantum dot-laccase hybrid nanobiosensor for low level determination of dopamine[J]. Analyst, 2012, 137(23): 5553-5559. DOI:10.1039/c2an36035g.
[22] TU M C, CHANG Y T, KANG Y T, et al. A quantum dot-based optical immunosensor for human serum albumin detection[J].Biosensors & Bioelectronics, 2012, 34(1): 286-290. DOI:10.1016/j.bios.2011.11.035.
[23] 孟元华, 陶冠红. CdSe/CdS量子点荧光探针检测大米中的镉[J].中国卫生检验杂志, 2014, 24(2): 180-183.
[24] 邓超, 张辉, 屠彬彬, 等. CdSe量子点的合成及其在重金属离子检测中的应用[J]. 化工环保, 2017, 37(1): 121-126. DOI:10.3969/j.issn.1006-1878.2017.01.022.
[25] CLSI. EP5-A. Evaluation of precision performance of clinical chemistry devices[S].
[26] 吴训, 江永红. ICP-MS法测定动物肝脏中重金属元素的含量[J]. 食品研究与开发, 2016, 37(18): 136-138. DOI:10.3969/j.issn.1005-6521.2016.18.031.
[27] 刑仕歌, 熊齐荣, 钟强, 等. 量子点抗体偶联技术研究进展[J]. 分析化学, 2013, 6(41): 949-955. DOI:10.3724/SP.J.1096.2013.21071.
[28] CHEN J L, GAO Y C, XU Z B, et al. A novel fluorescent array for mercury(II) ion in aqueous solution with functionalized cadmium selenide nanoclusters[J]. Analytica Chimica Acta, 2006, 577: 77-84.DOI:10.1016/j.aca.2006.06.039.
[29] 周华健, 曹立新, 高荣杰, 等. 水溶性CdTe量子点荧光探针的制备表征及应用[J]. 发光学报, 2013, 34(7): 829-835. DOI:10.3788/fgxb20133407.0829.
[30] 曹胡加. 核壳量子点合成与性能表征[D]. 杭州: 浙江大学, 2015.DOI:10.6043/j.issn.0438-0479. 201701012.
[31] PENG Z A, PENG X G. Foramtion of high-quality CdTe, CdSe and CdS nanocrystals using CdO as precursor[J]. Journal of the American Chemical Society, 2001, 123: 183-184. DOI:10.1021/ja003633m.
[32] 文凯, 亢宁, 周亚鸣, 等. CdSe/CdS量子点及量子点@聚苯乙烯荧光微球的制备[J]. 厦门大学学报(自然科学版), 2017, 56(5): 619-625.DOI:10.6043/j.issn.0438-0479.201701012.
Quantum Dot-Based Assay for Rapid Simultaneous Detection of Lead and Cadmium
LIU Beibei, CAO Lin. Quantum dot-based assay for rapid simultaneous detection of lead and cadmium[J]. Food Science, 2019,40(18): 335-341. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20181031-372. http://www.spkx.net.cn