
动物肌肉的组成部分——脂肪,在肉类感官品质和加工特性方面发挥着重要作用。脂肪的主要形式包括皮下脂肪、内脏脂肪、肌间脂肪和肌内脂肪,其中肌内脂肪对肉的嫩度、风味、多汁性等有好的促进作用[1]。脂肪沉积受物种、性别、日龄以及沉积部位等多种因素的影响,不同品种、性别和日龄的动物在不同组织中其脂肪沉积情况存在显著差异。而目前就日龄对肌肉组织中脂肪沉积影响的研究尚不够深入。
日龄是影响肌内脂肪沉积的重要因素,杨烨[2]在研究日龄与优质鸡的脂肪沉积关系时发现,日龄对肌内脂肪含量(intramuscular fat content,IMF)影响显著,且8~16 周龄优质鸡的IMF随着周龄的增加而显著增加。此外,不同组织器官的脂肪沉积也随着品种和日龄的不同而呈现出差异性。Simon等[3]的研究表明,家禽的脂肪最先在皮下部位发育沉积,紧接着在颈部位置,最后在胸部和腿部的皮下位置,但在腹部积累最快。除日龄外,脂肪代谢相关基因与肌内脂肪沉积密切相关。近年来,分子生物技术的飞速发展为研究脂肪沉积机制提供了极大便利,分析脂肪代谢相关基因的表达从而加深对脂肪沉积调控的认识,已成为国内外学者研究的热点。脂肪酸合成酶(fatty acid synthase,FAS)催化是脂肪酸生物合成通路的最后一步[4],是脂肪合成代谢的关键酶[5]。Semenkovich[6]的研究指出肌细胞内FAS能有效提高使甘油三酯合成量,从而增加动物的脂肪沉积。甘油三酯脂酶(adipose triglyceride lipase,ATGL)可以将甘油三酯催化水解为甘油二脂,是脂肪水解第一步的限速酶[7-8]。CIDEa蛋白可促进野生型小鼠体内的脂肪扩张与沉积[9],与CIDEb、CIDEc[10]共同构成CIDE家族。敲除CIDEa基因的小鼠表现出更高的基础代谢率,脂肪分解速度加快,大脂滴数量减少而小脂滴数量增加,体内脂肪积累减少,体质量减轻[11-12]。
目前,有关脂肪沉积对肉品品质的影响大多集中于猪、牛等哺乳动物中,少见于家禽。麻鸭是鸭类中优良的品种,具有丰富的营养价值,脂肪的沉积量与麻鸭的食用品质密切相关;因此研究麻鸭脂肪沉积具有一定实际意义,基于此,本研究采用荧光定量聚合酶链式反应(polymerase chain reaction,PCR)技术,分析不同日龄麻鸭肌肉组织中CIDEa基因、脂肪代谢相关基因的相对表达量,然后测定了麻鸭不同组织中脂肪质量分数,最后分析了肌肉组织的保水性和剪切力变化,旨在阐述日龄对麻鸭生长发育过程中脂肪沉积的代谢机制以及理清脂肪沉积对肌肉品质变化的影响。
绍兴雄性麻鸭,饲养于宁波市镇海江南家禽育种有限公司,饲养条件按照公司饲养方法执行,饲养管理条件均保持一致,分别于90、180、270、360 日龄取样,并分别标为I组、II组、III组和IV组,每组10 只。将实验所用麻鸭在当地屠宰场按照动物屠宰福利标准宰杀后,立即采集肝脏、心脏、皮下脂肪和腹部脂肪的组织样品,快速分装,放入-80 ℃冰箱保存,用于后续实验。同时称量并记录皮脂质量、腹脂质量、屠体质量。
三氯甲烷、甲醇、氢氧化钠均为国产分析纯。TRIzol试剂、RNA marker、DNA marker、PrimeScript RT reagent kit试剂盒、SYBR Premix Ex TaqTM II 试剂盒日本Takara公司;琼脂糖 法国Biowest公司;半定量PCR试剂盒 北京全式金公司;GelRed核酸凝胶染料美国Biotium公司。
pH计 梅特勒-托利多仪器(上海)有限公司;H-2050R型高速冷冻离心机 湘仪离心机有限公司;旋转蒸发仪 深圳市三利化学品有限公司;C-LMB型数显式肌肉嫩度仪 北京天翔飞域仪器设备有限公司;M200全波长酶标仪 瑞士Tecan公司;实时荧光定量PCR仪 德国艾本德公司。
1.3.1 脂肪质量分数的测定
参照Folch等[13]的方法提取脂质,测定麻鸭胸肌的IMF。样品于4 ℃解冻后,剔除结缔组织和可见脂肪,称2 g胸肌,剪碎,低速匀浆后用氯仿-甲醇(体积比2∶1)定容至120 mL,静置1 h,过滤后加入0.2 倍体积的生理盐水(7.3 g/L NaCl、0.5 g/L CaCl2),然后3 000 r/min离心15 min,吸取下层液体用真空旋转蒸发器44 ℃水浴真空蒸干,称量脂肪质量。皮脂率(percentage of subcutaneous fat,SFP)和腹脂率(percentage of abdominal fat,AFP)分别按式(1)和(2)计算。

1.3.2 pH值的测定
参照高海燕等[14]的方法稍作修改,取新鲜麻鸭胸肌2 g,剪碎放入小烧杯中,立即加入18 mL蒸馏水,匀浆之后过滤,最后用pH计测定滤液的pH值,用前先校准。
1.3.3 蒸煮损失的测定
取新鲜麻鸭胸肌肉样品,修成4 cmh3 cmh1 cm[15],称质量(m1/g),放入在蒸煮袋中密封,然后80 ℃水浴至肉样中心温度达至75 ℃,保持20 min。取出蒸煮袋,用吸水纸吸干肉样表面水分,冷却至室温后再次称质量,记录质量(m2/g)。蒸煮损失按式(3)计算。每个样品重复3 次。
1.3.4 剪切力的测定
剪切力的测定参照Marino等[16]的方法,并稍作修改。取麻鸭胸肌新鲜肉样,去掉脂肪、筋键、肌膜后,沿肌纤维方向修成2 cmh1 cmh1 cm的肉柱,然后放入蒸煮袋中密封,80 ℃水浴锅内加热至肉中心温度75 ℃,取出样品冷却至室温,用嫩度仪测定每个肉柱的剪切力(kggf),每个样品重复5 次。1.3.5 相关基因表达量的测定
根据IMF测定的结果,选出IMF差异显著的两个日龄组180 日龄和360 日龄,每个日龄组挑选体质量位于同日龄组平均水平的麻鸭各5 只作为研究对象,放血屠宰后,迅速取其胸肌、肝脏和心肌,剔除组织表面明显的脂肪和结缔组织后置于液氮中速冻,再放入-80 ℃冰箱保存。
按顺序依次进行组织总RNA的抽提、定量、设计引物(表1)、总RNA的反转录(反应条件:37 ℃、15 min,85 ℃、5 s,4 ℃、∞;合成的cDNA产物放于-20 ℃保存备用)、PCR(PCR扩增条件:94 ℃预变性5 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,共30 个循环,72 ℃延伸10 min)以及实时荧光定量PCR实验(反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火和延伸45 s,共40 个循环,并采集荧光信号,检测各个基因的扩增变化情况,记录Ct值)。
表1 相关基因荧光定量PCR引物序列
Table1 Primer sequences used for real-time PCR

基因 引物序列 扩增长度/bp退火温度/℃CIDEa F 5’-TGCAAGAACACAGCACAAGC-3’ 156 60 R 5’-ACTAAGGCCCAAACGGGAAA-3’FAS F 5’-CAAGTCAAGAAGTTTGTCCGTTATC-3’ 165 60 R 5’-CAGGCTGCTTAGTAGGGTTCCA-3’ATGL F 5’-CCGTCCTCTCCTTGCCATAG-3’ 155 60 R 5’-CCTCCAGAAGAGCTTGGTTCA-3’β-actin F 5’-TGAGCGCAAGTACTCTGTCTG-3’ 163 60 R 5’-TCACAAGGGTGTGGGTGTTG-3’
采用Excel软件统计数据,用SAS 8.0 factorial ANOVA的Duncan’s Multiple RangeTest模型进行显著性分析,P<0.05表示差异显著。
表2 不同日龄绍兴麻鸭体内脂肪沉积的分布(n=5)
Table2 Lipid distribution and deposition in Shaoxing sheldrake ducks of different ages (n= 5)

注:同列肩标小写字母不同表示差异显著(P<0.05)。表4同。
日龄/d IMF/% SFP/% AFP/%90 1.69±0.10c 2.46±0.03c 3.02±0.11c 180 2.36±0.07b 3.81±0.14c 3.14±0.09c 270 2.93±0.11a 7.30±0.10b 3.33±0.13bc 360 3.00±0.07a 15.08±0.03a 4.20±0.12a
饲养日龄对麻鸭胸肌IMF、SFP和AFP的影响如表2所示。随着饲养日龄的增长,胸肌IMF、SFP和AFP均有不同程度的增长,其中绍兴麻鸭胸肌IMF显著增加(P<0.05),SFP在180 日龄后显著增加(P<0.05),360 日龄的麻鸭的SFP达到最大值。
表3 不同日龄绍兴麻鸭的不同组织的脂肪质量分数
Table3 Fat contents in different tissues from Shaoxing sheldrake ducks of different ages%

注:同行肩标小写字母不同表示差异显著(P<0.05)。
组织 日龄/d 90 180 270 360肝脏 9.57±0.18d 10.43±0.10c 11.18±0.11b 12.11±0.37a表皮 2.63±0.06d 4.86±0.02c 10.63±0.03b 17.07±0.01a胸肌 1.69±0.10c 2.36±0.07b 2.93±0.10a 3.00±0.07a
如表3所示,随着饲养日龄的增长,绍兴麻鸭不同组织中的脂肪质量分数均增加。其中肝脏组织中的脂肪质量分数在分析的所有日龄中都显著高于胸肌中的脂肪质量分数,而在90、180 日龄显著高于表皮的脂肪质量分数。在360 日龄时,表皮中脂肪质量分数达到最大值,均显著高于其他两个组织。
表4 日龄对绍兴麻鸭IMF及肉品理化指标的影响
Table4 Effect of age on intramuscular fat content and meat quality of Shaoxing sheldrake duck

日龄/d IMF/% pH 蒸煮损失率/%剪切力/(kggf)90 1.69±0.10a 5.68±0.12c 24.90±2.07ab 1.92±0.16b 180 2.36±0.07b 5.88±0.16bc 21.89±1.69b 1.93±0.14b 270 2.93±0.11c 6.43±0.16a 16.67±1.66c 2.00±0.13b 360 3.00±0.07c 6.45±0.14a 13.41±1.12d 2.84±0.12a
如表4所示,随着饲养日龄的增加,IMF显著增加(P<0.05)。肌肉的pH值和剪切力显著增加(P<0.05),蒸煮损失率显著下降(P<0.05)。结果显示,日龄与IMF呈正相关,IMF越低,pH值和剪切力越低,而蒸煮损失率越大。
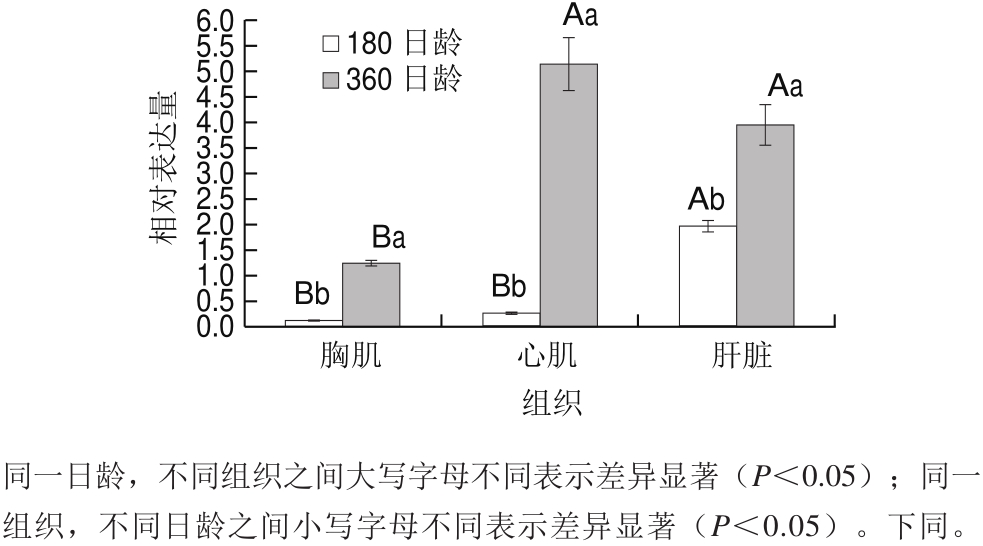
图1 CIDEa基因在180、360 日龄绍兴麻鸭的不同组织中的相对表达量
Fig.1 Relative expression levels of CIDEa gene in different tissues of sheldrake ducks at the age of 180 and 360 days
CIDEa基因在180 日龄和360 日龄麻鸭的胸肌、肝脏和心肌组织中的表达变化如图1所示。在180 日龄麻鸭的3 个组织中,CIDEa基因在肝脏中的相对表达量最高,在胸肌中相对表达量最低。在360 日龄的3 个组织中,在心肌中表达量最高,在胸肌中最低。而在同一组织中,CIDEa基因在不同日龄中mRNA表达量均差异显著(P<0.05),且360 日龄CIDEa基因表达量显著高于180 日龄。这表明日龄对CIDEa基因的表达具有显著影响。
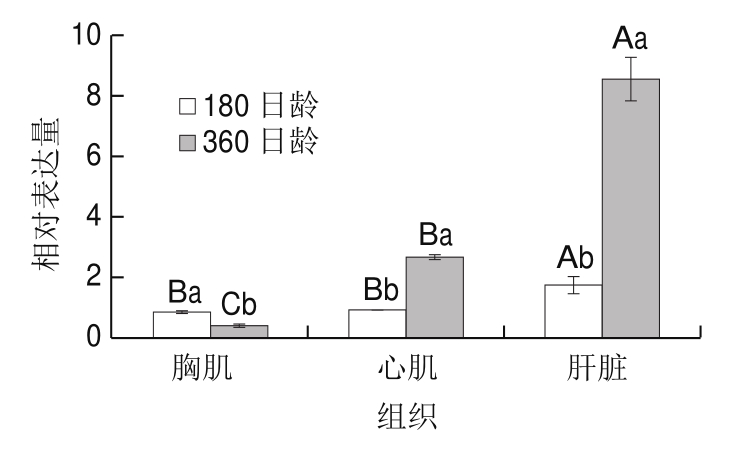
图2 FAS基因在180、360 日龄绍兴麻鸭的不同组织中的相对表达量
Fig.2 Relative expression levels of FAS gene in different tissues of sheldrake ducks at the age of 180 and 360 days
FAS基因在180 日龄和360 日龄麻鸭的胸肌、肝脏和心肌组织中的表达量如图2所示。在180 日龄麻鸭的胸肌、肝脏和心肌组织中,肝脏FAS基因的相对表达量显著高于胸肌和心肌(P<0.05)。360 日龄麻鸭在胸肌、肝脏和心肌组织中的FAS基因相对表达量差异显著(P<0.05),且在肝脏中表达量最高,在胸肌中最低。同一组织中FAS基因表达量与日龄的关系如下:在心肌和肝脏中,FAS基因表达量随日龄增加显著升高(P<0.05);在胸肌中,FAS基因表达量随着日龄的增加而显著降低(P<0.05)。
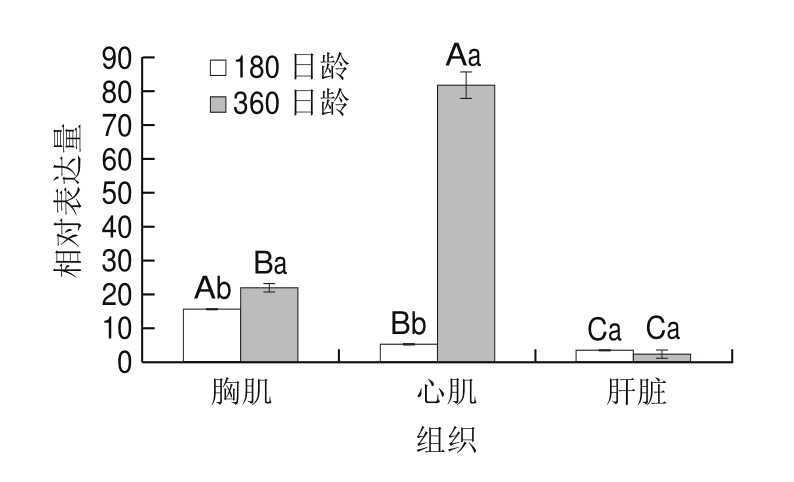
图3 ATGL基因在180、360 日龄绍兴麻鸭的不同组织中的相对表达量
Fig.3 Relative expression levels of ATGL gene in different tissues of sheldrake ducks at the age of 180 and 360 days
如图3所示,同一日龄下,在麻鸭的胸肌、肝脏和心肌组织中,ATGL基因的相对表达量差异显著(P<0.05)。180 日龄时,胸肌中ATGL基因的相对表达量显著高于肝脏和心肌;360 日龄麻鸭的ATGL基因的相对表达量则在心肌中最高。同一组织中ATGL基因相对表达量与日龄的关系如下:在心肌和胸肌中,ATGL基因表达量随日龄增加升高,其中心肌中的表达量升高最快(P<0.05);在肝脏中日龄对ATGL基因表达量没有显著影响。基因表达量的结果暗示360 日龄心肌中脂肪分解活动显著高于180 日龄。
本实验研究了绍兴麻鸭的日龄对其体内脂肪沉积的影响以及IMF对肉质的影响。结果显示,麻鸭的3 个组织中的肪含量差异显著,在分析的所有日龄中,肝脏中的脂肪质量分数始终高于胸肌,在前期高于表皮,360 日龄时则低于表皮。而日龄对IMF、SFP、APF有显著影响。在4 个日龄中,90 日龄麻鸭胸肌的IMF、SFP、APF都最低,而360 日龄麻鸭胸肌的IMF、SFP、APF显著高于其他3 个日龄。脂肪质量分数都是随着日龄增长而变大。这可能是因为麻鸭处在不同生长发育阶段脂肪代谢存在差异引起的[17]。随着饲养日龄增加,麻鸭日渐成熟,肝脏发育完全,脂肪合成能力增强,同时其体内新陈代谢速率逐渐变缓,因此麻鸭体内脂肪沉积的量会逐渐增大。IMF是评价肉质的诸多指标中关键的一个指标,与肌肉pH值、蒸煮损失率、滴水损失及剪切力密切相关[18]。Chartrin等[19]研究表明,鸭胸IMF从1.7%增加到8.5%时,L*值、b*值、蒸煮损失率、嫩度都有所增加。嫩度和保水性是评价肉质的重要指标,通常用剪切力和蒸煮损失率分别表示肉的嫩度和保水性。本实验结果显示:饲养日龄对这些指标有显著影响,IMF随日龄增加而增加,随着IMF的升高,肌肉的pH值和剪切力均呈现升高的趋势,蒸煮损失则降低。
Li等[20]报道,CIDEa基因在猪体内11 个组织中普遍表达,且表达量存在较大差异:CIDEa基因在肾脏和淋巴组织中有中等水平表达量,而在肝脏、脾脏、心脏、肺、大脑、小肠、胃、肌肉中的表达量很低。在野生型小鼠体内,CIDEa基因高表达于褐色脂肪组织中,少量表达于白色脂肪组织中[21-22]。在人类组织中,CIDEa基因大量存在于褐色和白色脂肪组织中[9]。黄柳梅[23]报道CIDEa基因在肉鸡的20 个组织中广泛表达,且表达丰度相差较大,在脂肪组织中的表达量最高,其次是在肾脏、肝脏和卵巢有中等水平的表达量,在心脏、脾脏、肺、胸肌、腿肌等中的表达量很微弱。这些报道都说明了CIDEa基因在不同物种中的组织表达模式存在差异,且具有组织特异性,而本实验结果表明CIDEa基因在同一日龄麻鸭的不同组织中,表达具有明显的组织特异性,且在脂滴含量丰富的组织中表达量较高,这与以上报道相一致。但与前面的研究相比,CIDEa基因在360 日龄的心肌中表达出现了很大的差异,这可能是本实验研究的物种(麻鸭)和日龄不同的缘故所致。同时,黄柳梅[23]还报道了在不同部位的脂肪组织中,随着肉鸡日龄的增大,CIDEa基因的相对表达量也随之增大。这与本实验的结果相符。CIDEa蛋白定位于脂滴表面及内质网上[24-25]和细胞核内[26],可促进野生型小鼠体内的脂肪扩张与沉积[9],调节褐色脂肪组织中的解偶联蛋白Ucp1的活性,在CIDEa基因敲除小鼠中,CIDEa抑制Ucp1的作用缺失,从而导致Ucp1的解偶联活性显著升高,最终导致能量代谢水平的显著提高,从而调节脂肪代谢[21]。在CIDEa基因敲除小鼠中,AMPK蛋白水平及酶活性升高,促进脂肪酸的β氧化[24]。在敲除了CIDEa基因后,小鼠表现出更高的基础代谢率,能量代谢速度加快,脂肪分解速度加快,大脂滴减少而小脂滴增加,体内脂肪积累减少,体质量减轻,表现为瘦的表型[12,21]。上述报道都说明CIDEa基因对脂肪的沉积有积极作用。而本实验的结果也证明了CIDEa对脂肪的沉积有积极作用。
动物体内脂肪沉积需要大量的脂肪酸,而这些脂肪酸大多是丙二酸单酰辅酶A和乙酰辅酶A在FAS的催化作用下合成的[27]。FAS表达水平的升高能够显著地增加甘油三脂在体内的沉积而导致肥胖[6]。鲁凯[28]的研究发现FAS基因在北京鸭与黑鹜鸭的肝脏中的相对表达量在同一周龄下表现出差异,但是都是16 周龄高于8 周龄的表达量。这表明FAS基因的表达不仅与物种相关,还随饲养日龄的变化而有所改变。而吕刚[29]的研究同样发现,不管是限饲还是自由觅食,FAS基因相对表达量在肉鸭肝脏中都随日龄的增加而增加。对哺乳动物的研究表明,FAS活力或基因表达与动物体脂沉积关系密切[30-31]。肝脏中酶蛋白含量受该酶基因表达的调控,肝脏中FAS基因的表达状况一定程度上反映了FAS含量的多寡,从而影响肝脏合成脂肪酸的能力的大小。本实验研究了心脏、肝脏、胸肌中FAS基因的相对表达量,发现FAS基因表达具有明显的组织特异性,在心肌和肝脏中,FAS基因表达量随日龄增加而显著升高(P<0.05),这与上述报道相符。但在胸肌中,FAS基因的表达量则随日龄升高显著降低(P<0.05)。
Nie Qinghua等[32]在研究ATGL基因在鹦鹉、鹌鹑、鸭这3 种禽鸟组织中的表达时发现,ATGL基因主要在鹦鹉、鹌鹑的胸肌和腿肌表达;在鸭的腹部脂肪、皮下脂肪中有最高表达量,在心脏、脾脏、胸肌和腿肌中也有较高的表达量。Zimmermann等[8]研究显示ATGL基因在在小鼠脂肪组织中表达量最高,在骨骼肌、心肌和睾丸中次之,在肾脏、肺、脾脏、脑和肝脏等组织中也有低水平的表达;王宝维等[33]研究发现ATGL基因在鹅的脾脏、肝脏、腹部脂肪、皮下脂肪中表达量较高,其次在腿肌、胸肌、肾脏和心脏中有少量表达,在肺、腺胃和肌胃中几乎不表达。以上研究可看出在正常生理条件下,ATGL基因广泛在动物的各组织器官中表达,并且物种和组织对其表达量都有影响。本实验研究的ATGL基因在3 个组织中的表达量也都差异显著,与上述报道相符。在胸肌和心肌中,ATGL表达量均随日龄增加而升高。本实验中无论是180 日龄还是360 日龄,ATGL基因在肝脏中的表达量均显著低于胸肌和心脏(P<0.05),对于这一异常现象,除了物种和日龄的原因,其他原因还有待进一步探究。
动物脂肪沉积是机体内脂肪合成与分解的共同结果。CIDEa基因对脂肪沉积有积极作用,FAS基因和ATGL基因分别调控脂肪的合成与分解。本实验中麻鸭肝脏组织和胸肌中,CIDEa基因表达量随着日龄增加显著升高,FAS基因与ATGL基因表达量在不同组织中随日龄变化趋势不一致。最终结果显示脂肪质量分数随日龄增加而升高。这说明随着日龄增加,麻鸭体内脂肪合成代谢比脂肪分解代谢更加活跃。
本实验测定了麻鸭脂肪质量分数和肉质理化指标,探讨了CIDEa、FAS和ATGL基因的表达量与麻鸭脂肪沉积的关系。结果显示:日龄对麻鸭脂肪质量分数的影响显著,随着日龄增加,IMF、肌肉的pH值和剪切力均呈现升高的趋势,蒸煮损失率则降低;CIDEa、FAS和ATGL基因的表达均具有组织特异性,但在不同组织中随日龄变化的趋势不一致。脂肪代谢是一个复杂的动态平衡过程,脂肪沉积是其综合作用的结果,最终结果显示脂肪质量分数随日龄增加而升高。这说明随着日龄增加,麻鸭体内脂肪合成代谢比脂肪分解代谢更加活跃。
[1] WOOD J D, ENSER M, FISHER A V, et al. Fat deposition, fatty acid composition and meat quality: a review[J]. Meat Science, 2008, 78(4):343-358.doi:10.1016/j.meatsci.2007.07.019.
[2] 杨烨. 优质鸡肌内脂肪代谢调控及其与肉质性状关系的研究[D]. 北京: 中国农业科学院研究生院, 2005: 16-35.
[3] SIMON J, LECLERCQ B. Longitudinal study of adiposity in chickens selected for high or low abdominal fat content: further evidence of a glucose-insulin imbalance in the fat line[J]. The Journal of Nutrition,1982, 112(10): 1961-1973.
[4] MCGARRY J D. The mitochondrial carnitine palmitoyltransferase system: its broadening role in fuel homoeostasis and new insights into its molecular features[J]. Biochemical Society Transactions, 1995,23(2): 321-324.
[5] 张力莉, 徐晓锋. 动物脂肪酸合成酶基因表达调控的研究进展[J].畜牧与兽医, 2012, 44(4): 101-103.
[6] SEMENKOVICH C F. Regulation of fatty acid synthase (FAS)[J].Progress in Lipid Research, 1997, 36(1): 43-53.
[7] MARCELIN G, LIU S M, LI X, et al. Genetic control of ATGL-mediated lipolysis modulates adipose triglyceride stores in leptindeficient mice[J]. Journal of Lipid Research, 2012, 53(5): 964-972.doi:10.1194/jlr.M022467.
[8] ZIMMERMANN R, STRAUSS J G, HAEMMERLE G, et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase[J]. Science, 2004, 306: 1383-1386.doi: 10.1126/science.1100747.
[9] ABREU-VIEIRA G, FISCHER A W, MATTSSON C, et al. Cidea improves the metabolic prof i le through expansion of adipose tissue[J].Nature Communications, 2015, 6: 7433.doi:10.1038/ncomms8433.
[10] 李红强, 李海玉, 李婧实, 等. CIDEC的亚细胞定位及其功能初步研究[J]. 核农学报, 2017, 31(8): 1494-1499.doi:10.11869/j.issn.100-8551.2017.08.1494.
[11] CHEN Z, GUO K, TOH S Y, et al. Mitochondria localization and dimerization are required for CIDE-B to induce apoptosis[J]. Journal of Biological Chemistry, 2000, 275(30): 22619-22622.doi:10.1074/jbc.C000207200.
[12] MONTASTIER E, DÉJEAN S, LE GALL C, et al. Adipose tissue CIDEA is associated, independently of weight variation, to change in insulin resistance during a longitudinal weight control dietary program in obese individuals[J]. PLoS ONE, 2014, 9(7): e98707.doi:10.1371/journal.pone.0098707.
[13] FOLCH J, LEES M, SLOANE-STANLEY G H. A simple method for the isolation and purification of total lipids from animal tissues[J].Journal of Biological Chemistry, 1957, 226(1): 497-509.
[14] 高海燕, 张瑞瑶, 贾甜, 等. 不同嫩化方法对鹅肉品质的影响[J].食品科学, 2017, 38(7): 182-186.doi:10.7506/spkx1002-6630-201707029.
[15] MELODY J L, LONERGAN S M, ROWE L J, et al. Early postmortem biochemical factors inf l uence tenderness and water-holding capacity of three porcine muscles[J]. Journal of Animal Science, 2004, 82(4):1195-1205.doi:10.2527/2004.8241195x.
[16] MARINO R, ALBENZIO M, DELLA MALVA A, et al. Proteolytic pattern of myof i brillar protein and meat tenderness as affected by breed and aging time[J]. Meat Science, 2013, 95(2): 281-287.doi:10.1061/j.meatsci.2013.04.009.
[17] 付睿琦. 利用蛋白质组学技术研究北京油鸡肌肉发育和肌内脂肪沉积的分子机制[D]. 北京: 中国农业科学院, 2013: 12-47.
[18] HOCQUETTE J F, GONDRET F, BAÉZA E, et al. Intramuscular fat content in meat-producing animals: development, genetic and nutritional control, and identif i cation of putative markers[J]. Animal,2010, 4(2): 303-319.doi:10.1017/S1751731109991091.
[19] CHARTRIN P, METEAU K, JUIN H, et al. Effects of intramuscular fat levels on sensory characteristics of duck breast meat[J]. Poultry Science, 2006, 85(5): 914-922.doi:10.1093/ps/85.5.914.
[20] LI Y H, LEI T, CHEN X D, et al. Molecular cloning, chromosomal location and expression pattern of porcine CIDEa and CIDEc[J].Molecular Biology Reports, 2009, 36(3): 575-582.doi:10.1007/s11033-008-9216-5.
[21] ZHOU Z, TOH S Y, CHEN Z, et al. Cidea-def i cient mice have lean phenotype and are resistant to obesity[J]. Nature genetics, 2003, 35(1):49-56.doi:10.1038/ng1225.
[22] XU L, ZHOU L, LI P. CIDE proteins and lipid metabolism[J].Arteriosclerosis Thrombosis & Vascular Biology, 2012, 32(5): 1094-1098.doi:10.1161/ATVBAHA.111.241489.
[23] 黄柳梅. CIDEa和CIDEc基因在肉鸡中的表达分析[D]. 南昌: 江西农业大学, 2016: 11-18.
[24] QI J Z, GONG J Y, ZHAO T J, et al. Downregulation of AMP-activated protein kinase by Cidea-mediated ubiquitination and degradation in brown adipose tissue[J]. The EMBO Journal, 2008,27(11): 1537-1548.doi:10.1038/emboj.2008.92.
[25] BOSTRÖM P, ANDERSSON L, RUTBERG M, et al. SNARE proteins mediate fusion between cytosolic lipid droplets and are implicated in insulin sensitivity[J]. Nature Cell Biology, 2007, 9(11): 1286-1293.doi:10.1038/ncb1648.
[26] WANG W S, LÜ N, ZHANG S S, et al. Cidea is an essential transcriptional coactivator regulating mammary gland secretion of milk lipids[J]. Nature Medicine, 2012, 18(2): 235-243.doi:10.1038/nm.2614.
[27] SMITH S, WITKOWSKI A, JOSHI A K. Structural and functional organization of the animal fatty acid synthase[J]. Progress in Lipid Research, 2003, 42(4): 289-317.doi:10.1016/S0163-7827(02)00067-X.
[28] 鲁凯. 北京鸭与黑鹜鸭屠宰性状及脂质沉积相关基因表达差异研究[D]. 雅安: 四川农业大学, 2013: 13-41.
[29] 吕刚. 不同饲喂方式下肉鸭体脂沉积规律及机制研究 [D]. 雅安: 四川农业大学, 2011: 53-115.
[30] 熊文中, 杨凤, 周安国. 猪重组生长激素对不同杂交肥育猪脂肪代谢调控的研究[J]. 畜牧兽医学报, 2001, 32(1): 1-4.
[31] 单体中, 汪以真, 刘建新, 等. 不同日龄猪腹脂中脂肪酸合成酶(FAS)基因表达规律的研究[J]. 畜牧兽医学报, 2006, 37(7): 662-666.
[32] NIE Qinghua, HU Yongsheng, XIE Liang, et al. Identification and characterization of adipose triglyceride lipase (ATGL) gene in birds[J].Molecular Biology Reports, 2010, 37(7): 3487-3493.doi:10.1007/s11033-009-9941-4.
[33] 王宝维, 孔敏, 葛文华, 等. 鹅脂肪甘油三酯脂肪酶和长链脂酰辅酶A合成酶1基因表达差异及其对脂肪沉积和血清脂类代谢的调控[J]. 动物营养学报, 2016, 28(7): 2079-2089.doi:10.3969/j.issn.1006-267x.2016.07.012.
Fat Deposition and Related Gene Expression in Sheldrake Duck of Different Ages