
传统大豆油脂的制取方式主要是采用机械压榨法和溶剂浸出法,其中多数为溶剂浸出法,但是随着研究的进行,人们发现了一种绿色、环保的新技术——水酶法/生物酶法。生物解离提取技术是一种同时从油料种子中提取油脂和蛋白质的方法,该方法所得的产品品质高,极适合人类食用。虽然生物解离有诸多优点,但是由于酶解处理时间长(通常在2~3 h),酶处理后干燥过程的成本比较高,所以生物解离技术的应用还存在一定的限制。并且在生物解离提油过程中会出现不可避免的乳化现象,大部分大豆油脂残留在由大豆蛋白和油脂构成的乳状液体系中[1],导致其包裹的油脂难以从由蛋白与油脂紧密结合形成的稳定乳状液中被释放分离,因而限制了油脂的提取率[2]。因此,如何采用高效、绿色、安全的破乳方法将乳状液中的油脂释放出来成为提高生物解离油脂提取率的一个重要环节。
热处理破乳法通过增加分子的热运动使乳状液中的微油脂颗粒聚结,此外,由于温度升高时乳状液黏度降低,进一步降低了乳状液的稳定性,并达到破乳目的。Chabrand等[3]的研究表明,在生物解离提取大豆油脂的过程中所形成的乳状液表面吸附蛋白含量为(11.40±0.35)mg/m2。相比于水剂法提取技术中形成的乳状液吸附蛋白含量(14.65 mg/m2)有所降低[4]。王文睿等[5]采用水浴和油浴加热破乳的工艺,优化了工艺参数,在加热温度为120 ℃、加热时间为15 min时,其优化的破乳率为90.76%。此外,Campbell等[2]也对乳状液进行了加热破乳研究,其将乳状液在95 ℃下加热30 min,也达到了初步破乳的效果。近年来,许多学者对乳状液的破乳技术进行了研究,但对乳状液结构特征的研究并不透彻。
因此,本研究在用不同温度热处理大豆乳状液中,通过ζ-电位、粒径分布、显微观察分析乳状液的稳定性,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、傅里叶变换红外光谱、荧光光谱分析蛋白质变化,明确不同热处理温度大豆乳状液结构与稳定性之间的构效关系,探究乳状液体系中各组分的分子间作用力和组成以及空间构象。从而开发新型、高效的破乳技术,为生物解离提取大豆油脂产业化提供理论参考及应用指导。
大豆 东北农业大学大豆研究所;Protex 6L碱性蛋白酶 杰能科生物工程有限公司;SDS、β-巯基乙醇、磷酸氢二钠、磷酸二氢钠盐酸、考马斯亮蓝G-250、牛血清白蛋白、氢氧化钠、丙酮、无水乙醇等试剂均为国产分析纯。
FW100型高速万能粉碎机 绍兴科宏仪器有限公司;挤压膨化机 东北农业大学;LGJ-1冷冻干燥机上海医用离心机厂;GL-21M高速冷冻离心机 上海市离心机械研究所;Zetasizer Nano ZS90纳米粒度电位仪、Mastersizer 2000粒度仪 英国马尔文仪器有限公司;TCS SP2型激光共聚焦显微镜 德国Leica公司;TNZ1-5700傅里叶变换红外光谱仪 美国Thermo Fisher公司;F2000荧光光谱仪 日本日立公司。
1.3.1 生物解离大豆乳状液的制备
参照齐宝坤[6]的方法并适当修改。大豆粉碎后挤压膨化预处理,得到膨化大豆粉。膨化大豆粉与水混合(料液比1∶6),加入Protex6L碱性蛋白酶,搅拌均匀后在60 ℃水浴锅中保持恒温加热,用2 mol/L NaOH溶液调节pH值至9.0,酶解3 h后取出,于100 ℃沸水中灭酶10 min,在4 500 r/min下离心20 min,吸取游离油,将其余液体部分倒入分液漏斗,静置24 h分层,将乳状液分离。
1.3.2 乳状液的热处理
称取20 g酶解后的原始乳状液,分别在不同的温度条件(55、65、75、85、95 ℃)下加热1 h,然后在3 585 r/min离心10 min,分离乳状液和水相。
1.3.3 乳状液分层系数和游离油得率的测定
取8 mL处理后的乳状液于离心管中,在4 ℃贮藏24 h,乳状液发生分层现象,上相浑浊、下相澄清。分层系数、游离油得率的计算分别见公式(1)、(2)。

1.3.4 乳状液粒径及ζ-电位的测定
采用激光光散射粒度仪测定乳状液体积平均粒径(D4,3)和表面积平均粒径(D3,2),将小部分乳状液分散在50 mL蒸馏水中,保持粒径数值在测定范围内,大豆油滴的折射指数(refractive index,RI)为1.470,分散剂的RI为1.333。
采用Zetasizer Nano ZS90纳米粒度电位仪测定乳状液溶液的ζ-电位。用0.05 mol/L pH 7.0的磷酸盐缓冲液将大豆乳状液样品稀释至质量分数为0.2%的溶液后进行测定,上样体积1 mL,测定温度25 ℃。每个样品重复测量3 次。
1.3.5 乳状液激光共聚焦显微镜观察
采用Ar/K和He/Ne双通道激光模式,激发光的波长分别是488 nm和633 nm。分别将0.01 mg/mL尼罗红和0.01 mg/mL尼罗蓝溶解在异丙醇中,制成染色液。取1 mL乳状液样品,分别加入400 μL 0.01 mg/mL尼罗红染色液和尼罗蓝染色液,混合均匀后染色20 min,取1 滴染色后的乳状液样品置于带凹槽的载玻片上,盖上盖玻片并用甘油密封。采用油镜进行图像的采集,分辨率为1 024h1 024,图像采集的范围为5~45 μm。
1.3.6 乳状液流变的测定
采用流变仪测定乳状液的流变学变化。剪切速率为5 s-1,升温速率为5 ℃/min,观察此时乳状液的黏度随温度的变化规律。在25 ℃下,采用流变仪观察黏度随剪切速率的变化规律。在线性黏弹区域内,测定乳状液样品的弹性模量G′随振荡频率的变化规律。选择平行板测试系统,其平行板的间距为1 mm,直径为40 mm[7]。
1.3.7 乳状液中蛋白质的提取
乳状液水相中蛋白质提取采用丙酮沉淀法[8],用冰丙酮按照20 g/L在-18 ℃下反应2 h,4 ℃ 12 000hg离心分离15 min,除去上清液,将沉淀继续用冷丙酮洗涤4~5 次,直到溶剂由黄色变成无色,沉淀中溶剂挥发后冻干得到蛋白,放入4 ℃冰箱备用。
1.3.8 SDS-PAGE分析
乳状液的处理参照文献[9]的方法,分离胶的质量分数为12%,浓缩胶的质量分数为4%,上样质量浓度1 mg/mL,上样量为10 μL,上样前将样品先在95 ℃下加热5 min。初始电流为10 mA,样品进入分离胶后改为20 mA。分离后先染色再脱色。
1.3.9 表面疏水性的测定
依据Laemmli[10]的方法,采用8-苯胺基-1-萘磺酸铵盐(8-anilino-1-naphthalenesulfonic acid ammonium salt,ANS)荧光探针法。称取0.025 g不同处理方式下的蛋白样品溶于50 mL磷酸盐缓冲液中,配成pH 7、0.01 mol/L的溶液,将溶液在室温下搅拌混合1 h,然后在10 000hg下离心30 min,取上清液采用Lowry法测定其蛋白质浓度,并用上述磷酸盐缓冲液依次稀释后,使其浓度在0.005~0.500 mol/mL之间。取不同浓度样品溶液4 mL,分别加入40 μL浓度为8 mmol/L的ANS溶液,经振荡混合后静置5 min,再测定样品的荧光强度。实验中激发波长为370 nm,发射波长为490 nm,夹缝宽度为5 nm。对荧光强度和蛋白质浓度作图,初始段斜率即为蛋白质分子的表面疏水性指数。
1.3.10 傅里叶变换红外光谱分析
将样品粉碎后过100 目筛,粉末在40 ℃烘箱中烘干12 h,然后在红外灯下进行研磨处理。称取约2 mg待测样品,加入200 mg溴化钾,在玛瑙研钵中研磨15 min,随后进行压片处理,压片机在14 kg压力下约保持1 min,然后将制得的均匀透明薄片放入傅里叶变换红外光谱仪中进行测定。测定的条件为:扫描范围400~4 000 cm-1,分辨率为4 cm-1,扫描信号累加64 次。每个样品重复3 次。
谱图的分析处理采用Peakfit软件,在酰胺I带(1 600~1 700 cm-1)进行两点基线校正,然后再采用Savitsk-Go1ay函数进行平滑处理,求二阶导数,并采用Gauss峰形进行拟合,估算出子峰的个数与位置,经过手动调整各子峰的峰高和半峰宽进行多次拟合使得残差最小,确定各子峰与各二级结构的对应关系后,根据其积分面积计算出4 种二级结构的含量。
1.3.11 荧光光谱分析
依据尹寿伟[11]的方法,采用F2000荧光光谱议测定乳状液分离出的大豆蛋白的色氨酸荧光光谱。将大豆蛋白样品分别分散于0.01 mol/L、pH 7.0的磷酸盐缓冲液中,配制蛋白质量浓度为0.15 mg/mL的溶液。荧光发散光谱分析以蛋白质分子内部的色氨酸荧光基团为探针,为了降低酪氨酸的贡献,荧光光谱的激发波长为290 nm,光谱的扫描范围为300~400 nm,激发与发射狭缝的宽度均为5 nm。
为保证实验数据的准确性,每组实验都进行3 次平行,并将实验数据进行误差分析。采用SPSS 18软件进行单因素方差分析,P<0.05表示差异显著。采用Origin 8.5软件绘图。
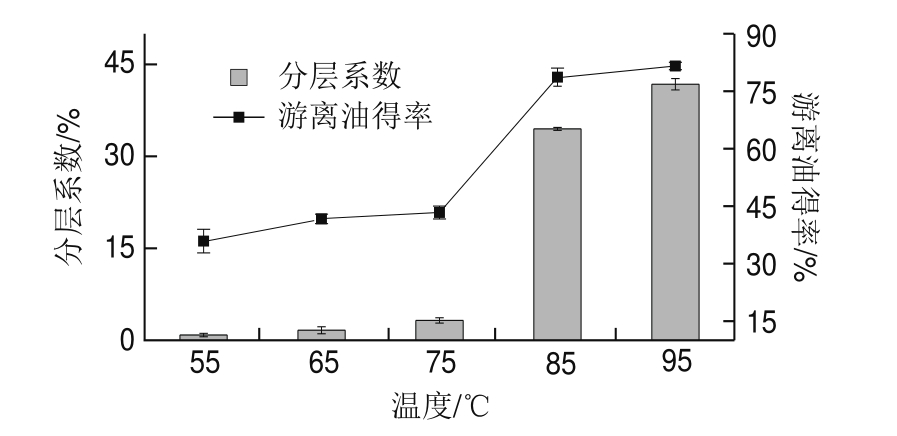
图1 不同温度下乳状液的分层系数和游离油得率
Fig.1 Creaming index and free oil yield of the emulsion treated at different temperatures
如图1所示,随着热处理温度的升高,分层系数和游离油得率呈增加趋势。当热处理温度为85 ℃以上时,分层系数和游离油得率明显增加。加热温度为95 ℃时,分层系数和游离油得率达到最大,分别为42%和81%左右。大豆乳状液的失稳是热不稳定蛋白质受热变性引起油滴聚集导致的。大豆中的蛋白质对乳状液的稳定起着重要的作用,高温加热能够使蛋白质变性。Kwon等[12]的研究表明,大豆乳状液中蛋白质在80 ℃以上会发生变性和凝聚。乳状液中蛋白质发生热变性会使油滴表面电荷降低,具有低表面电荷的油滴相互靠近导致乳状液分层,油滴聚集形成大油滴。由于聚集形成大油滴和施加的外力离心力的作用,会使乳状液破乳,导致相分离形成油层和水层[13]。因此,热处理温度超过85 ℃时会使大多数蛋白质变性,导致乳状液破乳并释放出油脂。
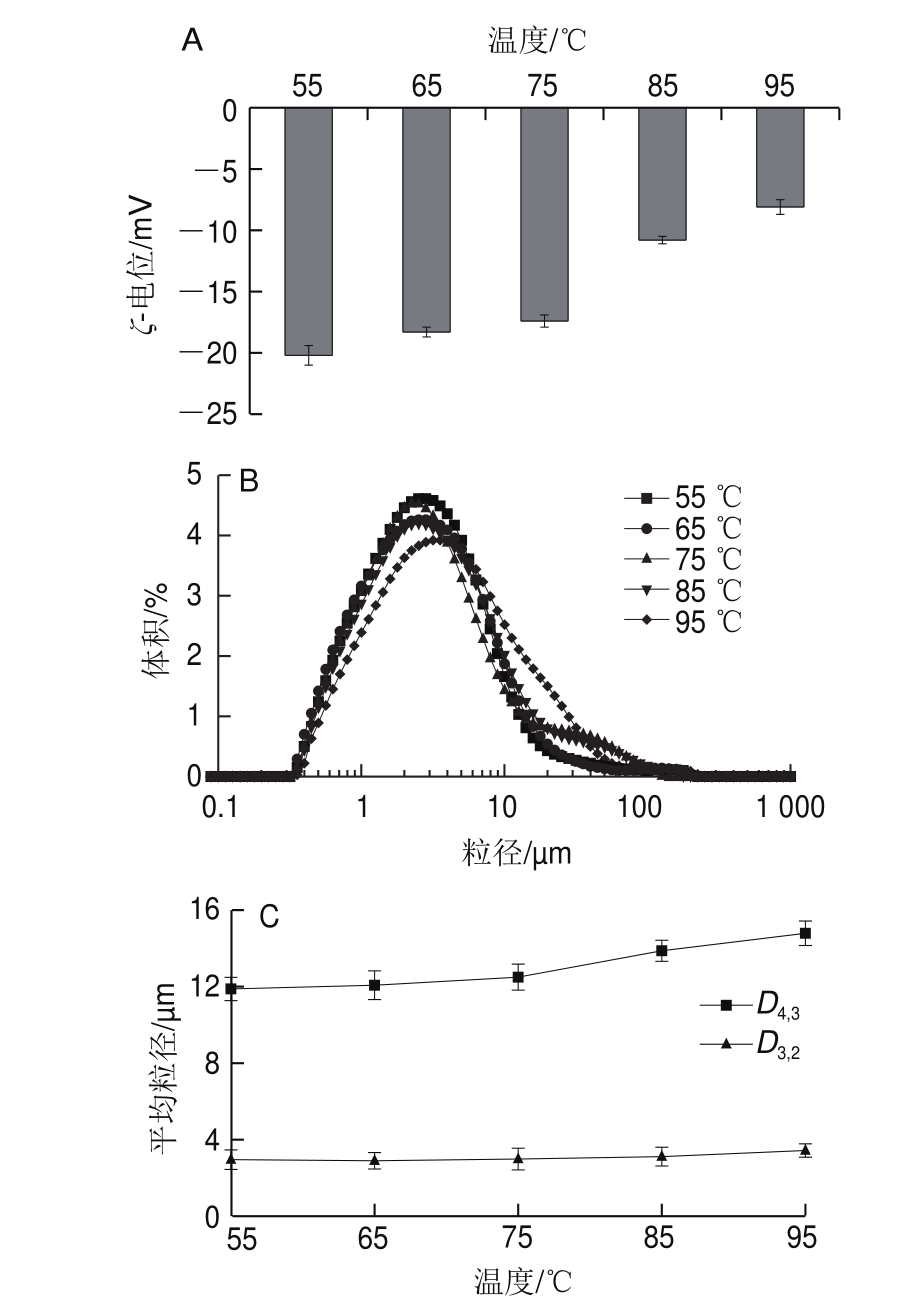
图2 不同热处理温度下乳状液ζ-电位(A)、粒度分布(B)与平均粒径(C)的变化
Fig.2 Zeta potential (A), particle size distribution (B) and average particle size (C) of the emulsion treated at different temperatures
如图2所示,乳状液ζ-电位在75 ℃以下时没有明显变化,粒度分布呈单峰,主要分布在0.5~100 μm。当加热到85 ℃时,乳状液ζ-电位明显增加,在10~100 μm范围分布的液滴明显增多。95 ℃热处理乳状液ζ-电位最大,粒度分布峰向大粒径方向移动,并且在大于100 μm的粒径区域也有少量的分布,平均粒径达到最大,其D4,3值为(14.79±0.64)μm,并且发生絮凝作用,导致乳状液稳定性降低,而D3,2值变化不明显。ζ-电位的变化表明乳状液周围界面层的组成和结构发生了一些改变[14]。一般来说,球蛋白稳定的乳状液易受热处理温度等不稳定因素的影响,大多数球蛋白容易发生热诱导变性[15]。此外,高温还会破坏乳状液界面层的组成和结构,使油脂体表面电荷减少,液滴之间的静电相互作用增大。通过静电相互作用产生的吸引力能够引起液滴的凝沉和聚集,导致乳状液粒径增大。然而,Chiang等[16]发现其他植物来源的天然或人造乳状液具有较好的热稳定性,这表明对球蛋白稳定油滴形成的乳状液进行热处理后,不会引起乳状液表面性质的显著改变。Nikiforidis等[17]对玉米胚芽乳状液的热稳定性研究结果与本研究不同,他发现对玉米胚芽乳状液进行热处理后其粒径变化不显著,这可能与热处理温度低于70 ℃有关。本研究的热处理温度设置在55~95 ℃,当加热到85 ℃和95 ℃时,温度高于油脂体蛋白的变性温度(60~75 ℃),乳状液ζ-电位与D4,3值才发生显著变化,破坏了界面层的组成和结构,使油脂体表面电荷急剧减少,导致乳状液稳定性降低。
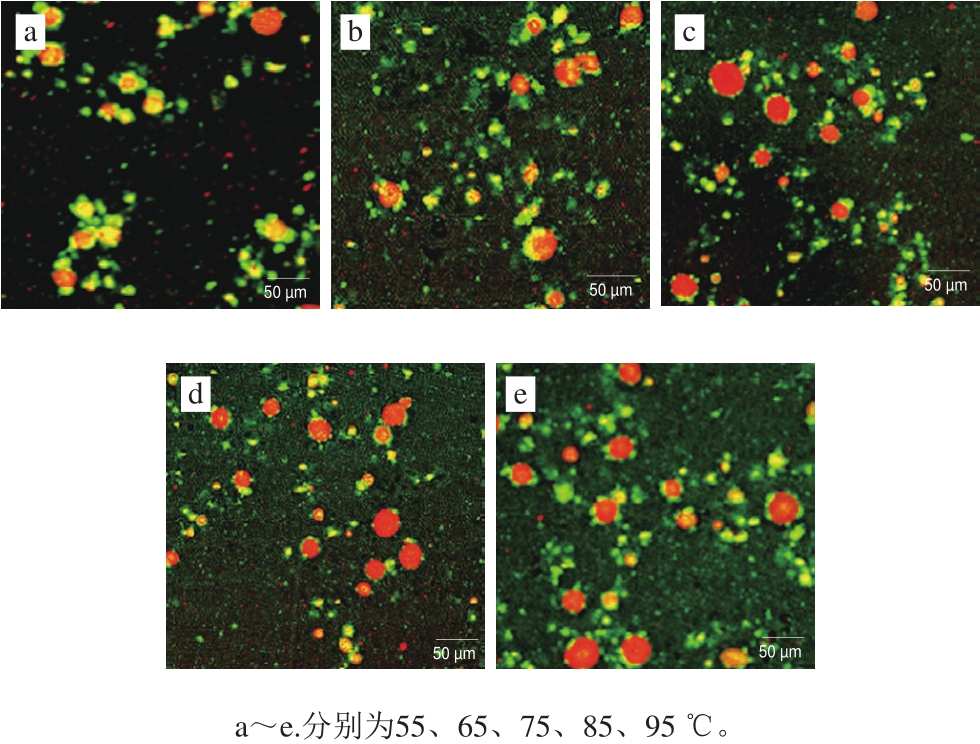
图3 不同热处理温度下乳状液的激光共聚焦显微镜观察结果
Fig.3 Confocal laser scanning microscopic images of the emulsion treated at different temperatures
乳状液的液滴分布、形态以及微观结构变化可以直接由激光共聚焦显微镜观察。从图3中可以看出红色的油相和绿色的蛋白相的分布情况,热处理温度对乳状液的微观结构具有显著影响。当热处理温度为55~75 ℃时没有破坏乳状液的稳定结构,油滴尺寸和分布情况没有显著改变;当热处理温度达到85~95 ℃时,油滴尺寸明显增加,出现了更多的大油滴,且部分蛋白质受热形成聚集体,这说明高温破坏了乳状液的稳定结构,导致小油滴聚集形成大油滴。这可能与蛋白质的变性温度有关,加热温度达到85 ℃以上后,能够使乳状液中大部分蛋白质变性,从而使蛋白质失去原有的乳化能力,破坏了乳状液的稳定结构,导致油滴聚集。因此,对乳状液进行85 ℃以上的热处理可以有效破坏乳状液的稳定体系,进而达到回收油脂的目的。
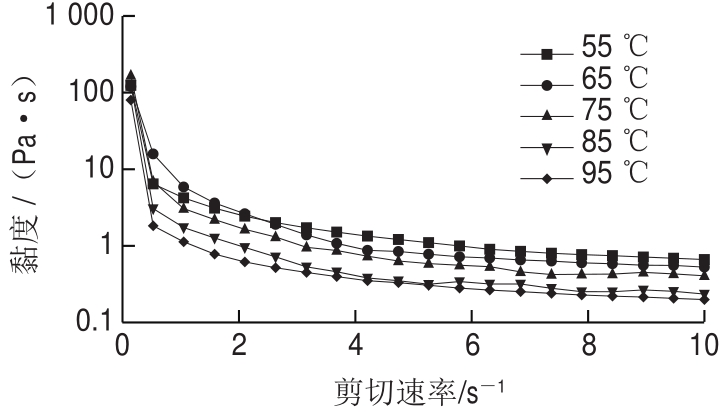
图4 不同温度下乳状液黏度与剪切速率的关系
Fig.4 Correlation between viscosity and shear rate of the emulsion treated at different temperatures
由图4可知,随着剪切速率的增加,所有热处理温度条件下乳状液的黏度逐渐降低,最终达到平衡,表现为剪切变稀的性质,为典型的假塑性流体。在低剪切速率下,乳状液黏度急剧下降;在高剪切速率下,乳状液黏度几乎没有变化,这与原始乳状液的变化趋势(未在图中显示)相似。热处理温度为55 ℃的乳状液黏度随着剪切速率的增加下降得最慢,且最终黏度最大。随着热处理温度的升高,乳状液黏度下降速率逐渐加快,且最终黏度也逐渐降低,表明剪切变稀行为加剧。在热处理温度为55~75 ℃时这种变化不明显,而当热处理温度升高到85 ℃和95 ℃时,乳状液黏度下降速率明显增加,最终黏度明显下降。这说明高温处理导致乳状液剪切变稀行为加剧,降低了乳状液的黏度,乳状液黏度的降低促进了液滴的移动,使小液滴易于聚集成大液滴,导致乳状液稳定性下降[18]。此外,这也可能与超过85 ℃的高温处理促使乳状液中蛋白质变性有关。因此,对乳状液进行高温处理可以达到破乳的目的。
2.5.1 不同热处理温度下乳状液表面疏水性分析
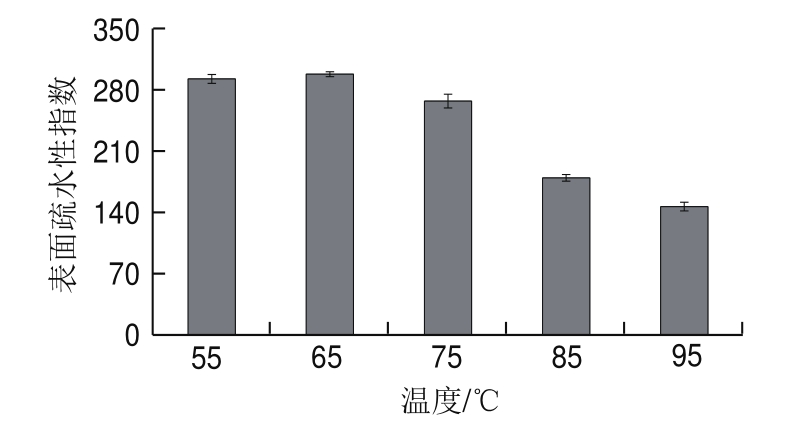
图5 不同热处理温度下乳状液中蛋白质的表面疏水性
Fig.5 Surface hydrophobicity of the emulsion treated at different temperatures
蛋白质分子重要的表观特征之一就是疏水性,蛋白质表面疏水基团的变化可以由表面疏水性反映,这也是反映蛋白质分子结构变化的一个重要指标。蛋白质多肽链的展开、亚基的解离等都可以导致其表面疏水性的增加,而蛋白质聚集形成的可溶性或不可溶性聚集体会导致其表面疏水性的降低。如图5所示,热处理会使乳状液中蛋白质的表面疏水性降低。热处理温度由55 ℃升高到95 ℃,乳状液中蛋白质的表面疏水性指数由(292.40±5.06)降低至(146.60±4.95)。Sorgentini等[19]对热处理过程中大豆分离蛋白表面疏水性进行研究,发现热处理会使蛋白质多肽链的分子结构伸展,暴露出埋藏在蛋白质内部的疏水基团,导致蛋白质表面疏水性升高,这与本研究中得到的热处理会使乳状液蛋白质表面疏水性降低的结果有所不同。其原因可能是由于乳状液经过热处理后,蛋白质发生热变性而暴露出内部的疏水残基,亚基之间通过疏水相互作用而发生聚集,形成可溶性或不可溶性的聚集体,这些聚集体会对蛋白质的疏水区域产生屏蔽作用,阻碍了疏水基团与荧光探针ANS的有效结合,导致蛋白质表面疏水性下降[20]。此外,乳状液由55 ℃升高到75 ℃过程中,蛋白质的表面疏水性变化不明显,当温度超过85 ℃后,其表面疏水性明显降低,在95 ℃时降至最低,这可能与85 ℃超过了乳状液中蛋白质的变性温度有关。当处理温度超过蛋白质变性温度时,蛋白质会发生明显的热聚集,引起其表面疏水性的明显降低。
2.5.2 不同热处理温度下的SDS-PAGE分析结果
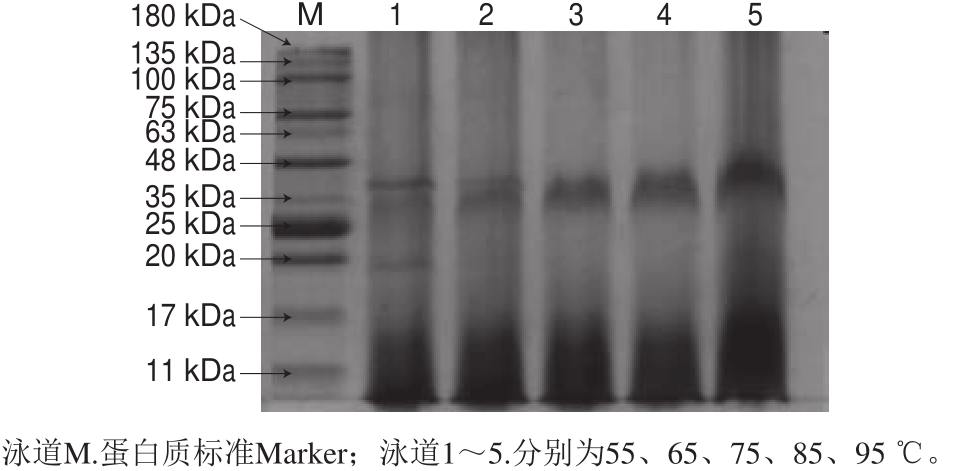
图6 不同热处理温度下乳状液中蛋白质的SDS-PAGE图
Fig.6 SDS-PAGE patterns of proteins in the emulsion treated at different temperatures
SDS-PAGE常用于蛋白质亚基组成和结构的分析,是蛋白质亚基常用的检测手段[21]。由图6可知,乳状液中蛋白质亚基分子质量主要分布在11~63 kDa,在分子质量小于11 kDa处还分布一部分小分子质量亚基。热处理温度为55 ℃的乳状液蛋白亚基主要分布在11、20 kDa和35~48 kDa处;当热处理温度升高到65 ℃时,分子质量为20 kDa的亚基消失了,这可能是由于20 kDa的亚基对热敏感,热处理导致其分解造成的[22]。75 ℃和65 ℃热处理的乳状液蛋白的亚基分布几乎没有差别,当热处理温度升高到85 ℃时,在35~48 kDa处分布的亚基分子质量增大;在95 ℃时亚基分子质量增大得更明显,这可能是由于高温处理使乳状液中蛋白质亚基聚集,导致分子质量的增大[23]。85 ℃以上热处理温度达到了乳状液蛋白的变性温度,蛋白质会发生热变性聚集,导致其分子质量增大,这也与本研究中热处理对乳状液稳定性影响的分析结果相符。
2.5.3 不同热处理温度下傅里叶变换红外光谱分析结果

图7 不同热处理温度下乳状液中蛋白质的傅里叶变换红外光谱图
Fig.7 Fourier transform infrared spectra of proteins in the emulsion treated at different temperatures
傅里叶变换红外光谱数据能够揭示蛋白质在特定环境中的二级结构信息。由图7可知,乳状液由55 ℃加热到95 ℃过程中,蛋白质的傅里叶变换红外光谱发生明显改变。随着热处理温度的升高,乳状液中蛋白质的红外特征吸收峰强度逐渐增加,在加热到75 ℃以上时吸收峰增加明显。这些吸收峰位置为C—O—C键伸缩振动产生吸收峰的1 000~1 260 cm-1处,芳香族中C—H键弯曲振动产生吸收峰的1 400~1 600 cm-1处[24],üCH3和—CH2基团中C—H伸缩振动产生吸收峰的2 800~3 000 cm-1处[25],—OH基伸缩振动产生吸收峰的3 300 cm-1附近[26]。
表1 不同热处理温度下乳状液中蛋白质的二级结构含量
Table1 Secondary structure contents of proteins in the emulsion treated at different temperatures

注:同列肩标小写字母不同表示差异显著(P<0.05)。
温度/℃ α-螺旋含量/%β-折叠含量/%β-转角含量/% 无规卷曲含量/%55 15.2±0.2d 42.5±0.1a 18.2±0.1ab 24.1±0.1a 65 13.9±0.1c 43.0±0.1b 17.9±0.1a 25.2±0.2b 75 10.7±0.1b 43.8±0.1c 18.1±0.2ab 27.4±0.2c 85 8.8±0.1a 43.3±0.1b 18.4±0.1b 29.5±0.1d 95 8.3±0.1a 44.0±0.2d 18.3±0.1ab 29.4±0.1d
原始乳状液的二级结构组成为:α-螺旋含量(17.3±0.1)%、β-折叠含量(40.9±0.2)%、β-转角含量(18.4±0.1)%、无规卷曲含量(23.4±0.1)%。由表1可知,乳状液经热处理后其蛋白质α-螺旋含量降低,β-折叠含量增加,β-转角含量变化不显著,无规卷曲含量增加,且这种变化趋势随着热处理温度的升高而更加明显。这说明乳状液经热处理后,蛋白质的α-螺旋结构转变为β-折叠结构和无规卷曲结构,这可能是蛋白质受热变性导致的[27]。随着热处理温度的升高,蛋白质的热变性程度进一步增加,导致更多的α-螺旋结构转变为β-折叠结构和无规卷曲结构,体现为α-螺旋含量降低,β-折叠和无规卷曲含量增加。然而,热处理温度超过85 ℃以后,乳状液中蛋白质的二级结构含量变化不显著(P>0.05),这可能与蛋白质已经完全变性有关。Chakraborty等[28]的研究发现,蛋白质在受热变性时,α-螺旋结构含量会减少,β-折叠结构和β-转角结构含量会增加。Kim等[29]发现热处理能够使β-乳球蛋白乳状液发生巯基-二硫键转换。Zhai Jiali等[30]发现在76 ℃下对β-乳球蛋白乳状液进行热处理,其发生了构象改变,但是这种构象改变没有溶液中蛋白质的变化明显,与本研究结果一致。
2.5.4 不同热处理温度下色氨酸内源荧光光谱分析
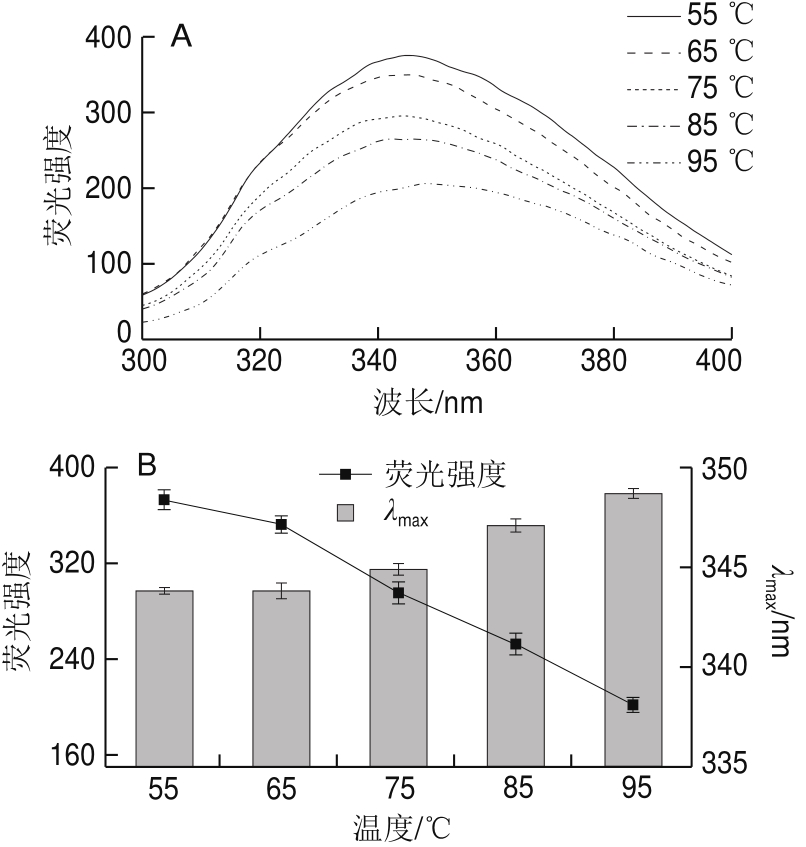
图8 不同热处理温度下乳状液中蛋白质的内源荧光光谱图(A)、荧光强度和最大吸收波长(B)
Fig.8 Intrinsic fl uorescence spectra (A), fl uorescence intensity and λmax (B) of the protein in the emulsion treated at different temperatures
在色氨酸内源荧光光谱中,光能够在90°入射角使样品成为激发态。当大量的光被乳状液吸收或发散,探测器能够检测到很弱的荧光信号。设定入射角在30°~60°之间,一部分光能够反射到检测器中获得较强的光信号[31]。色氨酸荧光光谱已被普遍用于研究乳状液中蛋白质的构象变化[32]。由图8可知,乳状液由55 ℃加热到95 ℃过程中,蛋白质的荧光强度由(373.1±8.3)逐渐降低至(201.8±6.2),发生了荧光猝灭作用,这可能是由于热处理过程中蛋白质色氨酸残基周围微环境变化导致的[33]。最大吸收波长(λmax)与荧光强度的变化趋势相反,随着热处理温度由55 ℃升高到95 ℃,蛋白质的λmax逐渐增大,由(343.8±0.2)nm增大到(348.7±0.2)nm,即λmax发生红移。乳状液由55 ℃升高到75 ℃,蛋白质的λmax变化不明显,当温度超过85 ℃后,λmax发生明显红移,这可能与85 ℃超过了乳状液中蛋白质的变性温度有关。当热处理温度超过蛋白质的变性温度后,蛋白质分子结构伸展,暴露出原本埋藏在内部的疏水基团,使色氨酸残基周围环境的极性增加,导致蛋白质构象改变。当温度达到95 ℃时,蛋白质完全变性,使蛋白质内部疏水结构更多的暴露到分子表面,且λmax红移程度增加,此时蛋白质三级结构变得更加松散。晏华立等[34]对麻疯树核糖体失活蛋白(curcin)荧光光谱的研究中发现,当温度高于curcin的变性温度时,可能导致curcin中色氨酸残基的疏水核心结构出现暴露在外的变性过程,引起色氨酸的特征吸收峰红移,这与本研究结果一致。
本研究通过生物解离技术提取大豆乳状液,探讨不同热处理温度(55、65、75、85、95 ℃)对乳状液稳定性的影响,从宏观到微观逐步探究了乳状液体系中各组分的分子间作用力、组成以及空间构象,得到主要结论如下:1)随着温度的增加,乳状液的ζ-电位、平均粒径和黏度均增加,95 ℃热处理时油滴尺寸明显增加,出现了更多的大油滴,这说明高温破坏了乳状液的稳定结构,导致小油滴聚集形成大油滴;2)热处理温度低时,乳状液蛋白的亚基分布几乎没有差别,当热处理温度升高到85 ℃时亚基分子质量增大,在温度为95 ℃时亚基分子质量增大更明显,说明乳状液经热处理后蛋白质二级结构遭到破坏,且这种变化趋势随着热处理温度的升高而更加明显;3)随着热处理温度的升高,蛋白的荧光强度降低,发生了荧光猝灭作用,乳状液的游离油得率升高。
[1] YOON S H, JUNG M Y, MIN D B. Effects of thermally oxidized triglycerides on the oxidative stability of soybean oil[J]. Journal of the American Oil Chemists’ Society, 1988, 65(10): 1652-1656.
[2] CAMPBELL K A, GLATZ C E. Mechanisms of aqueous extraction of soybean oil[J]. Journal of Agricultural and Food Chemistry, 2009,57(22): 10904-10912.doi:10.1021/jf902298a.
[3] CHABRAND R M, KIM H J, ZHANG C, et al. Destabilization of the emulsion formed during aqueous extraction of soybean oil[J].Journal of the American Oil Chemists’ Society, 2008, 85(4): 383-390.doi:10.1016/j.enzmictec.2009.03.008.
[4] PUPPO M C, SPERONI F, CHAPLEAU N, et al. Effect of highpressure treatment on emulsifying properties of soybean proteins[J].Food Hydrocolloids, 2005, 19(2): 289-296.doi:10.1016/j.foodhyd.2004.07.001.
[5] 王文睿, 江连洲, 郑环宇, 等. 热处理对大豆乳状液破乳工艺的研究[J]. 食品工业科技, 2012, 33(4): 285-287.doi:10.13386/j.issn1002-0306.2012.04.054.
[6] 齐宝坤. 挤压膨化预处理水酶法提取大豆油脂工艺及机理研究[D].哈尔滨: 东北农业大学, 2013: 16-17.
[7] 李丽娜, 李军生, 阎柳娟. 分光光度法测定食品蛋白质中二硫键的含量[J]. 食品科学, 2008, 29(8): 562-564.doi:10.3321/j.issn:1002-6630.2008.08.135.
[8] 王瑛瑶, 王璋, 罗磊. 水酶法提花生油中乳状液性质及破乳方法[J]. 农业工程学报, 2008, 24(12): 259-263.doi:10.3321/j.issn:1002-6819.2008.12.053.
[9] KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J].Biochimica et Biophysica Acta (BBA)-Protein Structure, 1980, 624(1):13-20.doi:10.1016/0005-2795(80)90220-2.
[10] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.doi:10.1038/227680a0.
[11] 尹寿伟. 芸豆蛋白的物化修饰及相关构效机理研究[D]. 广州: 华南理工大学, 2009: 17-19.
[12] KWON K S, BAE D, PARK K H, et al. Aqueous extraction and membrane techniques improve coconut protein concentrate functionality[J]. Journal of Food Science, 1996, 61(4): 753-756.doi:10.1111/j.1365-2621.1996.tb12197.x.
[13] PEAMPRASART T, CHIEWCHAN N. Effect of fat content and preheat treatment on the apparent viscosity of coconut milk after homogenization[J]. Journal of Food Engineering, 2006, 77(3): 653-658.doi:1016/j.jfoodeng.2005.07.024.
[14] KIM D A, CORNEC M, NARSIMHAN G. Effect of thermal treatment on interfacial properties of β-lactoglobulin[J]. Journal of Colloid and Interface Science, 2005, 285(1): 100-109.doi:10.1016/j.jcis.2004.10.044.
[15] MCCLEMENTS D J. Protein-stabilized emulsions[J]. Current Opinion in Colloid and Interface Science, 2004, 9(5): 305-313.doi:10.1016/j.cocis.2004.09.003.
[16] CHIANG C J, CHEN H C, CHAO Y P, et al. Eff i cient system of artif i cial oil bodies for functional expression and purification of recombinant nattokinase in Escherichia coli[J]. Journal of Agricultural and Food Chemistry, 2005, 53(12): 4799-4804.doi:10.1021/jf050264a.
[17] NIKIFORIDIS C V, KARKANI O A, KIOSSEOGLOU V.Exploitation of maize germ for the preparation of a stable oil-body nanoemulsion using a combined aqueous extraction-ultrafiltration method[J]. Food Hydrocolloids, 2011, 25(5): 1122-1127.doi:1016/j.foodhyd.2010.10.009.
[18] HARNSILAWAT T, PONGSAWATMANIT R, MCCLEMENTS D J.Stabilization of model beverage cloud emulsions using proteinpolysaccharide electrostatic complexes formed at the oil-water interface[J]. Journal of Agricultural and Food Chemistry, 2006, 54(15):5540-5547.doi:10.1021/jf052860a.
[19] SORGENTINI D A, WAGNER J R, ANÓN M C. Effects of thermal treatment of soy protein isolate on the characteristics and structurefunction relationship of soluble and insoluble fractions[J]. Journal of Agricultural and Food Chemistry, 1995, 43(9): 2471-2479.doi:10.1021/jf00057a029.
[20] JIANG L W, BUNKELMANN J, TOWILL L, et al. Identification of peroxisome membrane proteins (PMPs) in sunflower (Helianthus annuus L.) cotyledons and influence of light on the PMP developmental pattern[J]. Plant Physiology, 1994, 106(1): 293-302.doi:10.1104/pp.106.1.293.
[21] 陈珂玥. 11S/2S比值及热处理改性对葵花分离蛋白结构与功能特性的影响[D]. 齐齐哈尔: 齐齐哈尔大学, 2015: 24-26.
[22] JUNG S, LAMSAL B P, STEPIEN V, et al. Functionality of soy proteins produced by enzyme-assisted extraction[J]. Journal of the American Oil Chemists Society, 2006, 83(1): 71-78.doi:10.1007/s11746-006-1178-y.
[23] KAPCHIE V N, TOWA L T, HAUCK C, et al. Recycling of aqueous supernatants in soybean oleosome isolation[J]. Journal of the American Oil Chemists Society, 2010, 87(2): 223-231.doi:10.1007/s11746-009-1485-1.
[24] SU J F, HUANG Z, YUAN X Y, et al. Structure and properties of carboxymethyl cellulose/soy protein isolate blend edible films crosslinked by Maillard reactions[J]. Carbohydrate Polymers, 2010,79(1): 145-153.doi:10.1016/j.carbpol.2009.07.035.
[25] LIU Q, KONG B H, HAN J C, et al. Structure and antioxidant activity of whey protein isolate conjugated with glucose via the Maillard reaction under dry-heating conditions[J]. Food Structure, 2014, 1(2):145-154.doi:10.1016/j.foostr.2013.11.004.
[26] RHIM J W, MOHANTY K A, SINGH S P, et al. Preparation and properties of biodegradable multilayer films based on soy protein isolate and poly (lactide)[J]. Industrial and Engineering Chemistry Research, 2006, 45(9): 3059-3066.doi:10.1021/ie051207+.
[27] HARADA T, YOKOMIZO K. Demulsification of oil-in-water emulsion under freezing conditions: effect of crystal structure modifier[J]. Journal of the American Oil Chemists’ Society, 2000,77(8): 859-864.doi:10.1007/s11746-000-0137-y.
[28] CHAKRABORTY M, BHATTACHARYA D, MUKHOPADHYAY C,et al. Structure and conformational studies on dityrosine formation in the DNA binding domain of RFX5[J]. Biophysical Chemistry, 2010,149(3): 92-101.doi:10.1016/j.bpc.2010.04.005.
[29] KIM H J, DECKER E A, MCCLEMENTS D J. Role of postadsorption conformation changes of β-lactoglobulin on its ability to stabilize oil droplets against f l occulation during heating at neutral pH[J]. Langmuir,2002, 18(20): 7577-7583.doi:10.1021/la020385u.
[30] ZHAI Jiali, WOOSTER T J, HOFFMANN S V, et al. Structural rearrangement of β-lactoglobulin at different oil-water interfaces and its effect on emulsion stability[J]. Langmuir, 2011, 27(15): 9227-9236.doi:10.1021/la201483y.
[31] ZHANG J, FU Y, CHOWDHURY M H, et al. Metal-enhanced singlemolecule f l uorescence on silver particle monomer and dimer: coupling effect between metal particles[J]. Nano Letters, 2007, 7(7): 2101-2107.doi:10.1021/nl071084d.
[32] GRANGER C, BAREY P, TOUTAIN J, et al. Direct quantification of protein partitioning in oil-in-water emulsion by front-face fluorescence: avoiding the need for centrifugation[J]. Colloids and Surfaces B: Biointerfaces, 2005, 43(3): 158-162.doi:10.1016/j.colsurfb.2005.04.002.
[33] JIMÉNEZ-CASTANO L, VILLAMIEL M, LÓPEZ-FANDIÑO R.Glycosylation of individual whey proteins by Maillard reaction using dextran of different molecular mass[J]. Food Hydrocolloids, 2007,21(3): 433-443.doi:10.1016/j.foodhyd.2006.05.006.
[34] 晏华立, 蒋楠, 樊佳, 等. 温度、酸碱度和盐离子浓度对curcin紫外光谱和荧光光谱的影响[J]. 资源开发与市场, 2014, 30(12): 1409-1412.doi:10.3969/j.issn.1005-8141.2014.12.001.
Effect of Different Heat Treatments on the Stability of the Emulsion Formed during the Enzyme-Assisted Aqueous Extraction of Soybean Oil