金瓜(Cucurbita pepo L. var. medullosa Alef.)是上海崇明的传统名特产之一,其瓜丝素有“植物海蜇”之美誉。崇明年产金瓜1.7万 t左右[1],金瓜籽近百吨,随着金瓜丝的热销,金瓜及金瓜籽的产量也不断增加。金瓜籽形状饱满、肉质厚实,但目前仅作为炒货加以利用。一般瓜籽中蛋白质量分数达20%~30%,金瓜籽蛋白质含有8 种必需氨基酸,且组成比较合理,营养价值较高[2],但鲜见对其深加工的研究报道。
天然抗氧化肽具有清除重金属和促进过氧化氢分解的作用,可降低自氧化速率,减少脂肪过氧化氢含量和自由基的生成[3]。与化学法相比,酶解法生产抗氧化肽具有温和、高效、易控、安全等优势。国内外研究人员已从不同来源的蛋白质中制备出多种具有抗氧化活性的肽类物质[4],但这些研究主要集中在肽类的高效分离制备及构效关系的研究上[5-6],而对活性肽在体内生物有效性的研究却鲜有报道。由于消化系统的复杂性、实验模型难以建立、体内大分子难以控制等因素影响,消化实验难以在活体中进行。体外模拟消化既能在一定程度上真实模仿人体内环境,同时节省了大量资源,方便且易于控制[7]。金瓜籽抗氧化肽(antioxidant peptides from golden melon seeds,APG)具有较强抗氧化活性,研究其在体内的生物有效性是一项极具前景和应用性的课题。目前还鲜见关于其在体外模拟胃肠道消化情况的报道,因此研究APG在胃肠道消化过程中的稳定性显得至关重要。
本研究以金瓜籽为原料,通过单因素试验及Box-Behnken响应面试验优化了酶法制备APG的工艺参数;将不同分子质量的APG在体外模拟胃肠道消化,分别从产物的游离氨基酸组成、分子质量分布及抗氧化活性变化等角度分析了抗氧化肽在胃肠道消化过程中的生物有效性变化,旨在为APG作为功能性抗氧化剂的生产和应用提供参考。
金瓜籽 上海跃进食品有限公司;碱性蛋白酶(酶活力200 U/mg,最适温度55 ℃、最适pH 9.0)、酸性蛋白酶(酶活力50 U/mg,50 ℃、pH 4.0)、中性蛋白酶(酶活力100 U/mg,50 ℃、pH 7.0)、复合蛋白酶(酶活力120 U/mg,55 ℃、pH 7.0)、胃蛋白酶(酶活力3 000 U/mg,60 ℃、pH 2)、胰酶(酶活力8hUSP,40 ℃、pH 7.5) 美国Sigma公司;氢氧化钠(分析纯)国药集团(上海)化学试剂有限公司。
JA2003电子天平 上海恒平科学仪器有限公司;PHS-3C pH计 上海雷磁仪器有限公司;TGL-16M台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;DKZ系列电热恒温振荡水槽 上海一恒科学仪器有限公司;S-433D型全自动氨基酸分析仪 德国SYKAM公司;WFZ UV2350紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;MSM2013实验用全能型膜分离装置 上海摩速科学器材有限公司。
1.3.1 金瓜籽粕的制备
将过80 目筛的金瓜籽粉与蒸馏水按1∶7(m/V)混合,调pH值至7.4,加质量分数2%复合蛋白酶(以金瓜籽粉质量计)56 ℃下酶解2 h后100 ℃灭酶10 min,4 000 r/min离心20 min,得到游离油、乳状液、酶解液、沉淀。将乳状液、酶解液和沉淀冷冻干燥,得到金瓜籽粕。
1.3.2 金瓜籽蛋白酶解液的制备
金瓜籽粕→加水并搅拌均匀→调pH值→酶解→灭酶(100 ℃、10 min)→冷却后离心(4 000 r/min、20 min)→收集上清液(即APG)。
1.3.3 抗氧化活性测定
1.3.3.1 DPPH自由基清除率的测定
将2 mL 0.2 mmol/L DPPH溶液(溶于体积分数95%乙醇溶液)置于试管中,加入2 mL 1.3.2节所得样品,振荡混匀,室温放置30 min后在517 nm波长处测其吸光度[8]。DPPH自由基清除率根据公式(1)计算。
式中:Ai为待测样品的吸光度;Ac为2 mL DPPH溶液和2 mL体积分数95%乙醇溶液的吸光度;Aj为2 mL样品和2 mL体积分数95%乙醇溶液的吸光度。
1.3.3.2 羟自由基清除率的测定
取样品2 mL,加入2 mL 6 mmol/L的FeSO4、2 mL 6 mmol/L的H2O2,混匀后静置10 min,再加入2 mL 6 mmol/L水杨酸混匀,静置30 min后于510 nm波长处测吸光度[9]。羟自由基清除率根据公式(2)计算。
式中:Ai为待测样品的吸光度;Aj为双蒸水代替水杨酸测得的吸光度;A0为VC代替样品测得的吸光度。
1.3.3.3 还原力的测定
2 mL样品加入2 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6)和2 mL 1 g/100 mL的铁氰化钾溶液混合液中混合,50 ℃水浴反应20 min,冷却后加入2 mL 10 g/100 mL的三氯乙酸,混匀后取2 mL与2 mL蒸馏水以及0.4 mL 0.1 g/100 mL氯化铁在试管中反应,静置10 min后测定其在700 nm波长处的吸光度[10],还原力与吸光度成正比。
1.3.4 APG制备的单因素试验
以酶解产物的抗氧化活性为指标,在复合蛋白酶、中性蛋白酶、碱性蛋白酶、酸性蛋白酶中筛选出适合金瓜籽粕酶解的最佳蛋白酶,并对底物质量分数(3%、4%、5%、6%、7%)、加酶量(2%、3%、4%、5%、6%)、酶解温度(40、45、50、55、60 ℃)、酶解pH值(7.5、8.0、8.5、9.0、9.5)和酶解时间(30、60、90、120、150 min)进行单因素试验,酶解产物经离心、冷冻干燥后得到APG。
1.3.5 APG制备的Box-Behnken试验优化设计
在酶解产物抗氧化活性单因素试验基础上,选取加酶量、酶解pH值、酶解温度和酶解时间4 个因素,根据Box-Behnken试验原理进行四因素三水平的响应面优化试验,试验因素和水平设计见表1。
表1 因素与水平
Table1 Coded levels and corresponding actual levels of independent variablese used for Box-Behnken design
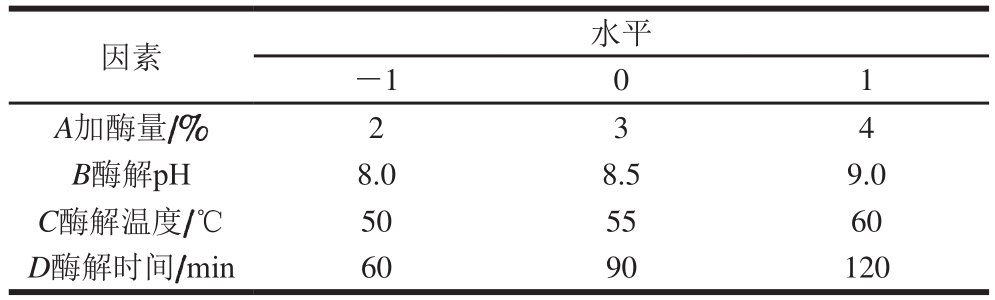
因素 水平-1 0 1 A加酶量/% 2 3 4 B酶解pH 8.0 8.5 9.0 C酶解温度/℃ 50 55 60 D酶解时间/min 60 90 120
1.3.6 不同分子质量APG的制备
将最佳条件下获得的金瓜籽蛋白酶解液离心,上清液在0.25 MPa、25 ℃条件下先后用截留分子质量为5 kDa和3 kDa的超滤膜依次超滤(图1),得到分子质量大于5 kDa、3~5 kDa和小于3 kDa的3 种多肽,分别在50 ℃下旋转蒸发浓缩后冷冻干燥、备用。
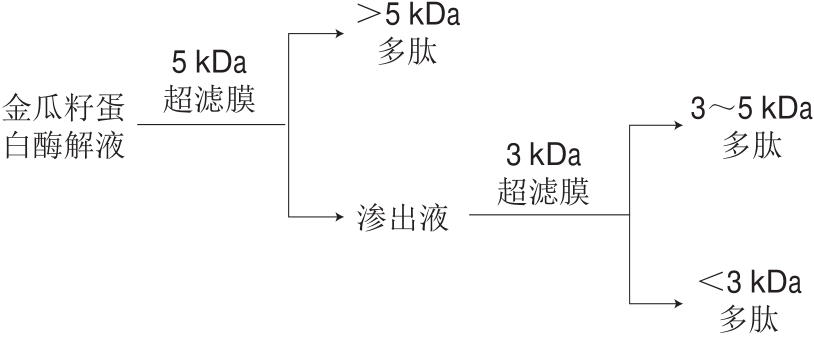
图1 不同分子质量APG的膜分离工艺流程图
Fig.1 Flow chart of membrane separation of APG with different molecular mases
1.3.7 APG的胃肠道消化模拟
体外模拟胃肠道消化反应参考Szołtysik[11]和Ruiz[12]等的方法并有所改进,模拟过程分两步反应进行:1)模拟胃消化道的消化过程:APG粉溶于去离子水中配成质量分数3%的溶液,调节pH值为2.0。加胃蛋白酶(APG质量的4%),适度搅拌,置于37 ℃、100 r/min下振荡孵育2 h,分别在0、1 h及2 h取样,调pH值至7.5,11 000 r/min离心15 min,取上清液冷冻干燥、保藏备用。2)模拟肠消化道的消化过程:APG经过胃消化道消化2 h后,调pH值至7.5。加入质量分数4%胰酶,适度搅拌,置于37 ℃、100 r/min下振荡孵育2 h,分别在1 h及2 h取样,100 ℃灭酶10 min,11 000 r/min离心15 min,取上清液冷冻干燥、保藏备用。
1.3.8 游离氨基酸组成的测定
将400 μL样品与100 μL体积分数10%磺基水杨酸溶液混合,在2~8 ℃冰箱中静置60 min后1 000 r/min离心15 min,取上清液1 000 r/min离心5 min。稀释后经0.45 μm尼龙滤膜过滤,用氨基酸分析仪分析。
氨基酸分析仪的工作条件[13]:色谱柱:LCA K07/Li(30 mmh4.6 mm);进样量20 μL;检测波长为570 nm(脯氨酸为440 nm);茚三酮流速为0.35 mL/min,流动相流速为0.35 mL/min;反应器温度为135 ℃。
1.3.9 多肽相对分子质量分布的测定
采用凝胶渗透色谱法测定多肽的相对分子质量分布。色谱条件:色谱柱:TSK-GEL G2000 SWXL(30 cmh7.8 mm,5 μm);流动相:0.1 mol/L Na2SO4+0.1 mol/L磷酸盐缓冲液(pH 6.7);流速:0.5 mL/min;进样量10 μL;柱温30 ℃;检测波长:220 nm[14]。
每个实验重复3 次,结果取平均值,采用Design-Expert 8.0.5、SPSS 11.0软件对数据进行方差分析(ANOVA),同时进行LSD检验。以P<0.05为有显著性差异。
2.1.1 酶种类

图2 酶种类对酶解产物抗氧化活性的影响
Fig.2 Effect of enzyme types on antioxidant activity of enzymatic hydrolysates
图2表明,分别经4 种蛋白酶酶解相同时间后,碱性蛋白酶酶解金瓜籽蛋白的效果最佳,酶解产物的还原力、羟自由基清除率、DPPH自由基清除率分别为0.37、43.01%和62.33%。徐贤[15]选用木瓜蛋白酶、碱性蛋白酶、风味蛋白酶、中性蛋白酶、胰蛋白酶和复合蛋白酶对大豆蛋白进行酶解,结果发现碱性蛋白酶作用效果最好,这与本实验结果一致。选取碱性蛋白酶进行后续实验。
2.1.2 底物质量分数
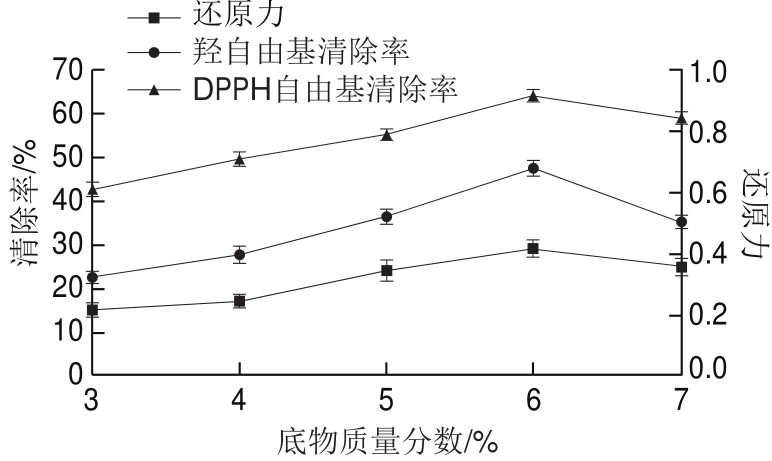
图3 底物质量分数对酶解产物抗氧化活性的影响
Fig.3 Effect of substrate concentration on antioxidant activity of enzymatic hydrolysates
图3 表明,当底物质量分数达到6%时,酶解产物的还原力、羟自由基清除率与DPPH自由基清除率均达到最大值,分别为0.41、47.57%和64.19%。原因可能是底物质量分数低于6%时,底物与酶充分接触发生酶解反应而使还原力、羟自由基清除率、DPPH自由基清除率逐步升高;当底物质量分数高于6%时,酶量不足以与全部底物发生酶解反应,导致底物不能被充分酶解而降低了酶解产物的抗氧化活性。后续实验选取底物质量分数为6%。
2.1.3 加酶量

图4 加酶量对酶解产物抗氧化活性的影响
Fig.4 Effect of enzyme dosage on antioxidant activity of enzymatic hydrolysates
图4表明,当加酶量为3%时达到最高值,酶解产物的还原力、羟自由基清除率、DPPH自由基清除率分别为0.40、45.56%和58.45%。这可能是由于进一步酶解反而使具有较高还原力、羟自由基清除率、DPPH自由基清除率的多肽进一步被降解而导致酶解产物的抗氧化活性下降。后续实验选取加酶量为3%。
2.1.4 酶解pH值

图5 pH值对酶解产物抗氧化活性的影响
Fig.5 Effect of pH on antioxidant activity of enzymatic hydrolysates
图5 表明,在实验范围内,当反应体系的pH值为8.5时酶解产物的还原力、羟自由基清除率、DPPH自由基清除率均达到最高值,分别为0.39、44.19%和55.45%。后续实验选取酶解pH值为8.5。
2.1.5 酶解温度

图6 酶解温度对酶解产物抗氧化活性的影响
Fig.6 Effect of hydrolysis temperature on antioxidant activity of enzymatic hydrolysates
图6 表明,酶解温度在55 ℃时酶解产物的还原力、羟自由基清除率、DPPH自由基清除率均达到最高值,分别为0.42、43.42%和56.68%。但温度高于55 ℃时,酶解产物的还原力、羟自由基清除率、DPPH自由基清除率急剧下降,这可能是由于温度过高使酶赖以稳定的二级与三级结构键因分子剧烈运动而被打断,导致碱性蛋白酶的结构发生变化,从而导致碱性蛋白酶变性失活,酶解效果急剧下降[16]。后续实验选取酶解温度为55 ℃。
2.1.6 酶解时间
图7表明,当酶解90 min时,酶解产物的还原力、羟自由基清除率、DPPH自由基清除率均达到最高值,分别为0.41、44.67%和54.44%。后续实验选取酶解时间为90 min。

图7 酶解时间对酶解产物抗氧化活性的影响
Fig.7 Effect of hydrolysis time on antioxidant activity of enzymatic hydrolysates
2.2.1 响应面试验设计与结果
根据Box-Behnken的中心组合设计原理,选择加酶量(A)、酶解pH值(B)、酶解温度(C)和酶解时间(D)4 个因素为自变量,羟自由基清除率、DPPH自由基清除率和还原力为响应值(Y1、Y2和Y3),设计四因素三水平试验,共29 个试验点,其中试验号2、21、25、27、29为中心试验,用以估计试验误差,其余为分析试验。试验设计与结果见表2。
表2 Box-Behnken试验设计与结果
Table2 Box-Behnken design with experimental results

序号 A加酶量/%还原力1 2 8.0 55 90 39.41 46.16 0.393 2 3 8.5 55 90 57.34 61.37 0.506 3 4 8.5 55 60 38.98 36.78 0.176 4 3 9.0 55 60 41.56 44.32 0.332 5 3 9.0 60 90 38.48 41.58 0.3056 3 9.0 55 120 43.57 42.42 0.3157 3 8.0 55 60 39.49 42.89 0.2598 4 8.0 55 90 42.09 44.14 0.3459 2 9.0 55 90 32.9 43.69 0.2039 3 9.0 50 90 39.58 40.51 0.242 11 3 8.5 60 120 50.41 54.69 0.417 12 3 8.5 60 60 49.39 50.89 0.406 13 3 8.5 50 120 51.65 53.31 0.427 14 2 8.5 50 90 38.64 41.11 0.282 15 3 8.5 50 60 47.69 51.74 0.387 16 4 8.5 55 120 32.64 39.31 0.392 17 3 8.0 55 120 36.84 40.67 0.314 18 2 8.5 55 60 37.89 39.79 0.204 19 2 8.5 60 90 38.47 41.61 0.302 20 3 8.0 50 90 44.78 47.57 0.374 21 3 8.5 55 90 55.91 60.97 0.548 22 3 8.0 60 90 40.57 43.31 0.353 23 4 8.5 50 90 44.65 45.42 0.325 24 4 8.5 60 90 45.74 46.93 0.367 25 3 8.5 55 90 59.11 56.37 0.495 26 2 8.5 55 120 42.65 42.67 0.113 27 3 8.5 55 90 62.11 62.37 0.467 28 4 9.0 55 90 45.69 46.12 0.395 29 3 8.5 55 90 59.11 61.97 0.529 B酶解pH C酶解温度/℃D酶解时间/min Y1 羟自由基清除率/%Y2 DPPH自由基清除率/%Y3
2.2.2 回归方程显著性分析
以DPPH自由基清除率和还原力为响应值时得到的结论与羟自由基清除率一致,因此以下分析仅以羟自由基清除率为例。
利用SAS 8.0软件对表2中试验数据进行二次线性回归拟合,得到数学模型:
表3 响应面回归模型方差分析
Table3 Analysis of variance for the fi tted quadratic response surface regression model
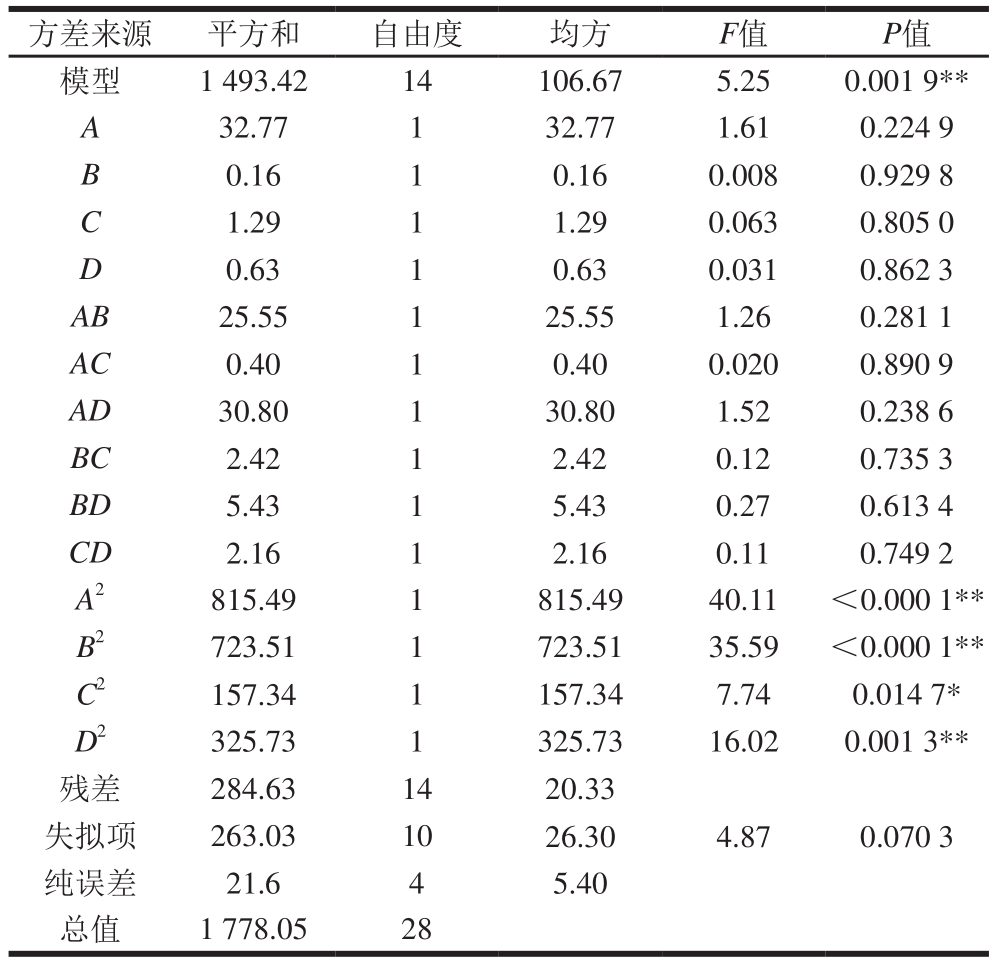
注:**.影响极显著(P<0.01);*.影响显著(P<0.05)。
方差来源 平方和 自由度 均方 F值 P值模型 1 493.42 14 106.67 5.25 0.001 9**A 32.77 1 32.77 1.61 0.224 9 B 0.16 1 0.16 0.008 0.929 8 C 1.29 1 1.29 0.063 0.805 0 D 0.63 1 0.63 0.031 0.862 3 AB 25.55 1 25.55 1.26 0.281 1 AC 0.40 1 0.40 0.020 0.890 9 AD 30.80 1 30.80 1.52 0.238 6 BC 2.42 1 2.42 0.12 0.735 3 BD 5.43 1 5.43 0.27 0.613 4 CD 2.16 1 2.16 0.11 0.749 2 A2 815.49 1 815.49 40.11 <0.000 1**B2 723.51 1 723.51 35.59 <0.000 1**C2 157.34 1 157.34 7.74 0.014 7*D2 325.73 1 325.73 16.02 0.001 3**残差 284.63 14 20.33失拟项 263.03 10 26.30 4.87 0.070 3纯误差 21.6 4 5.40总值 1 778.05 28
从表3可知,以羟自由基清除率为响应值时,模型P=0.001 9<0.01,表明该二次方程模型显著。同时失拟P=0.070 3>0.1,表示模型失拟不显著,说明响应面试验结果和数学模型拟合度较好,且该回归模型能对APG的制备效果进行较好地分析与预测。用各因素的F值可评价该因素对试验指标的影响,F值越大,说明该因素的影响越显著[17],即各因素对羟自由基清除率的影响顺序为:酶解pH值>酶解时间>酶解温度>加酶量。变异系数(coefficient of variation,CV)代表模型的置信度,当CV值小于10%时,说明模型的置信度良好,且CV值越低,模型的置信度越高[18]。本试验的CV值为10.08%,说明本试验的置信度较高。
2.2.3 酶解条件优化及模型验证
为检验Design Expert软件分析得到最优条件的准确性,对所得最佳酶解工艺条件进行实验验证,即底物质量分数为6%、添加碱性蛋白酶3%、在pH 8.5的体系中55 ℃酶解90 min,所得羟自由基清除率、DPPH自由基清除率、还原力分别为(58.19±0.80)%、(60.27±1.73)%、0.49±0.01,实验值分别与理论预测值(58.75%、60.59%、0.51)接近,说明该模型可较好地模拟和预测APG的制备工艺条件,并具有可行性。
2.3.1 模拟胃肠道消化对APG中游离氨基酸含量及组成的影响
表4 模拟胃肠消化中抗氧化肽氨基酸组成的变化
Table4 Changes in amino acid composition of antioxidant peptide
during simulated gastrointestinal digestion

大于5 kDa的APG中游离氨基酸含量/(mg/g)0 h 2 h 4 h 0 h 2 h 4 h 0 h 2 h 4 h天冬氨酸 27.00 0.59 0.85 3.25 0.52 0.74 3.09 0.49 0.69 2.54苏氨酸 8.70 1.34 2.26 3.02 0.82 1.57 2.44 0.36 1.11 2.03丝氨酸 14.90 2.21 3.00 4.13 1.58 1.94 3.19 0.42 1.55 2.33谷氨酸 43.90 2.07 2.77 4.58 1.85 2.48 3.41 1.24 2.05 3.15甘氨酸 14.60 2.76 3.35 4.08 2.64 3.27 3.79 2.55 2.81 3.58丙氨酸 12.80 4.09 4.86 7.78 3.75 4.77 6.48 3.44 4.75 6.14胍氨酸 17.60 1.67 9.42 12.17 1.53 8.76 11.98 1.35 8.14 11.9缬氨酸 12.80 4.45 4.93 5.73 4.39 4.89 5.69 2.31 4.9 5.61半胱氨酸 7.40 0.00 0.00 0.00 0.46 0.63 1.00 0.37 0.42 0.46蛋氨酸 15.50 1.54 2.05 8.26 1.46 1.89 5.64 1.39 1.61 3.11异亮氨酸 10.50 4.69 4.82 5.73 4.02 4.16 4.27 3.05 4.20 4.10亮氨酸 20.60 9.55 11.06 14.99 1.47 10.85 12.95 1.51 10.44 12.90酪氨酸 14.10 4.4 8.69 11.61 3.84 8.43 10.99 3.21 7.14 10.39苯丙氨酸 15.30 6.77 8.21 12.81 2.73 7.86 11.82 2.72 7.32 10.82色氨酸 12.30 1.91 2.78 3.26 1.83 2.47 3.41 1.7 2.18 3.04赖氨酸 11.20 4.87 5.95 6.96 4.56 5.49 6.22 3.37 5.37 6.09组氨酸 26.30 7.4 10.53 17.39 2.2 10.28 13.48 1.69 9.58 11.7精氨酸 47.80 3.61 8.19 15.27 3.41 7.63 15 3.13 7.21 14.74脯氨酸 8.00 0.84 0.91 1.36 0.70 0.86 1.21 0.65 0.83 1.17氨基酸 总氨基酸含量/(mg/g)小于3 kDa的APG中游离氨基酸含量/(mg/g)3~5 kDa的APG中游离氨基酸含量/(mg/g)总量/(mg/g)341.30 64.76 94.63 142.38 43.76 88.97 126.06 34.95 82.30 115.80游离氨基酸/总氨基酸/% 18.97 27.73 41.72 12.82 26.07 36.94 10.24 24.11 33.93
如表4所示,分子质量小于3 kDa、3~5 kDa与大于5 kDa的APG样品中分别含游离氨基酸18.97%、12.82%和10.24%,其中分子质量3~5 kDa和大于5 kDa也含有部分游离氨基酸,原因可能是大分子肽对小分子游离氨基酸的吸附作用,还可能由于肽具有一定的空间结构而使部分游离氨基酸难以通过超滤达到与肽完全分离的目的[19-20]。经过胃部模拟消化2 h后,小于3 kDa的APG中游离氨基酸的总量从64.76 mg/g增加到94.63 mg/g,增幅为46.12%;3~5 kDa的样品中游离氨基酸的含量从43.76 mg/g增加到88.97 mg/g,增幅为103.31%;大于5 kDa的样品中游离氨基酸的总量从34.95 mg/g增加到82.30 mg/g,增幅为135.48%。再经过肠道模拟消化2 h后,小于3 kDa、3~5 kDa、大于5 kDa的样品中游离氨基酸总量分别增加到142.38、126.06 mg/g和115.80 mg/g,即增加119.86%、188.07%、231.33%。分子质量3~5 kDa和大于5 kDa的样品经胃肠道消化4 h后,含游离氨基酸分别为41.72%、36.94%和33.93%,其余58%以上仍是以肽的形式存在。说明体外模拟胃肠消化主要是将大分子质量的APG水解成小片段的肽而不是全降解为游离氨基酸,此结果与Adibi等[21]的研究结果一致。
如表4所示,小于3 kDa、3~5 kDa、大于5 kDa的样品在模拟胃肠道消化过程中碱性氨基酸(赖氨酸、组氨酸、精氨酸)的释放量较多,酸性氨基酸(天冬氨酸、谷氨酸)的含量基本无变化,具有抗氧化活性的氨基酸如酪氨酸、苯丙氨酸、组氨酸、蛋氨酸[22]含量增加较明显。
2.3.2 模拟胃肠道消化对不同分子质量APG分布的影响
表5 模拟胃肠消化产物的分子质量分布
Table5 Molecular mass distribution of antioxidant peptides during simulated gastrointestinal digestion
%
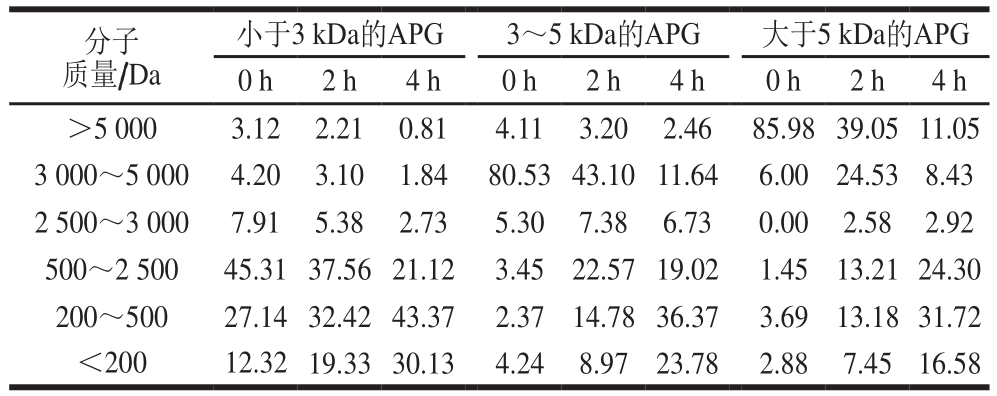
小于3 kDa的APG 3~5 kDa的APG 大于5 kDa的APG 0 h 2 h 4 h 0 h 2 h 4 h 0 h 2 h 4 h>5 000 3.12 2.21 0.81 4.11 3.20 2.46 85.98 39.05 11.05 3 000~5 000 4.20 3.10 1.84 80.53 43.10 11.64 6.00 24.53 8.43 2 500~3 000 7.91 5.38 2.73 5.30 7.38 6.73 0.00 2.58 2.92 500~2 500 45.31 37.56 21.12 3.45 22.57 19.02 1.45 13.21 24.30 200~500 27.14 32.42 43.37 2.37 14.78 36.37 3.69 13.18 31.72<200 12.32 19.33 30.13 4.24 8.97 23.78 2.88 7.45 16.58分子质量/Da
由表5可知,消化前小于3 kDa的样品中92.68%是分子质量小于3 kDa的肽段,3~5 kDa样品中80.53%是分子质量3~5 kDa的肽段,大于5 kDa样品中85.98%是分子质量大于5 kDa的肽段。小于3 kDa样品在模拟胃消化道过程中,分子质量在500~3 000 Da的肽段减少了19.32%,而分子质量小于500 Da的肽段增加了31.15%;在模拟肠道消化过程中,分子质量在500~3 000 Da的肽段增加了5.04%(P<0.05),而分子质量小于500 Da的肽段却增加了86.26%(P<0.05),消化产物中主要由分子质量小于500 Da的小分子肽段组成。3~5 kDa和大于5 kDa样品消化结果与小于3 kDa的样品结果类似。说明在模拟胃肠道消化过程中,大分子质量的肽段被逐步降解,这意味着胃肠道消化过程中主要通过内切方式对不同分子质量APG进行水解,进一步验证了胃蛋白酶和胰蛋白酶主要是将不同分子质量APG水解成小片段肽,而胰蛋白酶相对于胃蛋白酶而言其水解能力更强。
分子质量小于3 kDa、3~5 kDa、大于5 kDa样品在模拟胃肠道消化过程中分子质量分布的变化规律与其游离氨基酸变化规律一致。而且小于3 kDa、3~5 kDa、大于5 kDa样品的消化最终产物中分子质量小于500 Da的肽段分别为73.50%、60.15%和53.30%。这说明小于3 kDa、3~5 kDa和大于5 kDa样品经模拟消化后主要以二肽、三肽和寡肽的形式存在,而不全是游离氨基酸。文献报道,二肽和三肽不仅有利于人体快速吸收,而且具有良好的生物活性[23]。Zhu Lijuan等[24]发现大米的Alcalase水解产物在经过模拟胃肠消化后,分子质量大于4 500 Da的肽段逐渐减少,而分子质量小于500 Da的肽段逐渐增加,与本研究结果一致。
2.3.3 模拟胃肠道消化对不同分子质量APG抗氧化活性的影响
2.3.3.1 模拟胃肠道消化过程中APG的羟自由基清除能力变化
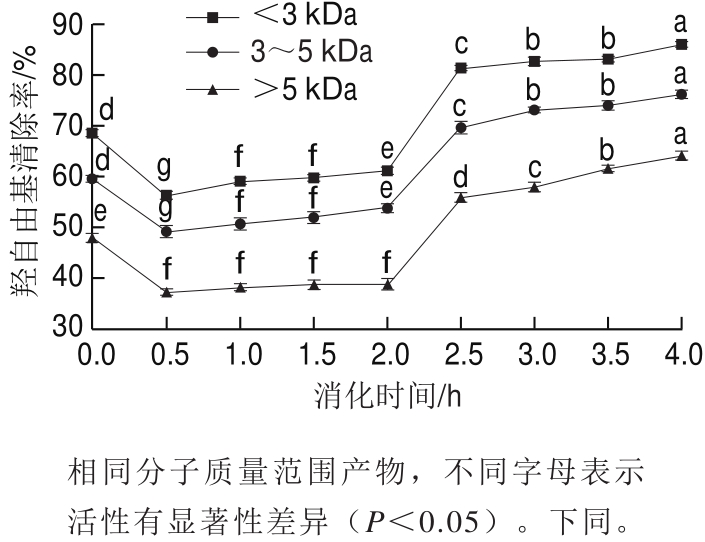
图8 模拟胃肠消化中肽的羟自由基清除能力的变化
Fig.8 Changes in hydroxyl radical scavenging capacity of antioxidant peptides during in vitro simulated digestion
如图8所示,小于3 kDa、3~5 kDa和大于5 kDa的空白样品对羟自由基清除能力分别为68.50%、59.39%和47.87%。经过胃蛋白酶消化0.5 h后,其羟自由基清除能力均显著降低,分别为56.25%、49.06%和37.19%(P<0.05);继续在胃里面消化1~2 h基本上没有显著改变。但经过第二阶段胰酶消化后,小于3 kDa、3~5 kDa和大于5 kDa的样品对羟自由基清除能力分别提高到86.34%、76.65%和64.35%(P<0.05),这与张淼[25]对玉米蛋白水解物经过模拟胃肠道消化后产物的羟自由基清除能力大大增加的研究结果相似。综上,经过模拟胃肠道消化后,不同分子质量的APG对羟自由基清除能力都有所提高,这可能是因为不同分子质量的APG在消化后生成的肽段或游离氨基酸更容易供给质子而具有更强的抗氧化活性[26-27]。
2.3.3.2 模拟胃肠道消化过程中APG的DPPH自由基清除能力变化
如图9所示,消化前小于3 kDa、3~5 kDa和大于5 kDa的样品对DPPH自由基清除能力分别为70.52%、51.63%和29.74%。经过胃蛋白酶消化0.5 h后,其清除能力分别提高到78.68%、59.34%和44.82%(P<0.05),进一步用胃蛋白酶消化DPPH自由基清除能力均没有显著提高。在第二阶段模拟肠道消化过程中,小于3 kDa、3~5 kDa和大于5 kDa样品经过胰酶消化0.5 h后,DPPH自由基的清除能力分别从78.93%显著降低至37.24%、从59.68%显著降低至28.24%、从42.93%显著降低至20.24%(P<0.05)。第二阶段模拟消化结束后,小于3 kDa、3~5 kDa和大于5 kDa样品的消化产物的DPPH自由基清除能力分别只有35.37%、27.63%和20.05%。You Lijun等[28]研究模拟胃肠道消化中泥鳅多肽清除DPPH自由基清除能力在胃中没有显著变化,在肠道中显著下降,与本研究结果一致。
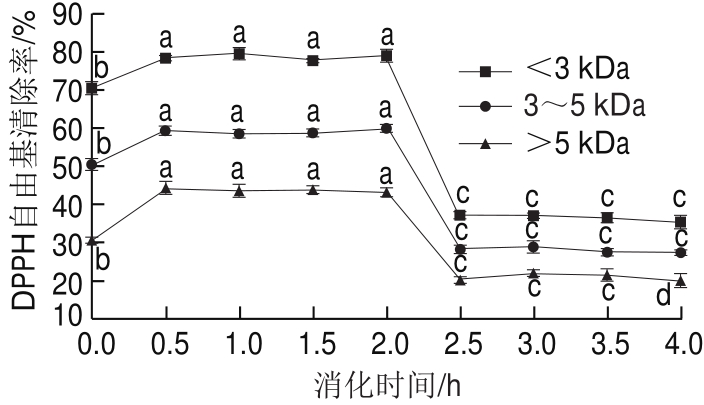
图9 模拟胃肠消化中肽的DPPH自由基清除能力变化
Fig.9 Changes in DPPH radical scavenging capacity of antioxidant peptides during in vitro simulated digestion
由图9可看出,小于3 kDa、3~5 kDa和大于5 kDa的样品在模拟胃部消化阶段对DPPH自由基清除能力要高于模拟肠道消化阶段,这可能是由于模拟胃部消化过程中,更多的疏水性氨基酸侧链被暴露[29],而DPPH是一种油溶性的自由基,这就使得消化产物与DPPH自由基能够更好地接触反应,从而获得较高的DPPH自由基清除率;当进入模拟肠道消化阶段,更多的游离氨基酸和小肽的生成导致消化产物的亲水性提升,不同分子质量抗氧化肽模拟消化产物极性的增加使得它更难捕获脂溶性的DPPH自由基从而降低了DPPH自由基清除率[30]。模拟胃部消化过程中,小于3 kDa比3~5 kDa和大于5 kDa的样品具有更高的DPPH自由基清除率,可能此阶段小于3 kDa比3~5 kDa和大于5 kDa样品具有更多的疏水性氨基酸侧链,而进入模拟肠道消化阶段,大于5 kDa、3~5 kDa比小于3 kDa样品具有更多亲水性小肽及游离氨基酸,从而使DPPH自由基清除率水平低于小于3 kDa样品。
2.3.3.3 模拟胃肠道消化过程中APG的还原力变化

图10 模拟胃肠消化中还原力的变化
Fig.10 Changes in reducing power of antioxidant peptides during in vitro simulated digestion
如图10所示,消化前小于3 kDa、3~5 kDa和大于5 kDa的样品的还原力分别为0.457、0.358和0.291。经过1 h的模拟胃消化后,还原力分别显著降低到0.393、0.336和0.274(P<0.05),进一步用胃蛋白酶消化1 h而还原力并没有显著变化(P>0.05)。在第二阶段模拟肠道消化过程中,小于3 kDa、3~5 kDa和大于5 kDa的样品经胰酶消化1 h后,还原力分别显著提高至0.674、0.554、0.473(P<0.05)。整个模拟消化过程结束后,小于3 kDa、3~5 kDa、大于5 kDa样品的消化产物的还原力比消化前分别提高了50.98%、64.53%、67.35%,这与Zhu Lijuan等[24]对大米水解物在经过模拟胃消化道消化1 h和模拟肠消化道消化2 h后产物的还原力大大增加的研究结果相似。
Dávalos等[31]研究发现酸性氨基酸或碱性氨基酸残基对酶解物的抗氧化能力影响极大,主要是由于这些氨基酸的羟基和氨基参与了金属离子的反应。因此对于模拟胃肠道消化过程中3 种样品的还原能力均先下降后上升这一实验结果,原因可能是肽进入胃部消化阶段后生成了较多的酸性氨基酸或碱性氨基酸残基而阻碍了其抗氧化作用的发挥;随着消化的进行,肽键不断断裂使更多极性或带电荷的氨基酸侧链基团暴露出来而使其还原能力逐渐提高[32]。模拟胃部消化过程中,小于3 kDa样品比3~5 kDa和大于5 kDa样品具有更高的还原力,可能原因是此阶段3~5 kDa和大于5 kDa样品比小于3 kDa样品具有更多的酸性氨基酸或碱性氨基酸残基,而进入模拟肠道消化阶段,小于3 kDa样品比3~5 kDa和大于5 kDa样品具有更多极性或带电荷的氨基酸侧链基团,从而使其还原力高于3~5 kDa和小于3 kDa样品。
APG制备的最佳工艺条件为:金瓜籽粕质量分数为6%,添加碱性蛋白酶质量分数3%,在pH 8.5的体系中55 ℃酶解90 min,在此条件下酶解产物的羟自由基清除率、DPPH自由基清除率、还原力分别为(58.19±0.80)%、(60.27±1.73)%、0.49±0.01。
在模拟胃肠道消化过程中,游离氨基酸的释放主要在肠道中,小于3 kDa、3~5 kDa和大于5 kDa的APG的最终消化产物中含游离氨基酸分别为41.72%、36.94%和33.93%,其主要是分子质量小于500 Da的肽段,占比分别为73.50%、60.15%和53.30%。
不同分子质量APG不仅能耐胃肠道的酶系,而且生成了一些抗氧化活性更强的肽段,使消化产物的抗氧化活性更高。小于3 kDa、3~5 kDa和大于5 kDa的APG经模拟消化后的最终产物与消化前相比,羟自由基的清除能力分别提高到86.34%、76.65%和64.35%,还原力分别提高了50.98%、64.53%、67.35%。
[1] 杨忠. 崇明金瓜种质资源的评价与利用[D]. 上海: 上海交通大学,2010: 1-7.
[2] 宋忠明, 蔡希义, 朱忠南, 等. 崇明金瓜种质资源鉴定及加工性状的综合评价[J]. 上海农业学报, 2007, 23(3): 132-134.
[3] KORHONEN H, PIHLANTO A. Bioactive peptides: production and functionality[J]. International Dairy Journal, 2006, 16(9): 945-960.doi:10.1016/j.idairyj.2005.10.012.
[4] TONG L M, SASAKI S, MCCLEMENTS D J, et al. Mechanisms of the antioxidant activity of a high molecular weight fraction of whey[J].Journal of Agricultural and Food Chemistry, 2000, 48(5): 1473-1478.doi:10.1021/jf991342v.
[5] 李景军, 陈正行, 毛健. 抑制羟自由基的粟水溶性蛋白胁迫培养基试验[J]. 江苏大学学报(自然科学版), 2008, 29(1): 9-12.
[6] MENDIS E, RAJAPAKSE N, KIM S K. Antioxidant properties of a radical-scavenging peptide purified from enzymatically prepared fish skin gelatin hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2005, 53(3): 581-587.doi:10.1021/jf048877v.
[7] GUERRA A, ETIENNE-MESMIN L, LIVRELLI V, et al. Relevance and challenges in modeling human gastric and small intestinal digestion[J]. Trends in Biotechnology, 2012, 30(11): 591-600.doi:10.1016/j.tibtech.2012.08.001.
[8] WU H C, CHEN H M, SHIAU C Y. Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus)[J]. Food Research International, 2003,36(9/10): 949-957.doi:10.1016/S0963-9969(03)00104-2.
[9] AMAROWICZ R, NACZK M, SHAHIDI F. Antioxidant activity of various fractions of non-tannin phenolics of canola hulls[J].Journal of Agricultural and Food Chemistry, 2000, 48(7): 2755-2759.doi:10.1021/jf9911601.
[10] AHMADI F, KADIVAR M, SHAHEDI M. Antioxidant activity of Kelussia odoratissima Mozaff. in model and food systems[J]. Food Chemistry, 2007, 105(1): 57-64.doi:10.1016/j.foodchem.2007.03.056.
[11] SZOŁTYSIK M, NIEDBALSKA J, DABROWSKA A, et al. Use of enzymatic hydrolysis of casein for the preparation of peptides with antioxidative activity[J]. Przemysl Chemiczny, 2012, 91(5): 1014-1019.
[12] RUIZ J Á G, RAMOS M, RECIO I. Angiotensin converting enzymeinhibitory activity of peptides isolated from Manchego cheese. stability under simulated gastrointestinaldigestion[J]. International Dairy Journal, 2004, 14(12): 1075-1080.doi:10.1016/j.idairyj.2004.04.007.
[13] 张苏平, 邱伟强, 卢祺, 等. 全自动氨基酸分析仪法测定4 种贝类肌肉中谷胱甘肽和游离氨基酸含量[J]. 食品科学, 2017, 38(4): 170-176.doi:10.7506/spkx1002-6630-201704027.
[14] 高瑀珑, 郑锐, 王玉梅, 等. 菜籽分离蛋白分子质量分布及酶解条件的研究[J]. 中国粮油学报, 2014, 29(6): 38-45.
[15] 徐贤. 高压预处理-酶解制备大豆蛋白抗氧化肽的研究[D]. 郑州: 郑州轻工业学院, 2009: 11-20.
[16] 桂兴芬, 吕文华, 康爱英. 生物化学[M]. 3版. 郑州: 郑州大学出版社,2008: 194-267.
[17] HAZIME R, NGUYEN Q H, FERRONATO C, et al. Optimization of imazalil removal in the system UV/TiO2/K2S2O8 using a response surface methodology (RSM)[J]. Applied Catalysis B Environmental,2013, 132/133: 519-526.doi:10.1016/j.apcatb.2012.12.021.
[18] XU Q, SHEN Y, WANG H, et al. Application of response surface methodology to optimise extraction of flavonoids from fructus sophorae[J]. Food Chemistry, 2013, 138(4): 2122-2129.doi:10.1016/j.foodchem.2012.11.099.
[19] 邬建敏. 蛋白质与酶在固相表面的吸附行为对其生物活性及稳定性影响的研究[D]. 杭州: 浙江大学, 2006: 41-48.
[20] 谢韵. 蛋白质界面吸附取向和构象的分子模拟研究[D]. 广州: 华南理工大学, 2010: 41-59.
[21] ADIBI S A, MERCER D W. Protein digestion in human intestine as ref l ected in luminal, mucosal, and plasma amino acid concentrations after meals[J]. Journal of Clinical Investigation, 1973, 52(7): 1586-1594.doi:10.1172/JCI107335.
[22] HERNÁNDEZ-LEDESMA B, DÁVALOS A, BARTOLOMÉ B, et al.Preparation of antioxidant enzymatic hydrolysates from alphalactalbumin and beta-lactoglobulin. identif i cation of active peptides by HPLC-MS/MS[J]. Journal of Agricultural and Food Chemistry, 2005,53(3): 588-593.doi:10.1021/jf048626m.
[23] RUFIN-HENARES J A, MORALES F J. Effect of in vitro enzymatic digestion on antioxidant activity of coffee melanoidins and fractions[J].Journal of Agricultural and Food Chemistry, 2007, 55(24): 10016-10021.doi:10.1021/jf0718291.
[24] ZHU Lijuan, CHEN Jie, TANG Xueyan, et al. Reducing, radical scavenging, and chelation properties of in vitro digests of alcalasetreated zein hydrolysates[J]. Journal of Agricultural and Food Chemistry, 2008, 56(8): 2714-2721.doi:10.1021/jf703697e.
[25] 张淼. 玉米蛋白及其水解物模拟体外消化产物抗氧化活性研究[D].呼和浩特: 内蒙古农业大学, 2016: 34-41.
[26] PANAYIOTIDIS M I, RANCOURT R C, ALLEN C B, et al.Hyperoxia-induced DNA damage causes decreased DNA methylation in human lung epithelial-like A549 cells[J]. Antioxidants & Redox Signaling, 2004, 6(1): 129-136.doi:10.1089/152308604771978435.
[27] QIAN Z J, JUNG W K, BYUN H G, et al. Protective effect of an antioxidative peptide purif i ed from gastrointestinal digests of oyster,Crassostrea gigas against free radical induced DNA damage[J].Bioresource Technology, 2008, 99(9): 3365-3371.doi:10.1016/j.biortech.2007.08.018.
[28] YOU Lijun, ZHAO Mouming, REGENSTEIN J M, et al. Changes in the antioxidant activity of loach (Misgurnus anguillicaudatus)protein hydrolysates during a simulated gastrointestinal digestion[J]. Food Chemistry, 2010, 120(3): 810-816.doi:10.1016/j.foodchem.2009.11.018.
[29] CHEN H M, MURAMOTO K, YAMAUCHI F. Structural analysis of antioxidative peptides from soybean beta-conglycinin[J]. Journal of Agricultural and Food Chemistry, 1995, 43(3): 574-578.doi:10.1021/jf00051a004.
[30] MENDIS E, RAJAPAKSE N, BYUN H G, et al. Investigation of jumbo squid (Dosidicus gigas) skin gelatin peptides for their in vitro antioxidant effects[J]. Life Sciences, 2005, 77(17): 2166-2178.doi:10.1016/j.lfs.2005.03.016.
[31] DÁVALOS A, MIGUEL M, BARTOLOMÉ B, et al. Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis[J]. Journal of Food Protection, 2004, 67(9): 1939-1944.doi:10.4315/0362-028X-67.9.1939.
[32] 张冠亚, 黄晓君, 聂少平, 等. 体外模拟3 种消化液对铁皮石斛多糖的消化作用[J]. 食品科学, 2014, 35(23): 279-283.doi:10.7506/spkx1002-6630-201423054.
Effect of in Vitro Digestion on Antioxidant Activity of Antioxidant Peptides from Marrow Seeds(Cucurbita pepo L. var. medullosa Alef.)