
图1 三元混合物的单纯型增强质心混料设计图
Fig.1 Schematic diagram of enhanced simple-centroid mixture design
植物精油是从草本植物的花、苞、叶、枝、根、树皮、果实、种子和树脂等中,以蒸馏或压榨等方式提炼出来的特有的芳香味油状液体[1-3]。研究报道植物精油具有广谱的抗微生物活性,能够抑杀细菌、真菌和病毒[4-6]。精油作为天然提取物,是新兴的具有良好抑菌效果的抑菌剂[7-8],利用单一精油组合的协同性和加和性是提高精油抗菌功效的新方法[9]。近年来由于化学合成防腐剂的使用对消费者的健康和环境产生不利的影响;同时细菌、真菌等食源性微生物的耐药性问题也已引起了世界各国的广泛关注[10-11]。因此,开发研究天然混合精油抑菌药物越来越受到科研工作者的关注。
采后病害是导致果蔬供应链中经济损失的主要因素之一,可能发生在供应链的各个环节,如采收、分级、包装、运输、贮藏等,同时采后果蔬侵染病害中的一些真菌病原物能够产生毒素,对人体健康产生潜在危害[12]。精油作为芳香植物体中提取的挥发性混合化合物,具有抑菌活性和抗氧化性,被认为是天然环保的控制食源性致病微生物的抗菌药物替代品[13-14]。研究表明植物精油的主要成分为萜烯、醇、酯、醛、酚类和一些含烃类化合物[15],不同精油之间不同类型的化合物含量存在差异,且不同类型的化合物抑菌活性不同,从而导致抑菌效果差异显著;混合植物精油由于化合物之间的组合相互作用,对目标菌株具有多靶点抑菌作用[16]。据报道,食品需要高浓度精油才能达到较佳的抑菌效果[9,17],但这些高浓度的精油则会改变食物感官特性或者产生毒性[1,9,18],为了减少精油的有效剂量并提高其抑菌效果,研究表明可以将不同精油进行组合[19-20];因此本实验通过测定试用菌株的最小抑菌浓度(minimum inhibitory concentration,MIC)、最小杀菌浓度(minimum bactericidal concentration,MBC)和菌落直径,利用单纯型增强质心混料设计数学模型设计3 种植物精油混合作用下对4 种果蔬真菌的最优混料比例,以实现在较低精油用量下较优的抑菌效果,为天然抑菌剂减量使用提供方法指导。
新疆孜然采购于甘肃敦煌种业有限公司;大红袍花椒购于甘肃省天水市张家川回族自治县;黄芥子采购于安徽亳州市中药材市场。
葡萄糖 国药集团化学试剂有限公司;琼脂粉、Tween-80、噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT) 北京Solarbio公司。
粉红单端孢(Trichothecium roseum)、扩展青霉(Penicillium expansum)、互隔交链孢(Alternaria alternata)、硫色镰刀菌(Fusarium sulphureum)分离自发病果实,保存于甘肃农业大学采后生物学与技术实验室。
LDZX-30KBS立式压力蒸汽灭菌锅 上海申安医疗器械有限公司;SW-CJ-2FD型超净工作台 苏州安泰空气技术有限公司;DHG-9245A型电热鼓风箱、DHP-9162型恒温培养箱 上海一恒科技有限公司;CX21FS1C生物显微镜 日本奥林巴斯有限公司;CN69M/FW80高效植物样品粉碎机 北京中西远大科技有限公司;GC6890N/MS5973N型气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)仪 美国安捷伦科技有限公司。
1.3.1 精油的制备及GC-MS分析
采用水蒸气蒸馏法制备精油,收集精油后用无水硫酸钠干燥,并于4 ℃冰箱中保存备用。
参照李伟等[21]的方法,GC条件:HP-5MS弹性石英毛细管柱(30 mh250 μm,0.25 μm)。柱温:65~250 ℃程序升温。初始温度为65 ℃,保持5 min;以8 ℃/min的速率升至180 ℃,保持2 min;再以20 ℃/min的速率升至250 ℃,保持2 min。载气为高纯氮气,柱流量为1.0 mL/min,以分流方式进样,分流比为20∶1,进样口温度为250 ℃。质谱条件:采用电子电离方式,电离能量70 eV,离子源温度250 ℃,接口温度230 ℃,溶剂采集方式Scan,容剂迟延时间4.2 min。间隔时间0.3 s,开始采集时m/z 50,结束时m/z 550,进样量0.2 μL。采用NIST02.1标准质谱库进行检索、分析。
1.3.2 植物精油抑菌效力测定
1.3.2.1 培养基的制备
分别配制马铃薯葡萄糖琼脂固体(potato dextrose agar,PDA)培养基和马铃薯葡萄糖液体(potato dextrose broth,PDB)培养基待用(自然pH值)。
1.3.2.2 孢子悬浮液的配制
分别取25 ℃下培养7 d的4 种真菌(粉红单端孢、扩展青霉、互隔交链孢、硫色镰刀菌)培养皿,加入含有体积分数为0.05% Tween-80的无菌水约10 mL,用玻璃涂布棒刮下平板上的真菌孢子,然后转入50 mL的三角瓶中,4 层纱布过滤,充分振荡后,滤液用血球计数器计数,稀释至浓度为1h106~3h106 个/mL备用。
1.3.2.3 菌落直径的测定
采用琼脂纸片扩散法测定抑菌活性,参考Cakir等[22]的方法并略作修改,使用直径9 cm的培养皿,每皿加入20 mL的PDA培养基,待培养基凝固后,用无菌金属打孔器(d=8 mm)在平板中央处打一小孔,去除孔内培养基,再用移液枪吸取一滴未凝固的PDA培养基溶液封底,待到孔内琼脂凝固后,加入5 μL菌悬液至完全吸收后将平板倒置,用无菌镊子取一滤纸片(d=25 mm)置于皿盖中央,在滤纸上加入100 μL无菌水,再加入3 μL精油,以不添加精油的设为空白对照,每次实验重复3 次。以上操作均在无菌条件下进行,然后在28 ℃培养箱内恒温孵育72 h。采用十字交叉法测定菌落直径,结果取其平均值,菌落直径越大则说明该种精油对此真菌的抑菌效果越差,反之则抑菌效果越好。
1.3.2.4 MIC和MBC测定
通过采用微量稀释法测定每种菌株的MIC和MBC,参考Haba[23]和Tian Jun[24]等的方法并略作修改。使用24 微孔板培养,分别配制所需浓度,每孔板分别依次加入1.9 mL含Tween-80(体积分数0.01%)和精油的PDB培养基、80 μL菌悬液,最后加入20 μL指示剂MTT(0.5 mg/mL)溶液,并略微振动10 min至混匀,然后将微孔板置于28 ℃下恒温孵育24~28 h。在孵育期后,观察孔板中指示剂(MTT)溶液颜色变化情况,并评估菌株生长活性,将MIC视为最低精油抑菌浓度,测定并记录MIC,为防止MTT指示剂颜色变化,继续孵育至72 h,测定MBC,MBC对应于在28 ℃孵育72 h后不产生培养物的精油为最低杀菌浓度,实验每次重复3 次进行。
1.3.2.5 混料设计
为了评估精油的一元、二元、三元混合抑菌效果,使用单纯型增强质心混料设计[25],每种精油所占混合物的百分比范围为0~1,对设计空间比例无限制。
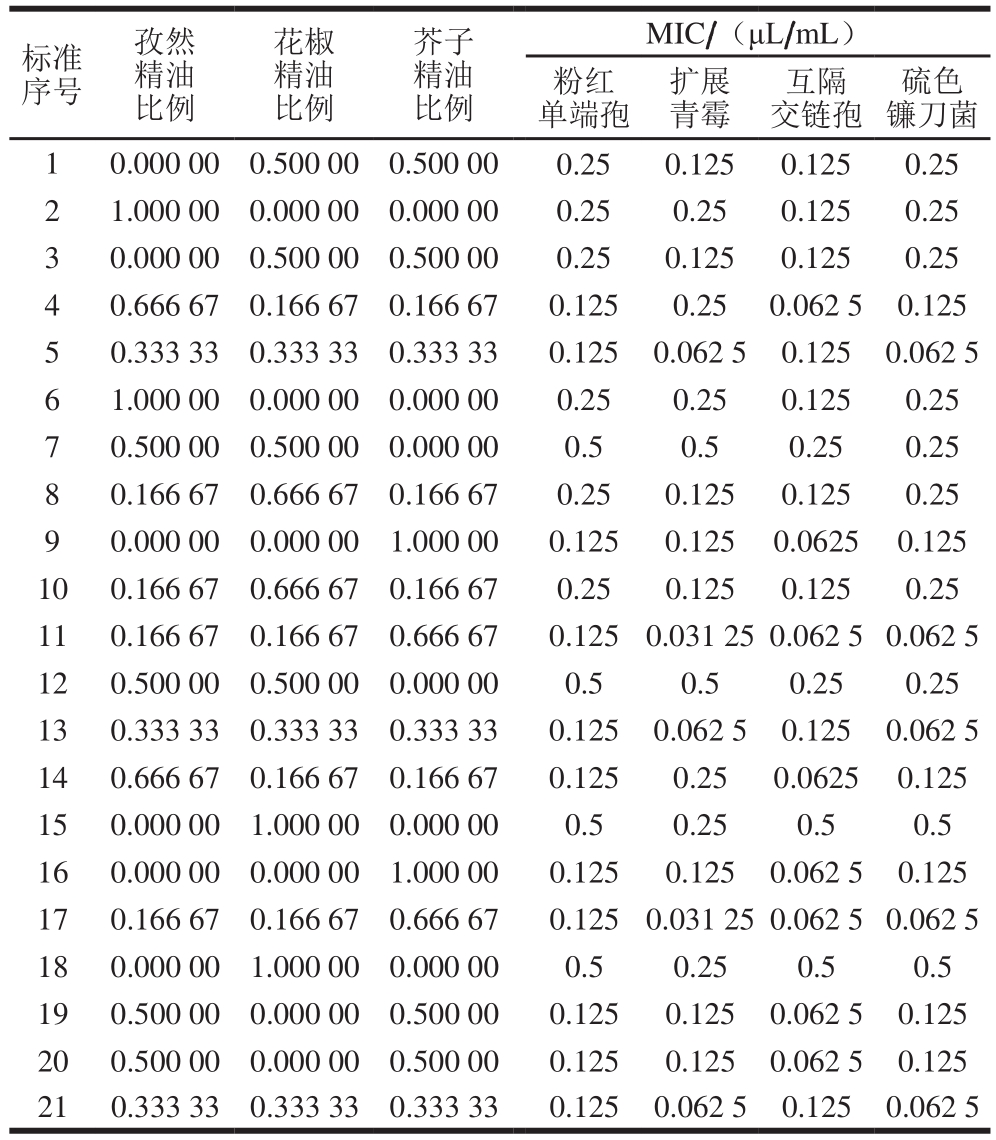
混料实验设计的要点是三角形的3 个顶点(1、2、3)(分别对应于3 种植物精油)、三边中点(4、5、6)、中心点(重心7)和3 个增强点(8、9、10)由三元组合的二进制设计组成(图1);每种真菌的完整实验设计包括21 个实验(表1),其中包含3 个中心点的增强设计,本实验以随机顺序进行。

图1 三元混合物的单纯型增强质心混料设计图
Fig.1 Schematic diagram of enhanced simple-centroid mixture design
表1 不同菌株MIC测定的混料设计矩阵和实验响应值
Table1 Mixture design matrix with experimental MICs against different strains
标准序号硫色镰刀菌1 0.000 00 0.500 00 0.500 00 0.25 0.125 0.125 0.25 2 1.000 00 0.000 00 0.000 00 0.25 0.25 0.125 0.25 3 0.000 00 0.500 00 0.500 00 0.25 0.125 0.125 0.25 4 0.666 67 0.166 67 0.166 67 0.125 0.25 0.062 5 0.125 5 0.333 33 0.333 33 0.333 33 0.125 0.062 5 0.125 0.062 56 1.000 00 0.000 00 0.000 00 0.25 0.25 0.125 0.257 0.500 00 0.500 00 0.000 00 0.5 0.5 0.25 0.258 0.166 67 0.666 67 0.166 67 0.25 0.125 0.125 0.259 0.000 00 0.000 00 1.000 00 0.125 0.125 0.0625 0.1259 0.166 67 0.666 67 0.166 67 0.25 0.125 0.125 0.25 11 0.166 67 0.166 67 0.666 67 0.125 0.031 25 0.062 5 0.062 5 12 0.500 00 0.500 00 0.000 00 0.5 0.5 0.25 0.25 13 0.333 33 0.333 33 0.333 33 0.125 0.062 5 0.125 0.062 5 14 0.666 67 0.166 67 0.166 67 0.125 0.25 0.0625 0.125 15 0.000 00 1.000 00 0.000 00 0.5 0.25 0.5 0.5 16 0.000 00 0.000 00 1.000 00 0.125 0.125 0.062 5 0.125 17 0.166 67 0.166 67 0.666 67 0.125 0.031 25 0.062 5 0.062 5 18 0.000 00 1.000 00 0.000 00 0.5 0.25 0.5 0.5 19 0.500 00 0.000 00 0.500 00 0.125 0.125 0.062 5 0.125 20 0.500 00 0.000 00 0.500 00 0.125 0.125 0.062 5 0.125 21 0.333 33 0.333 33 0.333 33 0.125 0.062 5 0.125 0.062 5孜然精油比例花椒精油比例芥子精油比例MIC/(μL/mL)粉红单端孢扩展青霉互隔交链孢
因变量是对4 种果蔬真菌粉红单端孢、扩展青霉、互隔交链孢、硫色镰刀菌的抑菌效果,通过1.3.2.4节所述的微量稀释法测得MIC,然后将数据拟合并应用最小二乘回归的特殊三次多项式模型中,以预测方程式中的未知系数。
式中:Y是响应值;bx是单组分响应值效应大小;bxy是双组分响应值效应的大小;bxyz是3 个组分对响应值交互效应的大小;Xx表示混合物中组分的比例。
本实验数据分析及响应面图采用Minitab 17软件处理,用Duncan’s法进行多重显著性分析和标准偏差计算,菌落直径柱状图采用Origin 9.1软件处理。
从孜然、花椒、芥子原料中提取的精油含量分别为2.29、2.52、1.12 mL/g。
通过GC-MS分析,孜然精油检测48 种化合物,占总量的99.93%(质量分数,下同),主要成分为枯茗醛(21.89%)、β-蒎烯(20.49%)、γ-萜品烯(18.37%)、4-丙-2-环己基-1,4-二烯-1-甲醛(10.98%)、p-伞花烃(8.89%)、4-丙-2-环己基-3-烯-1-甲醛(7.95%);据Teneva等[26]报道孜然精油中的25 种化合物主要包括枯茗醛(30.834%)、3-蒈烯-10-醛(17.223%)、β-蒎烯(14.837%)、γ-萜品烯(11.928%)、2-蒈烯-10-醛(8.228%)和p-伞花烃(6.429%);同时李大强[27]报道中国新疆和甘肃的孜然精油主要由萜类化合物组成,包括萜醛、萜烯、萜醇,从化合物种类来看,两地精油的主要成分均有2-蒈烯-10-醛、枯茗醛、3-蒈烯-10-醛、γ-松油烯、p-伞花烃、α-蒎烯等。
花椒精油检测出43 种化合物,占总量的95%,主要成分为芳樟醇(15.05%)、双戊烯(11.79%)、乙酸芳樟酯(11.17%)、β-蒎烯(9.33%)、(-)-4-萜品醇(6.04%)、桉叶油醇(4.62%);唐裕芳等[28]的研究发现花椒精油中主要有22 种化学成分,包括烯醇(芳樟醇29.69%、4-松油醇10.79%、α-松油醇8.35%)及其酯类衍生物(芳樟醇酯36.89%)、萜烯类化合物6.76%(β-月桂烯、(+)-2-蒈烯、柠檬烯、α-侧柏烯、顺-α-罗勒烯、γ-松油烯、α-石竹烯)、苯酚、桉叶油素等主要成分。
芥子精油检测出22 种化合物,占总量的99.97%,主要成分为烯丙基异硫氰酸酯(50.97%)、4-异硫氰基-1-丁烯(44.91%);陈密玉等[29]报道芥子精油的主要化学成分为烯丙基异硫氰酸酯(35.897%)、4-异硫氰基-1-丁烯(57.658%),这两种化合物的相对含量占总含量的93.555%,由此可见,芥子精油是以含有异硫氰基化合物为主的混合物。
总体而言,植物精油是一类含有烃类与其他物质(如萜烯、醇、酯、醛和酚类化合物)的混合物,其中萜烯、醇、酯、醛和酚类化合物具有抑菌活性[15];由植物精油提取出的化合物组合可能受植物品种、气候条件、地理区域及植物收集季节的影响[30],造成不同报道之间同种精油的组分存在部分差异。
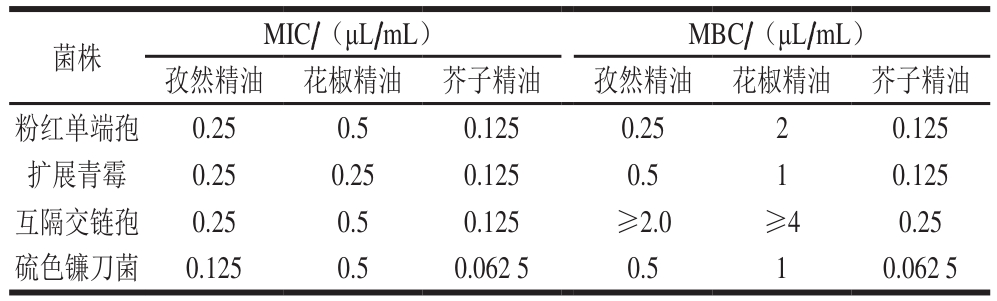
表2 3 种精油对4 种果蔬真菌的抑菌活性
Table2 Antimicrobial activity of three essential oils against four fungi
菌株 MIC/(μL/mL)MBC/(μL/mL)孜然精油 花椒精油 芥子精油 孜然精油 花椒精油 芥子精油粉红单端孢 0.25 0.5 0.125 0.25 2 0.125扩展青霉 0.25 0.25 0.125 0.5 1 0.125互隔交链孢 0.25 0.5 0.125 ≥2.0 ≥4 0.25硫色镰刀菌 0.125 0.5 0.062 5 0.5 1 0.062 5
所测试的精油通过微量稀释方法和琼脂纸片扩散法来测定其抑菌效果(表2、图2),在测试的菌株中,互隔交链孢的耐药性最强(MBC≥2.0 μL/mL),且孜然、花椒精油不能在2.0 μL/mL条件下杀死该菌株;相反,硫色镰刀菌相比于其他3 种菌株是最敏感的菌株;从菌落直径和MIC可以看出,芥子精油相比于孜然精油、花椒精油,其对4 种菌株均具有较强的抑菌效果,且花椒精油的抑菌效果最弱。根据每种菌株在不同精油处理组间显著性分析可知,混合精油和单种芥子精油处理后抗菌效果最佳;互隔交链孢相比于其他3 种菌株菌落直径较大、活力最强,但芥子精油对其抑菌效果最佳,这可能与精油的化学成分组成和所测目标菌株的种类有关,芥子精油所含的异硫氰基化合物的质量分数达到95.88%,而孜然、花椒精油所含的萜类、醇类、酯类和酚类化合物相对复杂,且各物质含量相对比例较少。据报道,不同的植物精油对同一种菌的抑制活性不同,如丁香精油、百里香酚和莳萝精油对链格孢菌的MIC分别为600 μg/mL、2 μL/mL和0.5 μL/mL[31-33];同一种精油对不同菌种的抑制效果也存在差异,亚香茅精油对炭疽菌的抗性很强,当添加量达到0.2%时平板中没有检出菌落,对柯柯豆毛色二孢的抑制作用较差,添加量为2%才可以完全抑制菌的生长[34]。由此可知,抑菌强弱与所用精油和所测目标菌株种类有关。
表3 不同菌株在混合精油处理下的响应模型方差分析
Table3 Analysis of variance for the antifungal activity of oil blends against different strains
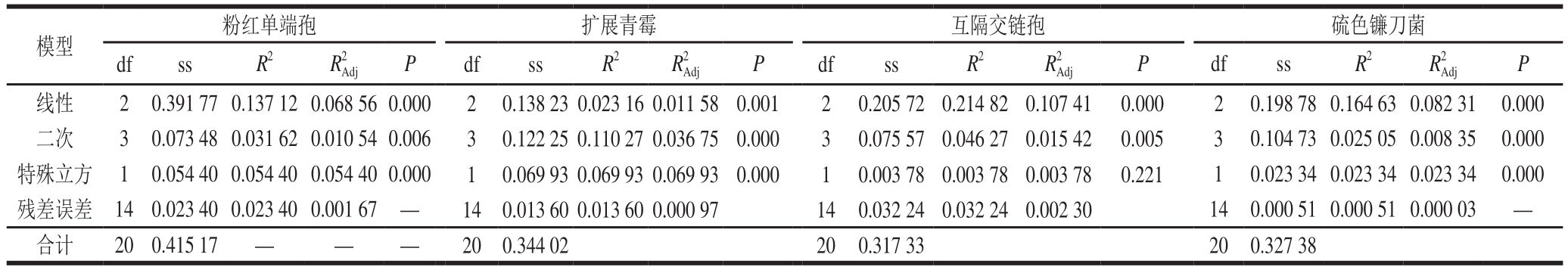
注:df.自由度;ss.平方和;R2.确定系数;R2 Adj.调整系数;P.差异显著性。
模型 粉红单端孢 扩展青霉 互隔交链孢 硫色镰刀菌df ss R2 R2 Adj P df ss R2 R2 Adj P df ss R2 R2 Adj P df ss R2 R2 Adj P线性 2 0.391 77 0.137 12 0.068 56 0.000 2 0.138 23 0.023 16 0.011 58 0.001 2 0.205 72 0.214 820.107 41 0.000 2 0.198 78 0.164 63 0.082 31 0.000二次 3 0.073 48 0.031 62 0.010 54 0.006 3 0.122 25 0.110 27 0.036 75 0.000 3 0.075 57 0.046 270.015 42 0.005 3 0.104 73 0.025 05 0.008 35 0.000特殊立方 1 0.054 40 0.054 40 0.054 40 0.000 1 0.069 93 0.069 93 0.069 93 0.000 1 0.003 78 0.003 780.003 78 0.221 1 0.023 34 0.023 34 0.023 34 0.000残差误差 140.023 40 0.023 40 0.001 67— 140.013 60 0.013 60 0.000 97 ü 140.032 240.032 240.002 30 ü 140.000 51 0.000 51 0.000 03 —合计200.415 17— — —200.344 02ü ü ü 200.317 33ü ü ü 200.327 38ü ü ü
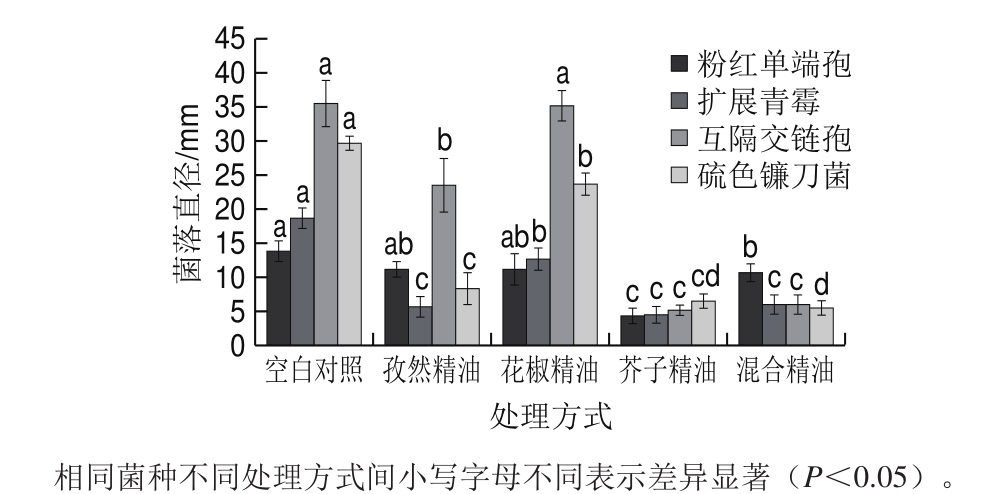
图2 不同处理方式下菌株的菌落直径
Fig.2 Diameters of inhibition zones of fungal strains when exposed to individual and blended essential oils
研究混合精油之间相互抑菌作用较为复杂,要根据混合精油比例关系和其化合物组成成分进行量化分析,才能确保结果的可靠性。棋盘和时间抑菌法曲线是评估混合精油抑菌效果的最常用的方法[9,35-36],但其无法得出最佳的混合比以及拟合出最佳混合响应值。因此,本实验采用单纯型增强质心混料设计数学模型预测3 种混合精油(孜然精油、花椒精油、芥子精油)对4 种果蔬真菌(粉红单端孢、扩展青霉、互隔交链孢、硫色镰刀菌)的抑菌效果。
2.3.1 建立响应预测模型
通过1.3.2.5节方法,对实验数据进行单纯型增强质心混料设计响应分析(表1),并为每种菌株建立响应预测方程,通过特殊立方模型描述响应变量与因子之间的关系,确定系数R2和调整后的系数R2分析所选模型数据拟合的最佳组合(表3),再根据统计学方差分析确定最优回归模型(表3)。通常拟合模型系数为负表示降低因子响应变量能力,为正表示增强因子响应变量能力。本研究应用混料设计数学模型的目的是提高混合精油抑菌联合作用,即最小响应变量(MIC),因此,系数为负表示混合精油相关因素增加抗菌作用的能力。
2.3.2 混合精油相互作用的影响
据报道,不同的化合物相互作用可以提高或者降低精油的抑菌效果[9]。其相互作用可以产生4 种类型的效果:无关、相加、拮抗和协同作用。
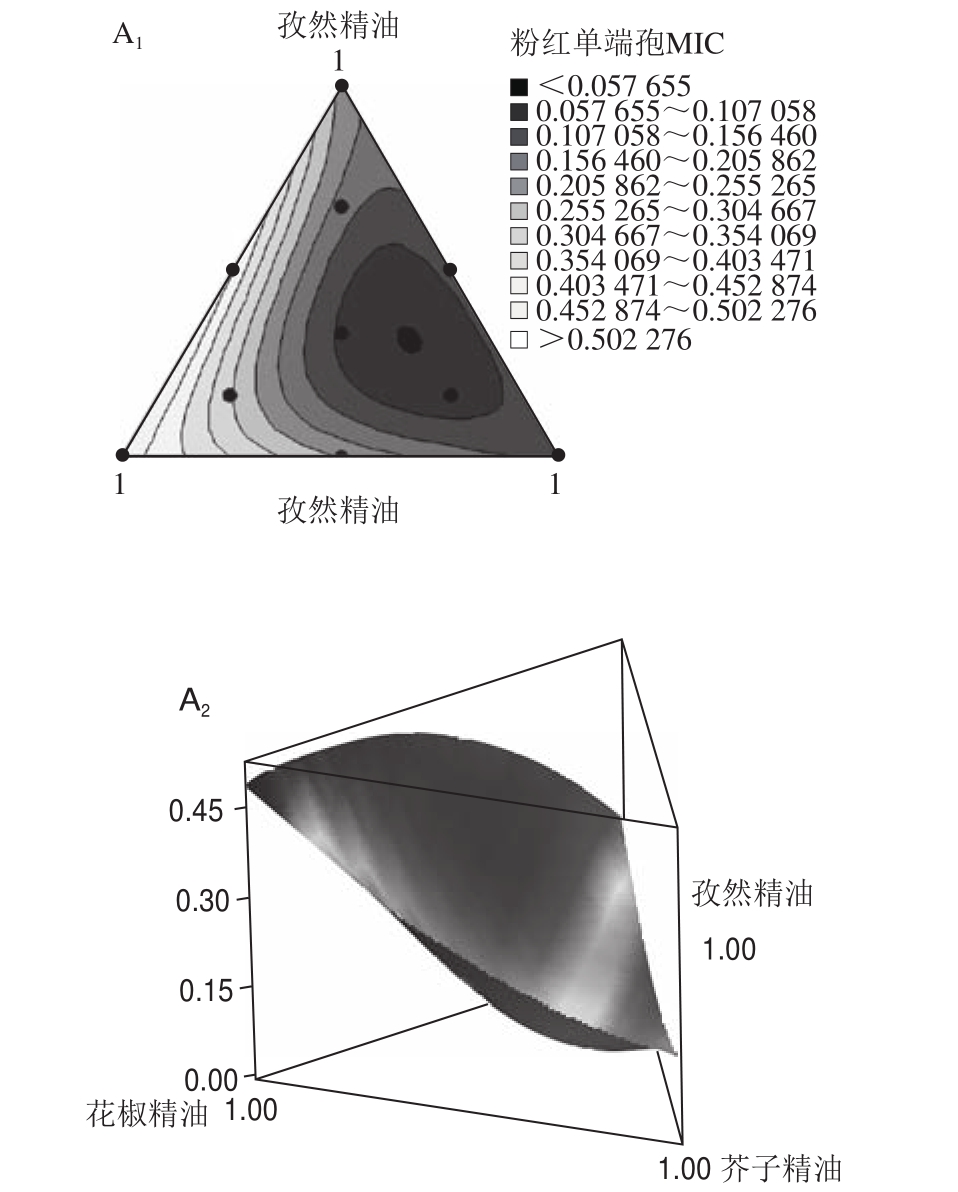

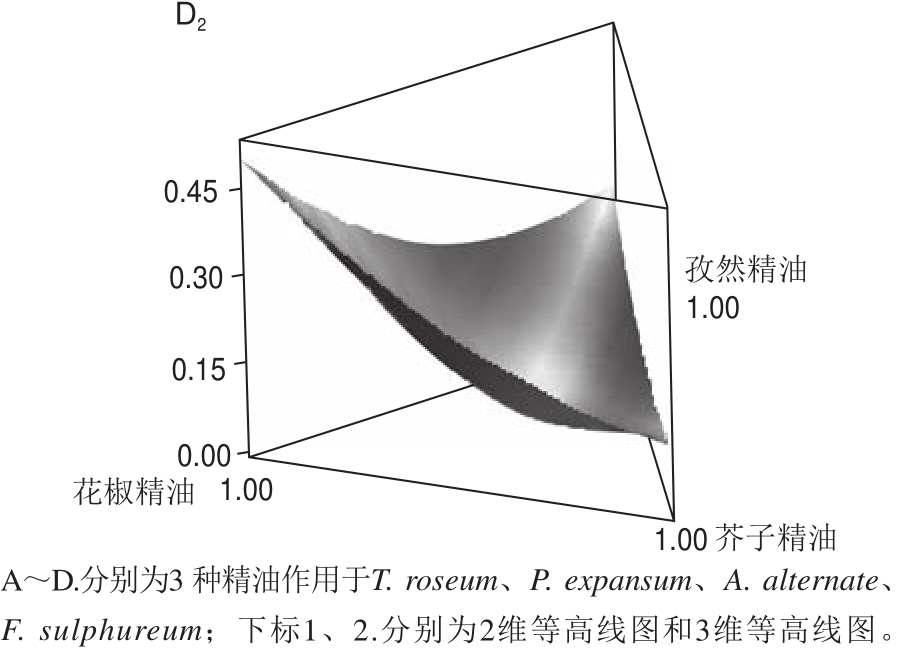
图3 3 种精油对4 种果蔬真菌在不同植物精油组合作用下响应的MIC 2D、3D轮廓图
Fig.3 Response surface and contour plots for the effect of interaction between essential oils on MICs against four fungi
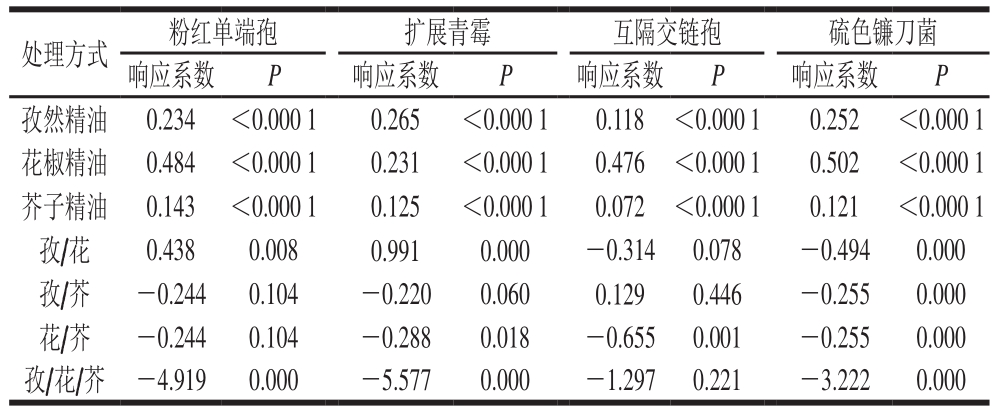
表4 不同模型系数拟合值及差异显著性水平分析
Table4 Response coeff i cients and signif i cance test
注:P<0.05表示差异显著;P<0.01表示差异极显著;P<0.001表示差异高度显著。
处理方式 粉红单端孢 扩展青霉 互隔交链孢 硫色镰刀菌响应系数 P 响应系数 P 响应系数 P 响应系数 P孜然精油 0.234 <0.000 1 0.265 <0.000 1 0.118 <0.000 1 0.252 <0.000 1花椒精油 0.484 <0.000 1 0.231 <0.000 1 0.476 <0.000 1 0.502 <0.000 1芥子精油 0.143 <0.000 1 0.125 <0.000 1 0.072 <0.000 1 0.121 <0.000 1孜/花 0.438 0.008 0.991 0.000 -0.314 0.078 -0.494 0.000孜/芥 -0.244 0.104 -0.220 0.060 0.129 0.446 -0.255 0.000花/芥 -0.244 0.104 -0.288 0.018 -0.655 0.001 -0.255 0.000孜/花/芥 -4.919 0.000 -5.577 0.000 -1.297 0.221 -3.222 0.000
从表4和图3中可以看出,芥子精油的响应系数最小,其次是孜然精油,花椒精油的响应系数较大,这一发现也反映出3 种精油抑菌能力的强弱,精油之间的相互作用程度可能与精油组成成分和受试菌株有关[16]。孜然精油和花椒精油对硫色镰刀菌表现出高度显著的协同抑菌作用(P<0.001),而对互隔交链孢菌没有发现显著的协同作用(P>0.05),然而,这两种精油对粉红单端孢和扩展青霉的响应系数为正,相比另外两种真菌具有相对较弱的抑菌能力,表现出极显著的拮抗作用(P<0.01),据报道酚类单萜与醇类的组合会对部分微生物产生协同抑菌作用[37];孜然精油和芥子精油对硫色镰刀菌具有高度显著的协同抑菌作用(P<0.001),对粉红单端孢、扩展青霉和互隔交链孢不能确定协同或拮抗抑菌作用(P>0.05);花椒精油和芥子精油对扩展青霉、互隔交链孢和硫色镰刀菌具有显著的协同抑菌效应(P<0.05),这一结果可能与花椒精油的主要成分醇类、酯类和芥子精油的主要成分异硫氰基化合物之间的化学组成成分相互作用有关。当3 种精油混合作用时,发现均显示负响应系数,表明对4 种真菌均具有较强的抑菌作用,对粉红单端孢、扩展青霉、硫色镰刀菌均具有高度显著的协同抑菌作用(P<0.001),且扩展青霉、硫色镰刀菌响应值(MIC)距三角形最佳混合区域中心较接近(图3B1、D1),表现出较优混合精油组合下的抑菌效果最佳,这一结果可能与混合精油各化学成分相互作用的原因有关。由于精油的生物活性与其化学成分直接相关,即使是在同一精油内也可能发生显著的变化,导致这些差异性来源可能包括提取的植物部位、植物的生长气候以及生长环境条件[38-39]。精油的生物活性也受其组成组分之间相互作用的影响,即使含量较小的化合物也会由于其化学类别的不同,导致其产生协同作用、拮抗或相加作用的化学反应[15,38,40-41]。
Pekmezovic等[42]利用动力学模型研究百里香、肉桂精油混合作用对黄曲霉菌的抑菌效果,结果表明其混合精油对黄曲霉菌具有协同性和加和性;de Azeredo等[43]发现牛至精油和迷迭香精油对单核增生性李斯特菌和小肠结肠炎耶尔森氏菌具有协同作用;此外Ghabraie等[44]研究发现中国肉桂和肉桂皮精油对4 种致病菌(大肠杆菌、单核增生性李斯特菌、金黄色葡萄球菌和鼠伤寒沙门氏菌)表现出加和的抗菌作用;刘晓丽等[45]研究丁香、肉桂及黑胡椒精油单独和复配后对单核增生性李斯特菌的抑制效果,发现单一精油的最低抑菌浓度分别为96、72、48 mg/L,复合精油最低抑菌浓度为16 mg/L,说明不同精油之间有协同作用,可以增强抑菌效果。通过前人的研究也充分说明精油之间的相互作用对一些细菌、真菌性微生物相比于单种精油作用具有较优的抑菌效果,混料设计数学模型适用于不同种精油组合对受试菌株产生较优的抑菌效果。
2.3.3 混合优化模型分析
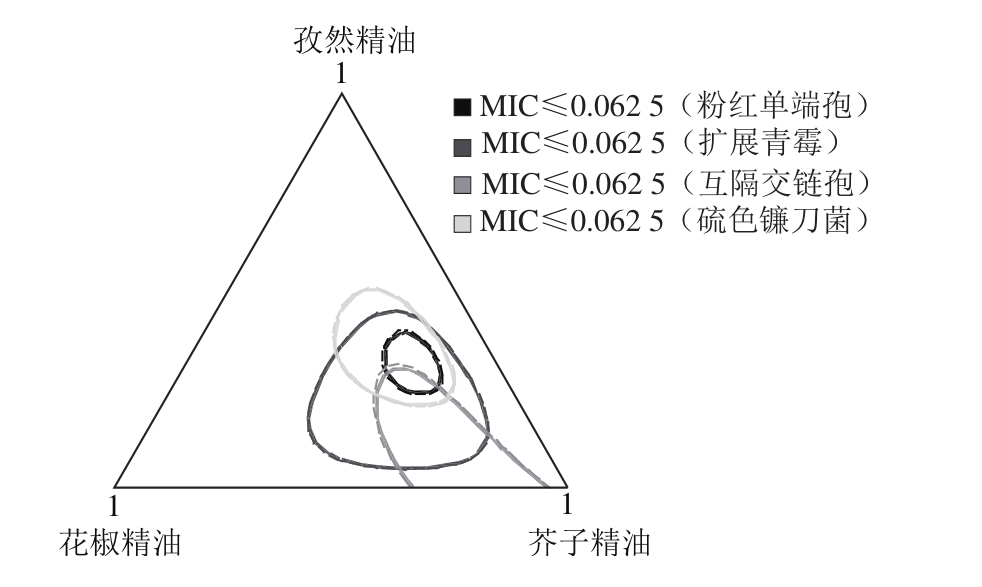
图4 3 种混合植物精油对4 种果蔬真菌最佳抑菌区域
Fig.4 The best antibacterial area of three kinds of mixed plant essential oils against four fruit and vegetable fungi
由图4响应优化分析可知,3 种混合精油对4 种果蔬真菌拟合数据MIC均不大于(0.062 5f0.010 0)μL/mL,其复合合意性大于95.0%,且相对抑菌浓度最小;当3 种混合精油(孜然精油、花椒精油、芥子精油)混料比例分别为36.11%、19.45%、44.44%时满足4 种菌株最佳抑菌反应期望(图5),对4 种果蔬真菌(粉红单端孢、扩展青霉、互隔交链孢、硫色镰刀菌)预测的最佳MIC分别为0.059 50、0.031 56、0.068 69、0.043 82 μL/mL(MIC<<0.125 μL/mL);其合意性分别为93.97%、99.93%、92.01%、97.32%;总体复合合意性达到95.76%,具有显著的期望值。分析得出当3 种精油在较佳比例混合作用4 种菌株时,预测的MIC相对于单种精油作用符合最佳抑菌浓度要求,且对4 种菌株具有相对广谱性的抑菌效果(图4)。

图5 3 种混合植物精油对4 种果蔬真菌的最佳混料组合
Fig.5 Optimum blend ratio of three essential oils against four fungi in fruits and vegetables
通过混合优化后的3 种精油(孜然精油、花椒精油、芥子精油)最佳混料比例分别为36.11%、19.45%、44.44%时对4 种果蔬真菌进行体外实验,根据1.3.2.3节操作方法,混合精油处理后的粉红单端孢、扩展青霉、互隔交链孢、硫色镰刀菌菌落直径分别是未用精油处理的77.15%、32.14%、18.54%、16.9%(图2);相比孜然、花椒精油单独作用具有较强的抗菌效果,但略弱于芥子精油单独处理的抑菌效果,这可能是芥子精油的主要成分异硫氰基化合物含量多且单一性强所致;从组间对比也得出3 种精油混合作用时,对4 种菌株具有较强的协同抑菌效果,其对混合后精油敏感强度大小依次是硫色镰刀菌、互隔交链孢、扩展青霉、粉红单端孢。这也充分证明混合精油相对较低浓度下对菌株具有较优的抑菌效果。
混合植物精油相比于单种植物精油在较低浓度下具有较强的抗菌效果。根据混料设计分析得出,组合精油的抑菌功效取决于不同精油的成分与混料比以及受试菌株;在孜然、花椒、芥子混料比例分别为36.11%、19.45%、44.44%时,预测对4 种果蔬真菌具有最佳的抑菌效果,琼脂纸片扩散法体外实验也证明出混合精油相比于单种精油在较小用量下具有较优抑菌效果。通过使用混料设计方法,不仅可以减少精油在抑菌防腐上的用量,而且能够节约成本,为配制新型天然食品防腐剂提供了理论依据。
[1] BURT S. Essential oils: their antibacterial properties and potential applications in foods: a review[J]. International Journal of Food Microbiology, 2004, 94(3): 223-253.doi:10.1016/j.ijfoodmicro.2004.03.022.
[2] SHELEF L A. Antimicrobial effect of spices[J]. Journal of Food Safety, 2007, 6(1): 29-44.doi:10.1111/j.1745-4565.1984.tb00477.x.
[3] CEYLAN E, FUNG D Y C. Antimicrobial activity of spices[J]. Journal of Rapid Methods & Automation in Microbiology, 2004, 12(1): 1-55.doi:10.1111/j.1745-4581.2004.tb00046.x.
[4] ARORA D S, KAUR J. Antimicrobial activity of spices[J].International Journal of Antimicrobial Agents, 1999, 12(3): 257-262.
[5] INOUYE S, TAKIZAWA T, YAMAGUCHI H. Antibacterial activity of essential oils and their major constituents against respiratory tract pathogens by gaseous contact[J]. Journal of Antimicrobial Chemotherapy, 2001, 47(5): 565-573.doi:10.1093/jac/47.5.565.
[6] CHUANG P H, LEE C W, CHOU J Y, et al. Anti-fungal activity of crude extracts and essential oil of Moringa oleifera Lam[J].Bioresource Technology, 2007, 98(1): 232-236.doi:10.1016/j.biortech.2005.11.003.
[7] GONCALVES M J, CRUZ M T, CAVALEIRO C, et al. Chemical,antifungal and cytotoxic evaluation of the essential oil of Thymus zygis subsp. sylvestris[J]. Industrial Crops & Products, 2010, 32(1): 70-75.doi:10.1016/j.indcrop.2010.03.005.
[8] ZUZARTE M, GONCALVES M J, CAVALEIRO C, et al. Antifungal and anti-inf l ammatory potential of Lavandula stoechas, and Thymus herba-barona, essential oils[J]. Industrial Crops & Products, 2013,44(2): 97-103.doi:10.1016/j.indcrop.2012.11.002.
[9] BASSOLE I H, JULIANI H R. Essential oils in combination and their antimicrobial properties[J]. Molecules, 2012, 17(4): 3989-4006.doi:10.3390/molecules17043989.
[10] STEINBERG J P. Superbug: the fatal menace of MRSA[J].Lancet Infectious Diseases, 2010, 10(8): 519-520.doi:10.3201/eid1610.101108.
[11] 吕媛, 李耘, 郑波. 国内外细菌耐药监测研究介绍[J]. 中国临床药理学杂志, 2011, 27(4): 311-317.doi:10.3969/j.issn.1001-6821.2011.04.021.
[12] 葛永红, 李灿婴, 吕静祎, 等. 植物精油在果蔬采后病害控制中的研究进展[J]. 食品工业科技, 2017, 38(2): 370-373.doi:10.13386/j.issn1002-0306.2017.02.063.
[13] YAP P S, LIM S H, HU C P, et al. Combination of essential oils and antibiotics reduce antibiotic resistance in plasmid-conferred multidrug resistant bacteria[J]. Phytomedicine International Journal of Phytotherapy & Phytopharmacology, 2013, 20(8/9): 710-713.doi:10.1016/j.phymed.2013.02.013.
[14] YAP P S X, YIAP B C, PING H C, et al. Essential oils, a new horizon in combating bacterial antibiotic resistance[J]. Open Microbiology Journal, 2014, 8(1): 6-14.doi:10.2174/1874285801408010006.
[15] TRIPATHI P, DUBEY N K, SHUKLA A K. Use of some essential oils as post-harvest botanical fungicides in the management of grey mould of grapes caused by Botrytis cinerea[J]. World Journal of Microbiology and Biotechnology, 2008, 24(1): 39-46.
[16] OUEDRHIRI W, BALOUIRI M, BOUHDID S, et al. Mixture design of Origanum compactum, Origanum majorana, and Thymus serpyllum,essential oils: optimization of their antibacterial effect[J]. Industrial Crops & Products, 2016, 89: 1-9.doi:10.1016/j.indcrop.2016.04.049.
[17] HYLDGAARD M, MYGIND T, MERYER R L. Essential oils in food preservation: mode of action, synergies, and interactions with food matrix components[J]. Frontiers in Microbiology, 2012, 3(12): 12-24.doi:10.3389/fmicb.2012.00012.
[18] HAMMER K A, CARSON C F. Antibacterial and antifungal activities of essential oils[M]// THORMAR H, LEY W, WILEY J. Lipids and Essential Oils as Antimicrobial Agents. US: A John Wiley and Sons, Ltd.,Publication, 2011: 255-306.doi:10.1002/9780470976623.ch11.
[19] GUTIERREZ J, BARRY-RYAN C, BOURKE P. The antimicrobial eff i cacy of plant essential oil combinations and interactions with food ingredients[J]. International Journal of Food Microbiology, 2008,124(1): 91-97.doi:10.1016/j.ijfoodmicro.2008.02.028.
[20] TSERENNADMID R, TAKO M, GALGOCZY L, et al. Antibacterial effect of essential oils and interaction with food components[J]. Central European Journal of Biology, 2010, 5(5): 641-648.doi:10.2478/s11535-010-0058-5.
[21] 李伟, 封丹, 陆占国. 孜然精油成分及其抗菌作用[J]. 食品科技,2008, 33(5): 182-186.doi:10.13684/j.cnki.spkj.2008.05.077.
[22] CAKIR A, KORDALI S, ZENGIN H, et al. Composition and antifungal activity of essential oils isolated from Hypericum hyssopifolium and Hypericum heterophyllum[J]. Flavour & Fragrance Journal, 2004, 19(1): 62-68.doi:10.1002/ffj.1279.
[23] HABA E, BOUHDID S, TORREGO-SOLLANA N, et al.Rhamnolipids as emulsifying agents for essential oil formulations:antimicrobial effect against Candida albicans and methicillin-resistant Staphylococcus aureus[J]. International Journal of Pharmaceutics,2014, 476(1/2): 134-141.doi:10.1016/j.ijpharm.2014.09.039.
[24] TIAN Jun, BAN Xiaoquan, ZENG Hong, et al. In vitro and in vivo activity of essential oil from dill (Anethum graveolens L.) against fungal spoilage of cherry tomatoes[J]. Food Control, 2011, 22(12):1992-1999.doi:10.1016/j.foodcont.2011.05.018.
[25] GOUPY J, CREIGHTON L. Introduction aux plans d’expériences[M].3rd ed, Paris: Dunod, 2006: 1-336.
[26] TENEVA D, DENKOVA Z, GOURANOV B, et al. Chemical composition and antimicrobial activity of essential oils from black pepper, cumin, coriander and cardamom against some pathogenic microorganisms[J]. Acta Universitatis Cibiniensis, 2016, 20(2): 39-52.doi:10.1515/aucft-2016-0014.
[27] 李大强. 孜然精油的成分分析、抗菌和抗氧化活性[D]. 兰州: 甘肃农业大学, 2012: 19-21.
[28] 唐裕芳, 唐小辉, 张妙玲, 等. 花椒挥发油化学组成及抑菌活性研究[J].湘潭大学自然科学学报, 2013, 35(2): 64-69.doi:10.13715/j.cnki.nsjxu.2013.02.002.
[29] 陈密玉, 林燕妮, 吴国欣, 等. 提取方法对芥子挥发油化学成分的影响[J]. 海峡药学, 2005, 17(5): 71-74.doi:10.3969/j.issn.1006-3765.2005.05.037.
[30] NHUTRANG T T, CASABINANCA H, GRENIERLOUSTALOT M F.Deuterium/hydrogen ratio analysis of thymol, carvacrol, gammaterpinene and p-cymene in thyme, savory and oregano essential oils by gas chromatography-pyrolysis-isotope ratio mass spectrometry[J].Journal of Chromatography A, 2006, 1132(1/2): 219-227.doi:10.1016/j.chroma.2006.07.088.
[31] HARSHINI H, KRISHANTHI A. In vitro application of selected essential oils and their major components in controlling fungal pathogens of crown rot in Embul banana (Musa acuminata-AAB)[J].International Journal of Food Science & Technology, 2010, 43(3):440-447.doi:10.1111/j.1365-2621.2006.01465.x.
[32] TIAN J, BAN X, ZENG H, et al. Chemical composition and antifungal activity of essential oil from Cicuta virosa L. var. latisecta Celak[J].International Journal of Food Microbiology, 2011, 145(2/3): 464-470.
[33] LIU X, WANG L P, Li Y C, et al. Antifungal activity of thyme oil against Geotrichum citri-aurantii in vitro, and in vivo[J]. Journal of Applied Microbiology, 2009, 107(5): 1450-1456.
[34] DIKBAS N, KOTAN R, DADASOGLU F, et al. Control of Aspergillus fl avus with essential oil and methanol extract of Satureja hortensis[J].International Journal of Food Microbiology, 2008, 124(2): 179-182.doi:10.1016/j.ijfoodmicro.2008.03.034.
[35] DJOUAHRI A, SAKA B, BOUDARENE L, et al. In vitro synergistic/antagonistic antibacterial and anti-inflammatory effect of various extracts/essential oil from cones of Tetraclinis articulata,(Vahl) Masters with antibiotic and anti-inflammatory agents[J].Industrial Crops & Products, 2014, 56(6): 60-66.doi:10.1016/j.indcrop.2014.02.035.
[36] WHITE R L, BURGESS D S, MANDURU M, et al. Comparison of three different in vitro methods of detecting synergy: time-kill,checkerboard, and E test[J]. Antimicrobial Agents & Chemotherapy,1996, 40(8): 1914-1918.
[37] PEI R S, ZHOU F, JI B P, et al. Evaluation of combined antibacterial effects of eugenol, cinnamaldehyde, thymol, and carvacrol against E. coli with an improved method[J]. Journal of Food Science, 2009,74(7): 379-383.doi:10.1111/j.1750-3841.2009.01287.x.
[38] ANGIONI A, BARRA A, CORONEO V, et al. Chemical composition,seasonal variability, and antifungal activity of Lavandula stoechas L. ssp.stoechas essential oils from stem/leaves and flowers[J]. Journal of Agricultural and Food Chemistry, 2006, 54(12): 4364-4370.doi:10.1021/jf0603329.
[39] ISMAN M B, MACHIAL C M, MIRESMAILLI S, et al. Essential oilbased pesticides: new insights from old chemistry[M]// OHKAWA H,MIYAGAWA H, LEE W P. Pesticide chemistry: crop protection,public health, environmental safety. US: A John Wiley and Sons, Ltd.,Publication, 2007: 201-209.doi:10.1002/9783527611249.ch21.
[40] HUMMELBRUNNER L A, ISMAN M B. Acute, sublethal,antifeedant, and synergistic effects of monoterpenoid essential oil compounds on the tobacco cutworm, Spodoptera litura (Lep.Noctuidae)[J]. Journal of Agricultural and Food Chemistry, 2001,49(2): 715-720.doi:10.1021/jf000749t.
[41] SAMPSON B J, TABANCA N, KIRIMER N, et al. Insecticidal activity of 23 essential oils and their major compounds against adult Lipaphis pseudobrassicae (Davis) (Aphididae: Homoptera)[J]. Pest Management Science, 2005, 61(11): 1122-1128.doi:10.1002/ps.1100.
[42] PEKMEZOVIC M, RAJKOVIC K, BARAC A, et al. Development of kinetic model for testing antifungal effect of Thymus vulgaris L.,and Cinnamomum cassia L. essential oils on Aspergillus flavus spores and application for optimization of synergistic effect[J].Biochemical Engineering Journal, 2015, 99: 131-137.doi:10.1016/j.bej.2015.03.024.
[43] DE AZEREDO G A, STAMFORD T L M, NUNES P C, et al.Combined application of essential oils from Origanum vulgare L.and Rosmarinus officinalis L. to inhibit bacteria and autochthonous microflora associated with minimally processed vegetables[J]. Food Research International, 2011, 44(5): 1541-1548.doi:10.1016/j.foodres.2011.04.012.
[44] GHABRAIE M, VU K D, TATA L, et al. Antimicrobial effect of essential oils in combinations against five bacteria and their effect on sensorial quality of ground meat[J]. LWT-Food Science and Technology, 2016, 66: 332-339.doi:10.1016/j.lwt.2015.10.055.
[45] 刘晓丽, 莫伟轩, 吴克刚, 等. 复合香辛料精油对冷却猪肉中单核增生性李斯特菌的抑制作用[J]. 中国调味品, 2010, 35(1): 42-45; 49.
Optimization of Combinations of Cuminum cyminum L., Zanthoxylum bungeanum Maxim. and Brassica juncea L. Essential Oils Using Mixture Design for Higher Antifungal Effect against Postharvest Fungi in Four Fruits and Vegetables