柑橘是世界第一大水果,也是我国主要的水果种植品种之一,我国柑橘栽培已有4 000多年历史[1]。由于柑橘果实成熟期相对集中,加之我国以鲜食为主的现状,采后需经历一定时间的贮藏和运输期,在此期间,腐烂、生理性能下降等引起的采后损失时常发生,严重影响了柑橘产业经济效益[2-3]。其中青霉病和绿霉病是柑橘最常见的两种贮藏病害,占总发病率的70%~90%[4-5]。因此,如何降低柑橘采收以后损失、控制柑橘采后贮藏过程中的生理病害、提高产品价值成为亟待解决的问题。
目前,化学杀菌剂以其较好的效果成为常用的控制柑橘采后病害的防治方式之一,但对人类健康及环境造成了一定的危害,长期使用将导致微生物对其产生耐药性,使其防治效果大打折扣[6]。槐糖脂最初于1954年被报道发现[7],它是由Spencer从苦苣菜上分离的一株名为Torulopsis magnoliae的酵母合成的糖脂,其主要产生菌种为假丝酵母属[8],通过微生物发酵法和生物酶催化法可生产[9-10]。槐糖脂为一种表面活性剂,具有诸多表面活性剂所拥有的优越性能,并具备了环境友好、无毒无害和容易降解等优点,使其在环境保护[11-12]、工业[13-14]、食品[15-16]、医药[17-20]及抗菌[21]等方面都具有较好的应用前景。但当前对其在果蔬采后生理病害机理的探究处于初步阶段,还需要进一步的研究。
本研究以蜜桔为实验材料,从腐烂的柑橘上分离致病病原菌,研究槐糖脂对蜜桔采后青霉的抑制作用,并对蜜桔果实采后诱导抗病性的机理进行初步的探讨,以期为蜜橘果实采后青霉病的防治提供一定的理论依据。
蜜橘(Citrus unshiu Marc.)采自重庆市北碚区某农户果园。选取大小均匀、成熟度一致、无机械伤和病虫害的果实,预冷后,放入7~10 ℃冷库中贮藏待用。实验时用质量分数为2%次氯酸钠溶液浸泡2 min后用自来水冲洗干净并晾干。
槐糖脂 西安康诺化工有限公司;DNA提取试剂盒、DP305试剂盒 天根生化科技(北京)有限公司。
SW-CJ-1F超净工作台 苏净集团安泰有限公司;B203LED生物显微镜 重庆奥特光学仪器有限公司;PowerPac电泳仪 美国Bio-Rad公司;G:BOX EF凝胶成像仪 英国Syngene公司; DHP-9162电热恒温培养箱、DHG-9140电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;LDZX-30KBS立式压力蒸汽灭菌锅上海申安医疗器械有限公司;TGL-16M台式高速冷冻离心机 湖南湘仪离心机仪器有限公司;FA2004A精密电子天平 上海精天电子仪器有限公司;XB.K.25型血球计数板 上海求精生化试剂有限公司;BCD-216YH冷冻冰箱 青岛海尔股份有限公司;SYNERGYH1MG全自动酶标仪 美国BioTek公司。
1.3.1 槐糖脂PDA平板的制备
在马铃薯葡萄糖琼脂(potato dextrose agar,PDA)平板中,槐糖脂质量浓度为0.025、0.050、0.075、0.100 g/L(用无菌水配制),121 ℃灭菌20 min,稍冷却后倾倒平板备用。
1.3.2 致病菌分离与鉴定
1.3.2.1 病原菌的分离纯化
选取自然发病的、具有典型青绿霉症状的蜜桔果实,在病健交界处取大小约为5 mmh5 mmh5 mm的小方块,放置于经灭菌冷却后的PDA平板中,在25 ℃的恒温培养箱中倒置培养5 d。待长出菌丝后,挑取培养皿中的菌丝进行分离,待长出单菌落后进行单孢培养,得到纯化的病原菌。
1.3.2.2 致病菌形态学鉴定
用无菌水配制浓度为1h106 CFU/mL的孢子悬浮液[22],取1 μL孢子悬浮液点在已灭菌的PDA培养基中,在25 ℃下进行培养,3 d后观察培养基上菌落的形态。
1.3.2.3 回接实验
将分离纯化后的病原菌置于25 ℃培养箱中培养7 d后,用接种环在培养好的培养基上刮取适量霉菌孢子,用无菌水配制成1hl04 CFU/mL孢子悬浮液待用。选取大小均匀、成熟度一致、无机械伤和病虫害的蜜桔果实,在果实赤道处对称地打2 个孔(直径3 mm、深3 mm),向每个孔内加入20 μL孢子悬浮液,晾干后单果包装,放置于25 ℃、相对湿度90%~95%条件下贮藏,观察果实的发病情况。
1.3.2.4 致病菌DNA的提取、通用引物扩增rDNA-内转录间隔区(internal transcribed spacer, ITS)全序列
DNA的提取采用DP305试剂盒。通用引物由上海生工生物工程技术服务有限公司提供。上游引物为ITS1:5’-TCCGTAGGTGAACCTGCGG-3’;下游引物为ITS4:5’-TCCTCCGCTTATTGATATGC-3’。聚合酶链式反应(polymerase chain reaction,PCR)体系(25 μL):模板0.5 μL、上下游引物(10 μmol/L)各1 μL、2hTaq PCR MasterMix 12.5 μL、ddH2O 10 μL。PCR程序为:预变性94 ℃ 4 min;变性94 ℃ 1 min,退火54 ℃ 1 min,延伸72 ℃ 1 min,循环数37;终延伸72 ℃ 10 min,保 温4 ℃ 60 min。
1.3.2.5 PCR产物的回收纯化、序列分析及结果对比
取5 μL产物点样于琼脂糖凝胶电泳检测。初样检测产物片段大小在500 bp左右,产物-20 ℃保存。产物送由上海生工生物技术工程服务有限公司纯化测序。测序结果在http://www.ncbi.nlm.nih.gov的数据库中进行比对。
1.3.3 不同质量浓度槐糖脂对青霉菌体外生长状况的影响
取1 μL浓度为1h104 CFU/mL的青霉孢子悬浮液点在配制好的不同质量浓度的槐糖脂PDA平板中,以不含槐糖脂的PDA平板作为对照,待菌液完全吸收后,将平板密封并放入25 ℃恒温培养箱中倒置培养,用十字交叉法测量菌落直径。每隔24 h测定一次菌落直径,每个质量浓度梯度3 个平板。
1.3.4 不同质量浓度槐糖脂接种处理对蜜桔青霉病的控制效果
蜜桔果实随机分成7 组,每组9 个果实,重复3 次。果实表面赤道部位用体积分数75%乙醇擦拭消毒后,用无菌打孔器在果实赤道部位等距离打2 个孔(直径3 mm、深3 mm)。每个孔用微量移液器接种20 μL如下的处理液:1)对照为无菌水;2)实验组分别为15、20、25、30、35、40 g/L槐糖脂溶液。4 h后,分别向每个孔中加入20 μL、1h104 CFU/mL的青霉孢子悬浮液。待菌液吸收后,用聚乙烯薄膜套袋单果包装,于25 ℃、相对湿度90%的环境中贮藏,每隔12 h统计果实的病斑直径和发病率。发病率的计算见下式。
1.3.5 槐糖脂对蜜桔采后抗病性的影响
1.3.5.1 果实打孔处理
用75%乙醇擦拭果实赤道部位后,用已消毒的无菌打孔器在果实赤道部位等距离打2 个孔(直径3 mm、深3 mm)。每个孔用微量移液器注入20 μL处理液。2 组处理液分别如下:1)对照组为无菌水;2)实验组为35 g/L槐糖脂溶液。待处理液完全吸收后,用聚乙烯薄膜袋对蜜桔果实进行单果包装,于25 ℃、相对湿度90%的环境中贮藏,每隔24 h进行一次取样,取样部位为蜜桔果实打孔伤口外直径1 cm的健康果皮部位,除去打孔伤口。每次取样5 个蜜桔果实,实验重复3 次。
1.3.5.2 果实浸泡处理
将果实浸泡于2 组处理液中20 min。2 组处理液分别如下:1)对照组为无菌水;2)实验组为35 g/L槐糖脂溶液。待果实表面完全晾干后,用聚乙烯薄膜袋对蜜桔果实进行单果包装,于25 ℃、相对湿度90%的环境中贮藏,每隔5 d进行一次取样,取样部位为蜜桔果实赤道部位果皮。每次取样5 个蜜桔果实,实验重复3 次。
1.3.5.3 果皮POD、PPO的提取及活力测定
过氧化物酶(peroxidase,POD)活力的测定参照曹建康等[23]的方法并作适当改进。3 mL的反应体系中,加入2.7 mL 0.1 mol/L磷酸盐缓冲液(pH 6.8)、0.1 mL质量分数4%愈创木酚溶液、0.1 mL体积分数0.5% H2O2溶液和0.1 mL上清液。采用全自动酶标仪于470 nm波长处室温下测定反应3 min吸光度的变化,以每分钟吸光度变化1为一个酶活力单位(U),实验重复3 次。POD活力单位为U/g,结果以鲜质量计。
多酚氧化酶(polyphenol oxidase,PPO)活力的测定参照Srivastava等[24]的方法并作适当改进。3 mL反应体系中,加入2 mL 0.1 mol/L磷酸盐缓冲液(pH 6.8)、0.9 mL 50 mmol/L邻苯二酚和0.1 mL上清液,采用全自动酶标仪于420 nm波长处室温下测定反应3 min吸光度的变化,以每分钟吸光度变化1为一个酶活力单位(U),实验重复3 次。PPO活力单位为U/g,结果以鲜质量计。
1.3.5.4 果皮PAL的提取及活力测定
苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)的活力测定参照Assis等[25]的方法并作适当修改。取两支试管,一支为样品管,一支为对照管。向两支试管中加入3.4 mL 50 mmol/L硼酸-硼砂缓冲液和0.25 mL上清液,于37 ℃下水浴平衡10 min后向反应管中加入0.5 mL 20 mmol/L L-苯丙氨酸溶液,在对照管中加入0.5 mL 50 mmol/L的硼酸-硼砂缓冲液(pH 8.8),将两支试管继续置于37 ℃水浴下保温60 min。保温结束后,立即向两支试管中加入0.1 mL 6 mol/L盐酸溶液以终止反应。分别测定两支试管在290 nm波长处室温下的吸光度,以每小时每克蜜桔果皮组织酶促反应体系吸光度增加0.01为一个酶活力单位(U),实验重复3 次。
用SPSS 18.0进行数据统计与分析,计算标准差,用Origin 8.0进行制图;并对数据进行方差分析,利用邓肯式多重比较对差异显著性进行分析,P<0.05表示差异显著。
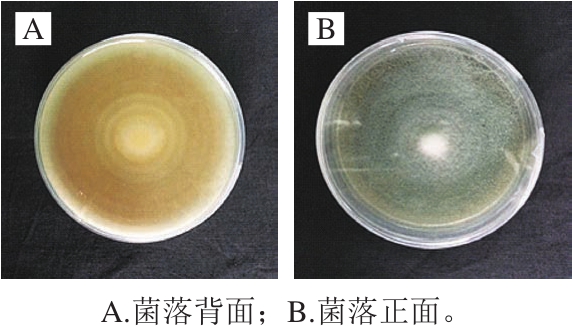
图1 病原菌菌落形态特征
Fig.1 Colony characteristics of the pathogen cultured on potato dextrose agar
从有典型青绿霉症状的蜜桔果实表面分离出一株病原菌,病原菌在平板上的菌落形态如图1所示。病原菌在PDA平板上菌落生长较快,呈现青绿色、粉粒状、较薄,有白色的边缘,菌落颜色随着培养时间的延长而逐步加深,有同心环。
将分离得到的病原菌回接到健康的蜜桔果实上,回接效果如图2所示。回接实验表明,该菌株能够引起蜜桔表面发生腐烂,果实在接种的48 h开始发病,发病初期果实变软,接种处呈现青绿色圆形病斑,最后至整个果实腐烂,此症状与田间蜜桔青霉病症状一致。将该菌株在PDA上分离、纯化并扩大培养,能够得到与所接种菌株培养形状相同的菌落。
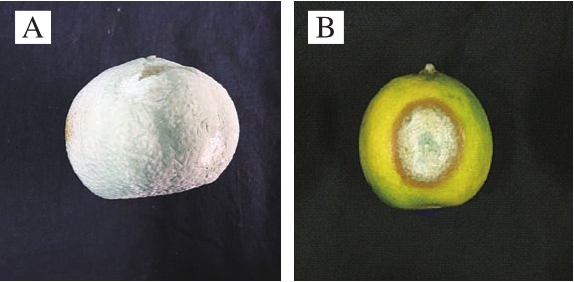
图2 回接病原菌蜜桔果实发病(A)和自然发病(B)症状
Fig.2 Inoculated (A) and naturally infected (B) satsuma mandarin fruit
2.3.1 病原菌ITS序列电泳结果
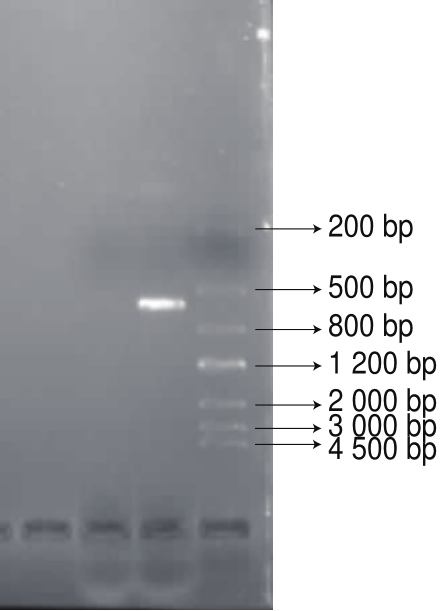
图3 菌株ITS的PCR产物电泳结果
Fig.3 Gel electrophoresis of polymerase chain reaction products of the ITS region from the pathogen
如图3所示,以病原菌DNA作为模板,扩增出500 bp左右的DNA片段。
2.3.2 病原菌rDNA-ITS序列测定结果
病原菌株ITS测定结果表明(图3),该片段长590 bp。将该核苷酸序列提交到GenBank核苷酸数据库(http://www.ncbi.nlm.nih.gov/blast),通过BLAST程序对比分析得到结果:该病原菌与已知的意大利青霉(Penicillium italicum,HQ850905.1)rDNA-ITS区域同源性为99%,根据该病原菌的形态学特征和分子鉴定结果,说明此病原菌为柑橘意大利青霉。
由图4可知,槐糖脂能抑制柑橘意大利青霉菌落直径的扩展,不同质量浓度槐糖脂实验组菌落水平在贮藏期间均显著低于对照组(P<0.05)。当槐糖脂质量浓度为0.100 g/L时,青霉菌的生长被完全抑制,说明槐糖脂对青霉菌具有较好的抑制效果。

图4 不同质量浓度槐糖脂对青霉菌体外生长的抑制作用
Fig.4 Effect of sophorolipids treatment on mycelium growth of Penicillium italicum
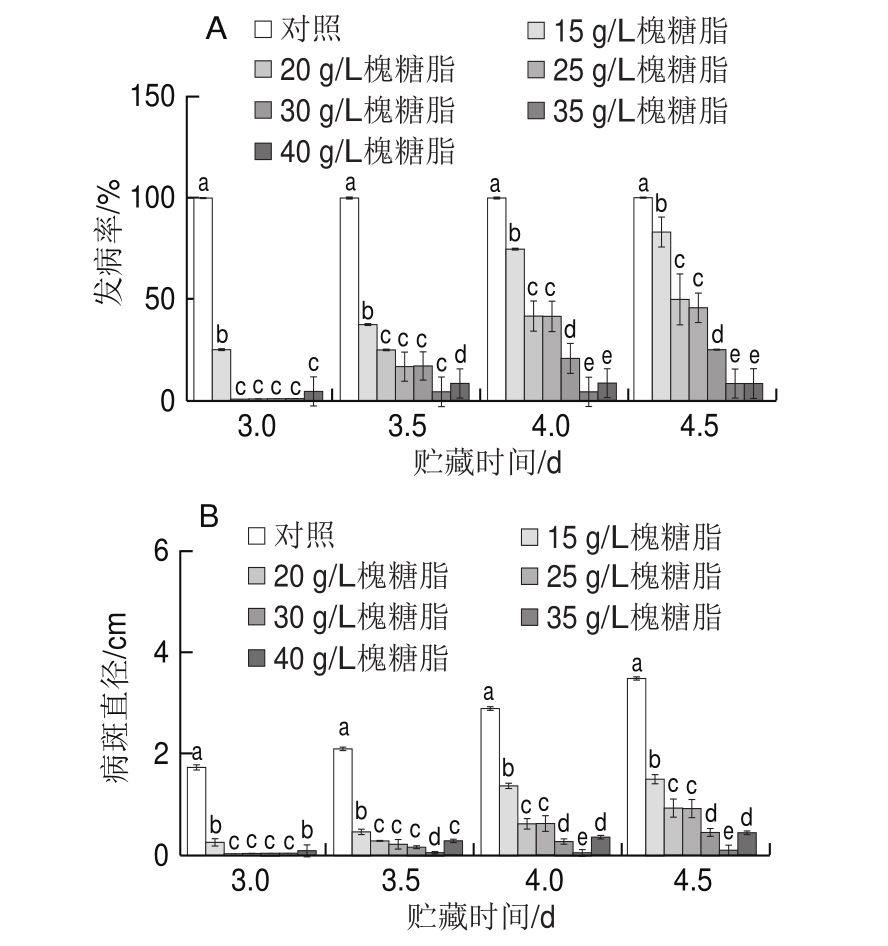
图5 不同质量浓度槐糖脂对青霉发病率(A)和病斑直径(B)的影响
Fig.5 Effect of sophorolipid on disease incidence (A) and lesion diameter of satsuma mandarin fruit (B) inoculated with Penicillium italicum
由图5A可以看出,同孔接种处理后,72 h时对照组发病率达100%,而槐糖脂处理组发病率较低,说明槐糖脂有效地延缓了蜜桔果实青霉病的发病;在108 h的贮藏期间,35 g/L槐糖脂实验组发病率始终处于较低的水平。图5B表明,同孔接种处理后,对照组蜜桔果实病斑直径迅速扩展,贮藏84 h,所有实验组均发病,经对比可知,在贮藏期间,槐糖脂质量浓度为35 g/L时对蜜桔病斑直径的抑制效果最好,因此选用质量浓度为35 g/L的槐糖脂对蜜桔采后青霉病的控制效果进行研究。贮藏96 h时,对照组病斑直径为2.89 cm,与35 g/L槐糖脂实验组(0.038 cm)相比差异显著(P<0.05)。
2.6.1 接种处理对蜜桔果皮PPO和POD活力的影响
由图6A、B可知,在接种处理后贮藏的5 d内,蜜桔果皮的PPO和POD活力总体呈先上升后下降的趋势。与对照组相比,槐糖脂实验组的PPO和POD活力明显增高,且在接种后贮藏的第3天,槐糖脂接种实验组POD、PPO活力分别约为对照组的2.90、1.96 倍。

图6 接种处理对蜜桔果皮POD(A)和PPO(B)活力的影响
Fig.6 Effect of inoculation with Penicillium italicum on POD (A) and PPO (B) activities in satsuma mandarin peel
2.6.2 接种处理对蜜桔果皮PAL活力的影响
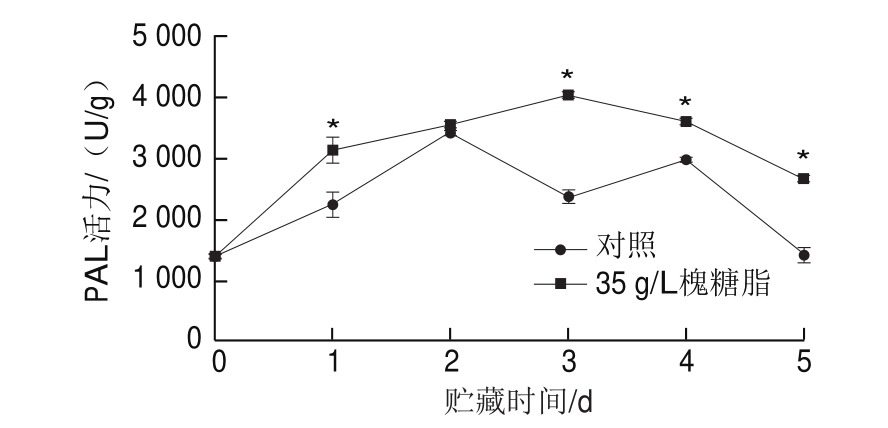
图7 接种处理对蜜桔果皮PAL活力的影响
Fig.7 Effect of inoculation with Penicillium italicum on PAL activity in satsuma mandarin peel
由图7可知,在接种槐糖脂处理的5 d内,蜜桔果皮的PAL活力整体大致呈现先升高后降低的趋势,且PAL活力显著高于对照组。接种后贮藏的第3天,槐糖脂实验组的PAL达到峰值,约为对照组的1.7 倍(P<0.05)。
2.7.1 浸泡处理对蜜桔果皮PPO、POD活力的影响
由图8A、B可知,在25 d的贮藏期内,经槐糖脂浸泡处理后的蜜桔,其POD和PPO活力整体呈现先增高后降低的趋势,且对照组的PPO活力在贮藏的25 d内一直比实验组低。在贮藏期内,对照组的PPO和POD处于较低的水平。在贮藏的第10天,槐糖脂实验组的POD、PPO活力约为对照组的1.84、2.72 倍。
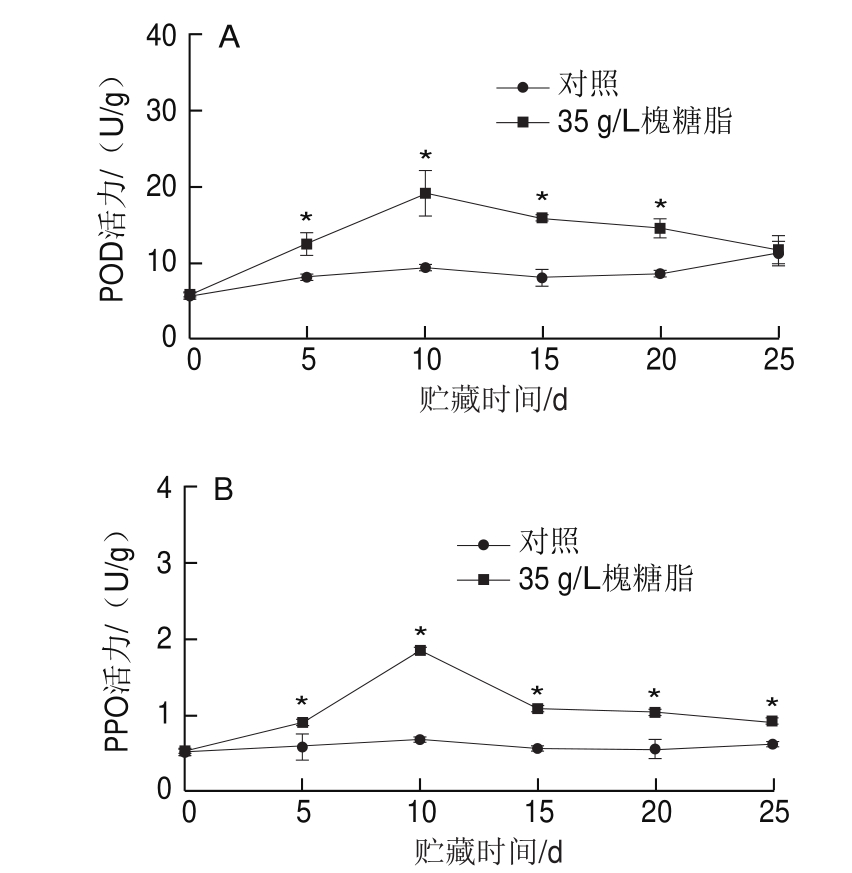
图8 浸泡处理对蜜桔果皮POD(A)和PPO(B)活力的影响
Fig.8 Effect of sophorolipid on POD (A) and PPO (B) activities in satsuma mandarin peel
2.7.2 浸泡处理对蜜桔果皮PAL活力的影响
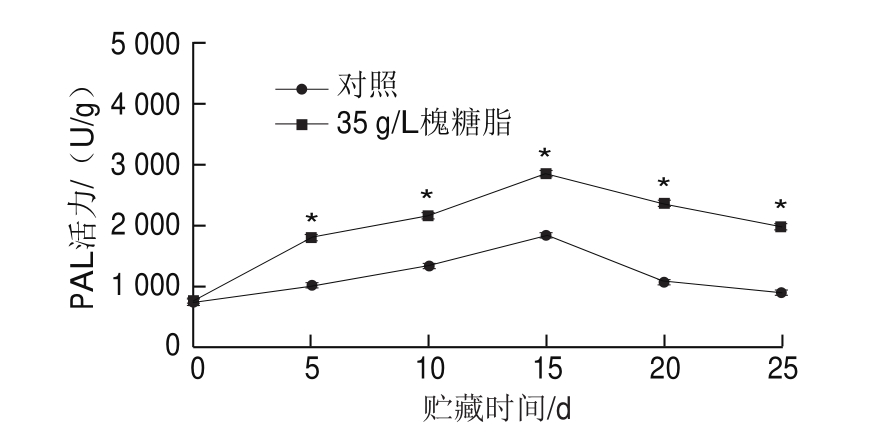
图9 浸泡处理对蜜桔果皮PAL活力的影响
Fig.9 Effect of sophorolipid on PAL activity in satsuma mandarin peel
由图9可知,在25 d的贮藏期内,经槐糖脂浸泡处理后的蜜桔PAL活力呈先增加后降低的趋势,且对照组PAL活力在25 d内一直比槐糖脂实验组低。在贮藏的第15天,槐糖脂实验组的PAL活力约为对照组的1.54 倍。
本实验通过组织块分离法,从有典型青绿霉病症状的蜜桔果实上分离到病原菌,通过回接实验、病原菌形态学以及ITS鉴定发现,该病原菌的种类为柑橘意大利青霉(Penicillium italicum)。
本实验使用槐糖脂处理,探讨不同质量浓度的槐糖脂对青霉的抑制作用。Yoo等[26]发现槐糖脂对疫霉菌以及腐霉菌均有抑制作用,胡静等[27]的研究结果表明,槐糖脂对金黄色葡萄球菌有较好的抑制作用,且槐糖脂具有稳定性,在酸性和高温条件下抑制效果都不会受到影响。本实验中,体外实验表明槐糖脂对柑橘意大利青霉具有良好的抑制作用,且当PDA培养基中槐糖脂质量浓度达到0.100 g/L时能100%抑制柑橘意大利青霉孢子的萌发;在活体实验中,槐糖脂质量浓度达到35 g/L时果实病斑直径最小,与其他质量浓度实验组及对照组相比差异显著(P<0.05)。离体和活体实验均能说明槐糖脂对柑橘意大利青霉的抑制有着较好的作用。
果实采后主要作用机制之一是诱导抗病性[28]。在果蔬采后抗病性的诱导中,相关抗性酶展现出了至关重要的作用。病程相关蛋白家族和酚类代谢系统中的一些酶如PPO、POD和PAL与植物体内抵抗病原微生物的侵染都有着一定的关系。PPO通过催化木质素及醌类化合物形成保护性屏蔽来保护细胞免受病菌的侵害[29],POD在木质素生物合成时能有效催化过氧化氢的分解[30],PAL是苯丙烷类代谢途径中的关键酶,它能促进次生代谢产物的生成,从而提高果实的诱导抗病性[31]。据研究发现,不论是物理、化学还是生物激发子,当对果蔬进行抗性诱导时,其PPO、POD和PAL三者的酶活力均能显著提高,使果蔬的抗性增加[29]。在抗菌方面,槐糖脂对细菌和真菌都展现了卓越的抗菌性能。果实采收过程中会不可避免受到不同程度的机械损伤,当果实受到损伤时,其自身会产生生理生化反应[32],为探究槐糖脂对蜜桔果实自身诱导抗病性和伤口愈合是否存在促进作用,本实验对蜜桔进行接种处理。实验发现,用质量浓度为35 g/L的槐糖脂溶液对蜜桔进行接种处理后,其PPO、POD和PAL活力得到了显著提高。在商品化应用的前提下,为探究槐糖脂对蜜桔果实的自然病害的抑制效果及抗病性是否有促进作用,本实验还采用了浸泡处理。当用质量浓度35 g/L的槐糖脂溶液对蜜桔进行浸泡处理时,蜜桔的PPO、POD和PAL活力也得到了显著提高。经对比研究发现,采用接种处理的蜜桔果实出现伤口,其PPO、POD和PAL的活力变化较快,并在贮藏的第3天达到峰值;当用质量浓度35 g/L的槐糖脂溶液对蜜桔浸泡处理后,蜜桔的PPO、POD和PAL的活力也显著提高,并在贮藏的第10天,PPO和POD活力达到峰值;实验组的PAL活力在贮藏第15天达到峰值。对比两处理组的酶活力发现变化趋势大致相同,接种实验组酶活力较浸泡实验组高,其原因可能是当果实出现伤口时,果实自身生理生化代谢也得到了诱导。初步判断提高果实诱导抗病性是槐糖脂对蜜橘果实采后青霉病的控制的作用机制之一。
综上所述,蜜橘青霉病的病原菌为意大利青霉,槐糖脂对蜜橘青霉病有显著控制效果,直接抑菌及诱导抗病性是其主要作用机制,为蜜橘采后青霉病的防治提供了新的方法和思路。本实验初步研究了槐糖脂的控病效果,并对其在蜜桔采后抗病性的诱导方面进行了初步的探究。在接下来的研究中,可系统开展槐糖脂在果蔬采后控病方面的研究,同时也可以研究其与不同拮抗剂复合,期待得到更好的效果。
[1] 庄虚之. 试论我国古代柑桔贮藏技术的发展[J]. 四川果树, 1994(4):20-23.
[2] 孙萍. 粘红酵母对柑橘采后病害的生物防治及其防治机理的研究[D].杭州: 浙江大学, 2003: 1.
[3] 李红叶, 曹若彬. 果蔬产后病害生物防治研究进展[J]. 中国生物防治通报, 1993, 9(4): 176-180.
[4] BOUBAKER H, SAADI B, BOUDYACH E H, et al. Sensitivity of Penicillium digitatum and P. italicum to imazalil and thiabendazole in Morocco[J]. Plant Pathology Journal, 2009, 8(4): 152-158.doi:10.3923/ppj.2009.152.158.
[5] HOLMES G J, ECKERT J W. Sensitivity of Penicillium digitatum and P. italicum to postharvest citrus fungicides in California[J]. Phytopathology, 1999, 89(9): 716-721.doi:10.1094/PHYTO.1999.89.9.716.
[6] WISNIEWSKI M E, WILSON C L. Biological control of postharvest diseases of fruits and vegetables: recent advances[J]. Hortscience,1992, 27(2): 94-98.doi:10.1007/BF00041276.
[7] ITO S, INOUE S. Sophorolipids from Torulopsis bombicola: possible relation to alkane uptake[J]. Applied & Environmental Microbiology,1982, 43(6): 1278-1283.
[8] HOMMEL R, STIIWER O, STUBER W, et al. Production of watersoluble surface-active exolipids by Torulopsis apicola[J]. Applied Microbiology and Biotechnology, 1987, 26(3): 199-205.doi:10.1007/BF00286308.
[9] DAVEREY A, PAKSHIRAJAN K. Kinetics of growth and enhanced sophorolipids production by Candida bombicola using a low-cost fermentative medium[J]. Applied Biochemistry & Biotechnology,2010, 160(7): 2090-2101.doi:10.1007/s12010-009-8797-3.
[10] PEKIN G, VARDAR-SUKAN F, KOSARIC N. Production of sophorolipids from Candida bombicola ATCC 22214 using Turkish corn oil and honey[J]. Engineering in Life Sciences, 2005, 5(4):357-362.doi:10.1002/elsc.200520086.
[11] ZERKOWSKI J A, SOLAIMAN D K Y. Polyhydroxy fatty acids derived from sophorolipids[J]. Journal of the American Oil Chemists’Society, 2007, 84(5): 463-471.doi:10.1007/s11746-007-1054-4.
[12] BOGAERT I N A V, ROELANTS S, DEVELTER D, et al.Sophorolipid production by Candida bombicola on oils with a special fatty acid composition and their consequences on cell viability[J]. Biotechnology Letters, 2010, 32(10): 1509-1514.doi:10.1109/20.133698.
[13] BOGAERT I N A V, DEVELTER D, SOETAERT W, et al. Cerulenin inhibits de novo sophorolipid synthesis of Candida bombicola[J].Biotechnology Letters, 2008, 30(10): 1829-1832.doi:10.1007/s10529-008-9764-8.
[14] SMYTH T J, PERFUMO A, MARCHANT R, et al. Directed microbial biosynthesis of deuterated biosurfactants and potential future application to other bioactive molecules[J]. Applied Microbiology and Biotechnology, 2010, 87(4): 1347-1354.doi:10.1007/s00253-010-2592-5.
[15] BANAT I M, MAKKAR R S, CAMEOTRA S S. Potential commercial applications of microbial surfactants[J]. Applied Microbiology and Biotechnology, 2000, 53(5): 495-508.doi:10.1007/s002530051648.
[16] CAMEOTRA S S, MAKKAR R S. Synthesis of biosurfactants in extreme conditions[J]. Applied Microbiology and Biotechnology,1998, 50(5): 520-529.doi:10.1007/s002530051329.
[17] NAPOLITANO L M. Sophorolipids in sepsis: antiinflammatory or antibacterial?[J]. Critical Care Medicine, 2006, 34(1): 258-259.doi:10.1097/01.CCM.0000196082.26483.F0.
[18] ISODA H, KITAMOTO D, SHINMOTO H, et al. Microbial extracellular glycolipid induction of differentiation and inhibition of the protein kinase C activity of human promyelocytic leukemia cell line HL60[J]. Bioscience Biotechnology & Biochemistry, 1997, 61(4):609-614.doi:10.1271/bbb.61.609.
[19] SHAH V, DONCEL G F, SEYOUM T, et al. Sophorolipids, microbial glycolipids with anti-human immunodeficiency virus and spermimmobilizing activities[J]. Antimicrobial Agents and Chemotherapy,2005, 49(10): 4093-4100.doi:10.1128/AAC.49.10.4093-4100.2005.
[20] 宋欣, 曲音波, 李慧. 槐糖脂在制备抗宫颈癌药物中的应用:CN101703514A[P]. 2010-05-12[2017-11-15]. https://www.ixueshu.com/document/5a40c305487775dd318947a18e7f9386.html.
[21] KIM K, YOO D, KIM Y, et al. Characteristics of sophorolipid as an antimicrobial agent[J]. Journal of Microbiology & Biotechnology,2002, 12(2): 235-241.
[22] 路来风. 海洋拮抗酵母Rhodosporidium paludigenum对柑橘果实抗性的增强效应及其生物学机理研究[D]. 杭州: 浙江大学, 2015: 31.
[23] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 142-147.
[24] SRIVASTAVA M K, DWIVEDI U N. Delayed ripening of banana fruit by salicylic acid[J]. Plant Science, 2000, 158(1/2): 87-96.doi:10.1016/S0168-9452(00)00304-6.
[25] ASSIS J S, MALDONADO R, MUÑOZ T, et al. Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J]. Postharvest Biology and Technology,2001, 23(1): 33-39.doi:10.1016/S0925-5214(01)00100-4.
[26] YOO D S, LEE B S, KIM E K. Characteristics of microbial biosurfactant as an antifungal agent against plant pathogenic fungus[J].Journal of Microbiology & Biotechnology, 2005, 15(6): 1164-1169.
[27] 胡静, 赵小慧, 朱春玉, 等. 槐糖脂对金黄色葡萄球菌的抑菌机理[J].食品科学, 2012, 33(5): 33-36.
[28] 毛淑波. 罗伦隐球酵母结合热空气处理对草莓采后病害的防治及其机理研究[D]. 南京: 南京农业大学, 2013: 8-9.
[29] SCHNEIDER S, ULLRICH W R. Differential induction of resistance and enhanced enzyme activities in cucumber and tobacco caused by treatment with various abiotic and biotic inducers[J]. Physiological and Molecular Plant Pathology, 1994, 45(4): 291-304.doi:10.1016/S0885-5765(05)80060-8.
[30] ABELES F B, BILES C L. Characterization of peroxidases in lignifying peach fruit endocarp[J]. Plant Physiology, 1991, 95(1): 269-273.doi:10.1104/pp.95.1.269.
[31] PELLEGRINI L, ROHFRITSCH O, FRITIG B, et al. Phenylalanine ammonia-lyase in tobacco. molecular cloning and gene expression during the hypersensitive reaction to tobacco mosaic virus and the response to a fungal elicitor[J]. Plant Physiology, 1994, 106(3): 877-886.doi:10.1104/pp.106.3.877.
[32] 苏晶. 采后苹果果实机械伤诱导的抗病性机理研究[D]. 南京: 南京农业大学, 2011: 2.
Biocontrol of Postharvest Blue Mold (Penicillium italicum) on Satsuma Mandarin (Citrus unshiu Marc.)Fruit by Sophorolipid and Underlying Mechanism