
图1 稀释曲线
Fig.1 Rarefaction curves
鲈鱼富含蛋白质、高不饱和脂肪酸和多种维生素及有益的微量元素,肉质滑嫩鲜美,深受消费者喜欢[1-2]。但鲈鱼在贮藏过程中极易因微生物的作用而腐败变质,微生物是其货架期的决定性影响因素[3]。鲈鱼鱼肉中丰富的营养物质特别适合微生物的生长[4],Parlapani等[5]研究表明,鱼种类、贮存方式、加工条件、包装方法等在不同外界条件对腐败性微生物的生长与代谢有极大的影响。长期以来,在延长鱼肉货架期、控制腐败微生物的生长方面,人们主要研究了不同品种鱼肉的加工方式、贮藏方法,以及加工贮藏过程微生物的种类和变化规律。
微生物群落多样性的研究大多还是采用传统的培养方法,通过表型和生理生化实验进行鉴定,耗费大量的时间和精力,而且不能对其精确鉴定,更难以获得微生物群落多样性的真正概貌[6]。因为有些微生物的培养条件非常苛刻,甚至不可培养,常规方法难以检测到不可培养的微生物。近年来,在微生物群落多样性研究中已经越来越倾向于采用分子生物学手段[7-10],该技术以细菌基因序列信息为基础,通过细菌的基因序列来研究水产品在贮藏过程中微生物(尤其是优势腐败菌)的组成及变化,与传统研究方法相比,其不需要对样品中的微生物进行分离培养,就能够快速检测出大量未培养的微生物,而且具有重现性高、工作量少等优点[11-12]。而16S rDNA被认为是最适于细菌系统发育和分类鉴定的指标,通常作为揭示生物物种的特征核酸序列,16S rDNA扩增子测序是对高变区进行测序分析和菌种鉴定[13],这样分析数据时既可以提高效率还可以节省成本。
本研究主要采用Illumina MiSeq测序技术研究调理啤酒鲈鱼片采用气调包装在-3 ℃贮藏过程中微生物群落结构差异及优势腐败菌组成,并与未经调理处理的鲈鱼片比较,以期探究贮藏过程的微生物群落结构及差异,为更好地抑制腐败菌的生长、优化产品工艺、延长啤酒鲈鱼调理产品货架期、提高产品质量提供理论依据。
鲜活海鲈鱼(Lateolabrax japonicus)500~600 g/条,体长30~40 cm,购自广州华润万家超市。
细菌基因组DNA提取试剂盒 美国Omega科技公司;高效和高保真酶Phusion® High-Fidelity聚合酶链式反应(polymerase chain reaction,PCR)Master Mix with GC Buffer 美国New England BioLabs公司。
MAP-D400复合气调包装机 苏州森瑞保鲜设备有限公司;HH-4数显恒温水浴锅 常州澳华仪器有限公司;DZ-500/2D真空包装机 温州市新泰包装机械厂;MM-2快速旋涡混合器 姜堰市沈高康健生化器具厂;高速冷冻离心机 美国Bio-Rad公司;HiSeq PE250美国Illumina公司;GeneJET胶回收试剂盒 美国Thermo Scientif i c公司。
引物515F和806R由北京诺禾致源生物信息科技有限公司合成。
1.3.1 样品制备
处理组调理啤酒鲈鱼片加工工艺流程参考文献[14],具体为:鲜活鲈鱼→预处理→取鱼片→脱脂→脱腥、抑菌→调味→沥干→包装→贮藏。
其中将调味并风干表面水分的调理啤酒鲈鱼片进行包装时,采用具有气体高阻隔性能的包装袋进行气调包装(V(CO2)∶V(N2)=3∶7),置于-3 ℃条件下进行微冻贮藏,记为TL组;对照组将鲜活鲈鱼去鳞去内脏,沿鱼的脊背骨从头到尾分别剖下鱼两侧的鱼肉片(未作调味处理),采用真空包装,置于4 ℃条件下进行贮藏,记为L组。
取样方式:根据之前贮藏实验结果,结合硫代巴比妥酸值、挥发性盐基氮含量、菌落总数和感官等指标综合考虑,上述处理条件下的调理鲈鱼片可以贮藏40~50 d[14],确定两种包装方式下取样分析的时间。TL组产品在-3 ℃贮藏的第0、10、20、30、40、50天取样,贮藏前期(0~10 d)、中期(20~30 d)、后期(40~50 d)分别记为B.1、B.2、B.3。L组产品在4 ℃贮藏的第0、2、4、6、8、10天取样,贮藏前期(0~2 d)、中期(4~6 d)、后期(8~10 d)分别记为A.1、A.2、A.3;TL、L后面数字代表取样时间。实验设计2 次重复,取数据平均值进行分析。
1.3.2 基因组DNA的提取和PCR扩增
利用试剂盒对样本的基因组DNA进行提取,提取之后通过琼脂糖凝胶电泳检测DNA的纯度和浓度,然后取适量的样品放在离心管中,用无菌水稀释样品至1 ng/μL。以稀释后的基因组DNA为模板,设计细菌的16S rDNA V4片段扩增的通用引物(515F:5’-GTGCCAGCMGCCGCGGTAA-3’、806R:5’-GGACTACNNGGGTATCTAAT-3’),并用高效和高保真酶Phusion® High-Fidelity PCR Master Mix with GC Buffer进行PCR扩增,确保扩增效率和准确性。
PCR体系:4 μL Primer Cocktail、25 μL Master Mix、2 μL DNA和19 μL ddH2O。反应参数:98 ℃预变性3 min;98 ℃变性45 s,55 ℃退火45 s,72 ℃延伸45 s,30 个循环;72 ℃延伸7 min。
PCR扩增产物使用质量分数1%琼脂糖凝胶进行电泳检测,根据产物浓度进行等量混样,充分混匀后对目的条带使用GeneJET胶回收试剂盒回收纯化产物。
1.3.3 文库构建和上机测序
用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒构建文库,并用Qubit和实时荧光定量PCR(quantitative real-time PCR,qPCR)定量,检测文库合格后,采用HiSeq2500 PE250测序。
测序得到的原始数据存在一定比例的干扰数据,为了使信息分析的结果更加准确、可靠,首先对原始数据使用FLASH软件进行拼接、过滤,得到有效数据[15-18]。然后对有效数据进行操作分类单元(operational taxonomic units,OTUs)聚类分析。根据分析结果,对每个OTU的代表序列做物种注释,获得对应的物种信息和丰度分布情况;同时对OTUs进行丰度、α-多样性计算、Venn图和花瓣图分析,以得到样品内物种丰富度和均匀度信息及不同样品或分组间共有、特有OTUs信息等[19-20]。为进一步挖掘分组样品间的群落结构差异,采用LEfSe、T-test、MetaStat、Anosim和MRPP等统计分析方法对分组样品的物种组成和群落结构进行差异显著性检验,通过对OTUs进行丰度和α-多样性分析,得到微生物群落结构组成。

图1 稀释曲线
Fig.1 Rarefaction curves
在0~10 000的测序数量范围内,随着测序数量的增加,稀释曲线(图1)急剧上升,且斜率较大,在10 000~40 000的测序数量范围内,稀释曲线缓慢上升并趋向平坦,进入平台期,说明本研究测序数据量合理,测试深度足以反映样品中绝大多数的微生物信息,即使再增加测序数量也不会产生新的OTU。

图2 鲈鱼片在贮藏过程中微生物α-多样性指数的箱图
Fig.2 Boxplots of alpha diversity indexes of sea bass fi llets during storage
A、B两组样品的α-多样性指数箱图见图2,其中物种观察指数反映样品中群落的丰富度,香农指数反映群落的多样性。鲈鱼制品在贮藏过程中微生物多样性逐渐趋向单一,调理啤酒鲈鱼片B.1组的微生物多样性比对照组A.1低,但是在B.2组和B.3组微生物多样性比对照组A.2和A.3丰富。鱼肉在贮藏过程中由于自身酶和微生物的作用会分解成小分子蛋白质或脂肪酸,为微生物的生长繁殖提供了充足的营养物质,引起微生物滋生。随着贮藏过程的进行,鱼肉开始腐败,产生各种有机酸,酸性环境能有效抑制微生物的繁殖,再加上低温环境对微生物的抑制作用;因此菌相逐渐变得单一,这与谢萍等[21]研究的结果一致,即在贮藏前期和中期微生物快速增长,而后又开始呈下降趋势。调理啤酒鲈鱼片调味前采用天然植物香菜和柠檬草进行脱腥抑菌处理,且调味料中的啤酒和盐对微生物有一定的抑制作用,因此调理啤酒鲈鱼片微生物多样性低于对照组。随着贮藏过程的进行,鱼肉开始出现汁液流失,调味料的加入使得鱼肉环境更加复杂,营养物质在一些酶的作用下降解成小分子肽或氨基酸,更有利于微生物滋生。

图3 样品的Tags和OTUs数目统计
Fig.3 Statistics of Tags and OTUs numbers in samples
由图3可知,对照组L0过滤后得到的拼接序列数共有58 707 条Tags,在97%的序列相似性条件下,可分为766 个OTUs,包括54 422 条可获得分类信息的Tags,4 275 条低频Tags;而实验组TL0共获得64 345 条Tags,在97%的序列相似性条件下,可分为210 个OTUs,包括63 906 条可获得分类信息的Tags,422 条低频Tags(图3)。从这些数据可以看出,调理啤酒鲈鱼片在加工过程中由于用啤酒、盐等调味腌制一段时间,并有一定时间的风干工序,鱼肉中的蛋白质和脂肪在这个过程发生降解,分解成小分子肽、氨基酸、脂肪酸等物质,为微生物的生长繁殖提供了营养条件;因此微生物多样性较对照组丰富,但调理啤酒鲈鱼片中的微生物种类比较单一。这与梁荣蓉[22]、范晓攀[23]等研究鸡肉调理制品时发现不同品种的鸡肉调理产品总体微生物总数偏高,但菌群结构存在差异,与产品的加工调制方式、贮藏温度和包装方式等有密切关系的结论相一致。
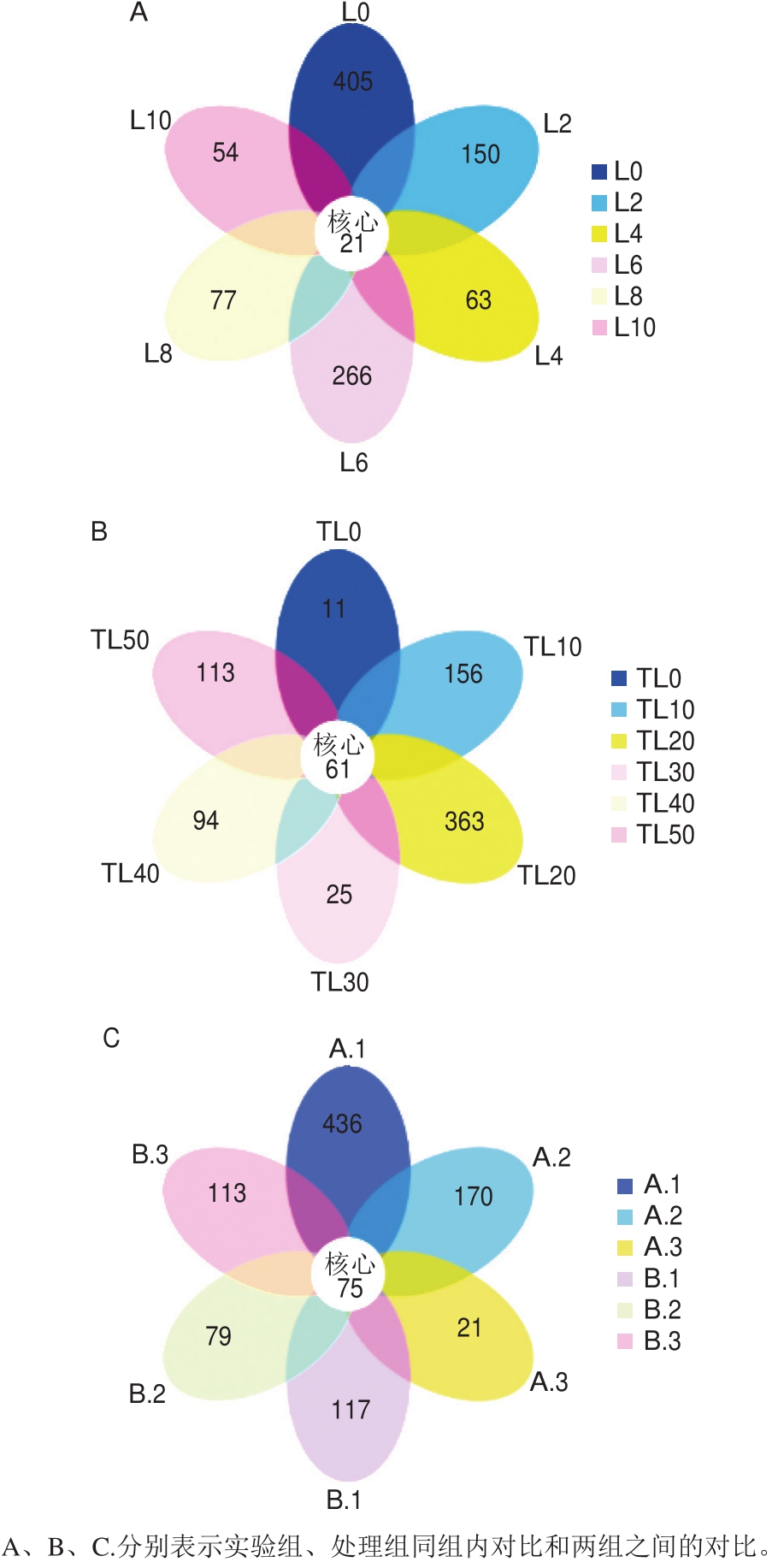
图4 鲈鱼制品在贮藏过程中细菌OTU花瓣图
Fig.4 OTU petal map of sea bass fi llets during storage
为了找出不同贮藏阶段样品中的核心微生物,利用OTU花瓣图作进一步分析。图4A、B为鲈鱼制品在贮藏过程中细菌OTU花瓣图分析结果,可以很直观地看出,在不同的贮藏时间,细菌多样性存在很大差异,但各个贮藏时间里又都含有共同的OTU数。调理啤酒鲈鱼片TL组在微冻贮藏0~50 d过程中共有61 个核心OTU,对照组(L组)在4 ℃贮藏0~10 d过程中共有21 个核心OTU,说明鲈鱼制品在贮藏过程中有些微生物一直存在,对鱼肉的品质变化有重大影响。图4C为鲈鱼制品在两种不同包装不同贮藏条件下的细菌OTU花瓣图分析结果,鱼肉在不同包装方式和不同贮藏条件下,核心优势微生物共有75 个核心OTU。
2.4.1 基于门水平的菌群结构分析

图5 鲈鱼制品在贮藏过程中门水平上的微生物相对丰度
Fig.5 Relative abundance of bacteria at the phylum level of sea bass fi llets during storage
图5 从门水平描述了鲈鱼制品贮藏过程微生物菌群结构变化。本实验自定义最大丰度排名前10的菌群为优势菌群。鲈鱼制品在贮藏过程中的优势微生物为:厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes),且在整个贮藏过程存在,说明这3 种微生物对鲈鱼的品质起着重要的作用,在今后的研究中可以重点探究其在鲈鱼品质变差的过程中的作用。对照组中的优势微生物厚壁菌门相对丰度在4 ℃冷藏过程中先上升后下降,变形菌门相对丰度在整个贮藏过程中持续上升,在货架期终点时达到最高,为73.2%,拟杆菌门相对丰度则在4 ℃冷藏过程中持续下降。气调包装的调理啤酒鲈鱼片中的优势微生物厚壁菌门相对丰度在整个-3 ℃微冻过程变化幅度不大,变形菌门相对丰度呈微弱上升的趋势,拟杆菌门相对丰度逐渐较小。这与范晓攀等[23]研究的肉类调理食品在门分类水平上微生物主要是变形菌门和厚壁菌门,这两类细菌占总菌数的80%~90%左右的结论基本一致,实验组中的微生物多样性不如对照组丰富。
2.4.2 基于属水平的菌群结构分析
图6是选择丰度排名前35的属,结合每个样品中的丰度信息,从物种的层面进行聚类的物种丰度聚类图,由鲈鱼制品在贮藏过程中的微生物丰度聚类图(图6A)可知,对照组鲈鱼片在贮藏第0天时优势菌为:鲸杆菌属(Cetobacterium)、优杆菌属(Eubacterium)、另枝菌属(Alistipes)。贮藏第2天时微生物发生了变化,优势菌以乳球菌属(Lactococcus)、生丝微菌属(Hyhomicrobium)、梭杆菌属(Cetobacterium)为主。第4天时微生物以索丝菌属(Brochothrix)、肉食杆菌属(Carnobacterium)为主,索丝菌广泛存在于环境中,是肉类食品中重要的腐败菌,也是导致真空包装肉制品在冷藏条件下腐败的主要微生物。说明从第4天开始,对照组中的鲈鱼片开始出现索丝菌属常见的腐败微生物,品质开始变差,有腐败变质的迹象。第6~8天肉食杆菌属、气单胞菌属(Aeromonas)快速生长。第10天时,嗜冷杆菌属(Psychrobacter)、索丝菌属、假单胞菌属丰度迅速增大,甚至出现了希瓦氏菌属(Shewanella),并且成为主要优势微生物,造成鲈鱼片的彻底腐败变质。熊振海等[20]的研究表明假单胞菌和希瓦氏菌都具有很强的腐败能力,是冷藏产品中主要的特定腐败菌。
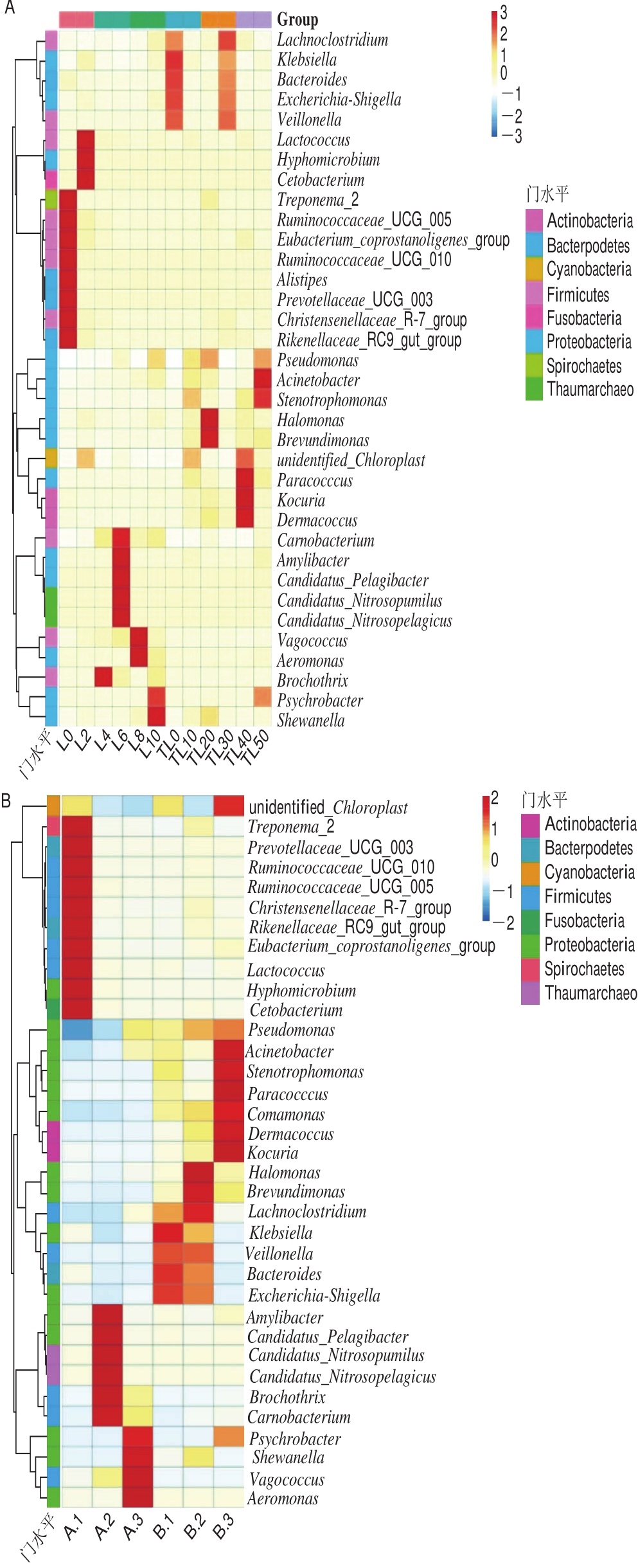
图6 鲈鱼制品在贮藏过程中的微生物丰度聚类图
Fig.6 Cluster heatmaps of bacterial genera based on relative abundance of sea bass fi llets during storage
调理啤酒鲈鱼片中的微生物群落结构较对照组发生了变化,贮藏第0天主要包括克雷伯氏杆菌属(Klebsiella)、拟杆菌属(Bacteroides)、埃希氏杆菌属(Escherichia)、韦永氏球菌属(Veillonella),而且还出现了一种新的微生物Lachnoclostridium;埃希氏杆菌属的检出说明产品可能受到了一定程度的污染。第10天时优势微生物包括寡养单胞菌属(Stenotrophomonas)、不动杆菌属(Acinetobacter)和未分类的菌。第20天时盐单胞菌属(Halomonas)、短波单胞菌属(Brevundimonas)成为主要优势微生物,同时出现了假单胞菌属和希瓦氏菌属等腐败菌。据研究报道,假单胞菌是导致冷藏肉腐败变质的主要优势菌[24-26],能够分解大分子蛋白质产生强烈的氨臭味,使其感官上不可接受,说明调理啤酒鲈鱼片在第20天才开始有变质的迹象。这与Hovda等[27]研究发现气调处理鳕鱼中假单胞菌属为优势菌群,气调处理能明显抑制嗜冷菌和产H2S菌的生长结论是一致的。而盐单胞菌属的出现,也说明调理啤酒鲈鱼片在腌制加工过程中,由于含有的盐对微生物进行了选择和富集,出现了耐盐的盐单胞菌属。第30~50天时优势微生物为皮生球菌属(Dermacoccus)、库克菌属(Kocuria)、副球菌属(Paracocccus)、假单胞菌属、不动杆菌属,此外还出现了次要优势微生物嗜冷杆菌属。嗜冷杆菌属出现较晚,这与Torrieri等[28]研究发现气调包装在0~2 ℃对嗜冷菌也有抑制作用的结论相同。
由图6B可以看出,气调包装的调理啤酒鲈鱼片中微生物种类和丰度明显低于对照组,说明气调包装中的CO2对微生物有一定的抑制作用。对照组鲈鱼片在冷藏过程中优势菌的种类波动较大,A.1时存在的优势菌属主要包括密螺旋体属(Treponema)、真杆菌属(Eubacterium)、乳球菌属、生丝微菌属、梭杆菌属,到了A.2时,菌相逐渐开始变的单一,索丝菌属、肉食杆菌属开始成为优势腐败菌,贮藏A.3时,索丝菌属、肉食杆菌属减弱,漫游球菌属(Vagococcus)丰度增强并成为优势菌,同时出现了较多的气单胞菌属(Aeromonas)、希瓦氏菌属、嗜冷杆菌属。气单胞菌属、希瓦氏菌属都属于氧化三甲胺和H2S的产生菌,可使鱼肉在贮藏过程中变色、发黏且产生不良气味[29]。
而调理啤酒鲈鱼片-3 ℃微冻贮藏过程中优势微生物种类在贮藏B.1和B.2变化不大,但在贮藏B.3时发生了较大变化,整个贮藏过程中的微生物种类也和对照组不同,说明鲈鱼的加工方式、包装方式和贮藏温度影响着微生物多样性。贮藏B.1的主要优势菌为埃希氏杆菌属、拟杆菌属、克雷伯氏杆菌属,Lachnoclostridium为次要优势微生物,贮藏B.2时,之前的主要优势菌丰度逐渐减弱,次要优势微生物Lachnoclostridium的丰度增强,同时出现了盐单胞菌、短波单胞菌属,假单胞菌属也开始生长繁殖。假单胞菌广泛存在于土壤、水和动植物体表中,容易导致肉类变黏,代谢产生过氧化物或H2S使肉类变色。随着贮藏时间的延长,优势微生物结构波动较大,多样性增加,假单胞菌属、不动杆菌属、嗜冷杆菌属的主导地位越来越显著,成为主要优势腐败菌;蓝蔚青等[30]研究也表明气调包装的鲳鱼在冷藏前期优势菌以革兰氏阴性菌为主,贮藏后期优势菌以腐败希瓦氏菌、荧光假单胞菌与嗜冷杆菌为主,气调处理对革兰氏阴性菌的生长有明显抑制。这说明气调包装和-3 ℃微冻贮藏能有效延缓假单胞菌属、不动杆菌属、嗜冷杆菌属这类腐败菌的出现和快速生长,并延长产品的货架期。
加工方式、包装方式和贮藏温度对鲈鱼片贮藏过程中微生物群落变化影响较大;鲈鱼片在整个贮藏过程中的优势微生物为厚壁菌门、变形菌门、拟杆菌门。处理组在-3 ℃微冻贮藏过程的微生物多样性远远低于贮藏在4 ℃的对照组。对照组在贮藏第4天时,开始出现了索丝菌属等常见的腐败微生物,到第10天时,索丝菌属、假单胞菌属丰度迅速增大,甚至出现了希瓦氏菌属,造成鲈鱼制品的彻底腐败变质。而处理组则在第20天时才开始出现假单胞菌和希瓦氏菌属等腐败菌,之后在CO2的抑制作用下,腐败菌丰度逐渐减小,直到货架期终点时,假单胞菌才迅速增长,并出现了嗜冷杆菌属,导致鲈鱼片的彻底腐败变质。采用啤酒等调味处理并经气调包装和微冻贮藏,可有效抑制鲈鱼腐败菌的生长,较好地延长产品货架期。
本实验室开发调理啤酒鲈鱼片的目的是为鲈鱼加工提供新的技术,开发当今消费者所需求的营养健康、方便快捷、个性风味的调理食品,延长产品在流通销售和食用的货架期。通过分析其微生物群落多样性,证明了采用啤酒调味加工技术的产品微生物多样性更丰富,可使有益微生物成为优势菌,有利于该产品形成独特风味,而气调包装方式和-3 ℃微冻的贮藏条件可以有效抑制微生物的生长,特别是腐败菌的产生,从而延长鱼片的货架期。该研究为具有特殊风味和啤酒香味的调理啤酒鲈鱼片的开发生产提供理论和技术依据。
[1] 吴燕燕, 李冰, 朱小静, 等. 养殖海水和淡水鲈鱼的营养组成比较分析[J]. 食品工业科技, 2016, 37(20): 348-352; 359.doi:10.13386/j.issn1002-0306.2016.20.061.
[2] 吴燕燕, 朱小静, 李来好, 等. 养殖日本真鲈和大口黑鲈原料特性比较[J]. 海洋渔业, 2016, 38(5): 507-515.doi:10.13233/j.cnki.mar.fi sh.2016.05.006.
[3] 李颖畅, 王亚丽, 齐凤元, 等. 紫菜多糖提取物对冷藏鲈鱼品质的影响[J]. 食品工业科技, 2014, 35(22): 336-339; 348.doi:10.13386/j.issn1002-0306.2014.22.065.
[4] 魏涯, 钱茜茜, 吴燕燕, 等. 栅栏技术在淡腌半干鲈鱼加工工艺中的应用[J]. 南方水产科学, 2017, 13(2): 109-120.doi:10.3969/j.issn.2095-0780.2017.02.014.
[5] PARLAPANI F F, MALLOUCHOS A, HAROUTOUNIAN S A, et al.Microbiological spoilage and investigation of volatile prof i le during storage of sea bream fi llets under various conditions[J]. International Journal of Food Microbiology, 2014, 189: 153-163.doi:10.1016/j.ijfoodmicro.2014.08.006.
[6] HANDELSMAN J. Metagenomics: application of genomics to uncultured microorganisms[J]. Microbiology and Molecular Biology Reviews, 2004, 68(4): 669-685.doi:10.1128/MMBR.68.4.669-685.2004.
[7] 李建柱, 侯杰, 张鹏飞, 等. 鱼菜共生模式中不同鱼类肠道微生物群落结构的比较[J]. 南方水产科学, 2016, 12(6): 42-50.doi:10.3969/j.issn.2095-0780.2016.06.006.
[8] 张岩, 吴燕燕, 李来好, 等. 16S rDNA序列分析鉴定一株合浦珠母贝共附生乳酸菌[J]. 南方水产科学, 2012, 8(6): 9-15.doi:10.3969/j.issn.2095-0780.2012.06.002.
[9] POŁKA J, REBECCHI A, PISACANE V, et al. Bacterial diversity in typical Italian salami at different ripening stages as revealed by high-throughput sequencing of 16S rRNA amplicons[J]. Food Microbiology, 2015, 46: 342-356.doi:10.1016/j.fm.2014.08.023.
[10] WILLIAMS S T, FOSTER P G, LITTLEWOOD D T J. The complete mitochondrial genome of a turbinid vetigastropod from MiSeq Illumina sequencing of genomic DNA and steps towards a resolved gastropod phylogeny[J]. Gene, 2014, 533(1): 38-47.doi:10.1016/j.gene.2013.10.005.
[11] YOUSSEF N, SHEIK C S, KRUMHOLZ L R, et al. Comparison of species richness estimates obtained using nearly complete fragments and simulated pyrosequencing-generated fragments in 16S rRNA gene-based environmental surveys[J]. Applied and Environmental Microbiology, 2009, 75(16): 5227-5236.doi:10.1128/AEM.00592-09.
[12] 吴燕燕, 钱茜茜, 李来好, 等. 基于Illumina MiSeq技术分析腌干鱼加工过程中微生物群落多样性[J]. 食品科学, 2017, 38(12): 1-8.doi:10.7506/spkx1002-6630-201712001.
[13] 聂志强, 韩玥, 郑宇, 等. 宏基因组学技术分析传统食醋发酵过程微生物多样性[J]. 食品科学, 2013, 34(15): 198-203.doi:10.7506/spkx1002-6630-201315041.
[14] 吴燕燕, 朱小静, 李来好, 等. 比较调理啤酒鲈鱼片在不同贮藏条件下的品质变化[J]. 食品科学, 2018, 39(11): 214-220.doi:10.7506/spkx1002-6630-201811034.
[15] HUSE S M, DETHLEFSEN L, HUBER J A, et al. Exploring microbial diversity and taxonomy using SSU rRNA hypervariable tag sequencing[J]. PLoS Genetics, 2008, 4(11): 1-10.doi:10.1371/journal.pgen.1000255.
[16] MAGOC T, SALZBERG S L. FLASH: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21):2957-2963.doi:10.1093/bioinformatics/btr507.
[17] BOKULICH N A, SUBRAMANIAN S, FAITH J J, et al. Qualityfi ltering vastly improves diversity estimates from Illumina amplicon sequencing[J]. Nature Methods, 2012, 10(1): 57-59.doi:10.1038/nmeth.2276.
[18] BULGARELLI D, GARRIDO-OTER R, MÜNCH P C, et al. Structure and function of the bacterial root microbiota in wild and domesticated barley[J]. Cell Host & Microbe, 2015, 17(3): 392-403.doi:10.1016/j.chom.2015.01.011.
[19] EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998.doi:10.1038/nmeth.2604.
[20] 熊振海, 马晨晨. 冷却牛肉货架期及微生物多样性分析[J]. 食品安全质量检测学报, 2014, 5(7): 2109-2113.
[21] 谢萍, 徐明生, 尹忠平, 等. MiSeq测序研究散装酱卤鸭肉贮藏期间微生物群落多样性[J]. 现代食品科技, 2015, 31(11): 120-126; 106.doi:10.13982/j.mfst.1673-9078.2015.11.020.
[22] 梁荣蓉. 生鲜鸡肉调理制品菌群结构分析和货架期预测模型的研究[D]. 泰安: 山东农业大学, 2010: 40-56.
[23] 范晓攀, 王娉, 陈颖, 等. 肉类调理食品中细菌多样性的分析[J]. 现代食品科技, 2017, 33(1): 237-242.doi:10.13982/j.mfst.1673-9078.2017.1.036.
[24] GILL C O, DUSSAULT F, HOLLEY R A, et al. Evaluation of the hygienic performances of the processes for cleaning, dressing and cooling pig carcasses at eight packing plants[J]. International Journal of Food Microbiology, 2000, 58(1): 65-72.doi:10.1016/S0168-1605(00)00294-4.
[25] 蔡秋杏, 李来好, 陈胜军, 等. 液熏罗非鱼片加工过程中微生物群落的PCR-DGGE分析[J]. 食品科学, 2009, 30(23): 35-40.
[26] 胡萍, 周光宏, 徐幸莲, 等. 应用PCR-DGGE指纹技术研究真空包装火腿切片贮藏过程中的微生物动态变化[J]. 南京农业大学学报,2009, 32(2): 137-140.
[27] HOVDA M B, LUNESTAD B T, SIVERTSVIK M, et a1.Characterisation of the bacterial fl ora of modif i ed atmosphere packaged farmed Atlantic cod (Gadus morhua) by PCR-DGGE of conserved 16S rRNA gene regions[J]. Internal Journal of Food Microbiology,2007, 117(1): 68-75.doi:10.1016/j.ijfoodmicro.2007.02.022.
[28] TORRIERI E, CAVELLA S, VILLANI F, et al. Inf l uence of modif i ed atmosphere packaging on the chilled shelf life of gutted farmed bass(Dicentrarchus labrax)[J]. Journal of Food Engineering, 2006, 77(4):1078-1086. DOI.10.1016/j.jfoodeng.2005.08.038.
[29] 李蕾蕾, 王素英. 南美白对虾在低温贮藏过程中的品质及菌相变化分析[J]. 食品科学, 2014, 35(18): 246-251.doi:10.7506/spkx1002-6630-201418047.
[30] 蓝蔚青, 张皖君, 谢晶, 等. 气调包装对鲳鱼冷藏期间主要微生物多样性的影响[J]. 中国食品学报, 2017, 17(2): 152-159.doi:10.16429/j.1009-7848.2017.02.021.
Microbial Community Diversity Analysis of Prepared Sea Bass Fillet (Lateolabrax japonicus) with Beer during Partially Frozen Storage under Modif i ed Atmosphere Packaging