肉色能够直观地反映肉品的新鲜度和卫生状况,是影响消费者购买欲望的最重要指标[1]。根据联合国粮食及农业组织2016年报道[2],失色是导致消费者拒绝购买食用肉制品的主要原因,给肉品的生产和销售带来了巨大浪费,仅美国肉类行业每年就会因产品的失色问题造成高达10亿 美元的经济损失。
气调包装技术可以通过改变肉品原有贮藏环境中的气体成分保护良好肉色并抑制微生物的生长,是一种被广泛用来改善产品肉色的有效手段。目前全球市场上最流行的气调包装方式是采用体积分数80% O2配合20%CO2的高氧气调包装。高氧环境可以促进肉的表面形成层次更深的氧合肌红蛋白,使肉品呈现出诱人的鲜红色,从而吸引消费者的购买。然而,肉品在高氧环境下长时间贮藏会加速氧合肌红蛋白氧化成棕褐色的高铁肌红蛋白,导致贮藏后期肉品出现褐变失色现象[3]。
良好肉色的维持主要取决于肉色是否稳定,通常高铁肌红蛋白还原能力(metmyoglobin reductase activity,MRA)和氧气消耗率(oxygen consumption rate,OCR)是决定肉色稳定性的关键指标[4]。在肉品成熟过程中,涉及糖酵解、线粒体代谢活性的一些肌浆蛋白会影响肉中烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)、抗氧化物质的含量以及高铁肌红蛋白还原酶的活性,进而影响肉品的MRA、OCR[5-6]。基于双向电泳技术(two-dimensional electrophoresis,2DE)的蛋白质组学分析可以很好地分离并识别肌肉向肉品转变过程中那些发生变化的差异蛋白,是研究肌肉宰后代谢进程的有力工具,然而目前有关肉色蛋白质组学的研究还多集中于比较不同部位肉的肉色稳定性差异上[6-8],而且这些研究多为观测宰后初期的蛋白表达量变化,对于长期贮藏过程中包装方式对肉色影响的蛋白质组学分析却鲜有报道。
从蛋白质组学的角度来探究贮藏期间高氧气调包装牛排肉色稳定性发生变化的原因,寻找与肉色相关的潜在蛋白质生物标签,可以更好地了解高氧气调包装的护色机理,为控制贮藏后期的肉品失色问题提供相关理论依据。
实验所用的腰背最长肌均购自山东某肉牛屠宰企业的4 头鲁西黄牛(26~30 月龄,286~315 kg 胴体质量,极限pH值为5.5~5.7),胴体在2~4 ℃下排酸48 h,然后取整块西冷部位并真空包装,将样品置于冰上迅速运回实验室进行分割。
甘油、亚硝酸钠、甲醇、磷酸 天津市凯通化学试剂有限公司;尿素、甘氨酸、硫脲、二硫苏糖醇(1,4-dithiothreitol,DTT)、3-[(3-胆固醇氨丙基)二甲基氨基]-1-丙磺酸、三羟甲基氨基甲烷(Tris-base)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、丙烯酰胺、碘代乙酰胺(iodoacetamide,IAA)、甲叉双丙烯酰胺、四甲基乙二胺、过硫酸铵、溴酚蓝、琼脂糖、考马斯亮蓝 北京索莱宝科技有限公司;IPG干胶条(24 cm,pH 3~10) 美国通用电气医疗集团;非干扰型蛋白浓度测定试剂盒 生工生物工程(上海)股份有限公司。
DT-6D气调包装机 中国大江机械设备有限公司;C200真空包装机 德国莫迪维克包装设备有限公司;SP62便携式色差计 美国爱色丽仪器有限公司;T18高速分散机 德国艾卡仪器设备有限公司;5804R高速冷冻离心机 德国艾本德有限公司;Ettan IPGphor III等电聚焦仪、Ettan DALTsix垂直电泳仪、ImageScanner III图像扫描仪 美国通用医疗集团;5800基质辅助激光解吸电离串联飞行时间质谱(matrix-assisted laser desorption ionization time of f l ight/time of f l ight,MALDI-TOF/TOF)质谱仪 美国SCIEX公司。
1.3.1 样品包装
在实验室将所有腰背最长肌分切成标准的2.54 cm牛排,然后随机放入包装盒内进行80% O2+20% CO2(以体积分数计)高氧气调包装,顶隙空间比为3∶1,每个贮藏时间点有8 块独立包装牛排作为重复实验单元。将所有包装放入2 ℃冷库黑暗贮藏15 d,分别在第5、10、15天取出包装并测定牛排的肉色指标,进行蛋白质组学分析。包装前随机取出8 块牛排测定以下各项指标作为第0天的初始指标。
1.3.2 肉色常规指标测定
第0天的牛排2 ℃下暴露于空气中发色30 min后测定肉色,贮藏第5、10、15天的牛排在打开各自包装后立即用便携式色差计测定牛排的亮度(L*)、红度(a*)、黄度(b*)。按照式(1)计算色彩饱和度。每个样品重复测量6 次,取其平均值。
高铁肌红蛋白相对含量(即高铁肌红蛋白占总肌红蛋白的相对比例)的测定参照文献[9]。色差计记录下400~700 nm波长之间所有间隔10 nm的反射率,根据线性关系计算出525 nm和572 nm波长处的反射率(R值),其对应的吸收散射系数(K/S)根据Kubelka-Munk公式(K/S=(1−R)2/(2R))计算得出,再根据K/S在572 nm与525 nm波长处的比值计算出高铁肌红蛋白相对含量。
1.3.3 MRA测定
MRA测定参考Sammel等[10]提出的方法稍作改进。在牛排中央位置取2.54 cmh2.54 cmh2.54 cm立方体肉样(无结缔组织和脂肪),沿牛排展示面方向将立方体一分为二,上层肉样正面朝上浸泡在50 mL 3 g/L NaNO2溶液中,室温放置20 min,然后取出肉样,用滤纸擦干肉样表面的NaNO2溶液,真空包装,立即测量肉样表面的反射率,计算此时的高铁肌红蛋白相对含量(即初始高铁肌红蛋白相对含量);真空包装的肉样30 ℃下放置2 h,再次测定肉样表面的反射率,每次扫描3 次,计算高铁肌红蛋白相对含量(最终高铁肌红蛋白相对含量)。MRA的计算见式(2)。
1.3.4 OCR测定
参考Madhavi等[11]提出的方法稍作改进。将下层肉样鲜切面朝上在2 ℃空气中发色30 min,真空包装后直接用色差计扫描,并参考文献[9]计算初始氧合肌红蛋白相对含量,然后将包装肉样在30 ℃下放置30 min,再次扫描并计算氧合肌红蛋白相对含量(最终氧合肌红蛋白相对含量),每次扫描3 次。OCR的计算见式(3)。
1.3.5 蛋白质组学分析
1.3.5.1 肌浆蛋白的提取
取2 g牛肉样品,按1∶5(m/V)的比例加入提取液(40 mmol/L Tris-base、2 mmol/L EDTA,调pH值至8.0)、120 μL 2 mol/L DTT,冰浴匀浆,4 ℃下15 000hg离心20 min,取上清液即为肌浆蛋白,分装冻藏(-80 ℃)备用。
1.3.5.2 一向等电聚焦
等电聚焦前,先用非干扰型蛋白浓度测定试剂盒测定样品的蛋白浓度,然后对IPG干胶条进行上样水化,上样量为800 μg。采用Ettan IPGphor Ⅲ聚焦仪对泡胀好的胶条进行一向等电聚焦,设定聚焦程序为:300 V/1 h;1 000 V/1 h;grd 4 000 V/1 h;10 000 V/2.5 h;grd 10 000 V至80 000 V•h;grd 300 V/10 h。
1.3.5.3 二向聚丙烯酰氨凝胶电泳
聚焦结束后,分别用含10 g/L DTT和45 g/L IAA的胶条平衡缓冲液(含6 mol/L尿素、20 g/L SDS、体积分数30%甘油、体积分数0.002%溴酚蓝)各4 mL去平衡胶条15 min。将平衡好的IPG胶条转移到125 g/L SDS-聚丙烯酰胺凝胶上端,将电泳缓冲液倒入电泳槽中。设置电泳仪参数:100 W电泳1 h,然后300 W下电泳约5 h,直到溴酚蓝到达凝胶底部后关闭电泳,用考马斯亮蓝染色液对凝胶染色。
1.3.5.4 图像扫描与质谱识别
将染色后的凝胶取出放入脱色液(体积分数1%冰醋酸)中摇晃脱色,多次更换脱色液至蛋白点清晰可见,通过图像扫描仪对脱色后的凝胶进行扫描获得图谱,寻找差异蛋白质点。采用质谱仪对差异蛋白进行质谱检测,主要操作过程为:切胶→胶内酶解→ZipTip脱盐→抽提酶解肽段→MALDI-TOF/TOF质谱鉴定。最后用UniProt数据库对质谱数据进行检索,识别差异蛋白的种类。
采用SSPS 18.0数据统计分析软件进行单因素方差分析,并计算Pearson相关系数,P<0.05表示差异显著。数据结果用平均值±标准差表示。使用PDQuest软件对不同贮藏时间组之间的同类蛋白进行图谱匹配,并分别将第5、10、15天的蛋白质丰度与第0天相对应的蛋白质丰度进行比较,两组间蛋白丰度相差1.5 倍以上且有显著差异(P<0.05)的蛋白点为差异蛋白点。
如表1所示,牛排的L*值在贮藏的0~10 d内显著升高(P<0.05),并在贮藏后期一直维持较高的稳定水平,说明高氧气调包装可以赋予牛排较好的亮度。贮藏前期,牛排具有较高的a*值和色彩饱和度,这主要是由于氧合肌红蛋白的大量形成以及肉品具有较高的肉色稳定性,但贮藏5 d后二者随贮藏时间延长快速下降(P<0.05)。b*值在15 d内也表现出类似于a*值先增高后降低的变化趋势。伴随着a*值和色彩饱和度的下降(贮藏5~15 d内),贮藏期间牛排的高铁肌红蛋白相对含量随贮藏时间延长显著升高(P<0.05),这些都预示着牛排的肉色稳定性不断降低,失色现象正在逐渐发生。Estévez[12]的研究表明高氧环境会损耗并破坏肉中的还原系统,促使氧合肌红蛋白氧化成为高铁肌红蛋白,从而加速了牛排的褐变速率。
表1 贮藏期间高氧气调包装冷却牛排的肉色指标变化
Table1 Changes in meat color traits of HiOx-MAP steak during chilled storage
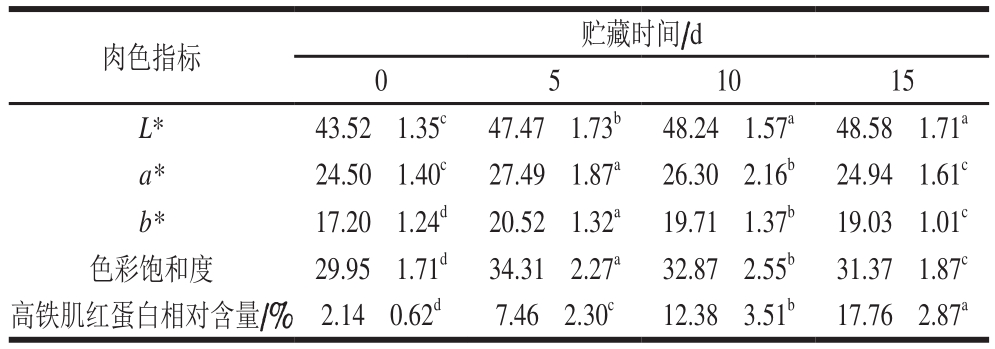
注:同行肩标小写字母不同表示差异显著(P<0.05)。
肉色指标 贮藏时间/d 0 59 15 L* 43.52f1.35c 47.47f1.73b 48.24f1.57a 48.58f1.71a a* 24.50f1.40c 27.49f1.87a 26.30f2.16b 24.94f1.61c b* 17.20f1.24d 20.52f1.32a 19.71f1.37b 19.03f1.01c色彩饱和度 29.95f1.71d 34.31f2.27a 32.87f2.55b 31.37f1.87c高铁肌红蛋白相对含量/% 2.14f0.62d 7.46f2.30c 12.38f3.51b 17.76f2.87a
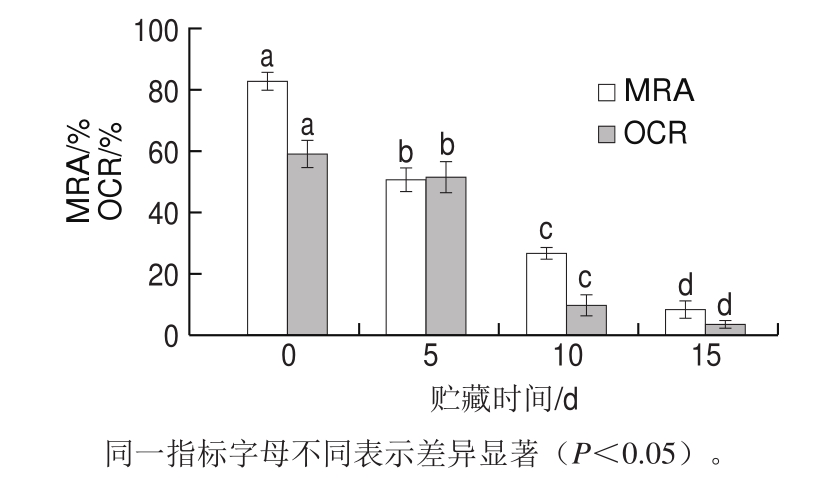
图1 贮藏期间高氧气调包装冷却牛排MRA和OCR变化
Fig.1 Changes in MRA and OCR of HiOx-MAP steak during chilled storage
MRA是指肉中的还原系统把高铁肌红蛋白还原成脱氧肌红蛋白的能力,通常肉色稳定性与MRA之间存在较高的正相关性[13]。OCR是指肉中线粒体消耗氧气的速率,成熟过程中肉品内部的线粒体活性会不断降低而且其形态也会发生改变,进而导致OCR的下降,肉色稳定性也随之降低[13]。由图1可知,贮藏期间牛排的MRA随时间延长而快速降低(P<0.05),这可能引发了高铁肌红蛋白的大量积累,从而导致高氧气调包装牛排在贮藏后期a*值和色彩饱和度的快速下降;贮藏期间牛排OCR也显著下降(P<0.05),有研究表明线粒体的结构在较高的氧气浓度下会遭到破坏,例如,一些脂质氧化产物就能破坏线粒体的膜结构,进而降低其活性[14]。高氧气调包装牛排的肉色稳定性在贮藏后期出现快速下降,这可能与高氧环境加速了肉中MRA和OCR的下降有关。
通过质谱,本研究共鉴定出20 个可信度大于95%的差异蛋白质点,这些蛋白点在凝胶图像中的位置如图2所示,与之对应的蛋白名称、检索号、分子质量、等电点、蛋白得分、肽段数、序列覆盖率和差异倍数如表2所示。这些差异蛋白质主要是一些代谢酶类、伴侣蛋白、结构蛋白、抗氧化蛋白和转运蛋白等,其中代谢酶类是最主要的蛋白质种类。共发现了8 种代谢酶,其中4 种酶类主要参与了糖酵解进程,包括果糖-二磷酸醛缩酶、丙酮酸激酶(点6624和点4422)、3-磷酸甘油醛脱氢酶和果糖-1,6-二磷酸酶同工酶2,还发现了参与三羧酸循环代谢的苹果酸脱氢酶和黄素还原酶,这些酶类的蛋白表达量随贮藏时间的延长出现了不同程度的下调。对于结果中出现的同一种蛋白对应不同蛋白点的现象,在其他文献中也都有类似报道,其可能是蛋白翻译后的修饰现象(磷酸化、乙酰化等)、不同蛋白亚型的存在,以及蛋白质的碎片化等导致的[15-17]。在动物宰后肌肉向肉品转化的过程中,肌肉中的生化反应和能量代谢并没有立即停止,而是进行糖酵解等代谢途径,并伴随着NADH和少量ATP的生成。在这一过程中,糖酵解酶和一些能量代谢酶类的活性通常会影响宰后肌肉的颜色、嫩度以及保水性等,对肉的品质具有决定性作用[15,17-18]。
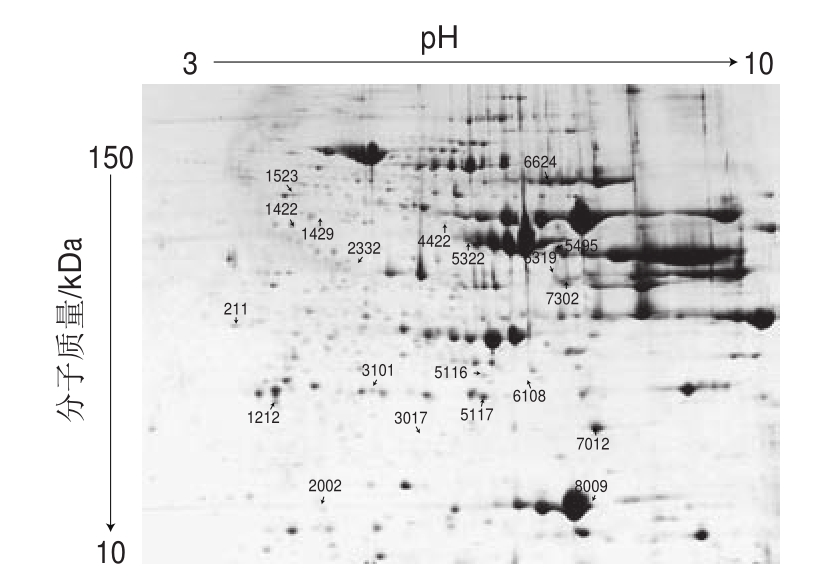
图2 贮藏期间高氧气调包装冷却牛排2DE差异蛋白点标记
Fig.2 Two-dimensional gel electrophoresis (2DE) of differentially abundant proteins in HiOx-MAP steak during chilled storage
本研究还检测出了两种热休克蛋白,热休克蛋白是细胞内最重要的伴侣蛋白,可以在蛋白质水解过程中使破损的蛋白重定向,并可以保护、维持并修复细胞内一些重要蛋白质分子的功能性构象,还能调节蛋白稳定性及激酶活性,具有抗氧化损伤和抗细胞凋亡的保护作用[19];DJ-1蛋白则是另一种对氧化还原敏感的伴侣蛋白,可保护神经元免于氧化应激和细胞死亡[20]。此外,检测到的抗氧化蛋白2则是一种在生物体内普遍存在的抗氧化酶,它们可以通过硫氧还蛋白对体内代谢产生的氧化物或超氧化物进行还原,清除氧自由基,因而具有抗氧化的生理作用[21]。以上这些蛋白的表达量发生显著变化,尤其是抗氧化蛋白2、DJ-1蛋白(点3101)和热休克蛋白的表达量在贮藏后期出现上调,其原因可能是高氧环境诱发了牛排的氧化应激反应,通过激发机体自身的抗氧化系统来抵御氧化应激所带来的损伤,进而起到减缓肌红蛋白氧化的作用。
表2 贮藏期间高氧气调包装冷却牛排的差异蛋白质信息
Table2 Identi fi ed differentially expressed proteins in HiOx-MAP steak during chilled storage
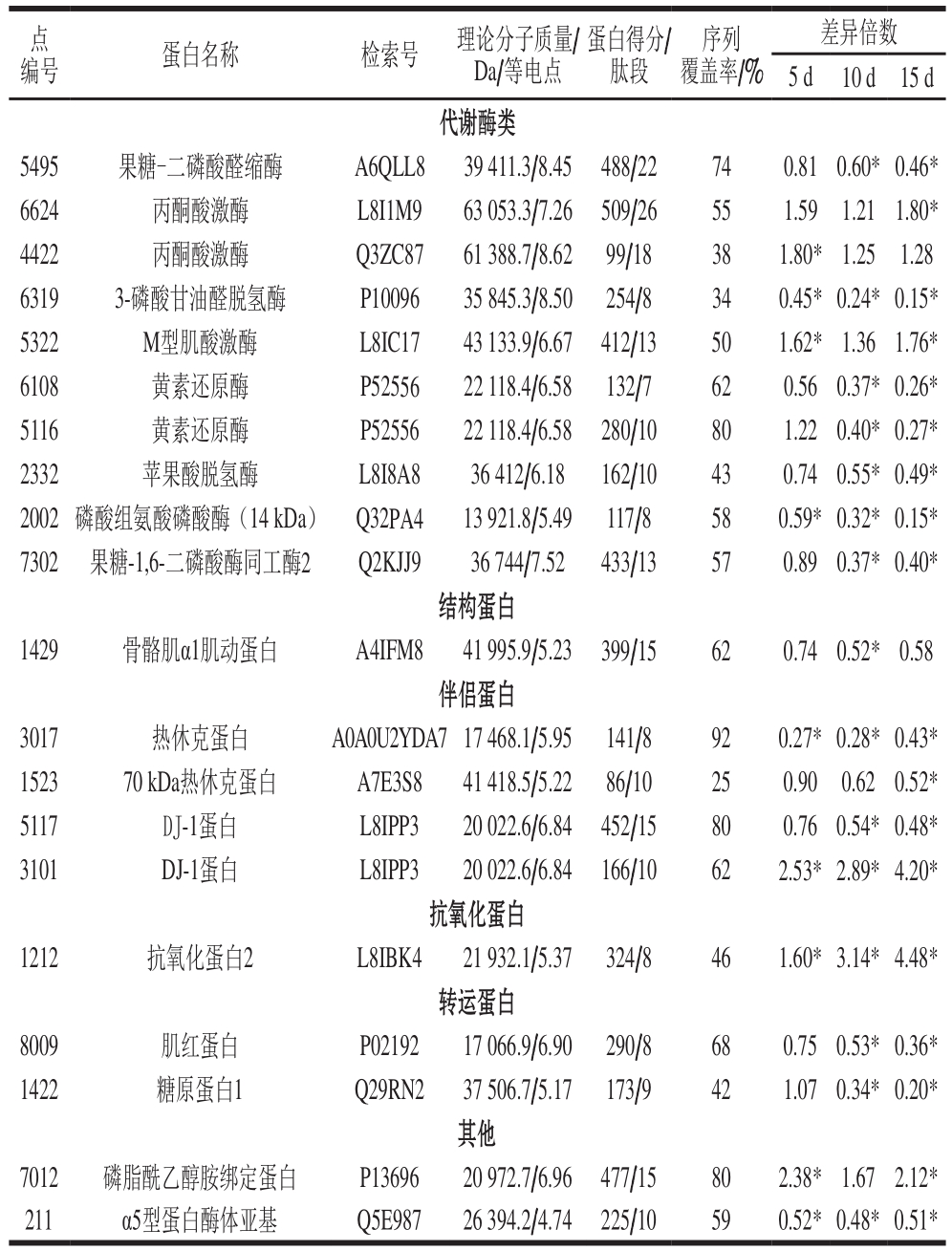
注:*.与初始组(贮藏0 d)相比,组间蛋白丰度差异倍数大于1.5 倍,且差异显著(P<0.05)。
差异倍数5 d 10 d 15 d代谢酶类5495 果糖-二磷酸醛缩酶 A6QLL8 39 411.3/8.45 488/22 74 0.81 0.60*0.46*6624 丙酮酸激酶 L8I1M9 63 053.3/7.26 509/26 55 1.59 1.21 1.80*4422 丙酮酸激酶 Q3ZC87 61 388.7/8.62 99/18 38 1.80*1.25 1.28 6319 3-磷酸甘油醛脱氢酶 P10096 35 845.3/8.50 254/8 34 0.45*0.24*0.15*5322 M型肌酸激酶 L8IC17 43 133.9/6.67 412/13 50 1.62*1.36 1.76*6108 黄素还原酶 P52556 22 118.4/6.58 132/7 62 0.56 0.37*0.26*5116 黄素还原酶 P52556 22 118.4/6.58 280/10 80 1.22 0.40*0.27*2332 苹果酸脱氢酶 L8I8A8 36 412/6.18 162/10 43 0.74 0.55*0.49*2002 磷酸组氨酸磷酸酶(14 kDa)Q32PA4 13 921.8/5.49 117/8 58 0.59*0.32*0.15*7302 果糖-1,6-二磷酸酶同工酶2 Q2KJJ9 36 744/7.52 433/13 57 0.89 0.37*0.40*结构蛋白1429 骨骼肌α1肌动蛋白 A4IFM8 41 995.9/5.23 399/15 62 0.74 0.52*0.58伴侣蛋白3017 热休克蛋白 A0A0U2YDA7 17 468.1/5.95 141/8 92 0.27*0.28*0.43*1523 70 kDa热休克蛋白 A7E3S8 41 418.5/5.22 86/10 25 0.90 0.62 0.52*5117 DJ-1蛋白 L8IPP3 20 022.6/6.84 452/15 80 0.76 0.54*0.48*3101 DJ-1蛋白 L8IPP3 20 022.6/6.84 166/10 62 2.53*2.89*4.20*抗氧化蛋白1212 抗氧化蛋白2 L8IBK4 21 932.1/5.37 324/8 46 1.60*3.14*4.48*转运蛋白8009 肌红蛋白 P02192 17 066.9/6.90 290/8 68 0.75 0.53*0.36*1422 糖原蛋白1 Q29RN2 37 506.7/5.17 173/9 42 1.07 0.34*0.20*其他7012 磷脂酰乙醇胺绑定蛋白 P13696 20 972.7/6.96 477/15 80 2.38*1.67 2.12*211 α5型蛋白酶体亚基 Q5E987 26 394.2/4.74 225/10 59 0.52*0.48*0.51*编号 蛋白名称 检索号 理论分子质量/Da/等电点点蛋白得分/肽段序列覆盖率/%
表3 高氧气调包装冷却牛排贮藏期间差异蛋白质表达量与肉色指标的相关性
Table3 Correlations between differentially abundant proteins in HiOx-MAP chilled steak and different meat color traits
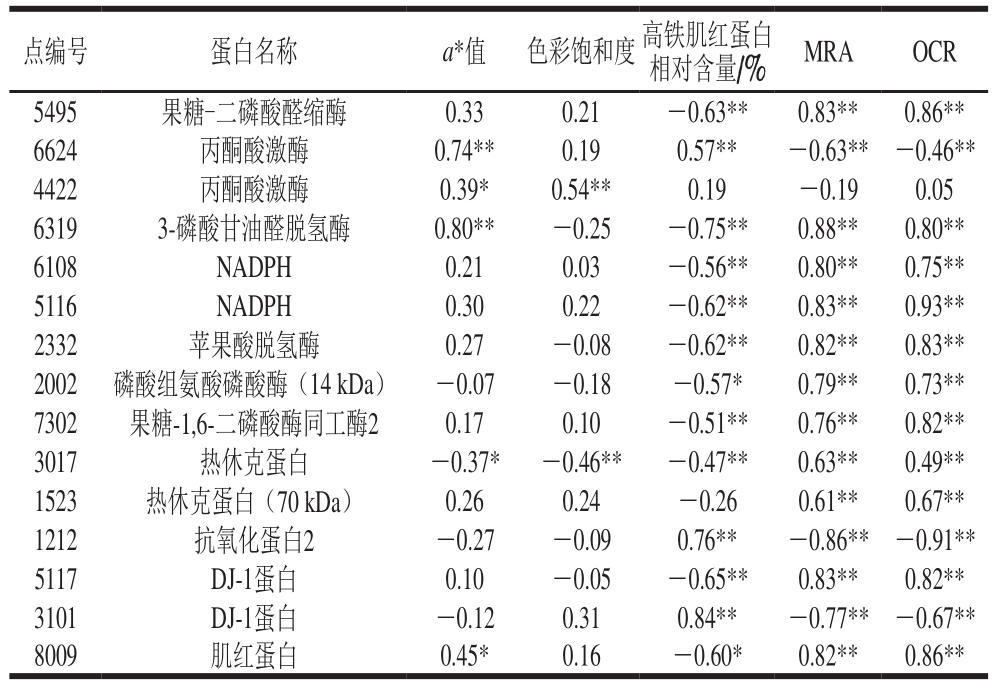
注:*.显著相关(P<0.05);**.极显著相关(P<0.01)。
点编号 蛋白名称 a*值 色彩饱和度高铁肌红蛋白相对含量/% MRA OCR 5495 果糖-二磷酸醛缩酶 0.33 0.21 -0.63** 0.83** 0.86**6624 丙酮酸激酶 0.74** 0.19 0.57** -0.63** -0.46**4422 丙酮酸激酶 0.39* 0.54** 0.19 -0.19 0.05 6319 3-磷酸甘油醛脱氢酶 0.80** -0.25 -0.75** 0.88** 0.80**6108 NADPH 0.21 0.03 -0.56** 0.80** 0.75**5116 NADPH 0.30 0.22 -0.62** 0.83** 0.93**2332 苹果酸脱氢酶 0.27 -0.08 -0.62** 0.82** 0.83**2002 磷酸组氨酸磷酸酶(14 kDa)-0.07 -0.18 -0.57* 0.79** 0.73**7302 果糖-1,6-二磷酸酶同工酶2 0.17 0.10 -0.51** 0.76** 0.82**3017 热休克蛋白 -0.37* -0.46** -0.47** 0.63** 0.49**1523 热休克蛋白(70 kDa)0.26 0.24 -0.26 0.61** 0.67**1212 抗氧化蛋白2 -0.27 -0.09 0.76** -0.86** -0.91**5117 DJ-1蛋白 0.10 -0.05 -0.65** 0.83** 0.82**3101 DJ-1蛋白 -0.12 0.31 0.84** -0.77** -0.67**8009 肌红蛋白 0.45* 0.16 -0.60* 0.82** 0.86**
如表3所示,贮藏过程中有15 个差异蛋白与高氧气调包装牛排肉色指标密切相关,这些蛋白主要是一些代谢酶类、伴侣蛋白、抗氧化蛋白以及肌红蛋白。其中丙酮酸激酶、3-磷酸甘油醛脱氢酶、热休克蛋白、肌红蛋白都与常规肉色指标a*值或色彩饱和度有显著的相关性,是反映牛排肉色稳定性变化的重要潜在蛋白质生物标签。作为糖酵解过程中最后一个酶也是主要的限速酶之一[22],丙酮酸激酶的表达量与a*值和色彩饱和度值呈正相关性,且丙酮酸激酶(4422)与二者显著相关。3-磷酸甘油醛脱氢酶的表达量与a*值、MRA、OCR都呈极显著正相关(P<0.01),与高铁肌红蛋白相对含量则呈极显著负相关(P<0.01),这种酶也是参与糖酵解进程的关键酶,它通过催化3-磷酸甘油醛的氧化磷酸化来影响糖酵解代谢速率,并调控着NADH的生成[23]。NADH对于高铁肌红蛋白的还原必不可少,高铁肌红蛋白还原酶通过NADH传递电子给高铁肌红蛋白,使得高铁肌红蛋白中的三价铁离子还原成二价铁离子[13]。此外,肌红蛋白的表达量与a*值、MRA、OCR呈显著或极显著正相关,Wu Wei等[6]在研究托盘包装牛排肉色相关蛋白变化时也有类似报道。Canto等[15]发现相较于肉色稳定性差的牛排,肌红蛋白表达量在肉色更稳定的牛排中得到上调,并指出透氧托盘包装贮藏过程中肌红蛋白的降解可能会导致其表达量下调,进而降低了肉色稳定性。因此,高氧气调包装贮藏过程中,肉色稳定性的降低可能与肌红蛋白的表达量下调有关。热休克蛋白表达量与a*值和色彩饱和度值显著或极显著负相关,与MRA、OCR极显著正相关,牛排在贮藏后期出现的热休克蛋白表达量上调现象(表2),可能是机体通过热休克蛋白来抵御氧化损伤的结果。
研究还发现,在代谢酶中,果糖-二磷酸醛缩酶、果糖-1,6-二磷酸酶同工酶2、黄素还原酶、苹果酸脱氢酶以及14 kDa磷酸组氨酸磷酸酶与牛排的MRA和OCR呈显著的正相关性(P<0.01)。其中果糖-1,6-二磷酸酶同工酶2可催化果糖-1,6-二磷酸水解生成果糖-6-磷酸和磷酸,而果糖-1,6-二磷酸则是糖酵解过程中的重要中间反应物[24]。果糖-二磷酸醛缩酶可以催化3-磷酸甘油醛和磷酸二羟丙酮之间发生可逆的羟醛裂解反应,也是参与糖酵解的重要酶类,牛肉成熟过程中果糖-二磷酸醛缩酶B的表达量下调已被其他学者证明[25]。鉴于糖酵解是NADH生成的重要途径,贮藏期间果糖-1,6-二磷酸酶同工酶2和果糖-二磷酸醛缩酶的表达量下调可能导致了肉中NADH的减少,从而降低了牛排的MRA,使牛排的肉色稳定性不断降低。苹果酸脱氢酶和黄素还原酶则分别是三羧酸循环中调控NADH和还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinarnide adenine dinucleotide,NADPH)生成的关键酶,NADH和NADPH都对维持肉色稳定性至关重要[26]。另外,NADH作为线粒体电子传递链中的重要反应物与再生产物,其含量和氧气摄入量显著相关,较低的NADH含量会降低牛排的OCR[27]。目前关于14 kDa磷酸组氨酸磷酸酶影响肉色的机理还尚不明确,但Joseph等[8]曾报道这种酶的表达量在肉色稳定的西冷部位要显著高于其在肉色不稳定的里脊部位的表达量,说明14 kDa磷酸组氨酸磷酸酶的表达量下调不利于维持肉色稳定。研究表明氧化环境导致的蛋白质氧化会造成一些酶原有功能的丧失,并降低其活性,另外,蛋白质在氧化过程中所发生的结构改变会使其变得更易被降解[28];因此贮藏过程中高氧气调包装可能会降低牛排中这些参与糖酵解和三羧酸循环的代谢酶的表达量,进而降低NADH和NADPH的生成量,引发牛排的MRA和OCR快速下降,肉色稳定性也随之降低。
贮藏期间,抗氧化蛋白2的表达量与高铁肌红蛋白相对含量呈显著正相关性,与MRA和OCR则显著负相关(P<0.01),暗示着高氧气调包装可能会激发抗氧化蛋白2的表达量上调以达到保护机体免受氧化损伤的目的,从而缓解肌红蛋白的氧化。DJ-1蛋白在细胞抵御氧化应激的反应中也发挥着关键作用[29],Wu Wei等[30]发现贮藏中牛排的a*值、MRA与DJ-1蛋白表达量呈显著的负相关性,并指出DJ-1蛋白可以作为指示贮藏后期肉品颜色变化的重要生物标签。本实验结果显示,不同DJ-1蛋白亚型(点5117和点3101)的表达量与各肉色指标呈现出相反的相关性,其中点3101与高铁肌红蛋白相对含量、MRA和OCR之间表现出类似于抗氧化蛋白2的相关性,点5117则与高铁肌红蛋白相对含量呈极显著负相关,与MRA和OCR极显著正相关(P<0.01)。有研究指出当肉品处于恶劣的贮藏环境中时,会促使DJ-1蛋白的表达量上调,但DJ-1蛋白会也在对抗氧化损伤的过程中不断被消耗[20,29,31]。因此推测对于高氧气调包装牛排,DJ-1蛋白的表达量可能会随时间延长出现先上升后下降的趋势,其变化趋势出现拐点的时间则由这种蛋白表达量的上调程度和自身被消耗的程度共同决定,这导致了不同DJ-1蛋白亚型的表达量与肉色指标的相关性并不一致。
贮藏过程中,高氧气调包装牛排的MRA和OCR随贮藏时间延长而快速下降,这导致了牛排的a*值和色彩饱和度贮藏5 d后显著降低,高铁肌红蛋白相对含量显著升高,牛排的肉色稳定性不断降低。通过蛋白质组学分析以及差异蛋白与各肉色指标之间的相关性分析,发现一些参与糖酵解和能量代谢的酶类、抗氧化蛋白、氧化应激相关的伴侣蛋白以及肌红蛋白是涉及高氧气调包装牛排肉色稳定性变化的重要因素,可作为研究肉品褐变失色现象的潜在生物标签。其中丙酮酸激酶、3-磷酸甘油醛脱氢酶、果糖-二磷酸醛缩酶和果糖-1,6-二磷酸酶同工酶2通过调节糖酵解进程来影响NADH的产生,而苹果酸脱氢酶和黄素还原酶则通过调节三羧酸循环来影响NADH和NADPH的产生,贮藏期间这些酶表达量的下调可能减少了NADH和NADPH的产生,进而降低了牛排的MRA和OCR。还发现高氧气调包装贮藏过程中,肉色稳定性的降低可能也与肌红蛋白的表达量下调有关。另外,抗氧化蛋白2、热休克蛋白以及DJ-1蛋白的表达量也与肉色指标密切相关,高氧环境可能会引起肉品的氧化应激反应,从而促使这些蛋白表达量出现上调来保护机体免受氧化损伤,进而减缓肌红蛋白的氧化。综上所述,本研究所发现的蛋白标签可以从机理上为解释高氧气调包装肉品的肉色变化提供有意义的理论依据。
[1] MANCINI R A, HUNT M C. Current research in meat color[J]. Meat Science, 2005, 71(1): 100-121.doi:10.1016/j.meatsci.2005.03.003.
[2] SEGRE A, FALASCONI L. Save food: global initiative on food loss and waste reduction[R]. Italy: FAO, 2016.
[3] YANG X Y, ZHANG Y M, ZHU L X, et al. Effect of packaging atmospheres on storage quality characteristics of heavily marbled beef longissimus steaks[J]. Meat Science, 2016, 117: 50-56.doi:10.1016/j.meatsci.2016.02.030.
[4] ENGLISH A R, MAFI G G, VANOVERBEKE D L, et al. Effects of extended aging and modif i ed atmospheric packaging on beef top loin steak color[J]. Journal of Animal Science, 2016, 94(4): 1727-1737.doi:10.2527/jas.2015-0149.
[5] KIM Y H, HUNT M C, MANCINI R A, et al. Mechanism for lactate-color stabilization in injection-enhanced beef[J]. Journal of Agricultural and Food Chemistry, 2006, 54(20): 7856-7862.doi:10.1021/jf061225h.
[6] WU Wei, YU Qianqian, FU Yu, et al. Towards muscle-specif i c meat color stability of Chinese Luxi yellow cattle: a proteomic insight into post-mortem storage[J]. Journal of Proteomics, 2016, 147: 108-118.doi:10.1016/j.jprot.2015.10.027.
[7] NAIR M N, SUMAN S P, CHATLI M K, et al. Proteome basis for intramuscular variation in color stability of beef semimembranosus[J].Meat Science, 2016, 113: 9-16.doi:10.1016/j.meatsci.2015.11.003.
[8] JOSEPH P, SUMAN S P, RENTFROW G, et al. Proteomics of musclespecific beef color stability[J]. Journal of Agricultural and Food Chemistry, 2012, 60(12): 3196-3203.doi:10.1021/jf204188v.
[9] American Meat Science Association (AMSA). Meat color measurement guidelines[EB/OL]. (2012-12)[2017-11-01]. https://meatscience.org/docs/default-source/publications-resources/Hot-Topics/downloadthe-ebook-format-pdf-of-the-meat-color-measurement-guidelines.pdf?sfvrsn=a218b8b3_0.
[10] SAMMEL L M, HUNT M C, KROPF D H, et al. Comparison of assays for metmyoglobin reducing ability in beef inside and outside semimembranosus muscle[J]. Journal of Food Science, 2002, 67(3):978-984.doi:10.1111/j.1365-2621.2002.tb09439.x.
[11] MADHAVI D L, CARPENTER C E. Aging and processing affect color, metmyoglobin reductase and oxygen consumption of beef muscles[J]. Journal of Food Science, 1993, 58(5): 939-942.doi:10.1111/j.1365-2621.1993.tb06083.x.
[12] ESTÉVEZ M. What’s new in meat oxidation?[M]. PURSLOW P P.New aspects of meat quality: from genes to ethics. Sawston: Woodhead Publishing, 2017: 91-109.doi:10.1016/B978-0-08-100593-4.00006-0.
[13] 吴爽, 罗欣, 毛衍伟, 等. 线粒体对肉色及其稳定性影响的研究进展[J].食品科学, 2018, 39(15): 247-253.doi:10.7506/spkx1002-6630-201815036.
[14] RAMANATHAN R, MANCINI R A, SUMAN S P, et al. Effects of 4-hydroxy-2-nonenal on beef heart mitochondrial ultrastructure,oxygen consumption, and metmyoglobin reduction[J]. Meat Science,2012, 90(3): 564-571.doi:10.1016/j.meatsci.2011.09.017.
[15] CANTO A C V C S, SUMAN S P, NAIR M N, et al. Differential abundance of sarcoplasmic proteome explains animal effect on beef Longissimus lumborum color stability[J]. Meat Science, 2015, 102: 90-98.doi:10.1016/j.meatsci.2014.11.011.
[16] BOULEY J, CHAMBON C, PICARD B. Mapping of bovine skeletal muscle proteins using two-dimensional gel electrophoresis and mass spectrometry[J]. Proteomics, 2004, 4(6): 1811-1824.doi:10.1002/pmic.200300688.
[17] ANDERSON M J, LONERGAN S M, HUFF-LONERGAN E.Differences in phosphorylation of phosphoglucomutase 1 in beef steaks from the longissimus dorsi with high or low star probe values[J]. Meat Science, 2014, 96(1): 379-384.doi:10.1016/j.meatsci.2013.07.017.
[18] DI LUCA A, ELIA G, HAMILL R, et al. 2D DIGE proteomic analysis of early post mortem muscle exudate highlights the importance of the stress response for improved water-holding capacity of fresh pork meat[J]. Proteomics, 2013, 13(9): 1528-1544.doi:10.1002/pmic.201200145.
[19] WYTTENBACH A, SAUVAGEOT O, CARMICHAEL J, et al.Heat shock protein 27 prevents cellular polyglutamine toxicity and suppresses the increase of reactive oxygen species caused by huntingtin[J]. Human Molecular Genetics, 2002, 11(9): 1137-1151.doi:10.1093/hmg/11.9.1137.
[20] BONIFATI V, OOSTRA B A, HEUTINK P. Linking DJ-1 to neurodegeneration offers novel insights for understanding the pathogenesis of Parkinson’s disease[J]. Journal of Molecular Medicine,2004, 82(3): 163-174.doi:10.1007/s00109-003-0512-1.
[21] RHEE S G, CHAE H Z, KIM K. Peroxiredoxins: a historical overview and speculative preview of novel mechanisms and emerging concepts in cell signaling[J]. Free Radical Biology and Medicine, 2005, 38(12):1543-1552.doi:10.1016/j.freeradbiomed.2005.02.026.
[22] FONTANESI L, DAVOLI R, COSTA L N, et al. Investigation of candidate genes for glycolytic potential of porcine skeletal muscle:association with meat quality and production traits in Italian Large White pigs[J]. Meat Science, 2008, 80(3): 780-787.doi:10.1016/j.meatsci.2008.03.022.
[23] ALVES R N, CORDEIRO O, SILVA T S, et al. Metabolic molecular indicators of chronic stress in gilthead seabream (Sparus aurata) using comparative proteomics[J]. Aquaculture, 2010, 299(1/2/3/4): 57-66.doi:10.1016/j.aquaculture.2009.11.014.
[24] RAKUS D, PASEK M, KROTKIEWSKI H, et al. Interaction between muscle aldolase and muscle fructose 1,6-bisphosphatase results in the substrate channeling[J]. Biochemistry, 2004, 43(47): 14948-14957.doi:10.1021/bi048886x.
[25] MARINO R, ALBENZIO M, DELLA MALVA A, et al. Changes in meat quality traits and sarcoplasmic proteins during aging in three different cattle breeds[J]. Meat Science, 2014, 98(2): 178-186.doi:10.1016/j.meatsci.2014.05.024.
[26] YU Q Q, WU W, TIAN X J, et al. Unraveling proteome changes of Holstein beef M. semitendinosus and its relationship to meat discoloration during post-mortem storage analyzed by label-free mass spectrometry[J]. Journal of Proteomics, 2017, 154: 85-93.doi:10.1016/j.jprot.2016.12.012.
[27] ATKINSON J L, FOLLETT M J. Biochemical studies on the discoloration of fresh meat[J]. International Journal of Food Science &Technology, 1973, 8(1): 51-58.doi:10.1111/j.1365-2621.1973.tb01688.x.
[28] BEKHIT A E D A, HOPKINS D L, FAHRI F T, et al. Oxidative processes in muscle systems and fresh meat: sources, markers, and remedies[J]. Comprehensive Reviews in Food Science and Food Safety, 2013, 12(5): 565-597.doi:10.1111/1541-4337.12027.
[29] SEKITO A, KOIDE-YOSHIDA S, NIKI T, et al. DJ-1 interacts with HIPK1 and affects H2O2-induced cell death[J]. Free Radical Research,2006, 40(2): 155-165.doi:10.1080/10715760500456847.
[30] WU Wei, GAO Xiaoguang, DAI Yan, et al. Post-mortem changes in sarcoplasmic proteome and its relationship to meat color traits in M. semitendinosus of Chinese Luxi yellow cattle[J]. Food Research International, 2015, 72: 98-105.doi:10.1016/j.foodres.2015.03.030.
[31] SAYD T, MORZEL M, CHAMBON C, et al. Proteome analysis of the sarcoplasmic fraction of pig semimembranosus muscle: implications on meat color development[J]. Journal of Agricultural and Food Chemistry, 2006, 54(7): 2732-2737.doi:10.1021/jf052569v.
Proteomic Study of the Color Stability of High-Oxygen Modif i ed Atmosphere Packaged Steak during Chilled Storage