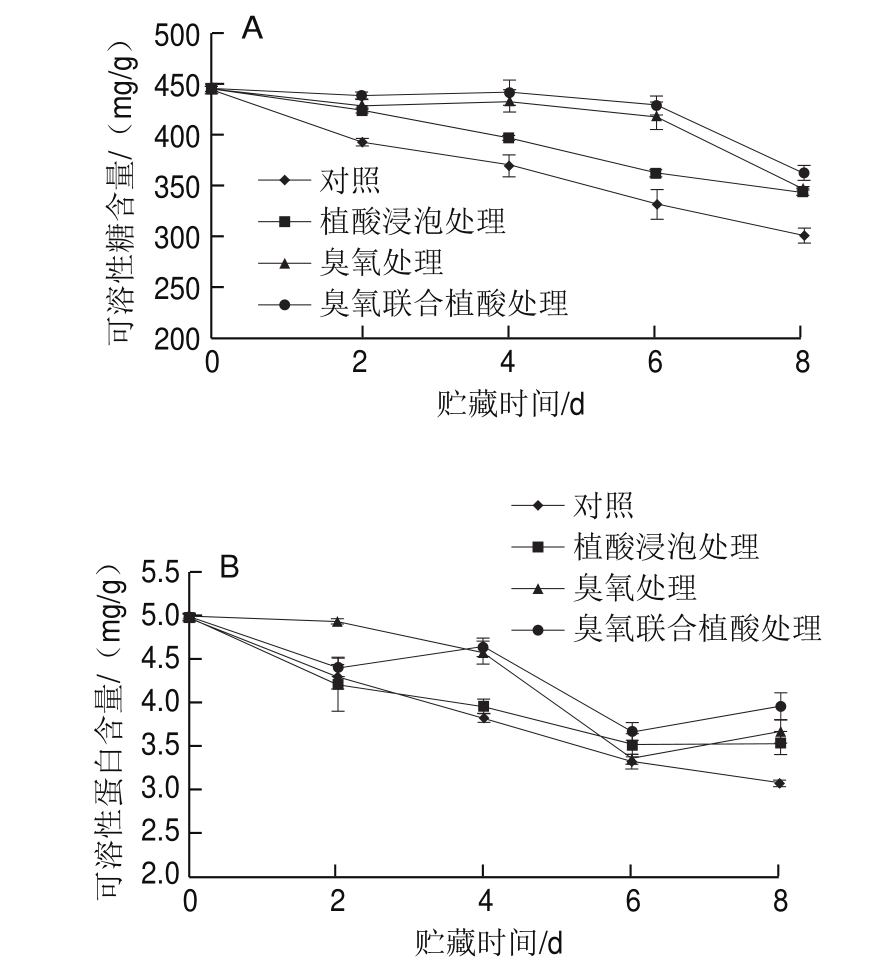
图1 不同处理对鲜切水果甘蓝贮藏过程中可溶性糖(A)和可溶性蛋白(B)含量的影响
Fig.1 Effects of different treatments on the contents of soluble sugar (A)and soluble protein (B) in fresh-cut fruit cabbage during storage
甘蓝(Brassica oleracea var. capitata)为十字花科芸薹属蔬菜中的一种,含有较为丰富的膳食纤维、矿物质、多酚、抗坏血酸、硫代葡萄糖苷等营养和生物活性物质。大量研究表明,甘蓝具有抗氧化、保护心脏、抗癌等多种生理功能[1-2]。相比于传统的结球甘蓝,水果甘蓝为一种较新颖的甘蓝品种,其具有较高的含糖量,质地清脆,适于鲜食和制作沙拉,因此受到了越来越多消费者的关注[3]。
将水果甘蓝加工成鲜切产品,一般需要经过分级、清洗、切分、保鲜、包装等一系列加工操作[4]。但是切割处理会导致甘蓝组织产生机械损伤,正常的组织代谢被破坏,极易发生酶促褐变和微生物侵染、增殖,影响鲜切蔬菜的品质、货架期和食用安全性。目前,关于鲜切蔬菜保鲜的研究较多,但是主要集中在花椰菜和青花菜,对结球甘蓝保鲜的研究鲜见报道;因此亟须针对鲜切水果甘蓝的保鲜和提高贮藏稳定性展开研究。
鲜切蔬菜的常用保鲜方式可分为物理保鲜、化学保鲜、生物保鲜。物理保鲜方式有低温处理、辐射处理、超高压处理、臭氧处理等。其中,臭氧杀菌速度较快且效果明显,无二次污染,是非常有前景的一项新技术[5],已经广泛应用于自来水消毒和食品的杀菌领域[6-7]。da Silva等[8]研究表明臭氧能有效保持卷心菜黄酮、VC、总叶绿素含量,并4 ℃贮藏下其货架期延长了6 d。Alwi等[9]采用9 mg/L的臭氧气体处理鲜切甜椒6 h后,大肠杆菌、沙门氏菌和单核细胞增生李斯特氏菌群降低了2.89、2.56、3.06(lg(CFU/g))。化学保鲜方式有涂膜处理、保鲜剂处理等。植酸是一种天然的果蔬保鲜剂,可抑制鲜切蔬菜的氧化、褐变和衰老[10-11]。姜丽等[12]发现植酸浸泡处理可以抑制紫背天葵过氧化物酶活力,提高可溶性糖、可溶性蛋白的保留率,从而提高了其品质。生物保鲜是用有益微生物的代谢产物抑制有害微生物,从而达到延长鲜切蔬菜货架期的目的。
近年来,不断有研究表明,将不同的保鲜技术进行组合后可增强鲜切蔬菜的保鲜效果。Song Zunyang等[13]发现乳酸链球素和壳聚糖涂膜联合处理能有效抑制鲜切胡萝卜抗坏血酸含量下降和腐败微生物生长,并增加其总酚含量。Bari等[14]在甘蓝和花椰菜苗上接种单增李斯特菌,用乳酸链球菌素处理、植酸处理、乳酸链球菌素和植酸进行联合处理,研究发现,联合处理比单独乳酸链球菌素处理和单独植酸处理的杀菌效果更好。目前,将臭氧和植酸联合用于鲜切蔬菜的保鲜研究鲜见报道。
因此,本实验分别采用臭氧、植酸浸泡,以及臭氧联合植酸的方式处理鲜切水果甘蓝,研究经过保鲜处理的鲜切水果甘蓝在低温贮藏过程中生理生化特性的变化规律,包括可溶性糖、可溶性蛋白、抗坏血酸和总酚含量,过氧化物酶(peroxidase,POD)和超氧化物歧化酶(superoxide dismutase,SOD)活力,硫苷成分及异硫氰酸盐的含量,在此基础上探究鲜切水果甘蓝的合理保鲜方式。
成熟水果甘蓝由江苏省农科院蔬菜研究所提供,于2016年11初采自江苏省农科院蔬菜种植基地,品种为‘甜味55号’。采摘后水果甘蓝立即贮藏于4 ℃冷库中,24 h内处理。
植酸(分析纯)、1,2-苯二硫醇(分析纯)广东省化学试剂工程技术研究开发中心;羧甲基纤维素钠(化学纯) 国药集团化学试剂有限公司;抗坏血酸(标准品)、没食子酸(标准品)、SOD试剂盒上海源叶生物科技有限公司;丙烯基硫苷(分析标准品)美国Sigma公司。
UV-2450型紫外-可见分光光度计、LC-30AD液相色谱-质谱联用仪 日本岛津公司;TDL-40B离心机 上海安亭科学仪器厂;1200高效液相色谱(high performance liquid chromatography,HPLC)仪美国安捷伦公司;IKA A11小型冷冻粉碎机 德国IKA公司;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;W-H臭氧发生器、臭氧检测器 南京沃环科技实业有限公司。
1.3.1 鲜切水果甘蓝的保鲜处理
选取新鲜、无损伤的水果甘蓝,剥去外部两层叶子后,依次选取第3~9层的叶片进行处理。先用蒸馏水清洗,然后切分成2 cmh5 cm的叶片,每次取100 g样品,分别在室温下(25 ℃)进行臭氧处理、植酸浸泡、臭氧联合植酸处理。臭氧处理组:将切分后的水果甘蓝置于含有30 mg/L臭氧的密闭容器内15 min。植酸浸泡组:将切分后的水果甘蓝在0.5 mmol/L的植酸溶液(1∶10,m/V)中浸泡10 min,结束后擦去表面溶液。臭氧联合植酸处理组:将在0.5 mmol/L植酸溶液(1∶10,m/V)中浸泡10 min后的水果甘蓝取出,先擦去表面溶液,然后置于含30 mg/L臭氧的密闭容器内,15 min后取出。以不进行任何保鲜处理的水果甘蓝作为对照样品,每个处理均重复3 次。
保鲜处理后,将水果甘蓝密闭包装在市售聚乙烯保鲜袋中,于4 ℃黑暗贮藏。分别在贮藏第0、2、4、6、8天取样分析水果甘蓝的生理生化特性。取样时部分样品冷冻干燥后打粉,用于水果甘蓝中可溶性糖、可溶性蛋白、抗坏血酸、总酚、硫苷、异硫氰酸盐含量的测定。其余新鲜样品用于菌落总数、过氧化物酶、超氧化物歧化酶、苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)、过氧化氢酶(catalase,CAT)活力的测定。
1.3.2 可溶性糖和可溶性蛋白含量的测定
可溶性糖含量采用蒽铜-硫酸法测定[15],可溶性蛋白质含量采用考马斯亮蓝法测定[16],单位均为mg/g,结果以干质量计。
1.3.3 抗坏血酸含量测定
抗坏血酸的测定参考Volden等[17]的方法。取0.1 g甘蓝冻干粉,用4 mL体积分数2%草酸溶液充分研磨匀浆后,10 000 r/min离心15 min得上清液,过0.45 μm水系膜,HPLC待测。HPLC条件:SB-C18色谱柱(250 mmh4.6 mm,5 μm);检测波长254 nm;流速0.8 mL/min;柱温30 ℃;进样量20 μL;流动相A为体积分数0.1%草酸溶液,流动相B为甲醇,体积比为95∶5。抗坏血酸含量单位为mg/g,结果以干质量计。
1.3.4 总酚含量测定
总酚含量测定参考Singleton等[18]的方法,略加改动。取甘蓝冻干粉0.1 g,用5 mL、体积分数50%甲醇溶液充分研磨匀浆后,10 000 r/min离心15 min得上清液。取0.5 mL上清液与1 mL Folin-酚溶液(0.1 mol/L)避光静置5 min,再加入1.5 mL质量分数7.5% Na2CO3溶液混匀,在室温下黑暗反应1.0 h,于765 nm波长处测定吸光度。采用没食子酸标品建立标准曲线,总酚含量单位为mg/g,结果以干质量计。
1.3.5 POD活力的测定
POD活力的测定参考Chen Yulong等[19]的方法并略作改动。取5 g鲜切水果甘蓝,加入0.1 g聚乙烯吡咯烷酮、20 mL磷酸钠缓冲液(pH 6.4),冰浴充分研磨后,4 ℃条件下12 000 r/min离心30 min,取上清液低温留存备用。
取0.5 m L上清液,与2 m L愈创木酚溶液(50 mmol/L)混匀后30 ℃水浴5 min。然后加入1 mL、体积分数0.08% H2O2溶液,室温下反应3 min,每30 s记录460 nm波长处的吸光度。以每克样品每分钟在460 nm波长处吸光度变化0.1为1个酶活力单位,单位为U/g,结果以鲜质量计。
1.3.6 SOD活力的测定
取0.5 mL 1.3.5节中提取出的酶液,用SOD试剂盒进行测定。以每克组织在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1 个酶活力单位,单位为U/g,结果以鲜质量计。
1.3.7 CAT活力的测定
CAT活力的测定参考文献[20]。取5.0 g鲜切水果甘蓝,加入0.1 g聚乙烯吡咯烷酮、20 mL磷酸钠缓冲液(pH 7.5),冰浴上充分研磨后,4 ℃条件下12 000 r/min离心30 min,取上清液低温留存备用。取3 mL H2O2(20 mmol/L)与0.5 mL上清液进行反应,室温下反应3 min,每30 s记录240 nm波长处的吸光度。以每克样品每分钟吸光度变化0.01为1 个酶活力单位,单位为U/g,结果以鲜质量计。
1.3.8 PAL活力的测定
PAL活力的测定参考文献[21]。取3 mL磷酸钠缓冲液(50 mmol/L,pH 7.5)与0.5 mL L-苯丙氨酸(20 mmol/L)混匀,在37 ℃预保温平衡10 min,加入0.5 mL 1.3.7节中提取的酶液,立即在290 nm波长处测定吸光度;置37 ℃保温60 min后,再测其吸光度。以每克果蔬样品每小时吸光度增加0.01为1个酶活力单位,单位为U/g,结果以鲜质量计。
1.3.9 硫代葡萄糖苷成分的鉴定及分析
参考Palani等[22]的方法,略加改动。取0.1 g甘蓝冻干粉,加入4 mL体积分数70%的甲醇,在70 ℃条件下水浴20 min,冷却至室温,10 000 r/min离心15 min得上清液。再用2 mL体积分数70%的甲醇溶液重复提取1 次,合并两次所得上清液。将上清液旋转蒸发至只剩干物质,用1 mL体积分数0.05%的三氟乙酸溶解,过0.45 μm水系膜,HPLC待测。
液相色谱-质谱联用仪的分析条件为:色谱柱:C18柱(100 mmh2.1 mm,3 μm),流动相A为10 mmol/L甲酸铵,流动相B为乙腈,洗脱条件:0~3~25~30~37~37.10 min,流动相B 5%(体积分数,下同)~80%~90%~90%~5%,流速:0.4 mL/min;检测波长226 nm。
液相色谱分析条件为:X D B-C1 8色谱柱(250 mmh4.6 mm,5 μm);检测波长227 nm;流速0.5 mL/min;柱温30 ℃;进样量20 μL;流动相三氟乙酸(体积分数0.05%)-乙腈,洗脱梯度时间为0~15~25~40~50~55~60 min,乙腈线性梯度为0%~0%~5%~20%~35%~99%~0%。用丙烯基硫苷、1-磺酸-3-吲哚甲基硫苷、4-甲基硫氧丁基硫苷建立标准曲线,硫代葡萄糖苷含量单位为mg/g,结果以干质量计。
1.3.10 异硫氰酸盐含量的测定
异硫氰酸盐含量的测定参考文献[23]。取0.1 g甘蓝冻干粉,用4 mL蒸馏水充分研磨,37 ℃水浴2 h后10 000 r/min离心15 min得上清液。取250 μL上清液,与250 μL磷酸钾缓冲液(0.1 mol/L,pH 8.5)、0.5 mL 1,2-苯二硫醇(10 mmol/L)混匀后,在65 ℃反应2 h。过0.45 μm有机膜,进行HPLC分析,采用萝卜硫素建立标准曲线。HPLC条件:色谱柱为XDB-C18柱(150 mmh4.6 mm,5 μm);流动相为甲醇-水(70∶30,V/V);流速1.00 mL/min;进样量20 μL;检测波长365 nm,单位为μmol/100 g,结果以干质量计。
1.3.11 菌落总数测定
菌落总数参考GB 4789.2ü2016《食品安全国家标准食品微生物学检验 菌落总数测定》[24]测定。
以上实验均重复均3 次,结果以平均值±标准差的形式表示,采用SPSS 20.0进行最小显著性差异分析,P<0.05表示差异显著。

图1 不同处理对鲜切水果甘蓝贮藏过程中可溶性糖(A)和可溶性蛋白(B)含量的影响
Fig.1 Effects of different treatments on the contents of soluble sugar (A)and soluble protein (B) in fresh-cut fruit cabbage during storage
由图1A可知,鲜切水果甘蓝中可溶性糖含量在低温贮藏过程中总体呈下降趋势,但是不同保鲜方式处理后的可溶性糖含量明显高于对照组。贮藏过程中可溶性糖为水果甘蓝呼吸作用的底物,在贮藏过程中被不断消耗,所以呈下降趋势。贮藏8 d后,对照组样品可溶性糖含量由初始的446.62 mg/g降至302.70 mg/g,可溶性糖保留率为67.78%;臭氧处理组、植酸浸泡处理组以及臭氧联合植酸处理组在贮藏8 d后,样品可溶性糖保留率分别为77.79%、77.27%和81.44%,其中臭氧联合植酸处理效果最好,可溶性糖含量是对照组的1.21 倍。姜丽等[12]发现植酸浸泡方式处理可以提高紫背天葵可溶性糖的保留率,Tzortzakis等[25]的研究表明臭氧处理有效维持了非结构性碳水化合物组分,提高了番茄的可溶性糖保留率。同时由可溶性糖含量的变化可知,臭氧处理与植酸处理联合作用效果比单独处理效果更好。
由图1B可知,不同条件处理后的鲜切水果甘蓝中可溶性蛋白含量在低温贮藏过程中整体上均呈下降趋势。同时不同处理组样品中可溶性蛋白含量整体上均高于对照组样品。贮藏8 d后,对照组样品可溶性蛋白含量由4.98 mg/g降至3.07 mg/g,损失了38.35%。臭氧、植酸浸泡、臭氧联合植酸处理组的样品可溶性蛋白含量分别为3.67、3.53 mg/g和3.95 mg/g,臭氧联合植酸处理组的可溶性蛋白含量是对照组的1.28 倍。由此可见,臭氧联合植酸处理更利于鲜切水果甘蓝可溶性蛋白在贮藏过程中的保留。
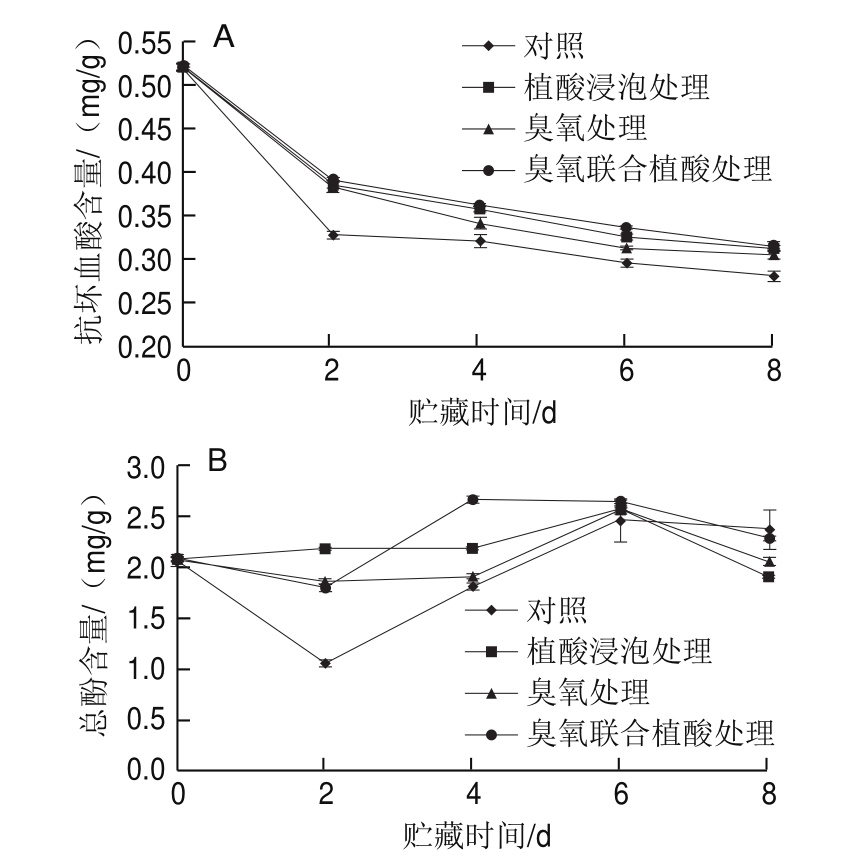
图2 不同处理对鲜切水果甘蓝贮藏过程中抗坏血酸(A)和总酚(B)含量的影响
Fig.2 Effects of different treatments on the contents of ascorbic acid (A)and total phenolics (B) in fresh-cut fruit cabbage during storage
与可溶性糖和可溶性蛋白含量的变化规律相似,不同处理组鲜切水果甘蓝中抗坏血酸含量在贮藏过程中不断降低(图2A)。在贮藏的前2 d,4 组鲜切水果甘蓝抗坏血酸含量下降都比较迅速,可能是由于水果甘蓝经切分处理后,抗坏血酸与氧气接触,导致抗坏血酸被迅速氧化。同时,臭氧、植酸浸泡以及臭氧联合植酸处理提高了贮藏过程中抗坏血酸的保留率,可能是由于臭氧抑制了抗坏血酸过氧化物酶和抗坏血酸氧化酶的活力[26],延缓了VC的降解;且植酸具有抗氧化性[12],能有效防止VC的损失。3 种不同保鲜处理方式下的水果甘蓝中抗坏血酸含量在不同贮藏阶段差异不显著。
酚类物质是水果甘蓝中重要的生物活性物质,总酚含量在贮藏过程中的变化如图2B所示。贮藏前2 d,对照组总酚含量显著下降,其余处理组样品总酚含量无明显变化。贮藏前6 d,臭氧联合植酸处理可显著提高鲜切水果甘蓝中酚类物质的保留率。臭氧联合植酸处理组样品在贮藏第2、4天的总酚含量为1.79 mg/g和2.66 mg/g,分别比相同贮藏时间的对照组高68.86%和46.15%,因此臭氧联合植酸处理能在贮藏前4 d有效提高总酚含量。酚类物质的积累与PAL活力相关,臭氧联合植酸处理后可能激活鲜切水果甘蓝中PAL活力,促进酚类物质的合成[26]。
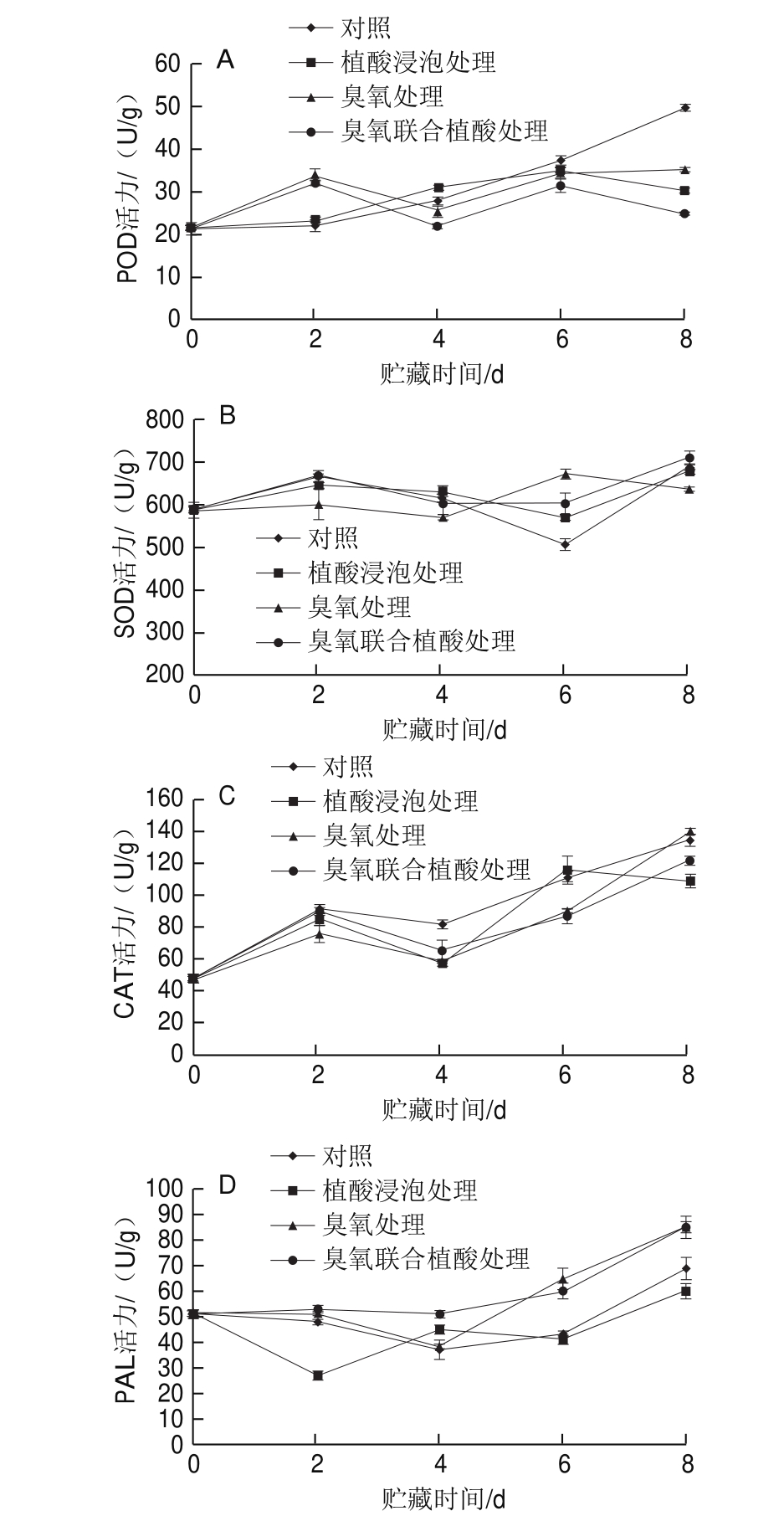
图3 不同处理鲜切水果甘蓝贮藏过程中POD(A)、SOD(B)、CAT(C)、PAL(D)活力的影响
Fig.3 Effects of different treatments on POD (A), SOD (B), CAT (C)and PAL (D) activities in fresh-cut fruit cabbage during storage
POD在酶促氧化过程中起到重要作用,POD活力越高,褐变程度越高。SOD、CAT可在植物体中相互协调配合,清除过剩的自由基,使体内自由基维持在正常的动态水平,以提高植物的抗逆性[25]。由图3A可知,贮藏前2 d,臭氧、植酸浸泡、臭氧联合植酸处理组中POD活力均高于对照组。对照组样品POD活力在整个贮藏过程中不断提高,而其他3种处理组样品POD活力无明显变化规律。贮藏的第8天,臭氧、植酸浸泡、臭氧联合植酸处理组水果甘蓝POD活力均显著低于对照组,表明植酸与臭氧处理能有效延缓鲜切水果甘蓝的褐变,且臭氧联合植酸处理效果优于各单独处理。
由图3B可知,不同方式处理的鲜切水果甘蓝SOD活力变化在贮藏过程中无明显变化规律。但是在贮藏的第8天,臭氧联合植酸处理组的鲜切水果甘蓝SOD活力略微高于对照组,推测此时经臭氧和植酸处理的鲜切水果甘蓝抗氧化能力稍强于对照组。由图3C可知,鲜切水果甘蓝中CAT活力整体呈上升趋势,且保鲜处理组CAT活力在贮藏过程中整体上低于对照组。
PAL是酚类物质合成的关键酶,催化苯丙氨酸向酚类物质转化,可提高果蔬总酚的含量。由图3D可知,贮藏4 d后,臭氧处理组、臭氧联合植酸处理组的样品以及对照组样品中PAL活力在贮藏过程中均呈现上升趋势。贮藏至第8天,臭氧处理组(84.50 U/g)、臭氧联合植酸处理组(85.05 U/g)的鲜切水果甘蓝PAL活力均高于对照组样品(69.07 U/g)。
硫代葡萄糖苷(硫苷)广泛存在于十字花科蔬菜中,是一种重要的次生代谢产物。当植物受到损伤时,植物细胞遭到破坏使硫苷与黑芥子酶反应,降解成异硫氰酸酯,异硫氰酸酯具有较强的抗癌、抗氧化等生物活力。液相色谱-质谱联用仪分析共鉴定得到5 种硫苷类物质,分别为丙烯基硫苷、1-磺酸-3-吲哚甲基硫苷、4-甲氧基-3-吲哚甲基硫苷、4-羟基-3-吲哚甲基硫苷和苯乙基硫苷(表1)。王志英等[27]测定甘蓝苗中硫苷类物质时,也鉴定出以上几种硫苷类物质。
表1 液相色谱-质谱联用鉴定的水果甘蓝硫苷成分
Table1 Glucosinolate composition of fruit cabbage identi fi ed by high performance liquid chromatography-mass spectrometry

初级粒子分子质量/Da丙烯基硫苷 C10H17NO9S2 1.08 358.02 4-甲氧基-3-吲哚甲基硫苷 C17H22N2O10S2 6.68 477.06 1-磺酸-3-吲哚甲基硫苷 C16H20N2O9S2 4.85 447.1 4-羟基-3-吲哚甲基硫苷 C16H20N2O10S2 3.44 463.05苯乙基硫苷 C15H21NO9S2 6.09 422.06硫苷种类 分子式 保留时间/min
表2为各硫代葡萄糖苷类物质在贮藏过程中的变化。鲜切水果甘蓝中各硫苷类物质在贮藏过程中含量均呈下降趋势。在贮藏8 d后,对照组、植酸浸泡处理组、臭氧处理组、臭氧联合植酸处理组的丙烯基硫苷保留率分别为31.51%、35.53%、35.69%、36.17%,不同处理组样品之间差异不大,1-磺酸-3-吲哚甲基硫苷的保留率分别为31.70%、35.16%、63.98%、64.84%,4-甲氧基-3-吲哚甲基硫苷保留率分别为55.98%、59.83%、65.38%、71.79%。由此可见,臭氧处理、臭氧联合植酸处理均可明显减少1-磺酸-3吲哚甲基硫苷和4-甲氧基-3-吲哚甲基硫苷在贮藏过程中的损失。4-羟基-3-吲哚甲基硫苷、苯乙基硫苷在水果甘蓝中含量较低,各保鲜处理组与对照组差异不大。
表2 鲜切水果甘蓝贮藏过程中硫苷成分及异硫氰酸盐含量的变化
Table2 Changes in glucosinolate and isothiocyanate contents in fresh cut fruit cabbage during storage

注:同行肩标小写字母不同表示差异显著(P<0.05)。
硫苷成分 贮藏时间/d对照植酸浸泡处理臭氧处理臭氧联合植酸处理丙烯基硫苷含量/(mg/g)0 6.22f0.61a 6.22f0.61a 6.22f0.61a 6.22f0.61a 2 2.98f0.15d 4.01f0.01a 3.25f0.19c 3.65f0.16b 4 2.51f0.12c 3.06f0.19a 2.47f0.05c 2.72f0.03b6 1.89f0.23b 2.51f0.03a 1.98f0.09b 1.94f0.20b8 1.96f0.04b 2.21f0.04a 2.22f0.32ab 2.25f0.05a 4-羟基-3- 吲哚甲基硫苷含量/(mg/g)0 0.38f0.01a 0.38f0.01a 0.38f0.01a 0.38f0.01a 2 0.36f0.01b 0.36f0.01b 0.44f0.01a 0.42f0.00a 4 0.36f0.02b 0.39f0.01ab 0.41f0.01a 0.42f0.00a6 0.32f0.03c 0.30f0.01c 0.42f0.01b 0.45f0.01a8 0.27f0.00b 0.27f0.00b 0.31f0.01a 0.32f0.03a 1-磺酸-3-吲哚甲基硫苷含量/(mg/g)0 3.47f0.06a 3.47f0.06a 3.47f0.06a 3.47f0.06a 2 1.36f0.21c 2.31f0.08a 3.36f0.08a 3.02f0.01b 4 1.51f0.03c 1.81f0.04b 2.47f0.03a 2.54f0.23a6 0.91f0.12b 1.94f0.19a 2.18f0.19a 2.16f0.17a8 1.10f0.01c 1.22f0.09b 2.22f0.13a 2.25f0.23a 4-甲氧基-3-吲哚甲基硫苷含量/(mg/g)0 2.34f0.11a 2.34f0.11a 2.34f0.11a 2.34f0.11a 2 1.64f0.01b 1.96f0.01a 2.08f0.12a 1.95f0.08a 4 1.61f0.06b 1.82f0.02a 1.86f0.12a 1.86f0.01a6 1.26f0.03c 1.40f0.04b 2.02f0.10a 2.19f0.15a8 1.31f0.04c 1.40f0.02b 1.53f0.03a 1.68f0.12a苯乙基硫苷含量/(mg/g)0 0.36f0.01a 0.36f0.01a 0.36f0.01a 0.36f0.01a 2 0.28f0.01b 0.37f0.01a 0.37f0.01a 0.29f0.01b 4 0.34f0.01a 0.33f0.01a 0.32f0.02a 0.35f0.03a6 0.29f0.01a 0.24f0.02b 0.30f0.01a 0.33f0.02a8 0.28f0.01a 0.31f0.03a 0.29f0.01a 0.30f0.03a 0 462.03f0.19a 462.03f0.19a 462.03f0.19a 462.03f0.19a 2 56.51f2.79d 395.88f10.34b110.42f4.39c462.91f18.02a 4 46.51f8.80d 77.32f6.50b 62.67f3.97c 111.82f8.42a6 94.21f8.41c 181.09f12.96b566.71f4.61a192.63f15.69b8 204.92f6.58c542.95f12.93a324.78f13.04b562.11f27.99a异硫氰酸盐含量/(μmol/100 g)
鲜切水果甘蓝中硫苷的代谢产物,即异硫氰酸盐的含量在贮藏过程中整体呈现先下降后上升的趋势,且臭氧、植酸浸泡以及臭氧联合植酸处理组样品中异硫氰酸盐含量显著高于对照组。对照组样品异硫氰酸盐含量在贮藏前2 d快速下降,然后逐渐升高;其余处理组样品也分别在贮藏第4天异硫氰酸盐含量降至最低。在贮藏的8 d内,对照组样品异硫氰酸盐由462.03 μmol/100 g(0 d)降至204.92 μmol/100 g(8 d),在贮藏的第8天,臭氧、植酸浸泡、臭氧联合植酸处理组的异硫氰酸盐含量分别为542.95、324.78、562.11 μmol/100 g,其中臭氧联合植酸处理组保留率最高。

图4 不同处理鲜切水果甘蓝贮藏过程中菌落总数的影响
Fig.4 Effects of different treatments on aerobic plate count in fresh-cut fruit cabbage during storage
由图4可知,鲜切水果甘蓝在贮藏过程中菌落总数不断增加,经过臭氧、植酸浸泡以及臭氧联合植酸处理的样品中菌落总数均显著低于对照组样品。贮藏8 d后,对照组鲜切水果甘蓝中菌落总数由5.05(lg(CFU/g))上升至6.98(lg(CFU/g)),贮藏的第8天,植酸浸泡处理、臭氧处理、臭氧联合植酸处理组的菌落总数分别为6.54、5.45、4.88(lg(CFU/g)),臭氧联合植酸处理组菌落总数比对照组低2.10(lg(CFU/g))。有研究表明,当微生物数量超过7(lg(CFU/g))时,商业性鲜切蔬菜的货架期在恒温或控温条件下不超过5~7 d[28],由此可知臭氧联合植酸处理能有效延长鲜切水果甘蓝的货架期。臭氧抑制微生物生长主要是通过攻击细菌的膜糖蛋白或糖脂实现的,植酸浸泡后的鲜切水果甘蓝表面pH值较低,亦不利于微生物的生长[14]。两种处理方式对微生物的生长均有协同抑制作用。
臭氧与植酸的联合处理对于鲜切水果甘蓝的保鲜效果较为理想。4 ℃贮藏8 d后,臭氧与植酸联合处理组样品中可溶性糖、可溶性蛋白含量高于其他组样品,且分别比对照组样品高0.21、0.28 倍,说明臭氧与植酸联合处理有效了以上组分的保留率;同时臭氧与植酸联合处理可提高鲜切水果甘蓝中总酚含量,并提高了PAL、SOD活力,抑制了POD、CAT活力,延缓了水果甘蓝的衰老;提高了水果甘蓝中硫代葡萄糖苷和异硫氰酸酯的保留率,对于提升鲜切水果甘蓝的品质和营养价值具有促进作用。另外,臭氧与植酸联合处理显著抑制了鲜切水果甘蓝中微生物在贮藏过程中的生长,有利于延长产品的货架期。
综上所述,臭氧联合植酸处理可有效降低鲜切水果甘蓝在贮藏过程中的营养物质的损失,并降低微生物侵染的风险。
[1] CARTEA M E, VELASCO P. Glucosinolates in Brassica foods:bioavailability in food and significance for human health[J].Phytochemistry Reviews, 2007, 7(2): 213-229.
[2] WICZKOWSKI W, SZAWARA-NOWAK D, TOPOLSKA J. Red cabbage anthocyanins: prof i le, isolation, identif i cation, and antioxidant activity[J]. Food Research International, 2013, 51(1): 303-309.doi:10.1016/j.foodres.2012.12.015.
[3] 刘亚琪. 江苏农科院研发出水果甘蓝新品[J]. 中国食品学报, 2014,14(4): 110.
[4] 陈晨, 胡文忠, 姜爱丽, 等. 鲜切果蔬天然抗菌剂的研究进展[J].食品工业科技, 2013, 34(10): 362-365; 369.
[5] MANOUSARIDIS G, NERANTZAKI A, PALEOLOGOS E K, et al.Effect of ozone on microbial, chemical and sensory attributes of shucked mussels[J]. Food Microbiology, 2005, 22(1): 1-9.doi:10.1016/j.fm.2004.06.003.
[6] GUZEL-SEYDIM Z B, GREENE A K, SEYDIM A C, et al. Use of ozone in the food industry[J]. LWT-Food Science and Technology,2004, 37(4): 453-460.doi:10.1016/j.lwt.2003.10.014.
[7] KETTERINGHAM L, GAUSSERES R, JAMES S J, et al. Application of aqueous ozone for treating pre-cut green peppers (Capsicum annuum L.)[J]. Journal of Food Engineering, 2006, 876(1): 104-111.doi:10.1016/j.jfoodeng.2005.05.019.
[8] DA SILVA J P, COSTA S M, DE OLIVEIRA L M, et al. Does the use of ozonized water inf l uence the chemical characteristics of organic cabbage (Brassica oleracea var. capitata)?[J]. Journal of Food Science and Technology, 2015, 52(11): 7026-7036.doi:10.1007/s13197-015-1817-0.
[9] ALWI N A, ALI A. Reduction of Escherichia coli O157, Listeria monocytogenes and Salmonella enterica sv. Typhimurium populations on fresh-cut bell pepper using gaseous ozone[J]. Food Control, 2014,46: 304-311.doi:10.1016/j.foodcont.2014.05.037.
[10] HIASA Y, KITAHORI Y, MORIMOTO J, et al. Carcinogenicity study in rats of phytic acid ‘Daiichi’, a natural food additive[J]. Food and Chemical Toxicology, 1992, 30(2): 117-125.doi:10.1016/0278-6915(92)90146-C.
[11] TORRE M, RODRIGUEZA R R D, SAURA-CALIXTO F.Effects of dietary fiber and phytic acid on mineral availability[J].Critical Reviews in Food Science and Nutrition, 1991, 30(1): 1-22.doi:10.1080/10408399109527545.
[12] 姜丽, 蒋娟, 张丽, 等. 采后植酸处理对紫背天葵贮藏期间生理生化反应的影响[J]. 食品科学, 2014, 35(2): 316-321.doi:10.7506/spkx1002-6630-201402062.
[13] SONG Zunyang, LI Feng, GUAN Hui, et al. Combination of nisin and ε-polylysine with chitosan coating inhibits the white blush of fresh-cut carrots[J]. Food Control, 2017, 74: 34-44.doi:10.1016/j.foodcont.2016.11.026.
[14] BARI M L, UKUKU D O, KAWASAKI T, et al. Combined eff i cacy of nisin and pediocin with sodium lactate, citric acid, phytic acid, and potassium sorbate and EDTA in reducing the Listeria monocytogenes population of inoculated fresh-cut produce[J]. Journal of Food Protection, 2005, 68(7): 1381-1387.doi:10.4315/0362-028X-68.7.1381.
[15] SHARMA D D, D’SOUZA V F, MCCNNELL M B, et al.Identification and quantification of sugars in Winter-Hardy apples by high-performance liquid chromatography[J]. Canadian Institute of Food Science and Technology Journal, 1998, 21(4): 435-437.doi:10.1016/S0315-5463(88)70982-7.
[16] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.doi:10.1016/0003-2697(76)90527-3.
[17] VOLDEN J, BORGE G I A, BENGTSSON G B, et al. Effect of thermal treatment on glucosinolates and antioxidant-related parameters in red cabbage (Brassica oleracea L. ssp. capitata f.rubra)[J]. Food Chemistry, 2008, 109(3): 595-605.doi:10.1016/j.foodchem.2008.01.010.
[18] SINGLETON V L, ROSSI J A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J]. American Journal of Enology and Viticulture, 1965, 16(3): 144-158.
[ 19] CHEN Yulong, WANG Huihui, XU Yujuan, et al. Effect of treatment with dimethyl dicarbonate on microorganisms and quality of Chinese cabbage[J]. Postharvest Biology and Technology, 2013, 76: 139-144.doi:10.1016/j.postharvbio.2012.10.005.
[20] ZHENG X L, TIAN S P, MENG X H, et al. Physiological and biochemical responses in peach fruit to oxalicacidtreatment during storage at room temperature[J]. Food Chemistry, 2007, 104(1): 156-162.doi:10.1016/j.foodchem.2006.11.015.
[21] KOUKOL J, CONN E E. The metabolism of aromatic compounds in higher plants. IV. purif i cation and properties of the phenylalanine deaminase of Hordeum vulgare[J]. Journal of Biological Chemistry,1961, 236: 2692-2698.
[22] PALANI K, HARBAUM-PIAYDA B, MESKE D, et al. Influence of fermentation on glucosinolates and glucobrassicin degradation products in sauerkraut[J]. Food Chemistry, 2016, 190: 755-762.doi:10.1016/j.foodchem.2015.06.012.
[23] GUO Q H, GUO L P, WANG Z Y, et al. Response surface optimization and identification of isothiocyanates produced from broccoli sprouts[J]. Food Chemistry, 2013, 141(3): 1580-1586.doi:10.1016/j.foodchem.2013.04.026.
[24] 国家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验菌落总数测定: GB 4789.2ü2016[S]. 北京: 中国标准出版社, 2016: 1-5.
[25] TZORTZAKIS N, BORLAND A, SINGLETON I, et al. Impact of atmospheric ozone-enrichment on quality-related attributes of tomato fruit[J]. Postharvest Biology and Technology, 2007, 45(3): 317-325.doi:10.1016/j.postharvbio.2007.03.004.
[26] ALI A, ONG M K, FORNEY C F. Effect of ozone pre-conditioning on quality and antioxidant capacity of papaya fruit during ambient storage[J]. Food Chemistry, 2014, 142: 19-26.doi:10.1016/j.foodchem.2013.07.039.
[27] 王志英, 郭丽萍, 李倩倩, 等.甘蓝苗生长过程中主要生理生化变化[J]. 食品科学, 2015, 36(3): 6-11.doi:10.7506/spkx1002-6630-201503002.
[28] 万忠民. 植酸对草莓保鲜的研究[J]. 食品科学, 2008, 29(10):619-621.doi:10.3321/j.issn:1002-6630.2008.10.149.
Effect of Combined Ozone and Phytic Acid Treatment on Storage Quality of Fresh-Cut Fruit Cabbage