表1 不同状态下细胞的部分生物学特性比较
Table1 Comparison of biological characteristics of difference cells under different states
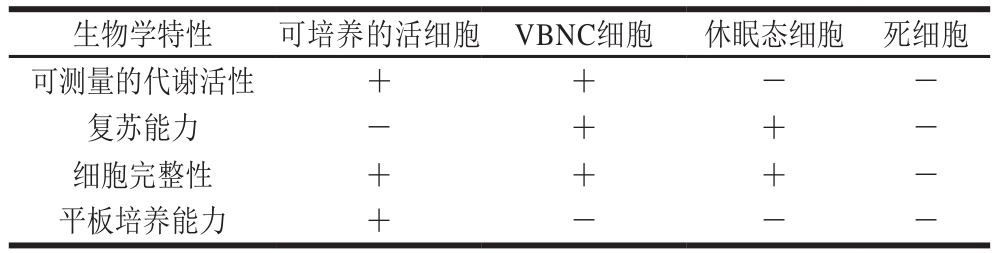
注:+.存在或具备该特性;-.不存在或不具备该特性。
生物学特性 可培养的活细胞 VBNC细胞 休眠态细胞 死细胞可测量的代谢活性 + + - -复苏能力 - + + -细胞完整性 + + + -平板培养能力 + - - -
随着我国经济发展水平的增长和居民饮食健康意识的提升,乳及乳制品作为膳食结构中重要的一环,其消费需求也日益增大。根据国家统计局数据,我国城镇居民家庭人均鲜奶购买量从1996年的4.6 kg逐年上升到2006年的18.3 kg,自2007年起有所下降,之后一直维持在14 kg左右[1]。然而,我国乳及乳制品的安全问题不容乐观,其主要集中在抗生素残留、食品添加剂滥用、微生物污染等方面,其中微生物污染问题是最主要的。国家食品药品监督管理总局关于2017年1ü11月婴幼儿配方乳粉抽检情况显示,不合格项目主要集中在标签问题和微生物污染,其中共检出阪崎肠杆菌2 批次。据美国疾病预防控制中心数据[2],在2011ü2017年5月近6 年间美国共发生13 起由单核增生李斯特氏菌引起的食物安全事件,其中有8 起与乳制品有关。此外,由乳及乳制品中沙门氏菌[3]、金黄色葡萄球菌[4-5]、空肠弯曲杆菌(Campylobacter jejuni)[6]、大肠杆菌(Escherichia coli)[7]、单核增生李斯特氏菌(Listeria monocytogenes)[8]、阪崎肠杆菌(Enterobacter sakazakii)[9]等致病菌引起的中毒事件在国内外也屡有报道。乳及乳制品中微生物污染问题成因较为复杂。首先,污染途径广是导致其微生物污染的重要原因。引起乳制品微生物污染的环节很多[10],其中原料乳本身携带较多的微生物,在挤乳、贮运过程中易造成源头污染,而且加工过程中添加剂的使用、生产环境、运输条件等因素都可能造成微生物的后期污染;其次,乳及乳制品中“活的非可培养状态”(viable but nonculturable state,VBNC)致病菌的发现使得微生物安全问题愈加不容忽视。大量的研究表明,乳及乳制品的生产、加工和贮运条件(如不锈钢管道运输、巴氏杀菌等)能够使各种致病菌产生胁迫适应能力,进入VBNC,而致病菌一旦进入VBNC,无法通过传统的平板培养方法检测,但仍具有可测量的代谢活性,能够进行转录和翻译,进而产生毒力和致病性,对公共安全造成严重威胁[11-13]。
现行有效的GB 4789.18ü2010《食品安全国家标准 食品微生物学检验 乳与乳制品检验》中常规平板计数法仍广泛应用于乳及乳制品中各类病原微生物的检测,可以检出大多数活的可培养的食源性致病菌。然而,针对VBNC致病菌的检测,其在平板上无法培养,但仍具有可测量的代谢活性,在合适的条件下可以快速复苏为可培养的细胞,产生毒力,从而避开传统的检测方法。目前VBNC致病菌的检测方法报道较多的有:吖啶橙染色荧光显微镜直接计数法、基于DNA分子的聚合酶链式反应(polymerase chain reaction,PCR)技术和环介导恒温核酸扩增(loop-mediated isothermal amplification,LAMP)技术、基于mRNA分子的反转录PCR技术[14-16]。然而,荧光显微镜观察常用于定性分析VBNC致病菌,在定量方面存在随机误差大等局限;至于基于DNA分子的检测技术,死菌DNA的存在使得检测结果高估了样品中的活菌水平;基于mRNA分子的检测技术则存在mRNA提取量少、代谢活跃容易发生降解等问题,而通过复苏致病菌再进行检测的方法也不可行,因为复苏耗时较长,往往需要几个月甚至更长的时间。因此,VBNC致病菌检测往往还需要结合其他的前处理手段,如利用乙锭单叠氮化合物(ethidium monoazide bromide,EMA)或叠氮溴化丙锭(propidium monoazide,PMA)染料,基于细胞的膜完整性对死、活细胞进行区分检测[15];也有报道采用基于细胞酯酶代谢活性的叠氮噻唑橙荧光染料(thiazole orange monoazide,TOMA)[17],能够更为精确地区分死、活细胞;此外,对于基质复杂的待测样品,有研究采用基于抗原抗体反应的免疫磁珠或者基于对细胞壁组分保留亲和力的溶菌酶进行特异性富集[18-19]。目前对于VBNC致病菌的检测尚无统一的标准,相关检测体系尚未完善。
综上所述,乳及乳制品中微生物污染问题不容忽视,尤其食源致病菌VBNC的发现大大增加了检测的难度。因此,本文综述了乳及乳制品中几种常见VBNC食源致病菌细菌的研究进展,包括致病菌的诱导和复苏因素、生物学特性及其检测方法,旨在提高人们对乳及乳制品中食源VBNC细菌研究的重视程度,尤其是关注致病菌VBNC的相关研究,以期为其检测方法的更新提供参考,也为完善乳及乳制品中常见致病菌的检测体系提供理论依据。
早在20世纪50年代末,海洋微生物学领域的工作者就报道了由显微镜直接计数法和平板计数法测得的细菌数量之间存在的显著性差异[20]。尽管存在细胞聚集现象和非生物颗粒的干扰,但这项研究也表明了基于细菌可培养性的平板计数法可能低估了样本中活细胞数量。1982年,Xu Haishu等[21]首次正式报道了大肠杆菌和霍乱弧菌存在VBNC这一现象,即存在“不可恢复”但仍保持活性的状态。到目前为止,研究人员已经确认了自然界有85 种细菌能够进入VBNC,其中包括18 种非致病菌和67 种致病菌。这18 种非致病菌普遍在发酵饮料中被发现,而另外67 种致病菌中目前已知有16 种对人类健康无害,但能感染其他生物体,如植物[22]。关于细菌VBNC的定义,目前主流的观点认为细菌受环境胁迫后,逐渐丧失在常规培养基上的“可培养性”,但仍保持活性的状态,即细菌的VBNC[23-24]。细菌VBNC的研究对于食品安全包括乳制品微生物污染问题具有重要意义。首先,VBNC可以看作是细菌适应环境胁迫的一种普遍生存策略[25],其中被报道能进入VBNC的细菌,囊括34 个属,涵盖拟杆菌门、厚壁菌门、放线菌门和变形菌门。自然界中各种胁迫因素无处不在,如低温、寡营养、紫外线、化学物质等均可能导致细菌进入VBNC状态[26],且细菌在环境胁迫下具有自适应能力,能够调整或改变代谢途径,进入VBNC,从而避免特定胁迫因素引起的代谢或结构破坏[27]。其次,虽然VBNC细菌通常无法引发疾病,但致病菌的毒性可以在复苏后恢复,进而感染人群、引起疾病[28-29]。
自然界中,与VBNC相似的细菌存活状态包括休眠、芽孢等。目前,VBNC仅存在于非芽孢细菌的观点被广泛接受,而休眠态与VBNC的关系尚存在争议。Mukamolova等[30]认为VBNC与休眠状态的区别就在于VBNC细胞表现出可测量的代谢活性,而在休眠细胞中无法检测到。还有学者认为VBNC是休眠态细胞的一种形式,因为VBNC细胞与休眠态细胞一样,都具有不可培养的特性,且能够在宿主体内复苏[31]。表1比较了几种常见细胞状态下的代谢活性、复苏能力、细胞完整性和平板培养能力。
表1 不同状态下细胞的部分生物学特性比较
Table1 Comparison of biological characteristics of difference cells under different states

注:+.存在或具备该特性;-.不存在或不具备该特性。
生物学特性 可培养的活细胞 VBNC细胞 休眠态细胞 死细胞可测量的代谢活性 + + - -复苏能力 - + + -细胞完整性 + + + -平板培养能力 + - - -
大多数进入VBNC的细菌的体积、形态等都会发生变化。革兰氏阴性菌在进入VBNC状态后,形态一般由杆状变为球状或球杆状,体积变小,如大肠杆菌、副溶血性弧菌等[32-33]。但目前也有报道VBNC的大肠杆菌仍为短棒状[34]。而革兰氏阳性菌进入VBNC后其形态变化较为复杂,如空肠弯曲杆菌在低温环境下会呈螺旋状或者保持原状不变 。此外,复苏后的VBNC大多与正常细菌形态类似[35]。
目前科学界已广泛认同VBNC致病菌对公众健康具有潜在威胁,但关于VBNC状态下致病菌的毒力及其致病性仍存在争议。如牛乳中常见的肠出血性大肠杆菌O157:H7是重要的食源性致病菌之一,主要通过产生志贺毒素、溶血素和黏附素在肠道上皮细胞表面形成擦拭性损伤,引起肠炎等疾病,损害人体健康。赵凤[36]的研究表明,VBNC大肠杆菌O157:H7仍然具备在宿主细胞上黏附的能力及引起擦试性损伤。空肠弯曲杆菌的毒力也通过类似的途径表现,Patrone等[37]通过检测VBNC空肠弯曲杆菌CadF蛋白的表达,证实其仍具备在肠道黏膜上的黏附能力。但也有研究表明,VBNC细菌不具有致病性,只有在其复苏为正常细胞时,才能表现出毒力和致病性[26]。无论如何,VBNC致病菌作为微生物污染中重要的组成部分,在食品安全方面存在重大的隐患。
乳及乳制品中包含丰富的营养元素,可以充分满足人体对于各类营养物质的需求,与此同时也成为许多致病菌理想的培养基。乳制品中部分产品的酸性条件、巴氏杀菌工艺等环境条件能够抑制致病菌增殖,但目前有越来越多的证据表明,乳及乳制品中的致病菌可以被诱导进入VBNC,能够保留毒力并在合适的条件下复苏。Gunasekera等[11]的研究表明,巴氏杀菌后的鲜乳中有明显的细胞亚群处于VNBC,大量的细胞由于热处理而不能形成菌落,但仍有可测量的代谢活性,能够转录和翻译基因,具有致病性。Gahan等[38]研究了单核增生李斯特氏菌在普通奶酪、酸奶、低脂奶酪和全脂奶酪中的酸适应能力,其中全脂奶酪和低脂奶酪中的单核增生李斯特氏菌突变体ATM56能够在70 d后恢复活性,该研究结果也表明单核增生李斯特氏菌在乳制品中存在VBNC,且其诱导和复苏因素也值得进一步研究。
表2 乳及乳制品中几种常见的VBNC食源致病菌诱导因素和复苏方法
Table2 Induction and resuscitation of common VBNC pathogens in milk and dairy products

菌种 VBNC诱导因素 VBNC复苏方法添加酵母液、Tween-80并升温[33]升温[40]空肠弯曲杆菌 酸性条件[41]人工模拟海水环境协同低温[42] 小鼠肠道复苏[51]金黄色葡萄球菌 寡营养协同低温[43]山梨酸钾[36] 无菌Tween-80处理[44]副溶血性弧菌低温低盐协同低温寡营养协同低温[39]单核增生李斯特氏菌低pH值[45]压力条件[46]弱酸性协同低温[47]添加复苏促进因子[48]胚卵培养[49]大肠杆菌寡营养协同低温[50]氯化物[51-53]巴氏杀菌[11]低温[16,29,32]添加肠道细菌自体诱导物[54]升温法[16]添加Tween-80协同升温[16]阪崎肠杆菌巴氏杀菌[11]寡营养[12]低温[55]干燥[56]添加质量分数0.1%丙酮酸钠[56]
在乳及乳制品加工、贮藏和运输的过程中,存在着各种各样的胁迫因素,如高温、低温、寡营养、极端pH值等。这些因素均可能导致其中的致病菌进入VBNC,增大检测难度;但同时,乳及乳制品中的VBNC致病菌通常只有在复苏后才能表现出致病性,因此研究其复苏因素同样具有重要意义。表2总结了乳及乳制品中几种常见的VBNC食源致病菌诱导因素和复苏方法。
在乳及乳制品的生产、加工、贮藏过程中,有许多胁迫因素均可能导致致病菌进入VBNC。Suliantari等[12]发现,在模拟奶粉生产加工的条件(1/10 TSA、不锈钢管道输送)下,阪崎肠杆菌被诱导进入了VBNC。研究者用乳糖诱导型绿色荧光蛋白基因(gfp)标记大肠杆菌,并在63.5 ℃下加热牛乳30 min,实验发现基于染料排除的活菌计数法测得的活细胞数显著高于基于细菌可培养性的平板计数法测得的数量,结果表明巴氏杀菌后的牛乳中大肠杆菌处于VBNC[54]。姜琛璐等[57]研究了阪崎肠杆菌在奶粉冲调温度下的存活率,结果表明部分阪崎肠杆菌菌株处于65 ℃以下的冲调温度环境时能够保持一定的活性,可能进入VBNC。
此外,乳品加工过程中经常会接触到一些化学胁迫因素,如使用添加剂以延长其货架期。然而添加剂作为一种胁迫因素,同时也可能诱导细菌进入VBNC,从而避开传统的检测方法,对公共健康造成威胁。
刘德欣等[35]采用不同温度和山梨酸钾浓度诱导金黄色葡萄球菌,使其进入了VBNC。田娟等[58]采用食品防腐剂诱导副溶血性弧菌进入了VBNC。
细菌经环境胁迫进入VBNC状态后,丧失了在平板上的生长繁殖能力,但仍具有可测量的代谢活性,在适宜的条件下可以复苏为正常的可培养细胞,这个过程是VBNC态致病菌可能开始大量繁殖并存在的基本条件。VBNC细菌的复苏是一个复杂的过程,其复苏机制尚未明确。目前研究较多的是“探索因子”和“群体感应”假说,其中随机出现的探索因子和群体感应中的活化细胞菌有助于解释细菌VBNC细菌的复苏过程,两者具有一定的内在联系[59-60]。目前已知的复苏因素包括升温、共培养、添加营养物(如酵母浸膏)、添加化学物质(如丙酮酸盐、Tween-80)、添加复苏因子Rpf等。Ayrapetyan等[59]的研究表明,群体感应的自体诱导物AI-2可以诱导VBNC创伤弧菌复苏,而不能产生AI-2突变体的VBNC细胞在培养物中补充外源AI-2也能复苏。Morishige等[61]在VBNC沙门氏菌中添加丙酮酸钠后,使得细胞复苏,同时相关研究也证明了丙酮酸盐在复苏过程中是触发大分子合成(如DNA和蛋白质)的关键分子之一。VBNC空肠弯曲杆菌与宿主细胞共培养一段时间后,同样能够复苏形成菌落[62]。因此,乳及乳制品中致病菌进入VBNC状态后,在加工、贮运条件中仍然可能复苏为正常细胞,产生毒力。
合理有效的细菌检测方法对于乳及乳制品中食源致病菌检测具有现实意义,对于那些只能应用非传统检测方法的VBNC细菌而言,正确的选择适合的检验手段更是研究该类微生物的必要工作。表3列举了多种检验VBNC致病细菌的手段,主要包括光学方法、免疫学方法、分子生物学方法和生物传感器技术。
表3 乳及乳制品中几种常见VBNC致病菌检测方法
Table3 Detection methods for common VBNC pathogenic bacteria in milk and dairy products

检测方法 原理 应用方法 检测对象金黄色葡萄球菌免疫学方法 利用抗原、抗体特异反应进行微生物分析光学方法利用吖啶橙或活/死试剂盒染色,在荧光显微镜下观察细菌,以鉴别其存活状态荧光显微镜直接计数法[16]活/死细菌试剂盒荧光染色[29] 大肠杆菌酶联免疫吸附测定间接免疫荧光[63] 副溶血性弧菌PCR 通过放大扩增特定的DNA进行定性或定量的检测Real time PCR[64-65]EMA/PMA-qPCR[66]大容量免疫磁珠分离(immunomagnetic separation,IMS)-PCR[18]qPCR[13]RT-qPCR[67]阪崎肠杆菌单核增生李斯特氏菌沙门氏菌LAMP针对靶基因的目标区域设计特异性引物,利用具有链置换活性的Bst DNA聚合酶,在恒温条件下完成扩增反应LAMP直接检测[15,68]IMS+LAMP[69]PMA+LAMP[70-71]大肠杆菌阪崎肠杆菌金黄色葡萄球菌重组酶聚合酶扩增(recombinase polymerase amplif i cation,RPA)利用重组酶和单链结合蛋白,在常温下协同实现引物与模板的特异结合的新型恒温体外核酸扩增技术PMA+haRPA[72]基于SERS的横流生物传感器+RPA[73]单核增生李斯特氏菌沙门氏菌生物传感器对生物物质敏感并将其浓度转换为电信号进行检测的仪器,由固定化的生物敏感材料作识别元件(酶、抗体、抗原等)和适当的理化换能器(氧电极、光敏管等)以及信号放大装置构成的分析工具或系统基于靶向DNA识别的电化学生物传感器[74]基于噬菌体的传染率的生物传感器[75]金黄色葡萄球菌沙门氏菌
过去科学家常用荧光染色方法来观察VBNC细胞,如活菌直接计数法、活/死菌试剂盒法,此类方法常用于定性判断。目前应用分子生物学和传感器方法对VBNC细胞进行定性、定量分析的报道越来越多。传统PCR和基于mRNA的实时荧光逆转录PCR等方法敏感、快速,在实验室检测中应用最为广泛。最新的生物传感器结合了分子检测与传感系统,能够产生可测定的光电信号,与传统方法相比具有检测迅速、特异性强、灵敏度高等优点,在VBNC致病菌的检测方面具有很好的应用前景。Labib等[76]开发了一种基于核酸适配体的传感器检测方法,用于检测VBNC沙门氏菌,能够在30 mL的样品中检测到30 个活细胞。Said等[75]开发了基于噬菌体的传染率的生物传感器用以检VBNC细菌。Liu Haibin等[73]开发了一种新的以表面增强拉曼散射为基础的横向流带状生物传感器,结合RPA用于同时检测单核增生李斯特氏菌和肠炎沙门氏菌,两种致病菌的检测限分别为27 CFU/mL和19 CFU/mL。
在乳制品检测中,传统的国标检测方法(如分离培养、生化鉴定)无法对难培养或不可培养的致病菌进行检测,存在特异性差、操作繁琐、耗时等缺点,无法实现及时有效的检测。对于乳制品中VBNC态的致病菌,光学方法和免疫学方法都容易出现漏检,且免疫学方法中酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)技术影响因素较多,结构类似物也会引起不同程度的交叉反应,容易出现假阳性的结果。而PCR方法与传感器方法成本较高,不适于大规模推广。LAMP技术、RPA技术在检测VBNC菌方面具有较好的特异性和灵敏性,而且只需要简单恒温设备就能进行LAMP反应,成本较低。由于死菌和食品基质中蛋白质、脂肪等的干扰,单一的LAMP和RPA检测方法仍存在缺陷,目前的研究通常将活性染色、免疫磁珠富集、传感器技术与分子生物学方法结合,这不仅提供了新的检测思路,而且可以有效避免单一方法的不足,进而提高对食源性致病菌VBNC状态检测的准确性。
乳及乳制品中VBNC细菌的污染问题不容忽视,容易成为逃避检测的“隐性传染源”,对食品安全构成潜在威胁。本文通过综述乳及乳制品中几种常见VBNC食源致病菌的诱导和复苏因素、生物学特性及其检测方法,为乳及乳制品微生物安全领域提供了新的研究对象及思路。同时由于乳制品中高脂肪、高蛋白的食品基质干扰以及细菌VBNC的特殊性,对现有的快速检测技术也提出了更高要求,通过对活性染色、免疫富集、生物传感器等技术整合,有利于构建新型微生物快速高通量检测技术平台,实现对食品中痕量食源致病细菌的快速定量检测,进一步保障乳及乳制品的质量安全。
[1] 张亚红, 王娉, 杨海荣, 等. 预测微生物学在乳及乳制品中的应用[J].检验检疫学刊, 2015, 25(6): 62-65; 51.
[2] Centers for Disease Control and Prevention. Listeria outbreaks[EB/OL].(2017-06-28)[2017-10-12]. https://www.cdc.gov/listeria/outbreaks/index.html.
[3] 何万生, 谭彩霞, 罗厚洪, 等. 一起由肠炎沙门氏菌感染乳及乳制品引起的食物中毒的调查分析[J]. 广州医药, 2001(5): 61.
[4] 韩宁生, 夏广金, 董建云, 等. 一起学校金黄色葡萄球菌食源性疾病暴发的流行病学调查[J]. 中国学校卫生, 2017, 38(8): 1266-1267.
[5] 侯浩. 一起金黄色葡萄球菌引起的乳制品食物中毒调查与分析[J].中外健康文摘, 2013(22): 148-149.
[6] LONGENBERGER A H, PALUMBO A J, CHU A K, et al.Campylobacter jejuni infections associated with unpasteurized milkmultiple states, 2012[J]. Clinical Infectious Diseases, 2013, 57(2):263-266.doi:10.1093/cid/cit231.
[7] BUVENS G, POSSE B, DE SCHRIJVER K, et al. Virulence profiling and quantification of verocytotoxin-producing Escherichia coli O145:H28 and O26:H11 isolated during an ice cream-related hemolytic uremic syndrome outbreak[J]. Foodborne Pathogens and Disease, 2011, 8(3): 421-426.doi:10.1089/fpd.2010.0693.
[8] MUNGAI E A, BEHRAVESH C B, GOULD L H. Increased outbreaks associated with nonpasteurized milk, United States, 2007-2012[J].Emerging Infectious Diseases, 2015, 21(1): 119-122.doi:10.3201/eid2101.140447.
[9] 龙奇志, 何志敏, 陈友群, 等. 一例由阪崎肠杆菌感染引起的婴儿腹泻调查[J]. 实用预防医学, 2017, 24(8): 954-956.
[10] 李利军, 马英辉, 卢美欢. 微生物及其毒素在乳制品加工中的污染与控制[J]. 陕西农业科学, 2016, 62(5): 72-75.
[11] GUNASEKERA T S, SORENSEN A, ATTFIELD P V, et al.Inducible gene expression by nonculturable bacteria in milk after pasteurization[J]. Applied & Environmental Microbiology, 2002,68(4): 1988-1993.
[12] SULIANTARI Y, DEWANTI H R. Cronobacter sakazakii enters viable but nonculturable state during biofilm formation[J]. Jurnal Teknologi dan Industri Pangan, 2016, 27(2): 140-147.doi:10.6066/jtip.2016.27.2.140.
[13] CALDERA L, ARIOLI S, STUKNYTĖ M, et al. Setup of a rapid method to distinguish among dead, alive, and viable but not cultivable cells of Pseudomonas spp. in mozzarella cheese[J]. Journal of Dairy Science, 2015, 98(12): 8368-8374.doi:10.3168/jds.2015-9677.
[14] 刘羽霏, 方祥, 廖振林, 等. 不同诱导条件下的VBNC状态副溶血弧菌的PMA-qPCR定量检测及其呼吸活性分析[J]. 食品科学, 2017,38(20): 215-221.doi:10.7506/spkx1002-6630-201720031.
[15] LI Y M, YANG L, FU J, et al. The novel loop-mediated isothermal amplif i cation based conf i rmation methodology on the bacteria in viable but non-culturable (VBNC) state[J]. Microbial Pathogenesis, 2017, 111: 280-284.
[16] 田聪, 余以刚, 肖性龙, 等. 活的非可培养状态大肠杆菌O157:H7的复苏研究[J]. 食品科学, 2013, 34(11): 218-221.doi:10.7506/spkx1002-6630-201311047.
[17] 黄韵. 冷鲜肉中单增李斯特菌活菌分子检测技术研究[D]. 广州: 华南理工大学, 2014: 55-64.
[18] LUO D, HUANG X L, MAO Y, et al. Two-step large-volume magnetic separation combined with PCR assay for sensitive detection of Listeria monocytogenes in pasteurized milk[J]. Journal of Dairy Science, 2017, 100(10): 7883-7890.
[19] DILER E, OBST U, SCHMITZ K, et al. A lysozyme and magnetic bead based method of separating intact bacteria[J]. Analytical &Bioanalytical Chemistry, 2011, 401(1): 253-265.
[20] JANNASCH H W, JONES G E. Bacterial populations in sea water as determined by different methods of enumeration[J]. Limnology &Oceanography, 1959, 4(2): 128-139.
[21] XU Haishu, ROBERTS N C, SINGLETON F, et al. Survival and viability of nonculturable Escherichia coli and Vibrio cholerae in the estuarine and marine environment[J]. Microbial Ecology, 1982, 8(4):313-323.doi:10.1007/BF02010671.
[22] LI L, MENDIS N, TRIGUI H, et al. The importance of the viable but non-culturable state in human bacterial pathogens[J]. Frontiers in Microbiology, 2014, 5(6): 1-20.
[23] OLIVER J D. Recent fi ndings on the viable but nonculturable state in pathogenic bacteria[J]. FEMS Microbiology Reviews, 2010, 34(4):415-425.doi:10.1111/j.1574-6976.2009.00200.x.
[24] OLIVER J D. The viable but nonculturable state for bacteria: status update: this dormant form of bacteria was fi rst appreciated in 1982;now skeptics recognize this state as a bacterial response to stress and a strategy for survival[J]. Microbe Magazine, 2016, 11(4): 159-164.doi:10.1128/microbe.11.159.1.
[25] 高鹤, 赵勇, 刘承初. 致病微生物应对环境胁迫形成的VBNC状态及其对风险评估的潜在影响[J]. 微生物学通报, 2014, 41(1): 169-177.
[26] PINTO D, SANTOS M A, CHAMBEL L. Thirty years of viable but nonculturable state research: unsolved molecular mechanisms[J].Critical Reviews in Microbiology, 2015, 41(1): 61-76.doi:10.3109/1 040841X.2013.794127.
[27] 邸聪聪, 胡平, 胡章立, 等. 细菌活的非可培养(VBNC)状态及其机理研究进展[J]. 应用与环境生物学报, 2014, 20(6): 1124-1131.
[28] ZHAO X H, ZHONG J L, WEI C J, et al. Current perspectives on viable but non-culturable state in foodborne pathogens[J]. Frontiers in Microbiology, 2017, 8: 1-16.
[29] 田聪. 两种食源性致病菌VBNC状态诱导与分子检测技术研究[D].广州: 华南理工大学, 2013: 44-50.
[30] MUKAMOLOVA G V, KAPRELYANTS A S, KELL D B, et al.Adoption of the transiently non-culturable state: a bacterial survival strategy?[J]. Advances in Microbial Physiology, 2003, 47: 65-129.
[31] AYRAPETYAN M, OLIVER J D. The viable but non-culturable state and its relevance in food safety[J]. Current Opinion in Food Science,2016, 8(Suppl C): 127-133.doi:10.1016/j.cofs.2016.04.010.
[32] 周蓉. 低温储藏对肠出血大肠杆菌VBNC状态的诱导及毒素表达量的影响研究[D]. 广州: 华南理工大学, 2015: 19-20.
[33] 李月. 活的非可培养状态副溶血弧菌生物学特性及其检测方法的研究[D]. 广州: 华南农业大学, 2011: 44-60.
[34] LIU J Y, ZHOU R, LI L, et al. Viable but non-culturable state and toxin gene expression of enterohemorrhagic Escherichia coli O157 under cryopreservation[J]. Research in Microbiology, 2016, 168(3):188-193.
[35] 刘德欣, 刘佩莹, 陈颖翘, 等. 金黄色葡萄球菌活的非可培养状态的诱导和复苏[J]. 食品工业科技, 2014, 35(3): 163-167.
[36] 赵凤. 高压二氧化碳诱导Escherichia coli O157:H7形成活的非可培养状态的机制研究[D]. 北京: 中国农业大学, 2014: 81-95.
[37] PATRONE V, CAMPANA R, VALLORANI L, et al. CadF expression in Campylobacter jejuni strains incubated under low-temperature water microcosm conditions which induce the viable but non-culturable(VBNC) state[J]. Antonie Van Leeuwenhoek, 2013, 103(5): 979-988.
[38] GAHAN C G M, O’DRISCOLL B, HILL C, et al. Acid adaptation of Listeria monocytogenes can enhance survival in acidic foods and during milk fermentation[J]. Applied and Environmental Microbiology, 1996, 62(9): 3128-3132.
[39] 郭川, 林奕华, 庄旭冬, 等. 副溶血性弧菌VBNC的诱导及其免疫捕获PCR检测[J]. 中国病原生物学杂志, 2010, 5(7): 502-504; 509; 568.
[40] WONG H C, WANG P, CHEN S Y, et al. Resuscitation of viable but non-culturable Vibrio parahaemolyticus in a minimum salt medium[J].FEMS Microbiology Letters, 2004, 233(2): 269-275.doi:10.1016/j.femsle.2004.02.015.
[41] CHAVEERACH P, HUURNE A, LIPMAN L J, et al. Survival and resuscitation of ten strains of Campylobacter jejuni and Campylobacter coli under acid conditions[J]. Applied & Environmental Microbiology,2003, 69(1): 711-714.
[42] BAFFONE W, CASAROLI A, CITTERIO B, et al. Campylobacter jejuni loss of culturability in aqueous microcosms and ability to resuscitate in a mouse model[J]. International Journal of Food Microbiology, 2006, 107(1): 83-91.
[43] MASMOUDI S, DENIS M, MAALEJ S. Inactivation of the gene katA or sodA affects the transient entry into the viable but non-culturable response of Staphylococcus aureus in natural seawater at low temperature[J]. Marine Pollution Bulletin, 2010, 60(12): 2209-2214.
[44] 田聪, 余以刚, 肖性龙, 等. 金黄色葡萄球菌活的非可培养状态复苏及PMA-qPCR检测[J]. 现代食品科技, 2013, 29(6): 1390-1394.
[45] CUNNINGHAM E, O’BYRNE C, OLIVER J D. Effect of weak acids on Listeria monocytogenes survival: evidence for a viable but nonculturable state in response to low pH[J]. Food Control, 2009,20(12): 1141-1144.
[46] OVERNEY A, CHASSAING D, CARPENTIER B, et al. Development of synthetic media mimicking food soils to study the behaviour of Listeria monocytogenes on stainless steel surfaces[J]. International Journal of Food Microbiology, 2016, 238: 7-14.
[47] 黄韵, 余以刚, 黄秀丽, 等. 单增李斯特菌非可培养状态的诱导与PMA-qPCR检测[J]. 食品工业科技, 2014, 35(1): 137-140; 149.
[48] 丁林贤, 胡娇娇, 郑祝军, 等. 基于Rpf土壤中VBNC细菌的复苏可培养化研究[C]//第十六次全国环境微生物学学术研讨会. 兰州: 中国微生物学会, 2013: 77-78.
[49] CAPPELIER J M, BESNARD V, ROCHE S M, et al. Avirulent viable but non culturable cells of Listeria monocytogenes need the presence of an embryo to be recovered in egg yolk and regain virulence after recovery[J]. Veterinary Research, 2007, 38(4): 573-583.
[50] ORRUÑO M, KABERDIN V R, ARANA I. Survival strategies of Escherichia coli and Vibrio spp.: contribution of the viable but nonculturable phenotype to their stress-resistance and persistence in adverse environments[J]. World Journal of Microbiology &Biotechnology, 2017, 33(3): 45.
[51] WANG Y Y, CLAEYS L, VAN DER HA D, et al. Effects of chemically and electrochemically dosed chlorine on Escherichia coli and Legionella beliardensis assessed by flow cytometry[J]. Applied Microbiology & Biotechnology, 2010, 87(1): 331-341.
[52] KIBBEE R J, ÖRMECI B. Development of a sensitive and falsepositive free PMA-qPCR viability assay to quantify VBNC Escherichia coli and evaluate disinfection performance in wastewater eff l uent[J]. Journal of Microbiological Methods, 2017, 132: 139-147.
[53] LIN H, YE C, CHEN S, et al. Viable but non-culturable E. coli induced by low level chlorination have higher persistence to antibiotics than their culturable counterparts[J]. Environmental Pollution, 2017,230: 242-249.
[54] REISSBRODT R, RIENAECKER I, ROMANOVA J M, et al.Resuscitation of Salmonella enterica serovar typhimurium and enterohemorrhagic Escherichia coli from the viable but nonculturable state by heat-stable enterobacterial autoinducer[J]. Applied &Environmental Microbiology, 2002, 68(10): 4788-4794.
[55] FAKRUDDIN M, RAHAMAN M. MIZANUR, HOSSAIN M, et al.Induction and resuscitation of Cronobacter sakazakii into viable but non-culturable state at low temperature in water microcosm[J]. Asian Journal of Biological Sciences, 2008, 10(2): 64-71.
[56] SARI R NURMALITA. Dessication induces viable but non-culturable cells of Cronobacter sakazakii[D]. Bogor: Institut Pertanian Bogor,2016: 6-16.
[57] 姜琛璐, 舒畅, 李林. 阪崎肠杆菌食品分离株的耐受性研究[J]. 食品工业科技, 2013, 34(19): 122-126.
[58] 田娟, 叶忱, 刘羽霏, 等. 基于iTRAQ方法分析副溶血弧菌活的非可培养状态的差异表达上调蛋白[J]. 现代食品科技, 2015, 31(8): 53-58.
[59] AYRAPETYAN M, WILLIAMS T C, OLIVER J D. Interspecific quorum sensing mediates the resuscitation of viable but nonculturable vibrios[J]. Applied & Environmental Microbiology, 2014, 80(8):2478-2483.
[60] EPSTEIN S S. Microbial awakenings[J]. Nature, 2009, 457: 1083.
[61] MORISHIGE Y, FUJIMORI K, AMANO F. Differential resuscitative effect of pyruvate and its analogues on VBNC (viable but nonculturable) Salmonella[J]. Microbes & Environments, 2013, 28(2):180-186.
[62] CHAISOWWONG W, KUSUMOTO A, HASHIMOTO M, et al.Physiological characterization of Campylobacter jejuni under cold stresses conditions: its potential for public threat[J]. Journal of Veterinary Medical Science, 2012, 74(1): 43-50.
[63] 姚斐, 寇运同, 陈刚, 等. 间接免疫荧光抗体技术检测活的非可培养状态的副溶血弧菌[J]. 海洋科学, 2000, 24(9): 10-12.
[64] CAI X Q, YU H Q, ZHOU X R, et al. Rapid detection and simultaneous genotyping of Cronobacter spp. (formerly Enterobacter sakazakii) in powdered infant formula using real-time PCR and high resolution melting (HRM) analysis[J]. PLoS ONE, 2013, 8(6): e67082.
[65] ZIMMERMANN J, SCHMIDT H, LOESSNER M J, et al.Development of a rapid detection system for opportunistic pathogenic Cronobacter spp. in powdered milk products[J]. Food Microbiology,2014, 42(12): 19-25.
[66] 庞贝妮, 顾文佳, 徐琼, 等. EMA/PMA-qPCR技术检测活肠炎沙门氏菌方法的对比研究[J]. 食品科技, 2014, 39(6): 298-302.
[67] 李影, 王伟利, 孟庆峰, 等. 活的非可培养状态沙门菌RT-PCR检测[J].华南农业大学学报, 2013, 34(1): 98-100.
[68] RAVAN H, AMANDADI M, SANADGOL N. A highly specific and sensitive loop-mediated isothermal amplif i cation method for the detection of Escherichia coli O157:H7[J]. Microbial Pathogenesis,2016, 91: 161-165.
[69] 覃昱. 应用免疫磁珠分离及LAMP技术快速检测配方奶粉中克罗诺杆菌[D]. 广州: 南方医科大学, 2014: 45-55.
[70] YAN M X, XU L, JIANG H, et al. PMA-LAMP for rapid detection of Escherichia coli and shiga toxins from viable but non-culturable state[J]. Microbial Pathogenesis, 2017, 105: 245-250.
[71] ZHONG Q P, CHEN Y Q, WANG L, et al. Development of PMA-LAMP for rapid detection of Staphylococcus aureus in viable but nonculturable state[C]// Joint International Conference on Social Science and Environmental Science/International Conference on Food Science and Engineering. Kuala Lumpur: World Academy of Science, 2016: 451-456.
[72] KOBER C, NIESSNER R, SEIDEL M. Quantification of viable and non-viable Legionella spp. by heterogeneous asymmetric recombinase polymerase amplification (haRPA) on a flow-based chemiluminescence microarray[J]. Biosensors and Bioelectronics,2018, 100: 49-55.doi:10.1016/j.bios.2017.08.053.
[73] LIU Haibin, DU Xinjun, ZANG Yuxuan, et al. A SERS-based lateral flow strip biosensor for simultaneous detection of Listeria monocytogenes and Salmonella enterica serotype enteritidis[J]. Journal of Agricultural and Food Chemistry, 2017, 65(47): 10290-10299.doi:10.1021/acs.jafc.7b03957.
[74] XU L, LIANG W, WEN Y L, et al. An ultrasensitive electrochemical biosensor for the detection of mecA gene in methicillin-resistant Staphylococcus aureus[J]. Biosensors & Bioelectronics, 2018, 99: 424-430.
[75] SAID M, OTAKI M, HASSEN A. Use of lytic phage to control Salmonella typhi’s viability after irradiation by pulsed UV light[J].Annals of Microbiology, 2012, 62(1): 107-111.
[76] LABIB M, ZAMAY A S, MUHAREMAGIC D, et al. Aptamer-based viability impedimetric sensor for viruses[J]. Analytical Chemistry,2012, 84(4): 1813-1816.doi:10.1021/ac203412m.
A Review of Viable but Nonculturable Pathogens in Milk and Dairy Products