
随着对氧化与人体衰老、疾病的发生与发展之间关系的认识不断深入,研究者发现,外源补充抗氧化剂是提高机体抗氧化能力、减缓衰老、防病养生的有效途径[1-2];而天然来源的抗氧化剂以安全性高、抗氧化能力强、无副作用等优点备受关注[3-4]。因此,寻找安全的天然抗氧化剂成为从事食品科学研究人员的重要课题。啤酒花(Humulus lupulus L.),别名忽布、蛇麻花等,是荨麻目大麻科葎草属多年生草本植物,雌雄异株;其化学成分主要有啤酒花树脂、黄酮、多酚、挥发油等。啤酒花味苦、性平,具有明显的药理活性、优异的抗氧化能力和防腐特性[5-8],有健胃、消食、利尿、安神、止咳化痰等功效[9-10]。
啤酒花是啤酒酿造的主要原料之一,在国内外均有悠久的应用历史,其安全性好。本实验以新疆三宝乐农业科技有限公司培育的萨斯特1、萨斯特2、萨斯特3号啤酒花为原料,首先通过石油醚提取得到啤酒花树脂,再以体积分数75%乙醇溶液提取脱脂后啤酒花中的其他活性成分,对得到的乙醇提取物经氯仿、乙酸乙酯、正丁醇依次分离得不同极性溶剂提取物,以·OH、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基及β-胡萝卜素-亚油酸体系综合评价上述不同极性溶剂提取物的抗氧化能力,并结合样品中活性成分含量的相关性分析,寻找啤酒花中抗氧化成分的物质基础,为进一步拓展啤酒花的应用领域提供理论基础。
萨斯特1号、萨斯特2号、萨斯特3号压缩啤酒花样品由新疆三宝乐农业科技有限公司提供;为叙述方便,后文中相应统一简化为1#、2#、3#。
DPPH、β-胡萝卜素、福林-酚试剂 Sigma-Aldrich(中国)公司;没食子酸、芦丁 中国药品生物制品鉴定所;其他试剂均为国产分析纯 国药集团化学试剂公司。
KQ-100VED型三频数控超声波清洗器 昆山市超声仪器有限公司;BS210S型电子天平 德国赛多利斯公司;DHP-420型电热恒温培养箱 北京市永光明医疗仪器厂;UV-5300PC型紫外-可见分光光度计 上海元析仪器有限公司;DHG-9075A型电热鼓风干燥箱 上海一恒科学仪器有限公司;HH-S4型数显恒温水浴 金坛市医疗仪器厂。
1.3.1 3 种啤酒花不同极性溶剂的提取
啤酒花样品粉碎后以石油醚萃取至溶液无色,石油醚相脱去溶剂后得石油醚提取物(petroleum ether extracts,PE);萃取后的啤酒花渣以体积分数75%乙醇溶液提取、浓缩后得乙醇提取物。该乙醇提取物用蒸馏水溶解混悬后,依据极性由弱到强顺序依次用氯仿、乙酸乙酯、正丁醇提取,提取液脱除溶剂后分别得氯仿提取物(chloroform extracts,CE)、乙酸乙酯提取物(ethyl acetate extracts,EAE)、正丁醇提取物(n-butanol extracts,NBE),萃取后的水相经浓缩干燥后得到水提取物(water extracts,WE),各极性溶剂提取物测试前分别用无水乙醇溶解,并根据需要进行相应稀释。
1.3.2 α-酸和β-酸含量的测定
α-酸和β-酸含量的测定参考GB/T 20369—2006《啤酒花制品》[11]中的方法。准确称取样品(5.000±0.001)g于250 mL具塞锥形瓶中,移入100 mL甲苯,振荡萃取30 min后静置10 min,精确移取5.0 mL萃取液于100 mL容量瓶中,甲醇定容,得到A液。准确移取3.0 mL A液于50 mL容量瓶中,用碱性甲醇(100 mL的甲醇中加入6 mol/L的NaOH 0.2 mL)定容,得到B液。参比液配制:移取5.0 mL甲苯于100 mL容量瓶中,用甲醇定容,摇匀后移取该溶液3.0 mL,再用碱性甲醇稀释定容至50 mL。以参比液校正仪器吸光度为零,然后在波长275、325、355 nm波长处分别测定样品稀释B液的吸光度,α-酸和β-酸含量分别按公式(1)、(2)计算。

式中:A355 nm、A325 nm、A275 nm分别为稀释B液在波长355、325、275 nm波长处的吸光度;其余数据均为经验公式中的经验值。
1.3.3 总黄酮含量的测定
采用NaNO2-Al(NO3)3-NaOH显色法[12]测定总黄酮含量。准确称量烘至恒质量的芦丁标准品0.109 1 g,用体积分数30%乙醇溶液配制成质量浓度为0.218 2 mg/mL的标准溶液。准确吸取标准溶液0、1.0、2.0、3.0、4.0、5.0、6.0 mL,分别置于25 mL的容量瓶中,用体积分数30%乙醇溶液补充至10 mL,加入质量分数5% NaNO2溶液1.0 mL,摇匀,放置5 min;然后加入质量分数10% Al(NO3)3溶液1.0 mL,摇匀,放置6 min;再加入1 mol/L NaOH溶液10 mL,用蒸馏水定容至刻度,摇匀,放置10 min。以不加样品的溶液为参比,在510 nm波长处测定吸光度,以质量浓度-吸光度进行线性回归,得回归方程为:A=0.007 5+15.668 7ρ,决定系数R2=0.999 2,线性范围0.008 7~0.043 6 mg/mL(以芦丁质量计)。以1 mL的样品溶液代替标准品溶液进行上述实验,总黄酮含量按式(3)计算。
式中:ω为样品中总黄酮含量;ρ为根据标准曲线计算出样品提取液中总黄酮的质量浓度/(mg/mL);V为提取液的体积/mL;n为稀释倍数;m为样品质量/g。
1.3.4 总多酚含量的测定
采用福林-酚比色法[13-14]测定总多酚含量。取烘至恒质量的没食子酸标准品0.044 3 g,用水溶解并配成质量浓度依次为8.86、17.22、35.44、53.16、70.88、88.60 μg/mL的系列标准溶液。分别取上述不同溶液1 mL加到10 mL比色管中,依次加入1 mL去离子水、0.5 mL稀释两倍的福林-酚试剂、1.5 mL 17.5% Na2CO3,去离子水定容至刻度;室温下反应2 h,在760 nm波长处测定吸光度。以质量浓度-吸光度进行线性回归,得回归方程为:A=0.003 5+0.010 3ρ,决定系数R2=0.999 5,线性范围在8.86~88.60 μg/mL(以没食子酸质量计)。1 mL的样品溶液代替标准品溶液进行上述实验,总多酚含量按式(4)计算。
式中:ω为样品中总多酚含量;ρ为根据标准曲线计算出样品提取液中多酚的质量浓度/(μg/mL);V为提取液的体积/mL;n为稀释倍数;m为样品质量/g。
1.3.5 ·OH清除活力的测定
采用邻二氮菲-Fe2+氧化法[15]测定·OH清除活力,取0.75 mmol/L新鲜配制的的邻二氮菲溶液1 mL于试管中,依次加入磷酸盐缓冲溶液(0.2 mmol/L、pH 7.4)2 mL和重蒸水1 mL,充分混匀后,加0.75 mmol/L FeSO4 1 mL混匀,再加入体积分数0.3% H2O2溶液1 mL,混合均匀后于37 ℃恒温箱中温育60 min。冷却后,在536 nm波长处测定吸光度(以蒸馏水作空白),所测得的数据为损伤管的吸光度。未损伤管以1 mL重蒸水代替损伤管中1 mL 0.3%的H2O2,样品管以1 mL样品代替损伤管中的1 mL重蒸水,操作方法同损伤管,可分别测得536 nm波长处损伤管和样品管的吸光度,样品·OH清除率按公式(5)计算。

式中:A样为样品的吸光度;A损为损伤管的吸光度;A未为未损伤管的吸光度。
1.3.6 DPPH自由基清除活力的测定
准确称取0.010 0 g DPPH,用甲醇定容于250 mL的容量瓶中,配成质量浓度为0.04 mg/mL的溶液。取1 mL样品液于试管中,加入3 mL DPPH溶液,放置40 min后,在517 nm波长处测定吸光度(空白对照组用甲醇代替样品)[16]。DPPH自由基清除率按公式(6)计算。
式中:A0为未添加样品时DPPH溶液的吸光度;A1为添加样品时DPPH溶液的吸光度。
1.3.7 β-胡萝卜素-亚油酸体系抗氧化活性实验
取0.5 mL质量浓度为1.21 mg/mL的β-胡萝卜素氯仿溶液、0.2 mL质量浓度为0.1 g/mL的亚油酸氯仿溶液、1.0 mL质量浓度为0.2 g/mL的吐温-40氯仿溶液于200 mL圆底烧瓶中混匀,置于50 ℃水浴中除去氯仿,加入100 mL蒸馏水摇匀,制得β-胡萝卜素-亚油酸溶液。同时另取小锥形瓶,不加β-胡萝卜素溶液,其他同前述,作空白调零用。测定时,取上述制得的β-胡萝卜素-亚油酸溶液45 mL,加入4 mL的0.2 mol/L pH 7.0磷酸盐缓冲液,摇匀得反应介质溶液。在试管中逐一加入4.0 mL反应介质溶液,再加0.1 mL的样液,同时设置不含试样(以0.1 mL 体积分数80%乙醇溶液代替)的对照管。配制好的溶液在470 nm波长处测定其吸光度,记为“0 min”时刻的吸光度[17]。然后将所有试管置于50 ℃恒温水浴中保温90 min,取出测定“90 min”时刻的吸光度,总抗氧化能力按公式(7)计算。
式中:A空t、A样t分别表示t=90 min时对照和样品的吸光度;A空0、A样0分别表示t=0 min时对照和样品的吸光度。
所有实验数据为3 次重复实验结果的平均值,表示为平均值±标准偏差,实验数据的处理与统计分析采用Microsoft Excel 2010、OriginPro 8.6和SPSS 16.0软件进行处理,采用邓肯氏多重极差法进行显著性分析。
α-酸、β-酸、黄酮和多酚类化合物为啤酒花中的主要活性成分,表1为3 个品种啤酒花各极性溶剂提取物中α-酸、β-酸、黄酮和多酚的含量。α-酸和β-酸极性较弱,主要存在于PE中,CE中仅有少量,其他极性提取物中均未检测出α-酸和β-酸。其中,1#和2#样品中的α-酸含量相当,3#样品略低;β-酸在3#样品中的含量也较低。黄酮及多酚类化合物在所有极性溶剂提取物中都存在,含量均以在EAE最高,NBE次之,PE最低。3 个啤酒花样品在各极性溶剂提取物中的趋势差异较小,各极性溶剂提取物中黄酮均为1#样品中含量最高,多酚含量除WE、EAE外也与此基本一致,仅在PE中3#样品略高于1#样品。
表 1 α-酸、β-酸、黄酮和多酚的含量
Table 1 Contents of α-acids, β-acids, fl avonoids and polyphenols in hop extracts mg/g
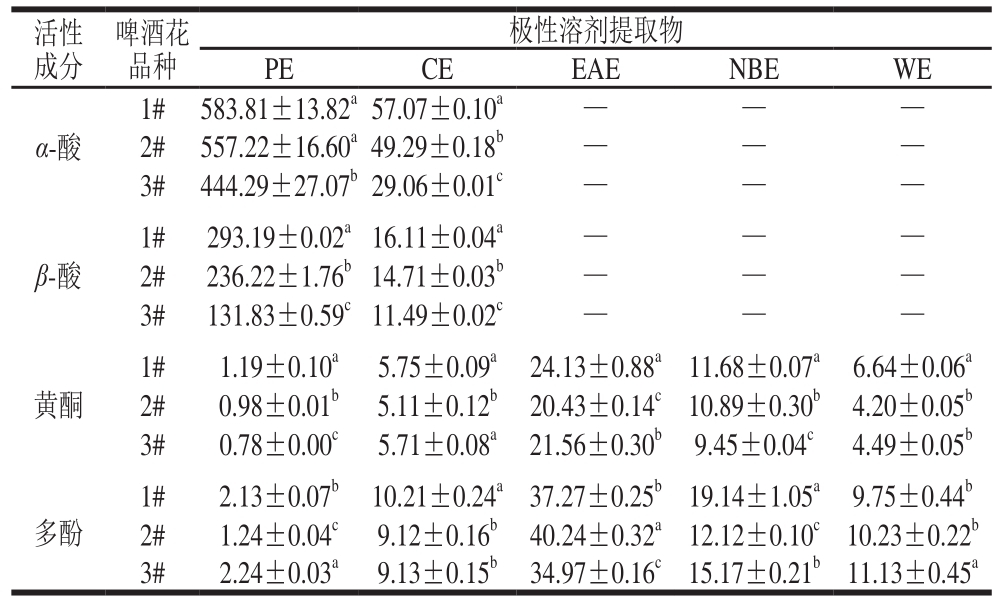
注:同列同一成分肩标小写字母不同表示差异显著(P<0.05);—.未检出相应数据。
活性成分啤酒花品种极性溶剂提取物PE CE EAE NBE WE α-酸1# 583.81±13.82a57.07±0.10a — — —2# 557.22±16.60a49.29±0.18b — — —3# 444.29±27.07b29.06±0.01c — — —β-酸1# 293.19±0.02a16.11±0.04a — — —2# 236.22±1.76b14.71±0.03b — — —3# 131.83±0.59c11.49±0.02c — — —黄酮1# 1.19±0.10a 5.75±0.09a 24.13±0.88a11.68±0.07a 6.64±0.06a 2# 0.98±0.01b 5.11±0.12b 20.43±0.14c10.89±0.30b 4.20±0.05b 3# 0.78±0.00c 5.71±0.08a 21.56±0.30b 9.45±0.04c 4.49±0.05b 1# 2.13±0.07b 10.21±0.24a37.27±0.25b19.14±1.05a 9.75±0.44b 2# 1.24±0.04c 9.12±0.16b 40.24±0.32a12.12±0.10c10.23±0.22b 3# 2.24±0.03a 9.13±0.15b 34.97±0.16c15.17±0.21b 11.13±0.45a多酚
Fenton反应产生的·OH能使邻二氮菲-Fe2+氧化为邻二氮菲-Fe3+,邻二氮菲-Fe2+在536 nm波长处的最大吸收峰消失,根据536 nm波长处吸光度变化可判断受试物清除·OH的能力,进而反映抗氧化剂抗氧化能力的强弱[18],啤酒花不同极性溶剂提取物的清除·OH活性见图1。

图 1 各样品清除·OH能力
Fig. 1 Hydroxyl radical scavenging activity of hop extracts
由图1可知,啤酒花各极性溶剂提取物对·OH均有一定的清除能力,且表现出明显的量效关系。3 种酒花各极性溶剂提取物清除·OH的能力由强到弱依次为PE>CE>EAE>NBE>WE。抗氧化活性强弱通常以半数清除浓度(half maximal inhibitory concentration,IC50)来评价,IC50越小,样品清除自由基能力越强。从表2的IC50可以看出,3 个啤酒花样品中,PE、CE、NBE清除·OH能力为1#>2#>3#,EAE为2#>1#>3#,WE为1#>3#>2#;与对照品芦丁(IC50为(0.041 8±0.000 1)mg/mL)相比,除1#样品的PE(IC50为(0.073 6±0.010 2)mg/mL)比较接近外,其余·OH清除能力均明显偏弱。比较白姗姗等[19]对扎一、马可波罗啤酒花废弃枝叶70%乙醇提取物清除·OH能力的相关性研究,1#、2#、3#各极性溶剂提取物清除·OH的能力都强于扎一、马可波罗啤酒花废弃枝叶70%乙醇提取物(扎一、马可波罗清除·OH的IC50分别为9.04、6.80 mg/mL)。
表 2 不同抗氧化体系样品的IC50
Table 2 IC50 for antioxidant properties of different hop extracts mg/mL
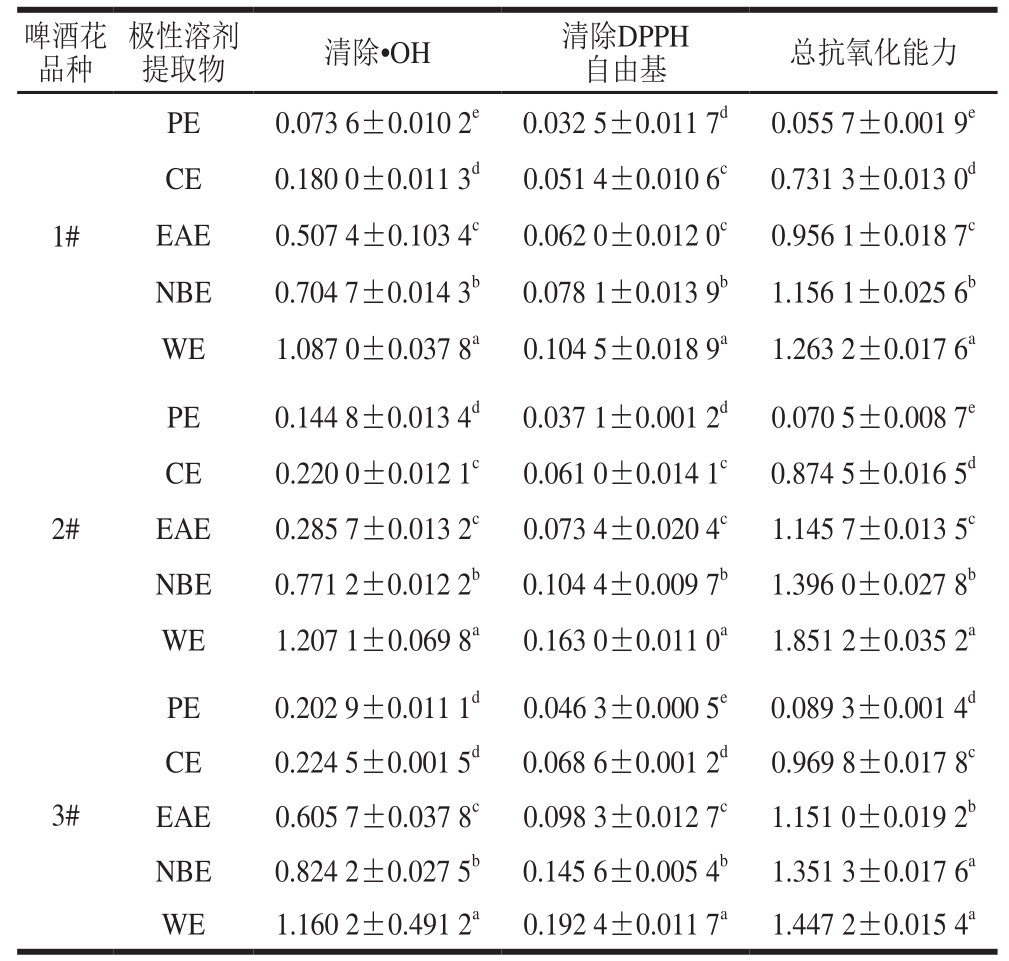
注:同列相同样品肩标小写字母不同表示差异显著(P<0.05)。
啤酒花品种极性溶剂提取物清除·OH清除DPPH自由基总抗氧化能力1#PE 0.073 6±0.010 2e 0.032 5±0.011 7d 0.055 7±0.001 9e CE 0.180 0±0.011 3d 0.051 4±0.010 6c 0.731 3±0.013 0d EAE 0.507 4±0.103 4c 0.062 0±0.012 0c 0.956 1±0.018 7c NBE 0.704 7±0.014 3b 0.078 1±0.013 9b 1.156 1±0.025 6b WE 1.087 0±0.037 8a 0.104 5±0.018 9a 1.263 2±0.017 6a 2#PE 0.144 8±0.013 4d 0.037 1±0.001 2d 0.070 5±0.008 7e CE 0.220 0±0.012 1c 0.061 0±0.014 1c 0.874 5±0.016 5d EAE 0.285 7±0.013 2c 0.073 4±0.020 4c 1.145 7±0.013 5c NBE 0.771 2±0.012 2b 0.104 4±0.009 7b 1.396 0±0.027 8b WE 1.207 1±0.069 8a 0.163 0±0.011 0a 1.851 2±0.035 2a PE 0.202 9±0.011 1d 0.046 3±0.000 5e 0.089 3±0.001 4d CE 0.224 5±0.001 5d 0.068 6±0.001 2d 0.969 8±0.017 8c EAE 0.605 7±0.037 8c 0.098 3±0.012 7c 1.151 0±0.019 2b NBE 0.824 2±0.027 5b 0.145 6±0.005 4b 1.351 3±0.017 6a WE 1.160 2±0.491 2a 0.192 4±0.011 7a 1.447 2±0.015 4a 3#
DPPH自由基是一种以氮为中心的很稳定的自由基,其甲醇溶液呈现深紫色,在517 nm波长有最大吸收峰,当有自由基清除剂存在时,DPPH自由基的游离电子被配对,溶液颜色会逐渐变浅。DPPH自由基的配对程度与其颜色褪色程度成定量关系,据此可通过测定其吸光度的变化确定其抗氧化能力的强弱[20],啤酒花各极性部位提取物清除DPPH自由基的活性见图2。
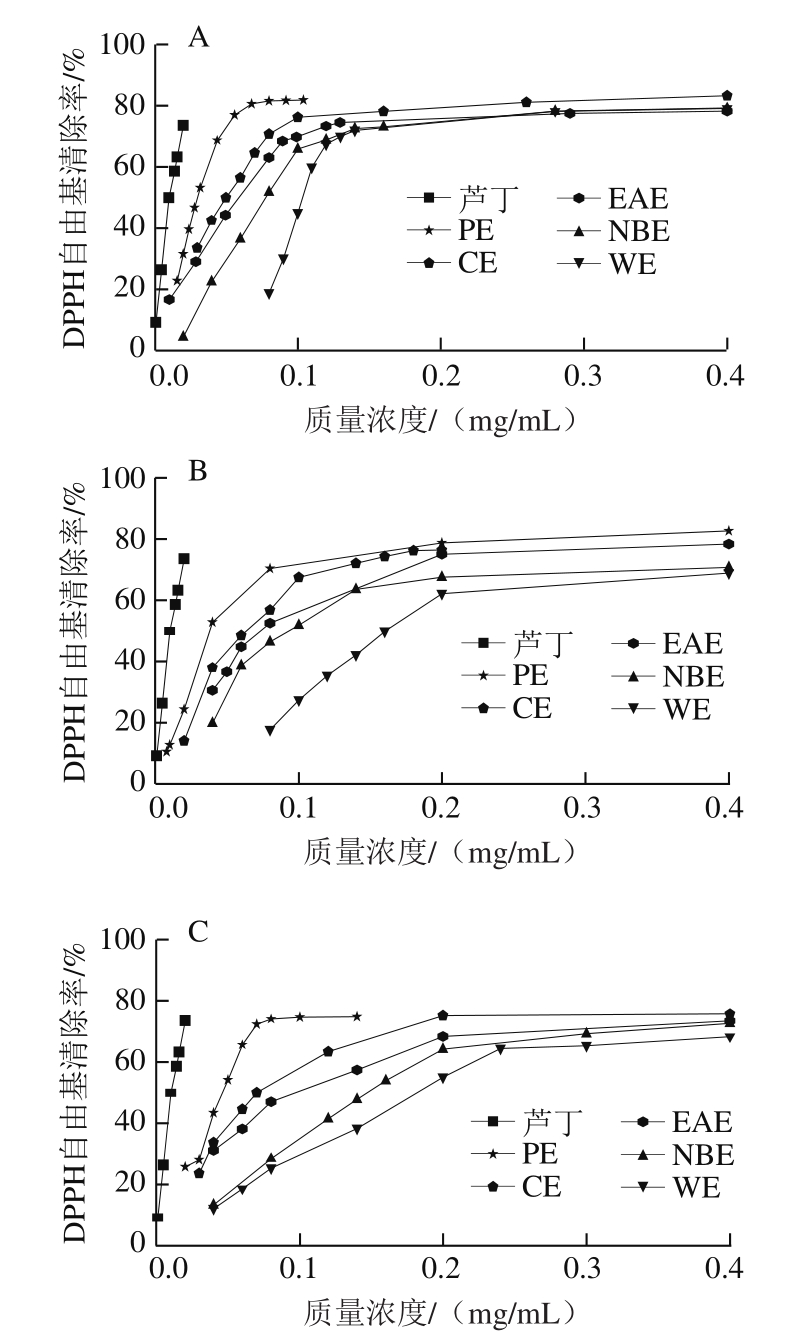
图 2 各样品清除DPPH自由基能力
Fig. 2 DPPH radical scavenging activity of hop extracts
由图2可知,啤酒花各极性溶剂提取物均具有清除DPPH自由基的活性,质量浓度在0~0.2 mg/mL的范围内,清除率随样品质量浓度的增大而增大,当质量浓度超过0.2 mg/mL时,清除率趋于稳定。各样品清除DPPH自由基的IC50如表2所示,3 个啤酒花各极性溶剂提取物清除能力大小均为PE>CE>EAE>NBE>WE,且1#>2#>3#。但与对照品芦丁相比,所有样品的IC50均高于芦丁(IC50为0.011 9±0.013 6 mg/mL)。上述结果与刘莎等[21]有关不同品种酒花(‘马可波罗’、‘青岛大花’和‘扎一’)液态CO2萃余物清除DPPH自由基能力结果相比,‘扎一’清除DPPH自由基活性弱于PE、CE及1#的EAE,但强于其他极性溶剂提取物;‘青岛大花’清除DPPH自由基活性弱于PE、CE、EAE、1#、2#的NBE和1#的WE;‘马可波罗’清除DPPH自由基的活性强于2#、3#的WE及3#的NBE,但都比其他极性溶剂提取物弱(‘马可波罗’、‘青岛大花’和‘扎一’清除DPPH自由基IC50分别为0.123、0.106、0.071 mg/mL)。
β-胡萝卜素是一种多烯橘黄色素易被氧化褪色,反应介质中的亚油酸会氧化产生过氧化物质使β-胡萝卜素褪色,当向反应体系中加入抗氧化剂时,抗氧化剂能抑制亚油酸氧化产生过氧化物质,其褪色程度取决于体系中抗氧化物质的活性强弱[17],基于此可通过比色法计算抗氧化物质的总抗氧化能力的大小。啤酒花不同极性部位提取物的总抗氧化能力见图3。
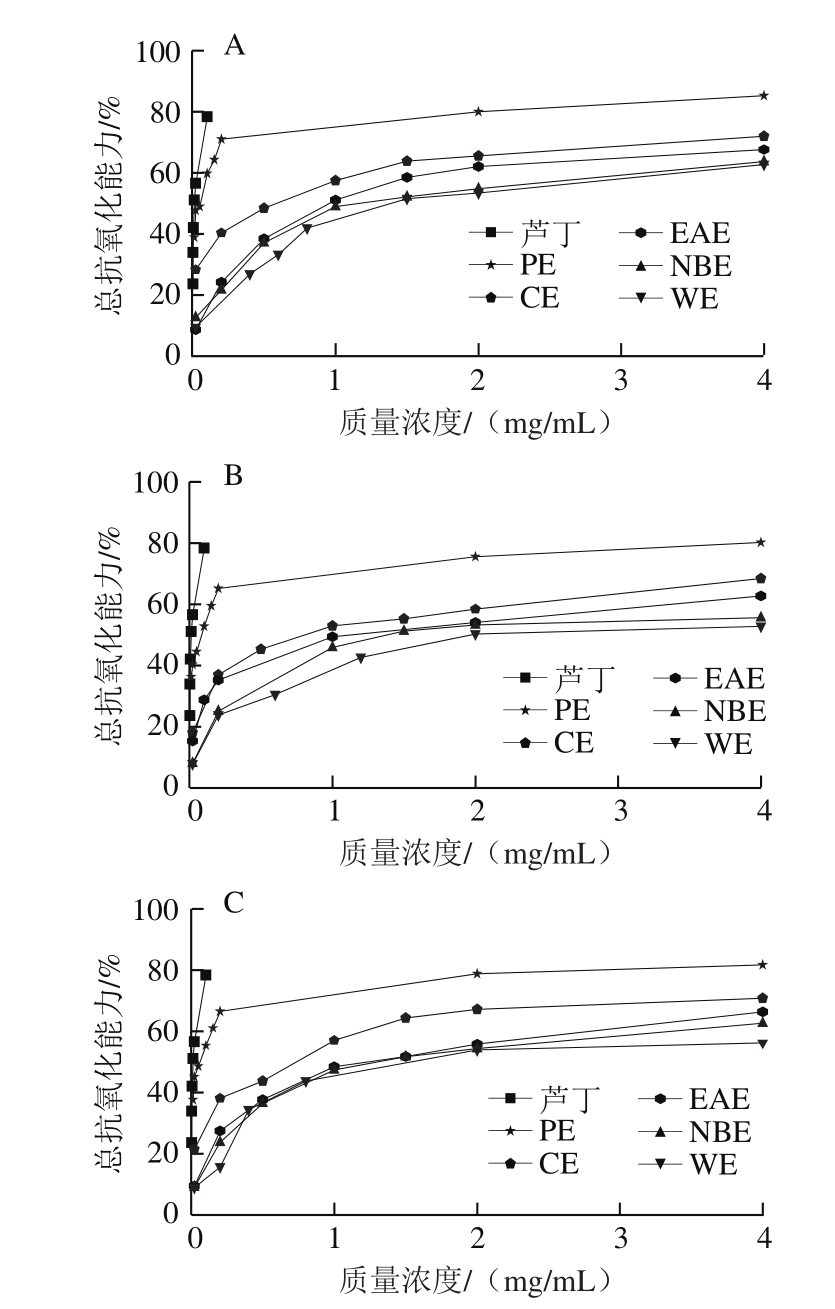
图 3 β-胡萝卜素-亚油酸抗氧化能力
Fig. 3 Total antioxidant activity evaluated by β-carotene-linoleic acid model system assay
由图3可知,啤酒花各极性溶剂提取物均有一定的抗氧化能力,且总抗氧化能力随各溶剂提取物质量浓度的增大而增大,当质量浓度超过2 mg/mL时总抗氧化能力趋于平衡。总抗氧化能力的强弱也可以IC50评价,IC50越小,总抗氧化能力越强。由表2的IC50可知,3 种酒花各极性部位的总抗氧化能力随极性增加而减小,其中PE、CE、EAE的总抗氧化能力由强到弱为1#>2#>3#,NBE、WE的总抗氧化能力为1#>3#>2#,但均低于对照品芦丁(IC50为(0.028 4±0.012 5)mg/mL)。与刘玉梅[22]对质量浓度为2 mg/mL的5 种啤酒花热水、乙醇提取物的总抗氧化能力相比,1#、2#、3#PE、CE的总抗氧化能力高于热水、乙醇提取物,EAE、NBE、WE的总抗氧化能力与乙醇提取物相当,高于热水提取物。
对啤酒花提取物中α-酸、β-酸、黄酮、多酚的含量与其3 种抗氧化体系的IC50进行相关性分析,可系统地评价啤酒花提取物的活性成分与其抗氧化活性的相关性。因α-酸、β-酸仅在PE和CE中存在,所以分别比较了PE和CE中α-酸、β-酸、黄酮、多酚的含量与3 种抗氧化体系的相关性及EAE、NBE、WE中的黄酮、多酚的含量与3 种抗氧化体系的相关性,分别见表3、4。
表 3 PE和CE中α-酸、β-酸、黄酮和多酚的含量与抗氧化活性IC50的相关系数
Table 3 Correlation between IC50 for antioxidant properties and the contents of α-acids, β-acids, phenolics and fl avonoids in PE and CE extracts
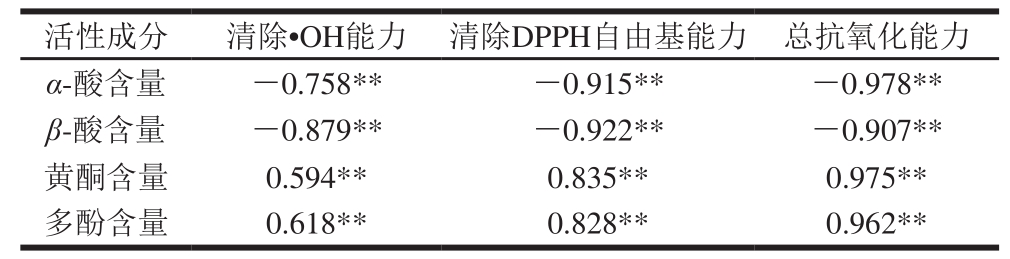
注:**.相关性极显著(P<0.01)。下同。
活性成分 清除·OH能力 清除DPPH自由基能力 总抗氧化能力α-酸含量 -0.758** -0.915** -0.978**β-酸含量 -0.879** -0.922** -0.907**黄酮含量 0.594** 0.835** 0.975**多酚含量 0.618** 0.828** 0.962**
由表3可知,在低极性的PE、CE样品中,α-酸、β-酸含量与3 个体系的抗氧化能力均具有极显著负相关性,其相关系数在-0.758~-0.978之间(P<0.01),说明在极性低的提取物样品中,当提取物质量浓度一定时,样品体系中α-酸、β-酸的浓度越高,其IC50越小,抗氧化活性越强,即α-酸、β-酸是抗氧化的主要贡献者。Liu Yumei等[23]研究了啤酒花α-酸、β-酸及其衍生物的抗氧化活性,结果表明,啤酒花α-酸、β-酸均具有很强的抗氧化活性;赵素华等[24]采用单扫描示波极谱法证明了酒花中的α-酸、β-酸对自由基均有一定程度的清除能力;Ting等[25]的研究也表明,α-酸可形成稳定的运载苯氧自由基的基团,可以抑制氧化反应。上述研究结果均与本研究取得的结果一致,说明啤酒花中的α-酸、β-酸有较强的抗氧化能力。表3的数据还表明,样品中黄酮和多酚含量与上述抗氧化体系IC50呈正相关关系,其相关性系数在0.594~0.975之间(P<0.01),说明样品的抗氧化活性与多酚、黄酮也存在明显的剂量依赖性。
表 4 EAE、NBE、WE中黄酮和多酚含量与抗氧化活性IC50的相关系数
Table 4 Correlation between IC50 for antioxidant properties and the contents of phenolics, fl avonoids in EAE, NBE and WE extracts

活性成分 清除·OH能力 清除DPPH自由基能力 总抗氧化能力黄酮含量 -0.891** -0.729** -0.701**多酚含量 -0.852** -0.683** -0.713**
由表4可知,在极性较大的EAE、NBE、WE样品中,黄酮和多酚含量与·OH、DPPH自由基清除能力和总抗氧化能力的IC50均具有极显著的负相关性,相关系数在-0.683~-0.891之间(P<0.01)。由于极性较大的提取物中没有α-酸、β-酸,说明黄酮、多酚为其主要抗氧化物质。已有文献报道啤酒花中总黄酮、总多酚的含量与其抗氧化活性有很高的相关性,也是其主要的抗氧化物质基础[26-27],这与本实验所得结论一致。研究表明,啤酒花中的多酚黄酮类物质以黄腐酚等查耳酮类物质为主,其次为金合欢素、槲皮素、杨梅素等黄酮及黄酮醇;花旗松素、儿茶酸等的黄烷醇类;山柰酚-O-芸香糖苷、槲皮素-3-O-β-D-吡喃半乳糖苷等黄酮苷;以及鞣花酸、羟基肉桂酸等酚酸类物质[28-29]。上述化合物中多含有酚羟基,酚羟基的氧原子与苯环形成p-π共轭结构,使得苯环上的电子云密度增高,酚羟基的O—H键能减弱,成为极好的氢和电子供体;而邻位酚羟基容易被氧化成半醌式或醌式结构,使自由基链式反应终止,且黄酮和多酚能够还原一些氧化性物质,所以黄酮和多酚具有较强的捕捉自由基的能力和抗氧化活性,黄酮和多酚抗氧化活性的强弱与其含量的高低、结构中取代基的性质和位置(尤其是羟基的取代位置)等均有关[30-32]。
通过比较不同极性部位啤酒花提取物发现,啤酒花中的活性成分α-酸、β-酸主要存在于极性较弱的PE和CE中,且以PE中为主,3 个啤酒花中α-酸和β-酸的含量范围分别为444.29~583.81 mg/g和131.83~293.19 mg/g;黄酮、多酚类物质则在P E中含量最低,仅为0.78~1.19 mg/g和1.24~2.24 mg/g。黄酮、多酚类物质在中等极性的EAE中含量较高,分别为20.43~24.13 mg/g和34.97~40.24 mg/g,在极性较大的NBE中次之,说明啤酒花中的黄酮和多酚主要为中等极性到极性较大的黄酮和黄酮苷类,而极性较弱的氯仿相和极性较大的水相中黄酮和多酚的含量相对较少。抗氧化活性的研究表明,啤酒花中各极性部位的提取物均有抗氧化活性。通过相关性分析表明,在极性较弱的PE和CE中α-酸、β-酸为主要的抗氧化物质,而极性较大的EAE、NBE和WE中黄酮和多酚为抗氧化基础物质。
[1] MANJEET S, MADELEINE A, THOMAS S, et al. Challenges for research on polyphenols from foods in Alzheimer’s disease:bioavailability, metabolism, and cellular and molecular mechanisms[J].Journal of Agricultural and Food Chemistry, 2008, 56(13): 4855-4873.DOI:10.1021/jf0735073.
[2] JIN S W, CHEN G L, DU J J M, et al. Antioxidant properties and principal phenolic compositions of Cynomorium Songaricum Rupr.[J].International Journal of Food Properties, 2013, 17(1): 13-25.DOI:10.1080/10942912.2011.587623.
[3] 方允中, 郑荣梁. 自由基生物学的理论与应用[M]. 北京: 科学出版社, 2002: 634-661.
[4] 章林, 黄明, 周光宏. 天然抗氧化剂在肉制品中的应用研究进展[J].食品科学, 2012, 33(7): 299-302.
[5] 刘玉梅. 啤酒花的化学成分及药理作用研究进展[J]. 食品科学,2009, 30(23): 521-527.
[6] 李玉晶, 刘玉梅. 齐洛克啤酒花品种的挥发性成分分析[J]. 中国酿造,2017, 36(4): 168-173. DOI:10.11882/j.issn.0254-5071.2017.04.035.
[7] MICHAEL D, CHRISTIAN V T, ANDREAS D, et al. The bitter chemodiversity of hops (Humulus lupulus L.)[J]. Journal of Agricultural and Food Chemistry, 2016, 64(41): 7789-7799.DOI: 10.1021/acs.jafc.6b03933.
[8] 李峰, 刘玉梅. 马格努门啤酒花挥发性成分的气相色谱-质谱联用分析[J]. 食品科学, 2012, 33(22): 259-263.
[9] CATHERINE L, GUILLAUME L, SONIA C. Measuring antioxidant ef fi ciency of wort, malt, and hops against the 2,2-azobis(2-amidinopropane) dihydrochloride-induced oxidation of an aqueous dispersion of linoleic acid[J]. Journal of Agricultural and Food Chemistry, 2000, 48(4): 1129-1344. DOI: 10.1021/jf9911242.
[10] MICHAEL D, ANDREAS D, THOMAS H. Sensomics analysis of key bitter compounds in the hard resin of hops (Humulus lupulus L.) and their contribution to the bitter pro fi le of pilsner-type beer[J].Journal of Agricultural and Food Chemistry, 2015, 63(13): 3402-3418.DOI: 10.1021/acs.jafc.5b00239.
[11] 国家质量监督检验检疫总局. 啤酒花制品: GB/T 20369—2006[S].北京: 标准出版社. 2006: 1-11.
[12] 燕雪花, 孙芸, 刘宏炳, 等. 新疆紫穗槐中总黄酮的提取与含量测定[J].光谱实验室, 2012, 29(2): 878-881.
[13] FERAH C O, MEHMET A, SATYAJIT D S. Comparative study of antioxidant properties and total phenolic content of the extracts of Humulus lupulus L. and quanti fi cation of bioactive components by LCMS/MS and GC-MS[J]. Joural of Agricultural and Food Chemistry,2013, 61(44): 10498-10506. DOI: 10.1021/jf4031508.
[14] DUAN X J, ZHANG W W, LI X M, et al. Evaluation of antioxidant property of extract and fractions obtained from a red alga, Polysiphonia urceolata[J]. Food Chemistry, 2006, 95(1): 37-43. DOI:10.1016/j.foodchem.2004.12.015.
[15] 陈利梅, 李德茂, 李燕. 万寿菊黄色素抗氧化特性研究[J]. 食品研究与开发, 2009, 30(12): 26-29.
[16] KAEWPIBOON C, LIRDPRAPAMONGKOL K, SRISOMSAP C,et al. Studies of the in vitro cytotoxic, antioxidant, lipase inhibitory and antimicrobial activities of selected Thai medicinal plants[J]. BMC Complementary and Alternative Medicine, 2012, 12(1): 217-225.DOI: 10.1186/1472-6882-12-217.
[17] 凌关庭. 抗氧化食品与健康[M]. 北京: 化学工业出版社, 2004: 333-334.
[18] 张昊, 任发政. 羟基和超氧自由基的检测研究进展[J].光谱学与光谱分析, 2009, 29(4): 1093-1098. DOI:10.3964/j.issn.1000-0593(2009)04-1093-07.
[19] 白姗姗, 刘博奥, 刘玉梅, 啤酒花废弃枝叶的营养成分及抗氧化活性研究[J]. 酿酒科技, 2016(3): 61-64. DOI:10.13746/j.njkj.2015446.
[20] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food science and Technology, 1995, 28(1): 25-30. DOI:10.1016/s0023-6438(95)80008-5.
[21] 刘莎, 刘玉梅. 啤酒花多酚提取物的抗氧化活性研究[J]. 酿酒科技,2010(10): 19-22. DOI:10.13746/j.njkj.2010.10.029.
[22] 刘玉梅. 啤酒花的分析评价及六氢蛇麻酮类的合成与应用[D]. 无锡: 江南大学, 2007: 49-50.
[23] LIU Yumei, GU Xiaohong, TANG Jian, et al, Antioxidant activities of hops (Humulus lupulus) and their products[J]. Journal of the American Society of Brewing Chemists, 2007, 65(2): 116-121. DOI:10.1094/ASBCJ-2007-0211-01.
[24] 赵素华, 司琴图亚. 黑加仑、榅桲、无花果、桑椹和啤酒花苦味酸及制品抗氧化作用研究[J]. 食品科学, 2002, 23(2): 35-37.
[25] TING P, LUSK L, REFLING J, et al. Identification of antiradical hop compounds[J]. Journal of the American Society of Brewing Chemists,2008, 66(2): 116-126. DOI:10.1094/ASBCJ-2008-0310-01.
[26] MALIAR T, NEMEČEK P, ÜRGEOVÁ E, et al, Secondary metabolites, antioxidant and anti-proteinase activities of methanolic extracts from cones of hop (Humulus lupulus L.) cultivars[J]. Chemical Papers, 2017, 71: 41-48. DOI:10.1007/s11696-016-0034-2.
[27] DE OLIVEIRA NETO J R, DE MACÊDO I Y L, DE OLIVEIRA N R L, et al. Antioxidant capacity and total phenol content in hop and malt commercial samples[J]. Electroanalysis, 2017, 29(12): 2788-2792.DOI:10.1002/elan.201700492.
[28] 张维库, 王守宝, 付骋宇, 等. 啤酒花的黄酮类成分[J]. 中国中药杂志, 2013, 38(10): 1539-1542. DOI:10.4268/cjcmm20131017.
[29] 刘莎. 啤酒花多酚的纯化及抗氧化活性研究[D]. 乌鲁木齐: 新疆大学, 2015: 1-11.
[30] 任红, 郑少杰, 张小利, 等. 基于不同抗氧化机制的黄酮类化合物构效关系研究进展[J]. 食品工业科技, 2016, 37(2): 384-388.DOI:10.13386/j.issn1002-0306.2016.02.070.
[31] LUCRECIA L C, MONICA A N. New method to determine antioxidant activity of polyphenols[J]. Food Chemistry, 2006, 54(22):8397-8402. DOI:10.1021/jf061729f.
[32] 吴丽君. 天然药物化学[M]. 5版. 北京: 人民卫生出版社, 2007: 169-182.
Correlation of Antioxidant Activity with Bioactive Components of Hops
LI Yujing, LIU Yumei. Correlation of antioxidant activity with bioactive components of hops[J]. Food Science, 2019, 40(5):24-30. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20171118-232. http://www.spkx.net.cn