表 1 HPLC洗脱条件
Table 1 HPLC elution conditions

时间/min A相体积分数/% B相体积分数/%0 95 5 5 90 10 6 86 14 31 74 26 35 74 26 38 40 60 41 40 60 43 20 80 48 20 80 50 95 5
山楂(Crataegus pinnatifida Bunge)是我国传统的药食两用资源,其味酸微涩,深受民众喜爱。中医记载其有行气散瘀、消食导滞的功效,其药用的历史已有300多年[1]。现代研究表明,山楂具有降血脂、抗衰老、抗癌等多种药理作用,其显著的抗氧化能力被认为是发挥药理学作用的重要基础[2-4]。曾有学者测定了30 种水果的抗氧化活性,发现山楂抗氧化能力最强,其亚铁离子还原能力为柑橘的7 倍[5]。
山楂的抗氧化活性与其含有的多酚类物质密不可分,相关分析结果表明,山楂鲜果总多酚含量与氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)存在正相关关系,相关系数r=0.886[6]。目前,国内外学者从山楂中分离和鉴定出逾60 种多酚类物质,其中绿原酸、原花青素B2、表儿茶素、金丝桃苷、异槲皮苷等5 种含量较高,是山楂中主要多酚类化合物[7-8]。以往对山楂多酚的研究多关注其含量、构成及生理学活性,关于体内胃肠道环境对其多酚成分及抗氧化活性的影响鲜见报道。然而,多酚在体内各种消化道酶和酸碱环境的作用下其结构、含量及构成可能发生改变,影响其生理活性,不同食品中由于其多酚形态及种类存在差异,导致其在胃肠消化中的变化规律也不相一致,如Bouayed等[9]发现苹果多酚经胃肠作用后,总多酚含量增加,抗氧化活性提高,而Pinacho等[10]的研究结果却显示胃消化对黑刺李多酚含量无显著影响,肠消化后多酚中香豆素类化合物降解了90%以上。目前关于山楂多酚及其抗氧化活性在胃肠道环境下的变化还有待探究。
因此,本研究对山楂进行体外模拟胃肠消化处理,分析消化道环境对山楂总多酚、黄酮含量及抗氧化能力的影响,并利用高效液相色谱(high performance liquid chromatography,HPLC)法测定消化前后山楂中绿原酸、原花青素B2、表儿茶素、金丝桃苷和异槲皮苷5 种主要单体酚类化合物含量的变化,进一步探究胃肠消化中山楂多酚及抗氧化能力变化的物质基础,以期为正确认知和评价山楂对人体的生理学活性提供理论依据。
山楂(Crataegus pinnatifida Bunge)品种为‘大金星’山楂,来源于山东临朐县偏口哥生态农业有限公司。
标准品绿原酸、原花青素B2、表儿茶素、金丝桃苷、异槲皮苷(纯度>98%)、没食子酸、芦丁、水溶性VE(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)、Folin-Ciocalteu试剂、2,2’-偶氮二异丁基脒二盐酸盐(2,2’-azobis(2-methylpropionamidine)dihydrochloride,AAPH)、荧光素钠盐、胃蛋白酶(活力≥250 U/mg)、胰蛋白酶(8 U/mg)、猪胆粉上海源叶生物科技有限公司。
Lab-1B-80真空冷冻干燥机 北京博医康有限公司;LC-20AT HPLC仪 日本岛津公司;MK-3酶标仪美国Thermo Labsystems公司;SRY-1230型恒温水浴摇床、FJ-200高速分速均质机 上海标本模型厂;OSB-2000旋转蒸发仪 埃朗科技国际贸易(上海)有限公司;LYNX4000台式冷冻离心机 德国Eppendorf公司;C18色谱柱 上海安谱实验科技股份有限公司。
1.3.1 山楂粉的制备
取新鲜山楂,洗净、去核,切成1 cm左右厚度,放入-80 ℃冰箱冷冻后冻干,用粉碎机粉碎,过60 目筛,得到鲜山楂粉末,备用。
1.3.2 化学溶剂法提取多酚
1.3.2.1 山楂游离态多酚的提取
参照文献[11]的方法,并稍作修改。准确称取山楂粉2 g,加20 mL正己烷去脂,重复操作3 次。再加入预冷的体积分数80%丙酮溶液,在冰浴下14 000 r/min高速匀浆5 min,4 ℃、12 000 r/min离心10 min,重复提取3 次后,合并上清液。45 ℃旋转蒸干,用去离子水定容至20 mL,即得到山楂的游离态多酚,-20 ℃储存备用。
1.3.2.2 山楂结合态多酚的提取
结合酚的提取采用碱水解法。向提取完游离态多酚的残渣中加入40 mL 2 mol/L的NaOH溶液,充入氮气,避光室温下振荡消化1 h。用12 mol/L HCl溶液调pH值至2.0,加入20 mL正己烷,去脂,重复2 次。加入40 mL乙酸乙酯,混匀,重复提取5 次,合并上清液,45 ℃旋转蒸干,去离子水定容至20 mL,即得到山楂的结合态多酚,-20 ℃储存备用。提取重复3 次。
1.3.3 体外模拟胃、肠消化
1.3.3.1 体外模拟胃消化
参照文献[12]的方法并稍作修改。取3 g山楂粉,加入200 g生理盐水,冰浴下14 000 r/min高速匀浆3 min,制成匀浆液,向匀浆液中补充生理盐水203 g。模拟胃液组:20 g匀浆液水浴至37 ℃后,用1 mol/L HCl溶液调至pH 2.0,再加入4 mL模拟胃液(0.2 g胃蛋白酶溶于5 mL 0.01 mol/L的HCl溶液);胃酸对照组:20 g匀浆液加入4 mL 0.01 mol/L的HCl溶液,调至pH 2.0;空白对照组:20 g匀浆液加入4 mL的生理盐水。避光并充入氮气,在37 ℃恒温水浴摇床中消化2 h。分别于0、0.5、1.0、2.0 h时取样,4 ℃、12 000 r/min离心15 min,取上清液,-80 ℃储存备用。
1.3.3.2 体外模拟肠消化
向经过胃消化2 h后的样品中加入1 mol/L NaHCO3调至pH 7.0,模拟肠液组:加入4 mL模拟肠液(0.2 g胰蛋白酶、1.25 g胆汁提取物溶于50 mL 0.1 mol/L的NaHCO3-Na2CO3缓冲溶液);空白对照组:等体积0.1 mol/L的NaHCO3-Na2CO3缓冲液代替肠液。
1.3.4 多酚、黄酮含量测定
多酚含量的测定采用Folin-Ciocalteu法[13],以没食子酸为标准品,多酚含量表示为100 g山楂中没食子酸的质量。黄酮含量的测定采用硝酸铝显色法[14],以芦丁为标准品,黄酮含量表示为100 g山楂中芦丁的质量。
1.3.5 ORAC测定
ORAC测定参照Prior等[15]的方法并加以改进。在96 孔板中加入20 µL磷酸盐缓冲液(pH 7.4),再加待测山楂提取液或消化液20 µL,接着依次加入AAPH 140 µL(终浓度6 mmol/L)和磷酸盐缓冲液20 µL,最后添加荧光素钠溶液20 µL(终浓度63 nmol/L)启动反应并迅速将酶标板置于荧光酶标仪(预置温度37 ℃)中开始测定。采用动力学方式,每2 min测定一个点,至荧光强度衰减至零为止。另设两个对照组:即没有添加自由基荧光自然衰减对照(记为-AAPH)和没有添加抗氧化剂作用自由基对照(记为+AAPH)。以Trolox为标准品,ORAC以1 g山楂中Trolox的物质的量表示。
1.3.6 HPLC法测定山楂多酚类物质消化前后含量的变化
1.3.6.1 HPLC条件
将1.3.3节中山楂模拟胃、肠消化液用0.22 µm滤膜过滤,进样,分析山楂消化前后多酚类物质含量变化情况。HPLC梯度洗脱条件如表1所示。液相色谱柱:CNWSIL C18(250 mm×4.6 mm,5 µm),流动相:流动相A为一级水(含体积分数0.1%甲酸)、流动相B为乙腈(含体积分数0.1%甲酸),紫外检测波长:280 nm,流动相流速:1 mL/min,柱温:30 ℃,进样量:10 µL。
表 1 HPLC洗脱条件
Table 1 HPLC elution conditions

时间/min A相体积分数/% B相体积分数/%0 95 5 5 90 10 6 86 14 31 74 26 35 74 26 38 40 60 41 40 60 43 20 80 48 20 80 50 95 5
1.3.6.2 标准溶液的配制
精确称取0.5 mg的绿原酸、原花青素B2、表儿茶素、金丝桃苷、异槲皮苷标准品溶于1 mL甲醇中,配成混合标准储备液,再用甲醇依次稀释成不同质量浓度的标准系列溶液。
1.3.6.3 标准曲线的绘制
取1.3.6.2节中的标准系列溶液过0.22 µm的滤膜,按1.3.6.1节的色谱条件进行分析。以样品质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线,以峰面积外标法进行定量。线性关系如表2所示。
表 2 标准品测定的标准曲线回归方程
Table 2 Linear regression equations for fi ve phenolic standards
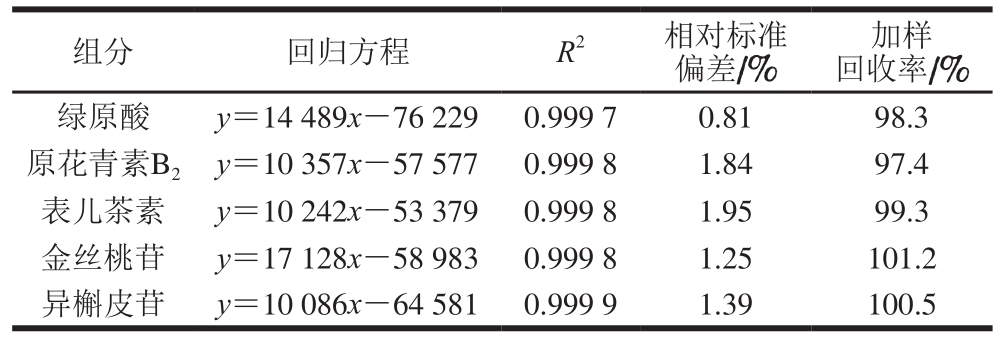
组分 回归方程 R2 相对标准偏差/%加样回收率/%绿原酸 y=14 489x-76 229 0.999 7 0.81 98.3原花青素B2 y=10 357x-57 577 0.999 8 1.84 97.4表儿茶素 y=10 242x-53 379 0.999 8 1.95 99.3金丝桃苷 y=17 128x-58 983 0.999 8 1.25 101.2异槲皮苷 y=10 086x-64 581 0.999 9 1.39 100.5
采用SPSS 21.0软件分析实验数据,Origin 8.5软件作图,结果用 ±s表示。数据差异性采用单因素方差分析中的最小显著差异法,P<0.05表示差异具有显著统计学意义。实验均重复3 次。
±s表示。数据差异性采用单因素方差分析中的最小显著差异法,P<0.05表示差异具有显著统计学意义。实验均重复3 次。
食品中的多酚根据其存在形态可分为游离态和结合态多酚,其中游离态多酚易溶于水或有机溶剂,而结合态多酚因与食品基质紧密结合,则需要通过酸、碱或酶水解才能释放出来[16]。本研究采用体积分数80%的丙酮溶液,在冰浴高速匀浆条件下进行山楂游离态多酚的提取,剩余山楂残渣经碱水解后再采用乙酸乙酯进行萃取得到山楂结合酚。
表 3 山楂中多酚、黄酮含量及ORAC
Table 3 Contents of polyphenols and fl avonoids and oxygen radical absorbance capacity of hawthorn

指标 游离态 结合态 总量多酚含量/(mg/100 g) 3 124.96±41.98 32.95±0.92 3 157.91±42.83黄酮含量/(mg /100 g) 1 760.56±79.03 25.16±0.33 1 785.72±79.35 ORAC/(µmol/g) 1 175.57±10.92 76.65±1.81 1 252.21±9.76
如表3所示,山楂中游离酚和结合酚的含量分别为(3 124.96±41.98)mg/100 g和(32.95±0.92)mg/100 g,游离黄酮和结合黄酮的含量分别为(1 760.56±79.03)mg/100 g和(25.16±0.33)mg/100 g,由此可看出,山楂中多酚的构成以游离酚、游离黄酮为主。研究发现,不同类
型食品中的多酚形态及含量存在显著差异[17],通常,小麦、玉米等粮谷类食品中的多酚主要以结合态的形式存在[11],而在大多数水果中则游离酚含量显著高于结合酚含量[18-19],本研究山楂多酚的测定结果与以往水果多酚的研究结果一致。山楂多酚的ORAC测定结果显示,样品抗氧化能力与多酚含量成正比,其中游离酚的ORAC明显高于结合酚ORAC,占总ORAC的93%,说明山楂游离酚是其抗氧化能力的主要贡献者。
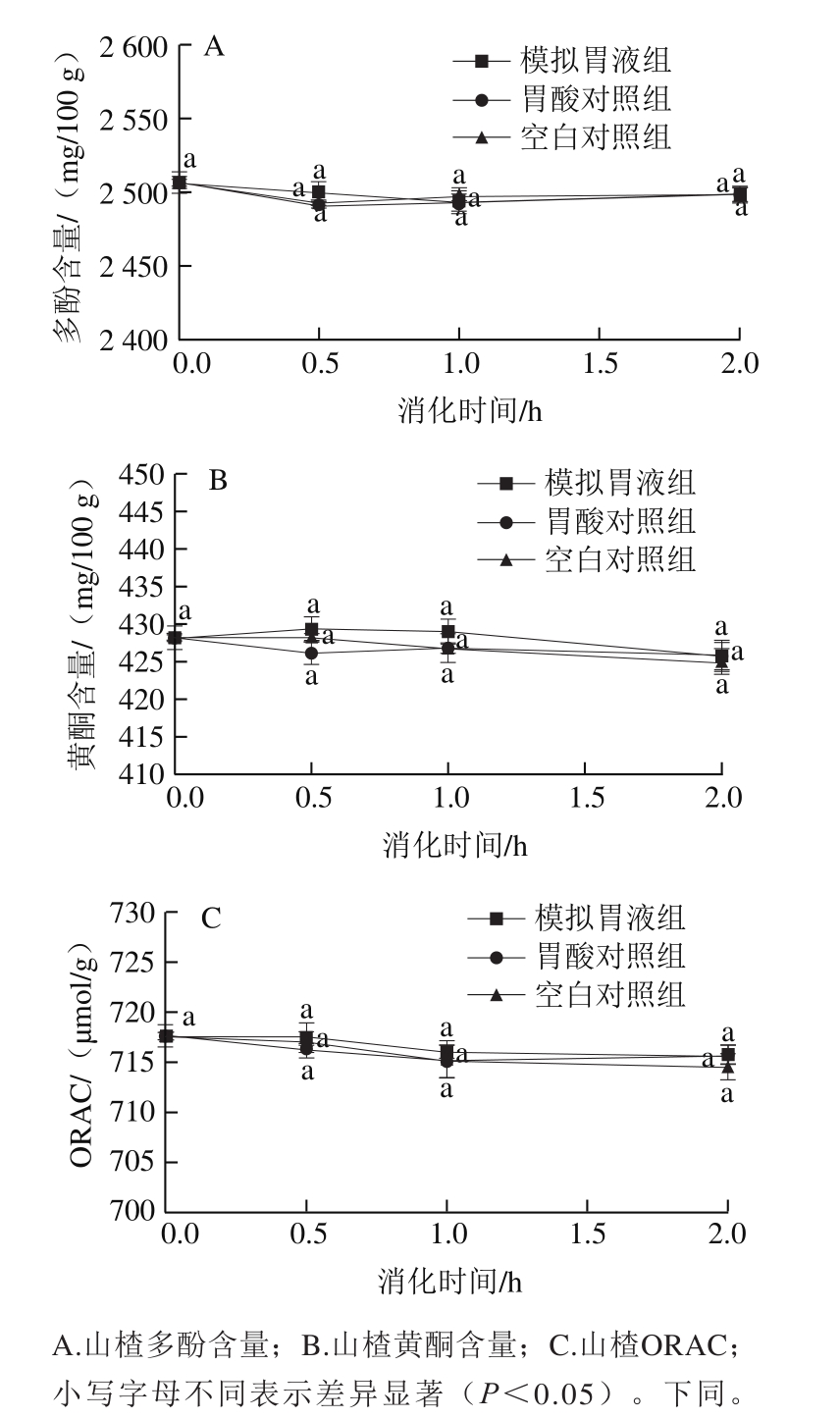
图 1 山楂模拟胃消化过程中多酚、黄酮含量及ORAC的变化
Fig. 1 Changes in total polyphenol and fl avonoid contents and oxygen radical absorbance capacity of hawthorn during gastric digestion
如图1所示,模拟胃液组、胃酸对照组和空白对照组之间的多酚、黄酮含量及ORAC无显著性差异(P>0.05),不同时间点之间也无显著性变化(P>0.05),说明胃蛋白酶和胃酸环境对山楂中多酚、黄酮的释放或降解及抗氧化活性均无显著性影响。这与黑刺李[10]、野樱莓[20]多酚在胃消化过程中的变化规律一致,可能是由于黑刺李、野樱莓与山楂同属蔷薇科,富含有机酸,其多酚类物质都以酚酸类(绿原酸、原儿茶酸、咖啡酸等)和原花青素类低聚、高聚物为主,这些多酚在以往研究中已被证实在酸性条件下性质较稳定,且pH值越低稳定性越好[21-22];因此胃液中的强酸环境对山楂多酚影响较小,同时其抗氧化活性也无显著性变化。

图 2 山楂模拟肠消化过程中多酚、黄酮含量及ORAC的变化
Fig. 2 Changes in total polyphenol and fl avonoid contents and oxygen radical absorbance capacity of hawthorn during intestinal digestion
如图2所示,在体外模拟肠消化中,模拟肠液组的多酚、黄酮含量及ORAC均显著高于空白对照组(P<0.05),推测这是因为肠液组中加入的胰酶和胆汁水解了多酚与细胞内外蛋白质结合形成的共价键、氢键等[23-24],促进了山楂中多酚、黄酮等抗氧化活性物质的释放。与0 h(肠)相比,模拟肠液组山楂多酚、黄酮含量在0.5 h内分别下降了16.26%和7.46%,空白对照组分别下降了32.58%和10.29%,0.5 h后趋于稳定(P>0.05)。肠消化过程中多酚、黄酮含量显著下降的原因可能是山楂多酚类化合物分子结构中多具有酚羟基,偏酸性,在碱性环境中不稳定,易发生降解生成其他物质[25]。其次,2.1节对山楂多酚形态的研究结果表明,山楂中以游离酚为主,在肠道碱性环境下山楂游离酚大量降解,其降解量大于多酚释放量;因此肠道中山楂多酚、黄酮含量总体仍表现为下降。
肠道环境中,山楂抗氧化能力随着多酚、黄酮含量的下降而降低,模拟肠液组和空白对照组的ORAC在0.5 h内分别从714.52 µmol/g下降到641.29 µmol/g和632.06 µmol/g,相应降低10.25%和11.54%;1 h时分别继续下降到632.06 µmol/g和610.06 µmol/g,1 h后无显著性变化(P>0.05)。结合图1、2可发现,在胃肠消化中山楂抗氧化活性与多酚、黄酮含量的变化规律相似,进一步说明多酚类化合物是山楂抗氧化能力的基础。
为进一步探究和明确在胃肠道环境下山楂多酚中具体成分的变化,本研究结合文献[1]的报道,选取了绿原酸、原花青素B2、表儿茶素、金丝桃苷、异槲皮苷等5 种山楂中含量较高的单体酚类化合物作为代表,研究其在胃肠道消化过程中的变化情况。图3为混合标准品及胃、肠消化0.5 h的HPLC图。
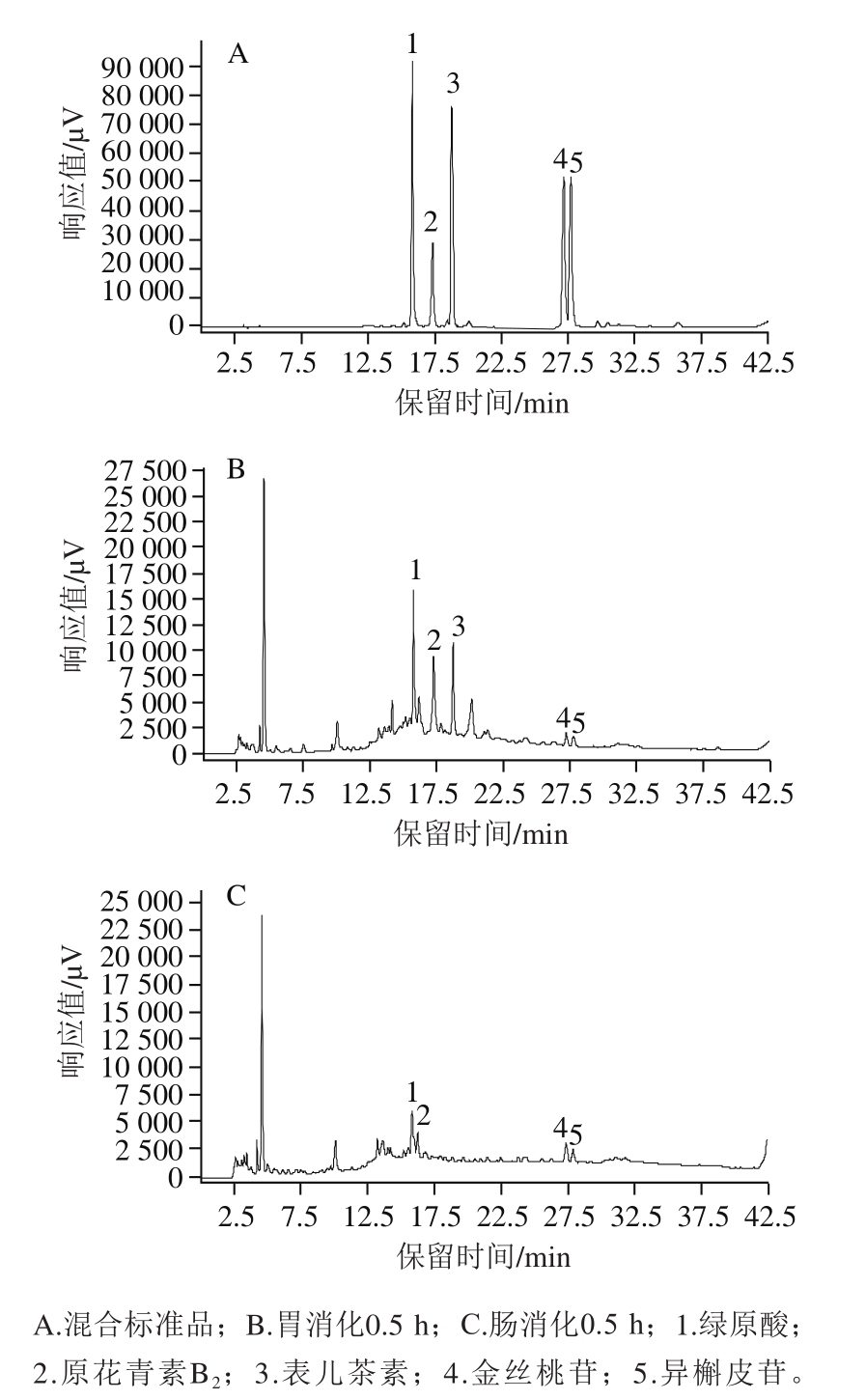
图 3 混合标准品、胃肠消化0.5 h山楂样品的HPLC图
Fig. 3 HPLC chromatograms of mixed standards and hawthorn subjected to 0.5 h of simulated gastrointestinal digestion
如表4所示,在模拟胃消化中,各单体酚类化合物含量在不同时间点无显著性差异(P>0.05),说明胃消化对山楂中单体酚无显著影响。
表 4 胃消化后山楂中酚类单体含量变化
Table 4 Changes in contents of individual polyphenols after gastric digestion mg/g

注:同行肩标小写字母不同表示差异显著(P<0.05)。下同。
酚类单体 消化时间/h 0 0.5 1.0 2.0绿原酸 1.06±0.01a 1.03±0.05a 1.04±0.01a 1.04±0.02a原花青素B2 0.70±0.01a 0.69±0.01a 0.70±0.03a 0.70±0.01a表儿茶素 0.99±0.06a 0.97±0.02a 0.96±0.04a 0.97±0.02a金丝桃苷 0.29±0.05a 0.29±0.01a 0.28±0.02a 0.29±0.01a异槲皮苷 0.43±0.02a 0.43±0.03a 0.43±0.02a 0.43±0.01a
表 5 肠消化后山楂中酚类单体含量变化
Table 5 Changes in contents of individual polyphenols after intestinal digestion mg/g

注:ND.未检测到。
0.5 1.0 2.0绿原酸 1.03±0.02a 0.61±0.01b 0.47±0.03c 0.47±0.01c原花青素B2 0.69±0.01a0.47±0.00b ND ND表儿茶素 0.98±0.06a ND ND ND金丝桃苷 0.29±0.02a 0.29±0.01a 0.29±0.01a 0.29±0.02a异槲皮苷 0.43±0.04a 0.42±0.01a 0.43±0.01a 0.43±0.03a酚类单体 消化时间/h 0
如表5所示,肠消化中山楂不同单体酚类化合物的含量变化规律不一致。金丝桃苷、异槲皮苷两者的含量无显著性变化(P>0.05),但表儿茶素、原花青素B2和绿原酸含量则均发生显著下降,其中表儿茶素降幅最大,在0.5 h内完全降解;原花青素B2次之,在0.5 h内降低了28.99%,1 h时已无法检测到;绿原酸在0.5 h内下降了40.78%,1 h较0.5 h继续降低22.95%,1 h后无显著性变化(P>0.05)。
由以上结果可知,金丝桃苷、异槲皮苷在胃肠消化中均较稳定,这可能是因为金丝桃苷和异槲皮苷互为同分异构体,在植物体内通常以糖苷键与糖基结合成苷类的形式存在,稳定性较强,在胃肠环境下不易分解[26]。
原花青素B2是表儿茶素的二聚体,但目前关于这两者在胃肠消化中变化规律的研究结果却各有不同。盛华刚等[27]发现金荞麦多酚中原花青素B2和表儿茶素经胃消化后含量均明显增加,而Kahle等[28]关于苹果多酚的研究结果却显示原花青素B2在胃消化中含量下降,表儿茶素含量增加,这是原花青素B2在胃液中降解成表儿茶素所致。Kahle等[28]的研究同时还发现表儿茶素在肠液中会进一步异构化生成儿茶素,而在Bouayed[29]和Zhu Qinyan[30]等的研究中却发现肠环境中,原花青素B2含量下降,表儿茶素和儿茶素含量却没有相应增加,据此他们认为原花青素B2在肠液中并未分解成表儿茶素,表儿茶素也未转化成儿茶素,而是可能生成了其他化合物。各项研究结果不一致的原因可能与不同食品中多酚构成、性质存在差异有关;此外,多酚之间可能存在的相互作用也是导致胃肠道消化对其影响不同的原因之一。本研究中,原花青素B2和表儿茶素在胃消化后含量并未发现显著变化(P>0.05),在肠消化过程中含量却均显著降低(P<0.05),说明肠道环境下,两者发生了降解,但具体的降解途径和降解产物还有待进一步确认。
绿原酸是由咖啡酸和奎宁酸缩合形成的酚酸,因此在偏酸性的胃环境中较稳定。但其分子结构中含有酯键和不饱和双键等不稳定部分,易被碱水解或分子内酯基迁移异构化生成同分异构体新绿原酸和隐绿原酸[31],故绿原酸在肠液中含量降低。
山楂中以游离酚为主,结合酚含量较低。山楂多酚在模拟胃消化中较稳定,其总多酚、黄酮含量及抗氧化活性均无显著性变化,而在肠消化中,山楂多酚不稳定,发生降解,0.5 h时肠液组总多酚、黄酮含量均显著降低,分别降低了16.26%和7.46%,抗氧化能力下降了10.25%,抗氧化能力下降与多酚含量降低成正比。进一步分析单体酚类化合物在胃肠消化中含量的变化规律发现,5 种单体酚在胃消化中含量均无显著性变化,在肠消化中变化却不相一致;其中金丝桃苷、异槲皮苷较稳定,含量无显著性变化(P>0.05),而表儿茶素在0.5 h内完全降解,原花青素B2、绿原酸在0.5 h内则分别下降了28.99%和40.78%。综上,经胃肠道消化后,山楂总多酚含量下降,伴随抗氧化能力显著下降;不同多酚单体因其自身性质差异在胃肠道环境表现出不同的稳定性,其降解途径、代谢产物及各多酚之间是否存在相互作用值得进一步探究。
[1] LIU P, KALLIO H, LÜ D, et al. Quantitative analysis of phenolic compounds in Chinese hawthorn (Crataegus spp.) fruits by high performance liquid chromatography-electrospray ionisation mass spectrometry[J]. Food Chemistry, 2011, 127(3): 1370-1377.DOI:10.1016/j.foodchem.2011.01.103.
[2] LUO Y C, CHEN G, LI B, et al. Evaluation of antioxidative and hypolipidemic properties of a novel functional diet formulation of Auricularia auricula and hawthorn[J]. Innovative Food Science and Emerging Technologies, 2009, 10(2): 215-221. DOI:10.1016/j.ifset.2008.06.004.
[3] 王轶菲, 陈纯, 王红, 等. 山楂提取物延缓秀丽隐杆线虫衰老作用的研究[J]. 营养学报, 2016, 4(27): 391-396. DOI:10.13325/j.cnki.acta.nutr.sin.2016.04.027.
[4] WU P P, LI F J, ZHANG J Y, et al. Phytochemical compositions of extract from peel of hawthorn fruit, and its antioxidant capacity, cell growth inhibition, and acetylcholinesterase inhibitory activity[J].BMC Complementary and Alternative Medicine, 2017, 17(1): 1-7.DOI:10.1186/s12906-017-1662-y.
[5] 郭长江, 韦京豫, 杨继军, 等. 66 种蔬菜、水果抗氧化活性的比较研究[J]. 营养学报, 2003, 25(2): 203-207. DOI:10.13325/j.cnki.acta.nutr.sin.2003.02.031.
[6] 徐维盛, 马姗媫, 毕烨, 等. 七个不同产地山楂的营养成分分析和抗氧化能力评价[J]. 营养学报, 2014, 36(3): 282-287. DOI:10.13325/j.cnki.acta.nutr.sin.2014.03.017.
[7] MRAIHI F, HIDALGO M, DE PASCUAL-TERESA S, et al. Wild grown red and yellow hawthorn fruits from Tunisia as source of antioxidants[J]. Arabian Journal of Chemistry, 2015, 8(4): 570-578.DOI:10.1016/j.arabjc.2014.11.045.
[8] LIU P Z, YANG B R, KALLIO H. Characterization of phenolic compounds in Chinese hawthorn (Crataegus pinnatifida Bge. var.major) fruit by high performance liquid chromatography-electrospray ionization mass spectrometry[J]. Food Chemistry, 2010, 121(4): 1188-1197. DOI:10.1016/j.foodchem.2010.02.002.
[9] BOUAYED J, HOFFMANN L, BOHN T. Total phenolics, fl avonoids,anthocyanins and antioxidant activity following simulated gastrointestinal digestion and dialysis of apple varieties: bioaccessibility and potential uptake[J]. Food Chemistry, 2011, 128(1): 14-21.DOI:10.1016/j.foodchem.2011.02.052.
[10] PINACHO R, CAVERO R Y, ASTIASARÁN I, et al. Phenolic compounds of blackthorn (Prunus spinosa L.) and influence of in vitro digestion on their antioxidant capacity[J]. Journal of Functional Foods,2015, 19: 49-62. DOI:10.1016/j.jff.2015.09.015.
[11] OKARTER N, LIU C S, SORRELLS M E, et al. Phytochemical content and antioxidant activity of six diverse varieties of whole wheat[J]. Food Chemistry, 2010, 119(1): 249-257. DOI:10.1016/j.foodchem.2009.06.021.
[12] TAGLIAZUCCHI D, VERZELLONI E, BERTOLINI D, et al.In vitro bio-accessibility and antioxidant activity of grape polyphenols[J]. Food Chemistry, 2010, 120(2): 599-606. DOI:10.1016/j.foodchem.2009.10.030.
[13] LIN X, ZHOU L, LI T, et al. Phenolic content, antioxidant and antiproliferative activities of six varieties of white sesame seeds(Sesamum indicum L.)[J]. RSC Advances, 2017, 7(10): 5751-5758.DOI:10.1039/c6ra26596k.
[14] 黎海彬. 山楂中有效成分含量测定的研究[J]. 食品科学, 2008,29(8): 475-477.
[15] PRIOR R L, HOANG H, GU L W, et al. Assays for hydrophilic and lipophilic antioxidant capacity (oxygen radical absorbance capacity(ORACFL)) of plasma and other biological and food samples[J].Journal of Agricultural and Food Chemistry, 2003, 51(11): 3273-3279.DOI:10.1039/c6ra26596k.
[16] 颜才植, 叶发银, 赵国华. 食品中多酚形态的研究进展[J]. 食品科学,2015, 36(15): 249-254. DOI:10.7506/spkx1002-6630-201515046.
[17] CHU Y F, SUN J, WU X Z, et al. Antioxidant and antiproliferative activities of common fruits[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25): 7449-7454. DOI:10.1021/jf0207530.
[18] IMEH U, KHOKHAR S. Distribution of conjugated and free phenols in fruits: antioxidant activity and cultivar variations[J]. Journal of Agricultural and Food Chemistry, 2002, 50(22): 6301-6306.DOI:10.1021/jf020342j.
[19] WANG H, GUO X, HU X, et al. Comparison of phytochemical profiles, antioxidant and cellular antioxidant activities of different varieties of blueberry (Vaccinium spp.)[J]. Food Chemistry, 2017, 217:773-781. DOI:10.1016/j.foodchem.2016.09.002.
[20] BERMÚDEZ-SOTO M J, TOMÁS-BARBERÁN F A, GARCÍACONESA M T. Stability of polyphenols in chokeberry (Aronia melanocarpa) subjected to in vitro gastric and pancreatic digestion[J]. Food Chemistry, 2007, 102(3): 865-874. DOI:10.1016/j.foodchem.2006.06.025.
[21] FRIEDMAN M, JÜRGENS H S. Effect of pH on the stability of plant phenolic compounds[J]. Journal of Agricultural and Food Chemistry,2000, 48(6): 2101-2110. DOI:10.1021/jf990489j.
[22] 张泽生, 高薇薇, 张颖, 等. 山楂果原花青素稳定性研究[J].食品工业科技, 2010, 31(8): 108-112. DOI:10.13386/j.issn1002-0306.2010.08.032.
[23] 贾娜, 刘丹, 谢振峰. 植物多酚与食品蛋白质的相互作用[J]. 食品与发酵工业, 2016, 7(45): 277-282. DOI:10.13995/j.cnki.11-1802/ts.201607045.
[24] LAURENT C, BESANÇON P, CAPORICCIO B. Flavonoids from a grape seed extract interact with digestive secretions and intestinal cells as assessed in an in vitro digestion/Caco-2 cell culture model[J]. Food Chemistry, 2007, 100(4): 1704-1712. DOI:10.1016/j.foodchem.2005.10.016.
[25] SVEDSTRÖM U, VUORELA H, KOSTIAINEN R, et al.Fractionation of polyphenols in hawthorn into polymeric procyanidins,phenolic acids and flavonoids prior to high-performance liquid chromatographic analysis[J]. Journal of Chromatography A, 2006,1112(1): 103-111. DOI:10.1016/j.chroma.2005.12.080.
[26] CRETU R, MIHAILESCU R, MITROI G, et al. Phytochemical investigation of Crataegi folium cum flos (hawthorn leaves and fl owers) and Hyperici herba (st johns wort aerial parts) hydroalcoholic extracts[J]. Analele Ştiinţifice Ale Universităţii Alexandru Ioan Cuza din Iași, Sectiunea II A : Genetica si Biologie Moleculara, 2011, 12(4):133-138.
[27] 盛华刚, 朱立俏, 张津萌. 金荞麦中原花青素B2和表儿茶素在人工胃肠液中的含量变化[J]. 中国实验方剂学杂志, 2014, 20(4): 77-80.
[28] KAHLE K, KEMPF M, SCHREIER P, et al. Intestinal transit and systemic metabolism of apple polyphenols[J]. European Journal of Nutrition, 2011, 50(7): 507-522. DOI:10.1007/s00394-010-0157-0.
[29] BOUAYED J, DEUßER H, HOFFMANN L, et al. Bioaccessible and dialysable polyphenols in selected apple varieties following in vitro digestion vs. their native patterns[J]. Food Chemistry, 2012, 131(4):1466-1472. DOI:10.1016/j.foodchem.2011.10.030.
[30] ZHU Qinyan, HOLT R R, LAZARUS S A, et al. Stability of the fl avan-3-ols epicatechin and catechin and related dimeric procyanidins derived from cocoa[J]. Journal of Agricultural and Food Chemistry,2002, 50(6): 1700-1705. DOI:10.1021/jf011228o.
[31] LÓPEZ-NICOLÁS R, GONZÁLEZ-BERMÚDEZ C A, ROSBERRUEZO G, et al. Influence of in vitro gastrointestinal digestion of fruit juices enriched with pine bark extract on intestinal microflora[J]. Food Chemistry, 2014, 157: 14-19. DOI:10.1016/j.foodchem.2014.01.126.
Changes in Polyphenol Contents and Antioxidant Activity in Hawthorn (Crataegus pinnatifida Bunge)during Simulated Gastrointestinal Digestion
CHEN Ximiao, LI Meiying, XU Qiuli, et al. Changes in polyphenol contents and antioxidant activity in hawthorn (Crataegus pinnatifida Bunge) during simulated gastrointestinal digestion[J]. Food Science, 2019, 40(5): 31-37. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20170930-447. http://www.spkx.net.cn