微波辅助快速制备碳量子点及其对表没食子儿茶素-3-没食子酸酯的促氧化作用
吴春莲,蒲洪彬,曲佳欢,孙大文,韦庆益*
(华南理工大学食品科学与工程学院,现代食品工程研究中心,广东省冷链食品智能感知与过程控制工程技术研究中心,广东 广州 510006)
摘 要:利用高通量微波消解/萃取工作站快速制备水溶性碳量子点,研究碳量子点的pH值依赖性和稳定性,探讨表没食子儿茶素-3-没食子酸酯(epigallocatechin-3-gallate,EGCG)在Cu2+存在条件下产生的活性氧自由基对碳量子点荧光探针的猝灭作用及EGCG与Cu2+的促氧化剂量-效应关系。结果表明:碳量子点具有pH值依赖性和良好的稳定性,相对量子产率为73.67%;Cu2+与EGCG的浓度比达到2∶1时,碳量子点荧光探针的猝灭更严重,EGCG的促氧化效果更好。该研究可为EGCG作为功能性物质的应用提供理论依据。
关键词:碳量子点荧光探针;表没食子儿茶素-3-没食子酸酯;促氧化作用;剂量-效应关系
碳量子点(carbon quantum dots,CQDs)是一种粒径小于10 nm、微观近乎准球形、表面富含有机官能团、具有荧光性能的新型碳纳米材料。由于CQDs具有环保、低成本、易制备和良好的生物相容性、光学稳定性等优点[1],其在生物成像、生物传感、催化、纳米医学、检测等方面显示了巨大的应用潜能。有研究表明,活性氧(reactive oxidative species,ROS)自由基特别是羟自由基(·OH)是很强的氧化剂,如果体系中产生·OH,CQDs表面的结构会发生改变,其荧光会被猝灭[2]。CQDs的合成方法分为top-down和bottom-up两大类[1]。Top-down方法是指CQDs由较大的碳结构材料形成或剥离形成,包括电弧切割法、激光消融法、电化学法和氧化法等。Bottom-up方法是指由分子前驱物形成CQDs,主要包括煅烧或加热法、微波合成法、载体合成法以及水热合成法等。经过10多年的研究和发展,CQDs的合成技术趋向于成熟,材料的使用也越来越简单和绿色。最近,利用微波辅助水热合成法制备CQDs的研究层出不穷,但是这些研究中所使用的微波设备都是家用微波炉,存在着一定的安全隐患和制备条件不可控等缺点[3]。
表没食子儿茶素-3-没食子酸酯(epigallocatechin-3-gallate,EGCG)是茶叶中儿茶素类化合物的主要成分,占绿茶中儿茶素总量的50%~75%[4],具有抗氧化、抗肿瘤、抗动脉硬化、抗菌、抗炎症、预防癌症、预防心脑血管疾病等多种生物活性[4-7],深受医学、营养学学科国内外研究者的广泛关注。许多研究者认为EGCG分子含有多个酚羟基的特殊分子结构,具有良好的抗氧化活性,能够清除自由基、减少活跃金属离子的破坏作用、激活某些酶及相关的活性因子,在生物机体中具有重要的作用。但是,也有研究表明,EGCG不仅具有抗氧化作用,在一定的条件下还表现出促氧化活性,比如其在金属离子(Cu2+、Fe3+)催化下易被转化成反应活性较高的醌式中间体,体系中还伴随着H2O2、·OH、超氧阴离子自由基( ·)等ROS的产生[8-9],这些ROS自由基对癌细胞具有很好的杀伤作用,同时还能够对生物分子进行共价修饰,表现出一定的生物毒性[10-12]。但是细胞内的超氧化物歧化酶、过氧化氢酶等会对过量的自由基进行清理,使细胞中的自由基处于动态平衡状态[13]。然而,不同的细胞类型所含有的过渡金属离子浓度是不同的,已有研究报道恶性肿瘤细胞中的Cu2+浓度会高于正常细胞[14]。因此,很多研究者认为EGCG的抗肿瘤作用是通过促氧化作用机制产生的[9]。但在EGCG的促氧化作用过程中,EGCG和Cu2+的剂量-效应关系至今少有研究。
·)等ROS的产生[8-9],这些ROS自由基对癌细胞具有很好的杀伤作用,同时还能够对生物分子进行共价修饰,表现出一定的生物毒性[10-12]。但是细胞内的超氧化物歧化酶、过氧化氢酶等会对过量的自由基进行清理,使细胞中的自由基处于动态平衡状态[13]。然而,不同的细胞类型所含有的过渡金属离子浓度是不同的,已有研究报道恶性肿瘤细胞中的Cu2+浓度会高于正常细胞[14]。因此,很多研究者认为EGCG的抗肿瘤作用是通过促氧化作用机制产生的[9]。但在EGCG的促氧化作用过程中,EGCG和Cu2+的剂量-效应关系至今少有研究。
本研究通过高通量微波消解/萃取工作站制备CQDs,并以此为探针研究EGCG与Cu2+之间的促氧化作用及其剂量-效应关系,以期为EGCG的功能性应用提供理论依据。
1 材料与方法
1.1 材料与试剂
EGCG(分析纯) Sigma-Aldrich(上海)试剂有限公司;H2SO4、NaOH、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)(分析纯) 广州精科生物有限公司;二甲基亚矾(dimethyl sulfoxide,DMSO)(分析纯) 阿拉丁(上海)试剂有限公司;MD 31 mm透析袋(截留分子质量100~500 Da) 上海源叶生物科技有限公司;实验用水为实验室制备的超纯水。
1.2 仪器与设备
JUPITER-B型高通量微波消解/萃取工作站 上海新仪微波化学科技有限公司;RF-6000型荧光分光光度计、UV-1800型紫外-可见分光光度计 日本岛津公司;Tensor 27型傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 德国Bruker公司;JEM-1400 Plus型透射电子显微镜(transmission electron microscopy,TEM) 日本JEOL公司。
1.3 方法
1.3.1 CQDs的制备和相对量子产率的测定
CQDs的制备参考文献[15]的方法并稍作调整,采用微波辅助法。将2 g一水合柠檬酸和0.954 mL乙二胺充分溶解在20 mL超纯水中,充分搅拌混匀后转移到100 mL聚四氟乙烯反应釜中,在200 ℃、500 W下反应5 min。反应结束后自然冷却至室温。用0.22 μm微孔滤膜将反应液过滤,将滤液用截留分子质量100~500 Da的透析袋透析24 h后放置于棕色瓶中,于4 ℃冰箱中保存备用。
参照文献[16]的方法测定CQDs的相对量子产率(quantum yields,QYs),测得所制备好的CQDs的相对量子产率为73.67%。具体方法如下:将硫酸奎宁溶解于配制好的0.1 mol/L硫酸溶液中,调节硫酸奎宁溶液和CQDs水溶液的浓度,使硫酸奎宁溶液和CQDs水溶液分别在360 nm和350 nm波长处的吸光度均小于0.1。配制该吸光度下的待测试样,用荧光分光光度计分别测定该硫酸奎宁溶液和CQDs水溶液在360 nm和350 nm激发波长处的发射光谱,根据荧光光谱计算荧光峰面积,即积分荧光强度。硫酸奎宁在360 nm激发波长处的量子点产率为54%。根据公式(1)计算CQDs的相对量子产率。
式中:QYs和QYst分别表示CQDs和硫酸奎宁的相对量子产率/%;Is和Ist分别表示CQDs和硫酸奎宁的荧光积分面积;As和Ast分别表示CQDs和硫酸奎宁的吸光度;ηs表示CQDs溶剂(水)的折射率(1.33);ηst表示硫酸奎宁溶剂(硫酸)的折射率(1.33)[16]。
1.3.2 CQDs的表征
利用Nanomeasure软件测定CQDs的粒径;采用UV-1800型紫外-可见分光光度计扫描CQDs的吸收光谱;采用RF-6000型荧光分光光度计测定CQDs的激发光谱和发射光谱,激发波长350 nm、发射波长440 nm、狭缝宽度3 nm;采用JEM-1400 Plus型TEM观察CQDs的形貌和粒径;采用Tensor 27型FTIR仪分析CQDs的表面基团:将适量冷冻干燥CQDs粉末加入到适量KBr粉末中,在玛瑙研钵中充分碾磨,混合均匀后压片制样测定,扫描范围4 000~500 cm-1。
1.3.3 CQDs的性质测定
1.3.3.1 pH值对CQDs发光性能的影响
不同pH值(pH 2、3、4、5、6、7、8、9、10、11)的CQDs溶液均用0.1 mol/L H2SO4和0.1 mol/L NaOH溶液调节,并用pH计测定,室温下用荧光分光光度计在350 nm激发波长处测其荧光强度,观察其荧光强度的变化。
1.3.3.2 贮藏条件对CQDs发光性能的影响
将CQDs原液和稀释105 倍体积的CQDs溶液各分为3 份,每份5 mL,设置3 个平行,分别在-4 ℃冰箱内避光、常温下避光、常温下不避光的环境下放置不同时间(0、1、8、15、23、30 d)。测定时将CQDs原液稀释105 倍体积后,室温下用荧光分光光度计在350 nm激发波长处测相应放置时间CQDs的荧光强度,稀释后的CQDs溶液在室温下直接测定,观察其荧光强度的变化。
1.3.4 不同浓度的EGCG和Cu2+对CQDs荧光猝灭效果的测定
在4 mL塑料离心管中依次加入1 mL稀释105 倍体积的CQDs溶液、900 µL不同浓度的Cu2+溶液和100 µL 250 µmol/L EGCG溶液,使体系中Cu2+与EGCG的浓度比分别为1∶2、1∶1、2∶1、4∶1,用混匀器混合均匀后,在40 ℃水浴锅中水浴30 min,用荧光分光光度计在350 nm激发波长处测其荧光强度。反应体系最终浓度为12.5 μmol/L EGCG和6.25、12.5、25、50 μmol/L Cu2+。根据公式(2)[17]计算CQDs荧光猝灭率(I)。
式中:Ia表示CQDs溶液中加入相应浓度Cu2+时的荧光强度;Ib表示CQDs溶液中加入相应浓度Cu2+和EGCG时的荧光强度。
在4 mL塑料离心管中依次加入1 mL稀释105 倍体积的CQDs溶液、100 µL 1 mmol/L Cu2+溶液和900 µL不同浓度的EGCG溶液,使反应体系最终浓度为50 μmol/L Cu2+和6.25、12.5、25、50 μmol/L EGCG。其他操作同上,根据公式(2)计算CQDs荧光猝灭率。式中:Ia为CQDs溶液中加入相应浓度EGCG溶液时的荧光强度;Ib为CQDs溶液中加入相应浓度EGCG和Cu2+溶液时的荧光强度。实验平行测定3 次。
1.3.5 DMSO/EDTA-2Na对CQDs的荧光保护作用
在4 mL塑料离心管中依次加入1 mL稀释105 倍体积的CQDs溶液、400 µL超纯水、200 µL 1 mmol/L Cu2+溶液、200 µL 14.08 mmol/L DMSO溶液(或2 mmol/L EDTA-2Na溶液)、200 µL 500 µmol/L EGCG溶液,用混匀器混合均匀后在40 ℃水浴锅中水浴30 min,用荧光分光光度计在350 nm激发波长处扫描其发射光谱,实验平行测定3 次。
1.4 数据分析
利用Origin和Omnic软件对光谱图进行分析及作图;用Excel软件进行数据分析。
2 结果与分析
2.1 CQDs的表征
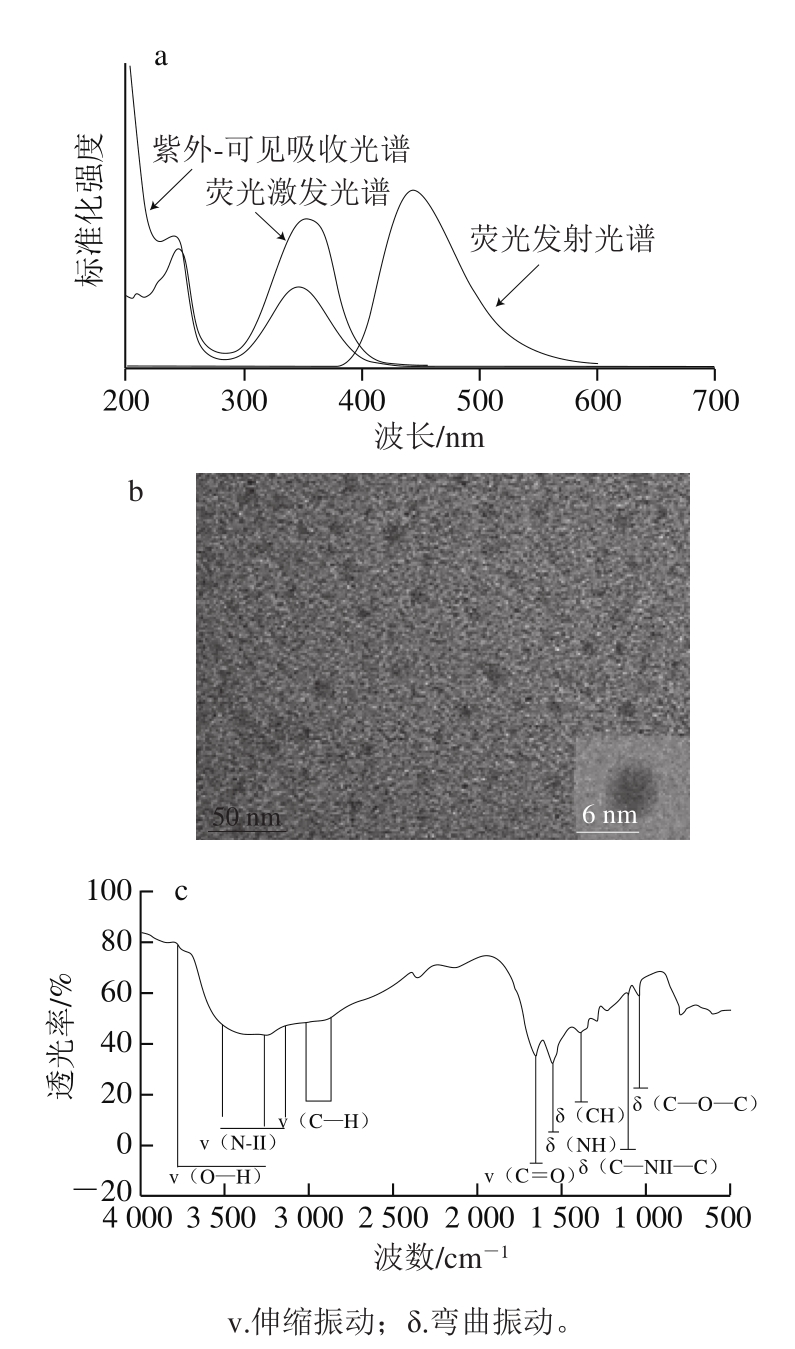
本研究制备的CQDs具有安全、快捷等优点,且相对量子产率(73.67%)较高,与普通水热法(80%)[18]基本持平;但是普通水热法需要反应18 h,而通过微波消解工作站只需要反应5 min,一次性就可制备960 mL CQDs溶液。由图1a的紫外-可见吸收光谱可以看出,所合成的CQDs溶液的吸收主要都在紫外光区,而在可见光区的吸收则比较弱,在波长238 nm附近出现了肩峰,348 nm波长处出现了宽的吸收峰。波长238 nm处的肩峰归因于芳香C=C键的π-π*跃迁,而在348 nm波长处宽的吸收峰归因于C=O键的n-π*跃迁[15,18]。由荧光光谱图可以看出,该CQDs最佳激发波长和发射波长分别为350 nm和445 nm,手持紫外灯照射下发出蓝色荧光。由图1b可以看出,该CQDs类似球形,少部分呈不规则状态,在水相中的分散性较好,但粒径分布不太均匀,平均粒径约为6 nm。为了探究该CQDs表面修饰的官能团,对其进行FTIR分析(图1c)。在3 200~3 750 cm-1和2 900~3 050 cm-1处的峰可分别归因于C—OH和C—H的伸缩振动;N—H的拉伸和弯曲振动分别出现在3 100~3 300 cm-1和1 552 cm-1处;1 656、1 150 cm-1处的峰分别表明存在C=O和C—NH—C。由此可见,通过微波消解工作站制备得到的CQDs的结构和粒径与文献[15,18-19]基本一致。通过FTIR图谱可以发现,CQDs表面含有羧基和氨基等含氮和含氧官能团,其表面被成功修饰了来源于乙二胺的氨基。这些官能团的存在大大增加了CQDs的水溶性[18]。
2.2 CQDs的性质
2.2.1 pH值对CQDs发光性能的影响
CQDs的荧光强度具有pH值依赖性,微波辅助高通量制备的CQDs同样具有这个特点。由图2可以看出,CQDs在高pH值或低pH值溶液中荧光强度较低,但在pH 4~10的溶液中荧光强度基本保持恒定,不随pH值的变化而变化。这与普通水热法制备的CQDs基本一致[18]。这可能归因于CQDs化学结构的变化或边缘卡宾结构的三重态[18,20-21],CQDs的表面状态/分子状态受溶液pH值的影响,太高或太低的pH值都会使CQDs表面的分子基团受到强烈的影响,大部分的CQDs没有石墨晶格,导致荧光猝灭;在强酸性条件下,CQDs的卡宾结构锯齿点被质子化,导致发光的三重态卡宾结构被破坏,发生荧光猝灭;而在中性或弱碱性情况下,CQDs的卡宾结构较稳定,荧光强度基本保持不变;但在强碱溶液中,CQDs表面的分子团会受到强烈的影响,表面结构被破坏,导致荧光猝灭。本实验用超纯水作溶剂,微量的EGCG和Cu2+不会对体系pH值产生明显的影响。
2.2.2 贮藏条件对CQDs发光性能的影响
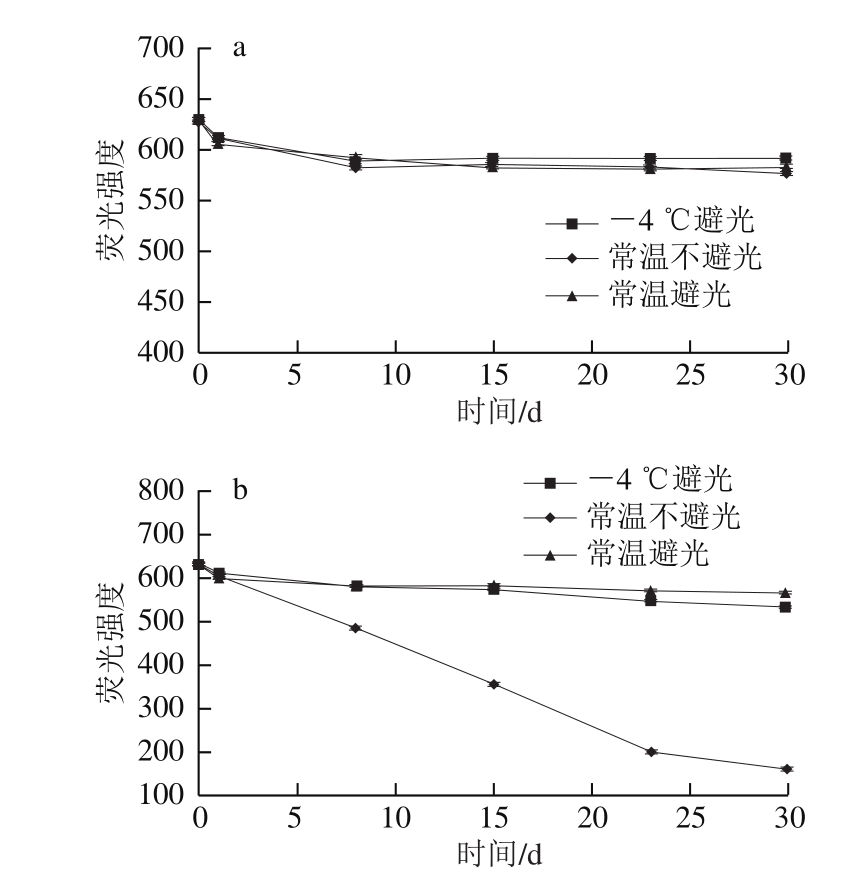
为研究CQDs的贮藏稳定性,利用CQDs在不同条件下贮藏1 个月后荧光强度的变化情况来探究CQDs的稳定性。由图3可以看出,CQDs原液比较稳定,随着贮藏时间的延长,-4 ℃避光、常温不避光、常温避光贮藏组的荧光强度都基本保持不变,说明CQDs原液贮藏1 个月中温度和光照对其影响不大。但是稀释后的CQDs稳定性则有所差异,不同的贮藏条件影响效果不同。-4 ℃避光和常温避光贮藏1 个月,CQDs的荧光强度基本保持不变;而常温不避光条件下贮藏则使CQDs荧光强度明显下降,30 d后约下降了74%。出现这一现象的原因可能是CQDs原液稀释了105 倍体积,溶液中含有的CQDs较少,随着贮藏时间的延长,稀释后的CQDs受到光照的强烈影响发生团聚或衰减,导致荧光强度明显下降。因此,制备好的CQDs最好在-4 ℃避光条件下以原液贮藏。
2.3 EGCG的促氧化作用
已有研究表明,EGCG在Cu2+等金属离子作用下会选择性地转变成促氧化剂,体系中发生类似Fenton反应,产生·OH等ROS自由基[9,22-23]。另外有研究发现,体系中产生的ROS自由基能够改变CQDs的表面状态并导致荧光猝灭[15,24]。因此,本研究以CQDs为荧光探针,研究EGCG和Cu2+是否会猝灭CQDs荧光探针。由图4可以看出,CQDs溶液中单独加入100 µmol/L Cu2+或50 µmol/L EGCG,体系中CQDs的荧光强度变化不大;但在EGCG与Cu2+共同作用时,CQDs的荧光强度大幅下降,但没有出现明显的偏移现象。这可能归因于EGCG和Cu2+之间的反应,Cu2+作为催化剂加速了EGCG自动氧化生成相应的半醌自由基和Cu+,半醌自由基被迅速氧化成相应的醌,而Cu+通过单电子转移给O2氧化生成O2-·;同时,溶液体系中伴随着H2O2的生成,Cu+与H2O2间发生类似Fenton反应,产生·OH,从而使CQDs荧光探针猝灭[15,22,25-26]。
为了进一步验证EGCG是否在一定量的Cu2+存在下转变成促氧化剂,产生·OH,从而猝灭CQDs荧光探针,选择DMSO作为自由基清除剂、EDTA-2Na作为Cu2+的螯合剂[27]。如图5所示,当体系中加入DMSO或EDTA时,CQDs荧光探针得到了一定的保护,加入1.408 mmol/L DMSO时,体系中荧光强度大约恢复了55%,这是由于DMSO不是很好的自由基清除剂[27],所以不能完全清除EGCG和Cu2+所产生的自由基,因此CQDs荧光探针在一定程度上有所猝灭;但是当加入200 µmol/L EDTA时,CQDs荧光探针的荧光强度基本得到保护,少量的CQDs荧光探针猝灭,这是因为EDTA是很好的金属螯合剂,使体系中游离的Cu2+减少,EGCG在没有游离Cu2+存在的条件下促氧化作用受到抑制。由此说明,CQDs荧光探针的猝灭是由于EGCG在一定量的Cu2+存在下产生ROS自由基引起的。
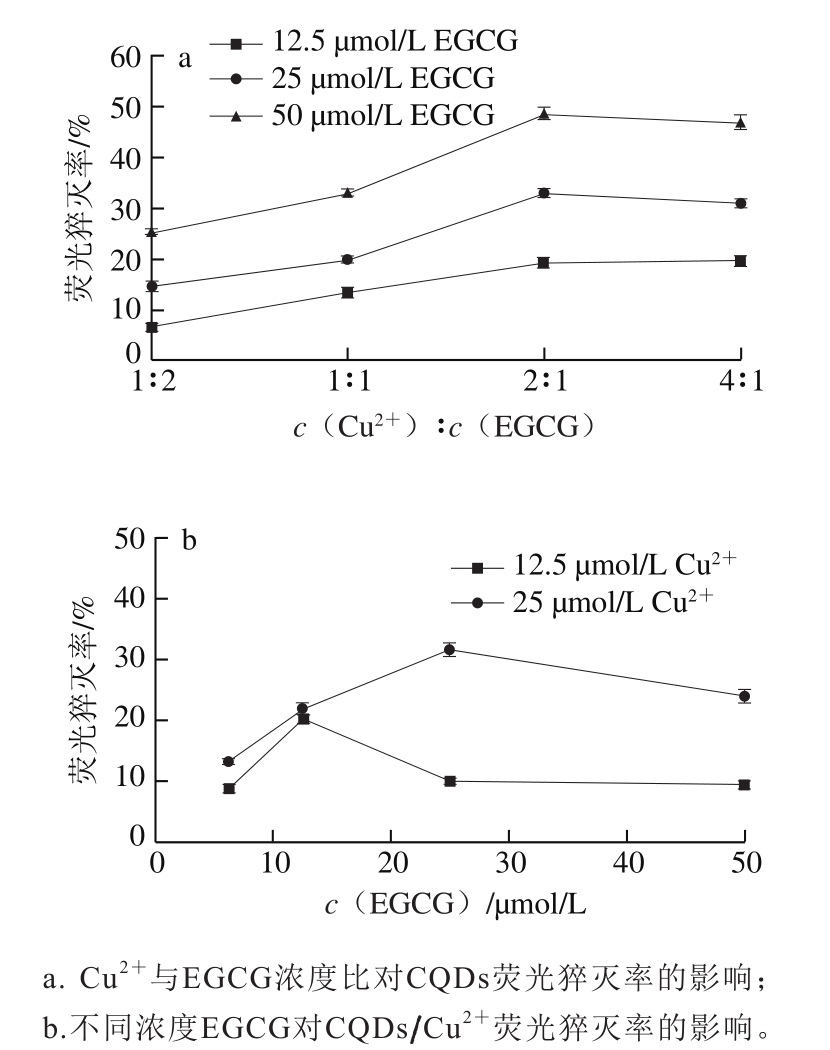
为了进一步研究EGCG和Cu2+之间的剂量-效应关系,了解EGCG在Cu2+存在下的促氧化性质,研究EGCG和Cu2+浓度比对CQDs荧光探针猝灭的影响。由图6a可以看出,固定EGCG浓度为12.5 µmol/L,不断增加Cu2+浓度,当Cu2+和EGCG的浓度比为2∶1时,CQDs的荧光猝灭效果最明显,继续增加Cu2+的浓度,CQDs荧光探针的猝灭率无明显的增加。当EGCG的浓度为50 µmol/L或者25 µmol/L时,随着Cu2+浓度的不断增加,同样得到类似的结果。如图6b所示,固定Cu2+浓度,随着EGCG浓度的增加,体系中CQDs荧光探针猝灭效果先明显升高后逐渐降低并趋于平缓。当Cu2+和EGCG的浓度比为2∶1,即EGCG浓度为25 µmol/L、Cu2+浓度为50 µmol/L或EGCG浓度为12.5 µmol/L、Cu2+浓度为25 µmol/L时,CQDs的荧光强度猝灭效果最明显。继续增加EGCG浓度,荧光猝灭效果降低。由此可以得出,Cu2+浓度是EGCG的2 倍时EGCG表现出更强的促氧化作用。
Hayakawa等[28]在1997年报道了茶多酚在Cu2+作用下对DNA和亚油酸的氧化作用,提出了自由基产生的反应式(式(3)~(6)),从反应式中可以看出1 个茶多酚与2 个分子的Cu2+作用,产生ROS自由基,但是在他们的实验中所使用的Cu2+浓度和茶多酚浓度并没有产生与本研究类似的剂量-效应关系。而本研究通过CQDs荧光探针可以清晰地看到Cu2+和EGCG浓度的剂量-效应关系,即EGCG在Cu2+存在的条件下表现出促氧化作用,而在Cu2+浓度是其2 倍的情况下表现出更强的促氧化作用,验证了Hayakawa等[28]提出的儿茶酚在Cu2+作用下的自由基产生机制。
EGCG在Cu2+的作用下自动氧化生成Cu+和半醌自由基。Cu+和H+在O2的作用下反应生成H2O2。H2O2在金属离子Cu+的作用下发生了类似的Fenton反应,产生·OH等ROS自由基[7,10]。ROS自由基会立即攻击CQDs的表面官能团,使CQDs表面结构发生改变,从而使荧光猝灭[2]。一些抗氧化物质如其他茶多酚(表没食子酸儿茶素、表儿茶素没食子酸酯、表儿茶素、儿茶素)[28]、白藜芦醇[29]及其类似物,苯环上具有多羟基官能团结构的物质,当它们遇到一定量的Cu2+时也会产生促氧化作用,产生·OH等ROS自由基[30]。通过CQDs荧光探针可快速预知这些抗氧化物质在过渡金属离子(如Cu2+等)存在下的促氧化性质。
3 结 论
本研究通过高通量微波消解/萃取工作站快速制备高相对量子产率的类似球形的水溶性荧光CQDs,研究了CQDs的pH值依赖性及其稳定性。另外,以此CQDs为荧光探针,研究了EGCG在Cu2+存在条件下产生的ROS自由基对CQDs荧光探针的猝灭作用,同时探讨了EGCG和Cu2+的促氧化剂量-效应关系,即当Cu2+和EGCG的浓度比为2∶1时,体系中的荧光猝灭效果最明显,EGCG的促氧化作用更强。本研究结果为CQDs的合成提供了新的方式,同时也为EGCG作为功能性物质的应用提供理论依据。
参考文献:
[1] LIM S Y, SHEN W, GAO Z Q. Carbon quantum dots and their applications[J]. Chemistry Society Reviews, 2015, 44: 362-381.DOI:10.1039/C4CS00269E.
[2] REN X L, LIU J, MENG X W, et al. Synthesis of ultra-stable fluorescent carbon dots from polyvinylpyrrolidone and their application in the detection of hydroxyl radicals[J]. Chemistry-An Asian Journal, 2014, 9(4): 1054-1059. DOI:10.1002/asia.201301419.
[3] WANG Y, ZHUANG Q, NI Y. Facile microwave-assisted solidphase synthesis of highly fluorescent nitrogen-sulfur-codoped carbon quantum dots for cellular imaging applications[J]. Chemistry a European Journal, 2015, 21(37): 13004-13011. DOI:10.1002/chem.201501723.
[4] YANG C S, WANG X, LU G, et al. Cancer prevention by tea: animal studies, molecular mechanisms and human relevance[J]. Nature Reviews Cancer, 2009, 9(6): 429-439. DOI:10.1038/nrc2641.
[5] GORDON N C, WAREHAM D W. Antimicrobial activity of the green tea polyphenol (-)-epigallocatechin-3-gallate (EGCG) against clinical isolates of Stenotrophomonas maltophilia[J]. International Journal of Antimicrobial Agents, 2010, 36(2): 129-131. DOI:10.1016/j.ijantimicag.2010.03.025.
[6] SINGH B N, SHANKAR S, SRIVASTAVA R K. Green tea catechin,epigallocatechin-3-gallate (EGCG): mechanisms, perspectives and clinical applications[J]. Biochemical Pharmacology, 2011, 82(12):1807-1821. DOI:10.1016/j.bcp.2011.07.093.
[7] XIONG C W, LIU C H, PAN W J, et al. Non-destructive determination of total polyphenols content and classification of storage periods of iron buddha tea using multispectral imaging system[J]. Food Chemistry, 2015, 176: 130-136. DOI:10.1016/j.foodchem.2014.12.057.
[8] CHEN R, WANG J B, ZHANG X Q, et al. Green tea polyphenol epigallocatechin-3-gallate (EGCG) induced intermolecular crosslinking of membrane proteins[J]. Archives of Biochemistry and Biophysics, 2011, 507(2): 343-349. DOI:10.1016/j.abb.2010.12.033.
[9] FARHAN M, KHAN H Y, OVES M, et al. Cancer therapy by catechins involves redox cycling of copper ions and generation of reactive oxygen species[J]. Toxins, 2016, 8(2): 1-10. DOI:10.3390/toxins8020037.
[10] BANDELE O J, OSHEROFF N. (-)-Epigallocatechin gallate, a major constituent of green tea, poisons human type II topoisomerases[J].Chemical Research Toxicology, 2008, 21(4): 936-943. DOI:10.1021/tx700434v.
[11] NISHIKAWA H, KITANI S. Tea catechins have dual effect on mast cell degranulation induced by compound 48/80[J]. International Immunopharmacology, 2008, 8(9): 1207-1215. DOI:10.1016/j.intimp.2008.04.010.
[12] 任婧, 张献清, 邢艳菲, 等. 茶多酚表没食子儿茶素-3-没食子酸酯对红细胞膜的促氧化作用[J]. 第四军医大学学报, 2009, 30(19): 1947-1949.
[13] 陈怡君, 熊立瑰, 黄建安, 等. EGCG对细胞的促氧化作用研究进展[J]. 茶叶科学, 2015, 35(2): 130-136. DOI:10.3969/j.issn.1000-369X.2015.02.006.
[14] EBARA M, FUKUDA H, HATANO R, et al. Relationship between copper, zinc and metallothionein in hepatocellular carcinoma and its surrounding liver parenchyma[J]. Journal of Hepatology, 2000, 33(3):415-422. DOI:10.1016/S0168-8278(00)80277-9.
[15] BARATI A, SHAMSIPUR M, ABDOLLAHI H. Hemoglobin detection using carbon dots as a fl uorescence probe[J]. Biosensors and Bioelectronics, 2015, 71: 470-475. DOI:10.1016/j.bios.2015.04.073.
[16] GEDDA G, LEE C Y, LIN Y C, et al. Green synthesis of carbon dots from prawn shells for highly selective and sensitive detection of copper ions[J]. Sensors and Actuators B: Chemical, 2016, 224: 396-403. DOI:10.1016/j.snb.2015.09.065.
[17] HOU J, LI H Y, WANG L, et al. Rapid microwave-assisted synthesis of molecularly imprinted polymers on carbon quantum dots for fl uorescent sensing of tetracycline in milk[J]. Talanta, 2016, 146: 34-40.DOI:10.1016/j.talanta.2015.08.024.
[18] ZHU S, MENG Q, WANG L, et al. Highly photoluminescent carbon dots for multicolor patterning, sensors, and bioimaging[J].Angewandte Chemie-International Edition, 2013, 125(14): 4045-4049.DOI:10.1002/anie.201300519.
[19] ZHANG Y Q, LIU X Y, FAN Y, et al. One-step microwave synthesis of N-doped hydroxyl-functionalized carbon dots with ultra-high fl uorescence quantum yields[J]. Nanoscale, 2016, 8(33): 15281-15287.DOI:10.1039/c6nr03125k.
[20] PAN D Y, ZHANG J C, LI Z, et al. Hydrothermal route for cutting graphene sheets into blue-luminescent graphene quantum dots[J]. Advanced Materials, 2010, 22(6): 734-738. DOI:10.1002/adma.200902825.
[21] SHEN J H, ZHU Y H, CHEN C, et al. Facile preparation and upconversion luminescence of graphene quantum dots[J]. Chemical Communcications, 2011, 47(9): 2580-2582. DOI:10.1039/c0cc04812g.
[22] MOCHIZUKI M, YAMAZAKI S, KANO K, et al. Kinetic analysis and mechanistic aspects of autoxidation of catechins[J]. Biochimica et Biophysica Acta, 2002, 1569(1/2/3): 35-44. DOI:10.1016/S0304-4165(01)00230-6.
[23] AKAGAWA M, SHIGEMITSU T, SUYAMA K. Production of hydrogen peroxide by polyphenols and polyphenol-rich beverages under quasi-physiological conditions[J]. Bioscience, Biotechnology and Biochemistry, 2003, 67(12): 2632-2640. DOI:10.1271/bbb.67.2632.
[24] WEI J F, REN J, LIU J, et al. An eco-friendly, simple, and sensitive fl uorescence biosensor for the detection of choline and acetylcholine based on C-dots and the Fenton reaction[J]. Biosensors and Bioelectronics, 2013, 52: 304-309. DOI:10.1016/j.bios.2013.09.006.
[25] SANG S, HOU Z, LAMBERT J D, et al. Redox properties of tea polyphenols and related biological activities[J]. Antioxidants & Redox Signaling, 2005, 7(11/12): 1704-1714. DOI:10.1089/ars.2005.7.1704.
[26] ZHANG L, BANDY B, DAVISON A J. Effects of metals, ligands and antioxidants on the reaction of oxygen with 1,2,4-benzenetriol[J].Free Radical Biology and Medicine, 1996, 20(4): 495-505.DOI:10.1016/0891-5849(95)02089-6.
[27] OIKAWA S, FURUKAWA A, ASADA H, et al. Catechins induce oxidative damage to cellular and isolated DNA through the generation of reactive oxygen species[J]. Free Radical Research, 2003, 37(8):881-890. DOI:10.1080/1071576031000150751.
[28] HAYAKAWA F, KIMURA T, MAEDA T, et al. DNA cleavage reaction and linoleic acid peroxidation induced by tea catechins in the presence of cupric ion[J]. Biochimica et Biophysica Acta, 1997, 1336(2):123-131. DOI:10.1016/S0304-4165(97)00019-6.
[29] ZHENG L F, WEI Q Y, CAI Y J, et al. DNA damage induced by resveratrol and its synthetic analogues in the presence of Cu (II)ions: mechanism and structure-activity relationship[J]. Free Radical Biology and Medicine, 2006, 41(12): 1807-1816. DOI:10.1016/j.freeradbiomed.2006.09.007.
[30] BARRETO G, MADUREIRA D, CAPANI F, et al. The role of catechols and free radicals in benzene toxicity: an oxidative DNA damage pathway[J]. Environmental and Molecular Mutagenesis, 2009,50(9): 771-780. DOI:10.1002/em.20500.
Rapid Microwave-Assisted Preparation of Carbon Quantum Dots and Its Application for Investigating Pro-oxidative Activity of Epigallocatechin-3-gallate
WU Chunlian, PU Hongbin, QU Jiahuan, SUN Da-wen, WEI Qingyi*
(Academy of Contemporary Food Engineering, Engineering and Technological Research Centre of Guangdong Province on Intelligent Sensing and Process Control of Cold Chain Foods, School of Food Science and Engineering,South China University of Technology, Guangzhou 510006, China)
Abstract: Aqueous carbon quantum dots were prepared rapidly by high-throughput microwave digestion/extraction workstation, and their pH dependence and stability behavior were studied. The fluorescence quenching of carbon quantum dots by reactive oxygen species produced by epigallocatechin-3-gallate (EGCG) in the presence of Cu2+ and the pro-oxidative dose-effect of EGCG with Cu2+ were investigated. Experimental results indicated that the carbon quantum dots had pH dependence and good stability behavior. The relative quantum yield was 73.67%. When the concentration ratio between Cu2+ and EGCG was 2:1, the fl uorescence quenching of carbon quantum dots was serious, and EGCG had strong pro-oxidative activity. This study provides a theoretical basis for the application of EGCG as a functional substance.
Keywords: carbon quantum dot fl uorescence probe; epigallocatechin-3-gallate; pro-oxidative activity; dose-effect relationship
收稿日期:2018-02-11
基金项目:中央高校基本科研业务费专项资金项目(2017MS075);广东省农业厅农产品保鲜物流共性技术创新团队项目(2016LM2154);广州市协同创新重大专项(201604020007;201604020057)
第一作者简介:吴春莲(1992—)(ORCID: 0000-0002-9000-048X),女,硕士研究生,研究方向为食品检测技术。E-mail: 1143905597@qq.com
*通信作者简介:韦庆益(1977—)(ORCID: 0000-0002-5577-2513),女,副教授,博士,研究方向为食品检测技术。E-mail: feweiqingyi@scut.edu.cn
DOI:10.7506/spkx1002-6630-20180211-124
中图分类号:TS201.2;O657.37
文献标志码:A
文章编号:1002-6630(2019)05-0063-07
引文格式:吴春莲, 蒲洪彬, 曲佳欢, 等. 微波辅助快速制备碳量子点及其对表没食子儿茶素-3-没食子酸酯的促氧化作用[J]. 食品科学, 2019, 40(5): 63-69. DOI:10.7506/spkx1002-6630-20180211-124. http://www.spkx.net.cn
WU Chunlian, PU Hongbin, QU Jiahuan, et al. Rapid microwave-assisted preparation of carbon quantum dots and its application for investigating pro-oxidative activity of epigallocatechin-3-gallate[J]. Food Science, 2019, 40(5): 63-69. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180211-124. http://www.spkx.net.cn
 ·)等ROS的产生[8-9],这些ROS自由基对癌细胞具有很好的杀伤作用,同时还能够对生物分子进行共价修饰,表现出一定的生物毒性[10-12]。但是细胞内的超氧化物歧化酶、过氧化氢酶等会对过量的自由基进行清理,使细胞中的自由基处于动态平衡状态[13]。然而,不同的细胞类型所含有的过渡金属离子浓度是不同的,已有研究报道恶性肿瘤细胞中的Cu2+浓度会高于正常细胞[14]。因此,很多研究者认为EGCG的抗肿瘤作用是通过促氧化作用机制产生的[9]。但在EGCG的促氧化作用过程中,EGCG和Cu2+的剂量-效应关系至今少有研究。
·)等ROS的产生[8-9],这些ROS自由基对癌细胞具有很好的杀伤作用,同时还能够对生物分子进行共价修饰,表现出一定的生物毒性[10-12]。但是细胞内的超氧化物歧化酶、过氧化氢酶等会对过量的自由基进行清理,使细胞中的自由基处于动态平衡状态[13]。然而,不同的细胞类型所含有的过渡金属离子浓度是不同的,已有研究报道恶性肿瘤细胞中的Cu2+浓度会高于正常细胞[14]。因此,很多研究者认为EGCG的抗肿瘤作用是通过促氧化作用机制产生的[9]。但在EGCG的促氧化作用过程中,EGCG和Cu2+的剂量-效应关系至今少有研究。