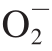 ·、HO2、H2O2和·OH,以及活性氮(reactive nitrogen species,RNS)自由基[1]。除了生理性的氧化产物,食品中油脂的氧化、臭氧的暴露、吸烟和紫外线照射均可能造成ROS和RNS的产生[2-3]。一般来讲,当机体产生过量自由基或细胞防御失败时,机体生物大分子如DNA、脂质、蛋白质和糖类物质等会被破坏,也被称为氧化应激[4-5]。氧化应激会对细胞膜、组织和酶系统产生氧化损伤,并促进癌症、糖尿病和动脉粥样硬化等疾病的发生与发展[6-8]。
·、HO2、H2O2和·OH,以及活性氮(reactive nitrogen species,RNS)自由基[1]。除了生理性的氧化产物,食品中油脂的氧化、臭氧的暴露、吸烟和紫外线照射均可能造成ROS和RNS的产生[2-3]。一般来讲,当机体产生过量自由基或细胞防御失败时,机体生物大分子如DNA、脂质、蛋白质和糖类物质等会被破坏,也被称为氧化应激[4-5]。氧化应激会对细胞膜、组织和酶系统产生氧化损伤,并促进癌症、糖尿病和动脉粥样硬化等疾病的发生与发展[6-8]。生物体中不同的代谢途径会产生自由基,包括活性氧(reactive oxygen species,ROS)自由基,如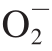 ·、HO2、H2O2和·OH,以及活性氮(reactive nitrogen species,RNS)自由基[1]。除了生理性的氧化产物,食品中油脂的氧化、臭氧的暴露、吸烟和紫外线照射均可能造成ROS和RNS的产生[2-3]。一般来讲,当机体产生过量自由基或细胞防御失败时,机体生物大分子如DNA、脂质、蛋白质和糖类物质等会被破坏,也被称为氧化应激[4-5]。氧化应激会对细胞膜、组织和酶系统产生氧化损伤,并促进癌症、糖尿病和动脉粥样硬化等疾病的发生与发展[6-8]。
·、HO2、H2O2和·OH,以及活性氮(reactive nitrogen species,RNS)自由基[1]。除了生理性的氧化产物,食品中油脂的氧化、臭氧的暴露、吸烟和紫外线照射均可能造成ROS和RNS的产生[2-3]。一般来讲,当机体产生过量自由基或细胞防御失败时,机体生物大分子如DNA、脂质、蛋白质和糖类物质等会被破坏,也被称为氧化应激[4-5]。氧化应激会对细胞膜、组织和酶系统产生氧化损伤,并促进癌症、糖尿病和动脉粥样硬化等疾病的发生与发展[6-8]。
大量实验证明,膳食抗氧化成分的补充可以增强人体的抗氧化防御能力,降低体内的氧化应激水平,帮助机体维持氧化和抗氧化平衡[9-14]。蛋白质是食品和食品成分的重要组成部分。在食物蛋白质序列中有一些片段可以表现出生物活性,这些片段被称为“生物活性肽”[15-16]。生物活性肽具有比氨基酸和蛋白质更强的生物活性和多样性,更易吸收并且安全。大量研究发现,不同来源的动植物源活性肽酶解物如乳清蛋白、大豆蛋白、鸡蛋蛋黄蛋白、鸵鸟蛋清蛋白、花生蛋白和蛋清源活性肽等具有很强的抗氧化能力,可以清除多余的自由基[7,17-20]。生物活性肽以多种方式发挥其抑制氧化应激的特性,包括清除自由基,抑制ROS的产生,上调抗氧化酶活力,抑制促炎细胞因子的释放以及降血压等[21-24]。蛋清中含有多种功能蛋白组分,蛋清蛋白的酶解产物具有多种生理活性[19,25-26],其在人类健康及疾病的预防和治疗方面有巨大潜力。在前期研究中发现蛋清源活性肽WNWAD具有很好的抗氧化活性[27]。因此,本实验以蛋清源活性肽WNWAD及其结构改造肽为研究对象,考察了其对H2O2诱导损伤的HEK293细胞的存活率、ROS水平、抗氧化酶活力及细胞因子白介素8(interleukin-8,IL-8)分泌的影响。
蛋清源活性肽WNWAD(Trp-Asn-Trp-Ala-Asp)、WNW(Trp-Asn-Trp)、WAD(Trp-Ala-Asp)、WN(Trp-Asn)(纯度>95%) 上海强耀生物科技有限公司;2’,7’-二氯荧光素二乙酸酯(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA)荧光探针(分析纯) 美国Sigma公司;人胚肾HEK293细胞中国科学院细胞库;DMEM培养基 美国GIBCO公司;胰蛋白酶、二甲基亚砜、乙二胺四乙酸 北京鼎国生物有限公司;H2O2(分析纯) 天津化学有限公司;MTS单溶液细胞增殖检测试剂盒 美国Promega公司;总超氧化物歧化酶(total superoxide dismutase,T-SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和过氧化氢酶(catalase,CAT)检测试剂盒 上海碧云天生物技术有限公司;IL-8酶联免疫吸附测定试剂盒 武汉伊艾博科技有限公司。
电子天平 瑞士METTLER TOLEDO公司;多功能酶标仪 美国伯腾仪器有限公司;黑色孔板(透明平底) 德国Greiner Bio-One公司;移液器 德国Eppendorf公司;超净工作台 苏州安泰空气技术有限公司;CO2培养箱 上海力申科学仪器有限公司;低速离心机 安徽中科中佳科学仪器有限公司;倒置荧光显微镜 日本尼康公司;激光共聚焦显微镜 日本奥林巴斯公司。
1.3.1 蛋清源活性肽对HEK293细胞的毒性作用
HEK293细胞培养方法参考Liu Jingbo等[27]的方法。完全培养液由DMEM培养基、胎牛血清、双抗和非必需氨基酸溶液以体积比90∶10∶1∶1配制而成。将密度为5.0×104 个/mL的HEK293细胞接种于96 孔板中,每孔接种90 µL,实验设置空白组(100 µL培养基)、对照组(90 µL细胞混悬液+10 µL培养基)和实验组(90 µL细胞混悬液),培养24 h。然后在实验组中加入10 µL终浓度为0.1、0.5、1.0、2.0 µmol/L的蛋清源活性肽溶液(每个浓度设置6 个复孔),在37 ℃,5% CO2培养箱中孵育24 h后,细胞存活率的检测采用单溶液细胞增殖检测试剂盒,即MTS法[27]测定。
1.3.2 蛋清源活性肽对 H2O2诱导的HEK293 细胞的保护作用
将密度为6.0×104 个/mL的HEK293细胞接种于96 孔板中,每孔接种80 µL。设置空白组(100 µL培养基)、对照组(80 µL细胞混悬液+20 µL培养基)、损伤组(80 µL细胞混悬液)和实验组(80 µL细胞混悬液),每个实验浓度设置6 个复孔。损伤模型采用本实验室前期建立的H2O2诱导的HEK293细胞氧化损伤模型。在37 ℃,5% CO2培养箱中孵育24 h后,实验组加入10 µL终浓度0.1、0.5、1.0、2.0 µmol/L的蛋清肽溶液,同时损伤组加入10 µL培养基,继续孵育24 h。然后,损伤组和实验组同时加入10 µL终浓度为400 µmol/L的H2O2溶液,继续孵育12 h后,MTS法测定细胞存活率。
1.3.3 蛋清源活性肽对H2O2诱导的HEK293细胞内ROS水平的影响
细胞内ROS含量的测定参照文献中已报道的DCFH-DA荧光探针法[24]。HEK293细胞以5×104个/孔的密度接种于24 孔板中,在37 ℃、5% CO2培养箱中孵育24 h后,实验组加入100 µL终浓度0.1、1.0 µmol/L的蛋清源活性肽溶液(每个浓度设置3 个复孔)。同时损伤组加入100 µL培养基,继续孵育24 h。然后,损伤组和实验组同时加入100 µL终浓度为400 µmol/L的H2O2溶液,继续孵育2 h。然后,用移液器吸弃各孔中的培养液,并加入100 µL DCFH-DA溶液(溶于二甲基亚砜,终浓度为10 µmol/L),放入培养箱中37 ℃孵育15 min。磷酸盐缓冲液清洗3 次后加入不完全培养基,在激发波长为485 nm,发射波长为525 nm下,用多功能酶标仪检测各孔细胞的荧光强度,同时用激光共聚焦扫描显微镜拍照。
1.3.4 蛋清源活性肽对H2O2诱导的HEK293细胞CAT、T-SOD和GSH-Px活力的影响
将浓度为1.0×106 个/mL的HEK293细胞接种于6 孔板中,每孔接种2 mL(每个浓度设置3 个复孔)。其中实验组加入250 µL终浓度为0.1、0.5、1.0 µmol/L的蛋清源活性肽WNWAD、WNW、WAD、WN溶液,最后损伤组和实验组同时加入250 µL终浓度为400 µmol/L的H2O2溶液。培养结束后,弃去培养液,以磷酸盐缓冲液清洗两遍后,放置冰上,每孔加入500 µL细胞裂解液,于冰上裂解30 min,用刮板刮下细胞,然后在4 ℃下12 000 r/min离心10 min,吸取各组细胞悬液,4 ℃冷藏备用(6 h内测定完各项酶系指标)。最后按照试剂盒说明书对T-SOD、GSH-Px和CAT活力等指标进行检测。蛋白质含量采用BCA蛋白试剂盒定量。
1.3.5 蛋清源活性肽对H2O2诱导的IL-8活性的酶联免疫吸附测定分析
将HEK293细胞接种于6 孔培养板各孔中,细胞密度为5.0×105 个/mL,每孔接种量为1.5 mL(每个浓度设置3 个复孔),5% CO2培养箱中孵育24 h后实验组加入250 µL终浓度为1.0 µmol/L的蛋清源活性肽溶液,空白组和损伤组加250 µL培养基。5% CO2培养箱中继续孵育24 h后损伤组和实验组同时加入250 µL终浓度为400 µmol/L的H2O2溶液,空白组加250 µL培养基。继续孵育12 h后按照按照IL-8酶联免疫吸附测定试剂盒操作说明书进行测定(各试剂使用前平衡至室温)。
实验重复3 次,结果以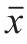 ±s表示。使用SPSS 19.0软件处理数据,通过单因素方差分析(One-way ANOVA)比较差异显著性。
±s表示。使用SPSS 19.0软件处理数据,通过单因素方差分析(One-way ANOVA)比较差异显著性。
为了排除实验中的非特异性干扰,在不添加H2O2的情况下,通过MTS法检测了蛋清源活性肽对HEK293细胞生长的影响。结果显示,实验组和对照组细胞存活率无显著性差异,蛋清源活性肽对HEK293细胞既无促进生长作用,也无毒性或抑制生长作用,蛋清源活性肽本身对实验结果无干扰作用(图1)。
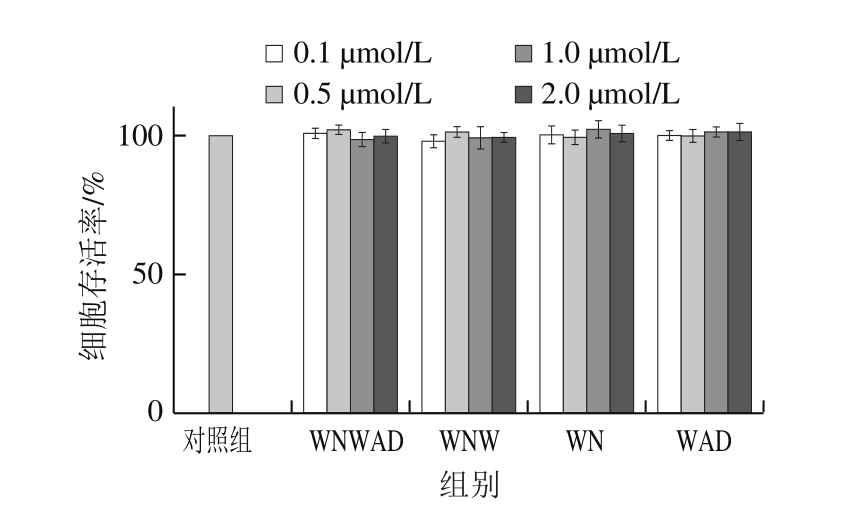
图 1 蛋清源活性肽对正常HEK293细胞存活率的影响
Fig. 1 Effect of peptides derived from egg white on survival rate of HEK293 cells
H2O2是一种ROS,可引发脂质过氧化从而增强氧化应激,最终可导致细胞损伤甚至死亡[28]。而加入一定的抗氧化剂可以减缓H2O2对细胞的损伤程度。本实验中,WNWAD、WNW、WAD和WN均有氧化应激抑制作用(图2)。只加H2O2处理的损伤组细胞存活率约为对照组的(49.8±2.0)%,与对照组有极显著性差异(P<0.01);蛋清源活性肽WNWAD、WNW、WAD、WN对细胞存活率的影响均呈现出浓度依赖性,细胞存活率从损伤组的(48.0±2.4)%分别提高到(99.7±1.8)%、(69.4±3.2)%、(78.9±5.1)%、(7 2.1±3.6)%,与损伤组有极显著性差异(P<0.01),即随着蛋清源活性肽浓度的增大,其抑制氧化应激的活性随之增强,对氧化损伤细胞的保护作用也越强,尤其在五肽WNWAD浓度为1.0 µmol/L和2.0 µmol/L时,实验组的细胞在其保护作用下,存活率((99.9±2.5)%、(99.7±1.8)%)几乎完全恢复到对照组的水平。结合2.1节细胞毒性实验结果可以证明,蛋清源活性肽对H2O2诱导损伤的HEK293模型细胞的保护作用是通过抑制氧化应激实现的,而非刺激HEK293细胞增殖。
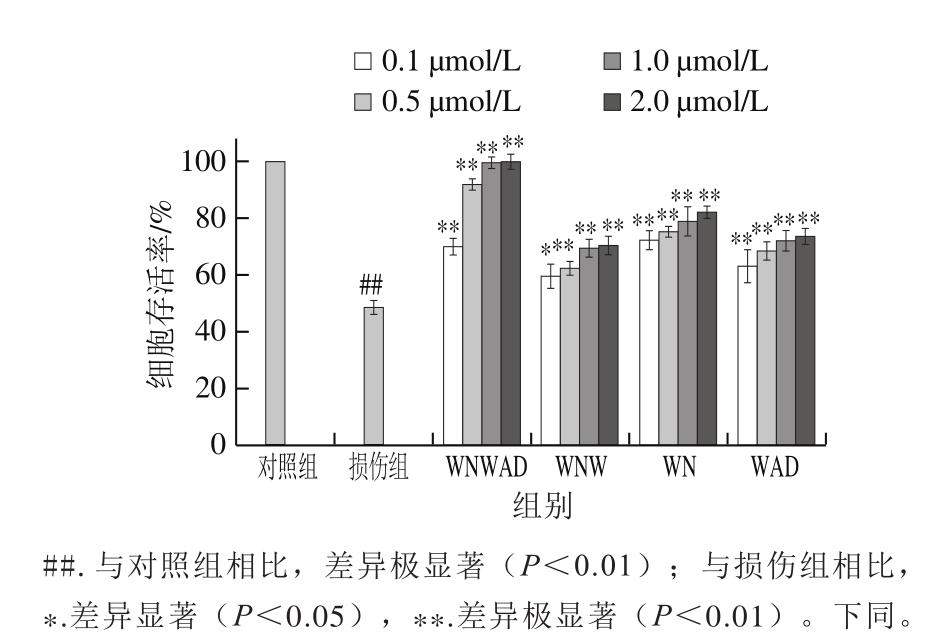
图 2 蛋清源活性肽对H2O2氧化损伤的HEK293细胞的保护作用
Fig. 2 Protective effect of peptides derived from egg white on H2O2-induced oxidative damage in HEK293 cells
采用DCFH-DA荧光探针法检测细胞内ROS水平变化。DCFH-DA是一种可以自由透过细胞膜的荧光染料,其本身无荧光。当DCFH-DA进入细胞后,可以被细胞内的酯酶水解成为2’,7’-二氯二氢荧光素(2’,7’-dichlorodihy drofluorescein,DCFH),而DCFH不能通透细胞膜,因此DCFH-DA荧光探针可容易地装载到细胞内。细胞内的ROS可以将无荧光的DCFH氧化成有荧光的2’,7’-二氯荧光素(2’,7’-dichlorofluorescein,DCF)。通过检测DCF的荧光强度便可得知细胞内ROS的水平[28]。在荧光照片中,荧光强度越强,代表细胞内ROS水平越高,反之则说明越低(图3)。
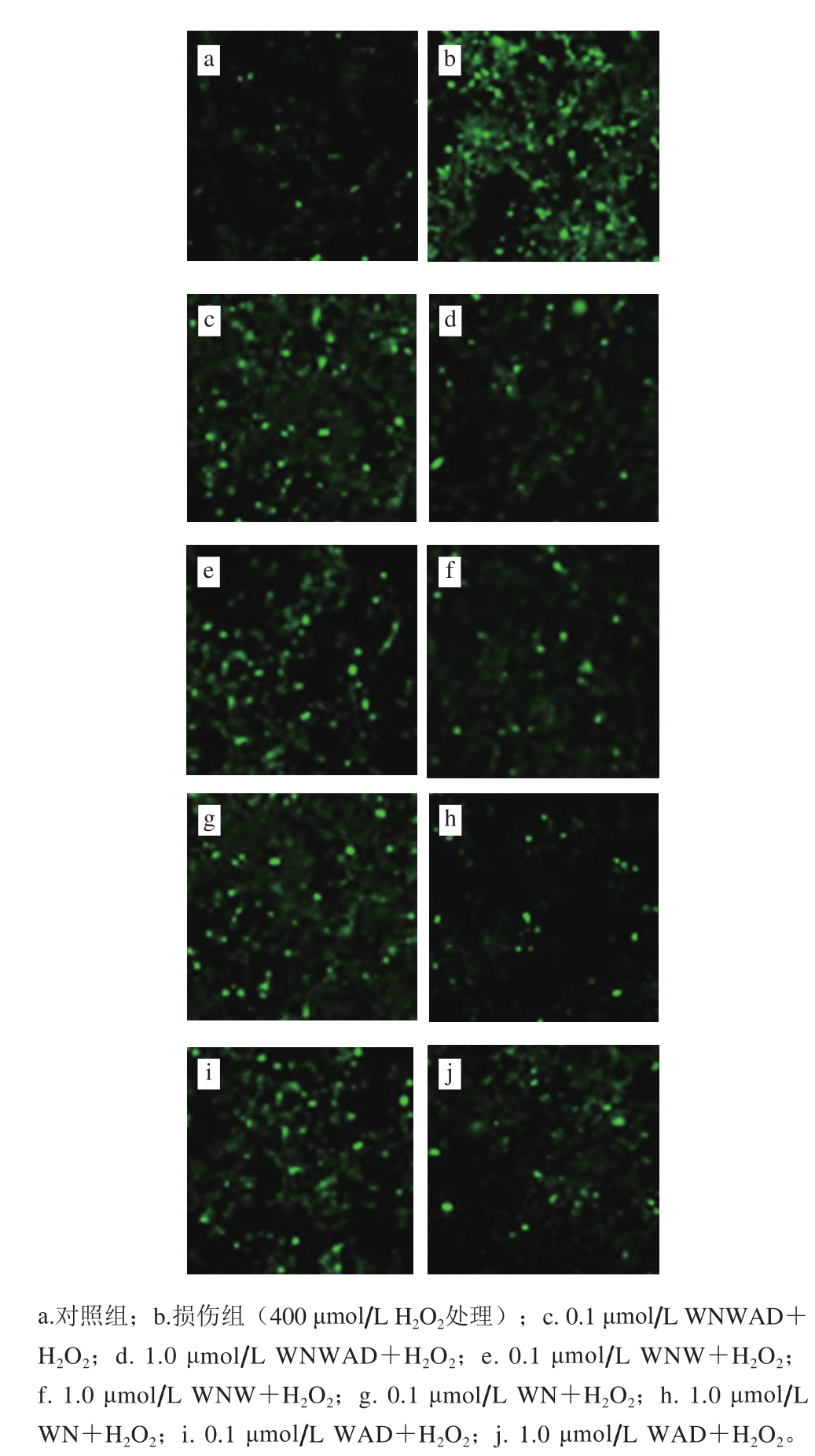
图 3 HEK293细胞中DCF荧光照片
Fig. 3 Fluorescence images of 2’7’-dichlorofluorescein entering into HEK293 cells
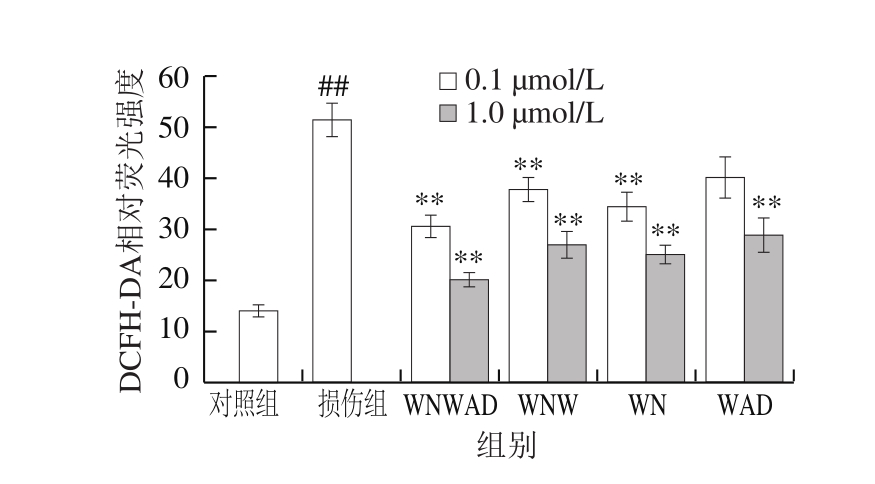
图 4 各组DCFH-DA相对荧光强度
Fig. 4 Relative fl uorescence intensity of DCFH-DA in all groups
本实验中HEK293细胞经H2O2处理后DCF荧光强度显著升高(P<0.01),说明H2O2诱导了HEK293细胞内ROS的产生。而经过蛋清源活性肽处理的实验组,与损伤组相比,细胞内ROS的水平极显著降低(P<0.01),呈浓度依赖型关系(图4)。0.1 μmol/L和1.0 μmol/L的WNWAD、WNW、WN和WAD均显著降低了DCF荧光强度(图3)。然而,关于DCF荧光探针是否可以检测特定种类的ROS仍未阐明,有报道称DCF对H2O2有特异性,也有报道称DCF可以检测一系列的活性中间体[29-30]。目前无法确定本实验中蛋清源活性肽究竟以哪种活性氧类物质为靶点,需要接下来进一步的研究。
T-SOD、CAT和GSH-Px均为细胞抗氧化防御系统中酶类物质的重要组成部分,对机体内氧化和抗氧化动态平衡起着非常重要的影响。CAT可将H2O2分解为水和氧气;还原型谷胱甘肽-SOD可清除O2-·,防止细胞受损;GSH-Px可促进H2O2和还原型谷胱甘肽反应生成水和氧化型谷胱甘肽。已有研究表明,H2O2不仅可攻击生物膜并引发脂质过氧化反应,破坏生物膜完整性,而且可以降低细胞内抗氧化酶系活性[1]。本实验中,HEK293细胞经过H2O2处理后,T-SOD、CAT和GSH-Px的活力和对照组相比,均极显著性下降(P<0.01),在经过WNWAD、WNW、WAD、WN处理的实验组,随着肽浓度的升高,3 种酶的活力均有所提高,呈现浓度依赖型关系(表1)。
表 1 蛋清源活性肽对H2O2诱导的HEK293细胞T-SOD、CAT和GSH-Px活力的影响
Table 1 Effect of peptides derived from egg white on T-SOD, CAT and GSH-Px activity in H2O2-induced HEK293 cells

注:##.与对照组相比差异极显著(P<0.01);与损伤组相比,*.差异显著(P<0.05),**.差异极显著(P<0.01)。
GSH-Px活力/(nmol/(min·mL))对照组 208.11±1.27 26.22±1.30 59.23±2.15损伤组 88.36±2.68## 8.36±0.94## 20.59±3.93##组别 浓度/(μmol/L)T-SOD活力/(U/mg)CAT活力/(U/mg)WNWAD 0.1 98.76±1.23* 9.28±0.74* 23.96±1.95*0.5 147.36±3.24** 19.24±0.98** 32.33±2.75**1.0 176.25±1.98** 21.03±1.52** 37.36±4.17**WNW 0.1 95.63±0.56* 8.63±0.92* 22.42±0.76*0.5 131.29±4.62** 14.23±1.57** 26.35±1.48**1.0 162.25±3.14** 17.22±1.93** 33.14±2.76**WN 0.1 92.41±2.17* 8.76±0.55* 23.10±2.18*0.5 126.53±2.18** 12.14±2.33** 29.11±2.37**1.0 141.39±2.22** 16.85±0.97** 32.19±2.62**0.1 97.26±2.16* 8.93±1.20* 21.74±0.68*0.5 129.62±3.72** 16.24±1.37** 33.27±3.37**1.0 157.32±1.98** 19.74±3.78** 35.69±1.24**WAD
在活性肽的浓度为1.0 μmol/L时,WNWAD的T-SOD、CAT和GSH-Px的活力分别为(176.25±1.98)、(21.03±1.52)U/mg和(37.36±4.17)nmol/(min·mL);W N W的T-S O D、C A T和G S H-P x的活力分别为(162.25±3.14)、(17.22±1.93)U/mg和(33.14±2.76)nmol/(min·mL);WN的T-SOD、CAT和GSH-Px的活力分别为(141.39±2.22)、(16.85±0.97)U/mg和(32.19±2.62)nmol/(min·mL);W A D的T-S O D、C A T和G S H-P x的活力分别为(157.32±1.98)、(19.74±3.78)U/mg和(35.69±1.24)nmol/(min·mL),较对应损伤组的酶活力均有极显著提高(P<0.01)。研究证明,GSH-Px能和SOD、CAT一起通过清除O2-·、H2O2防止·OH、1O2的产生,以减轻和阻断脂质过氧化作用同时GSH-Px还能还原脂质过氧化物,防止其均裂和引发脂质过氧化作用的链式支链反应以减少过氧化脂(lipid peroxide,LPO)的生成[31]。
IL-8是Yoshimura等[32]发现的第一个具有趋化功能的细胞因子。由于IL-8对于白细胞有趋化作用,所以在很多感染性疾病过程中其含量会升高,IL-8水平与心血管疾病、肝脏疾病、呼吸道疾病等疾病有关;细胞因子和氧化应激密切相关,在炎症感染的初期阶段,上皮细胞产生趋化因子,抗菌肽和氧自由基来调节细胞功能[33-36]。通过测定人外周血、尿液或细胞培养上清液中IL-8水平,可作为评判炎性疾病的临床指标。

图 5 蛋清源活性肽对HEK293细胞内IL-8分泌的影响
Fig. 5 Effect of peptides derived from egg white on IL-8 secretion in HEK293 cells
本实验中HEK293细胞经H2O2处理后,IL-8质量浓度较对照组细胞升高,差异具有显著性(P<0.05),加入1.0 μmol/L的蛋清源活性肽WNWAD、WNW、WN、WAD后,细胞中IL-8质量浓度不同程度地降低(图5)。蛋清源活性肽对于IL-8的分泌有一定的抑制作用。
本实验研究了蛋清源活性肽WNWAD、WNW、WAD、WN对H2O2诱导损伤的HEK293细胞的存活率、ROS水平、抗氧化酶活力和IL-8细胞因子分泌的影响。结果表明,蛋清源活性肽WNWAD、WNW、WAD、WN对H2O2诱导损伤的HEK293细胞具有保护作用,并且细胞存活率与活性肽浓度呈依赖型关系;活性肽降低了HEK293细胞内由H2O2引起的ROS水平;并且提高了T-SOD、CAT和GSH-Px的活力,对HEK293细胞中细胞因子IL-8的分泌有一定的抑制作用。以上结果显示蛋清源活性肽对降低HEK293细胞氧化应激水平、提高细胞抗氧化能力有一定影响。后续将对蛋清源活性肽的构效关系及具体的抑制氧化应激机理作进一步深入研究。
[1] HALLIWELL B, GUTTERIDGE J M. Oxygen free radicals and iron in relation to biology and medicine: some problems and concepts[J].Archives of Biochemistry and Biophysics, 1986, 246(2): 501-514.DOI:10.1016/0003-9861(86)90305-x.
[2] YANG B, XU Q Y, GUO C Y, et al. MHY1485 ameliorates UV-induced skin cell damages via activating mTOR-Nrf2 signaling[J]. Oncotarget, 2017, 8(8): 12775-12783. DOI:10.18632/oncotarget.14299.
[3] YOUN Y K, LALONDE C, DEMLING R. Oxidants and the pathophysiology of burn and smoke inhalation injury[J]. Free Radical Biology and Medicine, 1992, 12(5): 409-415.
[4] RICE-EVANS C A, DIPLOCK A T. Current status of antioxidant therapy[J]. Free Radical Biology and Medicine, 1993, 15(1): 77-96.DOI:10.1016/0891-5849(93)90127-g.
[5] WEI Y H, LEE H C. Oxidative stress, mitochondrial DNA mutation,and impairment of antioxidant enzymes in aging[J]. Experimental Biology and Medicine, 2002, 227(9): 671-682.
[6] MINE Y, KOVACS-NOLAN J. New insights in biologically active proteins and peptides derived from hen egg[J]. Worlds Poultry Science Journal, 2006, 62(1): 87-95. DOI:10.1079/wps200586.
[7] MEISEL H. Biochemical properties of regulatory peptides derived from milk proteins[J]. Biopolymers, 1997, 43(2): 119-128.DOI:10.1002/(sici)1097-0282(1997)43:2<119::aid-bip4>3.0.co;2-y.
[8] NAGAI T, NAGASHIMA T, ABE A. Antioxidative activities and angiotensin I-converting enzyme inhibition of extracts prepared from chum salmon (Oncorhynchus keta) cartilage and skin[J].International Journal of Food Properties, 2006, 9(4): 813-822.DOI:10.1080/10942910600620645.
[9] LEE H S, RYU H J, SONG H J, et al. Enzymatic preparation and antioxidant activities of protein hydrolysates from Protaetia brevitarsis Larvae[J]. Journal of the Korean Society of Food Science and Nutrition, 2017, 46(10): 1164-1170.
[10] RIPOLLÉS D, PARRÓN J A, CALVO M, et al. Antioxidant activity of co-products from milk fat processing and their enzymatic hydrolysates obtained with different proteolytic preparations[J]. International Dairy Journal, 2016, 60: 70-77. DOI:10.1016/j.idairyj.2016.02.031.
[11] QIN L, ZHU B W, ZHOU D Y, et al. Preparation and antioxidant activity of enzymatic hydrolysates from purple sea urchin(Strongylocentrotus nudus) gonad[J]. LWT-Food Science and Technology, 2011, 44(4): 1113-1118. DOI:10.1016/j.lwt.2010.10.013.
[12] MARINOVA M D, TCHORBANOV B P. Preparation of antioxidant enzymatic hydrolysates from honeybee-collected pollen using plant enzymes[J]. Enzyme Research, 2010, 2010: 1-5.DOI:10.4061/2010/415949.
[13] DONG X P, ZHU B W, ZHAO H X, et al. Preparation and in vitro antioxidant activity of enzymatic hydrolysates from oyster(Crassostrea talienwhannensis) meat[J]. International Journal of Food Science and Technology, 2010, 45(5): 978-984. DOI:10.1111/j.1365-2621.2010.02223.x.
[14] HEMANDEZ-LEDESMA B, DAVALOS A, BARTOLOME B, et al.Preparation of antioxidant enzymatic hydrolysates from (alphalactalbumin and beta-lactoglobulin. identification of active peptides by HPLC-MS/MS[J]. Journal of Agricultural and Food Chemistry, 2005,53(3): 588-593. DOI:10.1021/jf048626m.
[15] MINE Y. Egg proteins and peptides in human health-chemistry,bioactivity and production[J]. Current Pharmaceutical Design, 2007,13(9): 875-884. DOI:10.2174/138161207780414278.
[16] YOU S J, UDENIGWE C C, ALUKO R E, WU J. Multifunctional peptides from egg white lysozyme[J]. Food Research International,2010, 43(3): 848-855. DOI:10.1016/j.foodres.2009.12.004.
[17] JI N, SUN C X, ZHAO Y X, et al. Purification and identification of antioxidant peptides from peanut protein isolate hydrolysates using UHR-Q-TOF mass spectrometer[J]. Food Chemistry, 2014, 161: 148-154. DOI:10.1016/j.foodchem.2014.04.010.
[18] SAKANAKA S, TACHIBANA Y, ISHIHARA N, et al. Antioxidant activity of egg-yolk protein hydrolysates in a linoleic acid oxidation system[J]. Food Chemistry, 2004, 86(1): 99-103. DOI:10.1016/j.foodchem.2003.08.014.
[19] TANZADEHPANAH H, ASOODEH A, CHAMANI J. An antioxidant peptide derived from ostrich (Struthio camelus) egg white protein hydrolysates[J]. Food Research International, 2012, 49(1): 105-111.DOI:10.1016/j.foodres.2012.08.022.
[20] REN Y, WU H, LI X F, et al. A two-step, one-pot enzymatic method for preparation of duck egg white protein hydrolysates with high antioxidant activity[J]. Applied Biochemistry and Biotechnology,2014, 172(3): 1227-1240. DOI:10.1007/s12010-013-0578-3.
[21] DAVALOS A, MIGUEL M, BARTOLOME B, et al. Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis[J]. Journal of Food Protection, 2004, 67(9): 1939-1944.DOI:10.4315/0362-028x-67.9.1939.
[22] FUJITA H, SASAKI R, YOSHIKAWA M. Potentiation of the antihypertensive activity of orally administered ovokinin, a vasorelaxing peptide derived from ovalbumin, by emulsification in egg phosphatidylcholine[J]. Bioscience, Biotechnology and Biochemistry,1995, 59(12): 2344-2345. DOI:10.1271/bbb.59.2344.
[23] RAJAPAKSE N, MENDIS E, JUNG W K, et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. Food Research International, 2005, 38(2):175-182. DOI:10.1016/j.foodres.2004.10.002.
[24] YOUNG D, FAN M Z, MINE Y. Egg yolk peptides up-regulate glutathione synthesis and antioxidant enzyme activities in a porcine model of intestinal oxidative stress[J]. Journal of Agricultural and Food Chemistry, 2010, 58(13): 7624-7633. DOI:10.1021/jf1011598.
[25] YU Z P, YIN Y G, ZHAO W Z, et al. Application and bioactive properties of proteins and peptides derived from hen eggs:opportunities and challenges[J]. Journal of the Science of Food and Agriculture, 2014, 94(14): 2839-2845. DOI:10.1002/jsfa.6670.
[26] SUN S G, NIU H H, YANG T, et al. Antioxidant and anti-fatigue activities of egg white peptides prepared by pepsin digestion[J].Journal of the Science of Food and Agriculture, 2014, 94(15): 3195-3200. DOI:10.1002/jsfa.6671.
[27] LIU Jingbo, CHEN Zhifei, HE Jing, et al. Anti-oxidative and antiapoptosis effects of egg white peptide, Trp-Asn-Trp-Ala-Asp, against H2O2-induced oxidative stress in human embryonic kidney 293 cells[J]. Food and Function, 2014, 5(12): 3179-3188. DOI:10.1039/c4fo00665h.
[28] WANG L Y, DING L, WANG Y, et al. Isolation and characterisation of in vitro and cellular free radical scavenging peptides from corn peptide fractions[J]. Molecules, 2015, 20(2): 3221-3237. DOI:10.3390/molecules20023221.
[29] AFRI M, FRIMER A A, COHEN Y. Active oxygen chemistry within the liposomal bilayer part IV: locating 2’,7’-dichlorofluorescein (DCF),2’,7’-dichlorodihydrofluorescein (DCFH) and 2’,7’-dichlorodihydro fluorescein diacetate (DCFH-DA) in the lipid bilayer[J]. Chemistry and Physics of Lipids, 2004, 131(1): 123-133. DOI:10.1016/j.chemphyslip.2004.04.006.
[30] LEBEL C P, ISCHIROPOULOS H, BONDY S C. Evaluation of the probe 2’,7’-dichlorofluorescin as an indicator of reactive oxygen species formation and oxidative stress[J]. Chemical Research in Toxicology, 1992, 5(2): 227-231. DOI:10.1021/tx00026a012.
[31] HWANG S L, YEN G C. Modulation of Akt, JNK, and p38 activation is involved in citrus fl avonoid-mediated cytoprotection of PC12 cells challenged by hydrogen peroxide[J]. Journal of Agricultural and Food Chemistry, 2009, 57(6): 2576-2582. DOI:10.1021/jf8033607.
[32] YOSHIMURA T, MATSUSHIMA K, OPENHEIM J J, et al.Neutrophil chemotactic factor produced by lipopolysaccharide(LPS)-stimulated human blood mononuclear leukocytes: partial characterization and separation from interleukin 1 (IL 1)[J]. Journal of Immunology, 1987, 139(3): 788-793.
[33] YOON J, LIM J W, KIM H. Alpha-lipoic acid inhibits IL-8 expression by reducing oxidative stress in ataxia telangiectasia fibroblasts[J].FASEB Journal, 2017, 31: lb426.
[34] KASHIWAGI Y, TAKEDACHI M, MORI K, et al. High glucoseinduced oxidative stress increases IL-8 production in human gingival epithelial cells[J]. Oral Diseases, 2016, 22(6): 578-584. DOI:10.1111/odi.12502.
[35] ASHOUR A E, AHMED A F, KUMAR A, et al. Thymoquinone inhibits growth of human medulloblastoma cells by inducing oxidative stress and caspase-dependent apoptosis while suppressing NF-kappa B signaling and IL-8 expression[J]. Molecular and Cellular Biochemistry,2016, 416(1/2): 141-155. DOI:10.1007/s11010-016-2703-4.
[36] KIM N, LIM J W, KIM H. Protective role of HSP70 against oxidative stress-mediated IL-8 expression in ataxia telangiectasia fibroblasts received glutamine deficiency[J]. Free Radical Biology and Medicine,2015, 86: S22. DOI:10.1016/j.freeradbiomed.2015.07.085.
Effects of Egg White-Derived Bioactive Peptide on Antioxidative Enzyme Activities and IL-8 Secretion in HEK293 Cells under Oxidative Stress Induced by Hydrogen Peroxide
ZHANG Yan, HU Rong, ZHENG Jian, et al. Effects of egg white-derived bioactive peptide on antioxidative enzyme activities and IL-8 secretion in HEK293 cells under oxidative stress induced by hydrogen peroxide[J]. Food Science, 2019,40(5): 130-136. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20171103-035. http://www.spkx.net.cn