表 1 UPLC/ESI-IT-TOF/MS流动相梯度
Table 1 Mobile phase gradient program for UPLC/ESI-IT-TOF/MS
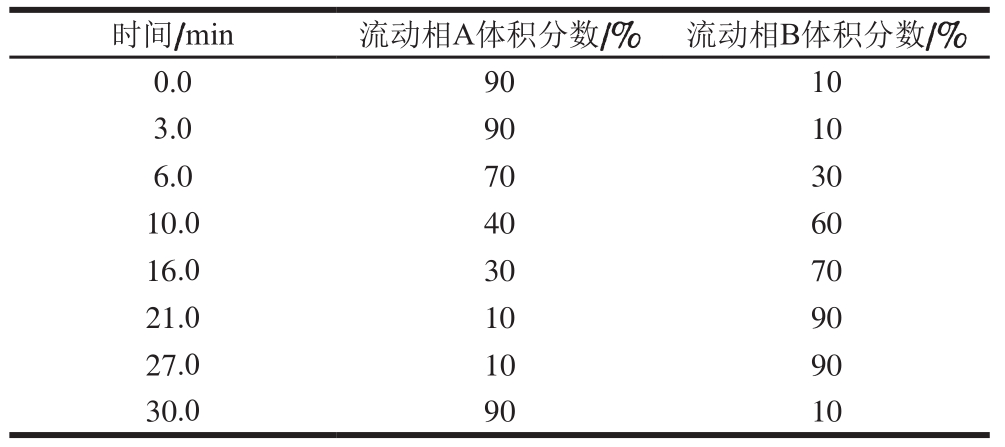
时间/min 流动相A体积分数/% 流动相B体积分数/%0.0 90 10 3.0 90 10 6.0 70 30 10.0 40 60 16.0 30 70 21.0 10 90 27.0 10 90 30.0 90 10
众所周知,高脂饮食不仅会使血浆胆固醇水平升高,还会促进动脉粥样硬化的生成,对人体心脑血管的健康有着极大的威胁。高脂血症是包括血清总胆固醇、甘油三酯、低密度脂蛋白胆固醇水平升高,高密度脂蛋白胆固醇水平降低的血脂代谢紊乱性疾病,是常见的代谢和内分泌疾病之一。高脂血症与动脉粥样硬化、糖尿病、非酒精性脂肪肝等疾病的发生、发展关系密切,是心脑血管疾病的主要危险因素之一。研究发现,多种植物蛋白如杏仁蛋白[1]、大豆蛋白[2]、燕麦蛋白[3]等,均具有降血脂功效。Shen Kuoping等[4]的研究表明膳食蛋白质摄入量与血清总胆固醇降低比例呈极显著负相关(r=-0.419,P<0.01),植物蛋白的摄入量与血清总胆固醇下降比例呈极显著正相关(r=0.521,P<0.01)。
苦荞作为“药食兼用”类绿色食品的典型代表,具有较高的营养价值和药用价值,是亚洲和中东欧人们的传统作物[5-6]。苦荞籽粒中含蛋白16%~20%(质量分数,下同),苦荞蛋白为结合蛋白,其中含有蛋白质65.8%、脂类22.0%、非纤维碳水化合物5.9%和3.1%的水分[7]。Javornik等[8]研究表明,苦荞蛋白含清蛋白18%、球蛋白43%、谷蛋白38%,而醇溶蛋白仅占1%,正是由于醇溶蛋白含量极少,使得苦荞蛋白安全性高,成为消费者可以信赖的食物。并且苦荞蛋白所含氨基酸种类齐全且组成合理,8 种必需氨基酸含量丰富,尤其是精氨酸、赖氨酸、色氨酸、组氨酸含量较高;因此苦荞蛋白的利用率(81.3%)比其他谷物(小麦(42%)、燕麦(57%))都高[9]。同时,苦荞蛋白是苦荞的主要生物活性成分,研究表明,不同苦荞蛋白组分均具有不同程度的降血脂功能,其中清蛋白降血脂功能最强,其次为球蛋白,谷蛋白最弱[10]。同大豆分离蛋白和酪蛋白相比,苦荞蛋白有显著的降低肝胆固醇[11]、清除自由基[12]、抑制癌细胞增殖[13]等作用。
代谢组学是系统生物学的一个重要分支,以相对分子质量小于1 000的内源性代谢物为研究对象,通过考察生物体系受到刺激或干扰前后的内源性代谢物的变化来研究生物体系代谢途径的一门科学[14-15]。目前,代谢组学在食品和营养科学领域的应用越来越广泛[16-18]。尤其是在对以天然产物为基础开发的功能性食品作用机制研究中起到了非常重要的作用[19]。代谢组学研究主要包括代谢物分析和数据分析两部分,其中,代谢物分析所使用的技术主要包括核磁共振波谱、质谱、色谱和光谱分析技术等;数据分析主要分为两类,即监督分析法和非监督分析法[20]。主要包括数据采集、原始数据前处理、以及借助生物信息学软件对获得的大量多维复杂数据进行降维处理并获取相关信息,找出反映样品内在机理及整体性差异的生物标志物。本实验采用超高效液相色谱电喷雾电离串联离子阱飞行时间质谱(ultra performance liquid chromatography-electron spray ionization tandemion trap-time-of-flight mass spectrometry,UPLC/ESI-ITTOF/MS)技术对高脂膳食小鼠的血浆样品进行分析与测定,并通过偏最小二乘法判别分析(partial least squaresdiscriminate analysis,PLS-DA)模式结合代谢组网络数据库,寻找苦荞蛋白饮食干预小鼠潜在的生物标志物及作用的代谢通路。从代谢组学角度探讨高脂小鼠被干预的代谢通路,从而初步探究苦荞蛋白发挥降血脂功效的作用机制。
SPF级C57BL/6小鼠,4 周龄,雄性,体质量14~16 g,购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2007-0005。
苦荞粉 山西雁门清高有限公司;乙腈、甲醇、甲酸(均为色谱纯) 美国赛默飞世尔公司。超纯水由PURELAB Classic纯水机制得。
UPLC/ESI-IT-TOF/MS联用仪(含两个Nexera X2系列LC-30AD泵、Nexera X2系列SIL-30AC型自动进样器、DGU-20A 5R在线脱气机、CTO-20AC柱温箱、CBM-20A系统控制器、SPD-M20A检测器,LCMS solution Version 3.40工作站,Profiling solution数据处理软件) 日本岛津公司;FD-80冷冻干燥机 北京博医康实验仪器有限公司;MDF-1156型超低温(-152 ℃)冰箱 日本松下公司;PURELAB Classic纯水机 英国ELGA公司;3-18K台式高速冷冻离心机 德国Sigma公司。
1.3.1 苦荞蛋白粉制备
苦荞粉经石油醚脱脂24 h后,自然风干。按苦荞粉与蒸馏水质量比1∶10混合溶解,NaOH溶液调节pH值至8,磁力搅拌2 h,5 000 r/min离心20 min,取上清液。取得的上清液用HCl溶液调节pH值至4.5,离心,取其沉淀物冷冻干燥24 h,得到苦荞蛋白粉(蛋白质量分数85%,水分质量分数10%,其他成分质量分数5%)。
1.3.2 UPLC/ESI-IT-TOF/MS条件
色谱柱为Shim-pack GIST C18(50 mm×3.0 mm,2.2 µm)。流动相A:0.1%(体积分数,下同)甲酸水溶液,流动相B:0.1%甲酸乙腈溶液,流速0.4 mL/min,柱温35 ℃,进样体积5 µL。梯度洗脱条件见表1[20]。
表 1 UPLC/ESI-IT-TOF/MS流动相梯度
Table 1 Mobile phase gradient program for UPLC/ESI-IT-TOF/MS

时间/min 流动相A体积分数/% 流动相B体积分数/%0.0 90 10 3.0 90 10 6.0 70 30 10.0 40 60 16.0 30 70 21.0 10 90 27.0 10 90 30.0 90 10
用正离子模式采集数据,雾化气速率1.5 L/min,干燥气压强0.2 MPa,检测电压1.52 kV,界面电压:正极4.5 kV、负极-3.5 kV,CDL及加热部件温度200 ℃,离子累积时间20 ms,质量扫描范围m/z 100~1 000[4]。
1.3.3 实验动物及模型的建立
以AIN-93G标准饲料预饲1 周,按体质量随机分为3 组,每组9 只:对照组饲喂AIN-93G标准饲料;高脂组饲喂含有10%(质量分数,下同)脂肪、1%胆固醇和0.5%胆酸钠的AIN-93G标准饲料;苦荞蛋白组在高脂组饲料的基础上用苦荞蛋白粉替代酪蛋白,且苦荞蛋白质量分数为20%。将小鼠同室且分笼饲养,进行自然光照,并自由饮食和饮水,环境温度控制在(22±2)℃,相对湿度为40%~60%。
1.3.4 样品的采集与预处理
饲养6 周后,小鼠在代谢笼中饲养12 h(在此期间小鼠禁食不禁水),称体质量,用乙醚对小鼠进行麻醉,眼球取血,血液立即放入预先用肝素钠处理的离心管内离心(4 ℃、4 000 r/min,15 min),取上清血浆,并保存在-150 ℃的冰箱中待测。
分析前将血浆样品于37 ℃解冻,解冻后取血浆200 μL,加甲醇600 μL,漩涡振荡30 s,13 000 r/min离心10 min,取上清液,N2吹干,残渣用体积分数80%乙腈200 μL溶解,漩涡振荡30 s,13 000 r/min离心10 min,取上清液进样检测[21]。
UPLC/ESI-IT-TOF/MS采集的数据经过Profiling Solution软件进行峰提取和峰匹配,所得数据集经过峰面积归一化及80%规则处理后导入SIMCA-P 11.0软件进行有监督的PLS-DA分析。相应的参数(R2Y、Q2等)用以考察模型的有效性,表示PLS-DA模型构建过程中所能解释变量数据的比例,R2Y表示模型的解释率,Q2表示模型的可预测度,它们的大小直接反映了该模型的可靠程度[22-23]。使用SPSS 16.0软件进行统计学处理,3 组间采用t检验,检验标志性代谢物组间差异的显著性。P<0.05表示差异显著。

图 1 UPLC/ESI-IT-TOF/MS采集的血浆样品典型总离子流图
Fig. 1 Typical total ion current chromatogram for plasma obtained from UPLC/ESI-IT-TOF/MS
采用UPLC/ESI-IT-TOF/MS仪器在正离子模式下采集血浆样品的代谢信息,图1为正离子模式下血浆样品的典型总离子流图。从总离子流图上可以直观地观察出LC图谱上的差异,提示对照组、高脂组与苦荞蛋白组小鼠在总体代谢上具有一定的差别。但是,这种直观上的差异还有待于进一步的数据分析,以探寻3 组小鼠所表现差别的生物学基础;因此,使用Profiling Solution软件对所采集的3 组27 个血浆样品的数据进行峰提取、峰匹配及归一化等处理。

图 2 基于UPLC/ESI-IT-TOF/MS分析的正离子模式下对照组、高脂膳食组和苦荞蛋白膳食组血浆代谢物PLS-DA得分图(A)和因子载荷图(B)
Fig. 2 PLS-DA analysis based on UPLC/ESI-IT-TOF/MS data of plasma samples in control, high-fat diet and TBP-treatedgroups under positive ion mode: PLS-DA score plot (A); PLS-DA loading plot (B)
由图2A可以看出,3 组小鼠的血浆代谢产物之间存在差异。PLS-DA图形显示苦荞蛋白组小鼠的空间分布较为分散,可能与苦荞蛋白组小鼠的代谢之间存在较大的个体差异有关,同时说明代谢组学方法具有准确反映个体代谢特征的优点。高脂模型组的代谢物远离对照组小鼠的血浆代谢产物,而苦荞蛋白组小鼠的血浆代谢产物更接近于对照组,说明高脂组小鼠给予苦荞蛋白后对高脂小鼠的异常代谢轮廓有的调节作用,使其更趋近于正常组。其中,正离子模式下,PLS-DA模型的R2Y和Q2分别为0.908和0.767,表明该模型是可靠的。
在图2B中,每一个点代表一个变量,离原点最远的代谢物是潜在的差异性物质,这些化合物可能是造成模型组和苦荞蛋白组小鼠血浆代谢产物差异的主要成分。变量对分类的重要程度(variable importance in the projection,VIP)由其值的大小来衡量,并依据VIP值对变量进行筛选。VIP大于1且具有统计学意义(P<0.05)的变量被认为对模型有显著贡献。因此将具有统计学意义(P<0.05)和VIP大于1的代谢物定义为潜在生物标志物[24-25]。3 组间差异方向上,距离中心越远的点对差异的贡献度越大,越有可能是潜在的特征代谢物。
将潜在的生物标志物根据其质谱数据,在公共数据库HMDB(http://www.hmdb.ca/)、METLIN(http://www.metlin.scipps.edu/)、KEGG(http://www.genome.jp/kegg/)和SMPD(http://www.smpdb.ca/)中进行检索和确认,并与文献进行比较,共鉴定出12 个潜在的生物标志物(表2)。包括亚油酸、胞苷二磷酸(cytidine diphosphate,CDP)甘油、磷脂酰乙醇胺、半乳糖神经酰胺、脑苷脂、葡糖神经酰胺、磷脂酰胆碱(phosphatidylcholine,PC)、葡糖苷酸、前列腺素G2、溶血磷脂酸(lysophosphatidic acid,LPA)、溶血磷脂酰胆碱(lysophosphatidylcholines,LysoPCs)、鞘磷脂。其中前6 种代谢产物的含量在高脂组小鼠较对照组均显著降低(P<0.05),而PC、葡糖苷酸、前列腺素G2的含量与对照组相比均显著升高(P<0.05)。
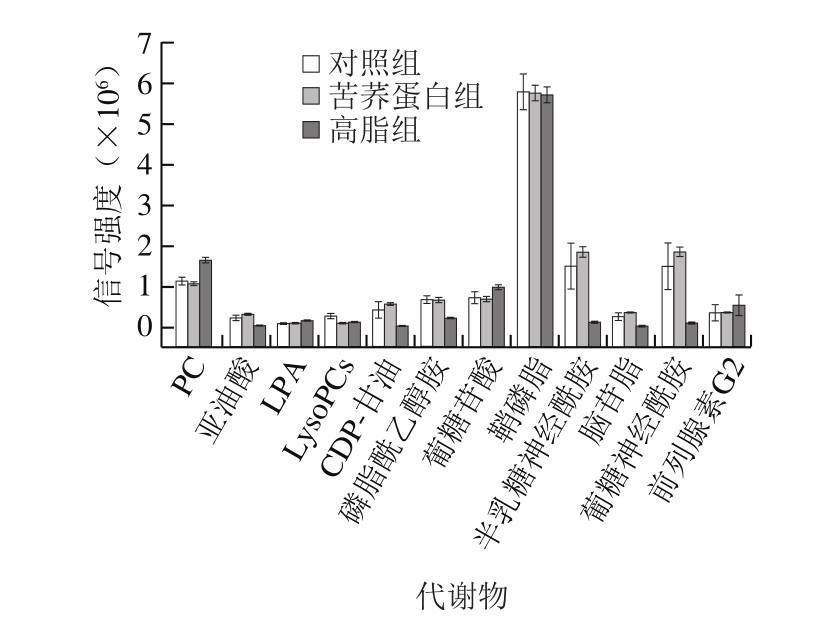
图 3 差异代谢物在3 组小鼠血浆中的含量水平
Fig. 3 Levels of differential metabolites in mouse plasma in three groups
图3为上述差异代谢物在3 组小鼠血浆中的含量比较。苦荞蛋白对差异代谢物的调节情况,除了LysoPCs的含量仍与高脂组接近,其余11 种差异代谢物含量均趋向对照组小鼠的代谢水平变化。以上研究结果表明,高脂膳食引起的代谢紊乱由于苦荞蛋白的干预得到了改善。
表 2 对区分对照组、高脂组、苦荞蛋白组小鼠有显著贡献的差异代谢物
Table 2 Differential plasma metabolites discriminating control,high-fat diet and TBP-treated mice
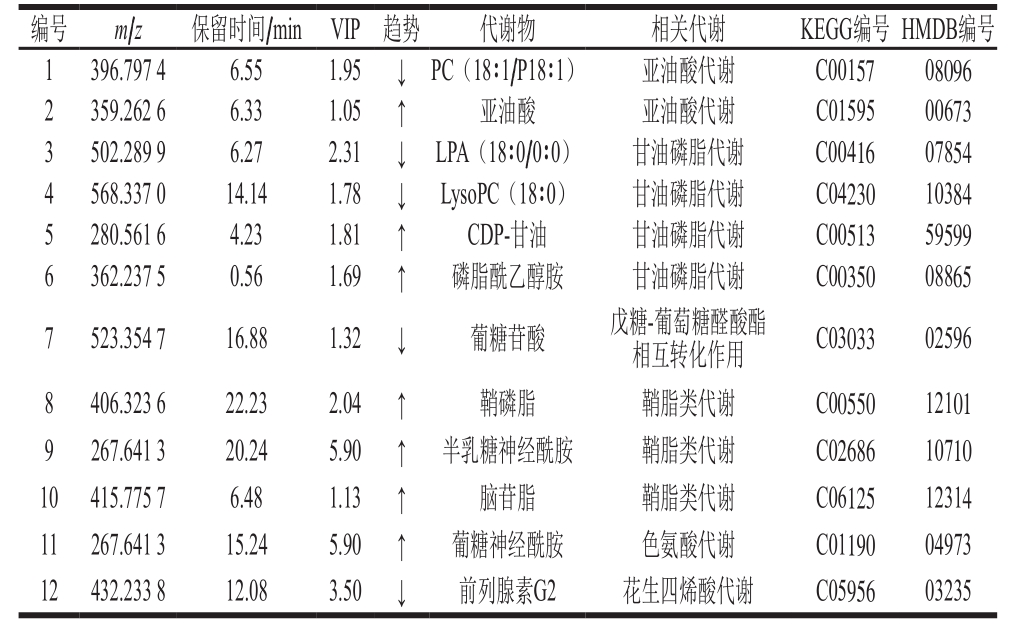
注:↑.与高脂组相比上调;↓.与高脂组相比下调。
编号 m/z 保留时间/min VIP 趋势 代谢物 相关代谢 KEGG编号 HMDB编号1 396.797 4 6.55 1.95 ↓ PC(18∶1/P18∶1) 亚油酸代谢 C00157 08096 2 359.262 6 6.33 1.05 ↑ 亚油酸 亚油酸代谢 C01595 00673 3 502.289 9 6.27 2.31 ↓ LPA(18∶0/0∶0) 甘油磷脂代谢 C00416 07854 4 568.337 0 14.14 1.78 ↓ LysoPC(18∶0) 甘油磷脂代谢 C04230 10384 5 280.561 6 4.23 1.81 ↑ CDP-甘油 甘油磷脂代谢 C00513 59599 6 362.237 5 0.56 1.69 ↑ 磷脂酰乙醇胺 甘油磷脂代谢 C00350 08865 7 523.354 7 16.88 1.32 ↓ 葡糖苷酸 戊糖-葡萄糖醛酸酯相互转化作用 C03033 02596 8 406.323 6 22.23 2.04 ↑ 鞘磷脂 鞘脂类代谢 C00550 12101 9 267.641 3 20.24 5.90 ↑ 半乳糖神经酰胺 鞘脂类代谢 C02686 10710 10 415.775 7 6.48 1.13 ↑ 脑苷脂 鞘脂类代谢 C06125 12314 11 267.641 3 15.24 5.90 ↑ 葡糖神经酰胺 色氨酸代谢 C01190 04973 12 432.233 8 12.08 3.50 ↓ 前列腺素G2 花生四烯酸代谢 C05956 03235
将表2中鉴定出的标志物输入MetPA(http://metpa.metabolomics.ca./MetPA/faces/Home.jsp)数据库中,构建分析代谢通路。代谢通路影响值的临界值设置为0.1[26-27],高于此值,将会被选择作为潜在的靶标路径。

图 4 通过MetPA得到的通路分析概要图
Fig. 4 Summary of pathway analysis with MetPA
a.亚油酸代谢;b.甘油磷脂代谢;c.鞘脂类代谢;d.戊糖-葡萄糖醛酸酯相互转化作用;e.色氨酸代谢;f.花生四烯酸代谢。横坐标通路影响值表示几种物质对通路的影响总和,纵坐标表示几种物质在通路中的统计学意义,横坐标值越大的通路气泡越大,纵坐标值越大气泡颜色越深。
由图4可知,由高脂膳食诱导的小鼠代谢紊乱主要与亚油酸代谢、甘油磷脂代谢、鞘脂类代谢、色氨酸代谢、花生四烯酸代谢、糖代谢6 条代谢通路相关。在苦荞蛋白饮食干预组中,代谢通路的紊乱均得到改善,在代谢层面验证了苦荞蛋白对由高脂膳食诱导的代谢紊乱有较好的治疗作用。
由表2和图4可知,鉴定的12 个标志物中,PC和亚油酸主要参与亚油酸代谢;LPA、LysoPCs、CDP-甘油和磷脂酰乙醇胺主要参与甘油磷脂代谢;葡糖苷酸主要参与戊糖-葡萄糖醛酸酯转化反应;鞘磷脂、半乳糖神经酰胺和脑苷脂主要参与鞘脂类代谢;葡糖神经酰胺主要参与色氨酸代谢;前列腺素和PC主要参与花生四烯酸代谢。其中,亚油酸代谢、甘油磷脂代谢通路影响值相对较高,分别为1和0.472 53;戊糖-葡萄糖醛酸酯相互转化作用和鞘脂类代谢影响值次之,其值分别为0.2、0.195 49;色氨酸代谢和花生四烯酸代谢影响值分别为0.177 15、0.106 23。
亚油酸属于多不饱和脂肪酸。脂肪酸不仅参与机体能量代谢及细胞膜、信号分子等合成,而且某些脂肪酸对于基因表达、细胞增殖和分化起重要作用,可作为脂类代谢异常的生物标志物[28]。如表2所示,苦荞蛋白干预饮食后,亚油酸含量相对于对照组和高脂组有所升高,且苦荞蛋白组亚油酸含量更接近对照组。这与亚油酸可降低小鼠体质量、血脂水平,升高血清脂蛋白脂酶、肝脂酶和总脂酶活性,发挥预防高脂血症发生的作用的研究结果一致[29]。
血浆甘油的变化很可能是由于脂肪酶从富含甘油三酯的颗粒中释放及甘油、甘油三酯、极低密度脂蛋白之间的相互作用引起的[30]。甘油磷脂除了构成生物膜外,还是胆汁和膜表面活性物质等的成分之一。甘油磷脂代谢紊乱与血脂异常等代谢性疾病、动脉粥样硬化和糖尿病等多种疾病相关[31]。甘油磷脂的生物合成是由TagF聚合酶等催化合成的,而最近的研究发现,CDP-甘油作为一种受体来激活TagF聚合酶的活性,从而促进甘油磷脂的生物合成。由表2可知,苦荞蛋白组CDP-甘油的含量相比高脂组显著升高,因此,苦荞蛋白可能通过激活TagF聚合酶的活性,从而发挥调节高脂血症的作用。
PC能使血浆中胆固醇水平降低20%。研究表明,PC是很少能增加血浆高密度脂蛋白胆固醇的物质之一[32]。苦荞蛋白干预饮食后,小鼠体内的PC较高脂膳食组小鼠含量降低。
LysoPCs包括LysoPC(14∶0)、LysoPC(15∶0)、LysoPC(18∶0)、LysoPC(18∶1)、LysoPC(17∶0)、LysoPC(20∶2)和LysoPC(20∶1)。LysoPCs是细胞膜与介导信号转导的基本组成部分。LysoPCs水平可作为揭示病理生理学变化的临床诊断指标。大量研究证明脂质代谢紊乱在高脂血症的发生和发展中起着关键性的致病作用。LysoPCs在许多疾病,包括炎症、动脉粥样硬化、糖尿病,癌症和血脂紊乱的进展中发挥重要作用,此研究中,与对照组相比,高脂饮食喂养的小鼠LysoPC(18∶0)水平显著降低,这与Jin Shuna[33]和Li Sen[34]等的报道一致。在高脂饲料喂养小鼠的LysoPCs水平变化可能与高脂血症的发病机制有关,可以作为潜在的生物标志物。有报道称,血脂水平和LysoPCs之间复杂的相互作用[35]。因此,推测苦荞蛋白对LysoPCs的作用可能有助于降低血脂水平,有待今后进一步研究证实。此外,LysoPCs是一个重要的活性分子,有多种生物学功能,可通过特异性受体介导单核细胞/巨噬细胞的信号传导途径[36-37],因此它可能参与了高脂饮食诱导的炎症反应。
PA和LPA是细胞内和细胞外信号转导的重要磷脂信号分子。它们主要通过磷脂酶D和磷脂酶C两条途径产生,并且PA在磷脂酶A2的催化下可水解生成LPA。与高脂小鼠相比,苦荞蛋白组小鼠体内的LPA含量有所下降(表2)。因此,推测苦荞蛋白降血脂功效可能与磷脂酶D和磷脂酶C表达有关。
戊糖和葡萄糖醛酸转换通路与扼合反应有关。葡萄糖醛酸扼合反应与机体内多种外源和内源性化合物的清除相关,并且在多种药物及其氧化代谢产物、体内毒物、内源性激素、胆酸的代谢清除中发挥着重要作用。在本实验中,苦荞蛋白可能是通过对肝脏戊糖和葡萄糖醛酸转换通路的调控,进而发挥相应的降脂作用。
鞘脂是组成真核细胞膜成分的一类脂质,对于维持细胞膜结构十分重要。鞘脂是众所周知的具有生物活性的脂类,是作为细胞内外调节生理细胞信号传递过程的介质[38]。本实验中,苦荞蛋白对鞘磷脂的水平起到一定调节作用,使其含量更接近对照组(表2)。形成大量鞘脂的鞘脂代谢通路是一个复杂的反应网络,并且以神经酰胺为代谢的中心。神经酰胺首先可以从丝氨酸和棕榈酰辅酶A产生3-酮基二氢鞘氨醇,然后形成二氢(神经)鞘氨醇,二氢(神经)鞘氨醇被神经酰胺合酶酰化成二氢神经酰胺然后经过二氢脱氢酶催化,最后产生神经酰胺;其次,通过鞘磷脂是被鞘磷脂酶水解释放磷酸胆碱和神经酰胺[39-40]。由此,推测苦荞蛋白可能是通过影响神经酰胺的合成从而影响小鼠血脂水平。鞘脂的合成与控制细胞脂质动态平衡的转录因子和调节蛋白相关[41]。鞘脂类合成的代谢物如神经酰胺和鞘氨醇等影响胆固醇外排及调节血浆高密度脂蛋白浓度的机制。磷脂的降低导致细胞膜流动性下降,从而减少和影响细胞间和细胞外基质之间物质的交换[42]。胆碱是磷酰胆碱的重要前体,是组成和分泌极低密度脂蛋白的必要成分。因此,缺乏胆碱会导致肝脏中甘油三酯的积累,引起肝脏脂肪变性[43]。
前列腺素G2是一种炎症介质,由表2可知,在苦荞蛋白干预后,小鼠体内的前列腺素G2含量较高脂组有所下调。前列腺素可以通过环氧合酶产生花生四烯酸,花生四烯酸是最具有生物活性的n-6多不饱和脂肪酸。因此可以推测,苦荞蛋白可以缓解由高脂膳食诱导的机体炎症反应,并进一步改善花生四烯酸的代谢。
本实验采用基于UPLC/ESI-IT-TOF/MS技术的代谢组学方法,并结合多元统计学研究了高脂膳食诱导小鼠在苦荞蛋白干预下的血浆代谢变化,初步筛选出和高脂血症相关的12 种潜在的生物标志物及其参与的6 条代谢通路,进而初步揭示了喂食苦荞蛋白后对高脂小鼠代谢紊乱干预的作用机制。结果表明,高脂膳食诱导小鼠血浆代谢谱发生了显著性变化,苦荞蛋白可通过升高小鼠血浆中亚油酸含量抑制高脂膳食诱导小鼠体内的亚油酸代谢,降低LPA、LysoPCs含量,升高CDP-甘油和磷脂酰乙醇胺含量,使得甘油磷脂代谢得到明显改善,通过调节鞘磷脂、半乳糖神经酰胺和脑苷脂含量从而调节鞘脂类代谢,并且苦荞蛋白可能调控戊糖和葡萄糖醛酸转换通路、缓解由高脂膳食诱导的机体炎症反应,进而预防或抑制高脂血症的形成。
[1] 解春艳, 李丛胜, 路艳霞, 等. 苦杏仁蛋白提取条件优化及加工特性研究[J]. 食品科技, 2015, 40(2): 294-298. DOI:10.13684/j.cnki.spkj.2015.02.060.
[2] 孙青山, 王常青, 张生万, 等. 小米油复合饮料降血脂作用的实验研究[J]. 食品工业科技, 2016, 37(17): 332-334; 339. DOI:10.13386/j.issn1002-0306.2016.17.056.
[3] 李笑蕊. 8 种代表性燕麦品种降血脂、抗氧化作用的评价研究[D].天津: 天津科技大学, 2016: 4-20.
[4] SHEN Kuoping, HAO Chilong, YEN H W, et al. Pre-germinated brown rice prevented high fat diet induced hyperlipidemia through ameliorating lipid synthesis and metabolism in C57BL/6J mice[J].Journal of Clinical Biochemistry & Nutrition, 2016, 59(1): 39-44.DOI:10.3164/jcbn.15-117.
[5] 聂薇, 李再贵. 苦荞麦营养成分和保健功能[J]. 粮油食品科技, 2016,24(1): 40-45. DOI:10.16210/j.cnki.1007-7561.2016.01.010.
[6] 熊德珍, 毛金祥. 浅析我国苦荞资源的前景[J]. 农业科技与信息,2016(11): 21. DOI:10.15979/j.cnki.cn62-1057/s.2016.11.012.
[7] TOMOTAKE H, SHIMAOKA I, KAYASHITA J, et al.Physicochemical and functional properties of buckwheat protein product[J]. Journal of Agricultural and Food Chemistry, 2002, 50(7):2125-2129. DOI:10.1021/jf011248q.
[8] JAVORNIK B, EGGUM B, KREFT I. Studies on protein fractions and protein quality of buckwheat[J]. Genetika, 1981, 13: 115-121.DOI:10.1021/jf011248q.
[9] 田斌. 荞麦蛋白酶解产物及其体外抗氧化研究[D]. 西安: 陕西科技大学, 2008: 9-11.
[10] 王世霞. 甜荞和苦荞降血脂及抗氧化作用的差异化研究[D]. 天津:天津科技大学, 2016: 6-8.
[11] KAYASHITA J, SHIMAOKA I, NAKAJYOH M. Hypocholesterolemic effect of buckwheat protein extract in rats fed cholesterol enriched diets[J]. Nutrition Research, 1995, 15(5): 691-698. DOI:10.1016/0271-5317(95)00036-I.
[12] 张美莉, 赵广华, 胡小松. 荞麦蛋白和类黄酮提取物清除自由基的ESR研究[J]. 营养学报, 2005, 27(1): 21-24. DOI:10.13325/j.cnki.acta.nutr.sin.2005.01.007.
[13] KAEWKON W, AONSRI C, TIYABOONCHAI W, et al. Sericin consumption suppresses development and progression of colon tumorigenesis in 1,2-dimethylhydrazine-treated rats[J]. Biologia, 2012,67(5): 1007-1012. DOI:10.2478/s11756-012-0093-y.
[14] NICHOLSON J K, LINDON J C, HOLMES E. ‘Metabonomics’:understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29(11):1181-1189. DOI:10.1080/004982599238047.
[15] FIEHN O, KOPKA J, DÖRMANN P, et al. Metabolite profiling for plant functional genomics[J]. Nature Biotechnology, 2000, 18(11):1157-1161. DOI:10.1038/81137.
[16] 罗朵生, 李坤平, 朴胜华, 等. 高脂血症大鼠病程进展的尿液代谢组学研究[J]. 广东药学院学报, 2016, 32(2): 223-227. DOI:10.16809/j.cnki.1006-8783.2016012001.
[17] 胡传芹, 张雨, 王静. 代谢组学在个性化功能性食品研究中的应用[J]. 食品工业科技, 2017, 38(1): 386-390. DOI:10.13386/j.issn1002-0306.2017.01.069.
[18] ROWLAND A, MINERS J O, MACKENZIE P I. The UDP-glucuronosyltransferases: their role in drug metabolism and detoxification[J]. International Journal of Biochemistry & Cell Biology, 2013, 45(6): 1121-1132. DOI:10.1016/j.biocel.2013.02.019.
[19] 缪璐欢, 杜静芳, 白凤翎, 等. 代谢组学在发酵食品有毒代谢产物分析中的研究进展[J]. 食品工业科技, 2016, 37(5): 388-393.DOI:10.13386/j.issn1002-0306.2016.05.071.
[20] 任向楠, 梁琼麟. 基于质谱分析的代谢组学研究进展[J]. 分析测试学报, 2017, 36(2): 161-169. DOI:10.3969/j.issn.1004-4957.2017.02.002.
[21] 马红. 基于代谢组学技术的新疆哈萨克族食管鳞癌血浆特征代谢物及临床意义研究[D]. 乌鲁木齐: 新疆医科大学, 2014: 22-23.
[22] 申国安, 段礼新, 漆小泉. 植物代谢组学数据分析和数据库[J]. 生命科学, 2015, 27(8): 995-999. DOI:10.13376/j.cbls/2015138.
[23] 贾金萍, 张福生, 李震宇, 等. 基于1H-NMR代谢组学技术研究“杀青”对连翘化学成分的影响[J]. 中草药, 2016, 47(8): 1375-1381.DOI:10.7501/j.issn.0253-2670.2016.08.022.
[24] 赵小梅, 刘歆颖, 续畅, 等. 基于LC-MS代谢组学的雷公藤多苷致肝毒性生物标志物的初步筛查[J]. 中国中药杂志, 2015, 40(19): 3851-3858. DOI:10.4268/cjcmm20151927.
[25] 王昕泰, 杜丽娜, 汪受传. 基于代谢组学的小儿腺病毒肺炎痰热闭肺证生物标志物研究思路[J]. 世界科学技术: 中医药现代化, 2015,17(10): 2177-2180. DOI:10.11842/wst.2015.12.040.
[26] 董宇, 俞忠明, 李洪玉, 等. 基于超高效液相色谱-高分辨质谱联用技术的桑黄干预后大鼠尿液代谢组学分析[J]. 色谱, 2016, 34(8): 811-816. DOI:10.3724/SP.J.1123.2016.04009.
[27] 李慧, 刘其南, 高叶, 等. 二至丸干预大鼠急性酒精肝损伤的尿液代谢组学研究[J]. 中国医院药学杂志, 2016, 36(19): 1665-1670.DOI:10.13286/j.cnki.chinhosppharmacyj.2016.19.12.
[28] 闫翠环, 王亚利, 王鑫国, 等. 卫气虚相关血浆代谢标志物的季节性变化研究[J]. 中国中医药信息杂志, 2017, 24(1): 66-70.DOI:10.3969/j.issn.1005-5304.2017.01.017.
[29] ZHU L L, GE G B, LIU Y, et al. Characterization of UDP-glucuronosyltransferases involved in glucuronidation of diethylstilbestrol in human liver and intestine[J]. Chemical Research in Toxicology, 2012, 25(12): 2663-2669. DOI:10.1021/tx300310k.
[30] LI X L, CHEN Y N, LIU J P, et al. Serum metabolic variables associated with impaired glucose tolerance induced by high-fathigh-cholesterol diet in Macaca mulatta[J]. Experimental Biology &Medicine, 2012, 237(11): 1310-1321. DOI:10.1258/ebm.2012.012157.
[31] 周传波. 多烯磷脂酰胆碱对酒精性脂肪肝患者的临床疗效研究[J].国际医药卫生导报, 2016, 22(4): 532-534. DOI:10.3760/cma.j.issn.1007-1245.2016.04.030.
[32] SCHERTZER J W, BROWN E D. Use of CDP-glycerol as an alternate acceptor for the teichoic acid polymerase reveals that membrane association regulates polymer length[J]. Journal of Bacteriology, 2008,190(21): 6940-6947. DOI:10.1128/JB.00851-08.
[33] JIN Shuna, SONG Chengwu, LI Sen, et al. Preventive effects of turmeric on the high-fat diet-induced hyperlipidaemia in mice associated with a targeted metabolomic approach for the analysis of serum lysophosphatidylcholine using LC-MS/MS[J]. Journal of Functional Foods, 2014, 11: 130-141. DOI:10.1016/j.jff.2014.09.016.
[34] LI Sen, JIN Shuna, SONG Chengwu, et al. The metabolic change of serum lysophosphatidylcholines involved in the lipid lowering effect of triterpenes from Alismatis rhizoma on high-fat diet induced hyperlipidemia mice[J]. Journal of Ethnopharmacology, 2016, 177:10-18. DOI:10.1016/j.jep.2015.11.017.
[35] ZHAO Y Y, MIAO H, CHENG X L, et al. Lipidomics: novel insight into the biochemical mechanism of lipid metabolism and dysregulation-associated disease[J]. Chemico-Biological Interactions,2015, 240: 220-238. DOI:10.1016/j.cbi.2015.09.005.
[36] OBACH R S. Pharmacologically active drug metabolites: impact on drug discovery and pharmacotherapy[J]. Pharmacological Reviews,2013, 65(2): 578-640. DOI:10.1124/pr.111.005439.
[37] 金姝娜. 基于组合LC-MS/MS技术的中药姜黄调节脂代谢紊乱活性及其成分姜黄素类化合物的全面表征和分离[D]. 武汉: 华中科技大学, 2015: 32-34.
[38] CHOI S, SNIDER A J. Sphingolipids in high fat diet and obesityrelated diseases[J]. Mediators of Inflammation, 2015, 2015: 1-12.DOI:10.1155/2015/520618.
[39] 易吉平, 曾明, 何兴轩. 鞘磷脂类信号通路在肺纤维化发病机制中的作用[J]. 中国药理学与毒理学杂志, 2016, 30(2): 158-164.DOI:10.3867/j.issn.1000-3002.2016.02.011.
[40] 王少媛, 张金兰, 张丹, 等. 鞘脂在肝脏疾病中的研究进展[J].药学学报, 2015, 50(12): 1551-1558. DOI:10.16438/j.0513-4870.2015.12.014.
[41] WORGALL T S. Lipid metabolism in cystic fibrosis[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2009, 12(2): 105-109. DOI:10.1097/MCO.0b013e32832595b7.
[42] SCHMITZ G, ORSÓ E. Intracellular cholesterol and phospholipid trafficking: comparable mechanisms in macrophages and neuronal cells[J]. Neurochemical Research, 2001, 26(8/9): 1045-1068.DOI:10.1023/A: 1012357106398.
[43] DUMAS M E, BARTON R H, TOYE A, et al. Metabolic profiling reveals a contribution of gut microbiota to fatty liver phenotype in insulin-resistant mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(33): 12511-12516. DOI:10.1073/pnas.0601056103.
Metabonomic Study of the Intervention Effect of Tartary Buckwheat Protein on Hyperlipidemic Mice
ZHOU Xiaoli, ZHAN Huan, ZHOU Yiming, et al. Metabonomic study of the intervention effect of tartary buckwheat protein on hyperlipidemic mice[J]. Food Science, 2019, 40(5): 149-155. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20171030-354. http://www.spkx.net.cn