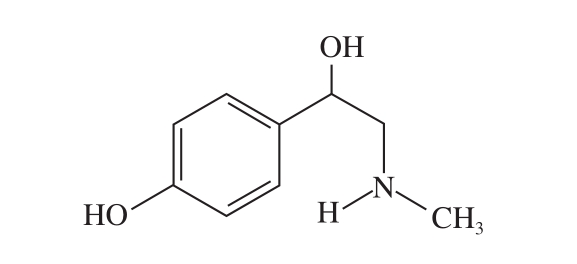
图 1 p-辛弗林结构
Fig. 1 Structure of p-synephrine
p-辛弗林(p-synephrine)为酸橙(Citrus aurantium)、中药枳实(Fructus Aurantii Immaturus)中的主要成分(图1)[1-3]。据《名医别录》、《本草纲目》等中医药书籍记载,枳实有破气消积、化痰散痞、理气宽中、行滞消胀等功效。美国食品药品监督管理局禁止膳食补充剂中添加麻黄碱,p-辛弗林由于结构与内源性神经递质如肾上腺素和去甲肾上腺素相似,具有促进能量消耗、抑制食欲、提高代谢和产热等作用[4],可以替代麻黄碱发挥减肥功效[5-6]。

图 1 p-辛弗林结构
Fig. 1 Structure of p-synephrine
作为减肥促进剂,p-辛弗林现已发现在外周组织中有很多作用,包括促进脂肪组织发生脂质分解,增加生热作用[7];增加肝细胞内cAMP含量,促进葡萄糖的呼吸作用[8-9];刺激肌肉组织中腺苷酸活化蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)磷酸化,诱导肌细胞葡萄糖的消耗等[10]。这些结果显示,p-辛弗林具有潜在的抗高血糖的活性。本研究在此基础之上,探讨p-辛弗林对肝细胞葡萄糖生成的影响及其具体作用机制。
人肝癌HepG2细胞株购自中国科学院上海细胞库。
p-辛弗林(纯度≥98%)、葡萄糖分析试剂盒、AMPK抑制剂Dorsomorphin(Compound C) 美国Sigma-Aldrich公司;CellTiter 96 AQueous单溶液细胞增殖检测试剂盒 美国Promega公司;DMEM培养基、胎牛血清 美国Gibco公司;磷酸化AMPK(p-AMPK)、AMPKα1/2、乙酰辅酶A羧化酶(acetyl coenzyme A synthetase,ACC)、磷酸化ACC(p-ACC)、叉头框转录因子1(forkhead box class O1,FoxO1)、磷酸化FoxO1(p-FoxO1)等特异性抗体 美国CST公司;AMPK siRNA 美国Santa Cruz公司;FuGENE® HD转染试剂 瑞士Roche公司。
二氧化碳培养箱 美国Thermo Fisher公司;酶标仪瑞士TECAN公司;ChemiDoc XRS系统 美国Bio-Rad公司。
1.3.1 细胞培养和细胞活力检测
人肝癌HepG2细胞株于高糖DMEM培养基(含体积分数10%胎牛血清、100 单位/mL青霉素、100 μg/mL链霉素)中,5% CO2、37 ℃培养箱内培养。
取对数生长期的人肝癌HepG2细胞(5×103 个/孔)接入到96 孔板中,细胞过夜贴壁,加入终浓度为1、10、50、100、200 μmol/L的p-辛弗林作用24 h后,每孔加入20 μL MTS试剂,在培养箱中继续孵育1~4 h,用酶标仪于490 nm波长处读取吸光度,分析细胞活力[11-12]。
1.3.2 葡萄糖生成检测
取对数生长期的人肝癌HepG2细胞(2×105 个/孔)接入24 孔板中,细胞过夜贴壁后,换用不含血清的培养基继续培养,同时加入终浓度为0.1、1、10、100 μmol/L的p-辛弗林或100 nmol/L胰岛素(阳性对照)作用细胞6 h,然后用磷酸盐缓冲液漂洗2 次,去掉培养基中的葡萄糖,接着用不含葡萄糖和酚红的DMEM继续培养3 h后,收集上清液,利用葡萄糖分析试剂盒测定葡萄糖的质量浓度,葡萄糖相对生成量以占对照组(未加入p-辛弗林或胰岛素)的比例表示[13]。
当检测AMPK信号通路在p-辛弗林抑制肝细胞葡萄糖生成中的作用时,在孵育p-辛弗林前先孵育AMPK抑制剂Compound C(20 μmol/L)1 h,再加入p-辛弗林继续孵育6 h后,然后按照上述方法检测葡萄糖相对生成量、葡萄糖-6-磷酸酶(glucose-6-phosphatase,G6Pase)、磷酸烯醇丙酮酸羧基激酶(phosphoenolpyruvate carboxykinase,PEPCK)活力等指标。
1.3.3 Western blot蛋白印迹检测蛋白表达
取对数生长期的人肝癌HepG2细胞(2×106 个/孔)接入到6 孔板中,细胞过夜贴壁后,换用不含血清的培养基继续培养,同时加入终浓度为0.1、1、10、100 μmol/L的p-辛弗林作用细胞6 h,磷酸盐缓冲液漂洗2 次,冰上裂解药物作用后的HepG2细胞,二喹啉甲酸法测定总蛋白质质量浓度,上样总蛋白质量为50 μg,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,电转蛋白至聚偏氟乙烯膜,用TBST配制的质量分数5%脱脂奶粉封闭液封闭2 h,然后按体积比1∶1 000加入各蛋白一抗抗体(p-AMPK、AMPKα1/2、p-ACC、ACC、p-FoxO1、FoxO1),室温孵育2 h,TBST漂洗3 次后加入HRP标记的二抗(体积比1∶2 000),室温孵育2 h,TBST漂洗3 次,ECL法显影,ChemiDoc XRS采集图像。Quantity One软件对蛋白印迹分析,实验以肌动蛋白(Actin)为内参,结果以磷酸化比例表示[14]。
1.3.4 酶活力检测
G6Pase活力检测:收集药物作用后的HepG2细胞于裂解液(20 mmol/L Tris-HCl、5 mmol/L乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、250 mmol/L蔗糖、10 μmol/L蛋白酶抑制剂,pH 7.0)中,冰上超声裂解10 min。然后4 ℃、12 000×g离心20 min,收集上清液以最大转速继续离心60 min,沉淀物于200 μL反应液(20 mmol/L葡萄糖-6-磷酸、50 mmol/L Tris-二甲砷酸盐缓冲液,pH 6.5)中重悬,35 ℃孵育20 min。加200 μL终止液(0.36 mmol/L钼酸铵、质量分数10%十二烷基硫酸钠、1 mmol/L H2SO4、质量分数1.4%抗坏血酸)终止反应,然后45 ℃继续孵育30 min,用酶标仪于820 nm波长处测吸光度[15]。
PEPCK活力检测:收集药物作用后的HepG2细胞于裂解液(10 mmol/L Tris-HCl、1 mmol/L EDTA、250 mmol/L蔗糖、50 μmol/L KCl,pH 7.2)中,冰上超声裂解,然后4 ℃、10 000×g离心30 min。测定总蛋白质量浓度。100 μg总蛋白中加入反应缓冲液(50 mmol/L Tris-HCl、2 mmol/L MnCl2、2.5 U/mL苹果酸脱氢酶和还原型的NADH),加入0.4 mmol/L脱氧鸟苷-5’-二磷酸开始反应,用酶标仪于340 nm波长处测吸光度[16]。
1.3.5 siRNA的瞬时转染及干扰效率分析
取对数生长期的HepG2细胞(2×106 个/孔)接入到6 孔板中,待细胞贴壁后,用不同浓度AMPKα1/2的siRNA质粒转染细胞,转染步骤根据FuGENE® HD转染试剂说明书进行。
在用siRNA转染24 h后,收集细胞提取总蛋白,Western蛋白印迹分析干扰效率,筛选建立瞬时干扰AMPK表达的细胞,然后再比较正常HepG2细胞(空白组)、转染空质粒HepG2细胞(阴性空质粒组)及基因敲除AMPK的HepG2细胞(AMPK siRNA组)的葡萄糖相对生成量、G6Pase、PEPCK活力等指标。
实验数据均以 ±s表示,统计分析使用Origin 8.0软件进行分析,两组间比较采用t检验,多组间比较采用ANOVA检验,采用Pearson相关性分析法分析,P<0.05为差异有统计学意义。
±s表示,统计分析使用Origin 8.0软件进行分析,两组间比较采用t检验,多组间比较采用ANOVA检验,采用Pearson相关性分析法分析,P<0.05为差异有统计学意义。
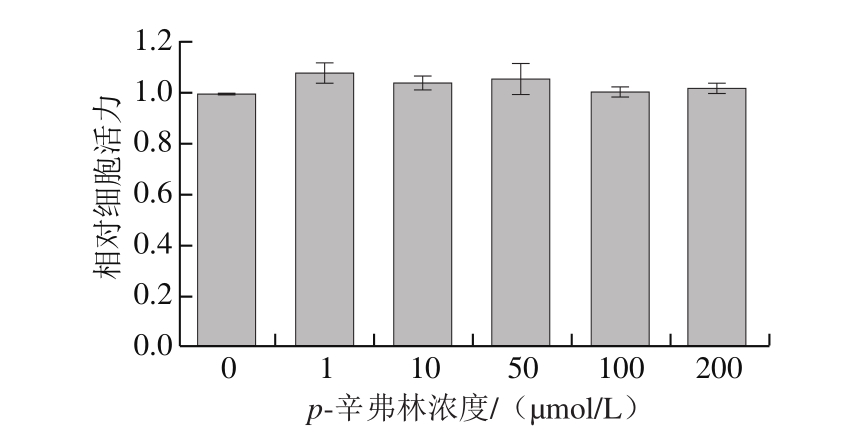
图 2 p-辛弗林对人肝癌HepG2细胞活力的影响(n=8)
Fig. 2 Effect of p-synephrine on HepG2 cell viability (n = 8)
由图2可知,不同浓度的p-辛弗林作用人肝癌HepG2细胞24 h后,细胞活力无显著性改变(P>0.05),提示直到作用浓度为200 μmol/L时,p-辛弗林也没有损伤细胞的完整性;因此,在后续实验中,采用0~100 μmol/L的p-辛弗林进行肝细胞葡萄糖生成研究。

图 3 p- 辛弗林对人肝癌HepG2细胞葡萄糖生成的影响(n=5)
Fig. 3 Effect of p-synephrine on glucose production in HepG2 cells (n = 5)
通过测定HepG2细胞葡萄糖生成的情况来反映p-辛弗林对肝细胞葡萄糖代谢的影响。如图3所示,在0.1~100 μmol/L的p-辛弗林作用HepG2细胞6 h后,肝细胞葡萄糖生成呈浓度依赖性降低。提示p-辛弗林能抑制HepG2细胞葡萄糖生成。
为了研究p-辛弗林对肝细胞葡萄糖异生关键蛋白潜在的影响,本研究检测了细胞能量平衡传感器AMPK信号通路中AMPK、ACC磷酸化水平及下游转录因子FoxO1磷酸化变化[17]。如图4A、B所示,与对照组相比较,p-辛弗林作用6 h后,AMPK、ACC、FoxO1的磷酸化比例都呈浓度依赖性增加。10 μmol/L的p-辛弗林作用后,AMPK、ACC、FoxO1的磷酸化比例分别为对照组的2.5、3.4 倍和2.3 倍。G6Pase和PEPCK活力也呈浓度依赖性降低(图4C、D)。

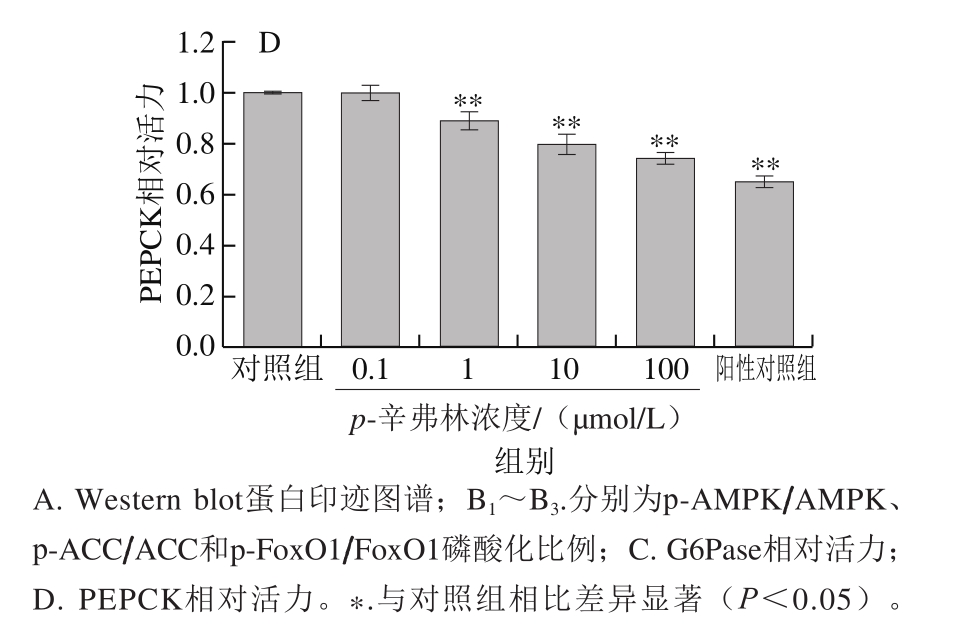
图 4 p-辛弗林对人肝癌HepG2细胞AMPK-FoxO1信号通路及其葡萄糖异生相关酶活力的影响
Fig. 4 Effect of p-synephrine on AMPK-FoxO1 signaling pathway and the activities of gluconeogenic enzymes in HepG2 cells
AMPK信号通路中的AMPK是肝脏糖异生的关键因子。本研究利用AMPK信号通路抑制剂Compound C进一步考察AMPK信号通路在p-辛弗林抑制肝细胞葡萄糖生成中的作用。
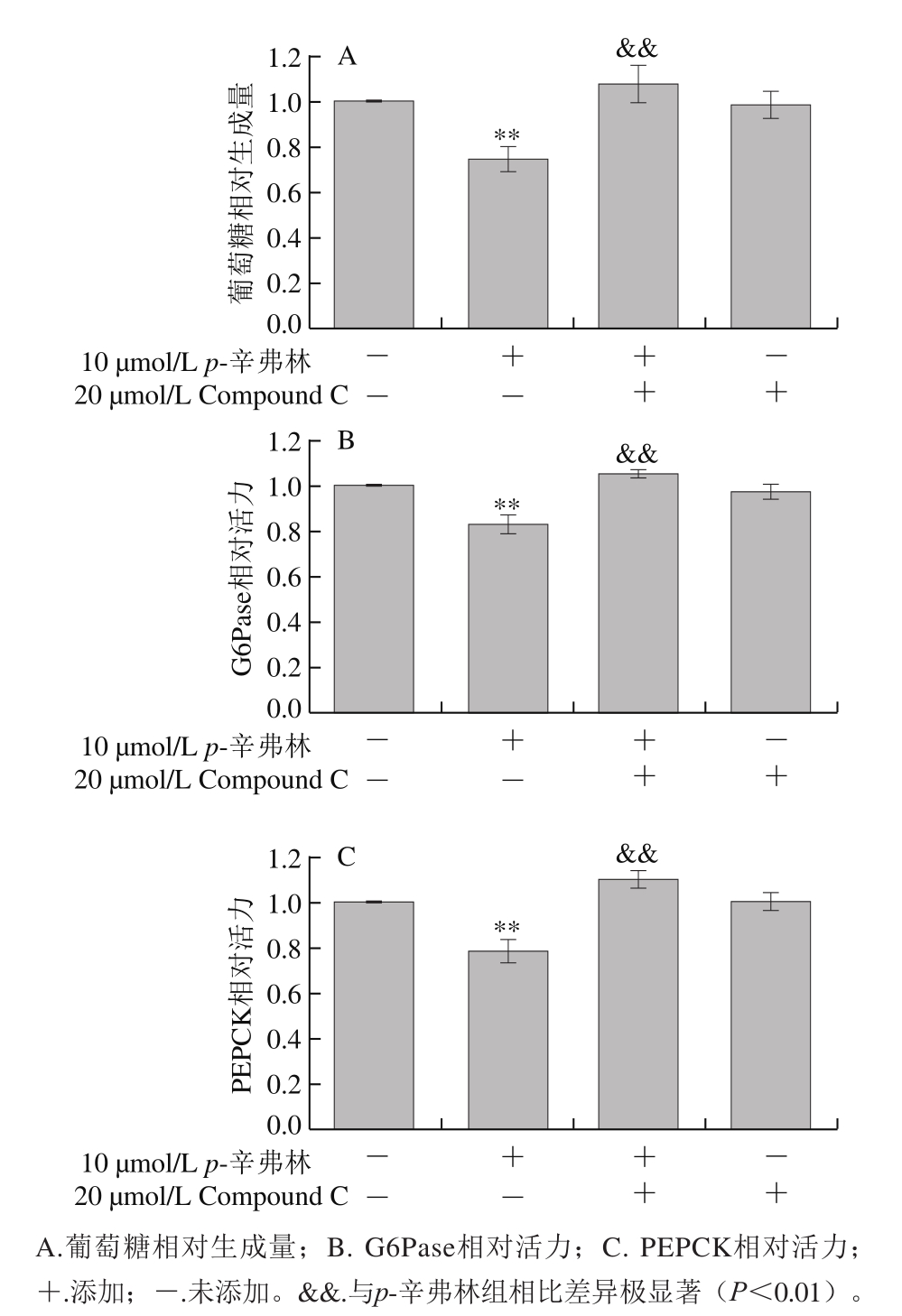
图 5 AMPK信号通路在p-辛弗林抑制肝细胞葡萄糖生成中的作用(n=10)
Fig. 5 Effect of p-synephrine on glucose production and gluconeogenic enzymes in the presence of Compound C in HepG2 cells (n = 10)
如图5所示,提前用20 μmol/L Compound C孵育HepG2细胞能够极显著抑制p-辛弗林对肝细胞葡萄糖生成、G6Pase和PEPCK活力的抑制作用(P<0.01)。
除了信号通路抑制剂的应用,本研究还利用了AMPK siRNA干扰质粒转染到HepG2肝细胞中[13,18],干扰细胞中AMPK的表达,再次考察AMPK信号通路在p-辛弗林抑制肝细胞葡萄糖生成中的作用。
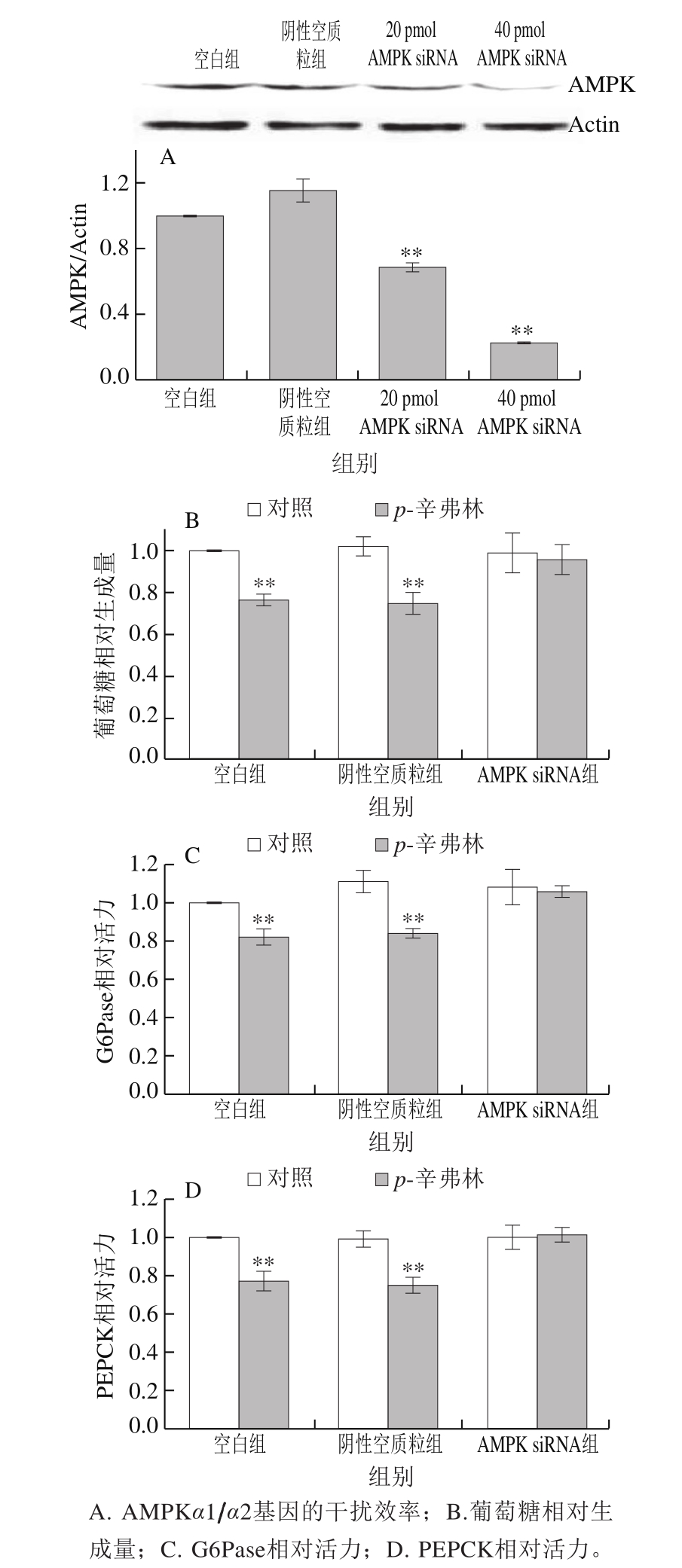
图 6 p-辛弗林对基因敲除AMPK的HepG2肝细胞葡萄糖生成的影响
Fig. 6 Effect of p-synphrine on glucose production and gluconeogenic enzymes in HepG2 cells with AMPKα1/α2 silencing
如图6A所示,与空白组和阴性空质粒组比较,AMPK的表达在干扰质粒为20、40 pmol/孔时均被极显著抑制(P<0.01),当干扰质粒的浓度为40 pmol/孔时,AMPK表达被抑制了78%。此时,相对于空白组和阴性空质粒组,基因敲除AMPK的HepG2肝细胞中p-辛弗林对肝细胞葡萄糖生成、G6Pase和PEPCK活力无显著性影响(P>0.05)(图6B~D)。
本研究结果表明,p-辛弗林能够抑制肝细胞葡萄糖的生成,这种抑制作用可能是通过激活AMPK-FoxO1信号通路从而抑制葡萄糖异生相关酶活力而实现的。
肝脏糖异生是肝糖代谢的重要组成部分,对维持细胞或者机体中糖的稳态起重要作用[19-20]。研究表明,p-辛弗林能够增加肝细胞内cAMP含量,促进葡萄糖的呼吸作用[8-9],但是p-辛弗林对肝细胞糖异生的影响及其中的作用机制还不清楚。本研究首先在人肝癌HepG2细胞上检测了p-辛弗林对葡萄糖生成的作用,结果证实p-辛弗林能够部分抑制肝细胞葡萄糖生成,这种抑制作用经由AMPK信号通路。
AMPK作为一种“能量感受器”,在肝脏等组织中广泛表达,其在调节机体能量代谢平衡方面发挥至关重要的作用[21]。AMPK能够调节葡萄糖和脂类代谢,降低外周胰岛素抵抗[22]。本研究发现,p-辛弗林显著增加AMPK及其直接下游底物ACC的磷酸化表达水平,这个结果提示AMPK信号通路有可能参与了p-辛弗林对肝细胞葡萄糖生成的抑制作用。通过AMPK特异性的抑制剂Compound C和AMPK siRNA证实了这个假设,p-辛弗林减少肝细胞葡萄糖生成的作用被Compound C和AMPK siRNA部分抑制。
有研究表明,激活AMPK可以抑制肝糖异生的G6Pase和PEPCK两个关键酶的活力,抑制肝糖异生,减少葡萄糖生成[23-24]。本研究中,p-辛弗林抑制了HepG2细胞中G6Pase和PEPCK活力,而且Compound C和AMPK siRNA抑制了p-辛弗林降低酶活力的作用。因此,AMPK在p-辛弗林调节肝糖异生关键酶活力中起重要作用。
转录因子FoxO1与AMPK信号通路调节的肝糖代谢有密切关系[25-26]。在肝脏中,活化的FoxO1(磷酸化后失去转录活性)通过与G6Pase和PEPCK的基因启动子结合而激活G6Pase和PEPCK的转录,进一步促进葡萄糖生成[27-30]。本研究结果显示,p-辛弗林呈剂量依赖性磷酸化FoxO1,这些结果阐明了p-辛弗林抑制酶活力的分子作用机制。
综上所述,p-辛弗林可通过激活AMPK信号通路,使FoxO1磷酸化而失去转录活性,从而抑制G6Pase和PEPCK活力,改善肝细胞糖异生,减少肝细胞葡萄糖相对生成量。激活AMPK信号通路可能是p-辛弗林调节肝细胞糖异生的机制之一。
[1] TETTE P A, GUIDI L R, BASTOS E M, et al. Synephrine: a potential biomarker for orange honey authenticity[J]. Food Chemistry, 2017,229: 527-533. DOI:10.1016/j.foodchem.2017.02.108.
[2] BADER M, LANG T, LANG R, et al. Synephrine as a specific marker for orange consumption[J]. Journal of Agricultural and Food Chemistry, 2017, 65(23): 4853-4858. DOI:10.1021/acs.jafc.7b01941.
[3] 毛华荣, 傅虹飞, 王鲁峰, 等. 不同柑橘品种生理落果中橙皮苷和辛弗林含量测定[J]. 食品科学, 2009, 30(14): 223-226. DOI:10.3321/j.issn:1002-6630.2009.14.047.
[4] FUNG-BERMAN A, MYERS A. Citrus aurantium, an ingredient of dietary supplements marketed for weight loss: current status of clinical and basic research[J]. Experimental Biology and Medicine, 2004,229(8): 698-704.
[5] HAAZ S, FONTAINE K R, CUTTER G, et al. Citrus aurantium and synephrine alkaloids in the treatment of overweight and obesity: an update[J]. Obesity Reviews, 2006, 7(1): 79-88. DOI:10.1111/j.1467-789X.2006.00195.x.
[6] STOHS S J, SHARA M. A review of the safety and efficacy of Citrus aurantium in weight management[M]//BAGCHI D, PREUSS H G.Epidemiology, pathophysiology, and prevention. Boca Raton: CRC Press,2007: 371-382. DOI:10.1201/9781420005479.ch28.
[7] LUCIANA G R, VERA M C, RENATA P L, et al. Synephrine:from trace concentrations to massive consumption in weight-loss[J].Food and Chemical Toxicology, 2011, 49: 8-16. DOI:10.1016/j.fct.2011.03.035.
[8] DE OLIVEIRA A L, COMAR J F, DE SÁ-NAKANISHI A B, et al.The action of p-synephrine on hepatic carbohydrate metabolism and respiration occurs via both Ca2+-mobilization and cAMP production[J].Molecular and Cellular Biochemistry, 2014, 388(1/2): 135-147.DOI:10.1007/s11010-013-1905-2.
[9] PEIXOTO J S, COMAR J F, MOREIRA C T, et al. Effects of Citrus aurantium (bitter orange) fruit extracts and p-synephrine on metabolic fluxes in the rat liver[J]. Molecules, 2012, 17(5): 5854-5869.DOI:10.3390/molecules17055854.
[10] HONG N Y, CUI Z G, KANG H K, et al. p-Synephrine stimulates glucose consumption via AMPK in L6 skeletal muscle cells[J].Biochemical and Biophysical Research Communications, 2012,418(4): 720-724. DOI:10.1016/j.bbrc.2012.01.085.
[11] CHEN M, ZHANG J, HU F, et al. Metformin affects the features of a human hepatocellular cell line (HepG2) by regulating macrophage polarization in a co-culture microenviroment[J]. Diabetes/Metabolism Research and Reviews, 2016, 31(8): 781-789. DOI:10.1002/dmrr.2761.
[12] CHANG H S, TANG J Y, YEN C Y, et al. Antiproliferation of Cryptocarya concinna-derived cryptocaryone against oral cancer cells involving apoptosis, oxidative stress, and DNA damage[J]. BMC Complementary and Alternative Medicine, 2016, 16: 94. DOI:10.1186/s12906-016-1073-5.
[13] GUO L X, ZHENG X X, LIU J H, et al. Geniposide suppresses hepatic glucose production via AMPK in HepG2 cells[J]. Biological &Pharmaceutical Bulletin, 2016, 39(4): 484-491. DOI:10.1248/bpb.b15-00591.
[14] GUO L X, LIU J H, ZHENG X X, et al. Geniposide improves insulin production and reduces apoptosis in high glucose-induced glucotoxic insulinoma cells[J]. European Journal of Pharmaceutical Sciences,2017, 110: 70-76. DOI:10.1016/j.ejps.2017.03.038.
[15] YAMASHITA R, SAITO T, SATOH S, et al. Effects of dehydroepiandrosterone on gluconeogenic enzymes and glucose uptake in human hepatoma cell line, HepG2[J]. Endocrine Journal,2005, 52(6): 727-733.
[16] POSPISILIK J A, STAFFORD S G, DEMUTH H U, et al. Long-term treatment with dipeptidyl peptidase IV inhibitor improves hepatic and peripheral insulin sensitivity in the VDF Zucker rat: a euglycemichyperinsulinemic clamp study[J]. Diabetes, 2002, 51(9): 2677-2683.
[17] OTERO-RODIÑO C, VELASCO C, ÁLVAREZ-OTERO R, et al.Changes in the levels and phosphorylation status of Akt, AMPK,CREB, and FoxO1 in hypothalamus of rainbow trout under conditions of enhanced glucosensing activity[J]. The Journal of Experimental Biology, 2017, 220: 4410-4417. DOI:10.1242/jeb.165159.
[18] LUO Z, ZHANG Y, LI F, et al. Resistin induces insulin resistance by both AMPK-dependent and AMPK-independent mechanisms in HepG2 cells[J]. Endocrine, 2009, 36(1): 60-69. DOI:10.1007/s12020-009-9198-7.
[19] KRSSAK M, BREHM A, BERNROIDER E, et al. Alterations in postprandial hepatic glycogen metabolism in type 2 diabetes[J].Diabetes, 2004, 53(12): 3048-3056.
[20] RODEN M, BERNROIDER E. Hepatic glucose metabolism in humans: its role in health and disease[J]. Best Practice & Research Clinical Endocrinology & Metabolism, 2003, 17(3): 365-383.
[21] HARDIE D G. The AMP-activated protein kinase pathway: new players upstream and downstream[J]. Journal of Cell Science, 2004,117: 5479-5487. DOI:10.1242/jcs.01540.
[22] VIOLLET B, FORETZ M, GUIGAS B, et al. Activation of AMP-activated protein kinase in the liver: a new strategy for the management of metabolic hepatic disorders[J]. The Journal of Physiology, 2006,574: 41-53. DOI:10.1113/jphysiol.2006.108506.
[23] MISRA P, CHAKRABARTI R. The role of AMP kinase in diabetes[J].The Indian Journal of Medical Research, 2007, 125(3): 389-398.
[24] LEE J M, SEO W Y, SONG K H, et al. AMPK-dependent repression of hepatic gluconeogenesis via disruption of CREB·CRTC2 complex by orphan nuclear receptor small heterodimer partner[J]. Journal of Biological Chemistry, 2010, 285(42): 32182-32191. DOI:10.1074/jbc.M110.134890.
[25] YADAV H, DEVALARAJA S, CHUNG S T, et al. TGF-β1/Smad3 pathway targets PP2A-AMPK-FoxO1 signaling to regulate hepatic gluconeogenesis[J]. The Journal of Biological Chemistry, 2017,292(8): 3420-3432. DOI:10.1074/jbc.M116.764910.
[26] YAMAZAKI Y, KAMEI Y, SUGITA S, et al. The cathepsin L gene is a direct target of FOXO1 in skeletal muscle[J]. The Biochemical Journal, 2010, 427(1): 171-178. DOI:10.1042/BJ20091346.
[27] NERURKAR P V, NISHIOKA A, ECK P O, et al. Regulation of glucose metabolism via hepatic forkhead transcription factor 1 (FoxO1)by Morinda citrifolia (noni) in high-fat diet-induced obese mice[J].The British Journal of Nutrition, 2012, 108(2): 218-228. DOI:10.1017/S0007114511005563.
[28] XIONG X, TAO R, DEPINHO R A, et al. Deletion of hepatic FoxO1/3/4 genes in mice significantly impacts on glucose metabolism through downregulation of gluconeogenesis and upregulation of glycolysis[J]. PLoS ONE, 2013, 8: e74340. DOI:10.1371/journal.pone.0074340.
[29] ZHANG W, PATIL S, CHAUHAN B, et al. FoxO1 regulates multiple metabolic pathways in the liver: effects on gluconeogenic, glycolytic,and lipogenic gene expression[J]. The Journal of Biological Chemistry,2006, 281(15): 10105-10117. DOI:10.1074/jbc.M600272200.
[30] MATSUMOTO M, POCAI A, ROSSETTI L, et al. Impaired regulation of hepatic glucose production in mice lacking the forkhead transcription factor Foxo1 in liver[J]. Cell Metabolism, 2007, 6(3):208-216. DOI:10.1016/j.cmet.2007.08.006.
p-Synephrine Suppresses Hepatic Glucose Production via the AMPK-FoxO1 Signaling Pathway in HepG2 Cells
GUO Lixia, ZHANG Yonghong, YIN Zhongyi, et al. p-synephrine suppresses hepatic glucose production via the AMPK-FoxO1 signaling pathway in HepG2 cells[J]. Food Science, 2019, 40(5): 156-161. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20171109-105. http://www.spkx.net.cn