β-胡萝卜素对H2O2诱导的斑马鱼肝损伤的保护作用
曲蕙名1,2,王 莹1,赵 博1,刘建龙2,刘可春1,沈 红1,楚 杰1,*
(1.齐鲁工业大学(山东省科学院)生物研究所,山东 济南 250103;2.山东师范大学生命科学学院,山东 济南 250014)
摘 要:研究β-胡萝卜素对H2O2诱导的斑马鱼肝损伤的保护作用。选择适宜浓度的H2O2诱导斑马鱼肝脏氧化应激损伤,分别以5、10、20 μg/mL的β-胡萝卜素对其进行保护。给药48 h后检测组织匀浆中谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、超氧化物歧化酶(superoxide dismutase,SOD)活力和丙二醛(malondialdelyde,MDA)含量;苏木精-伊红染色观察斑马鱼肝组织病理变化情况;实时荧光定量聚合酶链式反应技术检测SOD、CAT和GSTP2以及核转录因子Nrf2 mRNA的相对表达量。结果表明:H2O2处理斑马鱼仔鱼48 h后,组织匀浆液中ALT和AST活力升高,SOD活力降低,MDA含量升高;与模型组比较,β-胡萝卜素能够抑制ALT和AST的升高,提高SOD活力,降低MDA含量;病理切片结果显示β-胡萝卜素组能显著改善斑马鱼肝脏组织病理形态;提高Nrf2 mRNA的相对表达量,上调抗氧化酶基因的相对表达量。β-胡萝卜素对H2O2诱导的斑马鱼肝损伤具有保护作用。
关键词:β-胡萝卜素;H2O2;斑马鱼;肝损伤
β-胡萝卜素属于萜烯类化合物,由于其多烯烃的结构,β-胡萝卜素有较强的自由基清除能力及较好的抗氧化活性,同时具有抗癌、提高免疫力和繁殖力等功效[1-3]。H2O2作为一种强氧化剂,可造成细胞膜脂质过氧化,引起DNA和细胞内蛋白质的损伤,最终导致细胞凋亡。而H2O2浓度适宜并在保护剂的作用下,这种损伤是可逆的,有可能被修复[4-5]。
斑马鱼作为一种新型模式脊椎动物,具有繁殖能力强、生殖周期短、胚胎透明、能在显微镜下进行实时观察等特点。其基因与人类基因有着87%的相似性,被美国食品药品监督管理局列为继人和啮齿类鼠之后的第三大模式生物,已广泛应用于生命科学研究[6-7]。
本研究利用不同浓度的H2O2处理斑马鱼仔鱼,通过对斑马鱼生化指标的检测、肝脏形态的观察以及实时定量聚合酶链式反应(polymerase chain reaction,PCR)检测,确定了H2O2对斑马鱼仔鱼的肝脏毒性以及β-胡萝卜素对H2O2诱导的斑马鱼肝损伤的保护作用,为β-胡萝卜素的开发利用提供理论参考。
1 材料与方法
1.1 材料与试剂
β-胡萝卜素为本实验室由三孢布拉霉发酵后分离提取获得(纯度90%以上)。
体积分数30% H2O2、二甲基亚砜(dimethyl sulfoxide,DMSO) 国药集团化学试剂有限公司;BCA蛋白质量浓度测定试剂盒 碧云天生物技术研究所;谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdelyde,MDA)试剂盒 南京建成生物工程研究所;逆转录及荧光定量PCR试剂盒 日本Takara公司;双蒸水、斑马鱼培养水为实验室自制。
1.2 仪器与设备
斑马鱼养殖饲养系统 北京爱生科技有限公司;UV-2100型紫外-可见分光光度计 上海合利仪器有限公司;电热恒温水浴锅 上海贺德实验设备有限公司;SZX-16体视荧光显微镜 日本Olympus公司;实时定量PCR仪 美国ABI公司。
1.3 方法
1.3.1 斑马鱼仔鱼的准备
实验动物AB系、T3系斑马鱼的养殖和繁殖参照Westerfield[8]的方法。相较于其他模式生物,斑马鱼具有诸多优势:其基因与人类基因有87%的相似性,它们的编码蛋白结构相似而且在生物体内发挥类似的功能;胚胎透明,可实时观察药物毒性和活性;饲养方便,繁殖周期短[9-12]。斑马鱼肝脏形态在受精后48 h时初步形成,在受精后60~72 h时迅速生长至合适大小[12],因此本实验采用受精后72 h的斑马鱼仔鱼作为肝脏氧化损伤评价模型。
选择成熟的AB系斑马鱼,按照雌鱼与雄鱼数量1∶1或1∶2的比例置入繁殖缸内,中间放置隔板,次日清晨抽去隔板,光照刺激产卵后收集受精卵。加入几滴亚甲基蓝溶液,置于28 ℃恒温培养箱中孵化备用[13]。
1.3.2 氧化损伤造模
1.3.2.1 分组与给药
将体积分数30% H2O2溶液用新鲜的斑马鱼培养水配制成浓度为8.8 mmol/L的母液备用,实验时将H2O2母液用培养水稀释为0.11、0.22、0.44 mmol/L的工作液。
在斑马鱼胚胎发育至受精后3 d自然脱膜后,挑选发育正常的斑马鱼仔鱼移入6 孔板中,每孔30 条,每个浓度组设5 个重复孔。模型组样孔中预先加入5 mL不同浓度(0.11、0.22、0.44 mmol/L)的H2O2溶液,空白对照组加入5 mL新鲜培养水。将给药后的6 孔板放入28 ℃恒温培养箱中,孵育48 h备用。上述实验过程用不同批次的仔鱼重复3 次。
1.3.2.2 抗氧化酶活力及MDA含量的测定
不同浓度的H2O2处理48 h后,收集鱼体进行匀浆,按照试剂盒说明书测定匀浆液中ALT、AST、SOD活力和MDA含量。
1.3.3 β-胡萝卜素对斑马鱼肝损伤的保护作用测定
1.3.3.1 分组与给药
配制5 mg/mL的β-胡萝卜素母液,将5 mg/mL的β-胡萝卜素母液稀释为2.5、1.25 mg/mL的β-胡萝卜素母液。分别取1.25、2.5、5 mg/mL的β-胡萝卜素母液20 μL置于6 孔板中,用0.22 mmol/L的H2O2补至5 mL,得到终质量浓度分别为5、10、20 μg/mL的β-胡萝卜素实验组。
将1.3.1节中受精后3 d发育正常的斑马鱼仔鱼随机分成5 组,空白对照组、氧化造模组和β-胡萝卜素低、中、高剂量组(5、10、20 μg/mL)。空白对照组在6 孔板中加入5 mL新鲜培养水;氧化造模组加入5 mL的0.22 mmol/L的H2O2。每组设置5 个重复孔,每孔30 条鱼。将给药后的6 孔板放入28 ℃恒温培养箱中,孵育48 h备用。上述实验过程用不同批次的仔鱼重复3 次。
1.3.3.2 抗氧化酶活力及MDA含量的测定
分组给药处理48 h后,按照试剂盒说明书测定匀浆液中ALT、AST、SOD活力和MDA含量。
1.3.3.3 肝脏形态观察
以受精后3 d的肝脏绿色荧光转基因斑马鱼仔鱼T3(lfabp: EGFP)为实验对象,给药处理48 h后,体视显微镜下观察仔鱼肝脏荧光和形态的变化。H2O2以及β-胡萝卜素组给药方法同1.3.3.1节。
1.3.3.4 肝组织病理学检测
将1.3.3.1节中给药处理48 h后的AB系斑马鱼用多聚甲醛溶液固定,石蜡包埋,切片进行苏木精-伊红染色,封片后制备组织切片,显微镜下观察肝组织病理学形态并拍照。
1.3.3.5 实时定量PCR
按照试剂盒说明书提取斑马鱼总RNA,分光光度计法测定RNA溶液的吸光度;反转录合成cDNA。SOD、CAT、GSTP2、Nrf2和β-actin的引物根据GenBank中斑马鱼的基因登录序列,用Primer 5.0软件设计,由上海捷瑞生物工程有限公司合成,序列如表1所示。
表 1 实时定量PCR反应引物序列
Table 1 Sequences of primers used for qPCR amplification

目的基因 引物序列(5′-3′) 产物长度/bp β-actin TGCGGAAACTGGCAAAGG 111 GAGGGCAAAGTGGTAAACG SOD GGCCAACCGATAGTGTTAGA 205 CCAGCGTTGCCAGTTTTTAG CAT ACTACCAGTCAACTGCCCGTAC 240 TTTAGCACCTGAGTGAAGAACG GSTP2 TCTTGTTCCGACACCTCT 236 TGGCTCTTATGTCACCCT Nrf2 AGATGAGAACGGAAAGGC 129 AAGGAGGAAGGACAAAGC
1.4 数据统计与分析
运用SPSS 16.0软件进行数据统计分析,以单因素方差分析和Tukey’s多因素t检验进行比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 H2O2对斑马鱼仔鱼的肝脏毒性
表 2 H2O2对斑马鱼仔鱼AST、ALT和SOD活力以及MDA含量的影响
Table 2 Effect of H2O2 on the activity of AST, ALT and SOD and the content of MDA in zebrafish larvae

注:与空白对照组相比,*.差异性显著(P<0.05),**.差异性极显著(P<0.01)。
组别 ALT活力/(U/mg pro)AST活力/(U/mg pro)SOD活力/(U/mg pro)MDA含量/(nmol/mg pro)空白对照组 4.51±0.85 5.69±9.55 49.70±0.41 0.68±0.03 0.11 mmol/L H2O2 5.85±1.07** 7.40±2.81 45.46±0.70** 1.90±0.01 0.22 mmol/L H2O2 9.43±0.85** 9.63±0.74* 36.78±0.47** 3.06±0.02**0.44 mmol/L H2O2 7.10±1.07** 11.62±4.90* 31.69±0.25** 3.79±1.22**
如表2所示,不同浓度的H2O2处理斑马鱼仔鱼48 h后,与空白对照组相比,模型组ALT、AST活力均有升高;SOD活力极显著降低,MDA含量升高,且呈现一定的剂量-效应关系。高浓度H2O2组中斑马鱼仔鱼出现畸形、死亡。选择0.22 mmol/L的H2O2用于斑马鱼氧化应激肝损伤模型的制备。
2.2 β-胡萝卜素对H2O2诱导的斑马鱼肝损伤的保护作用
表 3 β-胡萝卜素对氧化损伤斑马鱼仔鱼AST、ALT 和SOD活力以及MDA含量的影响
Table 3 Effect of β-carotene on the activity of AST, ALT and SOD and the content of MDA in zebra fi sh larvae with H2O2-induced oxidative damage
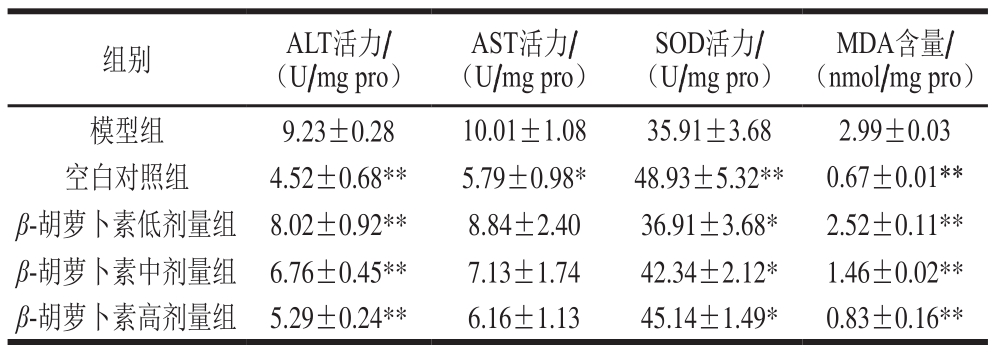
注:与模型组相比,*.差异显著(P<0.05),**.差异极显著(P<0.01)。
组别 ALT活力/(U/mg pro)AST活力/(U/mg pro)SOD活力/(U/mg pro)MDA含量/(nmol/mg pro)模型组 9.23±0.28 10.01±1.08 35.91±3.68 2.99±0.03空白对照组 4.52±0.68** 5.79±0.98* 48.93±5.32** 0.67±0.01**β-胡萝卜素低剂量组 8.02±0.92** 8.84±2.40 36.91±3.68* 2.52±0.11**β-胡萝卜素中剂量组 6.76±0.45** 7.13±1.74 42.34±2.12* 1.46±0.02**β-胡萝卜素高剂量组 5.29±0.24** 6.16±1.13 45.14±1.49* 0.83±0.16**
如表3所示,与模型组相比,β-胡萝卜素能极显著抑制ALT活力的升高,明显升高SOD活力,极显著降低MDA的含量,说明β-胡萝卜素能有效降低H2O2对斑马鱼仔鱼造成的氧化应激损伤。
2.3 肝脏形态观察及病理学检测
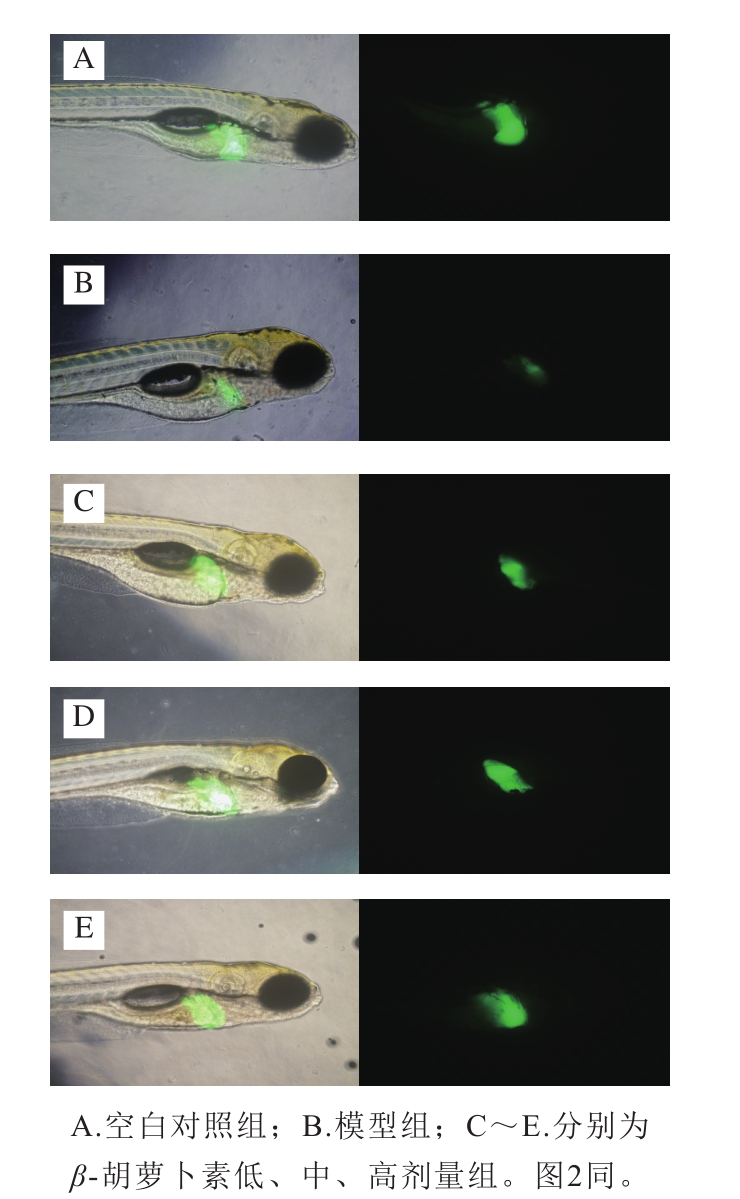
给药处理48 h后,荧光显微镜下观察H2O2和β-胡萝卜素对斑马鱼肝脏大小和荧光强度的影响。如图1所示,与空白对照组相比,模型组斑马鱼肝脏荧光强度降低,肝脏明显萎缩退化。与模型组相比,β-胡萝卜素组肝脏荧光强度增大,肝损伤有一定程度的减轻。
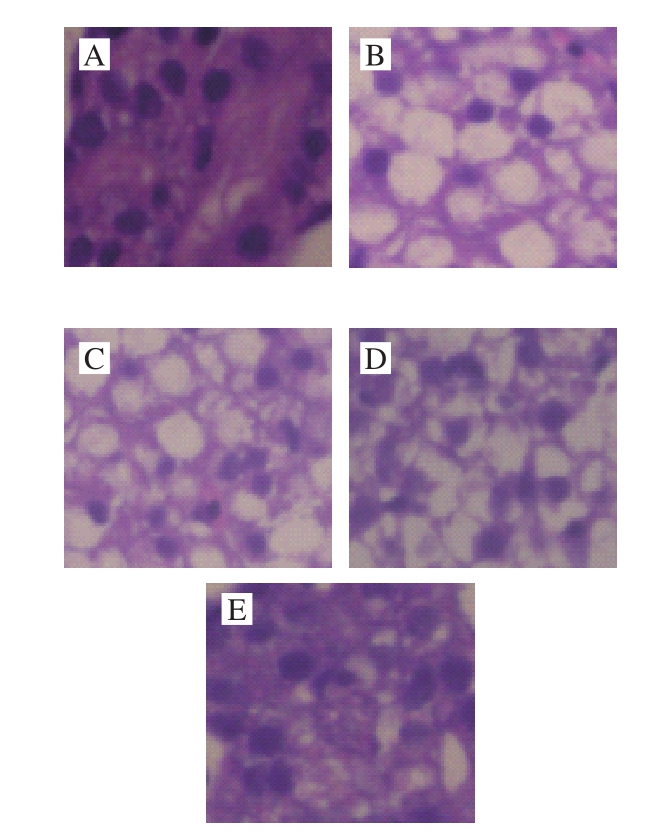
如图2所示,空白对照组中出生后5 d的仔鱼肝脏结构正常,肝脏细胞染色体丰富。模型组中H2O2导致仔鱼肝脏细胞核萎缩,肝细胞肿胀、坏死,部分肝细胞胞质透亮,胞浆疏松,肝脏严重空泡化。β-胡萝卜素组中仔鱼肝损伤有一定程度的减轻,高剂量组保护效果最显著。
2.4 核转录因子Nrf2及下游抗氧化基因相对表达量
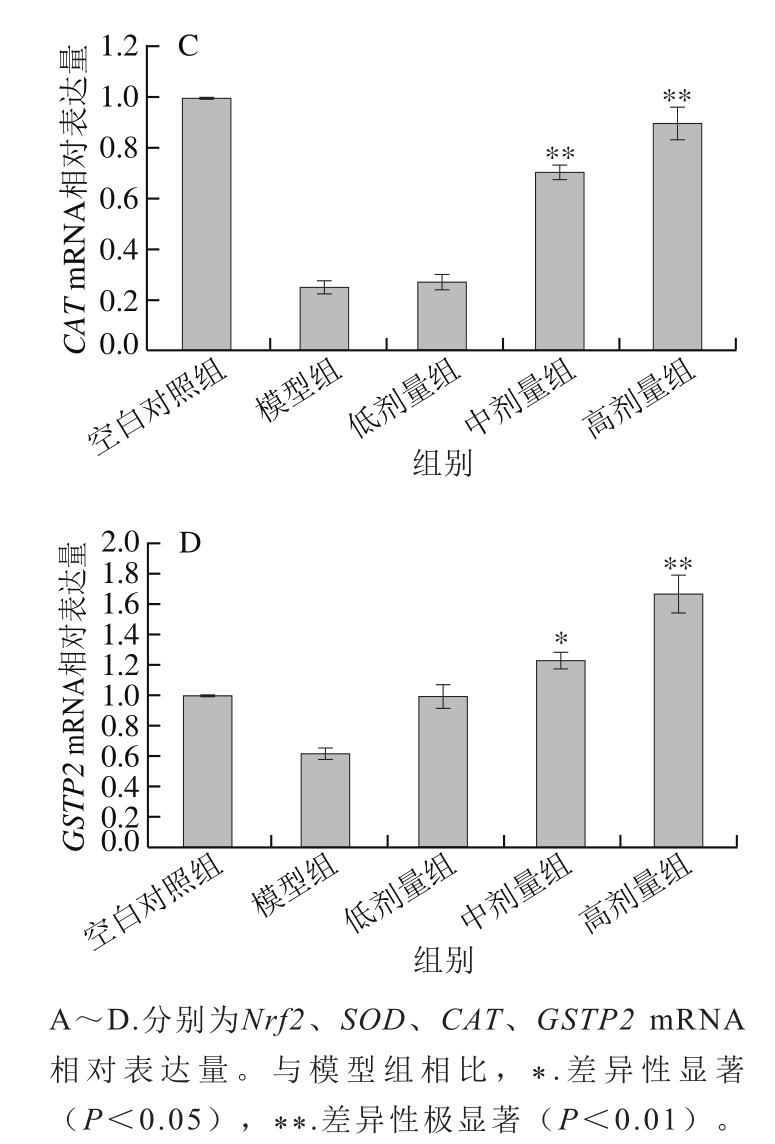
如图3所示,与空白对照组相比,模型组细胞核转录因子Nrf2 mRNA相对表达量降低;与模型组相比,β-胡萝卜素能明显上调Nrf2 mRNA相对表达量,其中β-胡萝卜素高剂量组效果最显著。
与空白对照组相比,模型组S O D、C A T、GSTP2 mRNA相对表达量均明显降低,β-胡萝卜素处理后能明显上调抗氧化酶基因相对表达量,对SOD和CAT的相对表达量的影响最明显。3 个剂量组中,β-胡萝卜素高剂量组对抗氧化酶基因相对表达量的上调效果最显著。
3 讨 论
氧化应激是指机体在遭受有害刺激时,体内的活性分子如活性氧、氮自由基产生并堆积,超出了机体对过氧化物的清除能力,破坏了机体氧化还原系统的平衡[14-15]。H2O2作为一种强氧化剂,能氧化酶的巯基,使酶失去活性;透过细胞膜与细胞内铁反应生成含氧自由基,对蛋白质和DNA造成损害[16-17];诱导肝细胞凋亡,促使肝纤维化,因此常用于细胞氧化应激损伤造模和保护剂的筛选[18-20]。本研究使用不同浓度的H2O2损伤斑马鱼仔鱼,构建氧化应激模型,通过对ALT、AST、SOD活力和MDA含量的测定,最终选择0.22 mmol/L的H2O2为最适诱导浓度,为本研究提供了良好的模型基础。
ALT和AST主要分布在肝细胞内,当肝细胞病变坏死时,ALT和AST活力会升高,是目前常用的反映肝功能的指标[21]。SOD对机体的氧化与抗氧化平衡起着至关重要的作用,能清除超氧阴离子自由基,保护机体免受损伤;自由基能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并形成脂质过氧化物,如MDA、酮基和氢过氧自由基等。SOD活力反映了机体清除自由基的能力,而MDA含量可反映细胞受自由基攻击的严重程度[22-23]。
β-胡萝卜素由于其抗氧化、防癌等功效受到广泛关注,在体内经转化可与细胞膜中脂质相溶,在自由基对机体产生损害前将其淬灭,阻断其氧化过程,从而对膜脂起保护作用[24]。β-胡萝卜素抗脂质过氧化作用可能是抗肝损伤的作用机制之一,其护肝作用的体内实验研究多见于小鼠上[25-26],对于斑马鱼肝脏的保护作用的研究鲜见报道。本研究中发酵生产β-胡萝卜素的低、中、高剂量组均能有效降低斑马鱼ALT、AST活力和MDA含量,显著提高SOD活力,说明β-胡萝卜素能够加快自由基的清除,从而减轻含氧自由基对肝细胞的损伤。
Keap1-Nrf2-ARE通路是近年来新发现的机体抵抗内外界氧化和化学等刺激的防御性信号通路,是抗毒、抗氧化研究的重点和热点,Nrf2是关键核转录因子和激活该信号通路的开关,同样也是鱼类调节下游抗氧化酶基因表达量的最主要调控因子,其高水平表达于解毒器官中,尤其是肝脏[27-28]。研究表明较高浓度和长时间的氧化应激对Nrf2的表达量有下调的作用[29-30],本实验中H2O2处理受精48 h后斑马鱼仔鱼表达量明显下调,β-胡萝卜素对Nrf2 mRNA相对表达量有上调的作用,并且一定程度上调主要抗氧化酶SOD、CAT、GSTP2 mRNA相对表达量,其抗氧化机理可能是通过激活Nrf2,上调细胞的抗氧化酶基因的表达,从而增强机体抗氧化酶清除自由基的能力。
本实验以H2O2作为氧化应激诱导因子,研究β-胡萝卜素对斑马鱼仔鱼肝脏的保护作用及其抗氧化作用机理。实验结果表明,β-胡萝卜素有良好的肝保护作用,为β-胡萝卜素作为抗氧化剂和药物的应用提供了理论支持。
参考文献:
[1] 张相伦, 范喜梅, 游伟, 等. 日粮添加β-胡萝卜素对肉牛抗氧化性能的影响[J]. 山东农业科学, 2017, 49(6): 119-122. DOI:10.14083/j.issn.1001-4942.2017.06.025.
[2] CUCCO M, GUASCO B, MALACARNE G, et al. Effects of β-carotene on adult immune condition and antibacterial activity in the eggs of the Grey Partridge, Perdix perdix[J]. Comparative Biochemistry and Physiology, 2007, 147: 1038-1046. DOI:10.1016/j.cbpa.2007.03.014.
[3] MATOS H R, MARQUES S A, GOMES O F, et al. Lycopene and beta-carotene protect in vivo iron-induced oxidative stress damage in rat prostate[J]. Brazilian Journal of Medical and Biological Research,2006, 39(2): 203-210.
[4] 尹学哲, 金延华, 何鑫, 等. 大豆异黄酮对过氧化氢诱导的肝细胞损伤的保护作用[J]. 大豆科学, 2016, 35(4): 687-690. DOI:10.11861/j.issn.1000-9841.2016.04.0687.
[5] 刘红亮, 胡磊, 王靖凯, 等. 槲皮素对H2O2损伤PC12细胞的保护效果与机制[J]. 中国药理学通报, 2014, 30(3): 373-377. DOI:10.3969/j.issn.1001-1978.2014.03.017.
[6] EIMON P M, ASHKENAZI A. The zebrafish as a model organism for the study of apoptosis[J]. Apoptosis, 2010, 15(3): 331-349.DOI:10.1007/s10495-009-0432-9.
[7] 刘晓金, 陈华利, 高燕, 等. 斑马鱼模式研究现状及应用情况进展[J].辽宁中医药大学学报, 2016, 18(4): 125-127. DOI:10.13194/j.issn.1673-842x.2016.04.039.
[8] WESTERFIELD M. The zebrafish book[M]. Eugene: University of Oregon Press, 1995: 16-21.
[9] INGHAM P W. The power of the zebrafish for disease analysis[J].Human Molecular Genetics, 2009, 18(R1): 107-112. DOI:10.1093/hmg/ddp091.
[10] KAFINA M D, PAW B H. Methods in molecular biology[M]. New York:Humana Press, 2018: 11-36. DOI:10.1007/978-1-4939-7428-3_2.
[11] MESHALKINA D A, KIZLYK M N, KYSIL E V, et al. Zebrafish models of autism spectrum disorder[J]. Experimental Neurology, 2018,299: 207-216. DOI:10.1016/j.expneurol.2017.02.004.
[12] CHU J, SADLER K C. New school in liver development: lessons from zebrafish[J]. Hepatology, 2009, 50(5): 1656-1663. DOI:10.1002/hep.23157.
[13] 韩建, 彭维兵, 韩利文, 等. 铜、汞和铅对斑马鱼仔鱼肝脏发育的影响[J]. 山东科学, 2016, 29(5), 54-59; 75. DOI:10.3976/j.issn.1002-4026.2016.05.009.
[14] 付远妨, 赵尉丹, 蒙西南, 等. 鸡血藤黄酮乙酸乙酯部位对H2O2诱导RAW264.7细胞氧化应激的调节作用[J]. 黑龙江畜牧兽医, 2017(12):145-147; 296.
[15] RYTER S W, KIM H P, HOETZEL A, et al. Mechanisms of cell death in oxidative stress[J]. Antioxidants and Redox Signaling, 2007, 9(1) :49-89. DOI:10.1089/ars.2007.9.49.
[16] 王秋举. L-肉碱对H2O2诱导氧化应激的两种鱼细胞抗氧化功能影响及其机理研究[D]. 吉林: 吉林农业大学, 2015: 1-117.
[17] 冯燕, 张波, 王少兰, 等. H2O2诱导SD大鼠视网膜细胞凋亡过程中细胞内钙离子浓度的变化[J]. 西安交通大学学报(医学版), 2015,36(5): 580-586. DOI:10.7652/jdyxb201505002.
[18] 金明, 王玉娇, 金梅花, 等. 两种细胞建立肝细胞氧化损伤模型比较[J]. 中国公共卫生, 2015, 31(3): 324-326. DOI:10.11847/zgggws2015-31-03-21.
[19] ZHAO X Y, DOU M M, ZHANG Z H, et al. Protective effect of Dendrobium officinale polysaccharides on H2O2-induced injury in H9c2 cardiomyocytes[J]. Biomedicine and Pharmacotherapy, 2017,94: 72-78. DOI:10.1016/j.biopha.2017.07.096.
[20] 尹学哲, 王玉娇, 尹基峰, 等. 草苁蓉提取物对HepG2细胞氧化应激损伤的保护作用[J]. 食品科学, 2015, 36(15): 173-178. DOI:10.7506/spkx1002-6630-201515032.
[21] 吴豪, 宋捷, 仲青香, 等. 基于斑马鱼模型研究补骨脂肝损伤效应及作用机制[J]. 南京中医药大学学报, 2017, 33(3): 263-267.DOI:10.14148/j.issn.1672-0482.2017.0263.
[22] 黄勇, 廖彪. 超氧化物歧化酶在斑马鱼早期胚胎中的表达特点[J].陕西理工学院学报(自然科学版), 2008, 24(3): 91-94.
[23] 陈汉, 王慧君, 李学峰, 等. 甲基苯丙胺对大鼠脑组织中NO、SOD和MDA的影响[J]. 中国药物依赖性杂志, 2007, 16(2): 102-104.DOI:10.13936/j.cnki.cjdd1992.2007.02.006.
[24] 肖琳, 喻剑华. 3 种维生素联用对四氯化碳所致大鼠慢性肝损伤的防护作用[J]. 中西医结合肝病杂志, 2001, 11(5): 292-293.
[25] 苏伟, 王纪宁, 刘韬. 胡萝卜素的提取及其护肝作用的研究[J]. 食品科学, 2006, 27(11): 486-488.
[26] CUI Bokang, LIU Su, WANG Qibo, et al. Effect of β-carotene on immunity function and tumour growth in hepatocellular carcinoma rats[J]. Molecules, 2012, 17(7): 8595-8603. DOI:10.3390/molecules17078595.
[27] 陈光海, 刘晓平. Keap1-Nrf2信号通路与细胞氧化应激反应相关性研究进展[J]. 医学理论与实践, 2016, 29(15): 2012-2015.DOI:10.19381/j.issn.1001-7585.2016.15.011.
[28] 赵慧慧, 王道艳, 王春波. 胶原蛋白肽经由Nrf2信号通路对H2O2诱导的肝细胞氧化损伤的保护作用[J]. 现代生物医学进展, 2014(3):4434-4439. DOI:10.13241/j.cnki.pmb.2014.23.009.
[29] KAZIM S, CEMAL O, HASAN Y, et al. Lycopene improves activation of antioxidant system and Nrf2/HO-1 pathway of muscle in rainbow trout (Oncorhynchus mykiss) with different stocking densities[J]. Aquaculture, 2014, 430: 133-138. DOI:10.1016/j.aquaculture.2014.04.007.
[30] NING J L, MO L W, LAI X N. Low- and high-dose hydrogen peroxide regulation of transcription factor NF-E2-related factor 2[J]. Chinese Medical Journal, 2010, 123(8): 1063-1069. DOI:10.3760/cma.j.issn.0366-6999.2010.08.016.
Protective Effect of β-Carotene on Liver Oxidative Damage Induced by Hydrogen Peroxide in Zebrafish
QU Huiming1,2, WANG Ying1, ZHAO Bo1, LIU Jianlong2, LIU Kechun1, SHEN Hong1, CHU Jie1,*
(1. Biology Institute, Qilu University of Technology (Shandong Academy of Sciences), Jinan 250103, China;2. Life Sciences Institute of Shandong Normal University, Jinan 250014, China)
Abstract: The protective effect of β-carotene on H2O2-induced liver injury in zebrafish was investigated. Liver injury model was induced by H2O2 at the proper concentration, and β-carotene at doses of 5, 10 and 20 μg/mL was used to suppress H2O2-induced damage. After 48 h of incubation, the levels of alanine aminotransferase (ALT), aspartate aminotransferase(AST) and superoxide dismutase (SOD) activities and malondialdelyde (MDA) content were measured. Pathological changes in the liver were observed by hematoxylin-eosin (HE) staining. The relative mRNA expression levels of SOD, CAT, GSTP2 and Nrf2 were assessed by real-time quantitative polymerase chain reaction (qPCR). The results showed that H2O2 elevated the levels of ALT, AST and MDA and reduced the level of SOD. Compared with the model group, β-carotene decreased the levels of ALT, AST, and MDA and improved the activity of SOD. Moreover, β-carotene significantly ameliorated hepatic pathological changes and upregulated the relative mRNA expression levels of SOD, CAT, GSTP2 and Nrf2. Finally we conclude that β-carotene has a protective effect on liver injury induced by H2O2 in zebrafish.
Keywords: β-carotene; H2O2; zebrafish; liver injury
收稿日期:2017-11-17
基金项目:国家国际科技合作项目(2014DFR30840);国家重点研发计划-国际科技创新合作重点专项(2016YFE0111600);山东省科学院青年基金项目(2018QN0025)
第一作者简介:曲蕙名(1991—)(ORCID: 0000-0001-8492-3184),女,硕士研究生,研究方向为食品科学。E-mail: 13656406282@163.com
*通信作者简介:楚杰(1965—)(ORCID: 0000-0001-6090-5432),女,研究员,硕士,研究方向为生物学。E-mail: chuj@sdas.org
DOI:10.7506/spkx1002-6630-20171117-217
中图分类号:Q593.1
文献标志码:A
文章编号:1002-6630(2019)05-0162-05
引文格式:曲蕙名, 王莹, 赵博, 等. β-胡萝卜素对H2O2诱导的斑马鱼肝损伤的保护作用[J]. 食品科学, 2019, 40(5): 162-166.DOI:10.7506/spkx1002-6630-20171117-217. http://www.spkx.net.cn
QU Huiming, WANG Ying, ZHAO Bo, et al. Protective effect of β-carotene on liver oxidative damage induced by hydrogen peroxide in zebrafish[J]. Food Science, 2019, 40(5): 162-166. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20171117-217. http://www.spkx.net.cn