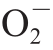 ·荧光强度检测
·荧光强度检测枸杞是我国传统名贵中药,其果实为枸杞子,属于枸杞属(Lycium),主要包括宁夏枸杞(Lycium barbarum L.)和中华枸杞(Lycium chinense Mill.)。枸杞子性平味甘,药用成分多样,具有滋补肝肾、益精明目、延缓衰老等众多功效。《本草纲目》中记载枸杞子“久服坚筋骨,轻身不老,耐寒暑”。
衰老是一个生理功能持续退化,器官功能损伤,对疾病敏感性增加的一个过程,基于衰老的自由基学说,衰老与细胞的氧化损伤密不可分。作为天然抗氧化剂,枸杞的抗氧化、抗衰老功能受到了科学家的广泛关注[1-3]。研究发现,枸杞可以通过下调生长抑制因子p53和p16的表达促进细胞增殖,从而延缓细胞复制性衰老[4-5]。枸杞可以抑制衰老、高脂饮食、缺氧、过量运动诱导的氧化应激[6-10],上调各组织中抗氧化酶的活性,提高抗氧化能力,抑制脂质过氧化水平[11-12]。在临床应用方面也有研究发现,连续30 d饮用枸杞饮料可以提高老人血清中抗氧化酶(超氧化物歧化酶和谷胱甘肽过氧化物酶)的水平,下调脂质过氧化水平,从而提高机体抗氧化能力[13-14]。虽然已经有很多研究证实了枸杞的抗氧化作用,但对于其作用的具体机制还不清楚。秀丽隐杆线虫(Caenorhabditis elegans)是经典的模式生物,具有易于培养、生长周期短、后代数量多等特点,这赋予其在衰老功能研究方面的极大优势[15-16]。本研究以秀丽隐杆线虫(以下简称线虫)为模型,分析了枸杞总提取物对线虫寿命及产卵能力的影响,并进一步探讨了其抗氧化能力,从亚细胞水平解释了枸杞的抗氧化作用机制,为其开发利用与应用研究提供理论依据。
枸杞果实分别取自宁夏中宁、青海和甘肃。
线虫品系B r i s t o l N 2来自于明尼苏达大学Caenorhabditis elegans Genetics Center;线虫品系Pmyo3::HyPer、roGFP2::Orp1由实验室前期构建,其含有HyPer、Orp1的质粒由德国癌症研究中心的Tobias P.Dick教授惠赠。
蛋白胨 美国BD公司;2’,7’-二氯-二氢荧光素乙酰乙酸盐(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA) 上海碧云天生物技术有限公司;线粒体超氧化物红色荧光探针MitoSox Red、TRIzol试剂美国Invitrogen公司;M-MLV逆转录酶、核糖核酸酶抑制剂 美国Promega公司;SYBR Green荧光染料南京诺唯赞生物科技有限公司;抗氧化标准物质水溶性VE(Trolox)、三吡啶基三嗪(tripyridyltriazine,TPTZ)、胆固醇 美国Sigma公司;琼脂粉、白藜芦醇、Oligo(dT)、dNTP 生工生物工程(上海)股份有限公司;DEPC水 上海翊圣生物科技有限公司;冰醋酸、醋酸钠、三氯化铁、氯化钙、无水乙醇、三氯甲烷、异丙醇、磷酸二氢钾、磷酸氢二钠、氯化钠、硫酸镁、磷酸氢二钾、氢氧化钠、次氯酸钠溶液 国药集团化学试剂有限公司。
普通体视显微镜 日本Olympus公司;恒温生化培养箱武汉瑞华仪器设备有限公司;恒温振荡培养箱 上海智城有限公司;生物洁净工作台 海尔股份有限公司;离心机 德国Sigma公司;LSM750激光共聚焦显微镜、荧光体视镜 德国Zeiss公司;实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪、多功能酶标仪 美国Thermo Fisher公司。
1.3.1 枸杞提取物的制备
称取采集到的宁夏中宁、青海、甘肃3 个产地枸杞果实100 g,蒸馏水清洗5 次,室温下在1 L蒸馏水(pH 7)中浸泡12 h,加入2 L蒸馏水煎煮2.0 h,之后再加入2 L蒸馏水继续煎煮1.5 h。采用空心纤维膜趁热过滤煎煮过的枸杞液,合并两次所得滤液进行浓缩(1 kPa、45 ℃),最终获得100 mL浓缩液(-20 ℃储存)。提取获得的枸杞水煎液质量浓度为1 g/mL,成分主要包括枸杞多糖、枸杞黄酮、枸杞色素等水溶性成分。青海枸杞和甘肃枸杞采用同样的流程获得水煎液。
1.3.2 线虫培养
所有线虫均采用接种有大肠杆菌OP50的标准NGM琼脂平板在20 ℃下进行培养。枸杞提取物依据不同的稀释质量浓度与大肠杆菌OP50混合涂布于NGM平板上。同步化后L4时期的线虫分别放置于对照或混合有枸杞提取物的NGM平板上培养。
1.3.3 线虫同步化
为了保证实验过程中线虫生长时期基本一致,需要对线虫进行同步化。培养线虫至成虫,以体内含有较多虫卵为佳。使用M9缓冲液将线虫从培养板上洗下,转移至15 mL离心管中,并用M9缓冲液将液体体积补充至12 mL,2 000×g离心2 min,小心去除上清液,使用M9缓冲液重悬洗涤1 次。离心去除上清液后,在管中加入4 mL Bleach液,不断摇晃并镜检观察,约5~6 min后,大部分虫体断裂,释放出虫卵。立即使用M9缓冲液补充管内液体体积至12 mL,终止反应。2 000×g离心2 min,去除上清液,用M9缓冲液重新悬浮,洗涤3 次。离心去除上清液后,在管中加入4 mL M9缓冲液,20 ℃恒温200 r/min培养过夜,保证虫卵孵化。此时线虫均同步化在L1期。
1.3.4 体外抗氧化能力检测
采用亚铁离子还原/抗氧化能力(ferric reducing/antioxidant power,FRAP)法[17-18]检测3 种枸杞提取物的总抗氧化能力。其原理为在酸性条件下,淡黄色的Fe3+-TPTZ可被样品中还原性物质还原为蓝色的Fe2+-TPTZ形式,于593 nm波长处具有最大吸光度,在Fe3+-TPTZ过量的情况下,检测蓝色物质的生成量可以反映样品的总抗氧化能力。以Trolox为标准溶液,绘制标准曲线,再求得样品相应Trolox的浓度(mmol/L),定义为FRAP值,FRAP值越大,抗氧化活性越强。因此将新配制的190 μL TPTZ工作液置于96 孔酶标板中预热到37 ℃,于593 nm波长处读取吸光度(A1),加入10 μL稀释枸杞提取物样品、标准品、双蒸水(空白对照)并混匀,反应5 min后于593 nm波长处读取吸光度(A2),以A1与A2的差值作为最终的吸光度。最后通过标准曲线求得各样品的FRAP。
1.3.5 ROS水平和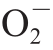 ·荧光强度检测
·荧光强度检测
用M9缓冲液将线虫从培养板上洗下,转移至1.5 mL离心管中,采用活性氧(reactive oxygen species,ROS)-敏感染料DCFH-DA、线粒体红色荧光探针(MitoSox Red)进行检测。线虫在含有20 μmol/L DCFH-DA或1 μmol/L MitoSox Red的M9缓冲液中20 ℃处理30 min,2 000×g离心2 min,去除上清液,用M9缓冲液重新悬浮,洗涤3 次。然后用200 μL M9重悬,转移到黑色96 孔酶标板中,立即在全自动多功能酶标仪中进行检测,DCFH-DA的激发光和发射光波长分别为485 nm和535 nm,MitoSox Red的激发光和发射光波长分别为510 nm和580 nm。
1.3.6 线虫体内抗氧化物酶基因表达水平的测定
用M9缓冲液将线虫从培养板上洗下,转移至1.5 mL离心管中,加入1 mL TRIzol试剂,根据说明书提取总RNA,之后采用M-MuLV逆转录酶将mRNA逆转录为cDNA,通过实时荧光定量PCR系统检测mRNA的相对水平,具体流程如下:样品加热到95 ℃,停留2 min,接下来进行40 个循环(变性94 ℃,1 min;退火58 ℃,1 min;延伸72 ℃,1 min),72 ℃延伸10 min。引物序列如下:sod-1上游引物:5′-CGTAGGCGATCTAGGAAATGTG-3′、下游引物:5′-AACAACCATAGATCGGCCAACG-3′;sod-2上游引物:5′-AGCTTTCGGCATCAACTGTC-3′、下游引物:5′-AAGTCCAGTTGTTGCCTCAAGT-3′;gcs-1上游引物:5′-GTGCAAGTGTCGACGATCGTAC-3′、下游引物:5′-GCGAATATGTTTTGCCAGTGGCTC-3′。
1.3.7 线虫产卵计数
挑取20 只L4时期的线虫分别放置于10 组对照和枸杞接种的NGM平板上培养,之后每天将线虫挑取至新平板后统计虫卵数量到线虫不再产卵为止。
1.3.8 线虫寿命统计
线虫同步化后L4时期的线虫分别挑取50 只放置于对照或枸杞接种的NGM平板上培养,之后每天统计死亡线虫的数量直到全部线虫死亡为止。
1.3.9 细胞质H2O2水平的检测
本实验采用两种转基因(P m y o 3::H y P e r和roGFP2::Orp1)线虫为模型检测不同枸杞提取物对线虫胞质中H2O2的清除能力,将同步化后L4时期的两种转基因线虫分别放置于对照或混合有枸杞提取物的NGM平板上培养。4 d后用M9缓冲液将线虫转移至1.5 mL离心管中,用M9缓冲液洗涤3 次。然后用200 μL M9缓冲液重悬后转移到黑色96 孔酶标板中并检测。HyPer和Orp1探针特异性感知胞质氧化还原状态,HyPer探针氧化态和还原态的激发光波长分别为488 nm和405 nm,发射光波长为530 nm,以480 nm与405 nm波长处荧光强度的比值表示胞质H2O2相对含量。Orp1探针氧化态和还原态的激发光波长分别为405 nm和488 nm,发射光波长同为530 nm,以405 nm与488 nm波长处荧光强度的比值表示胞质H2O2的相对含量。
实验结果采用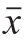 ±s表示。利用SPSS 19.0软件对实验数据进行t检验和方差分析(analysis of variance,ANOVA),P<0.05为差异显著,P<0.01为差异极显著。
±s表示。利用SPSS 19.0软件对实验数据进行t检验和方差分析(analysis of variance,ANOVA),P<0.05为差异显著,P<0.01为差异极显著。
本实验利用FRAP法[19]体外检测比较不同产地枸杞抗氧化能力的差异,同时以Trolox为对照评估枸杞样品质量浓度与抗氧化力之间的关系。
表 1 不同产地枸杞提取物体外总抗氧化能力(n=3)
Table 1 Total antioxidant capacity of Goji berries at different concentrations (n= 3)
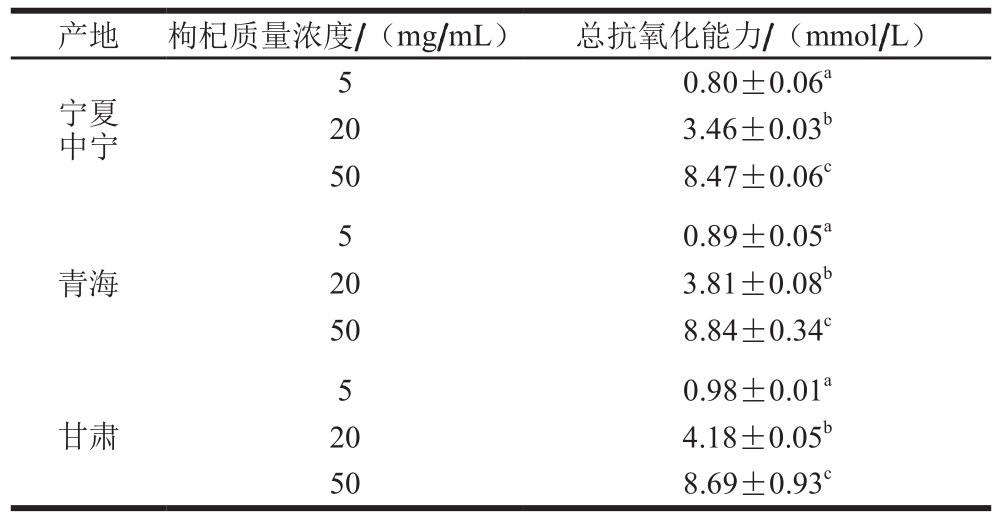
注:肩标小写字母不同表示相同质量浓度、不同产地间差异极显著(P<0.01)。
产地 枸杞质量浓度/(mg/mL) 总抗氧化能力/(mmol/L)宁夏中宁5 0.80±0.06a 20 3.46±0.03b 50 8.47±0.06c 5青海0.89±0.05a 20 3.81±0.08b 50 8.84±0.34c 0.98±0.01a 20 4.18±0.05b 50 8.69±0.93c 5甘肃
由表1可知,3 个产地的枸杞均具有很强的体外抗氧化能力,它们之间没有显著差异。随着枸杞质量浓度的提高,其抗氧化能力梯度增加,因此后续实验选择枸杞质量浓度50 mg/mL做进一步研究。
枸杞在体外有明显的抗氧化作用,为深入探究宁夏中宁枸杞在生物体内的抗氧化作用,本实验采用ROS-敏感染料DCFH-DA检测枸杞对线虫体内ROS水平的影响。由表2可知,枸杞可以降低线虫体内的ROS水平。同时实时荧光定量PCR结果显示,枸杞可以提高抗氧化物酶基因sod-1、sod-2、gcs-1的相对表达水平。
表 2 枸杞对线虫体内ROS水平和抗氧化物酶基因相对表达水平的影响(n=3)
Table 2 Effect of Goji berries on the level of ROS and the relative expression of antioxidant enzymes in C. elegans (n= 3)

注:与对照组相比较,*.差异显著(P<0.05),**.差异极显著(P<0.01)。下同。
gcs-1相对表达水平对照组 5.45±0.08 1.00±0.03 1.00±0.17 1.00±0.04枸杞处理组(50 mg/mL) 2.77±0.18** 1.87±0.15** 1.67±0.16* 1.41±0.08*组别 ROS水平 sod-1相对表达水平sod-2相对表达水平
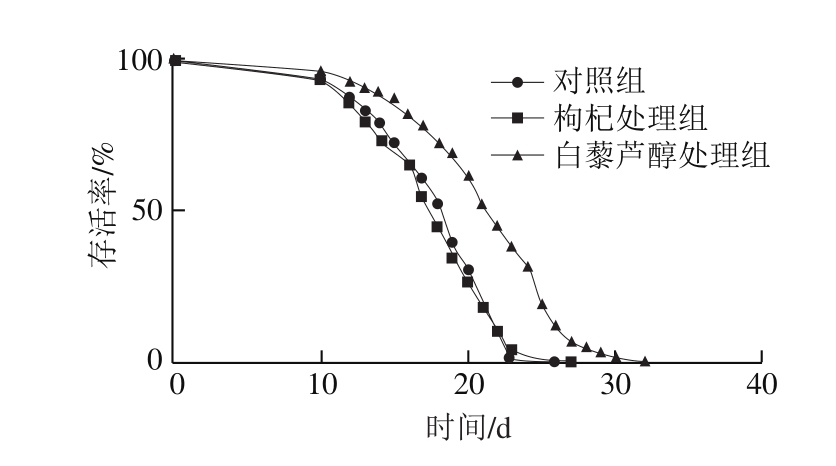
图 1 枸杞对线虫寿命的影响
Fig. 1 Effect of Goji berries on the lifespan of C. elegans
为了深入阐述枸杞在延缓衰老和延长寿命方面的功效,以野生型N2线虫为模型统计了中宁枸杞对线虫寿命的影响。已有研究报道白藜芦醇可以延长线虫寿命[20-21],本实验以白藜芦醇为阳性对照,分析了枸杞对线虫寿命的影响,发现与阳性对照相比,枸杞对线虫的最长寿命没有显著延长作用(图1)。
中医理论中,枸杞具有“益精补肾”的传统功效,很多研究也发现枸杞多糖在保护生殖系统方面具有重要作用[22-23]。有临床研究显示,每日服用枸杞子50 g,连续10 d,可使男性血中睾酮含量显著升高,从而改善精子运动能力,可以用于治疗弱精子症[24],而且枸杞多糖能够促进大鼠睾丸支持细胞体外增殖[25]。为了探索中宁枸杞是否在改善线虫生殖方面具有一定的功效,以野生型N2线虫为模型统计了枸杞对线虫产卵数量的影响。经过多次重复实验,发现枸杞对线虫的产卵总数、开始产卵的时间、结束产卵的时间以及产卵高峰期都没有明显的改变(图2、3)。
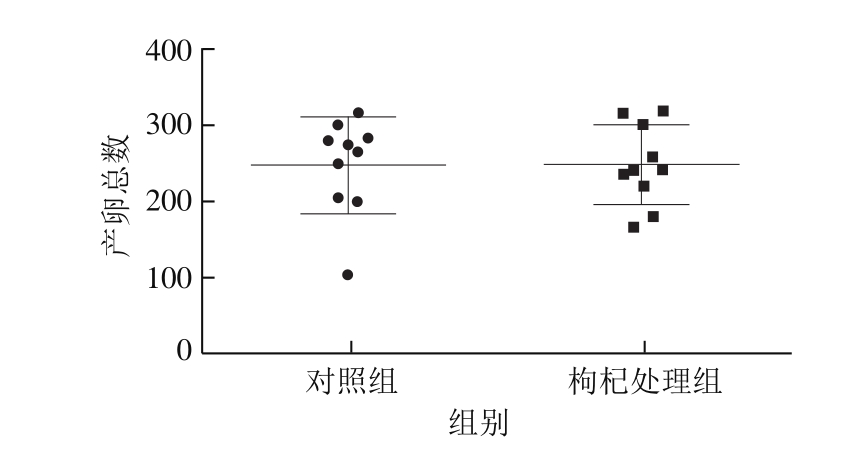
图 2 枸杞对线虫产卵总数的影响
Fig. 2 Effect of Goji berries on the total number of eggs laid by C. elegans

图 3 枸杞对线虫日产卵数的影响
Fig. 3 Effect of Goji berries on the number of daily eggs laid by C. elegans
虽然有研究分析了枸杞多糖对体外活性氧自由基的清除作用[26],但枸杞对细胞内不同细胞器中ROS的清除作用鲜有报道。利用带有荧光标记可以感知胞质中H2O2水平的Pmyo3::HyPer[27]和roGFP2::Orp1[28]两种转基因线虫为模型,检测了枸杞提取物对胞质中H2O2的清除能力。实验结果显示,枸杞总提取物对细胞质中H2O2水平都没有显著的影响。利用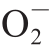 ·特异的荧光探针MitoSox Red进一步检测了枸杞提取物对野生型线虫体内
·特异的荧光探针MitoSox Red进一步检测了枸杞提取物对野生型线虫体内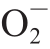 ·水平的影响,发现相对于对照组,枸杞提取物可以显著降低
·水平的影响,发现相对于对照组,枸杞提取物可以显著降低 ·水平(表3)。因此,枸杞提取物的抗氧化能力很可能是通过清除细胞线粒体中
·水平(表3)。因此,枸杞提取物的抗氧化能力很可能是通过清除细胞线粒体中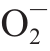 ·来实现的。
·来实现的。
表 3 枸杞对细胞中线粒体和胞质ROS的清除能力(n=3)
Table 3 ROS scavenging effect of Goji berries in mitochondria and cytoplasm (n= 3)

组别 O2-·荧光强度 H2O2荧光强度(Pmyo3::HyPer)H2O2荧光强度(roGFP2::Orp1)对照组 1.45±0.24 0.54±0.05 0.83±0.13枸杞处理组(50 mg/mL) 0.61±0.17* 0.56±0.07 0.93±0.22
衰老是指随着时间推移,生物的生理结构完整性丧失,导致退行性病变和机能衰退,适应性和抵抗力减退,死亡率增加的过程[29]。衰老伴随着机体各个组织器官的老化和退行性病变,与肿瘤、心血管疾病、糖尿病、神经退行性疾病等一系列严重威胁人类健康的疾病密切相关。由于衰老对人类健康和生命造成了巨大威胁,探索衰老的机制、寻求延缓衰老的方法既是一个古老的问题,又是一个崭新的科研领域。为了验证并深入探索《本草纲目》中记载的“枸杞子久服可轻身不老”的功效,以线虫为动物模型开展了相关实验,虽然结果显示枸杞提取物对线虫的最长寿命和产卵能力没有显著影响,但这与其抗衰老功效并不矛盾,而且这与前人研究发现枸杞对果蝇和小鼠的最长寿命没有显著影响是一致的[3],因为抗衰老并不等同于延长最长寿命。随着科技进步,人们对于衰老机制的认识越来越深入,目前关于诱导衰老的机制主要包括以下几个方面:基因组不稳定性、端粒缩短、表观遗传学改变、蛋白质稳态丧失、营养敏感度降低、线粒体功能障碍、细胞衰老、干细胞耗竭和细胞间通讯改变等[29]。这些机制从各个方面阐述了衰老诱导的机体变化和抵抗衰老效应的可能方法,所以枸杞可能是通过调控细胞代谢、蛋白质稳态或线粒体功能等来发挥促进健康衰老功效的,这还有待于进一步深入研究。
自由基衰老学说是经典的衰老学说之一,其认为自由基过度积累导致DNA损伤或蛋白质等大分子氧化损伤是导致衰老的重要原因,所以抗氧化被认为是实现抗衰老的重要方法。事实上,只有自由基的产生和抗氧化系统严重失衡时才会导致组织的损伤。适量自由基的产生不仅为机体提供和传递能量,还是体内多种代谢和信号通路的启动者和调节者,参与体内炎症免疫、代谢、细胞增殖、组织再生修复等各种生命过程的调节。而且细胞内不同细胞器的氧化还原状态是不同的,细胞质和线粒体是偏还原态的,而内质网是偏氧化态的,最近的研究也发现随着衰老过程的发生,细胞中内质网向还原状态转变,而细胞质和线粒体则向氧化态转变[30]。所以,深入研究枸杞在体内发挥抗氧化能力的机制需要具体研究其作用的细胞器。本实验利用感受不同细胞器中ROS的荧光探针,检测了枸杞对细胞质和线粒体中ROS的清除能力,实验结果显示,枸杞可以降低线粒体中O2-·的水平,主要在线粒体中发挥抗氧化作用。前期研究也发现枸杞在阿尔茨海默病模式线虫中可以调控线粒体应激反应[31],这也提示了枸杞在线粒体中的重要功能。因此,枸杞在线粒体中的抗氧化作用可能是其抗衰老作用的一种机制。
[1] 殷玥琪, 印虹, 孙桂菊. 枸杞多糖抗氧化作用研究进展[J]. 中国医药生物技术, 2012, 7(5): 380-382. DOI:10.3969/cmba.j.issn.1673-713X.2012.05.012.
[2] 王心广, 曹有龙. 枸杞抗氧化功能研究进展[J]. 宁夏农林科技, 2011,52(11): 48-52. DOI:10.3969/j.issn.1002-204X.2011.11.020.
[3] 戴寿芝, 文润玲, 李为, 等. 枸杞和枸杞多糖抗衰延寿功效的研究[J].宁夏医学院学报, 1992(1): 12-17.
[4] LIU L, WANG X N, LIU Z, et al. Effect of Lycium bararum polysaccharides on angiotensin II-induced senescence of human umbilical vein endothelial cells and expressions of P53 and P16[J].Journal of Southern Medical University, 2011, 31(7): 1212-1215.DOI:10.3892/mmr.2012.1145.
[5] 王彩霞. 枸杞多糖延缓小鼠皮肤衰老随机平行对照研究[J].实用中医内科杂志, 2012, 26(16): 21-22. DOI:10.3969/j.issn.1671-7813.2012.11.11.
[6] LI X M, MA Y L, LIU X J. Effect of the Lycium barbarum polysaccharides on age-related oxidative stress in aged mice[J].Journal of Ethnopharmacology, 2007, 111(3): 504-511. DOI:10.1016/j.jep.2006.12.024.
[7] LI X M. Protective effect of Lycium barbarum polysaccharides on streptozotocin-induced oxidative stress in rats[J]. International Journal of Biological Macromolecules, 2007, 40(5): 461-465. DOI:10.1016/j.ijbiomac.2006.11.002.
[8] WU H T, HE X J, HONG Y K, et al. Chemical characterization of Lycium barbarum polysaccharides and its inhibition against liver oxidative injury of high-fat mice[J]. International Journal of Biological Macromolecules, 2010, 46(5): 540-543. DOI:10.1016/j.ijbiomac.2010.02.010.
[9] NIU A J, WU J M, YU D H, et al. Protective effect of Lycium barbarum polysaccharides on oxidative damage in skeletal muscle of exhaustive exercise rats[J]. International Journal of Biological Macromolecules, 2008, 42(5): 447-449. DOI:10.1016/j.ijbiomac.2008.02.003.
[10] LI G L, YANG J J, REN B B, et al. Effect of Lycium barbarum L on defending free radicals of mice caused by hypoxia[J].Journal of Hygiene Research, 2002, 31(1): 30-31. DOI:10.3969/j.issn.1000-8020.2002.01.011.
[11] 张莲香, 陈海军, 胡嘉航, 等. 宁夏无果枸杞芽提取物对自然衰老小鼠SOD、MDA及NCAM的影响[J]. 宁夏医科大学学报, 2012, 34:1265-1268. DOI:10.16050/j.cnki.issn1674-6309.2012.12.009.
[12] 王彩霞. 枸杞多糖对衰老模型小鼠皮肤的影响[C]//2014中华中医药学会美容分会学术年会暨重庆市中医药学会皮肤外科专业委员会年会论文集. 重庆: 中华中医药学会美容分会, 2014: 13-15.
[13] AMAGASE H, SUN B, BOREK C. Lycium barbarum (goji)juice improves in vivo antioxidant biomarkers in serum of healthy adults[J]. Nutrition Research, 2009, 29(1): 19-25. DOI:10.1016/j.nutres.2008.11.005.
[14] 程桂花. 枸杞子抗衰老作用的临床研究[J]. 中国医药指南, 2012,10(34): 287-288. DOI:10.15912/j.cnki.gocm.2012.34.064.
[15] BRENNER S. The genetics of Caenorhabditis elegans[J]. Genetics,1974, 77(1): 71-94.
[16] MIRANDA-VIZUETE A, VEAL E A. Caenorhabditis elegans as a model for understanding ROS function in physiology and disease[J].Redox Biology, 2017, 11: 708-714. DOI:10.1016/j.redox.2016.12.020.
[17] BENZIE I F, STRAIN J J. The ferric reducing ability of plasma (FRAP)as a measure of “antioxidant power”: the FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76. DOI:10.1006/abio.1996.0292.
[18] BENZIE I F, STRAIN J J. Ferric reducing/antioxidant power assay:direct measure of total antioxidant activity of biological fluids and modified version for simultaneous measurement of total antioxidant power and ascorbic acid concentration[J]. Methods in Enzymology,1999, 299: 15-27.
[19] 李洋, 马文平, 倪志婧. 宁夏枸杞体外抗氧化机理研究[J]. 食品科学,2014, 35(1): 79-84. DOI:10.7506/spkx1002-6630-201401015.
[20] BASS T M, WEINKOVE D, HOUTHOOFD K, et al. Effects of resveratrol on lifespan in Drosophila melanogaster and Caenorhabditis elegans[J]. Mechanisms of Ageing & Development, 2007, 128(10):546-552. DOI:10.1016/j.mad.2007.07.007.
[21] FISCHER N, BÜCHTER C, KOCH K, et al. The resveratrol derivatives trans-3,5-dimethoxy-4-fluoro-4’-hydroxystilbene and trans-2,4’,5-trihydroxystilbene decrease oxidative stress and prolong lifespan in Caenorhabditis elegans[J]. Journal of Pharmacy &Pharmacology, 2017, 69(1): 73-81. DOI:10.1111/jphp.12657.
[22] 罗琼, 黄晓兰, 李卓能, 等. 枸杞多糖对雄性大鼠性功能及生殖功能的影响[J]. 营养学报, 2006(1): 62-65; 70. DOI:10.3321/j.issn:0512-7955.2006.01.017.
[23] 黄晓兰, 杨明亮, 吴晓旻, 等. 枸杞多糖对大鼠生殖系统保护作用的机制探讨[J]. 武汉大学学报(医学版), 2004(1): 29-31; 41.DOI:10.3969/j.issn.1671-8852.2004.01.009.
[24] 王永磊, 俞旭君, 王梓童, 等. 枸杞子治疗弱精子症的临床应用[J].内蒙古中医药, 2013, 32(7): 123-125. DOI:10.16040/j.cnki.cn15-1101.2013.07.050.
[25] 南亚昀, 李阳, 雍学芳, 等. 枸杞多糖对大鼠睾丸支持细胞体外增殖的影响[J]. 中国中医急症, 2015, 24(1): 35-37. DOI:10.3969/j.issn.1004-745X.2015.01.012.
[26] 李贵荣. 枸杞多糖的提取及其对活性氧自由基的清除作用[J]. 中国现代应用药学, 2002(2): 94-96. DOI:10.13748/j.cnki.issn1007-7693.2002.02.005.
[27] MISHINA N M, MARKVICHEVA K N, BILAN D S, et al.Visualization of intracellular hydrogen peroxide with HyPer, a genetically encoded fluorescent probe[J]. Methods in Enzymology,2013, 526: 45-59. DOI:10.1016/b978-0-12-405883-5.00003-x.
[28] GUTSCHER M, SOBOTTA M C, WABNITZ G H, et al. Proximitybased protein thiol oxidation by H2O2-scavenging peroxidases[J].Journal of Biological Chemistry, 2009, 284(46): 31532-31540.DOI:10.1074/jbc.M109.059246.
[29] LÓPEZOTíN C, BLASCO M A, PARTRIDGE L, et al. The hallmarks of aging[J]. Cell, 2013, 153(6): 1194-1217. DOI:10.1016/j.cell.2013.05.039.
[30] KIRSTEIN J, MORITO D, KAKIHANA T, et al. Proteotoxic stress and ageing triggers the loss of redox homeostasis across cellular compartments[J]. EMBO Journal, 2015, 34(18): 2334-2349.DOI:10.15252/embj.201591711.
[31] MENG J, LÜ Z, LI X, et al. Lycium extracts protect against β-amyloidinduced pathological behaviors through UPRmt in transgenic Caenorhabditis elegans[J]. Journal of Aging and Age Related Disease,2017, 1: 1001.
Effect of Goji Berries (Lycium barbarum) on Lifespan and Spawning of Caenorhabditis elegans and Its Antioxidant Capacity
LÜ Zhenyu, MENG Jiao, SUN Chuanxin, et al. Effect of Goji berries (Lycium barbarum) on lifespan and spawning of Caenorhabditis elegans and its antioxidant capacity[J]. Food Science, 2019, 40(5): 183-188. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20171016-119. http://www.spkx.net.cn