山楂原花青素对人肝癌SMMC-7721细胞增殖和凋亡的影响
孙思明,徐宏伟,郭凯元,郭梦冉,崔胜男,崔 同,檀建新*
(河北农业大学食品科技学院,河北省农产品加工工程技术研究中心,河北 保定 071001)
摘 要:目的:探讨山楂原花青素提取物、表儿茶素和原花青素B2对人肝癌SMMC-7721细胞增殖及凋亡的影响。方法:体外培养SMMC-7721细胞,噻唑蓝法检测不同质量浓度山楂原花青素对细胞增殖的影响;4’,6-二脒基-2-苯基吲哚染色法观察细胞凋亡,Western blot法检测细胞凋亡相关蛋白的表达;检测每组细胞中过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、Na+K+-ATP酶活力和丙二醛(malondialdehyde,MDA)含量。结果:山楂原花青素提取物、表儿茶素和原花青素B2呈时间和质量浓度依赖性地显著抑制SMMC-7721细胞的增殖(P<0.05),促进细胞凋亡;与对照组相比,SMMC-7721细胞中SOD、CAT、GSH-Px、Na+K+-ATP酶活力降低,MDA含量升高;细胞凋亡相关蛋白半胱天冬酶-8、半胱天冬酶-3、Bcl-2相关X蛋白表达量和多聚二磷酸腺苷核糖聚合酶片段化增加,Bcl-2表达量降低。结论:山楂原花青素可通过影响抗氧化酶活力和细胞凋亡相关蛋白来抑制SMMC-7721细胞增殖,促进细胞凋亡。
关键词:山楂原花青素;抗氧化活性;人肝癌SMMC-7721细胞;细胞增殖;细胞凋亡
原花青素(proanthocyanidins,PCs)是一类以黄烷醇及其衍生物为结构单元的多酚类聚合物,其种类繁多、结构复杂,具有极强的抗氧化作用[1-2]。经检测,87 个科的600多种种子植物中都含有PCs,其中山楂(Crataegus pinnatifida Bunge)富含PCs,且构成PCs的结构单元只有表儿茶素,平均聚合度低,只有2~3 个聚合度[3]。
研究表明,从食物中摄取的PCs具有调节细胞凋亡[4]、抗氧化[5]、抗衰老[6]、抗肿瘤[7]、预防老年痴呆[8]、降血压血脂[9]、预防心血管疾病[10]等作用。这些功能可能与其抗氧化作用和对细胞凋亡的调节作用有关。研究证明,PCs能够有效地清除 ·、·OH、NO·、ONOO-·、1,1-二苯基-2-三硝基苯肼(1-diphenyl-2-picrylhydrazyl,DPPH)自由基、·CH3等自由基[11],保护内源性抗氧化物质,加强体内的抗氧化防御系统。Jordão等[12]发现葡萄酒清除自由基能力和抗氧化活性与其PCs含量之间呈线性关系;Wang Xinghui等[13]研究表明葡萄籽PCs可以通过提高超氧化物歧化酶(superoxide dismutase,SOD)活力、降低丙二醛(malondialdehyde,MDA)含量来改善去氧皮质酮-盐型高血压小鼠模型的氧化应激反应,缓解高血压症状。细胞凋亡是由细胞自身基因控制的自主有序死亡,PCs对细胞凋亡有双向调节作用[3],这种作用可能是通过其调节活性氧(reactive oxygen species,ROS)水平来完成的。实验证明,低聚原花青素能够通过减少ROS生成、降低细胞Ca2+浓度来缓解六溴环十二烷的细胞毒性,减少人肝癌HepG2细胞的凋亡[14]。另一方面,人们发现PCs可以引起多种肿瘤细胞如乳腺癌细胞、肺癌细胞、胃腺癌细胞的凋亡。Faria等[15]证明葡萄籽PCs除了抗氧化活性外,还具备很强的抑制人乳腺癌株MCF-7细胞DNA合成的能力,从而能够抑制癌细胞的增殖,诱导其凋亡。
·、·OH、NO·、ONOO-·、1,1-二苯基-2-三硝基苯肼(1-diphenyl-2-picrylhydrazyl,DPPH)自由基、·CH3等自由基[11],保护内源性抗氧化物质,加强体内的抗氧化防御系统。Jordão等[12]发现葡萄酒清除自由基能力和抗氧化活性与其PCs含量之间呈线性关系;Wang Xinghui等[13]研究表明葡萄籽PCs可以通过提高超氧化物歧化酶(superoxide dismutase,SOD)活力、降低丙二醛(malondialdehyde,MDA)含量来改善去氧皮质酮-盐型高血压小鼠模型的氧化应激反应,缓解高血压症状。细胞凋亡是由细胞自身基因控制的自主有序死亡,PCs对细胞凋亡有双向调节作用[3],这种作用可能是通过其调节活性氧(reactive oxygen species,ROS)水平来完成的。实验证明,低聚原花青素能够通过减少ROS生成、降低细胞Ca2+浓度来缓解六溴环十二烷的细胞毒性,减少人肝癌HepG2细胞的凋亡[14]。另一方面,人们发现PCs可以引起多种肿瘤细胞如乳腺癌细胞、肺癌细胞、胃腺癌细胞的凋亡。Faria等[15]证明葡萄籽PCs除了抗氧化活性外,还具备很强的抑制人乳腺癌株MCF-7细胞DNA合成的能力,从而能够抑制癌细胞的增殖,诱导其凋亡。
自由基清除实验表明PCs清除能力的高低可能与其羟基数量、没食子酰化程度、单体组成、单体间连接方式及聚合度等有关[16-18]。用PCs处理细胞也得到了类似的结果。Lizarraga等[19]的研究表明葡萄籽PCs的平均聚合度和没食子酰化程度要高于松树皮中的PCs,高聚合度和没食子酰基化程度的葡萄籽PCs具有更高的ROS清除能力和诱导人肠癌HT29细胞凋亡作用,并且证明了PCs清除自由基的能力和使DNA浓缩断裂及抗癌细胞增殖能力间呈正相关。Lozano等[20]发现诱导HT29细胞凋亡能力可能与儿茶素没食子酰基化有关,但主要机制在于电子传递效率。ROS形成过程中,电子传递效率越高,越容易引起细胞凋亡,从而抑制癌症发生。赵丹等[18]证明聚合度越高,去除自由基的能力越弱。因此,PCs的结构组成和聚合度与抗氧化之间的关系仍需进一步探讨。
据统计,肝癌是世界上最常见的恶性肿瘤之一,预计2018年在世界范围内肝癌发病率位居恶性肿瘤第6位,死亡率排在第4位;其中男性患者更是高居发病率的第5位,死亡率的第2位[21]。从天然动植物中寻找可以防治肿瘤的有效成分,可为预防和治疗癌症提供了新的思路。本实验通过研究山楂PCs提取物及其主要成分对人肝癌SMMC-7721细胞的增殖抑制作用及其对抗氧化和细胞凋亡的影响,探究不同PCs的作用功效,为充分合理地利用丰富的膳食PCs资源提供实验依据,为肝癌的防治提供新思路。
1 材料与方法
1.1 材料与试剂
SMMC-7721细胞由河北医科大学第四医院动物中心提供,人肝HL-7702细胞购于上海羽朵生物科技有限公司。山楂PCs提取物、表儿茶素、PCs B2由河北农业大学崔同教授实验室纯化制得,纯度大于99%。
RPIM-1640细胞培养基 美国HyClone公司;胎牛血清 赛默飞世尔科技(中国)有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)、质量分数0.25%胰蛋白酶溶液-乙二胺四乙酸北京博奥拓达科技有限公司;4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI) 索莱宝生物科技有限公司;超微量Na+K+-ATP酶试剂盒、MDA试剂盒、总SOD试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、过氧化氢酶(catalase,CAT)试剂盒,总蛋白定量试剂盒 南京建成生物工程研究所;半胱天冬酶(Caspase)-3、Caspase-8、多聚二磷酸腺苷核糖聚合酶(poly (ADP-ribose) polymerase,PARP)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、Bcl-2蛋白 美国Cell Signaling Technology公司;山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)(H+L)、抗小鼠IgG(H+L) 康为世纪生物科技有限公司。
1.2 仪器与设备
Multiskan Spectrum全波长酶标仪 赛默飞世尔科技(中国)有限公司;CKX41荧光倒置显微镜 日本奥林巴斯公司;JY96-IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;MiniChemi I化学发光成像系统北京赛智创业科技有限公司。
1.3 方法
1.3.1 细胞活力检测
根据本课题组前期研究及预实验确定药品质量浓度(6.25、12.5、25、50、100 μg/mL),选取PCs提取物(主要含有机酸和PCs类物质,包括表儿茶素、PCs B2、PCs B5、PCs C1、PCs三聚体、PCs四聚体、PCs五聚体等)[22]、表儿茶素和PCs B2进行实验。细胞活力检测采用MTT法[23]。参考试剂盒说明书,取对数生长期细胞,调节细胞为105 个/mL,每孔100 μL接种于96 孔板中(板边缘孔用无菌磷酸盐缓冲液(phosphate buffered saline,PBS)填充)。细胞置于培养箱中培养,待细胞贴壁后,弃去培养基,加入含不同质量浓度药品的不含血清的细胞培养液100 μL,对照组为等体积无血清、无药品培养基,设5 个复孔。分别培养24、48 h后弃去培养液,加入由10 μL MTT溶液和90 μL无血清培养基组成的培养液,放入培养箱中继续培养4 h,细胞底部生成蓝紫色结晶甲瓒后,小心用移液器吸去上清培养液,加入DMSO,置于摇床上低速振荡10 min,测490 nm波长处吸光度。实验重复3 次。PCs对细胞增殖抑制率的计算公式如下,细胞存活率/%=100%-细胞增殖抑制率/%。
1.3.2 细胞形态观察
取对数期细胞,调节细胞为106 个/孔,每孔1 mL接种于6 孔板中,置于培养箱中培养。待细胞贴壁后,弃去培养基,分别加入含100 μg/mL山楂PCs提取物、表儿茶素和PCs B2的不含血清的细胞培养液1 mL,对照组为等体积无血清、无药品培养基。培养48 h后,于荧光倒置显微镜下观察细胞形态。
1.3.3 DAPI染色法观察细胞凋亡
参考文献[24]和试剂盒说明书,取对数期细胞,调节细胞为105 个/孔,接种于24 孔板中,置于培养箱中培养。待细胞贴壁后弃去培养基,分别加入含50、100、150 μg/mL山楂PCs提取物、表儿茶素和PCs B2的不含血清的细胞培养液1 mL,对照组为等体积无血清、无药品培养基。培养48 h后,弃去培养基,加入PBS漂洗两次,然后加入DAPI工作液至终质量浓度为1 μg/mL,放入37 ℃培养箱中培养15 min。洗掉DAPI工作液,用PBS洗2~3 次,每次3~5 min,吸出PBS,荧光显微镜下观察细胞凋亡情况。
1.3.4 细胞酶活力和MDA含量检测
取对数期细胞,调节细胞为105 个/孔,接种于6 孔板中,置于培养箱中培养。待细胞贴壁后,弃去培养基,分别加入含50、100、150 μg/mL山楂PCs提取物、表儿茶素和PCs B2的不含血清的细胞培养液1 mL,对照组为等体积无血清、无药品培养基。培养48 h后用4 ℃预冷的PBS洗两次,用细胞刮板将细胞刮下,4 ℃离心机中1 000 r/min离心10 min。去上清液,用生理盐水洗一遍,再次离心10 min;去上清液,加入300 μL生理盐水,冰水浴条件下用超声波细胞粉碎机进行细胞破碎(功率300 W、5 s/次、间隔30 s、重复3~5 次)。参照试剂盒说明书测定细胞CAT、SOD、GSH-Px和Na+K+-ATP酶活力和MDA含量。
1.3.5 Western bolt法检测细胞凋亡相关蛋白的表达
参照文献[25]的方法,样品经过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、转膜、一抗和二抗杂交、ECL Plus显色,使用凝胶成像系统成像,以β-actin为内参蛋白。
1.4 数据统计与分析
用Excel 2013软件和SPSS 20.0软件对实验结果进行单因素方差分析,P<0.05表示差异显著,P<0.01表示差异极显著,P<0.001表示差异高度显著。采用GraphPad Prism 5软件作图。
2 结果与分析
2.1 山楂PCs对细胞增殖的影响
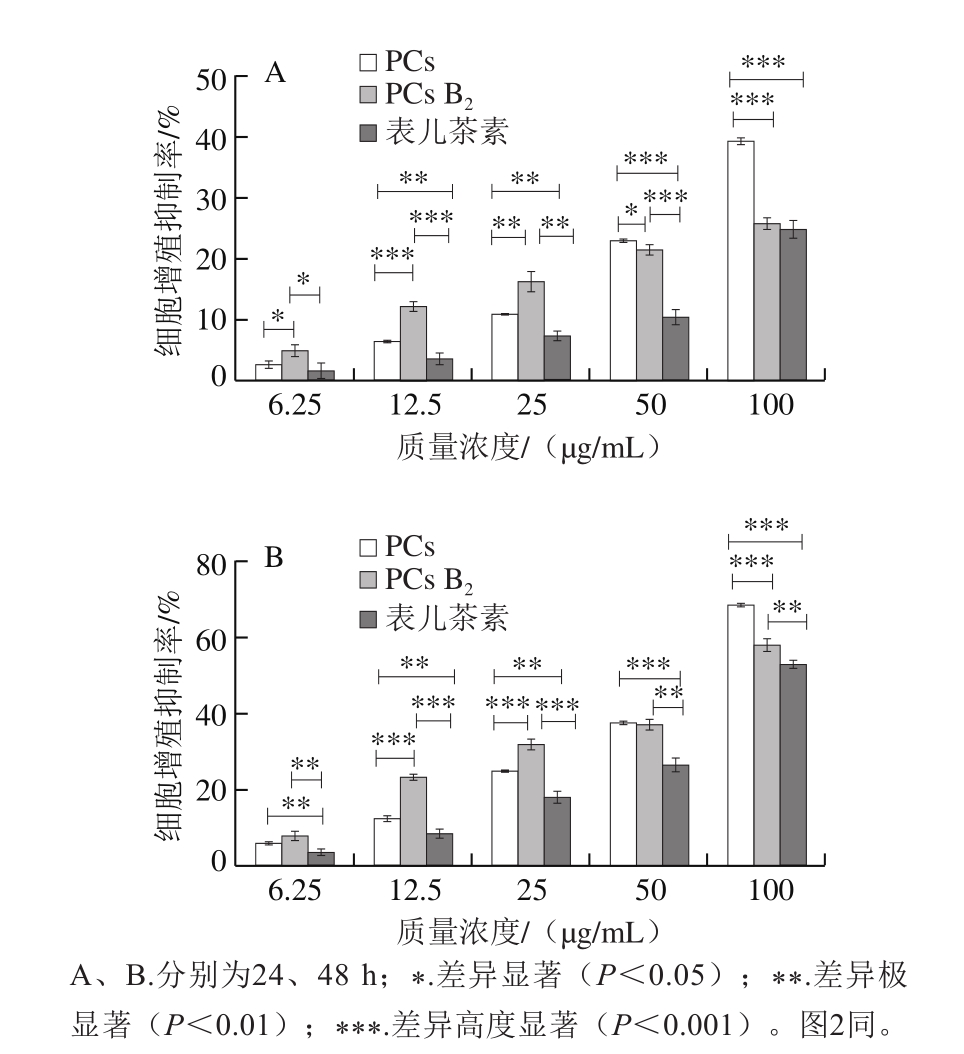
山楂中含有多种多酚类化合物,其中PCs种类多且含量较高。由图1可知,处理时间相同(如24 h)时,山楂PCs提取物对SMMC-7721细胞的增殖抑制率随质量浓度提高而增加,呈现明显的质量浓度依赖效应,质量浓度为6.25、12.5、25、50、100 μg/mL的PCs提取物抑制率分别为2.77%、6.40%、10.85%、22.91%、39.19%;表儿茶素和PCs B2也有类似的效应。同一质量浓度的PCs处理不同时间,其抑制率随处理时间的延长而升高,表现出时间依赖性,如25 μg/mL PCs B2处理24 h时抑制率为16.08%,48 h时则升至到31.95%,增加了近1 倍。虽然山楂PCs提取物、表儿茶素和PCs B2对SMMC-7721细胞增殖的抑制作用规律相近,但是相同质量浓度处理相同时间的不同种PCs对SMMC-7721细胞增殖的抑制效果却有一定差异,在质量浓度低于25 μg/mL时,PCs B2对细胞增殖的抑制效果最好,表儿茶素对细胞增殖的抑制率最低;而在50、100 μg/mL时,山楂PCs提取物的细胞增殖抑制率最高。由此可见,不同种类的PCs可呈浓度和时间依赖性的对SMMC-7721细胞增殖产生抑制作用,且与对照组(细胞增殖抑制率为0,未在图中显示)相比差异显著(P<0.05)。
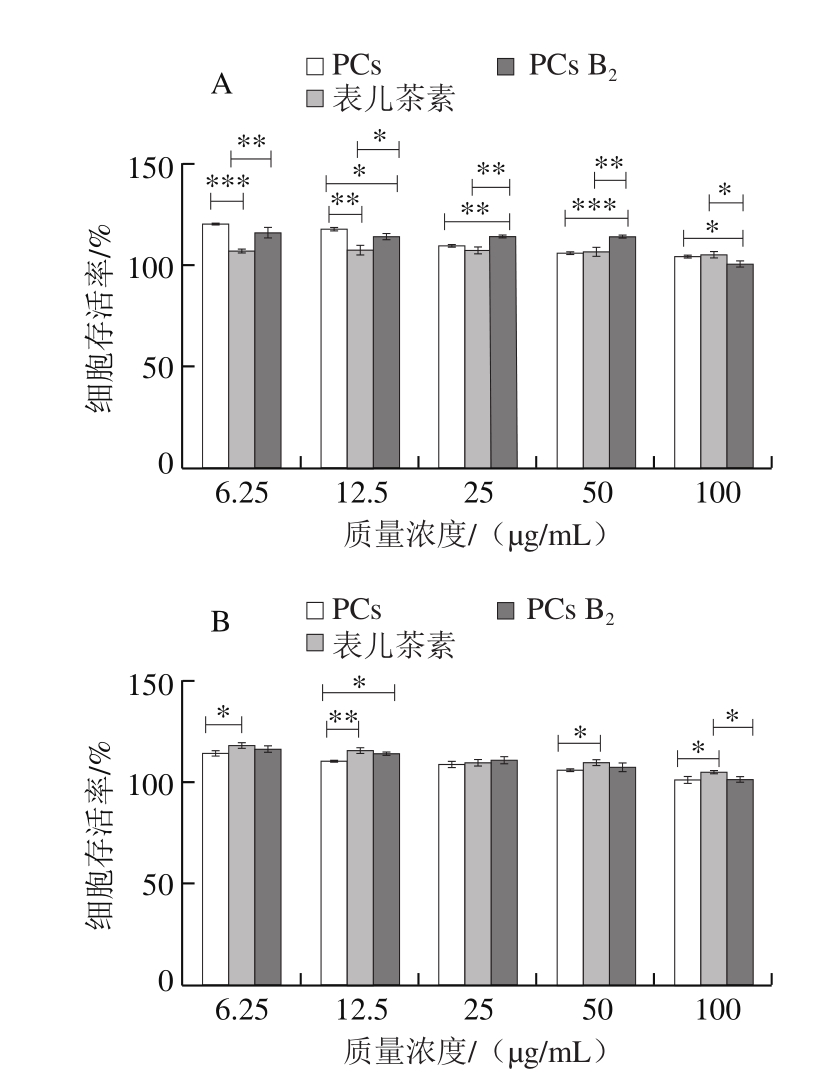
如图2所示,采用相同质量浓度PCs和时间处理HL-7702细胞,与无药物处理的细胞(细胞存活率为100%,未在图中显示)相比,3 种PCs对HL-7702细胞存活率无明显影响,低质量浓度下还略有提高作用,说明本实验选取的PCs质量浓度和处理时间对正常细胞无毒害作用。
2.2 PCs处理SMMC-7721细胞的形态变化和细胞凋亡情况
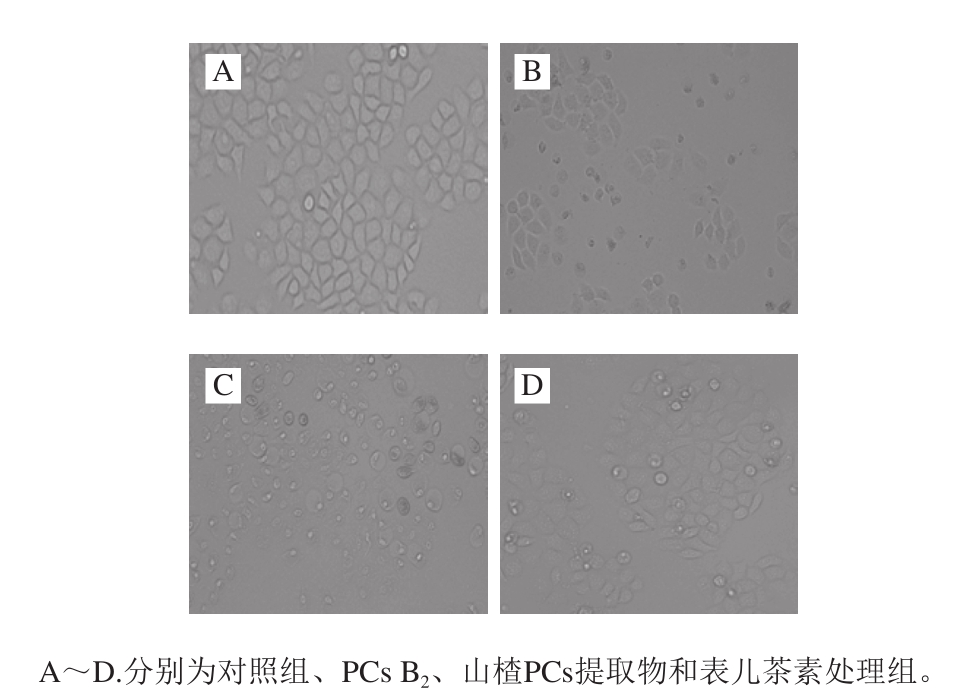
选用对正常HL-7702细胞活力无影响,但对SMMC-7721细胞抑制力最强的100 μg/mL 3 种PCs进行实验。如图3所示,未加PCs处理的对照组细胞呈现原有的多角形,大小相似、紧密相连、贴壁良好、均匀透亮。山楂PCs提取物、表儿茶素和PCs B2处理组细胞大小不一、数量减少,形态变小、变圆,且出现脱壁漂浮现象,有凋亡小体产生,胞内亮度不均,表明细胞出现不同程度的凋亡状态,程度由重到轻依次为山楂PCs提取物、PCs B2和表儿茶素处理组,这与2.1节MTT法得到的结果一致。
如图4所示,未经处理的对照组细胞染色后呈现均匀的暗蓝色荧光,细胞形态整齐均一;而用PCs处理后细胞膜完整性降低、通透性增加,细胞收缩、核染色质固缩,染色后细胞核局部呈现出比对照组更强烈的蓝色荧光,凋亡晚期细胞可看到凋亡小体,这些特征说明3 种PCs均可诱导SMMC-7721细胞凋亡,且凋亡特征随着PCs质量浓度的增加而越发明显,山楂PCs提取物促进SMMC-7721细胞凋亡的效果优于其他两种,再次印证了前文中得到的结果。
2.3 PCs对SMMC-7721细胞中MDA含量和抗氧化酶活力的影响
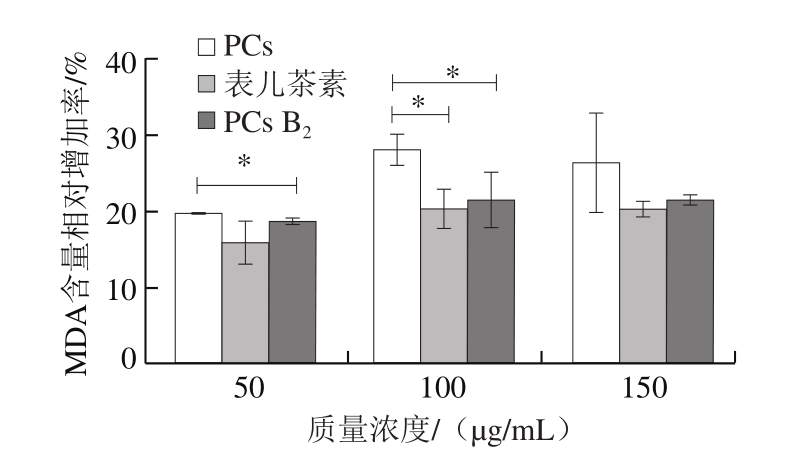
由图5可知,PCs可以显著提高SMMC-7721细胞中MDA含量(P<0.05),且呈浓度依赖性。山楂PCs提取物处理的细胞中MDA相对增加率最高,其次为PCs B2和表儿茶素。与对照组相比,150 μg/mL山楂PCs提取物、PCs B2和表儿茶素使细胞中MDA含量分别增加26.11%、21.08%和20.01%。
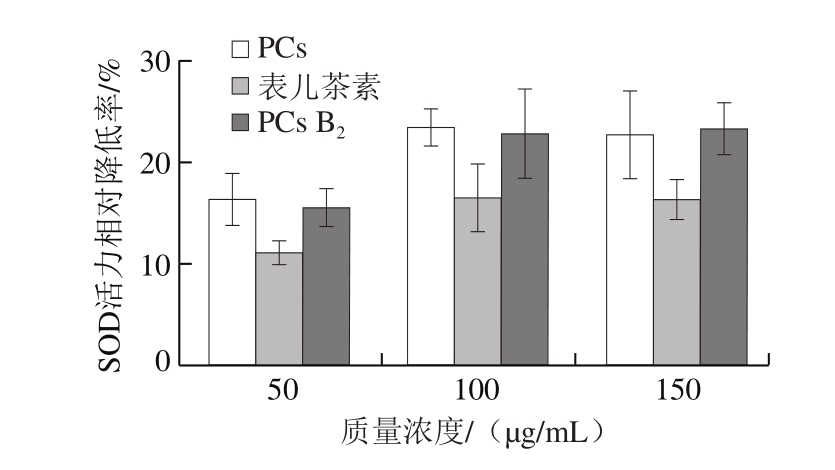
图6表明PCs可以显著降低SMMC-7721细胞中SOD活力(P<0.05),且呈浓度依赖性。与对照组相比,150 μg/mL山楂PCs提取物、PCs B2和表儿茶素分别使细胞中SOD活力降低23.06%、22.84%和16.10%。
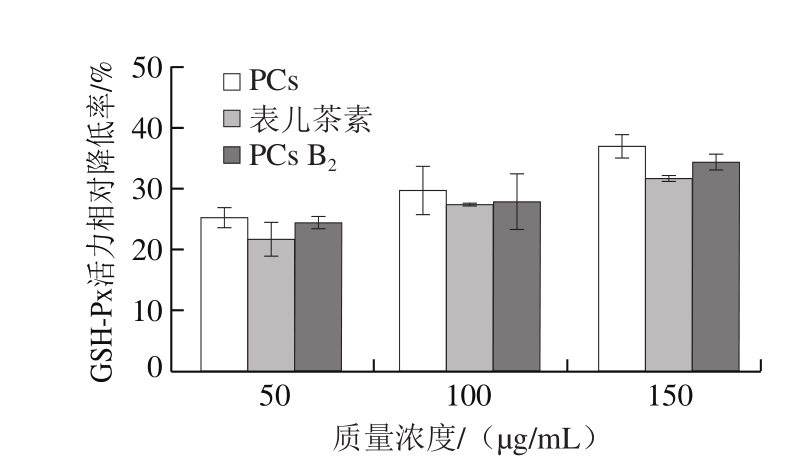
图7表明,PCs可以显著降低SMMC-7721细胞中GSH-Px活力(P<0.05),且呈浓度依赖性。3 种PCs的作用效果和规律与其对SOD活力的影响表现出高度一致性。与对照组相比,150 μg/mL山楂PCs提取物、PCs B2和表儿茶素分别使细胞中GSH-Px活力降低36.97%、34.31%和31.80%。
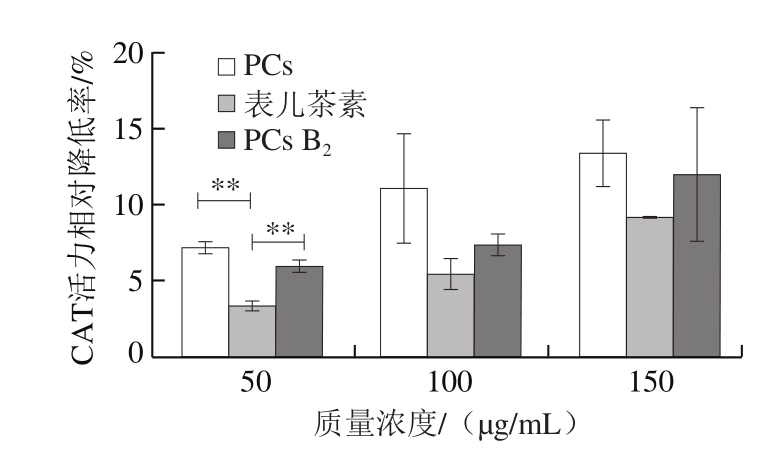
如图8所示,与对照组相比,PCs可以显著降低SMMC-7721细胞中CAT活力(P<0.05),且呈浓度依赖性。150 μg/mL山楂PCs提取物、PCs B2和表儿茶素对细胞中CAT活力的相对降低率分别为13.20%、11.05%和9.12%。
2.4 PCs对SMMC-7721细胞Na+K+-ATP酶活力的影响
图9表明,PCs呈浓度依赖性的显著降低SMMC-7721细胞中Na+K+-ATP酶的活力(P<0.05),说明细胞吸钾排钠功能和细胞主动运输能力的减弱。3 种PCs中,山楂PCs提取物对细胞中Na+K+-ATP酶活力相对降低率最高,其次为PCs B2和表儿茶素。与对照组相比,150 μg/mL山楂PCs提取物、PCs B2和表儿茶素对细胞中Na+K+-ATP酶活力分别降低21.13%、17.41%和16.01%,这一结果与2.3节抗氧化酶活力的变化相似。
2.5 PCs对SMMC-7721细胞凋亡信号转导的影响
如图10所示,PCs对SMMC-7721细胞作用后,PCs提取物、PCs B2和表儿茶素都使Caspase-8的表达呈现增加趋势;同时,促凋亡蛋白Bax的表达量有增加的趋势,而抑制凋亡蛋白Bcl-2表达则有降低的趋势,说明Bax与Bcl-2比值增大。Caspase-3在Caspase-8和Bax、Bcl-2引发信号转导途径中的级联反应的下游,图10中显示Caspase-3被活化,产生活化的Caspase-3,导致PARP片段化增加,最终诱导细胞凋亡。
3 讨 论
目前,大量研究证明PCs提取物具有自由基清除能力和抗氧化活性[26],对癌细胞增殖有显著的抑制作用[27],也有一些实验表明这与PCs的浓度和结构具有较强的相关性[16-18,28]。实验表明多种PCs单体都能提高脂质抗氧化能力和抗低密度脂蛋白氧化能力[29];等物质的量的多聚PCs、寡聚PCs和黄烷醇单体的抗氧化性依次减弱[28]。Zhang Shuting等[30]用DPPH、总抗氧化能力检测和铁离子还原/抗氧化能力法3 种方法证明了葡萄籽提取物中多聚PCs水解物的自由基清除作用具有浓度效应,且与其结构相关,其抗氧化活性由强到弱顺序为:表儿茶素没食子酸酯根皮酚衍生物>表儿茶素没食子酸酯>表儿茶素根皮酚衍生物>儿茶素根皮酚衍生物>儿茶素>表儿茶素>水溶性VE。Wang等[31]的研究发现,槟榔籽PCs聚合程度越高,对细胞引起的氧化性伤害越大,细胞凋亡越多。Lizarraga等[19]的研究表明,具有高聚合度和没食子酰基化度的葡萄籽PCs较松树皮中低聚合度和低没食子酰基化度的PCs具有更高的ROS清除能力和诱导人肠癌HT29细胞凋亡的作用。上述研究证明PCs抗氧化活性可能与聚合物中单体的数目、羟基的数量和没食子酰基化度等指标相关。本研究发现不同质量浓度和组成的PCs对细胞的作用具有差异:在样品质量浓度为6.25、12.5 μg/mL及25 μg/mL时,PCs B2对细胞增殖的抑制效果较好;而样品在50 μg/mL及100 μg/mL时,山楂PCs提取物对细胞增殖的抑制效果最好,PCs的癌细胞增殖抑制作用和促进癌细胞凋亡作用顺序为:山楂PCs提取物>PCs B2>表儿茶素,且与质量浓度和时间成正比。本研究所用山楂PCs提取物含有多种活性成分[22],主要是有机酸、表儿茶素、PCs B2、PCs B5、PCs C1和绿原酸等,故而其活性较PCs B2和表儿茶素更好。虽然还不能明确地判定PCs的聚合度和其活性之间的关系,但也基本体现了总体趋势。
PCs处理SMMC-7721细胞后,细胞的增殖受到了抑制。本研究通过对PCs作用后的细胞形态进行观察和DAPI染色,发现PCs作用于SMMC-7721细胞后,细胞发生凋亡,表明PCs对细胞增殖的抑制作用是通过诱导细胞凋亡实现的。PCs作用于SMMC-7721细胞后,出现凋亡细胞的形态特征。进一步用DAPI染色后,可以看到细胞收缩、核染色质固缩,染色后细胞核局部呈现出比对照组更为强烈的蓝色荧光,凋亡晚期细胞可看到凋亡小体。但100 μg/mL PCs处理后的SMMC-7721细胞经DAPI染色后,明亮蓝色荧光最多,考虑可能是150 μg/mL PCs处理后细胞凋亡脱落,被PBS洗脱。故用150 μg/mL PCs处理SMMC-7721细胞后,DAPI染色出现明亮的蓝色荧光反而较少。
正常情况下,机体内存在的抗氧化酶如SOD和非酶的抗氧化物如VE通过清除体内氧化物质维持机体正常生理功能[32]。但当机体抗氧化系统损坏、遭遇外源物质胁迫时,氧化物质的产生和清除的平衡被打破,氧化物质含量增加,进而导致DNA损伤,细胞信号转导发生紊乱,细胞凋亡。研究发现葡萄籽提取物PCs可以使肝癌细胞的MDA含量和ROS水平降低,增强SOD活力。许慧[33]证明加入莲房PCs后,会诱导HepG2细胞内ROS积蓄,导致细胞DNA损伤及线粒体膜电位的损失,诱导细胞凋亡。本研究发现,山楂PCs会增加SMMC-7721细胞内MDA含量,使细胞中SOD、CAT和GSH-Px活力降低。推测PCs可通过降低抗氧化酶活力,导致过氧化物质清除率降低,最终致使胞内MDA含量升高,进而诱导细胞凋亡。但PCs对癌细胞中氧化物质含量和抗氧化酶活力的分子调控机理还需要进一步研究。
Na+K+-ATP酶位于细胞膜上,具有载体蛋白和ATP水解酶的活力,通过酶构象的变化水解ATP,驱动细胞吸钾排钠,与膜两侧的膜电位稳定、调节渗透压和营养物质运输以及信号转导密切相关。研究显示,神经胶质瘤和乳腺癌等多种细胞株中,Na+K+-ATP酶呈现高水平表达[34-35]。Lefranc等[34]利用RNA干扰技术敲低神经胶质瘤U372-MG细胞中Na+K+-ATP酶α1亚单位的表达,可抑制肿瘤细胞增殖活性。肿瘤细胞中高活性Na+K+-ATP酶可为肿瘤细胞生长提供充足的能量,促进细胞增殖;反之,可以抑制细胞增殖。强心甾类固醇作为Na+K+-ATP酶抑制剂,通过抑制酶活力抑制肿瘤细胞能量来源并抑制Na+K+-ATP酶相关信号通路,达到抗肿瘤作用。本研究证明山楂PCs可以抑制Na+K+-ATP酶活力,这很可能是引起细胞凋亡的原因之一。
Papademetrio等[36]的研究指出,儿茶素可以通过使细胞线粒体膜电位损失、下调生存素蛋白和Bcl-2表达、增加促凋亡蛋白Bax表达来诱导细胞凋亡,从而达到抗癌的目的。Roy等[25]的研究证明,葡萄籽PCs依赖于p53蛋白,并通过Bcl-2、Bax和Caspase 3 种途径来诱导细胞凋亡。本研究发现PCs可能通过两种途径使细胞凋亡,即细胞外部信号触发的凋亡——死亡受体途径和细胞内部信号触发的凋亡——线粒体途径。死亡受体途径中细胞膜表面死亡受体会在细胞受到凋亡刺激后发生相应的变化,形成死亡诱导信号复合体,随后其死亡效应结构域和Caspase-8相互作用,活化的Caspase-8进一步激活如Caspase-3等Caspase,引发级联反应,使细胞发生凋亡;线粒体途径中线粒体跨膜电位的下降和细胞色素c的释放使Caspase-9被激活,活化型的Caspase-9激活下游的Caspases,进而作用于PARP,使其发生片段化,最终导致细胞凋亡。Bcl-2家族蛋白对调节线粒体膜电位发挥了重要作用,通过它们对线粒体膜电位的改变,促使线粒体内部的细胞色素c释放到胞质中,从而使Caspase被激活并发生级联反应,诱导细胞凋亡[37-39]。本研究也证明PCs可增加Caspase-8的表达,上调促凋亡蛋白Bax的同时下调抑制凋亡蛋白Bcl-2,使活化的Caspase-3和片段化的PARP表达增多,最终诱导死亡受体调节的外源凋亡途径和线粒体调节的内源凋亡途径。
尽管植物来源的PCs类物质在体外具有很强的抗氧化性,能够强烈抑制肿瘤细胞增殖,通过调节抗氧化酶活力和信号转导途径诱导肿瘤细胞凋亡,但PCs被机体吸收程度很有限,以完整形式吸收的二聚体至多聚体只占吸收的(-)-表儿茶素的10%,血液和尿液中PCs单体也并非来自人体吸收的寡聚体和多聚体[40];因此,多聚体能否在体内呈现生理活性有待探讨。但PCs可以被肠道微生物降解形成植物甾体苯戊烯醇酮和酚酸,降解后产物的吸收和对机体的作用可能与PCs在人体中的作用情况更相符[41];另一方面,PCs也可以改变肠道微生物种类和代谢,进而影响人体健康。因此,肠道微生物和PCs的相互作用更应该得到人们的关注[40]。
综上,山楂PCs提取物、PCs B2和表儿茶素都可以通过影响抗氧化酶、Na+K+-ATP酶活力来降低细胞的自我保护能力,同时进一步触发不同凋亡途径,最终导致肿瘤细胞的凋亡,从而起到抑制肿瘤的效果;山楂PCs的生物活性与质量浓度和处理时间呈正相关,与其聚合度和分子结构也具有一定相关性。
参考文献:
[1] NACZK M, SHAHIDI F. Extraction and analysis of phenolics in food[J]. Journal of Chromatography A, 2004, 1054(1/2): 95-111.DOI:10.1016/j.chroma.2004.08.059.
[2] YANG Y, CHIEN M. Characterization of grape procyanidins using high-performance liquid chromatography/mass spectrometry and matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2000,48(9): 3990-3996. DOI:10.1021/jf000316q.
[3] CUI T, LI J Z, KAYAHARA H, et al. Quantification of the polyphenols and triterpene acids in Chinese hawthorn fruit by high-performance liquid chromatography[J]. Journal of Agricultural and Food Chemistry,2006, 54(13): 4574-4581. DOI:10.1021/jf060310m.
[4] PUIGGRÒS F, SALVADÒ M J, BLADÉ C, et al. Differential modulation of apoptotic processes by proanthocyanidins as a dietary strategy for delaying chronic pathologies[J]. Critical Reviews in Food Science and Nutrition, 2014, 54(3): 277-291. DOI:10.1080/10408398.2011.565456.
[5] 禹华娟, 孙智达, 谢笔钧. 莲原花青素在油脂体系中的抗氧化作用[J]. 中国农业科学, 2010, 43(10): 2132-2140. DOI:10.3864/j.issn.0578-1752.2010.10.020.
[6] 谢文利, 晋玉章, 万宗明, 等. 聚果多酚抗衰老作用的实验研究[J].食品科学, 2009, 30(9): 207-209.
[7] PRASANNA R, HARISH C C, PICHAI R, et al. Anti-cancer effect of Cassia auriculata leaf extract in vitro through cell cycle arrest and induction of apoptosis in human breast and larynx cancer cell lines[J].Cell Biology International, 2009, 33(2): 127-134. DOI:10.1016/j.cellbi.2008.10.006.
[8] GAO J, INAGAKI Y, LIU Y. Research progresses on flavonoids isolated from traditional Chinese medicine in treatment of Alzheimer’s disease[J]. Intractable and Rare Diseases Research, 2013, 2(1): 3-10.DOI:10.5582/irdr.2013.v2.1.3.
[9] WANG L, FUMOTO T, MASUMOTO S, et al. Regression of atherosclerosis with apple procyanidins by activating the ATP-binding cassette subfamily a member 1 in a rabbit model[J]. Atherosclerosis,2017, 258: 56-64. DOI:10.1016/j.atherosclerosis.2017.01.032.
[10] LIANG Y, WANG J, GAO H Q, et al. Beneficial effects of grape seed proanthocyanidin extract on arterial remodeling in spontaneously hypertensive rats via protecting against oxidative stress[J].Molecular Medicine Reports, 2016, 14(4): 3711-3718. DOI:10.3892/mmr.2016.5699.
[11] LIU Z Q, YANG Q L, ZHANG C S, et al. Study on antioxidant activity of proanthocyanidins from peanut skin[J]. Advanced Materials Research, 2011, 197/198: 1582-1586. DOI:10.4028/www.scientific.net/AMR.197-198.1582.
[12] JORDÃO A M, GONÇALVES F J, CORREIA A C, et al.Proanthocyanidin content, antioxidant capacity and scavenger activity of Portuguese sparkling wines (Bairrada appellation of origin)[J].Journal of the Science of Food and Agriculture, 2010, 90(12): 2144-2152. DOI:10.1002/jsfa.4064.
[13] WANG Xinghui, HUANG Lingling, YU Tingting, et al. Effects of oligomeric grape seed proanthocyanidins on heart, aorta, kidney in DOCA-salt mice: role of oxidative stress[J]. Phytotherapy Research,2013, 27(6): 869-876. DOI:10.1002/ptr.4793.
[14] AN J, CHEN C, WANG X, et al. Oligomeric proanthocyanidins alleviate hexabromocyclododecane nduced cytotoxicity in HepG2 cells through regulation on ROS formation and mitochondrial pathway[J]. Toxicology in Vitro, 2014, 28(2): 319-326. DOI:10.1016/j.tiv.2013.11.009.
[15] FARIA A, CALHAU C, DE FREITAS V, et al. Procyanidins as antioxidants and tumor cell growth modulators[J]. Journal of Agricultural and Food Chemistry, 2006, 54(6): 2392-2397.DOI:10.1021/jf0526487.
[16] CHEN J Y, XU Z, ZHU W, et al. Novel proanthocyanidin dimer analogues with the C-ring-opened diaryl-propan-2-gallate structural unit and enhanced antioxidant activities[J]. Journal of Functional Foods, 2016, 21: 290-300. DOI:10.1016/j.jff.2015.12.023.
[17] AGUILERA Y, ESTRELLA I, BENITEZ V, et al. Bioactive phenolic compounds and functional properties of dehydrated bean flours[J].Food Research International, 2011, 44(3): 774-780. DOI:10.1016/j.foodres.2011.01.004.
[18] 赵丹, 曾新安, 徐中岳. 不同聚合度葡萄皮原花青素的抗氧化活性[J]. 食品与发酵工业, 2012, 38(4): 4104-4108. DOI:10.13995/j.cnki.11-1802/ts.2012.04.009.
[19] LIZARRAGA D, LOZANO C, BRIEDÉ J J, et al. The importance of polymerization and galloylation for the antiproliferative properties of procyanidin-rich natural extracts[J]. The FEBS Journal, 2007, 274(18):4802-4811. DOI:10.1111/j.1742-4658.2007.06010.x.
[20] LOZANO C, JULIÁ L, JIMÉNEZ A, et al. Electron-transfer capacity of catechin derivatives and influence on the cell cycle and apoptosis in HT29 cells[J]. The FEBS Journal, 2006, 273(11): 2475-2486.DOI:10.1111/j.1742-4658.2006.05255.x.
[21] BRAY F, FERLAY J, SOERJOMATARAM L, et al. Global Cancer Statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2018, 68(6): 394-424. DOI:10.3322/caac.21492.
[22] CUI T, NAKAMURA K, TIAN S, et al. Polyphenolic content and physiological activities of Chinese hawthorn extracts[J]. Bioscience,Biotechnology, and Biochemistry, 2006, 70(12): 2948-2956.DOI:10.1271/bbb.60361.
[23] 谭卫东, 金红, 罗弟祥, 等. 抗肿瘤药物筛选中MTT法和SRB法的比较[J]. 天然产物研究与开发, 1999, 11(3): 17-22. DOI:10.16333/j.1001-6880.1999.03.004.
[24] 董成龙, 游娜, 许向红, 等. 白藜芦醇对人甲状腺乳头状癌IHH4细胞增殖和凋亡的影响[J]. 南京医科大学学报(自然科学版), 2015,35(8): 1096-1103. DOI:10.7655/NYDXBNS20150809.
[25] ROY A M, BALIGA M S, ELMETS C A, et al. Grape seed proanthocyanidins induce apoptosis through p53, Bax, and Caspase 3 pathways[J]. NeoPlasia, 2005, 7(1): 24-36. DOI:10.1593/neo.04412.
[26] SHAHIDI F, AMBIGAIPALAN P. Phenolics and polyphenolics in foods, beverages and spices: antioxidant activity and health effects: a review[J]. Journal of Functional Foods, 2015, 18: 820-897.DOI:10.1016/j.jff.2015.06.018.
[27] WANG S N, MECKLING K A, MARCONE M F, et al. Can phytochemical antioxidant rich foods act as anti-cancer agents?[J].Food Research International, 2011, 44(9): 2545-2554. DOI:10.1016/j.foodres.2011.05.021.
[28] SPRANGER I, SUN B S, MATEUS A M et al. Chemical characterization and antioxidant activities of oligomeric and polymeric procyanidin fractions from grape seeds[J]. Food Chemistry, 2008,108(2): 519-532. DOI:10.1016/j.foodchem.2007.11.004.
[29] FRANKEL E N, WATERHOUSE A L, TEISSEDRE P L. Principal phenolic phytochemicals in selected California wines and their antioxidant activity in inhibiting oxidation of human low-density lipoproteins[J]. Journal of Agricultural and Food Chemistry, 1995,43(4): 890-894.
[30] ZHANG Shuting, CUI Yan, LI Lingxi, et al. Preparative HSCCC isolation of phloroglucinolysis products from grape seed polymeric proantho-cyani dins as new powerful antioxidants[J]. Food Chemistry,2015, 188: 422-429. DOI:10.1016/j.foodchem.2015.05.030.
[31] WANG C C, HUANG P L, LIU T Y, et al. Highly oligomeric procyanidins from areca nut induce lymphocyte apoptosis via the depletion of intracellular thiols[J]. Toxicology in Vitro, 2009, 23(7):1234-1241. DOI:10.1016/j.tiv.2009.07.033.
[32] MATÉS J M, PÉREZ-GÓMEZ C, NÚÑEZ D C I. Antioxidant enzymes and human diseases[J]. Clinical Biochemistry, 1999, 32(8):595-603. DOI:10.1016/S0009-9120(99)00075-2.
[33] 许慧. 莲房原花青素诱导ROS积蓄介导HepG2细胞自噬和凋亡的研究[D]. 镇江: 江苏大学, 2016: 37-39.
[34] LEFRANC F, MIJATOVIC T, KONDO Y, et al. Targeting the α1 subunit of the sodium pump to combat glioblastoma cells[J]. Neurosurgery, 2008, 62(1): 211-222. DOI:10.1227/01.NEU.0000311080.43024.0E.
[35] WINNICKA K, BIELAWSKI K, BIELAWSKA A, et al. Antiproliferative activity of derivatives of ouabain, digoxin and proscillaridina in human MCF-7 and MDA-MB-231 breast cancer cells[J]. Biological and Pharmaceutical Bulletin, 2008, 31(6): 1131-1140. DOI:10.1248/bpb.31.1131.
[36] PAPADEMETRIO D L, TRABUCCHI A, CAVALIERE V, et al. The catechin flavonoid reduces proliferation and induces apoptosis of murine lymphoma cells LB02 through modulation of antiapoptotic proteins[J]. Brazilian Journal of Pharmacognosy, 2013, 23(3): 455-463. DOI:10.1590/S0102-695X2013005000025.
[37] MARTINOU J C, YOULE R J. Mitochondria in apoptosis: Bcl-2 family members and mitochondrial dynamics[J]. Developmental Cell,2011, 21(1): 92-101. DOI:10.1016/j.devcel.2011.06.017.
[38] MARSDEN V S, O’CONNOR L, O’REILLY L A, et al. Apoptosis initiated by Bcl-2-regulated caspase activation independently of the cytochrome C/Apaf-1/Caspase-9 apoptosome[J]. Nature, 2002, 419:634-637. DOI:10.1038/nature01101.
[39] OLA M S, NAWAZ M, AHSAN H. Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J]. Molecular and Cellular Biochemistry, 2011, 351(1/2): 41-58. DOI:10.1007/s11010-010-0709-x.
[40] OU K Q, GU L W. Absorption and metabolism of proanthocyanidins[J]. Journal of Functional Foods, 2014, 7: 43-53.DOI:10.1016/j.jff.2013.08.004.
[41] ESPIN J C, LARROSA M, GARCIA-CONESA M T, et al. Biological significance of urolithins, the gut microbial ellagic acid-derived etabolites: the evidence so far[J]. Evidence-Based Complementary and Alternative Medicine, 2013, 2013: 1-15. DOI:10.1155/013/270418.
Effect of Hawthorn Proanthocyanidins on Proliferation and Apoptosis of Human Hepatocellular Carcinoma SMMC-7721 Cells
SUN Siming, XU Hongwei, GUO Kaiyuan, GUO Mengran, CUI Shengnan, CUI Tong, TAN Jianxin*
(Engineering Research Center of Hebei Province for Agricultural Products Processing, College of Food Science and Technology,Hebei Agricultural University, Baoding 071001, China)
Abstract: Objective: To investigate the effect of hawthorn proanthocyanidins extract, epicatechin and proanthocyanidin B2 on the proliferation and apoptosis of human hepatocellular carcinoma SMMC-7721 cells. Methods: SMMC-7721 cells were cultured in vitro. The effect of different concentrations of hawthorn proanthocyanidins on cell proliferation and apoptosis was determined by 3-(4,5-dimethylthiazol-2-yl)-2,5 diphenyl tetrazolium bromide assay and 4’,6-diamidino-2-phenylindole(DAPI) staining, respectively. The expression of apoptosis-related proteins was detected by Western blotting. The activities of catalase (CAT), superoxide dismutase (SOD), glutathione peroxidase (GSH-Px) and Na+K+-ATPase and malondialdehyde(MDA) level in cells from each group were determined. Results: Hawthorn proanthocyanidins extract, epicatechin and proanthocyanidin B2 all significantly inhibited the proliferation of SMMC-7721 cells in a time-dependent and concentrationdependent manner (P < 0.05) and induced cell apoptosis. Compared with the control group, hawthorn proanthocyanidins extract, epicatechin and proanthocyanidin B2 decreased the activity of SOD, CAT, GSH-Px and Na+K+-ATPase and increased the level of MDA in SMMC-7721 cells. The expression of apoptosis-related proteins casepase-8, caspase-3,Bcl-2-associated X protein and the fragment of poly (ADP-ribose) polymerase were increased, while the expression of Bcl-2 was decreased. Conclusion: Hawthorn proanthocyanidins can inhibit the proliferation of SMMC-7721 cells and induce apoptosis through regulating antioxidant activity and apoptosis-related proteins.
Keywords: hawthorn proanthocyanidins; antioxidant activity; human hepatocellular carcinoma SMMC-7721 cells; cell proliferation; cell apoptosis
收稿日期:2018-02-28
基金项目:河北省自然科学基金项目(C2015204187);河北省重点研发计划项目(16275505D);河北省食品科学与工程学科“双一流”建设资金项目(2016SPGCA18)
第一作者简介:孙思明(1991—)(ORCID: 0000-0002-3142-4645),女,硕士研究生,研究方向为食品工程。E-mail: 331416826@qq.com
*通信作者简介:檀建新(1968—)(ORCID: 0000-0002-2796-1958),男,教授,博士,研究方向为功能性食品。E-mail: jianxintan@sina.com
DOI:10.7506/spkx1002-6630-20180228-250
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2019)05-0189-08
引文格式:孙思明, 徐宏伟, 郭凯元, 等. 山楂原花青素对人肝癌SMMC-7721细胞增殖和凋亡的影响[J]. 食品科学, 2019, 40(5):189-196. DOI:10.7506/spkx1002-6630-20180228-250. http://www.spkx.net.cn
SUN Siming, XU Hongwei, GUO Kaiyuan, et al. Effect of hawthorn proanthocyanidins on proliferation and apoptosis of human hepatocellular carcinoma SMMC-7721 cells[J]. Food Science, 2019, 40(5): 189-196. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180228-250. http://www.spkx.net.cn
 ·、·OH、NO·、ONOO-·、1,1-二苯基-2-三硝基苯肼(1-diphenyl-2-picrylhydrazyl,DPPH)自由基、·CH3等自由基[11],保护内源性抗氧化物质,加强体内的抗氧化防御系统。Jordão等[12]发现葡萄酒清除自由基能力和抗氧化活性与其PCs含量之间呈线性关系;Wang Xinghui等[13]研究表明葡萄籽PCs可以通过提高超氧化物歧化酶(superoxide dismutase,SOD)活力、降低丙二醛(malondialdehyde,MDA)含量来改善去氧皮质酮-盐型高血压小鼠模型的氧化应激反应,缓解高血压症状。细胞凋亡是由细胞自身基因控制的自主有序死亡,PCs对细胞凋亡有双向调节作用[3],这种作用可能是通过其调节活性氧(reactive oxygen species,ROS)水平来完成的。实验证明,低聚原花青素能够通过减少ROS生成、降低细胞Ca2+浓度来缓解六溴环十二烷的细胞毒性,减少人肝癌HepG2细胞的凋亡[14]。另一方面,人们发现PCs可以引起多种肿瘤细胞如乳腺癌细胞、肺癌细胞、胃腺癌细胞的凋亡。Faria等[15]证明葡萄籽PCs除了抗氧化活性外,还具备很强的抑制人乳腺癌株MCF-7细胞DNA合成的能力,从而能够抑制癌细胞的增殖,诱导其凋亡。
·、·OH、NO·、ONOO-·、1,1-二苯基-2-三硝基苯肼(1-diphenyl-2-picrylhydrazyl,DPPH)自由基、·CH3等自由基[11],保护内源性抗氧化物质,加强体内的抗氧化防御系统。Jordão等[12]发现葡萄酒清除自由基能力和抗氧化活性与其PCs含量之间呈线性关系;Wang Xinghui等[13]研究表明葡萄籽PCs可以通过提高超氧化物歧化酶(superoxide dismutase,SOD)活力、降低丙二醛(malondialdehyde,MDA)含量来改善去氧皮质酮-盐型高血压小鼠模型的氧化应激反应,缓解高血压症状。细胞凋亡是由细胞自身基因控制的自主有序死亡,PCs对细胞凋亡有双向调节作用[3],这种作用可能是通过其调节活性氧(reactive oxygen species,ROS)水平来完成的。实验证明,低聚原花青素能够通过减少ROS生成、降低细胞Ca2+浓度来缓解六溴环十二烷的细胞毒性,减少人肝癌HepG2细胞的凋亡[14]。另一方面,人们发现PCs可以引起多种肿瘤细胞如乳腺癌细胞、肺癌细胞、胃腺癌细胞的凋亡。Faria等[15]证明葡萄籽PCs除了抗氧化活性外,还具备很强的抑制人乳腺癌株MCF-7细胞DNA合成的能力,从而能够抑制癌细胞的增殖,诱导其凋亡。