桃(Prunus persica (L.) Batsch)是蔷薇科、桃属的核果类植物,其果实营养丰富、味道鲜美,且易于消化吸收,具有较高的食用与经济价值。但桃果实皮薄且肉质柔软,采摘期正值高温多雨季节,因此采后极易遭受病原菌的侵染而腐败变质。由匍枝根霉(Rhizopus stolonifer)引起的软腐病是桃果实采后运输和贮藏过程中的主要病害[1] ,可造成巨大的经济损失。长期以来,低温结合化学杀菌剂处理[2]是控制果蔬采后病害的主要方法,但随着人们环境保护意识的提高,探索新型高效、绿色环保的方法来防治果蔬采后病害迫在眉睫。
能量代谢在果蔬成熟、衰老及采后抗病性方面发挥着重要作用,稳定的能荷水平有利于保持果蔬贮藏期间良好的品质[3]。果蔬采后遭受到生物或非生物的胁迫后,能量消耗增加,对病原菌的抵抗力下降,从而加速病害的发生[4-5]。越来越多的研究表明,荔枝、枇杷、龙眼、梨和桃等果实病害的发生与能量亏损有密切的联系[5-10]。Lin Yifen等[11]发现外源三磷酸腺苷(adenosine triphosphate,ATP)处理能提高经拟茎点霉接种的龙眼果实的ATP含量和能荷水平,显著降低龙眼果实贮藏期间的病害指数;而作为解偶联剂,2,4-二硝基苯酚(2,4-dinitrophenol,DNP)能够阻断ATP的形成,龙眼果实经外源DNP处理后,ATP含量和能荷水平显著下降,病害指数大幅度上升。也有研究显示,采用外源激发子处理采后果实也能够提高其能荷水平,从而增强采后果实对病原菌的抵抗能力,比如Cao Shifeng等[6]研究表明,茉莉酸甲酯熏蒸处理能显著降低枇杷果实接种炭疽菌后的病害发生率,延缓其能荷水平的下降。因此采取适当的措施维持较高的能荷水平对增强果蔬采后抗病能力尤为重要。
油菜素内酯是植物中普遍存在的一种甾醇类物质,具有高效、广谱、无毒的生理活性,已被公认为第6类植物激素。其中,2,4-表油菜素内酯(2,4-epibrassionolide,EBR)是最活跃的市售油菜素内酯之一。它们在调节植物的生长发育、缓解各种生物和非生物因素对植物造成的胁迫方面发挥着关键作用[12]。近年来,油菜素内酯在园艺产品抗病方面的研究也越来越多。采前应用油菜素内酯处理黄瓜可以增强其对黄瓜花叶病毒的抗性[13]。Zhu Zhu等[14]发现5 μmol/L的油菜素内酯处理延缓了枣果实的衰老且显著抑制了其青霉病的扩展。柑橘经5.0 mg/L EBR浸泡2 min并贮藏50 d后,其腐烂率显著低于对照组[15]。Liu Qing等[16]报道EBR处理不仅可以有效控制葡萄果实采后灰霉病的发展,还能延缓硬度的下降和质量损失率的上升,保持较好的贮藏品质。这些结果显示EBR处理在果蔬防腐保鲜中具有较好的应用前景。但迄今有关EBR对桃果实采后病害控制的作用及其机理鲜见报道。本实验意在研究EBR处理对控制桃果实采后软腐病的作用,并探究EBR是否通过调节能量代谢来控制桃果实病害,以期为EBR处理在果蔬采后防腐保鲜中的应用提供依据。
实验采用的‘白凤’桃果实(Prunus persica (L.)Batsch cv Baifeng)采摘于南京市六合果园,采摘后立即运回实验室,摆放在实验台上以散除田间热。挑选大小均一、八成熟、表面无病虫害、无机械损伤的桃果实备用。
匍枝根霉(Rhizopus stolonifer)保存于实验室,使用前于马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上活化3 代,置于26 ℃恒温恒湿箱内培养。挑取适量孢子于无菌蒸馏水中,经无菌纱布过滤,最终配成浓度为1×105 个/mL的孢子悬浮液,现配现用。
EBR(纯度≥95%)、Folin试剂 上海瑞永生物科技有限公司;ATP、二磷酸腺苷(Adenosine diphosphate,ADP)、一磷酸腺苷(Adenosine monophosphate,AMP)、磷酸二氢钾、磷酸氢二钾、甲醇、细胞色素c 上海源叶生物科技有限公司;三羟甲基氨基甲烷 北京索莱宝科技有限公司;磷测试盒(磷钼酸法) 南京建成生物工程研究所;三氯乙酸(trichloroacetic acid solution,TCA)、硫酸甲酯吩嗪(phenazine methosulfate,PMS)、琥珀酸钠、硝酸钠、2,6-二氯酚靛酚(2,6-dichloroindophenol,DCPIP)等国药集团化学试剂有限公司。其中ATP、ADP、AMP、磷酸氢二钾、磷酸二氢钾和甲醇为色谱纯,其他试剂为国产分析纯。
手持阿贝折光仪 日本Atago公司;GY-3型硬度计杭州图谱仪器有限公司;GL-20G-H型冷冻离心机上海安亭科学仪器厂;UV-6000型分光光度计 上海元析仪器有限公司;电子分析天平 赛多利斯科学仪器有限公司;HH-6型数显恒温水浴锅 国华电器有限公司;LC-20A高效液相色谱仪 日本岛津公司。
1.3.1 原料处理
EBR浓度筛选实验:将挑选好的桃果实平均分成4 组,分别用0(蒸馏水,对照)、1、5、10 μmol/L的EBR溶液浸泡10 min,料液比1∶150(m/V),6 h后用体积分数70%乙醇溶液轻轻擦拭果实表面接种处,在果实赤道部位用灭菌钉等距离刺孔2 个(约深4 mm、直径2 mm),晾干后用微量移液器注入15 μL浓度为1×105 个/mL的匍枝根霉孢子悬浮液,每个处理40 个果实,重复3 次。将接种后的桃果实分装于塑料盒中,置于(20±1)℃下贮藏60 h,于24、36、48、60 h时观测发病率和病斑直径,以便筛选出对桃果实软腐病抗性最佳的EBR处理浓度。
EBR处理对能量代谢影响实验:将挑选好的桃果实平均分成2 组,分别用蒸馏水(对照)和5 μmol/L的EBR溶液浸泡10 min,6 h后按上述方法接种匍枝根霉孢子悬浮液,每组处理选用100 个果实,重复3 次。接种后的桃果实于塑料盒中分装后置于(20±1)℃下贮藏60 h。接种后(0 h)立即取样,之后每隔12 h进行取样,取样时先将果实削皮,然后取病、健交界处果肉,切碎混匀后立即用液氮速冻,并保存于-80 ℃冰箱中备用。
1.3.2 病斑直径和发病率的测定
用游标卡尺测量病斑直径,以接种处病斑直径大于3 mm记为发病。每个病斑交叉测量2 次,取平均值。发病率按式(1)进行计算。
1.3.3 品质指标测定
果肉硬度的测定:在果实的赤道部位病健交界处对称取4 点,去皮(约1 mm),用GY-3型硬度计测定桃果实硬度,每次测定10 个果实,取平均值。
可滴定酸(titratable acid,TA)和可溶性固形物(total soluble solids,TSS)质量分数参照Jin Peng等[17]的方法测定,取10 g果肉研磨充分,定容至100 mL,静置30 min后用纱布过滤,利用酸碱滴定法测定TA质量分数,结果以苹果酸质量分数表示。用手持阿贝折光仪测定TSS质量分数。实验均重复3 次并取平均值。
VC含量参照Arakawa等[18]的邻菲罗啉比色法测定,单位为mg/100 g,结果以鲜质量计。
1.3.4 能量水平的测定
ATP、ADP、AMP含量及能荷水平的测定参照Liu Hai等[19]的方法并稍作修改。称取4 g冷冻样品,用5 mL 0.6 mol/L的高氯酸充分研磨,4 ℃ 13 000 r/min离心20 min,然后取3 mL上清液立即用1 mol/L KOH溶液调节pH值至6.5~6.8,用超纯水定容到4 mL,静置30 min后,再用0.45 μm的纤维滤膜过滤,用高效液相色谱仪进行测定分析。色谱条件为反向C18柱(250 mm×4.6 mm,10 μm),检测波长为254 nm,柱温30 ℃,流速0.8 mL/min,进样量为50 μL。流动相A为0.05 mol/L PH 7.0的磷酸钾缓冲液,流动相B为纯甲醇。采用梯度洗脱,流动相B在0、7、10 min时所占比例分别为0%、20%和0%。根据ATP、ADP、AMP标准品的保留时间对样品峰定性分析。根据制作的标准曲线对样品峰进行定量分析,单位为μg/g,结果以鲜质量计。能荷通过式(2)进行计算。
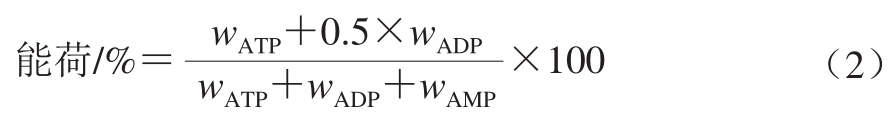
式中:wATP、wADP、wAMP分别表示ATP、ADP、AMP的含量/(μg/g)。
1.3.5 能量代谢相关酶活力的测定
样品线粒体的提取参照Liang Wusheng等[20]的方法进行,称取5 g果肉,加入10 mL 50 mmol/L预冷的Tris-HCl(pH 7.5)提取缓冲液(含0.25 mol/L蔗糖、1 mmol/L乙二胺四乙酸、0.3 mol/L甘露醇、5 g/L聚乙烯吡咯烷酮)研磨至匀浆状态,5 层纱布过滤,滤液转移至离心管中,4 ℃下4 000 r/min离心10 min,得到的上清液在4 ℃下13 000 r/min离心20 min。向得到的沉淀中加入5 mL 10 mmol/L的Tris-HCl(pH 7.2)洗涤液(含0.25 mol/L蔗糖、1 mmol/L乙二胺四乙酸、0.3 mol/L甘露醇),重复上述离心操作,最终的沉淀加入1.5 mL洗涤液即得线粒体粗酶液,将其保存于4 ℃冰箱中,用于后续能量代谢相关酶活力的测定。
H+-ATPase和Ca2+-ATPase活力的测定参照Jin Peng等[21]的方法进行。测定H+-ATPase活力时,量取0.7 mL 30 mmol/L Tris-HCl缓冲液(pH 7.2,含3 mmol/L MgSO4、50 mmol/L NaNO3、0.1 mmol/L Na3VO4、50 mmol/L KCl、0.1 mmol/L钼酸铵)与0.1 mL线粒体粗酶液混合,加入0.1 mL 30 mmol/L ATP-Tris(pH 8.0)迅速启动反应,于37 ℃水浴保温20 min后,加入0.1 mL 5.5 g/10 mL TCA终止反应。对照用蒸馏水代替启动液和终止液。Ca2+-ATPase活力的测定与H+-ATPase类似,Tris-HCl缓冲液中不含MgSO4,以Tris-HCl缓冲液中加或不加3 mmol/L Ca(NO3)2引起的最终吸光度的差值表示Ca2+-ATPase活力。无机磷含量的测定采用磷测试盒,最终以每小时释放1 μmol/L无机磷所需要的酶量作为1 个酶活力单位(U)。
琥珀酸脱氢酶(succinate dehydrogenase,SDH)活力的测定参照Ackrell等[22]的方法,量取2.7 mL 0.2 mol/L磷酸钾缓冲液(pH 7.4,含0.2 mol/L琥珀酸钠)与0.1 mL 0.9 mol/L的DCPIP混合,30 ℃保温5 min,冷却后加入0.1 mL线粒体粗酶液,混匀后加入0.1 mL 3.3 g/L PMS启动反应,于30 ℃保温10 min。分别测定600 nm波长处反应前后的吸光度。以每克鲜质量每分钟吸光度变化0.01为1 个酶活力单位(U)。
线粒体细胞色素c氧化酶(cytochrome oxidase,CCO)活力参照Veitch等[23]的方法测定。反应体系包含0.2 mL线粒体粗酶液、0.5 mL 0.4 g/L细胞色素c和2 mL蒸馏水。于37 ℃保温2 min后加入0.5 mL 4 g/L对苯二胺溶液,再次于37 ℃下保温10 min,测定反应前后510 nm波长处的吸光度。以每克鲜质量每分钟吸光度变化0.01为1 个酶活力单位(U)。
所有酶活力单位均为U/g,结果均以鲜质量计。
运用Excel和SAS 8.1软件对实验数据进行统计分析,邓肯氏多重比较方法进行差异显著分析,P<0.05表示差异显著,P<0.01表示差异极显著。用SPSS 24.0软件中Pearson相关系数法进行相关性分析。用Origin 9.0软件作图。

图 1 不同浓度EBR处理对桃果实采后病斑直径(A)和发病率(B)的影响
Fig. 1 Effect of EBR treatment at different concentrations on lesion diameters (A) and disease incidence (B) on postharvest peach fruits
如图1所示,桃果实接种R. stolonifer后,36 h开始发病,病斑直径逐渐增加,接种60 h后,1、5 μmol/L处理组果实的病斑直径均显著低于对照组果实(P<0.05),1、5、10 μmol/L处理组病斑直径分别为对照组的87.7%、66.2%和93.4%。从病斑直径角度比较,3 个浓度EBR中5 μmol/L抑菌效果最好。在接种后的前48 h,3 个浓度处理组果实发病率均小于对照组,60 h时所有组果实的发病率均达到100%;其中5 μmol/L处理的效果最好,能明显延缓发病率的上升,接种后36 h,该组发病率仅为对照组的83.2%。因此选择对桃果实采后软腐病抑制效果最好的5 μmol/L的EBR处理浓度开展下一步实验,研究EBR处理对桃果实采后能量代谢的影响。

图 2 EBR处理对桃果实接种后品质的影响
Fig. 2 Effect of EBR treatment on the quality of inoculated peach fruit
如图2A、B、D所示,随着贮藏时间的延长,桃果实的硬度、TA质量分数和VC含量变化趋势基本一致,在(20±1)℃贮藏期间,呈逐渐下降趋势。EBR处理组的果实硬度在48 h和60 h时分别是对照组的1.58 倍和1.91 倍;EBR处理组果实的TA质量分数在24 h后开始显著高于对照组(P<0.05),48 h时比对照组高4.3%。在接种后60 h,EBR处理组果实VC含量为23.34 mg/100 g,显著高于对照组(22.60 mg/100 g)(P<0.05)。这说明EBR处理能延缓采后桃果实硬度、TA质量分数和VC含量的下降,贮藏后期还能保持较高的TA质量分数和VC含量。
由图2C可知,TSS质量分数在贮藏期间呈现先上升后下降的趋势,在36 h达到高峰。这可能是因为桃果实采后存在后熟现象,后熟过程中TSS会有所积累。EBR处理组果实的TSS质量分数在48 h和60 h时分别为11.61%和11.54%,与对照组相比,分别提高了3.6%和3.7%。这些结果说明,与对照相比,EBR处理能维持采后桃果实良好的品质。

图 3 EBR处理对桃果实接种后ATP(A)、ADP(B)、AMP(C)含量和能荷(D)的影响
Fig. 3 Effect of EBR treatment on ATP (A), ADP (B) and AMP (C)contents and energy charges (D) of inoculated peach fruit
如图3所示,随接种后贮藏时间的延长,ATP含量在前36 h逐渐增加,随后迅速下降,EBR处理显著促进了ATP在贮藏前期的积累(P<0.05),并延缓了贮藏后期ATP含量的下降,在48 h和60 h时EBR处理组ATP含量比对照组分别高出6.5%和8.4%。ADP含量随贮藏时间延长也呈现先上升后下降的趋势,于24 h达到高峰;整个贮藏时间内,EBR处理组ADP含量始终高于对照组,但差异不显著。AMP含量在贮藏前24 h保持平稳状态,随后逐渐上升,但EBR处理显著抑制了AMP含量的上升,48 h后AMP含量显著低于对照组(P<0.05)。能荷水平的变化与ATP含量变化趋势类似,两组的能荷水平在贮藏前期保持平稳,36 h后迅速下降,在接种60 h后EBR处理组的能荷水平为69.1%,显著高于对照组(66.1%)(P<0.05),这说明EBR处理能显著延缓桃果实能荷的下降。相关性分析显示,对照组和EBR处理组桃果实的发病率和能荷水平均呈极显著负相关,(相关系数分别为-0.939、-0.962,P<0.01),说明能荷水平越高,越能抑制发病率的上升。因此,EBR处理可能通过调节能量代谢来增强桃果实采后的抗病能力。

图 4 EBR处理对桃果实接种后Ca2+-ATPase(A)、H+-ATPase(B)、SDH(C)和CCO(D)活力的影响
Fig. 4 Effect of EBR treatment on the activity of Ca2+-ATPase (A),H+-ATPase (B), SDH (C) and CCO (D) of inoculated peach fruit
如图4A、B所示,Ca2+-ATPase和H+-ATPase活力在整个贮藏期间呈现先上升后下降。贮藏24 h后,Ca2+-ATPase活力开始显著高于对照组(P<0.05),对照组和EBR处理组Ca2+-ATPase活力分别在48、36 h达到峰值,且EBR处理组峰值比36 h时的对照组高7.8%。H+-ATPase活力在48 h达到高峰,随后开始下降,EBR处理组的H+-ATPase活力在整个贮藏期间均高于对照组,36 h和48 h时比对照组分别提高了4.6%和3.9%。
如图4C所示,SDH活力在贮藏12 h后迅速上升,在48 h时达到高峰,随后逐渐下降;EBR处理组的SDH活力在贮藏前12 h低于对照组,但差异不显著,36 h后显著高于对照组(P<0.05);在36、48 h和60 h时,EBR处理组的SDH活力比对照组分别高8.7%、7.5%和7.4%。如图4D所示,CCO活力在贮藏前期上升迅速,于36 h到达高峰,此时EBR处理组和对照组的酶活力比初始分别高出24.7%和15.7%;随后两组的CCO活力开始下降,但EBR处理组的CCO活力依然保持在较高水平,在贮藏末期(60 h),对照组CCO活力仅为EBR处理组的86%。由此可知,EBR处理能够促进4 种能量代谢相关酶活力的上升,并能抑制后期酶活力的下降。
桃果实采后容易受到病原菌的侵染,导致腐败变质,从而大幅缩短了货架期并降低营养品质;因此开发应用绿色环保的激发子来诱导采后桃果实抗病变得十分重要。本实验中应用0、1、5、10 μmol/L的EBR处理桃果实,其中5 μmol/L的浓度对接种的匍枝根霉抑制效果最好,与对照相比,显著降低了桃果实病斑直径并延缓了其发病率的上升,浓度过高或过低时抑菌效果均下降。该结果与Zhu Zhu等[14]在枣果实上的研究以及李园园等[24]在草莓果实上的研究结果一致,5 μmol/L的油菜素内酯处理可有效抑制青霉菌在枣果实上的扩展,也可显著延缓草莓果实在贮藏期间腐烂指数的上升。增强桃果实采后抗病性最终是为了尽可能长时间维持桃果实采后良好的品质,以供消费者食用。硬度、TA质量分数、TSS质量分数和VC含量是衡量果实采后品质的重要指标,也可反映果实采后的衰老进程。本实验研究发现,5 μmol/L EBR处理可以显著延缓接种匍枝根霉的桃果实硬度、TA质量分数、TSS质量分数和VC含量的下降,能较好地维持桃果实采后良好的品质,这也与前人的研究结果[14,24]相符。
以往的研究表明,果蔬采后病害的发生与能量状态有密切的联系,能量供应不足会降低果蔬采后的抗病能力[4,6,8,25-26]。正常情况下,植物组织能够合成足够的能量来保证细胞正常的生理代谢;但当遭遇病原菌侵染时,植物组织需要消耗大量的能量去合成抗病相关的物质去抵御病原菌[27];而与此同时,受病菌侵染的植物组织ATP的合成能力下降,当能量供应出现严重不足时,细胞结构的完整性将遭到破坏,抗病能力迅速下降从而导致最终病害的发生[28-29]。龙眼果实接种龙眼拟茎点霉后,ATP含量和能荷水平显著下降,这揭示了由病原菌侵染造成的能量缺乏可能降低了龙眼果实的抗病能力,从而加速了病害的发展[4]。Yi Chun等[5]的研究发现,外源ATP处理能保持采后荔枝果实较高的能荷水平,促进酚类物质的合成,从而为抵御荔枝霜疫霉病提供物质基础。有研究表明,苯并噻二唑(acibenzolar-S-methyl,ASM)和β-氨基丁酸处理能分别提高采后梨[9]和桃果实[10]的能荷水平和ATP含量,降低发病率,延缓果实抗病性的下降。Liu Zhanli等[30]发现油菜素内酯处理能够提高竹笋采后贮藏期间的ATP、ADP含量和能荷水平,延缓AMP含量的上升,从而提高其能量水平,增强竹笋对冷害的耐受能力。本实验发现,EBR处理显著延缓了桃果实采后ATP和ADP含量的下降,抑制了AMP含量的上升,维持了较高的能荷水平,这与Liu Zhanli等[30]的研究结果相符合。相关性分析结果显示,对照组果实和EBR处理组果实的发病率和能荷水平均呈显著负相关,说明较低的能荷水平能促进桃果实发病率的上升,较高的能荷水平能抑制桃果实发病率的上升。以上结果说明,EBR处理能够抑制桃果实采后匍枝根霉的侵染,降低发病率,这可能归功于EBR处理对桃果实采后能荷水平的有效保持。
Ca2+-ATPase、H+-ATPase、SDH和CCO是与能量代谢相关的重要酶,参与ATP的供应和线粒体功能的维持。ATPase可以催化ATP分解成ADP和游离磷酸根离子,并释放出能量。质膜H+-ATPase在水解ATP的同时,将H+跨膜转移到线粒体内膜外侧,形成质子浓度梯度和跨膜电化学梯度,为ATP的合成提供驱动力[31]。Ca2+-ATPase能利用ATP释放的能量将细胞质内的Ca2+转移到线粒体或液泡中,维持Ca2+浓度动态平衡,进而维持细胞的稳态[32]。SDH和CCO均位于线粒体内膜上,在三羧酸循环中通过催化琥珀酸转变为延胡索酸,参与ATP的合成。CCO是线粒体电子传递链中最后一个酶,催化电子从还原型细胞色素c传递给氧分子,同时发生质子的跨膜移位,在ATP合成中发挥着至关重要的作用[33]。Liu Zhanli等[30]发现油菜素内酯处理能通过提高Ca2+-ATPase、H+-ATPase、SDH和CCO 4 种酶的活力,从而提高采后竹笋的ATP含量和能荷水平,进而有利于减轻竹笋贮藏期间的褐变。梨果实经ASM处理后,Ca2+-ATPase、H+-ATPase、SDH和CCO活力显著提高,从而维持了较高的能荷水平,为ASM诱导梨果实采后抗病提供了能量保证[9]。在本实验中,EBR处理提高了Ca2+-ATPase、H+-ATPase、SDH和CCO 4 种酶的活力,这也与EBR处理组保持了较高的ATP含量和能荷水平相符合;Wang Jing等[10]在桃果实上的抗病研究也呈现出类似的结果。这说明EBR处理能通过调节能量代谢相关酶的活力来维持细胞内能量代谢的平衡,从而抑制桃果实采后由匍枝根霉引起的软腐病的发生和发展。
5 μmol/L的EBR处理对匍枝根霉的抑制效果最显著,不仅能够降低接种匍枝根霉后桃果实的病斑直径和发病率,还能延缓硬度、TA质量分数、TSS质量分数和VC含量的下降,从而保持桃果实采后良好的贮藏品质。与此同时,与对照相比,EBR处理能提高Ca2+-ATPase、H+-ATPase、SDH和CCO 4 个能量代谢相关酶的活力,从而提高ATP和ADP的含量,降低AMP的含量,维持较高的能荷水平,为桃果实采后抵抗软腐病提供较为充足的能量。
[1] FAN Q, TIAN S P. Postharvest biological control of Rhizopus rot of nectarine fruits by Pichia membranefaciens[J]. Plant Disease, 2000,84(11): 1212-1216. DOI:10.1094/PDIS.2000.84.11.1212.
[2] KORSTEN L. Advances in control of postharvest diseases in tropical fresh produce[J]. International Journal of Postharvest Technology and Innovation, 2006, 1(1): 48-61. DOI:10.1504/IJPTI.2006.009181.
[3] HUANG Z H, GUO L F, WANG H, et al. Energy status of kiwifruit stored under different temperatures or exposed to long-term anaerobic conditions or pure oxygen[J]. Postharvest Biology and Technology,2014, 98: 56-64. DOI:10.1016/j.postharvbio.2014.07.008.
[4] CHEN Y H, LIN H T, JIANG Y M, et al. Phomopsis longanae Chiinduced pericarp browning and disease development of harvested longan fruit in association with energy status[J]. Postharvest Biology and Technology, 2014, 93: 24-28. DOI:10.1016/j.postharvbio.2014.02.003.
[5] YI Chun, JIANG Yueming, SHI J, et al. ATP-regulation of antioxidant properties and phenolics in litchi fruit during browning and pathogen infection process[J]. Food Chemistry, 2010, 118(1): 42-47.DOI:10.1016/j.foodchem.2009.04.074.
[6] CAO Shifeng, CAI Yuting, YANG Zhenfeng, et al. Effect of MeJA treatment on polyamine, energy status and anthracnose rot of loquat fruit[J]. Food Chemistry, 2014, 145: 86-89. DOI:10.1016/j.foodchem.2013.08.019.
[7] CHEN M Y, LIN H T, ZHANG S, et al. Effects of adenosine triphosphate (ATP) treatment on postharvest physiology, quality and storage behavior of longan fruit[J]. Food and Bioprocess Technology,2015, 8(5): 971-982.
[8] ZHANG S, LIN H T, LIN Y F, et al. Energy status regulates disease development and respiratory metabolism of Lasiodiplodia theobromae(Pat.) Griff. & Maubl.-infected longan fruit[J]. Food Chemistry, 2017,231: 238-246. DOI:10.1016/j.foodchem.2017.03.132.
[9] GE Y H, WEI M L, LI C Y, et al. Effect of acibenzolar-S-methyl on energy metabolism and blue mould of Nanguo pear fruit[J]. Scientia Horticulturae, 2017, 225: 221-225. DOI:10.1016/j.scienta.2017.07.012.
[10] WANG Jing, CAO Shifeng, WANG Lei, et al. Effect of β-aminobutyric acid on disease resistance against Rhizopus rot in harvested peaches[J]. Frontiers in Microbiology, 2018, 9: 1-10. DOI:10.3389/fmicb.2018.01505.
[11] LIN Yifen, CHEN Mengyin, LIN Hetong, et al. DNP and ATP induced alteration in disease development of Phomopsis longanae Chi-inoculated longan fruit by acting on energy status and reactive oxygen species production-scavenging system[J]. Food Chemistry,2017, 228: 497-505. DOI:10.1016/j.foodchem.2017.02.045.
[12] BAJGUZ A, HAYAT S. Effects of brassinosteroids on the plant responses to environmental stresses[J]. Plant Physiology and Biochemistry, 2009, 47(1): 1-8. DOI:10.1016/j.plaphy.2008.10.002.
[13] XIA X J, WANG Y J, ZHOU Y H, et al. Reactive oxygen species are involved in brassinosteroid-induced stress tolerance in cucumber[J].Plant Physiology, 2009, 150(2): 801-814.
[14] ZHU Zhu, ZHANG Zhanquan, QIN Guozheng, et al. Effects of brassinosteroids on postharvest disease and senescence of jujube fruit in storage[J]. Postharvest Biology and Technology, 2010, 56(1): 50-55. DOI:10.1016/j.plaphy.2008.10.002.
[15] ZHU F, YUN Z, MA Q L, et al. Effects of exogenous 2,4-epibrassinolide treatment on postharvest quality and resistance of Satsuma mandarin (Citrus unshiu)[J]. Postharvest Biology and Technology, 2015, 100: 8-15. DOI:10.1016/j.postharvbio.2014.09.014.
[16] LIU Qing, XI Zhumei, GAO Jiangman, et al. Effects of exogenous 2,4-epibrassinolide to control grey mould and maintain postharvest quality of table grapes[J]. International Journal of Food Science and Technology, 2016, 51(5): 1236-1243. DOI:10.1111/ijfs.13066.
[17] JIN Peng, ZHENG Yonghua, TANG Shuangshuang, et al. A combination of hot air and methyl jasmonate vapor treatment alleviates chilling injury of peach fruit[J]. Postharvest Biology and Technology,2009, 52(1): 24-29. DOI:10.1016/j.postharvbio.2008.09.011.
[18] ARAKAWA N, TSUTSUMI K, SANCEDA N G, et al. A rapid and sensitive method for the determination of ascorbic acid using 4,7-diphenyl-1,10-phenanthroline[J]. Journal of the Agricultural Chemical Society of Japan, 1981, 45(5): 1289-1290. DOI:10.1271/bbb1961.45.1289.
[19] LIU Hai, JIANG Weibo, LUO Yunbo, et al. A Simple and rapid determination of ATP, ADP and AMP concentrations in pericarp tissue of litchi fruit by high performance liquid chromatography[J].Food Technology & Biotechnology, 2006, 44(4): 531-534.
[20] LIANG Wusheng, PAN Juan, LIANG Houguo. Activation of cyanideresistant respiration by pyruvate in mitochondria of aged potato tuber slices[J]. Journal of Plant Physiology and Molecular Biology, 2003,29(4): 317-321.
[21] JIN Peng, ZHU Hong, WANG Jing, et al. Effect of methyl jasmonate on energy metabolism in peach fruit during chilling stress[J]. Journal of the Science of Food and Agriculture, 2013, 93(8): 1827-1832.DOI:10.1002/jsfa.5973.
[22] ACKRELL B A C, KEARNEY E B, SINGER T P. Mammalian succinate dehydrogenase[J]. Methods in Enzymology, 1978, 53:466-483. DOI:10.1016/S0076-6879(78)53050-4.
[23] VEITCH K, HOMBROECKX A, CAUCHETEUX D, et al. Global ischaemia induces a biphasic response of the mitochondrial respiratory chain. anoxic pre-perfusion protects against ischaemic damage[J].Biochemical Journal, 1992, 281: 709-715. DOI:10.1042/bj2810709.
[24] 李园园, 王莉, 周梦洁, 等. 2,4-表油菜素内酯对草莓果实贮藏品质及抗氧化活性的影响[J]. 食品科学, 2018, 39(1): 279-284.DOI:10.7506/spkx1002-6630-201801042.
[25] YI C, QU H X, JIANG Y M, et al. Roles of energy in senescence and disease development of harvested litchi fruit[J]. Acta Horticulturae,2008, 804: 347-354. DOI:10.17660/ActaHortic.2008.804.49.
[26] WANG H, QIAN Z J, MA S M, et al. Energy status of ripening and postharvest senescent fruit of litchi (Litchi chinensis Sonn.)[J]. BMC Plant Biology, 2013, 13(1): 1-16. DOI:10.1186/1471-2229-13-55.
[27] QU H X, YI C, JIANG Y M. Loss of pathogen resistance by harvested horticultural crops[J]. Stewart Postharvest Review, 2008, 4(2): 1-4.
[28] YI C, QU H X, JIANG Y M, et al. ATP-induced changes in energy status and membrane integrity of harvested litchi fruit and its relation to pathogen resistance[J]. Journal of Phytopathology, 2008, 156(6):365-371. DOI:10.1111/j.1439-0434.2007.01371.x.
[29] TIAN S P, QIN G Z, LI B Q. Reactive oxygen species involved in regulating fruit senescence and fungal pathogenicity[J]. Plant Molecular Biology, 2013, 82(6): 593-602. DOI:10.1007/s11103-013-0035-2.
[30] LIU Zhanli, LI Li, LUO Zisheng, et al. Effect of brassinolide on energy status and proline metabolism in postharvest bamboo shoot during chilling stress[J]. Postharvest Biology and Technology, 2016,111: 240-246. DOI:10.1016/j.postharvbio.2015.09.016.
[31] AZEVEDO I G, OLIVEIRA J G, DA SILVA M G, et al. P-type H+-ATPases activity, membrane integrity, and apoplastic pH during papaya fruit ripening[J]. Postharvest Biology and Technology, 2008,48(2): 242-247. DOI:10.1016/j.postharvbio.2007.11.001.
[32] PALMGREN M G, HARPER J F. Pumping with plant P-type ATPases[J]. Journal of Experimental Botany, 1999, 50: 883-893.DOI:10.1093/jxb/50.Special_Issue.883.
[33] MILLAR A H, ATKIN O K, LAMBERS H, et al. A critique of the use of inhibitors to estimate partitioning of electrons between mitochondrial respiratory pathways in plants[J]. Physiologia Plantarum, 1995, 95(4):523-532. DOI:10.1111/j.1399-3054.1995.tb05518.x.
Effect of 2,4-Epibrassinolide Treatment on Rhizopus Rot and Energy Metabolism in Postharvest Peach Fruit
ZHANG Zhengmin, YANG Yilin, LI Meilin, et al. Effect of 2,4-epibrassinolide treatment on Rhizopus rot and energy metabolism in postharvest peach fruit[J]. Food Science, 2019, 40(5): 207-213. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20180828-312. http://www.spkx.net.cn