基于高通量测序分析不同保鲜冰处理对鲈鱼菌群组成与代谢功能的影响
张皖君1,蓝蔚青1,2,*,段贤源1,孙晓红1,2,谢 晶1,2,*
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海冷链装备性能与节能评价专业技术服务平台,食品科学与工程国家级实验教学示范中心(上海海洋大学),上海 201306)
摘 要:目的:分析不同保鲜冰处理下鲈鱼微生物菌群变化及其与品质指标的相关性。方法:分别采用流化冰(slurry ice,SI)、酸性电解水冰(acidic electrolyzed water ice,AEWI)和碎冰(crushed ice,CI)对鲈鱼进行处理,测定鲈鱼的总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量与K值,并利用高通量测序技术对样品菌群结构和代谢功能进行比较分析。结果:SI和AEWI对鲈鱼均有一定的保鲜作用,其中SI抑制鲈鱼蛋白质和核苷酸降解速度的效果最显著。在冰藏前期(0~3 d),AEWI与CI组样品中芽孢杆菌属(Bacillus)、乳球菌属(Lactococcus)、大洋芽孢杆菌属(Oceanobacillus)相对丰度明显高于SI组。冰藏中、后期(12~21 d),SI组样品中假单胞菌属(Pseudomonas)、希瓦氏菌属(Shewanella)、摩替亚氏菌属(Moritella)、埃希氏杆菌属(Escherichia)和别弧菌属(Aliivibrio)相对丰度明显增加,AEWI组样品假单胞菌属(Pseudomonas)和不动杆菌属(Acinetobacter)相对丰度所占比例逐渐增大,CI组中不动杆菌属在21 d时达27.77%,成为造成鲈鱼贮藏中、后期腐败的主要菌属。主成分分析表明,冰藏方式及贮藏时间对鲈鱼菌群结构组成有较大影响。鲈鱼菌群中与TVB-N含量、K值呈正相关的有假单胞菌属、不动杆菌属、嗜冷杆菌属(Psychrobacter)和希瓦氏菌属,它们可能是鲈鱼冰藏期间的优势菌。CI和AEWI组鲈鱼细菌中参与氨基酸、脂质和碳水化合物代谢的相关基因相对丰度高于同一时期的SI组,这在一定程度上从细菌代谢水平解释了SI能延缓鲈鱼腐败的原因,为后期进一步从微生物抑制机制上优化鲈鱼贮藏保鲜技术提供了理论参考。
关键词:鲈鱼;保鲜冰处理;高通量测序;菌群结构;代谢功能
鲈鱼(Lateolabrax japonicus)属鲈形目、鲈属经济鱼类,在我国海洋渔业中具有相当重要的地位,经济价值与开发潜力较高。近年来,随着鲈鱼市场需求的不断增长,开展鲈鱼的贮藏保鲜研究显得尤为重要。但由于鲈鱼水分与蛋白质含量高,鱼体鳃部及体表易携带大量细菌,贮藏期间极易腐败变质[1]。前人研究得出,微生物的生长繁殖会加速鱼肉组织结构分解、氧化酸败并产生大量异味,导致其腐败,严重影响水产品的品质[2-3]。目前普遍应用的保鲜方法是冰藏。传统碎冰(crushed ice,CI)贮藏密封不充分,抑菌效果差,保鲜能力不足;因此优化冰藏处理技术对延长水产品货架期具有重要意义[4]。流化冰(slurry ice,SI)为新型保鲜处理技术,其具有预冷速度快、机械损伤小等优点,贮藏中可将鱼体完全浸没,能有效隔绝氧气。同时,SI中的盐对细菌也有一定的抑制作用,能延缓由氧化和微生物繁殖导致的腐败变质[5]。酸性电解水冰(acidic electrolyzed water ice,AEWI)不仅结合了传统冰低温贮藏的作用,还具有杀菌能力强、应用范围广且安全方便的特点,在水产品保鲜中也有广泛应用[6]。但由于鱼类在冰藏过程中依然会受到优势腐败菌(specific spoilage organisms,SSO)的影响,且其生长速度和致腐能力均较强[7];因此,开展水产品冰藏期间SSO的研究并进行靶向抑制,对水产品保鲜具有重要意义。
现有报道显示,目前微生物群落研究主要基于传统分离培养或变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)等分子生态学技术开展,其仅能检测极少数易培养或优势菌群的变化情况,难以反映微生物真实丰度与演替规律[8]。高通量测序技术也称“下一代测序”技术,能一次并行对几十万到几百万条DNA分子进行序列测定,一般以读长较短为标志,是微生物领域中重要的研究方法,具有测序通量高、结果精准等优点[9-10]。其虽建立时间不长,但发展迅速,现已广泛应用于基因组,包括测序、表观基因组学与功能基因组学研究等方面[11]。高通量测序技术能检出样品中不可培养及低丰度的微生物,在土壤多样化、肠道环境、发酵食品与人类健康等学科领域应用广泛[12]。米其利等[13]对高通量测序技术的操作流程、在食品微生物生态学中的应用进行综述,评价了该测序技术的优势、局限性及应用前景。张和平等[14]总结了近年来高通量测序技术在乳制品微生物基因组和生物多样性中的应用现状。目前高通量技术在鲐鱼、大黄鱼、南美白对虾、鲊鱼等水产品的微生物生态学上已有应用研究,但运用高通量技术分析不同冰藏条件下鲈鱼中的细菌群落演变规律及品质特征变化的报道较少[15-17]。
本实验在进行挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量、K值等品质指标测定的基础上,通过Illumina Miseq测序平台和PICRUSt功能预测工具来对比分析不同冰藏条件下鲈鱼菌群结构和代谢功能的差异,以揭示鲈鱼冰藏过程中的微生物变化规律及致腐机制,为后期靶向抑制其腐败变质提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜活鲈鱼(质量(500±20)g、体长(27.5±1.2)cm),购自上海市水产品市场,30 min内运至实验室后立即处理。
细菌基因组DNA提取试剂盒(E.Z.N.A.Soil DNA Kit)美国OMEGA公司;Qubit 3.0 DNA检测试剂盒 美国Life公司;Taq酶 赛默飞世尔科技公司(上海);核酸纯化试剂盒(Agencourt AMPure XP) Beckman公司(中国);ATP关联物标准品 美国Sigma公司;轻质氯化镁等 国药集团化学试剂有限公司。
1.2 仪器与设备
RE-1000W-SP型SI制冰机 江苏南通瑞友工贸有限公司;AF-103 AS型制冰机 意大利Scotsman公司;FW-200型强酸性电解水生成器 日本Amano公司;Kjeltec8400型凯氏定氮仪 丹麦FOSS公司;Alliance 2695型高效液相色谱(high performance liquid chromatography,HPLC)系统 美国Waters公司;DYCZ-21型电泳槽 北京市六一仪器厂;T100TM型聚合酶链式反应(polymerase chain reaction,PCR)仪 伯乐(中国)公司;Miseq高通量测序仪 美国Illumina公司。
1.3 方法
1.3.1 原料处理与分组
样品用冰水洗净后随机分为3 组,分别置于盛有SI、AEWI和CI的泡沫箱中,冰鱼体积比为1∶1,置于4 ℃冰箱冰藏,隔天换冰一次。鲈鱼经去头、尾、内脏,取背部鱼肉进行各项指标测定和细菌DNA提取。
选择3 个处理组样品分别于0~23 d内定期取样测定其TVB-N含量与K值,判定其鲜度变化,每个指标做3 组平行。同时,选取贮藏前期(3 d)、中期(12 d)与末期(21 d)的样品直接用于提取总细菌DNA。其中,贮藏3 d的SI、AEWI、CI组细菌基因组DNA分别记为A1、A2、A3,12 d和21 d的SI、AEWI、CI组细菌基因组DNA分别记为B1、B2、B3和C1、C2、C3。
1.3.2 保鲜冰制备
表 1 不同保鲜冰制取规格参数
Table 1 Preparation methods and technical parameters for different types of ice used for fi sh preservation

组别 制取方式 相关参数SI SI制冰机制取冰浆由质量分数80%的冰与质量分数20%的水组成,盐质量浓度为33 g/L,SI体系温度在(-1.8±1.0)℃AEWI有效氯含量(available chlorine concentration,ACC)为(25±1)mg/kg,pH值为(3.64±0.03),氧化还原电位(oxidationreduction potential,ORP)为(1 124.0±0.8)mV,冰粒大小约为0.5 cm×0.5 cm×0.5 cm CI 普通制冰机制取 冰体温度为0 ℃左右使用质量分数0.1%的NaCl溶液电解5 min后取其酸性电解水,于-20 ℃低温箱中冷冻24 h成冰
1.3.3 TVB-N含量的测定
参考SC/T 3032—2007《水产品中挥发性盐基氮的测定》[18]进行操作,平行测定3 次,结果以mg/100 g表示。
1.3.4 K值的测定
参考杨文鸽等[19]的方法,并略作改动。取5 g鱼样放入离心管,加入质量分数10%高氯酸10 mL,匀浆后8 000 r/min冷冻离心15 min,取上清液。沉淀用10 mL 5%高氯酸洗涤,冷冻离心取上清液,合并上清液,用KOH溶液调pH值至6.5,取上清液于50 mL容量瓶中定容,过0.22 μm膜后液相测定。HPLC检验条件:pH 6.5的0.05 mol/L磷酸缓冲溶液平衡洗脱;进样量10 μL,流速1 mL/min,柱温28 ℃,检测波长254 nm,采用外标法进行定量。计算方法如下式所示。
式中:ATP、ADP、AMP、IMP、HxR、Hx分别代表腺苷三磷酸、腺苷二磷酸、腺苷酸、肌苷酸、次黄嘌呤核苷、次黄嘌呤的含量/(μmol/g)。
1.3.5 总DNA提取与PCR扩增
在无菌状态下取不同部位的鲈鱼肉,混匀后称量,采用E.Z.N.A.Soil DNA Kit的试剂盒提取鲈鱼肉中总菌群的基因组DNA[2]。用琼脂糖凝胶检测DNA完整性,置于-20 ℃备用。PCR所需引物为已融合引物(Miseq测序平台中V3~V4通用的引物)341F(5′-CCTACGGGNGGCWGCAG-3′)与805R(5′-GACTACHVGGGTATCTAATCC-3′)。其中,两轮PCR扩增体系与扩增条件参照温崇庆等[20]的方法,第一轮,30 μL PCR反应体系:2×Taq master Mix 15 μL、10 μmol/L引物各1 μL、DNA模板10 ng,加ddH2O至30 μL。PCR扩增条件为:94 ℃预变性3 min;94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,5 个循环;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,20 个循环;72 ℃延伸5 min。第二轮扩增,引入Illumina桥式PCR兼容引物,DNA模板为20 ng,PCR扩增条件为:95 ℃预变性30 s;95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸30 s,5 个循环;72 ℃延伸5 min。第二轮PCR产物进行琼脂糖凝胶电泳,观察扩增效果。
1.3.6 PCR产物纯化及测序
使用SanPrep柱式DNA胶回收试剂盒对DNA进行回收,用Qubit 3.0 DNA检测试剂盒对回收的DNA精确定量,以便于后续实验按照体积比1∶1混合后测序。由生工生物工程(上海)股份有限公司进行Illumina MiSeq高通量测序。
1.3.7 QIIME软件数据分析
通过QIIME软件(生工生物工程(上海)股份有限公司)对获得的序列进行质控与过滤,舍弃低质量的DNA序列,对获得的高质量有效序列作分类单元(operational taxonomic units,OTU)聚类[21]。根据聚类分析结果,使用mothur软件(http∶//www.mothur.org/)中的summary.single命令,计算生物多样性指数并进行Alpha多样性分析,采用RDP-classifier(https∶//sourceforge.net/projects/rdp-classifier/)方法[22]和Green Gene数据库对序列进行物种注释和分类学分析。
由OTU的分析结果计算常用的Alpha多样性指数,其中,Coverage值为测序深度指数,代表每个样品文库的覆盖率;Chao1和ACE指数可表示菌群丰富程度,数值越高表明群落物种丰富度越高;香农和辛普森指数反映物种多样性,群落多样性与香农指数呈正相关,与辛普森指数呈负相关[21]。
稀释曲线可用来说明样本的测序数据量是否合理,利用mothur软件对OTU做Rarefaction分析,利用R软件绘制曲线图。主成分分析(principal component analysis,PCA)通过方差分解,对原有的复杂数据降维,保持数据集中对方差贡献最大的特征,反映样本间的差异和距离,利用R软件的vegan package进行分析[16]。利用PICRUSt(http∶//picrust.github.io/picrust/)工具将OTU表标准化并进行功能预测分析。
1.4 数据分析
利用Excel 2010、SPSS Statistics 20.0等统计软件进行数据处理和分析,利用Origin 9.1软件作图。
2 结果与分析
2.1 TVB-N含量和K值分析
鲈鱼肉的TVB-N含量小于13 mg/100 g为一级鲜度,TVB-N含量大于30 mg/100 g即不可食用[23]。
如图1所示,从6 d开始,CI组样品的TVB-N含量明显上升,在12 d时超过一级鲜度的极限值,贮藏18 d时已接近限量标准。SI组样品的TVB-N含量在18 d时处于一级鲜度,AEWI组样品也处于新鲜状态,贮藏后期SI组样品的TVB-N含量在初始值附近,明显低于AEWI组样品。一般认为作为生鱼片的新鲜鱼K值约在20%以下,20%~50%为二级鲜度,大于70%为不可食用[24]。鲈鱼样品的初始K值为(3.95±0.18)%,表明样品的新鲜度较高。在贮藏第21天,CI和AEWI处理组样品的K值分别达到(76.41±2.12)%、(75.95±2.01)%,SI组样品为(51.08±1.22)%,低于其余两组。因此,SI可抑制样品蛋白质和核苷酸的降解速度,其中AEWI组的保鲜效果优于CI组。
2.2 样品细菌多样性分析
由表2可知,经质控与过滤等处理后得到了鲈鱼样品的有效序列,不同贮藏时间下每组样品的有效序列数均在10 000以上,有效序列达50%以上,表明测序所得到的有效序列可达到后续微生物多样性分析的要求[25]。对97%相似水平下的OTU进行生物信息统计,AEWI和CI组样品随着贮藏时间的延长,OTU数量明显增加,SI组鲈鱼样品OTU数量在贮藏后期较少,表明菌群种类较少。
表 2 不同冰藏条件下鲈鱼样品序列信息和Alpha多样性指数
Table 2 Summary of the sequencing data sets and Alpha diversity index for Lateolabrax japonicas with different ice treatments

处理方式 组别 序列数 OTU ACE指数 Chao1指数 香农指数 辛普森指数 Coverage值SI A1 47 843 904 1 112.47 1 062.45 2.99 0.13 0.99 B1 28 732 544 762.83 699.37 3.21 0.10 0.99 C1 27 237 485 634.20 570.95 2.59 0.15 0.99 AEWI A2 34 601 427 584.56 568.08 2.50 0.19 1.00 B2 36 497 518 723.46 701.33 2.75 0.16 1.00 C2 33 042 1 211 1 325.60 1 317.29 4.36 0.06 0.99 CI A3 38 553 544 730.12 771.59 2.77 0.16 1.00 B3 37 883 618 833.13 790.97 2.85 0.14 0.99 C3 35 344 923 1 087.00 1 015.92 3.73 0.06 0.99
由表2可知,各样品的测序深度指数Coverage值均大于0.99,说明样品中序列未被测出的概率较低,测序结果可反映不同冰藏过程中鲈鱼样品的真实情况[26]。AEWI组中Chao1、Ace、香农指数最小的均为样品A2,数值最大的均是样品C2,这说明AEWI组中的鲈鱼样品在3 d时物种丰富度最低,在21 d时物种丰富度和微生物多样性达到最高,可能由于此时AEWI中的有效氯成分挥发,抑菌效果降低,导致微生物污染和繁殖加剧[27]。CI组在贮藏12 d物种丰富度和微生物多样性较高,说明微生物种类和含量迅速增加,鲈鱼样品在此时已腐败。SI组中A1样品的物种丰富度最高,可能由于贮藏前期SI中的微生物与鱼体发生交叉感染,导致微生物数量增加[28]。SI组样品中,C1的Ace、Chao1和香农指数最低,辛普森指数最高,表明SI贮藏末期样品菌群丰度及多样性较低,其原因可能是“微冻”温度抑制了部分微生物的生长与繁殖,使鲈鱼样品菌群结构发生较大变化[16]。
如图2A所示,随着测序量的增加,各组样品稀释性曲线逐渐进入饱和期,说明测序量合理充分,测序深度已基本覆盖所有物种信息[29]。同时,香农指数曲线也趋于平缓(图2B),表明测序数据可反映样品中微生物菌群多样性组成,更多数据量对发现新的OTU贡献很小。
2.3 不同冰处理对鲈鱼贮藏过程中细菌群落结构的影响
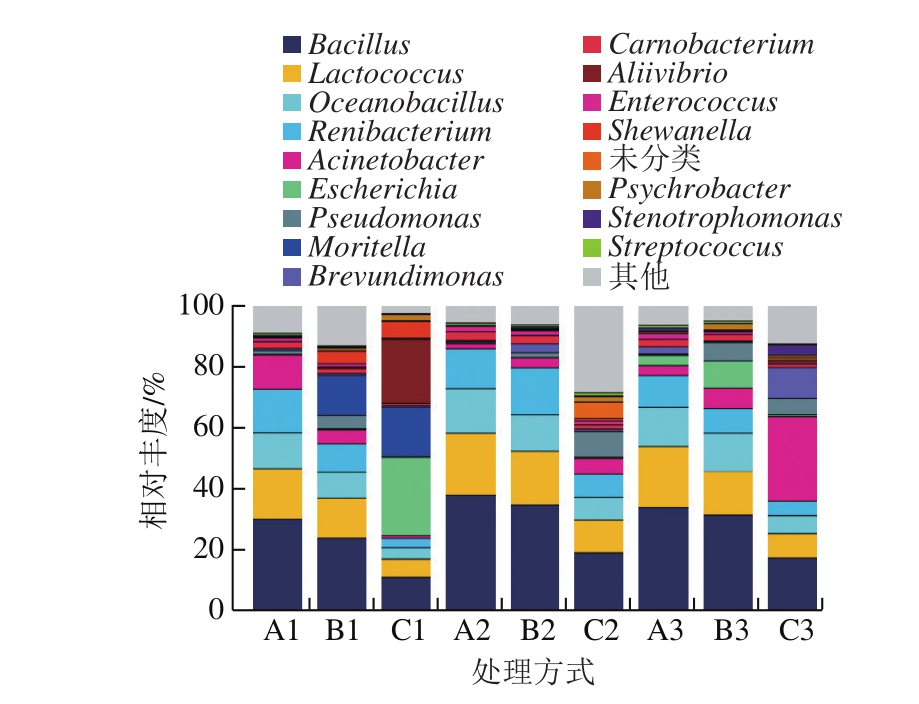
对所有冰藏样品获得的OTU从属水平上进行物种注释,图3为属水平上相对丰度大于1%的菌群柱状分布图。
由图3可知,鲈鱼在不同贮藏阶段中的菌群结构差异较大。在冰藏初期(3 d),3 组中鲈鱼样品A1、A2、A3主要以芽孢杆菌属(Bacillus)、乳球菌属(Lactococcus)、大洋芽孢杆菌属(Oceanobacillus)、肾杆菌属(R e n i b a c t e r i u m)、不动杆菌属(Acinetobacter)为主,其中在菌群中占比例最大的是芽孢杆菌属,分别达30.08%、38.12%、33.82%,与目前大多数冷鲜肉优势腐败菌研究结果[17,30]一致,其次为乳球菌属、大洋芽孢杆菌属。随着冰藏时间的延长,鲈鱼样品中芽孢杆菌属、乳球菌属和大洋芽孢杆菌属相对丰度明显下降,且以上菌属在AEWI组和CI组的相对丰度显著高于SI组。
随着贮藏时间的延长,SI处理样品中的假单胞菌属(Pseudomonas)、希瓦氏菌属(Shewanella)相对丰度分别由1.25%、0.03%升至4.38%、4.06%,摩替亚氏菌属(Moritella)、埃希氏杆菌属(Escherichia)和别弧菌属(Aliivibrio)在贮藏中、后期所占比例逐渐增大,优势明显。相关研究报道显示,假单胞菌属和希瓦氏菌属是水产品低温贮藏过程中常见的腐败菌,具有很强的产生氨等腐败产物的能力[31-32]。此外,摩替亚氏菌属、埃希氏杆菌属也能在冰藏温度下生长,是冷鲜水产品和禽畜肉中的常见腐败菌和致病菌[33]。在AEWI和CI组样品中,假单胞菌属、短波单胞菌属(Brevundimonas)与不动杆菌属(Acinetobacter)在贮藏前期均未检出或检出量很少,到12 d时,其所占比例总体呈增长态势,21 d时AEWI组假单胞菌属和不动杆菌属迅速增加,加速了冰鲜鲈鱼的腐败。CI组在21 d时不动杆菌属比例达27.77%,说明该菌是影响CI组贮藏过程中鲈鱼腐败变质的优势菌属。综上所述,假单胞菌属、不动杆菌属和希瓦氏菌属可能是鲈鱼冰藏期间的主要优势菌。
2.4 PCA比较分析
样品在PCA图中相应坐标轴上的距离越近,组成相似性越高[25]。对于主成分PC1-2分析(图4A),冰藏前期的样品A1、A2、A3样品较为相近,说明在这一主成分水平上3 种保鲜冰处理下鲈鱼贮藏前期的菌群特征较为相近[12]。对主成分PC1-3分析(图4B),在主成分PC3方面,贮藏21 d的3 组鲈鱼样品与前、中期样品的距离区分度明显,表明样品在冰藏末期的菌群组成发生较大变化,该结果与群落结构分析结果一致。温冬玲等[25]在不同增菌温度下冷鲜鸡肉细菌群落的主成分分析中也得到相似结果。主成分PC2-3分析中(图4C),贮藏12 d的样品B1、B2、B3间与贮藏21 d的C1、C2、C3样品间在主成分PC2和PC3方面均距离相对较远,贮藏中期和末期样品在几种特定微生物组成上均有较大差异。总体来看,在各个主成分坐标轴上,贮藏末期3 个处理组样品与前、中期样品均相距较远,且贮藏末期的样品C2、C3与C1相互间也有一定距离,表明贮藏时间及冰藏方式对鲈鱼样品微生物种类及组成变化影响显著,导致冰鲜鲈鱼群落结构组成发生较大变化。
2.5 TVB-N含量、K值相关细菌筛选
表 3 鲈鱼冰藏期间与TVB-N含量、K值显著相关细菌
Table 3 Bacteria at the genus level remarkably associated with TVB-N content and K value in Lateolabrax japonicas during ice storage
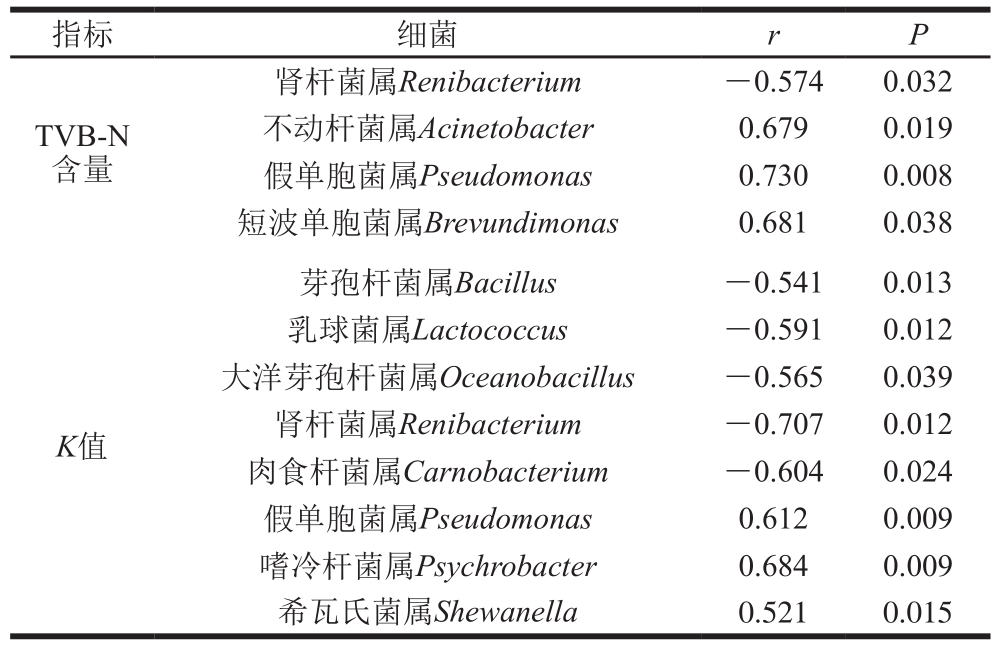
指标 细菌 r P TVB-N含量肾杆菌属Renibacterium -0.574 0.032不动杆菌属Acinetobacter 0.679 0.019假单胞菌属Pseudomonas 0.730 0.008短波单胞菌属Brevundimonas 0.681 0.038 K值芽孢杆菌属Bacillus -0.541 0.013乳球菌属Lactococcus -0.591 0.012大洋芽孢杆菌属Oceanobacillus -0.565 0.039肾杆菌属Renibacterium -0.707 0.012肉食杆菌属Carnobacterium -0.604 0.024假单胞菌属Pseudomonas 0.612 0.009嗜冷杆菌属Psychrobacter 0.684 0.009希瓦氏菌属Shewanella 0.521 0.015
在属水平上,利用皮尔森相关性检验冰藏期间鲈鱼TVB-N含量、K值与微生物群落的相关性,筛选出相对丰度>1%,r>0.5且P<0.05的相关细菌。结果如表3所示,鲈鱼样品中与TVB-N含量显著相关的细菌共4 个,其中与TVB-N含量呈正相关的有假单胞菌属、短波单胞菌属和不动杆菌属。与K值显著相关的细菌有8 个,其中呈正相关的主要是嗜冷杆菌属(Psychrobacter)、假单胞菌属和希瓦氏菌属,表明这些微生物可能是导致冰藏期间鲈鱼腐败变质的优势菌。
2.6 PICRUSt功能预测
利用软件PICRUSt进行功能基因的同源蛋白簇预测(相对丰度>0.1%),在功能聚类上,鲈鱼样品细菌代谢相关基因能基本按不同贮藏时间聚成3 类(即前、中、后期),不同保鲜冰组之间有交叉,也有相似之处。杨娟等[34]在研究集雨窖水中微生物群落结构中也得到类似结果。结果获得预测功能基因中主要是氨基酸转运和代谢、碳水化合物转运和代谢、脂质转运和代谢、辅酶转运和代谢、能源产生和转换等与代谢相关的基因。此外,鲈鱼样品中还有与翻译、核糖体结构和起源,转录,复制、重组和修复,细胞壁/膜/包膜起源,无机离子运输和代谢以及信号转导机制等相关的功能基因。冰藏至21 d时,鲈鱼样品中与上述新陈代谢和能源生产与转换相关的基因在数量上呈C2>C3>C1的趋势。其中,有关氨基酸、碳水化合物和脂质代谢的基因在数量上,C3和C2显著高于C1。表明随着贮藏时间的延长,在相关微生物作用下,CI和AEWI的样品更易进行氨基酸、脂质和碳水化合物代谢产生醛、酮和酸等物质,使鱼体产生腥臭味,品质下降。说明PICRUSt功能预测在肌肉新陈代谢相关菌的研究上表现出良好的应用前景,能为从微生物代谢角度延缓鲈鱼腐败的研究提供新思路。
3 结 论
不同保鲜冰处理下鲈鱼微生物多样性存在较大差异,与SI组相比,AEWI和CI组抑菌效果降低,群落多样性与丰富度增加。冰藏前期,3 组鲈鱼样品中主要以芽孢杆菌属、乳球菌属、大洋芽孢杆菌属为主,其中AEWI组和CI组的相对丰度显著高于SI组,随贮藏时间延长,鲈鱼菌群组成发生变化,其优势菌可能为假单胞菌属、不动杆菌属、嗜冷杆菌属、希瓦氏菌属。PCA分析发现,贮藏末期3 组样品的微生物种类及组成与其他时期样品存在较大差异,且样品C2、C3与C1间也相距较远,表明贮藏时间与冰藏方式对鲈鱼群落结构有较大影响。与SI组相比,CI和AEWI组鲈鱼样品细菌具有更高丰度的参与氨基酸、脂质和碳水化合物代谢的相关基因,说明SI对鲈鱼腐败降解的抑制效果优于AEWI和CI。本研究为从微生物代谢功能角度开发针对性的鲈鱼保鲜技术提供了参考。
参考文献:
[1] 刘明爽, 李婷婷, 马艳, 等. 真空包装鲈鱼片在冷藏与微冻贮藏过程中的新鲜度评价[J]. 食品科学, 2016, 37(2): 210-213. DOI:10.7506/spkx1002-6630-201602037.
[2] 江艳华, 王联珠, 许东勤, 等. 基于高通量测序分析虾夷扇贝柱菌群结构及腐败优势菌[J]. 食品科学, 2018, 39(20): 140-145.DOI:10.7506/spkx1002-6630-201820021.
[3] MOLINA B, SÁEZ M I, MARTÍNEZ T F, et al. Effect of ultraviolet light treatment on microbial contamination, some textural and organoleptic parameters of cultured sea bass fillets (Dicentrarchus labrax)[J]. Innovative Food Science and Emerging Technologies,2014, 26: 205-213. DOI:10.1016/j.ifset.2014.07.002.
[4] LIN H M, DENG S G, HUANG S B, et al. Effects of precooling with slurry ice on the quality and microstructure of anglerfish (Lophius americanus) liver[J]. Journal of Food Process Engineering, 2015,39(1): 3-10. DOI:10.1111/jfpe.12193.
[5] ZHANG B, DENG S G, GAO M, et al. Effect of slurry ice on the functional properties of proteins related to quality loss during skipjack tuna (Katsuwonus pelamis) chilled storage[J]. Journal of Food Science,2015, 80(4): 695-702. DOI:10.1111/1750-3841.12812.
[6] XUAN X T, FAN Y F, LING J G, et al. Preservation of squid by slightly acidic electrolyzed water ice[J]. Food Control, 2017, 73: 1483-1489. DOI:10.1016/j.foodcont.2016.11.013.
[7] 郭全友, 董艺伟, 李保国, 等. 淡腌青鱼中木糖葡萄球菌碳源代谢能力研究[J]. 农业机械学报, 2016, 47(10): 258-266. DOI:10.6041/j,issn.1000-1298.2016.10.032.
[8] 薛明, 何瑶瑶, 邱孟德, 等. 高通量测序分析凡纳滨对虾育苗期水体菌群结构特征[J]. 水产学报, 2017, 41(5): 785-794. DOI:10.1196/jfc.20160210291.
[9] WU L Y, WEN C Q, QIN Y J, et al. Phasing amplicon sequencing on Illumina Miseq for robust environmental microbial community analysis[J]. BMC Microbiology, 2015, 15: 1-12. DOI:10.1186/s12866-015-0450-4.
[10] DI BELLA B J M, BAO Y G, GLOOR G B, et al. High throughput sequencing methods and analysis for microbiome research[J]. Journal of Microbiological Methods, 2013, 95(3): 401-414. DOI:10.1016/j.mimet.2013.08.011.
[11] YANG L Y, LIU S Y, DING J M, et al. Gut microbiota comicroevolution with selection for host humoral immunity[J]. Frontiers in Microbiology, 2017, 8: 1-11. DOI:10.3389/fmicb.2017.01243.
[12] XIA X L, ZHANG Q W, ZHANG B, et al. Insights into the biogenic amine metabolic landscape during industrial semidry Chinese rice wine fermentation[J]. Journal of Agricultural and Food Chemistry,2016, 64(39): 7385-7393. DOI:10.1021/acs.jafc.6b01523.
[13] 米其利, 李雪梅, 管莹, 等. 高通量测序在食品微生物生态学研究中的应用[J]. 食品科学, 2016, 37(23): 302-308. DOI:10.7506/spkx1002-6630-201623049.
[14] 张和平, 郑艺. 高通量测序技术在乳制品研究中的应用[J]. 中国食品学报, 2015, 15(3): 1-7. DOI:10.16429/j.1009-7848.2015.03.001.
[15] 程三红, 汤海青, 欧昌荣, 等. 鲐鱼和大黄鱼冷藏期间体表细菌群落组成和代谢功能的比较分析[J]. 食品科学, 2018, 39(19): 218-225.DOI:10.7506/spkx1002-6630-201819034.
[16] 邓晓影, 张宾, 汤贺, 等. 基于高通量测序的南美白对虾中微生物群落分析[J]. 食品科学, 2018, 39(24): 149-155. DOI:10.7506/spkx1002-6630-201824023.
[17] 于美娟, 谭欢, 马美湖, 等. 传统固态发酵鱼中细菌群落多样性与品质特征分析[J]. 食品科学, 2017, 38(8): 86-95. DOI:10.7506/spkx1002-6630-201708015.
[18] 农业部. 水产品中挥发性盐基氮的测定: SC/T 3032—2007[S]. 北京:中国标准出版社, 2007: 3.
[19] 杨文鸽, 薛长湖, 徐大伦, 等. 大黄鱼冰藏期间ATP关联物含量变化及其鲜度评价[J]. 农业工程学报, 2007, 23(6): 217-222.
[20] 温崇庆, 何瑶瑶, 薛明, 等. 高通量测序分析DNA提取引起的对虾肠道菌群结构偏差[J]. 微生物学报, 2016, 56(1): 130-142.
[21] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303.
[22] EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998.DOI:10.1038/nmeth.2604.
[23] CAI L Y, WU X S, LI X X, et al. Effects of different freezing treatments on physicochemical responses and microbial characteristics of Japanese sea bass (Lateolabrax japonicas) fi llets during refrigerated storage[J]. LWT-Food Science and Technology, 2014, 15(1): 122-129.DOI:10.1016/j.lwt.2014.04.062.
[24] LI Q, ZHANG L T, LU H, et al. Comparison of postmortem changes in ATP-related compounds, protein degradation and endogenous enzyme activity of white muscle and dark muscle from common carp (Cyprinus carpio) stored at 4 ℃[J]. LWT-Food Science and Technology, 2017,78: 317-324. DOI:10.1016/j.lwt.2016.12.035.
[25] 温冬玲, 成淑君, 刘悦, 等. 高通量测序分析不同增菌温度下冷鲜鸡肉细菌的群落多样性[J]. 食品科学, 2018, 39(24): 156-161.DOI:10.7506/spkx1002-6630-201824024.
[26] KRAKOVÁ L, ŠOLTYS K, BUDIŠ J, et al. Investigation of bacterial and archaeal communities: novel protocols using modern sequencing by Illumina MiSeq and traditional DGGE-cloning[J]. Extremophiles,2016, 20(5): 795-808. DOI:10.1007//s00792-016-0855-5.
[27] 姚鑫, 赵爱静, 杜苏萍, 等. 酸性电解水冰对小黄鱼品质及肌肉组织中酶活力变化的影响[J]. 食品科学, 2017, 38(13): 244-250.DOI:10.7506/spkx1002-6630-201713040.
[28] ERIKSON U, MISIMIL E, JORNE G. Superchilling of rested Atlantic salmon: different chilling strategies and effects on fish and fillet quality[J]. Food Chemistry, 2011, 127(4): 1427-1437. DOI:10.1016/j.foodchem.2011.01.036.
[29] 杨俊花, 赵志辉, 郭文博, 等. 应用Illumina-MiSeq高通量测序技术分析脱氧雪腐镰刀菌烯醇对小鼠肠道菌群的影响[J]. 动物营养学报,2017, 29(1): 158-167. DOI:10.3969/j.issn.1006-267x.2017.01.018.
[30] YANG S P, XIE J, QIAN Y F. Determination of spoilage microbiota of pacific white shrimp during ambient and cold storage using nextgeneration sequencing and culture-dependent method[J]. Journal of Food Science, 2017, 82(5): 1178-1183. DOI:10.1111/1750-3841.13705.
[31] SALAZAR J K, WANG Y, YU S, et al. Polymerase chain reactionbased serotyping of pathogenic bacteria in food[J]. Journal of Microbiological Methods, 2015, 110: 18-26. DOI:10.1016/j.mimet.2015.01.009.
[32] 高磊, 谢晶, 叶藻, 等. 冷鲜鸡腿肉中优势腐败菌的分离鉴定及腐败能力研究[J]. 食品与发酵工业, 2015, 41(8): 48-53. DOI:10.13995/j.cnki.11-1802 /ts.201508009.
[33] 杨秀霞. 南极细菌Moritella sp.低温脂肪酶基因的克隆与表达[D].青岛: 中国海洋大学, 2004: 13.
[34] 杨娟, 郝志成, 张亚平, 等. 基于MiSeq测序分析新疆泥火山土壤细菌群落多样性[J]. 微生物学通报, 2016, 43(12): 2609-2618.DOI:10.13344/j.microbiol.china.151073.
Analysis of Bacterial Community Composition and Its Metabolic Function in Lateolabrax japonicus with Different Ice Treatments by High-Throughput Sequencing
ZHANG Wanjun1, LAN Weiqing1,2,*, DUAN Xianyuan1, SUN Xiaohong1,2, XIE Jing1,2,*
(1. College of Food Sciences and Technology, Shanghai Ocean University, Shanghai 201306, China;2. Shanghai Aquatic Products Processing and Storage Engineering Technology Research Center, Shanghai Professional Technology Service Platform on Cold Chain Equipment Performance and Energy Saving Evaluation, National Experimental Teaching Demonstration Center for Food Science and Engineering (Shanghai Ocean University), Shanghai 201306, China)
Abstract: Objective: To evaluate variations in the bacterial community composition of Lateolabrax japonicas during storage with different ice treatments and to determine its correlation with quality attributes. Methods: The fi sh were treated with slurry ice (SI), acidic electrolyzed water ice (AEWI) or crushed ice (CI). Total volatile basic nitrogen (TVB-N) content and K values (freshness index) were measured during ice storage. The structure and metabolic function of the bacterial community were also analyzed by using high-throughput sequencing. Results: SI and AEWI could maintain the quality of fi sh with the former being more effective in inhibiting the degradation rate of protein and nucleotide. The relative abundance of Bacillus,Lactococcus and Oceanobacillus in the CI and AEWI groups were much higher than in the SI group at the early stage of storage (0-3 d). During the middle to late periods of storage (12-21 d), the relative abundance of Pseudomonas, Shewanella,Moritella, Escherichia and Aliivibrio in the SI group increased rapidly; in the AEWI group, Pseudomonas and Acinetobacter gradually became dominant; the relative abundance of Acinetobacter as the dominant spoilage bacteria was up to 27.77%in the CI group on the 21st day. The results of principal component analysis (PCA) showed that ice storage and storage time had a significant influence on the bacterial community composition of Lateolabrax japonicus. Pseudomonas, Acinetobacter,Psychrobacter and Shewanella were positively correlated with TVB-N contents and K values , which may be the specific spoilage organisms of Lateolabrax japonicas during ice storage. The relative abundance of genes related to amino acid, lipid and carbohydrate metabolism in the AEWI and CI group were greatly higher than in the SI group. This may partially explain why SI could delay spoilage at the level of bacterial metabolism. This study provides a theoretical basis for optimizing the preservation and storage of Lateolabrax japonicas by microbial inhibition.
Keywords: Lateolabrax japonicus; ice treatment; high-throughput sequencing; bacterial community; metabolic function
收稿日期:2018-01-23
基金项目:现代农业产业技术体系建设专项(CARS-47);2016年上海市科技兴农重点攻关项目[沪农科攻字(2016)第1-1号];上海市科委平台能力建设项目(16DZ2280300);上海市科委公共服务平台建设项目(17DZ2293400)
第一作者简介:张皖君(1991—)(ORCID: 0000-0002-0777-6907),女,硕士,研究方向为水产品贮藏与保鲜。E-mail: 1393128715@qq.com
*通信作者简介:蓝蔚青(1977—)(ORCID: 0000-0002-0509-4494),男,高级工程师,博士,研究方向为水产品加工及贮藏工程。E-mail: 17022914@qq.com谢晶(1968—)(ORCID: 0000-0002-0507-4136),女,教授,博士,研究方向为食品低温保鲜技术。E-mail: jxie@shou.edu.cn
DOI:10.7506/spkx1002-6630-20180123-314
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2019)05-0234-08
引文格式:张皖君, 蓝蔚青, 段贤源, 等. 基于高通量测序分析不同保鲜冰处理对鲈鱼菌群组成与代谢功能的影响[J]. 食品科学,2019, 40(5): 234-241. DOI:10.7506/spkx1002-6630-20180123-314. http://www.spkx.net.cn
ZHANG Wanjun, LAN Weiqing, DUAN Xianyuan, et al. Analysis of bacterial community composition and its metabolic function in Lateolabrax japonicus with different ice treatments by high-throughput sequencing[J]. Food Science, 2019,40(5): 234-241. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180123-314. http://www.spkx.net.cn