氯吡苯脲处理对莲子细胞壁多糖降解特性的影响
孙凤杰1,2,3,罗淑芬2,3,颜廷才1,胡花丽2,3,周宏胜2,3,张雷刚2,3,李鹏霞2,3,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.江苏省高效园艺作物遗传改良重点实验室,江苏 南京 210014)
摘 要:为探究氯吡苯脲(1-(2-chloropyridin-4-yl)-3-phenylurea,CPPU)处理对莲子采后细胞壁多糖降解特性的影响,以‘太空莲36号’莲蓬为试材,以清水浸泡为对照,以5 mg/L CPPU对莲蓬进行处理。结果表明:CPPU处理可有效维持莲蓬及莲子较好的表型,保持莲子脆嫩口感;CPPU处理的莲子含有更高的共价结合果胶含量和更完整的纤维素多糖碳链结构;CPPU处理可有效抑制果胶甲酯酶、多聚半乳糖醛酸酶等果胶降解酶和外切葡聚糖酶、β-葡萄糖苷酶、内切葡聚糖酶等纤维素降解酶的活力,从而延缓共价结合果胶降解及水溶性果胶、离子结合果胶积累,并保持莲子纤维素和半纤维素含量;同时,CPPU处理保持了莲子细胞壁结构和纤维素微纤丝的形态,并抑制了细胞的质壁分离。因此,CPPU处理有利于抑制莲子细胞壁多糖的降解,更好地维持细胞完整性,保持莲子的口感,从而延缓其采后衰老。本实验为鲜莲蓬和莲子的采后保鲜提供理论依据和技术支持。
关键词:莲子;氯吡苯脲;贮藏品质;细胞壁多糖;超微结构
莲(Nelumbo nucifera Gaertn.)为睡莲科(Nymphaeaceae)莲属(Nelumbo),是一种重要的水生经济植物,兼具观赏、食用、药用等方面的价值,在我国分布较广[1]。鲜食莲子因其口感甜脆、肉质娇嫩[2]、富含多种微量元素及生物活性成分等特点而深受消费者青睐,市场发展前景十分广阔[3-4]。但是,莲蓬采后呼吸极其旺盛,常温下放置一段时间就丧失脆嫩的口感,商品价值迅速降低,严重制约了鲜食莲蓬产业的发展。
目前,莲蓬采后贮藏保鲜常用的方法主要有低温贮藏、保鲜剂法和气调保鲜等。例如,高建晓等[5]发现漆蜡涂膜可减轻鲜莲蓬采后褐变,从而保持鲜莲蓬较好的贮藏品质;王建辉等[6]利用低温对湘莲进行贮藏,发现4 ℃条件可减缓鲜莲组织水分、蛋白等散失,大幅保留其营养价值和食用品质;此外,朱雁青等[7]采用不同透气性薄膜包装莲蓬,发现高二氧化碳渗透袋可有效降低鲜莲蓬的褐变指数、总酚含量及褐变相关酶活性。同时,本课题组前期研究发现,1-甲基环丙烯可通过抑制莲蓬呼吸及乙烯产生来延缓其采后衰老[8];6-苄氨基腺嘌呤(6-benzylaminopurine,6-BA)处理可通过保持淀粉-蔗糖代谢中蔗糖合酶活性和抑制淀粉酶活性来维持莲子的淀粉和蔗糖含量[9]。总体来说,目前有关莲蓬采后保鲜的报道仍较少;因此,探究莲蓬保鲜新技术仍有较大的空间。
氯吡苯脲(1-(2-chloropyridin-4-yl)-3-phenylurea,CPPU)又名氯吡脲、KT-30等,是细胞分裂素类的一种植物生长调节剂,在采前具有诱导愈伤组织生长、促进芽发育等作用;在采后,对控制多种果蔬采后叶片黄化和采后病害等具有显著作用[10],例如,CPPU对延缓菜心叶片[11]、水稻叶片[12]等黄化方面具有显著效果;张鲁斌等[13]发现外源CPPU处理可有效降低杧果果实在贮藏期间的病害指数,推迟其乙烯生成高峰出现,降低其多聚半乳糖醛酸酶(polygalacturonase,PG)和内切葡聚糖酶(β-1,4-endoglucanase,Cx)活性。此外,Huang Hua等[14]用不同浓度CPPU处理西兰花和香蕉,发现其不仅能延缓香蕉和西兰花的成熟和软化,还能保持色泽,抵御真菌感染,延长保质期;也有研究发现适宜浓度的CPPU处理能较好地维持猕猴桃细胞壁及膜的完整性,减缓其膜结构的氧化作用[15]。细胞壁由果胶、纤维素、半纤维素及少量蛋白和木质素组成,纤维素是细胞壁的骨架,它的降解意味着细胞壁的解体和果实的软化;半纤维素以单分子层与纤维素微纤丝间以氢键相连,构成细胞壁模型;果实未成熟时,大多数果胶类物质以共价键的形式与细胞壁中的纤维素、半纤维素、木质素等大分子缔合成共价结合果胶,维持细胞壁结构。一旦果胶结构破坏,共价结合果胶会降解为水溶性果胶和离子结合果胶,引起果蔬细胞壁的分解。然而,迄今尚鲜见有关CPPU处理在莲子采后细胞壁多糖降解特性的相关研究。
本课题组前期研究结果表明,CPPU处理对莲蓬及莲子的品质具有较好的保持效果[16]。本实验从莲子多糖含量和其相关酶活性,以及细胞壁超微结构角度出发,进一步探讨CPPU处理对莲子采后衰老的影响机制,旨在为莲蓬贮藏保鲜及CPPU的实际应用提供理论及技术支持。
1 材料与方法
1.1 材料与试剂
本实验的莲蓬品种为‘太空莲36号’,于2017年7月25日采摘于江苏省淮安市金湖县荷盛莲业合作社,采后2 h内运回江苏省农业科学院农产品加工所果蔬保鲜与加工实验室。挑选大小均匀、无明显机械伤、无病虫害、成熟度一致的莲蓬作为实验材料。
CPPU、咔唑 上海瑞永生物科技有限公司;浓硫酸、甲醇 南京化学试剂股份有限公司;蒽酮、戊二醛国药集团化学试剂有限公司;丙酮、氯仿 成都市科龙化工试剂厂;羧甲基纤维素钠(化学纯) 北京索莱宝科技有限公司;滤布 德国默克公司。
1.2 仪器与设备
UV-1102紫外-可见分光光度计 上海天美科学仪器有限公司;A11 Basic型液氮研磨器 艾卡(广州)仪器设备有限公司;Seven multi pH计 梅特勒-托利多仪器(上海)有限公司;高速冷冻离心机 美国Sigma公司;CM100透射电子显微镜 荷兰Philips公司;Nicolet iS50型傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 美国Thermo Nicolet公司。
1.3 方法
1.3.1 原料处理
根据前期实验结果,清水浸泡处理对鲜莲蓬和莲子无保鲜效果,且5 mg/L CPPU对莲蓬保鲜效果较好[16]。本实验分别选择5 mg/L CPPU和清水(CK组)对莲蓬浸泡处理10 min(CPPU处理组和CK组各150 个莲蓬,每10 个莲蓬为1 个平行),于室温(23~27 ℃)条件下晾干后置于对角带孔(孔径1 cm)的乐扣箱中,于温度(25±1)℃条件下贮藏8 d。隔天取样1 次,取样方法为:CPPU处理组和CK组分别随机从15 个平行中抽取3 组(共30 个莲蓬),测定呼吸强度,拍摄表型照片后,立即去莲房、莲皮,然后切除莲子两端(约2 mm),去除莲心,用液氮速冻后于-70 ℃下保存,用于后续相关指标的测定。
1.3.2 感官评价
参考Luo Shufen等[9]的方法,评分小组由10 个经培训的成员组成,于江苏省农业科学院农产品加工研究所感官评审室按表1分别从莲蓬褐变程度(褐变面积)、籽粒脱离莲房程度、莲房失水皱缩程度、莲子褐变程度(褐变莲子比例)及莲子质地、口感5 个方面进行综合评价。总分100 分,每项分值20 分,且分4 个等级进行评价,最终得分为5 项得分的总和,得分越高表示评价越好。
表 1 莲蓬感官评定标准
Table 1 Criteria for sensory evaluation of lotus seeds

(分值) 褐变面积 籽粒脱离莲房程度等级 莲房失水皱缩程度 褐变莲子比例 莲子质地、口感I(15~20 分) <25% 未分离或轻微分离 几乎无失水、皱缩 <25% 脆嫩而饱满,甜II(10~15 分) <50% 开始出现明显分离 轻微失水、皱缩 <50% 较饱满,肉质稍疏松,较甜III(5~10 分) <75% 较明显分离 明显失水、皱缩 <75% 莲子塌陷,肉质疏松,不甜IV(0~5 分) >75% 严重分离 严重失水、皱缩 >75% 莲子明显塌陷,腐烂
1.3.3 莲子细胞壁物质的提取及FTIR分析
参照茅林春等[17]的方法进行莲子细胞壁物质提取。取莲子20 g,加180 mL、体积分数95%乙醇溶液煮沸30 min,用滤布过滤,残渣用100 mL沸腾乙醇冲洗后用50 mL体积分数90%二甲基亚砜溶液浸提放置过夜。过滤,残渣依次用100 mL无水乙醇、200 mL氯仿-甲醇(1∶1,V/V)和200 mL丙酮洗涤,30 ℃烘箱干燥后得到细胞壁物质,经80 目标准分样筛筛选,保存于干燥器中备用。
使用FTIR仪对提取好的细胞壁物质进行分析,扫描32 次,分辨率4 cm-1,测量范围4 000~500 cm-1。扫描背景单通道光谱每间隔1 h扫描1 次背景,消除外界信息干扰,保证光谱的稳定性以减少实验误差。每个品种收集3 次光谱取平均值,基线校准,以平均数作为光谱强度分析。按McCann等[18]的方法进行处理得到红外差谱。
1.3.4 细胞壁多糖物质成分的分离和含量的测定
参照Carvajal等[19]的方法分离细胞壁物质,依次得到水溶性果胶、离子结合果胶、共价结合果胶和半纤维素。水溶性果胶、离子结合果胶和共价结合果胶含量测定采用咔唑比色法。1 mL果胶物质提取液加入浓硫酸6 mL,然后沸水浴20 min,取出冷却至室温,加入0.2 mL 2 g/L的咔唑溶液,暗处放置30 min,测定反应液在530 nm波长处的吸光度,结果以每克细胞壁干物质中果胶的质量表示。半纤维素含量测定采用蒽酮比色法,纤维素含量测定参照李合生[20]的方法。
1.3.5 细胞壁多糖降解酶活性的测定
外切葡聚糖酶(cellobiohydrolase,C1)和β-葡萄糖苷酶活力的测定参照辜青青等[21]的方法,C1和β-葡萄糖苷酶活力以每克鲜质量样品每分钟形成还原糖的质量表示。Cx活力以每克鲜质量样品每小时生成1 μmol葡萄糖的量为1 个酶活力单位,结果以U/g表示。果胶甲酯酶(pectin methylesterase,PME)和PG活力测定参照吴雪莹等[22]的方法,PME活力以每毫克鲜质量样品每分钟内消耗0.01 mol/L NaOH的体积表示;PG活力以每克鲜质量样品每小时生成1 μmol半乳糖醛酸的量为1 个酶活力单位,结果以U/g表示。
1.3.6 透射电子显微镜样品制备及超微结构观察
参照Khaliq等[23]的方法并略有改动,取莲子样品各10 颗,将莲子去除莲子壳,用双面刀片快速切取莲子0.5~1.0 mm3的小块,迅速投入已预冷的体积分数2.5%戊二醛(100 mmol/L磷酸盐缓冲液配制,pH 7.2,含体积分数2%多聚甲醛)固定液中并抽真空直至组织块完全浸入固定液中,固定4 h(4 ℃)后用磷酸盐缓冲液(pH 7.2)冲洗3 次,每次15 min。之后加入体积分数1%锇酸溶液固定2.5 h,再用磷酸盐缓冲液清洗3 次,每次15 min。接着用体积分数30%、50%、70%、80%、90%、100%乙醇进行梯度脱水,之后用丙酮树脂浸透包埋,60 ℃聚合,然后进行修块、超薄切片、染色、拍照。
1.4 数据统计与分析
所有数据平行测定3 次,数据采用平均值±标准差表示,所有数据用SPSS 20.0软件进行分析,显著性采用ANOVA进行邓肯氏多重差异性分析,P<0.05表示差异显著。
2 结果与分析
2.1 CPPU处理对鲜莲蓬和莲子贮藏过程中感官评分及表型的影响
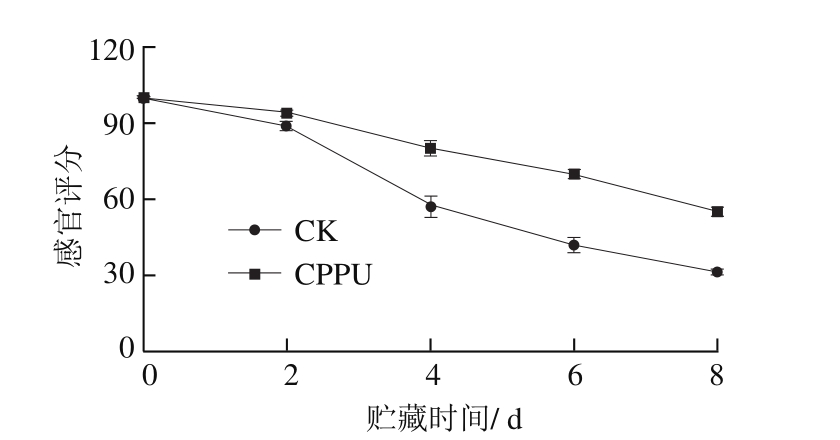
贮藏期间,莲蓬和莲子表型、口感均发生不同程度的下降。如图1、2显示,莲蓬在刚采收时,莲房呈翠绿色,莲子饱满、肉质清脆、口感极佳。在采后第2天,CK组和CPPU处理组莲房表型无明显变化,莲子由绿色变为黄绿色。在4 d时,CK组莲房出现轻微褐变,莲子出现明显褐变,口感明显下降,感官得分下降至57.32 分,而此时CPPU处理组中莲房及莲子仍保持较绿的外观及鲜嫩的口感,感官得分为80.20 分;到6 d时,CK组莲房出现大面积褐变,莲子口感急剧下降,CPPU处理组莲房开始出现褐斑,莲子褐变程度远低于CK组,并仍保持较好口感;到第8天时,CK组中莲子已出现大面积褐变,莲子出现明显松软现象,并发生腐烂,失去食用价值,此时CPPU处理组中莲房也出现明显褐变,莲子表皮虽褐变明显,但仍保持较硬的质地,具有一定食用价值。上述结果表明,CPPU处理可有效保持鲜莲蓬和莲子的表型及口感。
2.2 莲子细胞壁物质的FTIR分析
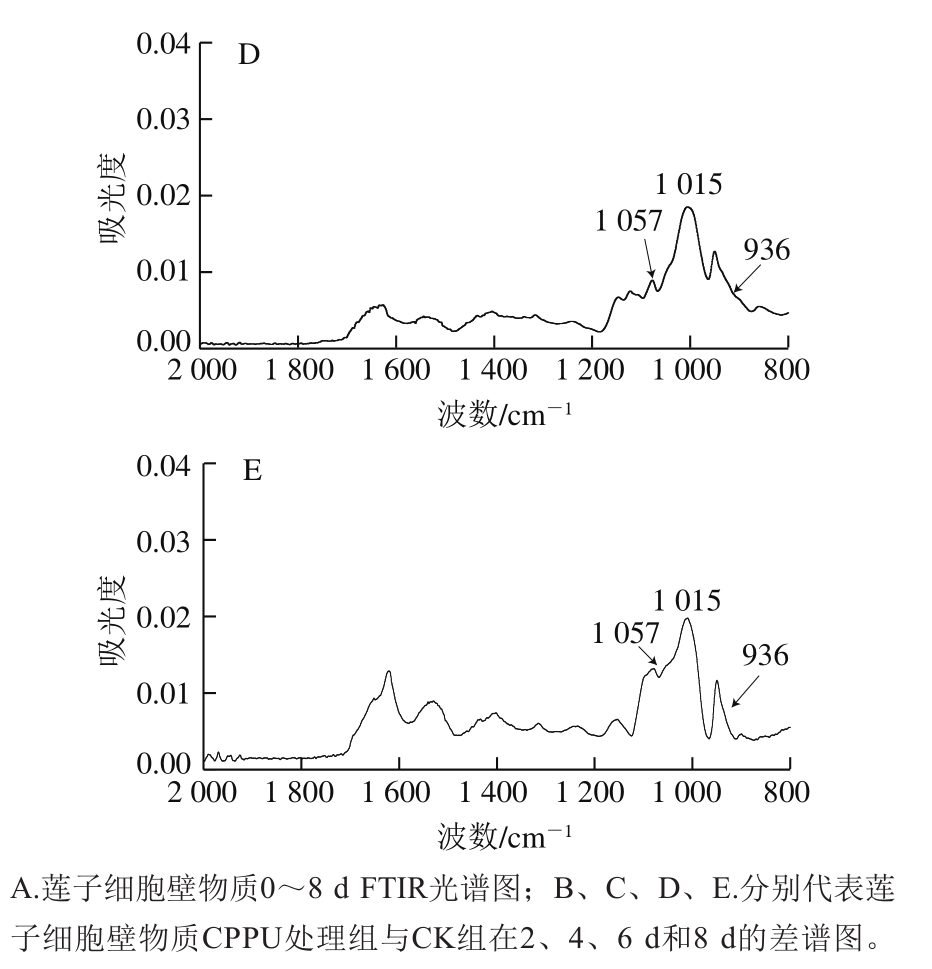
莲子不同贮藏期间的细胞壁物质FTIR光谱如图3A所示,细胞壁多糖的红外吸收峰主要在1 800~700 cm-1区域内[24-26]。1 740、1 630 cm-1处分别为甲酯化果胶酯基伸缩振动峰及反对称伸缩振动特征峰[27];果胶的其他特征峰还有1 440、1 230 cm-1和1 015 cm-1,其中1 015 cm-1峰吸收强度最强,对应果胶C—C和C—O的伸缩振动及骨架振动;以1 316、1 057 cm-1和899 cm-1为中心的波段是与纤维素相关特征基团的吸收峰,其中1 057 cm-1为纤维素的C—O和C—C伸缩振动峰;以1 147 cm-1和936 cm-1为中心的波段是与半纤维素相关的吸收峰,936 cm-1为半纤维素的环形振动。此外,某种物质的某些波段可能是重叠的,并受相邻位置波段的影响,而900~1 200 cm-1的区域,其特征是出现多种不同多糖吸收峰[28]。
莲子细胞壁物质相对含量最高的为果胶,其次是纤维素。从图3A~E中可以看出,CPPU处理组的莲子细胞壁物质在1 100~1 060 cm-1波长区间的吸收峰面积明显高于CK组,此结果初步说明,CPPU处理组莲子中果胶(1 015 cm-1)含量较CK组中高,纤维素多糖碳链结构(1 057 cm-1)较CK组完整,这种差异在贮藏第4天最为明显。半纤维素(936 cm-1)特征峰面积在红外谱图上差异不明显,初步说明CPPU处理组与CK组之间莲子细胞壁半纤维含量无明显差异。
2.3 CPPU处理对贮藏过程中莲子细胞壁果胶含量的影响
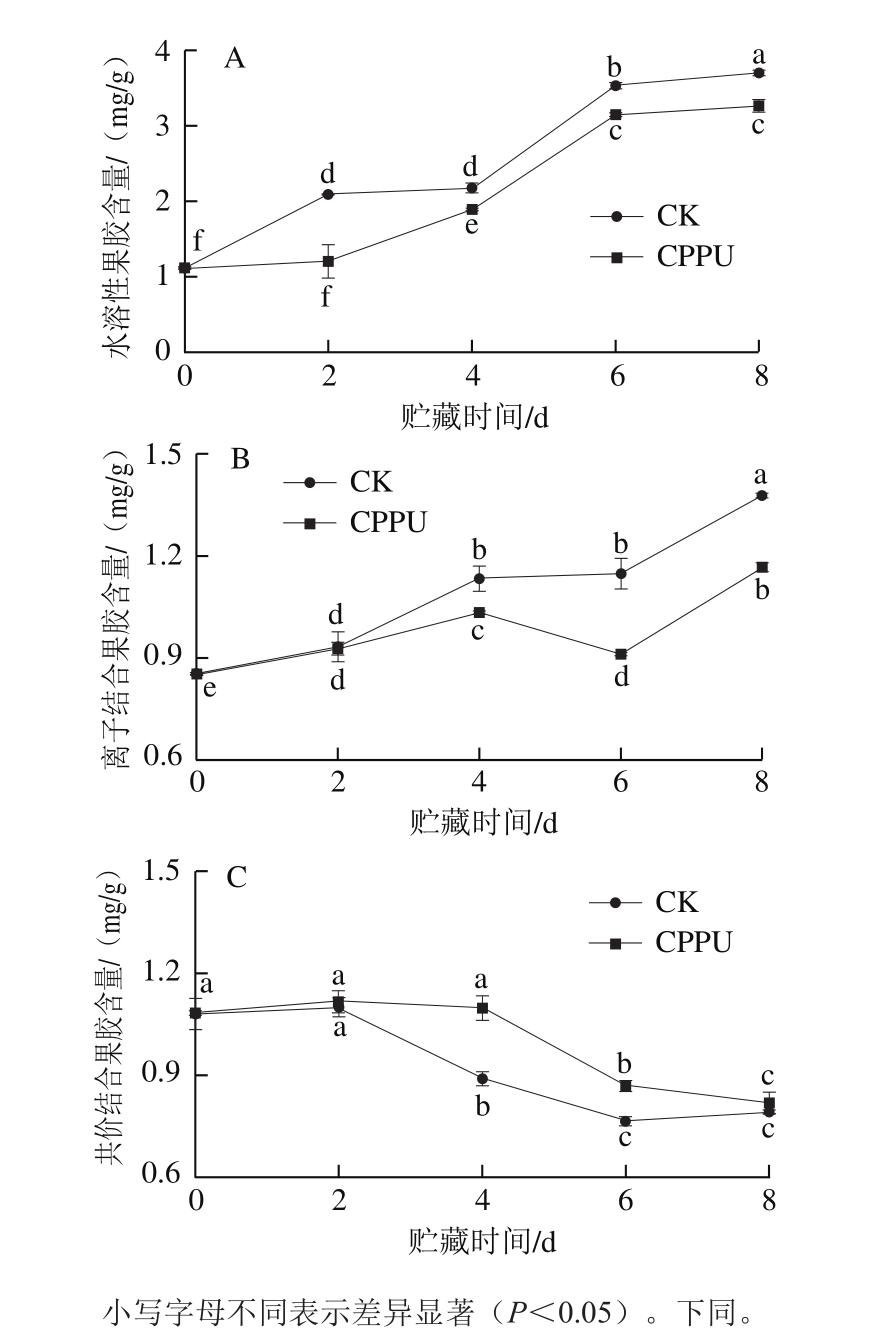
果实中的果胶类型主要分为水溶性果胶、离子结合果胶和共价结合果胶,它们的含量变化可以间接反映果实的成熟度。从图4A可以看出,莲子的水溶性果胶含量在贮藏过程中呈上升趋势,莲子水溶性果胶含量前期(0~6 d)上升较快,特别是CK组,采后第2天水溶性果胶含量上升至0 d的1.85 倍,而CPPU处理组水溶性果胶仅较0 d高0.07 倍,且在整个贮藏期间CK组的水溶性果胶含量始终显著高于CPPU处理组(P<0.05)。
如图4B所示,莲子的离子结合果胶含量在贮藏过程中也呈上升趋势。CK组与CPPU处理组的离子结合果胶含量在0~2 d差异不显著,但CK组在4~8 d显著高于CPPU处理组(P<0.05),特别是第6天,CK组的离子结合果胶含量比CPPU处理组高27.78%。
如图4C所示,共价结合果胶含量则是随着贮藏时间延长逐渐下降,与CK处理组相比,CPPU处理推迟了共价结合果胶含量的下降,例如在第4天,CK组和CPPU处理组分别较第2天分别下降了25.83%、2.68%。整个贮藏期间,CPPU处理组的共价结合果胶含量始终高于CK组,且在第4、6天差异显著(P<0.05)。由此可见,CPPU处理可较好地抑制莲子共价结合果胶含量降解,及水溶性果胶、离子结合型果胶积累。
2.4 CPPU处理对细胞壁果胶降解酶活力的影响
细胞壁中果胶的降解是多种酶作用的结果,但一般认为PME、PG是导致果胶降解的关键酶。由图5A可以看出,PME活力在贮藏期间先上升后下降,且在0~2 d上升幅度较大。CPPU处理组的PME活力始终低于CK组,并在第6~8天达到显著差异(P<0.05)。由图5B可以看出,在贮藏期间,莲子PG活力在0~2 d下降较快,2~6 d变化较小,且CK组与CPPU处理组无明显差异。到第6~8天,CPPU处理组仍保持平缓的变化,而CK组的PG活力迅速上升,到第8天,CK组的PG活力是CPPU处理组的1.71 倍,达到显著水平(P<0.05)。可以看出,CPPU处理可有效抑制PME活力,而对PG活力的抑制作用主要体现在贮藏后期。
2.5 CPPU处理对莲子纤维素和半纤维素质量分数的影响
纤维素和半纤维素是维持细胞壁形态的关键成分,由图6A可知,莲子纤维素质量分数在贮藏前期明显上升,4 d后开始下降,CK组下降较快,4~8 d期间下降了10.92%,而CPPU处理组仅下降5.60%;在整个贮藏期间,CPPU处理组的纤维素质量分数始终显著高于CK组(P<0.05)。由图6B可知,CPPU处理组和CK组的半纤维质量分数在0~2 d都迅速下降,之后含量呈小幅波动变化,但整体呈下降趋势,且在整个贮藏期间CPPU处理组的半纤维素质量分数高于CK组,并在4~8 d差异达到显著水平(P<0.05)。上述结果表明,CPPU处理可更好地维持莲子的纤维素和半纤维素质量分数。
2.6 CPPU处理对细胞壁纤维素降解酶活力的影响
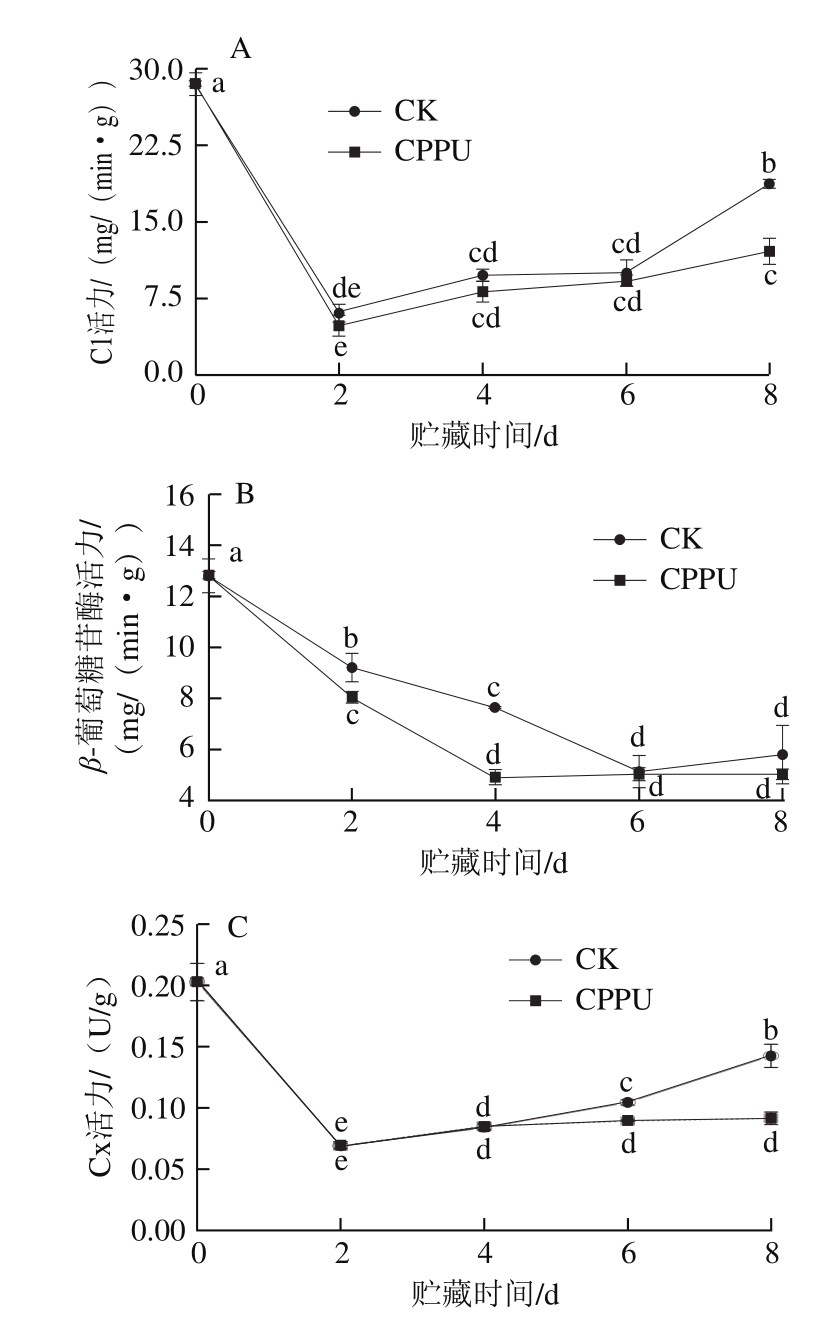
C1、β-葡萄糖苷酶和Cx共同构成细胞壁降解的酶系。由图7A可以看出,CK组与CPPU处理组C1活力变化趋势一致,均在0~2 d急剧下降后,在2~8 d呈上升趋势,在第8天,CK组的C1活力显著高于CPPU处理组(P<0.05)。
由图7B可知,β-葡萄糖苷酶活力在贮藏期间整体呈现下降趋势,前期(0~4 d)下降速率较快;后期CK组的β-葡萄糖苷酶活力呈波动变化,而CPPU处理组变化幅度不明显。在第4天时,CK组的β-葡萄糖苷酶活力比CPPU处理组高出55.92%(P<0.05)。
图7C显示,采后0~2 d,莲子Cx活力下降很快,2 d后缓慢上升,但CK组上升速度大于CPPU处理组,第6~8天显著高于CPPU处理组(P<0.05),第8天时,CK组的Cx活力比CPPU处理组高出56.04%。上述结果表明,CPPU处理可抑制细胞壁纤维素降解酶活力。
2.7 CPPU处理对莲子细胞壁超微结构及纤维素微丝结构的影响
如图8所示,莲子细胞壁超微结构在贮藏过程中发生了明显的变化,贮藏初期(0 d),细胞壁较厚、轮廓清新,细胞膜光滑,尚未发生质壁分离且结构致密,中胶层电子密度较高。至贮藏第4天时,CK组莲子的细胞壁结构开始出现轻微质壁分离,中胶层发生降解;此时CPPU处理组的莲子细胞壁状态与0 d时无明显差别。到第6天时,CPPU处理组的莲子开始出现质壁分离的现象,中胶层仍结构紧密,瓦解的现象不明显;而此时,CK组莲子细胞壁出现明显质壁分离,中胶层松散,发生瓦解。贮藏末期(8 d),CK组莲子细胞壁质壁分离严重,中胶层进一步瓦解;相比而言,此时CPPU处理组的莲子细胞壁质壁分离尚不明显,中胶层降解程度明显低于CK组,仍保持了较完整的细胞壁结构。
植物细胞壁的纤维素主要以小微纤丝的形式存在,通过对莲子细胞壁纤维素微纤丝的观察(图9)可以看出,0 d的莲子细胞壁纤维素微纤丝排列紧密、形态清晰、粗糙不透明。CK组莲子细胞壁纤维素微纤丝在4 d后出现明显的结构松散、软化和排列不规则现象,且随着贮藏时间的延长逐渐恶化;而CPPU处理组的莲子细胞壁在第8天时纤维素微纤丝仍保持排列紧密、粗糙不透明的形貌。由此可知,CPPU处理可有效保持莲子细胞壁纤维素微纤丝的形态和排列紧密、规则的状态。
3 讨 论
CPPU属于苯基脲型细胞分裂素类的植物生长调节剂,其也可用于调控果蔬采后衰老,如Huang Hua等[14]的研究结果表明,CPPU可以延缓香蕉和西兰花的衰老,推迟其表面颜色变化,抑制呼吸速率和褐变,减少质量损失,并推测CPPU对质量损失的控制与其增加角质层含量、维持细胞膜完整性有关。本实验发现,CPPU处理亦可有效保持莲蓬及莲子的表型及脆嫩的口感,延长其常温保质期。
果胶是果实细胞壁中胶层的主要组分,而纤维素是细胞壁的骨架,植物衰老过程中,细胞壁中纤维素、半纤维和果胶等多糖降解会直接影响细胞的完整性,从而使细胞中VC、酚类物质等渗出,与空气接触发生氧化,进而影响果蔬品质及口感,加速衰老[29]。本实验采用FTIR对莲子细胞壁物质进行了分析,发现CPPU处理对莲子细胞壁果胶、纤维素类和半纤维素相关官能团有较好的保持作用,尤其是保持了多糖C—C链骨架的完整性。在细胞壁降解过程中起关键作用的酶包括由PME和PG组成的果胶降解酶,以及由Cx、C1和β-葡萄糖苷酶等组成的纤维素降解酶系[30-31]。其中,PME使果胶去甲酯化,是PG活动的必要前提,PG水解果胶分子多聚半乳糖醛酸链,使细胞壁解体。本实验发现,CPPU处理对这两类酶的活力均有不同程度的抑制作用,从而维持莲子更高的纤维素、半纤维素和共价结合果胶的含量,延缓水溶性和离子结合果胶的累积。类似的研究也发现,外源CPPU处理能够有效延缓采后杧果PG和Cx活力升高,从而有利于保持果实的风味[13]。
与此结果相印证,莲子细胞壁及纤维素微纤丝的观察结果显示,CPPU处理可保持莲子纤维素微纤丝排列紧密、规则,延缓松弛变软现象出现,从而维持莲子完整的细胞壁结构,进而保持莲子新鲜、脆嫩的口感。本实验室前期的研究发现,6-BA[32]、CPPU[16]等细胞分裂素可提高莲子自由基清除能力,降低其采后膜脂过氧化程度。而刘莹等[33]发现细胞膜脂过氧化会引起细胞壁降解酶活力的升高,导致细胞壁降解。由此推测,CPPU处理抑制莲子细胞壁降解,延缓莲子衰老,可能与其作为细胞分裂素可提高莲子自由基清除能力,保护膜完整性有关,该结论与文献[34-35]所得结论相似。
综上所述,CPPU处理可通过抑制PEM和PG等果胶水解酶和Cx、C1和β-葡萄糖苷酶等纤维素水解酶活力,以延缓莲子细胞壁共价结合果胶和纤维素、半纤维素等多糖的降解,从而维持莲子细胞壁完整的结构,使莲子保持新鲜、脆嫩的口感,进而达到延缓莲蓬及莲子衰老的目的。
参考文献:
[1] 杨美, 付杰, 向巧彦, 等. 利用AFLP分子标记技术构建花莲核心种质资源[J]. 中国农业科学, 2011, 44(15): 3193-3205. DOI:10.3864/j.issn.0578-1752.2011.15.015.
[2] 郑天闻, 徐婷婷, 范亚苇, 等. 莲子多酚氧化酶的酶学性质[J].食品工业科技, 2014, 35(2): 162-165; 170. DOI:10.13386/j.issn1002-0306.2014.02.039.
[3] 王凌云, 杨梦飞, 郑寨生, 等. 不同温度条件对鲜食莲子品质的影响[J]. 现代农业科技, 2013(23): 296; 299. DOI:10.3969/j.issn.1007-5739.2013.23.186.
[4] LIU S Y, QIU F, KONG W J, et al. Development and validation of an accurate and rapid LC-ESI-MS/MS method for the simultaneous quantification of aflatoxin B1, B2, G1 and G2 in lotus seeds[J]. Food Control, 2013, 29(1): 156-161. DOI:10.1016/j.foodcont.2012.05.069.
[5] 高建晓, 王毓宁, 李鹏霞, 等. 漆蜡涂膜对鲜莲蓬采后褐变的影响[J]. 食品科学, 2016, 37(18): 275-282. DOI:10.7506/spkx1002-6630-201618044.
[6] 王建辉, 靳娜, 刘永乐, 等. 低温处理对湘莲采后生理变化的影响[J]. 食品科学, 2014, 35(18): 209-213. DOI:10.7506/spkx1002-6630-201418040.
[7] 朱雁青, 胡花丽, 郭峰, 等. 不同薄膜包装对鲜莲蓬褐变的影响[J].食品与发酵工业, 2014, 40(10): 97-102.
[8] LI P X, HU H L, LUO S F, et al. Shelf life extension of fresh lotus pods and seeds (Nelumbo nucifera, Gaertn.) in response to treatments with 1-MCP and lacquer wax[J]. Postharvest Biology and Technology,2017, 125: 140-149. DOI:10.1016/j.postharvbio.2016.10.004.
[9] LUO Shufen, HU Huali, ZHANG Leigang, et al. Sugars in postharvest lotus seeds were modified by 6-benzylaminopurine treatment through altering related enzymes involved in starch-sucrose metabolism[J]. Scientia Horticulturae, 2017, 221: 73-82. DOI:10.1016/j.scienta.2017.03.044.
[10] CRUZ-CASTILLO J G, BALDICCHI A, FRIONI T, et al. Preanthesis CPPU low dosage application increases ‘Hayward’ kiwifruit weight without affecting the other qualitative and nutritional characteristics[J]. Food Chemistry, 2014, 158: 224-228. DOI:10.1016/j.foodchem.2014.01.131.
[11] 陈巧玲, 叶蕙, 刘伟, 等. CPPU延缓菜心叶片衰老的作用[J].西北植物学报, 2001, 21(6): 1245-1248. DOI:10.3321/j.issn:1000-4025.2001.06.032.
[12] 梁颖. KT-30对离体水稻叶片衰老进程的影响[J]. 西南农业学报,2002, 15(3): 53-56. DOI:10.3969/j.issn.1001-4829.2002.03.012.
[13] 张鲁斌, 宋康华, 贾志伟, 等. 氯吡脲(CPPU)处理对采后杧果保鲜及生理效应的影响[J]. 果树学报, 2016, 33(5): 604-611. DOI:10.13925/j.cnki.gsxb.20150388.
[14] HUANG Hua, JIANG Yueming. Effect of plant growth regulators on banana fruit and broccoli during storage[J]. Scientia Horticulturae,2012, 145: 62-67. DOI:10.1016/j.scienta.2012.07.025.
[15] 张美芳, 何玲, 张美丽, 等. 猕猴桃鲜果贮藏保鲜研究进展[J]. 食品科学, 2014, 35(11): 343-347. DOI:10.7506/spkx1002-6630-201411066.
[16] 周宏胜, 孙凤杰, 罗淑芬, 等. 氯吡苯脲处理对采后莲蓬保鲜效果的影响[J]. 食品科学, 2018, 39(15): 225-232. DOI:10.7506/spkx1002-6630-201815033.
[17] 茅林春, 张上隆. 间歇低温胁迫对桃果实细胞壁代谢的影响[J].植物生理学报, 2001, 27(2): 151-155. DOI:10.3321/j.issn:1671-3877.2001.02.010.
[18] MCCANN M C, SHI J, ROBERS K, et al. Changes in pectin structure and localization during the growth of unadapted and NaCl-adapted tobacco cells[J]. The Plant Journal, 1994, 5(6): 773-785. DOI:10.1046/j.1365-313X.1994.5060773.x.
[19] CARVAJAL F, PALMA F, JAMILENA M, et al. Cell wall metabolism and chilling injury during postharvest cold storage in zucchini fruit[J].Postharvest Biology and Technology, 2015, 108: 68-77. DOI:10.1016/j.postharvbio.2015.05.013.
[20] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社,2000: 211-212.
[21] 辜青青, 唐红英, 魏清江, 等. 南丰蜜橘果实纤维素代谢与化渣的关系研究[J]. 园艺学报, 2016, 43(5): 867-875. DOI:10.16420/j.issn.0513-353x.2015-0750.
[22] 吴雪莹, 屈立武, 周雅涵, 等. 壳聚糖和纳米SiOx处理对采后脐橙果实硬度的影响[J]. 食品科学, 2015, 36(2): 204-209. DOI:10.7506/spkx1002-6630-201502040.
[23] KHALIQ G, MOHAMED M T M, ALI A, et al. Effect of gum arabic coating combined with calcium chloride on physico-chemical and qualitative properties of mango (Mangifera indica L.) fruit during low temperature storage[J]. Scientia Horticulturae, 2015, 190: 187-194.DOI:10.1016/j.scienta.2015.04.020.
[24] SZYMAŃSKA-CHARGOT M, CHYLINSKA M, KRUK B, et al.Combining FT-IR spectroscopy and multivariate analysis for qualitative and quantitative analysis of the cell wall composition changes during apples development[J]. Carbohydrate Polymers, 2015,115: 93-103. DOI:10.1016/j.carbpol.2014.08.039.
[25] SZYMANSKA-CHARGOT M, CYBULSKA J, ZDUNEK A. Sensing the structural differences in cellulose from apple and bacterial cell wall materials by Raman and FT-IR spectroscopy[J]. Sensors, 2011, 11(6):5543-5560. DOI:10.3390/s110605543.
[26] ZHBANKOV R G, FIRSOV S P, BUSLOV D K, et al. Structural physico-chemistry of cellulose macromolecules: vibrational spectra and structure of cellulose[J]. Journal of Molecular Structure, 2002,614(1/2/3): 117-125. DOI:10.1016/S0022-2860(02)00252-1.
[27] ABDENOR F, PADMESH A, MARKR W, et al. Determining the degree of methylesterification of pectin by ATR/FT-IR: methodology optimisation and comparison with theoretical calculations[J].Carbohydrate Polymers, 2009, 78(4): 847-853. DOI:10.1016/j.carbpol.2009.07.003.
[28] 王梦, 段德超, 徐辰, 等. 茶树根细胞壁不同组分对铅的吸附性能及其功能团的傅里叶红外光谱学研究[J]. 生态学报, 2015, 35(6):1743-1751. DOI:10.5846/stxb201305291222.
[29] GOULAO L F, OLIVEIRA C M. Cell wall modifications during fruit ripening: when a fruit is not the fruit[J]. Trends in Food Science &Technology, 2008, 19(1): 4-25. DOI:10.1016/j.tifs.2007.07.002.
[30] SÁNCHEZ C. Lignocellulosic residues: biodegradation and bioconversion by fungi[J]. Biotechnology Advances, 2009, 27(2): 185-194. DOI:10.1007/s00158-003-0325-4.
[31] SEYMOUR G B, GROSS K C. Cell wall disassembly and fruit softening[J]. Postharvest News and Information, 1996, 7(3): 45-52.
[32] 罗淑芬, 孙凤杰, 胡花丽, 等. 6-苄基腺嘌呤对鲜莲子活性氧代谢及能量水平的影响[J]. 核农学报, 2018, 32(5): 916-923. DOI:10.11869/j.issn.100-8551.2018.05.0916.
[33] 刘莹, 马慧, 刘艳, 等. 机械损伤对甜瓜果实贮藏期间膜脂过氧化和细胞壁代谢的影响[C]//中国园艺学会2015年学术年会论文摘要集.厦门: 园艺学报编辑部, 2015: 202.
[34] 王三根. 细胞分裂素在植物抗逆和延衰中的作用[J]. 植物学通报, 2000, 17(2): 121-126; 167. DOI:10.3969/j.issn.1674-3466.2000.02.004.
[35] 龚吉军, 谭兴和, 夏延斌, 等. 小袋包装气调和6-BA对黄花菜采后生理变化的影响[J]. 食品科学, 2004, 25(6): 175-178. DOI:10.3321/j.issn:1002-6630.2004.06.046.
Effect of 1-(2-Chloropyridin-4-yl)-3-phenylurea Treatment on Degradation Characteristics of Cell Wall Polysaccharides in Lotus Seeds
SUN Fengjie1,2,3, LUO Shufen2,3, YAN Tingcai1, HU Huali2,3, ZHOU Hongsheng2,3, ZHANG Leigang2,3, LI Pengxia2,3,*
(1. College of Food Science, Shenyang Agricultural University, Shenyang 110866, China;2. Institute of Agro-product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;3. Jiangsu Key Laboratory for Horticultural Crop Genetic Improvement, Nanjing 210014, China)
Abstract: In order to investigate the effect of 1-(2-chloropyridin-4-yl)-3-phenylurea (CPPU) treatment on the degradation of cell wall polysaccharides in lotus seeds, lotus pods from the cultivar ‘Taikonglian 36’ were treated with 5 mg/L CPPU. The samples treated with distilled water were used as controls. It was found that CPPU treatment could significantly maintain good phenotype of lotus pods and seeds, as well as crisp and tender taste of the seeds as compared with control.Meanwhile, CPPU treatment increased covalently bound pectin content in lotus seeds and maintained the structural integrity of cellulose polysaccharide chains. In addition, CPPU treatment inhibited the activity of pectin-degrading enzymes such as pectin methylesterase (PME) and polygalacturonase (PG) and the activity of cellulose-degrading enzymes such as cellobiohydrolase 1(C1), β-1,4-endoglucanase (Cx) and β-glucosidase in lotus seeds, thus degrading the degradation of covalently bound pectin and the accumulation of water-soluble pectin and ion-bound pectin and maintaining cellulose and hemicellulose.CPPU treatment could maintain the integrity of the cell wall and the morphology of cellulose microfibrils in lotus seeds and inhibited plasmolysis. Therefore, CPPU treatment can inhibit the degradation of cell wall polysaccharides, maintain cell integrity in lotus seeds as well as the taste and delay postharvest senescence of lotus pods and seeds. This experiment can provide theoretical and technical support for postharvest preservation of lotus pods and seeds.
Keywords: lotus seeds; 1-(2-chloropyridin-4-yl)-3-phenylurea; storage quality; cell wall polysaccharides; ultrastructure
收稿日期:2018-01-02
基金项目:江苏省农业科技自主创新资金项目(CX(16)1011)
第一作者简介:孙凤杰(1993—)(ORCID: 0000-0003-3672-8610),女,硕士,研究方向为果蔬贮藏与保鲜。E-mail: 1032819599@qq.com
*通信作者简介:李鹏霞(1976—)(ORCID: 0000-0002-2858-5042),女,研究员,博士,研究方向为果蔬保鲜与加工。E-mail: pengxiali@126.com
DOI:10.7506/spkx1002-6630-20180102-008
中图分类号:TS255.36
文献标志码:A
文章编号:1002-6630(2019)05-0242-08
引文格式:孙凤杰, 罗淑芬, 颜廷才, 等. 氯吡苯脲处理对莲子细胞壁多糖降解特性的影响[J]. 食品科学, 2019, 40(5): 242-249.DOI:10.7506/spkx1002-6630-20180102-008. http://www.spkx.net.cn
SUN Fengjie, LUO Shufen, YAN Tingcai, et al. Effect of 1-(2-chloropyridin-4-yl)-3-phenylurea treatment on degradation characteristics of cell wall polysaccharides in lotus seeds[J]. Food Science, 2019, 40(5): 242-249. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180102-008. http://www.spkx.net.cn