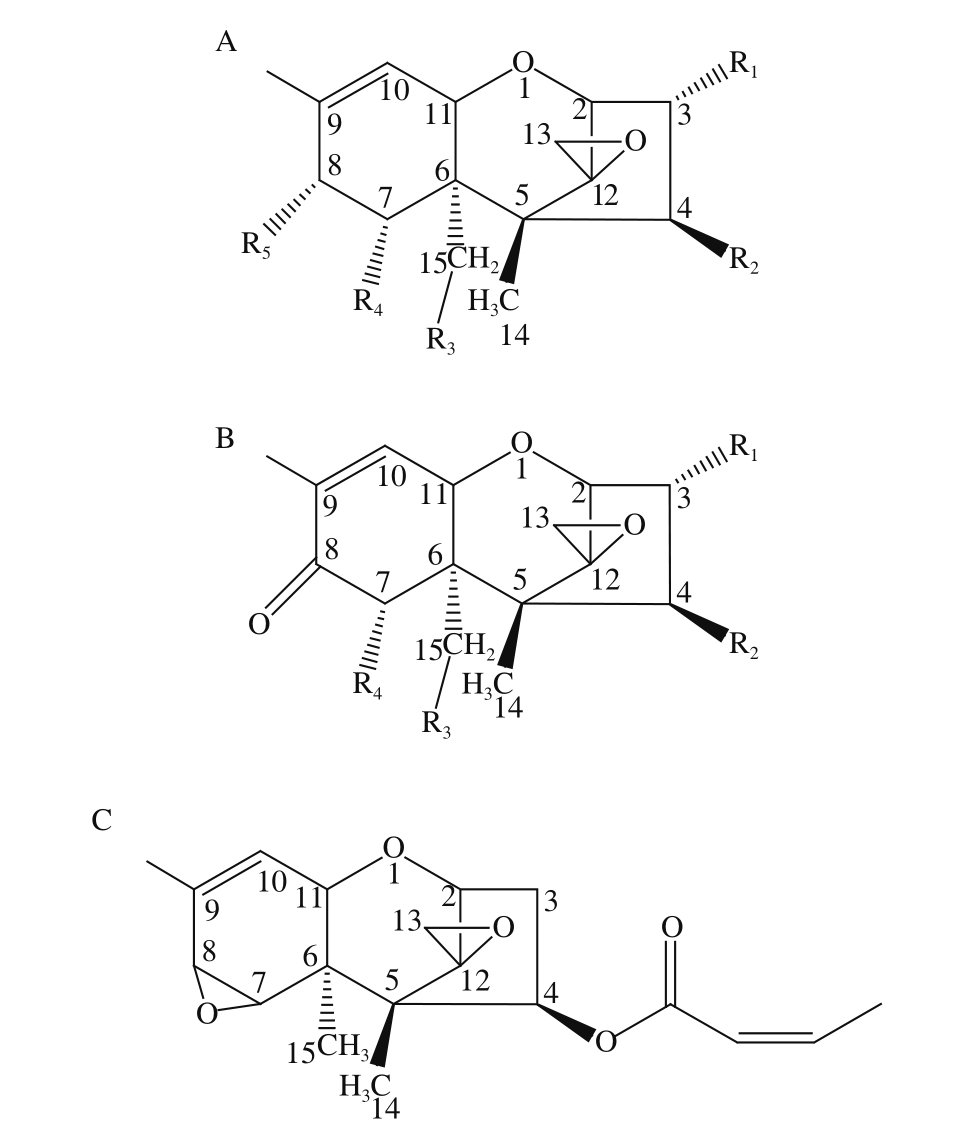
单端孢霉烯族毒素是由镰刀菌属(Fusarium)、单端孢霉属(Trichthecium)、漆斑霉属(Myrothecium)、葡萄穗霉属(Stachybotrys)等丝状真菌产生的有毒的次级代谢产物[1],其不仅广泛存在于小麦、大麦、玉米等禾谷类作物籽粒中[2-6],也存在于苹果、梨、马铃薯、葡萄等果蔬[7-8]以及肉、蛋、奶等畜产品中[3,9-10]。单端孢霉烯族毒素种类繁多,目前已超过200 种[11],典型的共同特征是具有C9,10-双键和C12,13-环氧化的倍半萜烯骨架结构。根据化学结构的不同,单端孢霉烯族毒素可分为A型、B型、C型、D型4 类(图1、表1),A型在C8位上有羟基(—OH)或酯基(—COOR)相连,主要包括T-2毒素(T-2 toxin,T-2)、HT-2毒素(HT-2 toxin,HT-2)、二乙酰镳草镰刀菌烯醇(diacetoxyscirpenol,DAS)、新茄病镰刀菌烯醇(neosolaniol,NEO)等;B型在C8位上连接羰基(—C=O),主要包括脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、雪腐镰刀菌烯醇(nivalenol,NIV)、3-乙酰脱氧雪腐镰刀菌烯醇(3-acetyldeoxynivalenol,3-ADON)、15-乙酰脱氧雪腐镰刀菌烯醇(15-acetyldeoxynivalenol,15-ADON)等;C型在C7、C8位上环氧化,如扁虫菌素;D型在C4、C15位上连接一个大环,如疣疱菌素A、杆孢菌素E等。


图 1 单端孢霉烯族毒素的基本结构[1]
Fig. 1 Chemical structures of trichothecenes[1]
表 1 A型和B型单端孢霉烯毒素取代基的区别
Table 1 Comparison of substituent groups in type A and type B trichothecenes
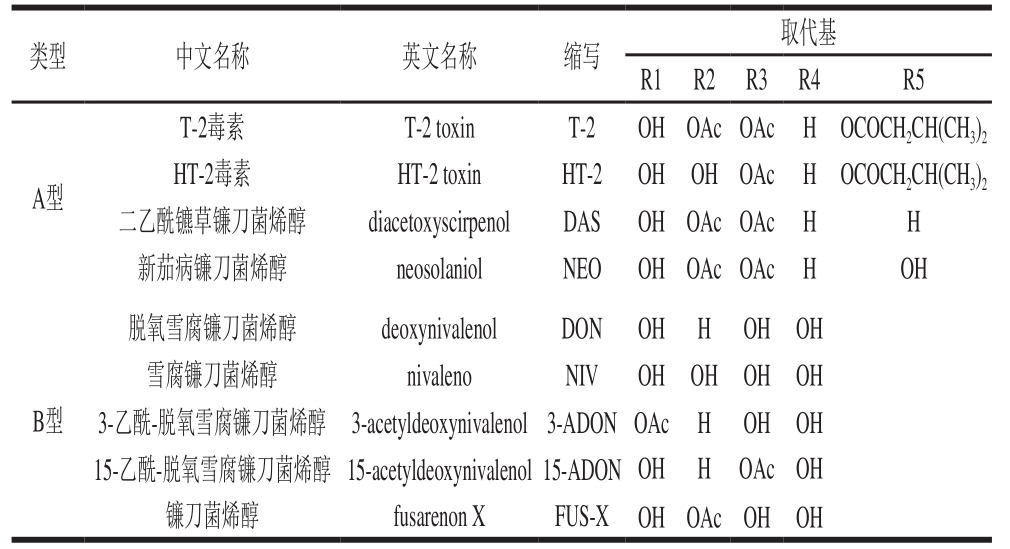
类型 中文名称 英文名称 缩写 取代基R1 R2 R3 R4 R5 A型T-2毒素 T-2 toxin T-2 OH OAc OAc H OCOCH2CH(CH3)2 HT-2毒素 HT-2 toxin HT-2 OH OH OAc H OCOCH2CH(CH3)2二乙酰镳草镰刀菌烯醇 diacetoxyscirpenol DAS OH OAc OAc H H新茄病镰刀菌烯醇 neosolaniol NEO OH OAc OAc H OH B型脱氧雪腐镰刀菌烯醇 deoxynivalenol DON OH H OH OH雪腐镰刀菌烯醇 nivaleno NIV OH OH OH OH 3-乙酰-脱氧雪腐镰刀菌烯醇 3-acetyldeoxynivalenol3-ADON OAc H OH OH 15-乙酰-脱氧雪腐镰刀菌烯醇 15-acetyldeoxynivalenol 15-ADON OH H OAcOH镰刀菌烯醇 fusarenon X FUS-X OH OAcOH OH
镰刀菌产生的单端孢霉烯族毒素主要由A型和B型组成。A型以T-2为代表,其是目前污染最广、毒性最强的真菌毒素之一;B型以DON及乙酰化的DON为代表,是存在最为广泛的真菌毒素[12]。单端孢霉烯族毒素能够抑制真核细胞蛋白质、DNA和RNA的合成,破坏细胞分裂、线粒体和膜功能,对造血系统和免疫系统有很强的毒性,具有致畸、致癌、致突变作用[13-16]。鉴于镰刀菌单端孢霉烯族毒素污染的普遍性,以及其对人类健康和粮食安全形成的巨大威胁,真菌毒素的控制显得尤为重要。从基因水平研究毒素的代谢及调控,掌握真菌毒素的生物合成途径,可为毒素防控、毒素脱除技术的发展提供理论支撑。因此,本文对镰刀菌单端孢霉烯族毒素的生物合成途径、功能基因及相关代谢调控的机理进行了综述,并结合自身相关研究基础提出了展望,以期为更好地理解和深入探究镰刀菌单端孢霉烯族毒素产毒机理和调控机制提供理论依据。
近年来,禾谷镰刀菌(Fusarium graminearum)全基因组序列的公布为基因水平研究镰刀菌真菌毒素的代谢提供了便利[17]。随着单端孢霉烯族毒素合成基因和基因簇不断被发掘和研究,单端孢霉烯族毒素的生物合成途径已经较为清楚[17-20]。单端孢霉烯族毒素合成过程中至少有15 个基因参与毒素合成[11],在拟枝孢镰刀菌(Fusarium sporotrichioides)和F. graminearum中发现12 个Tri相关基因(Tri5、Tri4、Tri6、Tri3、Tri11、Tri12、Tri7、Tri10、Tri13、Tri8、Tri9和Tri14)组成Tri5基因簇[18],排列在一个长25 kb的DNA片段上,具有相似的结构和高度的保守性(图2)。目前已经发现与单端孢霉烯族毒素合成相关的基因中有3 个基因家族:Tri5基因簇、Tri1~Tri16基因簇和Tri101基因簇,这3 个基因簇不仅位于不同的位置,而且在不同的染色体上[11,18]。参与单族毒素合成的绝大部分基因的序列及功能已经清楚(表2),包括编码单端孢霉二烯合酶的Tri5、编码P450单加氧酶的Tri4、Tri11和Tri13、编码转录调控因子的Tri6和Tri10、编码乙酰基转移酶的Tri7、Tri3、Tri16和Tri101、编码酯酶的Tri8、编码羟化酶的Tri1、编码毒素输出泵的Tri12。另外,Tri9编码一个由43 个氨基酸组成的蛋白,与现有的任何蛋白都没有同源性,到目前为止功能未知[20];Tri14对于毒素的合成不是必须的,且功能未知,但是在侵染小麦时与高致病性及毒素合成相关,表明Tri14在特定条件下影响单端孢霉烯族毒素的合成[21]。
表 2 单端孢霉烯族Tri5基因簇、Tri1~Tri16基因簇、Tri101基因簇基因及其功能[18]
Table 2 Functions of Tri genes in Tri5, Tri1-16 and Tri101 gene clusters[18]

注:tFPP.反式法尼基焦磷酸(trans-farnesyl pyrophosphate)。
基因 编码酶 功能 来源生物Tri8 酯酶 C3催化酯水解 F. sporotrichioides和F. graminearum Tri7 乙酰基转移酶 C4乙酰化 F. sporotrichioides Tri3 乙酰基转移酶 C15乙酰化 F. sporotrichioides和F. graminearum Tri4 P450单加氧酶 C2羟基化、C12和C13环氧化、C11羟基化、C3羟基化 F. sporotrichioides和F. graminearum Tri6 转录因子 调控Tri基因表达 F. sporotrichioides和F. graminearum Tri5 单端孢霉二烯合酶 tFPP环化形成单端孢霉二烯 F. sporotrichioides和F. graminearum Tri10 转录因子 调控Tri基因表达 F. sporotrichioides和F. graminearum Tri9 未知 未知 F. sporotrichioides Tri11 P450单加氧酶 C15羟基化 F. sporotrichioides Tri12 毒素输出泵 运输毒素至体外 F. sporotrichioides和F. graminearum Tri13 P450单加氧酶 C4羟基化 F. sporotrichioides和产NIV F. graminearum Tri14 未知 未知 F. sporotrichioides Tri1 羟化酶 C8羟基化或C7、C8羟基化 F. sporotrichioides和F. graminearum Tri16 乙酰基转移酶 C8形成酯基 F. sporotrichioides Tri101 乙酰基转移酶 C3乙酰化 F. sporotrichioides和F. graminearum
在产不同毒素类型的镰刀菌中,个别Tri基因也有一些差异[11]。Tri1在产T-2的F. sporotrichioides和产DON、NIV毒素的F. graminearum中只有59%的同源性,共同编码羟化酶,但是具有不同的功能。F. graminearum TRI1催化C7和C8位羟基化,F. sporotrichioides TRI1只催化C8位羟基化。Tri16最初发现在F. sporotrichioides Tri1~Tri16基因簇内位于Tri1基因的下游,编码一种乙酰基转移酶,催化C8位形成酯基,是合成T-2、HT-2等A型毒素特有的Tri基因。在F. graminearum中,Tri16假基因与Tri1毗邻,位于Tri1上游,且不具有功能活性。在T-2、NIV毒素产生菌中,Tri13编码细胞色素P450单加氧酶,催化C4位羟基化,Tri7编码乙酰基转移酶,催化C4位乙酰化;在DON产生菌中,Tri13、Tri7不具有功能活性;在产NIV的DON产生菌中,Tri13、Tri7具有功能活性,催化底物C4位羟基乙酰化从而进入NIV合成途径。这表明F. graminearum中Tri13、Tri7基因可能是导致不同类型菌株产生不同类型毒素的关键,Tri13、Tri7基因被用于区分DON和NIV毒素化学型及不同的镰刀菌。另外,在F. graminearum中构建Tri7缺失突变体,结果积累了HT-2而没有合成T-2,表明Tri7基因与C4位上加氧乙酰化相关,Tri7基因可能是导致A型毒素菌株产生不同毒素的一个关键基因。
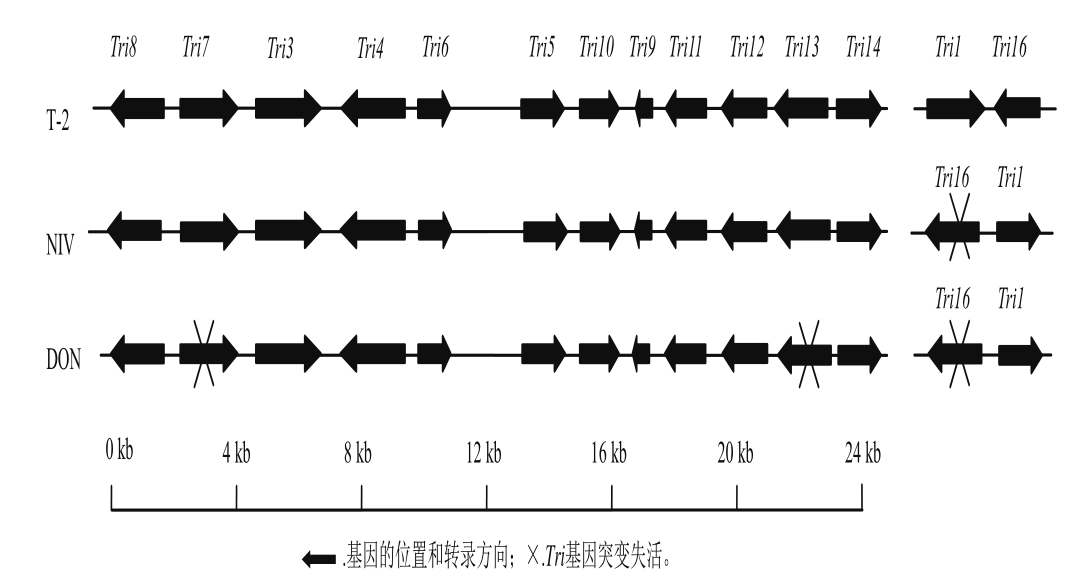
图 2 产不同毒素的镰刀菌单端孢霉烯族毒素合成基因簇的比较[18]
Fig. 2 Comparison of trichothecene gene clusters in different chemotype strains of Fusarium[18]
单端孢霉烯族毒素的生物合成起始于tFPP环化形成单端孢霉二烯,再经过一系列的加氧、异构化、环化和酯化反应最终形成不同结构的单端孢霉烯族毒素(图3)。不同种的镰刀菌具有相同的单端孢霉烯族毒素合成途径[17-18]。单端孢霉烯具有法尼基焦磷酸合成的骨架,法尼基焦磷酸是一种普遍的中间代谢产物,是固醇、辅酶Q、多萜醇等众多重要化合物的中间代谢物[22],由异戊二烯焦磷酸缩合而成。Tir5基因编码的单端孢霉二烯合酶催化tFPP环化形成单端孢霉二烯,其是开始合成单族毒素的第1个前体物质,该反应为单端孢霉烯族毒素合成途径的第1个限速步骤[23-24]。
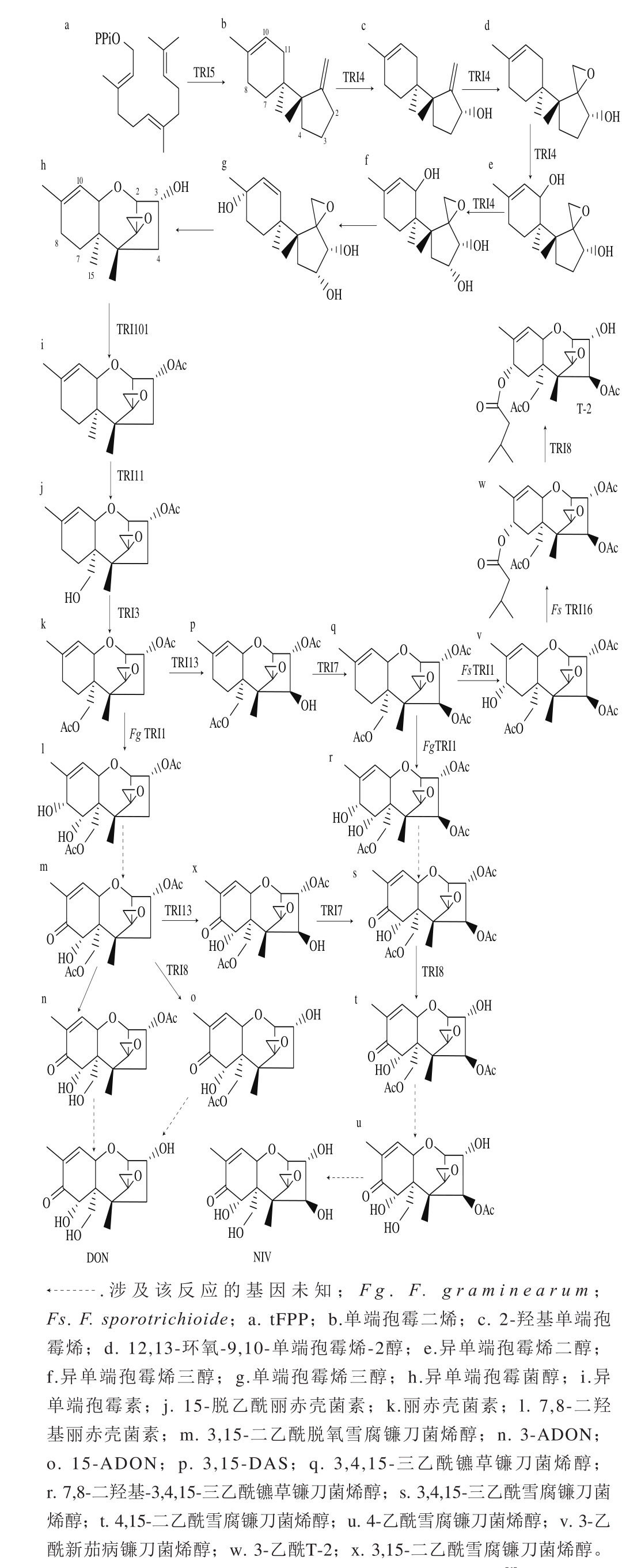
图 3 镰刀菌单端孢霉烯族毒素生物合成途径[1]
Fig. 3 Proposed trichothecene biosynthetic pathway in Fusarium[1]
紧接着单端孢霉二烯在Tri4基因编码的多功能P450单加氧酶催化下经由4 步加氧反应合成异单端孢霉烯三醇,其中首先在单端孢霉二烯的C2位上加羟基,接着在C12和C13位上环氧化、C11位上羟基化,最后在C3位上羟基化[25]。随后发生两步非酶促反应:第1步,通过异构化反应,异单端孢霉烯三醇C9位羟基取代了C11位羟基,形成单端孢霉烯三醇;第2步,单端孢霉烯三醇C2位氧原子与C11位之间环化成一个吡喃环生成异单端孢霉菌醇,成为第1个具有三环核心结构和C12,13-环氧化结构的单端孢霉烯族化合物的骨架结构[11]。
异单端孢霉菌醇在Tri101基因编码的乙酰基转移酶作用下C3位羟基乙酰化,生成异单端孢霉素,C3位的乙酰化对下步反应是必须的[26-27]。异单端孢霉素在Tri11基因编码的P450单加氧酶催化下C15位羟基化生成15-脱乙酰丽赤壳菌素[28],异单端孢霉素C15位羟基化之后,在Tri3基因编码的乙酰基转移酶催化下C15位羟基乙酰化生成丽赤壳菌素[29]。丽赤壳菌素经过不同的生物合成途径可分别生成T-2、NIV和DON等单端孢霉烯族毒素,最终由Tri12基因编码的毒素输出泵运出菌体外[30-31]。
在产T-2和NIV毒素的镰刀菌中,丽赤壳菌素经过Tri13基因编码的细胞色素P450单加氧酶的催化,C4位羟基化形成3,15-二乙酰镳草镰刀菌烯醇,接着在Tri7基因编码的乙酰基转移酶催化下C4位羟基乙酰化形成3,4,15-三乙酰镳草镰刀菌烯醇[32]。接下来,3,4,15-三乙酰镳草镰刀菌烯醇在产T-2的F. sporotrichioide中和产NIV毒素的F. graminearum中分别通过不同的代谢途径生成T-2或NIV[33]。在F. graminearum中Tri1基因编码的细胞色素P450单加氧酶催化C7和C8位羟基化[34],接着C8位羰基化形成3,4,15-三乙酰基NIV,在Tri8基因编码的酯酶催化下C3位脱乙酰基,接着C15和C4位分别脱乙酰基[35],最终形成NIV毒素;而在F. sporotrichioide中Tri1基因编码细胞色素P450单加氧酶只催化C8位羟基化[36],接着在Tri16基因编码的乙酰基转移酶催化下C8位形成含有异戊酸单体结构的酯基[37],最后通过Tri8基因编码的酯酶催化C3位脱乙酰基从而形成T-2[35]。
在产DON的F. graminearum中,Tri13基因失活,从而不能将C4位羟基化,丽赤壳菌素在Tri1基因编码的细胞色素P450单加氧酶作用下催化C7和C8位羟基化[34],形成7,8-二羟基丽赤壳菌素。接着C8位羰基化,生成3,15-ADON,在Tri8基因编码的酯酶催化下C3位脱乙酰基形成15-ADON[35]。3,15-ADON在C15位脱乙酰基生成3-ADON,两者分别在C15位和C3位脱去乙酰基最终生成DON。在产NIV毒素的F. graminearum中,3,15-ADON还可以在Tri13基因编码的细胞色素P450单加氧酶的催化下C4位羟基化,接着在Tri7基因编码的乙酰基转移酶催化下C4位羟基乙酰化形成3,4,15-三乙酰基NIV,进入NIV合成途径[33]。由此看来,单端孢霉烯族毒素的生物合成途径是一系列Tri基因编码酶催化的氧化、酯化反应,在这个过程中需要转运蛋白的参与并需要一系列相关基因的表达,一起构成一种网式互作,个别Tri基因的差异是导致合成不同类型毒素的关键。
尽管单端孢霉烯族毒素的生物合成途径已经基本清楚,但是代谢途径中涉及到相关Tri基因的分子调控,相比而言了解较少。在Tri5基因簇中,Tri6、Tri10被证实编码两种不同结构的转录因子,正向调控单族毒素生物合成的相关基因[38]。在F. sporotrichioide中将Tri10敲除,T-2合成受阻,同时显著降低包括Tri6基因在内的其他Tri基因的表达量。在F. graminearum中构建Tri6和Tri10缺失突变株侵染麦穗能显著降低致病性。从转录水平对RNA进行分析,发现包括Tri基因在内的超过200 个基因表达量发生了变化,其中一半基因在启动子区具有TRI6调控因子的结合序列。这就表明Tri6是一个综合的调节因子,不仅调控单端孢霉烯族毒素合成相关Tri基因的表达,还调控这些涉及毒素合成上游异戊二烯途径相关基因及其他基因的表达[39]。在F. graminearum中,Tri10调控Tri6的表达,Tri6还反向调控Tri10的表达。将Tri10敲除后对Tri6的表达没有明显的影响。此外,Tri14被认为是Tri基因的调控因子,在F. sporotrichioides和F. graminearum中将Tri14敲除,体外实验表明对毒素的合成没有影响,而侵染小麦的体内实验却降低了F. graminearum的致病性,并且使其失去了产生毒素的能力[21]。Tri15基因被认为是与毒素合成相关的第4个基因簇,编码锌指结构转录因子,在F.sporotrichioides中负向调控其他Tri基因的表达。然而,在F. graminearum中将Tri15敲除对毒素的合成和致病性都没有影响[40]。由此看出,单端孢霉烯族毒素生物合成途径中的Tri基因受到转录因子的调控,其在不同种的镰刀菌中以及不同环境条件下,对毒素合成的调控及致病性的影响都是不同的(图4)。
在镰刀菌单端孢霉烯族毒素生物合成途径中,由tFPP经过Tri5基因编码的单端孢二烯合酶催化生成单端孢霉二烯,然后依次在Tri4、Tri101、Tri11和Tri3基因编码的P450单加氧酶、乙酰基转移酶、羟化酶和乙酰基转移酶的催化下最终生成丽赤壳菌素,这10 步反应是A型和B型毒素产生菌中共有的代谢途径[11]。在F. sporotrichioides中和产NIV毒素的F. graminearum中,Tri13和Tri7基因具有功能活性,丽赤壳菌素在Tri13基因编码的细胞色素P450单加氧酶、Tri7基因编码的乙酰基转移酶的作用下C4位加氧羟基化、乙酰化生成3,4,15-三乙酰镳草镰刀菌烯醇。在T-2产生菌中,3,4,15-三乙酰镳草镰刀菌烯醇经过F.s Tri1、F.s Tri16、F.s Tri8编码的羟化酶、乙酰基转移酶、酯酶的催化下生成T-2[33]。F.s Tri16是生成T-2、HT-2镰刀菌所特有的编码乙酰基转移酶的基因,能催化C8位形成含有异戊酸单体结构的酯基。在产NIV毒素的F. graminearum中,3,4,15-三乙酰镳草镰刀菌烯醇经过F.g Tri1、F.g Tri8编码酶的催化生成4-乙酰NIV,最终生成NIV。在DON产生菌中,Tri13和Tri7基因没有功能活性,所以C4位上没有加氧。丽赤壳菌素在F.g Tri1、F.g Tri8基因编码酶的催化下生成3-ADON或15-ADON,最终形成DON[33]。合成3-ADON或15-ADON是由菌株特异性导致的,取决于编码酯酶Tri8基因的序列[41]。不同类型的单端孢霉烯族毒素生物合成的基因簇比较表明,参与毒素合成的基因大多数是相同的,但也有个别差异。参与的代谢途径不同以及基因的差异是导致形成不同毒素的根本原因。
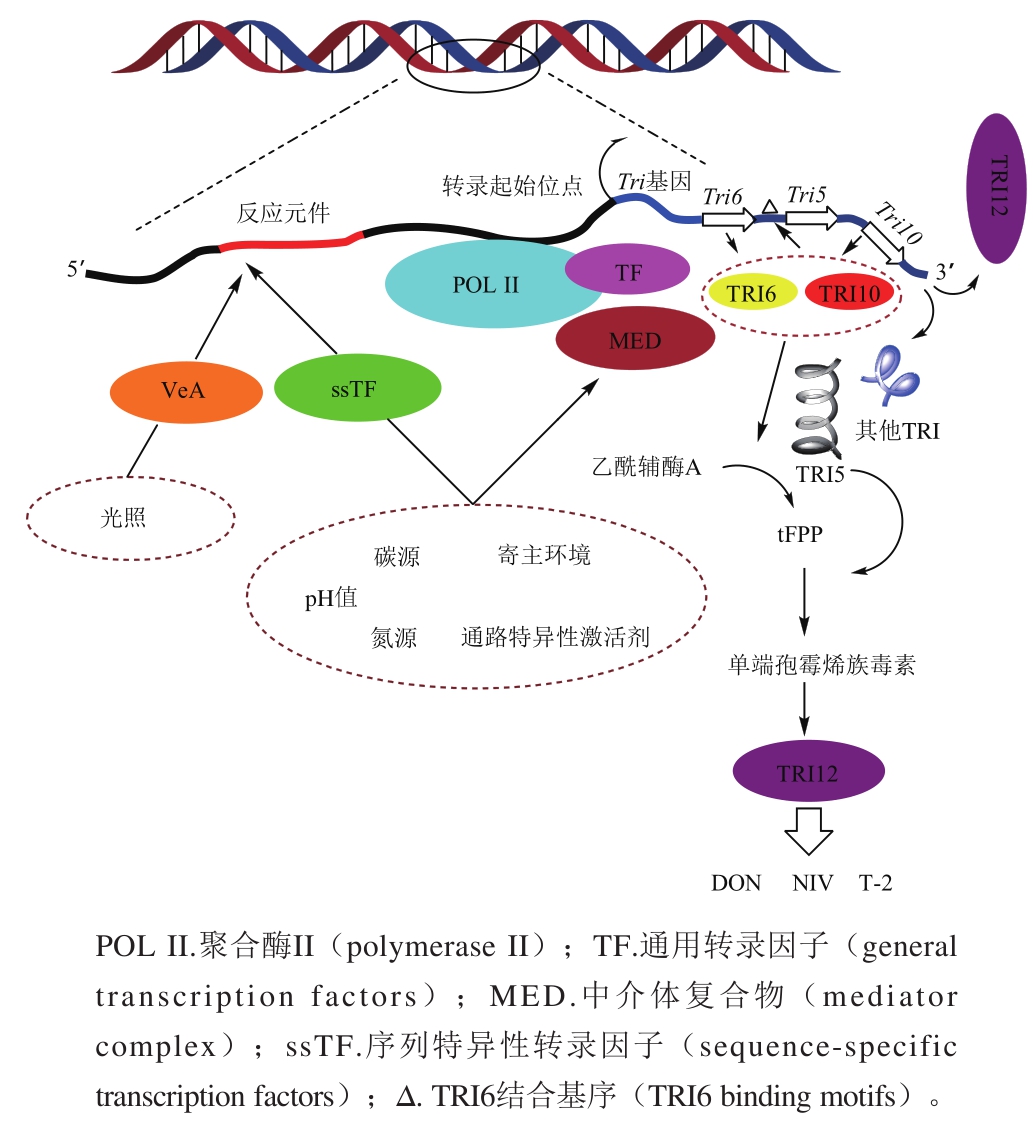
图 4 单端孢霉烯族毒素生物合成的分子调控机制
Fig. 4 overview of molecular regulation mechanism involved in the transcription of trichothecenes biosynthetic genes
单端孢霉烯族毒素的生物合成除了受特异的转录调控因子调控之外,还受到与外界环境因素密切相关的全局性调控因子的调控。pH值是一个影响单端孢霉烯族毒素合成的重要环境因素。F. graminearum在pH值低缓冲合成培养基中生长会导致环境pH值降低,Tri基因的表达和毒素的合成与pH值呈正相关;而在中性乃至碱性条件下抑制毒素的合成和Tri基因的表达[42]。在Aspergillus nidulans中发现pH值调控系统,在碱性条件下6 个pal基因编码产物激活锌指结构调控因子PacC,PacC进入细胞核与具有“GCCARG”特异识别序列的启动子结合从而指导基因的转录[43]。在F. verticillioides中也发现Pac1调控伏马菌素的合成[44]。在F. graminearum中发现Pac1直接参与了由pH值介导调控单端孢霉烯族毒素的合成,表明在酸性条件下表达组成型有活性的Pac1因子显著抑制了Tri基因的表达并降低了毒素的积累;缺失Pac1突变株与野生型菌株相比,在酸性条件下早期诱导了Tri基因的表达和毒素的合成[42]。在包括Tri6及其他Tri基因的启动子区中发现具有PacC结合序列“GCCARG”,从而表明PacC直接调控Tri6的表达,进而间接调控其他Tri基因的表达或同样直接调控Tri基因的表达来影响毒素的积累[42]。光照也是一种重要的影响真菌生长的刺激信号。真菌感受光刺激会做出反应,调整代谢通路来适应环境的变化。除了光调控受体蛋白WC-1和WC-2之外[45],在A. nidulans中发现velvet基因编码的VeA也是一种重要的光调控蛋白。大量研究表明VeA参与了丝状真菌代谢相关基因的表达和次级代谢产物的合成[46-47]。A. nidulans中,柄曲霉素生物合成基因簇由转录激活因子aflR基因激活调控,VeA可通过影响aflR的转录表达调控柄曲霉素的合成[48];在F. verticillioides中,F.v VE1调控伏马菌素的生物合成[49];在F. fujikuroi中,F.f Vel1和F.f Lae1调控伏马菌素和镰刀菌素C的合成[50];在F. graminearum中,F.g VeA通过调控Tri6的表达来正向调控DON的生物合成和影响致病性[51]。丝状真菌的次级代谢途径非常复杂,许多调节次级代谢的调控因子大多已被鉴定,但是具体的调节机制还有待进一步研究。
镰刀菌产生的单端孢霉烯族毒素既是自身生长过程中分泌的一种次级代谢产物,同时也可以被认为是镰刀菌因外界环境改变而产生的一种适应反应,可见镰刀菌真菌毒素受到一系列复杂的镰刀菌与寄主、镰刀菌与环境等互作过程的综合调控[52-54]。目前,对真菌毒素的发生、检测、毒性等研究多有报道[55-62],而对毒素生物合成及调控机理方面报道并不多[63-64],所以更应该深入研究真菌毒素的生物合成及其遗传信息、分子机制,以推动农业和食品行业中真菌毒素的防控与去除。本文针对目前食品中最常见的镰刀菌单端孢霉烯族毒素的生物合成及其分子调控进行了综述,分别阐释了单端孢霉烯族毒素合成的相关基因、合成途径及相关酶和分子调控机理。镰刀菌单端孢霉烯族毒素的生物合成途径是一系列Tri基因编码酶催化的氧化、酯化反应,在这个过程中需要转录调控因子的参与并需要一系列Tri基因的表达,一起构成一种网式互作。由镰刀菌单端孢霉烯族毒素生物合成途径可以看出,毒素形成的差异主要是由代谢途径和基因差异决定的,如果能够调控合成途径中的关键基因的表达,则可以起到调控毒素积累的作用。
植物体内能够合成多种多酚类物质来抵抗病原真菌的侵入,这些物质也能抑制真菌的生长和毒素的积累:例如木脂素松脂醇、开环异落叶松脂素可抑制F. graminearum的生长和毒素的积累[65];黄酮和呋喃香豆素在抑制F. graminearum毒素合成的同时还抑制单端孢霉烯族毒素合成中Tri4基因编码酶的活性[66];阿魏酸可有效抑制B型单端孢霉烯族毒素的积累和Tri基因的表达[67-68];肉桂酸类、苯乙酮类、苯甲酸类、苯丙素类、羟基联苯类等对F. culmorum产B型毒素有抑制作用[69]。Atanasova-Pénichon等报道了绿原酸在对抵抗玉米粒中F. graminearum的侵染和DON的积累中起到积极作用[70];本课题组的研究发现1.25 mmol/L绿原酸对F. sulphureum具有抑制效果,可引起细胞膜通透性增大,细胞内的电解质、核酸和蛋白质渗漏到胞外,并且发现引起F. sulphureum Tri5、Tri4、Tri6、Tri10、Tri12基因表达量的下调,与Ferruz等[71-72]报道的绿原酸在低浓度(0.5 mmol/L)时对F. sporotrichioides生物量没有抑制作用,但降低了毒素的积累,下调了Tri5、Tri6、Tri12基因的表达量,在高浓度(2.5~10.0 mmol/L)时可完全抑制菌体的生长的结论一致。Martínez等[73]报道了2.5~10.0 µg/µL绿原酸对于F. solani等多种植物病原真菌具有抑制作用,可抑制孢子萌发和菌丝体的生长,破坏细胞膜,造成细胞裂解,与本课题组研究结果一致。
农产品中积累的真菌毒素对人畜的健康造成较大威胁,所以,开展防控农产品中真菌毒素污染的研究显得尤为重要和迫切。化学杀菌剂虽然可有效控制镰刀菌引起的危害,但其残留不仅会危害人类健康,还会导致镰刀菌产生抗药性和环境污染。因此,寻找安全、高效、环保的真菌毒素抑制剂便成为当前食品安全控制中亟待解决的问题。植物体内的天然化合物是生物可降解并且可再生的,对于植物病害的防控具有很好的应用前景。目前,降低单端孢霉烯族毒素积累的研究主要集中在筛选高效、天然、无毒的多酚类物质,以及对一些相关Tri基因或是关键酶进行单独研究[65-72],缺乏整体、系统的探索。对于这些物质调控单端孢霉烯族毒素产生的分子机制目前尚不清楚。鉴于目前尚鲜有理想的防控农产品镰刀菌单端孢霉烯族毒素污染的措施,而来自植物体内的天然化合物又表现出抑制镰刀菌及真菌毒素的巨大潜力,我们应该进一步加强对镰刀菌真菌毒素产生的途径和调控机理的系统研究,建立植物体内天然化合物调控单端孢霉烯族毒素的代谢网络,以代谢网络中的上游基因和关键基因作为毒素控制的靶标,遏制病原菌真菌毒素的代谢,降低农产品、食品受真菌毒素污染的风险,确保人类饮食健康安全。
[1] MCCORMICK S P, STANLEY A M, STOVER N A, et al.Trichothecenes: from simple to complex mycotoxins[J]. Toxins, 2011,3(7): 802-814. DOI:10.3390/toxins3070802.
[2] QIU J B, DONG F, YU M Z, et al. Effect of preceding crop on Fusarium species and mycotoxin contamination of wheat grains[J].Journal of the Science of Food and Agriculture, 2016, 96(13): 4536-4541. DOI:10.1002/jsfa.7670.
[3] OIDENBURG E, HÖPPNER F, ELLNER F, et al. Fusarium diseases of maize associated with mycotoxin contamination of agricultural products intended to be used for food and feed[J]. Mycotoxin Research, 2017, 33(3): 167-182. DOI:10.1007/s12550-017-0277-y.
[4] KAMALA A, KIMANYA M, LACHAT C, et al. Risk of exposure to multiple mycotoxins from maize-based complementary foods in Tanzania[J]. Journal of Agricultural and Food Chemistry, 2017,65(33): 7106-7114. DOI:10.1021/acs.jafc.6b03429.
[5] YOSHINARI T, TAKEUCHI H, AOYAMA K, et al. Occurrence of four Fusarium mycotoxins, deoxynivalenol, zearalenone, T-2 toxin,and HT-2 toxin, in wheat, barley, and Japanese retail food[J]. Journal of Food Protection, 2014, 77(11): 1940-1946. DOI:10.4315/0362-028X.JFP-14-185.
[6] DONG F, QIU J B, XU J H, et al. Effect of environmental factors on Fusarium population and associated trichothecenes in wheat grain grown in Jiangsu province, China[J]. International Journal of Food Microbiology, 2016, 230: 58-63. DOI:10.1016/j.ijfoodmicro.2016.04.020.
[7] TANG Y M, XUE H L, BI Y, et al. A method of analysis for T-2 toxin and neosolaniol by UPLC-MS/MS in apple fruit inoculated with Trichothecium roseum[J]. Food Additives & Contaminants: Part A,2015, 32(4): 480-487. DOI:10.1080/19440049.2014.968884.
[8] XUE H L, BI Y, WEI J M, et al. New method for the simultaneous analysis of types A and B trichothecenes by ultrahigh-performance liquid chromatography coupled with tandem mass spectrometry in potato tubers inoculated with Fusarium sulphureum[J]. Journal of Agricultural and Food Chemistry, 2013, 61(39): 9333-9338.DOI:10.1021/jf402997t.
[9] WEI D Z, WANG Y, JIANG D M, et al. Survey of Alternaria toxins and other mycotoxins in dried fruits in China[J]. Toxins, 2017, 9(7):1-10. DOI:10.3390/toxins9070200.
[10] ABRUNHOSA L, MORALES H, SOARES C, et al. A review of mycotoxins in food and feed products in Portugal and estimation of probable daily intakes[J]. Critical Reviews in Food Science and Nutrition,2016, 56(2): 249-265. DOI:10.1080/10408398.2012.720619.
[11] KIMURA M, TOKAI T, TAKAHASHI-ANDO N, et al. Molecular and genetic studies of Fusarium trichothecene biosynthesis: pathways,genes, and evolution[J]. Bioscience, Biotechnology, and Biochemistry,2007, 71(9): 2105-2123. DOI:10.1271/bbb.70183.
[12] WU Q H, DOHNAL V, KUCA K, et al. Trichothecenes: structuretoxic activity relationships[J]. Current Drug Metabolism, 2013, 14(6):641-660. DOI:10.2174/1389200211314060002.
[13] ESCRIVÁ L, FONT G, MANYES L. In vivo toxicity studies of Fusarium mycotoxins in the last decade: a review[J]. Food and Chemical Toxicology, 2015, 78: 185-206. DOI:10.1016/j.fct.2015.02.005.
[14] LEE H J, RYU D. Advances in mycotoxin research: public health perspectives[J]. Journal of Food Science, 2015, 80(12): 2970-2983.DOI:10.1111/1750-3841.13156.
[15] AHMED ADAM M A, TABANA Y M, MUSA K B, et al. Effects of different mycotoxins on humans, cell genome and their involvement in cancer (review)[J]. Oncology Reports, 2017, 37(3): 1321-1336.DOI:10.3892/or.2017.5424.
[16] ADHIKARI M, NEQI B, KAUSHIK N, et al. T-2 mycotoxin:toxicological effects and decontamination strategies[J]. Oncotarget,2017, 8(20): 33933-33952. DOI:10.18632/oncotarget.15422.
[17] DESJARDINS A E, PROCTOR R H. Molecular biology of Fusarium mycotoxins[J]. International Journal of Food Microbiology, 2007,119(1/2): 47-50. DOI:10.1016/j.ijfoodmicro.2007.07.024.
[18] ALEXANDER N J, PROCTOR R H, MCCORMICK S P. Genes,gene clusters, and biosynthesis of trichothecenes and fumonisins in Fusarium[J]. Toxin Reviews, 2009, 28(2/3): 198-215.DOI:10.1080/15569540903092142.
[19] WOLOSHUK C P, SHIM W B. Aflatoxins, fumonisins, and trichothecenes: a convergence of knowledge[J]. FEMS Microbiology Reviews, 2013, 37(1): 94-109. DOI:10.3892/or.2017.5424.
[20] BROWN D W, MCCORMICK S P, ALEXANDER N J, et al. A genetic and biochemical approach to study trichothecene diversity in Fusarium sporotrichioides and Fusarium graminearum[J].Fungal Genetics and Biology, 2001, 32(2): 121-133. DOI:10.1006/fgbi.2001.1256.
[21] DYER R B, PLATTNER R D, KENDRA D F, et al. Fusarium graminearum TRI14 is required for high virulence and DON production on wheat but not for DON synthesis in vitro[J]. Journal of Agricultural and Food Chemistry, 2005, 53(23): 9281-9287.DOI:10.1021/jf051441a.
[22] MENKE J, WEBER J, BROZ K, et al. Cellular development associated with induced mycotoxin synthesis in the fi lamentous fungus Fusarium graminearum[J]. PLoS ONE, 2013, 8(5): 1-7. DOI:10.1371/journal.pone.0063077.
[23] HOHN T M, VANMIDDLESWORTH F. Purification and characterization of the sesquiterpene cyclase trichodiene synthetase from Fusarium sporotrichioides[J]. Archives of Biochemistry and Biophysics, 1986, 251(2): 756-761. DOI:10.1016/0003-9861(86)90386-3.
[24] HOHN T M, BEREMAND P D. Isolation and nucleotide sequence of a sesquiterpene cyclase gene from the trichothecene-producing fungus Fusarium sporotrichioides[J]. Gene, 1989, 79(1): 131-138.DOI:10.1016/0378-1119(89)90098-x.
[25] TOKAI T, KOSHINO H, TAKAHASHI A N, et al. Fusarium Tri4 encodes a key multifunctional cytochrome P450 monooxygenase for four consecutive oxygenation steps in trichothecene biosynthesis[J].Biochemical and Biophysical Research Communications, 2007,353(2): 412-417. DOI:10.1016/j.bbrc.2006.12.033.
[26] MCCORMICK S P, ALEXANDER N J, TRAPP S E, et al. Disruption of TRI101, the gene encoding trichothecene 3-O-acetyltransferase,from Fusarium sporotrichioides[J]. Applied and Environmental Microbiology, 1999, 65(12): 5252-5256.
[27] KIMURA M, SHINGU Y, YONEYAMA K, et al. Features of Tri101,the trichothecene 3-O-acetyltransferase gene, related to the self-defense mechanism in Fusarium graminearum[J]. Bioscience Biotechnology and Biochemistry, 1998, 62(5): 1033-1036. DOI:10.1271/bbb.62.1033.
[28] ALEXANDER N J, HOHN T M, MCCORMICK S P. The TRI11 gene of Fusarium sporotrichioides encodes a cytochrome P-450 monooxygenase required for C-15 hydroxylation in trichothecene biosynthesis[J]. Applied and Environmental Microbiology, 1998,64(1): 221-225.
[29] GARVEY G S, MCCORMICK S P, ALEXANDER N J, et al.Structural and functional characterization of TRI3 trichothecene 15-O-acetyltransferase from Fusarium sporotrichioides[J]. Protein Sciences, 2009, 18(4): 747-761. DOI:10.2210/pdb3fp0/pdb.
[30] ALEXANDER N J, MCCORMICK S P, HOHN T M. TRI12,a trichothecene efflux pump from Fusarium sporotrichioides:gene isolation and expression in yeast[J]. Molecular and General Genetics,1999, 261(6): 977-984. DOI:10.1007/s004380051046.
[31] MENKE J, DONG Y H, KISTLER H C. Fusarium graminearum Tri12p influences virulence to wheat and trichothecene accumulation[J]. Molecular Plant-Microbe Interactions, 2012, 25(11):1408-1418. DOI:10.1094/mpmi-04-12-0081-r.
[32] LEE T, HAN Y K, KIM K H, et al. Tri13 and Tri7 determine deoxynivalenol- and nivalenol-producing chemotypes of Gibberella zeae[J]. Applied and Environmental Microbiology, 2002, 68(5):2148-2154. DOI:10.1128/aem.68.5.2148-2154.2002.
[33] MERHEJ J, RICHARD-FORGET F, BARREAU C. Regulation of trichothecene biosynthesis in Fusarium: recent advances and new insights[J]. Applied Microbiology and Biotechnology, 2011, 91(3):519-528. DOI:10.1007/s00253-011-3397-x.
[34] MCCORMICK S P, HARRIS L J, ALEXANDER N J, et al. Tri1 in Fusarium graminearum encodes a P450 oxygenase[J]. Applied and Environmental Microbiology, 2004, 70(4): 2044-2051. DOI:10.1128/aem.70.4.2044-2051.2004.
[35] MCCORMICK S P, ALEXANDER N J. Fusarium Tri8 encodes a trichothecene C-3 esterase[J]. Applied and Environmental Microbiology,2002, 68(6): 2959-2964. DOI:10.1128/aem.68.6.2959-2964.2002.
[36] MEEK I B, PEPLOW A W, AKE C J, et al. Tri1 encodes the cytochrome P450 monooxygenase for C-8 hydroxylation during trichothecene biosynthesis in Fusarium sporotrichioides and resides upstream of another new Tri gene[J]. Applied and Environmental Microbiology, 2003, 69(3): 1607-1613. DOI:10.1128/aem.69.3.1607-1613.2003.
[37] PEPLOW A W, MEEK I B, WILES M C, et al. Tri16 is required for esterification of position C-8 during trichothecene mycotoxin production by Fusarium sporotrichioides[J]. Applied and Environmental Microbiology, 2003, 69(10): 5935-5940. DOI:10.1128/aem.69.10.5935-5940.2003.
[38] NASMITH C G, WALKOWIAK S, WANG L, et al. Tri6 is a global transcription regulator in the phytopathogen Fusarium graminearum[J]. PLoS Pathogens, 2011, 7(9): 1-8. DOI:10.1371/journal.ppat.1002266.
[39] SEONG K, PASQUALI M, ZHOU X Y, et al. Global gene regulation by Fusarium transcription factors Tri6 and Tri10 reveals adaptations for toxins biosynthesis[J]. Molecular Microbiology, 2009, 72(2): 354-367. DOI:10.1111/j.1365-2958.2009.06649.x.
[40] ALEXANDER N J, MCCORMICK S P, LARSON T M, et al.Expression of Tri15 in Fusarium sporotrichioides[J]. Current Genetics,2004, 45(3): 157-162. DOI:10.1007/s00294-003-0467-3.
[41] ALEXANDER N J, MCCORMICK S P, WAALWIJK C, et al. The genetic basis for 3-ADON and 15-ADON trichothecene chemotypes in Fusarium[J]. Fungal Genetics and Biology, 2011, 48(5): 485-495.DOI:10.1016/j.fgb.2011.01.003.
[42] MERHEJ J, RICHARD-FORGET F, BARREAU C. The pH regulatory factor Pac1 regulates Tri gene expression and trichothecene production in Fusarium graminearum[J]. Fungal Genetics and Biology, 2011,48(3): 275-284. DOI:10.1016/j.fgb.2010.11.008.
[43] DELGADO-VIRGEN F, GUZMANDE-DE-PEÑA D. Mechanism of sterigmatocystin biosynthesis regulation by pH in Aspergillus nidulans[J]. Brazilian Journal of Microbiology, 2009, 40(4): 933-942.DOI:10.1590/s1517-83822009000400027.
[44] FLAHERTY J E, PIRTTILA A M, BLUHM B H, et al. PAC1, a pH-regulatory gene from Fusarium verticillioides[J]. Applied and Environmental Microbiology, 2003, 69(9): 5222-5227. DOI:10.1128/aem.69.9.5222-5227.2003.
[45] PRUSS S, FETZNER R, SEITHER K, et al. Role of the Alternaria alternata blue-light receptor LreA (white-collar 1) in spore formation and secondary metabolism[J]. Applied and Environmental Microbiology, 2014, 80(8): 2582-2591. DOI:10.1128/aem.00327-14.
[46] RAUSCHER S, PACHER S, HEDTKE M, et al. A phosphorylation code of the Aspergillus nidulans global regulator VelvetA(VeA)determines specific functions[J]. Molecular Microbiology, 2016,99(5): 909-924. DOI:10.1111/mmi.13275.
[47] KOPKE K, HOFF B, BLOEMENDAL S, et al. Members of the Penicillium chrysogenum velvet complex play functionally opposing roles in the regulation of penicillin biosynthesis and conidiation[J].Eukaryotic Cell, 2013, 12(2): 299-310. DOI:10.1128/ec.00272-12.
[48] PARK H S, LEE M K, KIM S C, et al. The role of VosA/VelB-activated developmental gene vadA in Aspergillus nidulans[J]. PLoS ONE, 2017, 12(5): 1-7. DOI:10.1371/journal.pone.0177099.
[49] LAN N, ZHANG H X, HU C C, et al. Coordinated and distinct functions of velvet proteins in Fusarium verticillioides[J]. Eukaryotic Cell, 2014, 13(7): 909-918. DOI:10.1128/ec.00022-14.
[50] WIEMANNI P, BROWN D W, KLEIGREWE K, et al. Ff Vel1 and Ff Lae1, components of a velvet-like complex in Fusarium fujikuroi,affect differentiation, secondary metabolism and virulence[J].Molecular Microbiology, 2010, 77(4): 972-994. DOI:10.1111/j.1365-2958.2010.07263.x.
[51] KIM H K, LEE S, JO S M, et al. Functional roles of Fg LaeA in controlling secondary metabolism, sexual development, and virulence in Fusarium graminearum[J]. PLoS ONE, 2013, 8(7): 1-6.DOI:10.1371/journal.pone.0068441.
[52] XUE H L, BI Y, TANG Y M, et al. Effect of cultivars, Fusarium strains and storage temperature on trichothecenes production in inoculated potato tubers[J]. Food Chemistry, 2014, 151: 236-242.DOI:10.1016/j.foodchem.2013.11.060.
[53] 赵莹, 薛华丽, 毕阳, 等. 低质量浓度T-2处理对马铃薯块茎苯丙烷代谢活性的诱导[J]. 食品科学, 2015, 36(6): 232-235. DOI:10.7506/spkx1002-6630-201506044.
[54] 师雯, 韩铮, 武爱波, 等. 温度和pH对不同镰刀菌生长及产毒的影响[J]. 食品工业科技, 2015, 36(18): 117-122. DOI:10.13386/j.issn1002-0306.2015.18.015.
[55] 谢雪钦, 刘舟. 基于PCR技术的产真菌毒素镰刀菌分子诊断研究进展[J]. 食品科学, 2017, 38(11): 291-300. DOI:10.7506/spkx1002-6630-201711046.
[56] 赵亚荣, 马丽艳, 王富华. 单端孢霉烯族毒素及其去除方法研究进展[J]. 食品工业科技, 2016, 37(21): 383-387. DOI:10.13386/j.issn1002-0306.2016.21.066.
[57] 黄晓静, 王少敏, 毛丹, 等. 镰刀菌属真菌毒素的毒性研究进展[J].食品安全质量检测学报, 2017, 8(8): 3117-3128. DOI:10.3969/j.issn.2095-0381.2017.08.046.
[58] 张晓莉, 孙伟, 张红印, 等. 脱氧雪腐镰刀菌烯醇的毒性及生物脱毒研究进展[J]. 食品科学, 2016, 37(17): 245-251. DOI:10.7506/spkx1002-6630-201617041.
[59] 薛华丽, 毕阳, 宗元元, 等. 果蔬及其制品中真菌毒素的污染与检测研究进展[J]. 食品科学, 2016, 37(23): 285-290. DOI:10.7506/spkx1002-6630-201623047.
[60] 李国林, 薛华丽, 毕阳, 等. 脱氧雪腐镰刀菌烯醇的毒性及脱毒研究进展[J]. 食品工业科技, 2013, 34(24): 380-384. DOI:10.13386/j.issn1002-0306.2013.24.089.
[61] 王虎军, 薛华丽, 赵军, 等. T-2毒素的产生、毒性及脱毒研究进展[J].食品安全质量检测学报, 2014, 5(8): 2392-2398.
[62] 毕阳, 宗元元. 果蔬加工与质量安全控制[J]. 食品安全质量检测学报, 2017, 8(9): 3281-3282.
[63] 蔡静平, 刘新影, 翟焕趁. 禾谷镰刀菌DON毒素生物合成调控研究进展[J]. 河南工业大学学报(自然科学版), 2016, 37(1): 114-119.
[64] 王龑, 王刘庆, 刘阳. 食品中主要真菌毒素生物合成途径研究进展[J].食品安全质量检测学报, 2016, 7(6): 2158-2167.
[65] KULIK T, BUŚKO M, PSZCZOLKÓWSKA A, et al. Plant lignans inhibit growth and trichothecene biosynthesis in Fusarium graminearum[J]. Letters in Applied Microbiology, 2014, 59(1): 99-107. DOI:10.1111/lam.12250.
[66] TAKAHASHI-ANDO N, OCHIAI N, TOKAI T, et al. A screening system for inhibitors of trichothecene biosynthesis: hydroxylation of trichodiene as a target[J]. Biotechnology Letters, 2008, 30(6): 1055-1059. DOI:10.1007/s10529-008-9649-x.
[67] BOUTIGNY A L, BARREAU C, ATANASOVA-PÉNICHON V, et al. Ferulic acid, an efficient inhibitor of type B trichothecene biosynthesis and Tri gene expression in Fusarium liquid cultures[J].Mycological Research, 2009, 113(6/7): 746-753. DOI:10.1016/j.mycres.2009.02.010.
[68] BOUTIGNY A L, ATANASOVA-PÉNICHON V, BENET M, et al.Natural phenolic acids from wheat bran inhibit Fusarium culmorum trichothecene biosynthesis in vitro by repressing Tri gene expression[J]. European Journal of Plant Pathology, 2010, 127(2):275-286. DOI:10.1007/s10658-010-9592-2.
[69] PANI G, SCHERM B, AZARA E, et al. Natural and natural-like phenolic inhibitors of type B trichothecene in vitro production by the wheat (Triticum sp.) pathogen Fusarium culmorum[J]. Journal of Agricultural and Food Chemistry, 2014, 62(22): 4969-4978.DOI:10.1021/jf500647h.
[70] ATANASOVA-PÉNICHON V, PONS S, PINSON-GADAIS L, et al.Chlorogenic acid and maize ear rot resistance: a dynamic study investigating Fusarium graminearum development, deoxynivalenol production and phenolic acid accumulation[J]. Molecular Plant-Microbe Interactions, 2012, 25(12): 1605-1616. DOI:10.1094/mpmi-06-12-0153-r.
[71] FERRUZ E, LORAN S, HERRERA M, et al. Inhibition of Fusarium growth and mycotoxin production in culture medium and in maize kernels by natural phenolic acids[J]. Journal of Food Protection, 2016,79(10): 1753-1758. DOI:10.4315/0362-028x.jfp-15-563.
[72] FERRUZ E, ATANASOVA-PÉNICHON V, BONNIN-VERDAL M N, et al. Effects of phenolic acids on the growth and production of T-2 and HT-2 toxin by Fusarium langsethiae and F. sporotrichioides[J].Molecules, 2016, 21(4): 449-506. DOI:10.3390/molecules21040449.
[73] MARTÍNEZ G, REGENTE M, JACOBI S, et al. Chlorogenic acid is a fungicide active against phytopathogenic fungi[J]. Pesticide Biochemistry and Physiology, 2017, 140: 30-35. DOI:10.1016/j.pestbp.2017.05.012.
Advances in Biosynthesis and Regulation of Fusarium Trichothecenes
ZHANG Wenwei, WANG Yanling, XUE Huali, et al. Advances in biosynthesis and regulation of Fusarium trichothecenes[J]. Food Science, 2019, 40(5): 267-275. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180305-056. http://www.spkx.net.cn