荧光和发光二极管辐射技术调控果蔬采后抗氧化活性及其机制研究进展
马亚丹,张翠翠,李林杰,詹丽娟*
(河南农业大学食品科学技术学院,河南 郑州 450002)
摘 要:如何维持/增加果蔬采后抗氧化活性是当前果蔬采后贮藏保鲜研究的热点问题,光辐射技术作为当前一种新兴的物理保鲜方法,对果蔬采后抗氧化活性具有显著的调控作用。本文首先简要综述光辐射技术主要的光源类型及可能的保鲜机理,重点阐述光辐射对果蔬采后抗氧化物质(VC、多酚类物质、类胡萝卜素)和抗氧化活性的调控作用,并对其可能的调控机制进行解析;最后就目前光辐射技术在果蔬采后贮藏保鲜研究和应用中存在的问题进行讨论。
关键词:光辐射;抗氧化活性;保鲜;多酚
大量流行病学调查研究表明经常食用一定量的新鲜果蔬可以降低很多疾病尤其是慢性疾病发病率[1],这主要得益于果蔬中含有大量天然抗氧化物质(维生素类、多酚类以及类胡萝卜素类等)[2],这些抗氧化物质发挥抗氧化作用的可能机理有:1)清除活性氧自由基;2)增强抗氧化酶活性;3)阻断脂质过氧化链式反应,减少膜脂质过氧化损伤,不少果蔬可抑制过氧化产物丙二醛及脂褐素的生成;4)减少DNA损伤[3]。因此,世界卫生组织和联合国粮农组织建议每人每天应食用不低于400 g新鲜果蔬[4]。
然而,新鲜的果蔬在采后贮运和销售过程中极易发生衰老劣变,主要表现为感官品质下降和营养物质降解。光辐射技术作为当前一种新兴的物理保鲜方法已经被证实具有延缓果蔬采后衰老劣变和延长货架期作用[5-6],且该技术成本低廉、操作简单、无毒害残留、无副产物、对环境友好[5,7],完全满足现代工业生产和消费者对安全、环保型食品的生产和需求。目前研究应用于果蔬采后保鲜领域的光辐射技术光源类型主要有荧光和发光二极管(lighting emitting diode,LED)。本实验室前期对荧光照射技术在果蔬保鲜方面的应用进行了综述[5],但有关光辐射技术尤其是LED光辐射技术对果蔬采后抗氧化活性调控的综述文献鲜有报道。为此,本文首先简要介绍光辐射技术的光源类型及其可能的保鲜机制,重点综述光辐射技术对果蔬采后抗氧化物质如VC、多酚化合物和类胡萝素类等物质以及抗氧化活性的调控作用,并对其可能的调控机制进行解析,最后对当前光辐射技术在果蔬保鲜中的研究和应用中存在的问题进行讨论,以期为相关领域的研究和应用提供有价值的参考。
1 光辐射类型及保鲜机制
1.1 荧光辐射技术及保鲜机制
荧光辐射(一般波长范围为380~720 nm)技术在果蔬保鲜中的研究最早可追溯到1972年,Peacock首次报道连续荧光辐射处理对香蕉果实采后呼吸跃变期的影响[8]。但由于早期化学保鲜剂在果蔬保鲜中的广泛应用,荧光辐射技术一直未得到快速发展。近年来,随着现代消费者对安全、廉价和环境友好型食品需求的增加,荧光辐射技术作为一项绿色安全的物理保鲜方法在果蔬保鲜中的作用逐渐引起人们的广泛关注并得到迅速发展。现有文献对荧光辐射技术在果蔬保鲜中的研究还处于探索阶段,主要集中于研究荧光辐射强度和周期对果蔬采后营养品质和生理变化的影响[5],有关荧光辐射延缓果蔬采后衰老的调控机理尚无明确定论,归纳起来主要有以下几种观点:1)荧光辐射引起叶片气孔开放,光敏色素参与光延迟叶绿体衰老进程[9];2)荧光辐射延缓组织衰老主要通过光合作用产生糖类物质[10];3)通过光合作用和呼吸作用形成ATP[11];4)光辐射抑制果蔬组织内乙烯的释放并推迟乙烯峰的出现,从而延缓组织衰老[12]。
1.2 LED光辐射技术及保鲜机制
LED是一种直接把电转化为光,能够发出可见光和众多单色光质的半导体发光器件。发光器件是由无毒的材料组成,眩光小、冷光源,可以安全触摸,属于典型的绿色照明光源[13-14]。由于LED光波波长类型丰富(一般波长范围为400~700 nm),光谱范围正好与植物光合成和光形态建成的光谱范围吻合(红光波长620~630 nm和640~660 nm、蓝光波长450~460 nm和460~470 nm为植物生长敏感的波段),并可按照需要组合获得纯正单色光与复合光谱;因此被广泛应用于农作物和园艺作物采前生长发育调控。最近研究发现LED照射处理对园艺作物采后贮藏保鲜有显著的调控作用[6],有关LED照射技术对果蔬采后保鲜的调控机理讨论较少,且无明确的结论。根据现有文献归纳其可能的作用机制是:1)促进采后果蔬继续进行光合作用,合成营养物质,如可溶性糖,维持果蔬物质能量代谢[6,15];2)减缓/抑制呼吸强度及乙烯释放[16];3)上调果蔬某些营养成分如花青素、类胡萝卜素合成相关基因表达,增加/维持其营养物质水平[17];4)抑制采后果蔬表面微生物生长[18]。
2 光辐射技术对果蔬采后抗氧化物质及抗氧化活性的调控
2.1 光辐射技术对果蔬采后VC的调控作用
VC又称抗坏血酸,是人体必需的但无法自我合成的营养元素,其广泛存在于新鲜的果蔬中。光辐射对采后果蔬中VC含量具有显著的调控作用,和黑暗对照相比,无论是荧光还是LED光辐射处理都能显著增加或维持果蔬组织内VC含量(表1)。生菜[19]、羽衣甘蓝[20]、花椰菜[21]、西兰花[22]、萝卜嫩叶[23]、芹菜[24]和菠菜[25]在采后贮藏期间,经光照强度范围为15~30 µmol/(m2·s)荧光24 h/d连续辐射后,其组织内VC含量显著高于黑暗对照(表1)。番茄[26]和黄瓜[27]果实采后经75 μmol/(m2·s) LED白光24 h/d连续照射后,组织内V C含量显著高于黑暗对照组;低强度(5 µmol/(m2·s))LED红光对芫荽和蕹菜连续照射4 d后,处理样品中VC含量分别是对照的2.38 倍和2.31 倍[28];相似的,绿芦笋经2 µmol/(m2·s)的LED红光照射6 d后,处理样品中VC含量增加了55%,而黑暗对照样品中VC含量则下降[29];此外,LED红蓝、红绿和蓝白复合光均能增加/维持西兰花和西芹贮藏过程中VC含量[30-32](表1)。
光辐射增加/维持果蔬贮藏期间VC含量可能原因是:1)光辐射促进VC合成前体物质:研究发现荧光辐射可诱导果蔬尤其是绿色蔬菜如生菜[19]、芹菜[24]、西蓝花[22]、菠菜[25]等在贮藏期间继续进行光合作用,累积可溶性糖,累积的可溶性糖如己糖可为VC合成提供前体物质[25]。然而研究也发现,荧光辐射对菠菜组织中VC代谢相关酶如抗坏血酸过氧化物酶、抗坏血酸氧化酶、脱氢抗坏血酸还原酶和单脱氢抗坏血酸还原酶并无显著影响[25];2)光辐射上调VC合成相关基因的表达:最新研究发现,LED光辐射调控西兰花VC变化发生在转录水平上,50 µmol/(m2·s)的LED白光辐射显著上调西兰花VC合成基因(BO-VTC2、BO-GLDH)和再生基因(BO-MDAR1、BO-MDAR2)的表达[33]。因此,光辐射对果蔬采后VC的调控可能通过增加合成前体物质和上调合成相关基因表达,但其真正的调控机制还有待进一步研究。
表 1 光辐射技术对部分果蔬采后VC含量变化的调控作用
Table 1 Regulatory effect of light irradiation on VC content in selected fruits and vegetables during postharvest storage
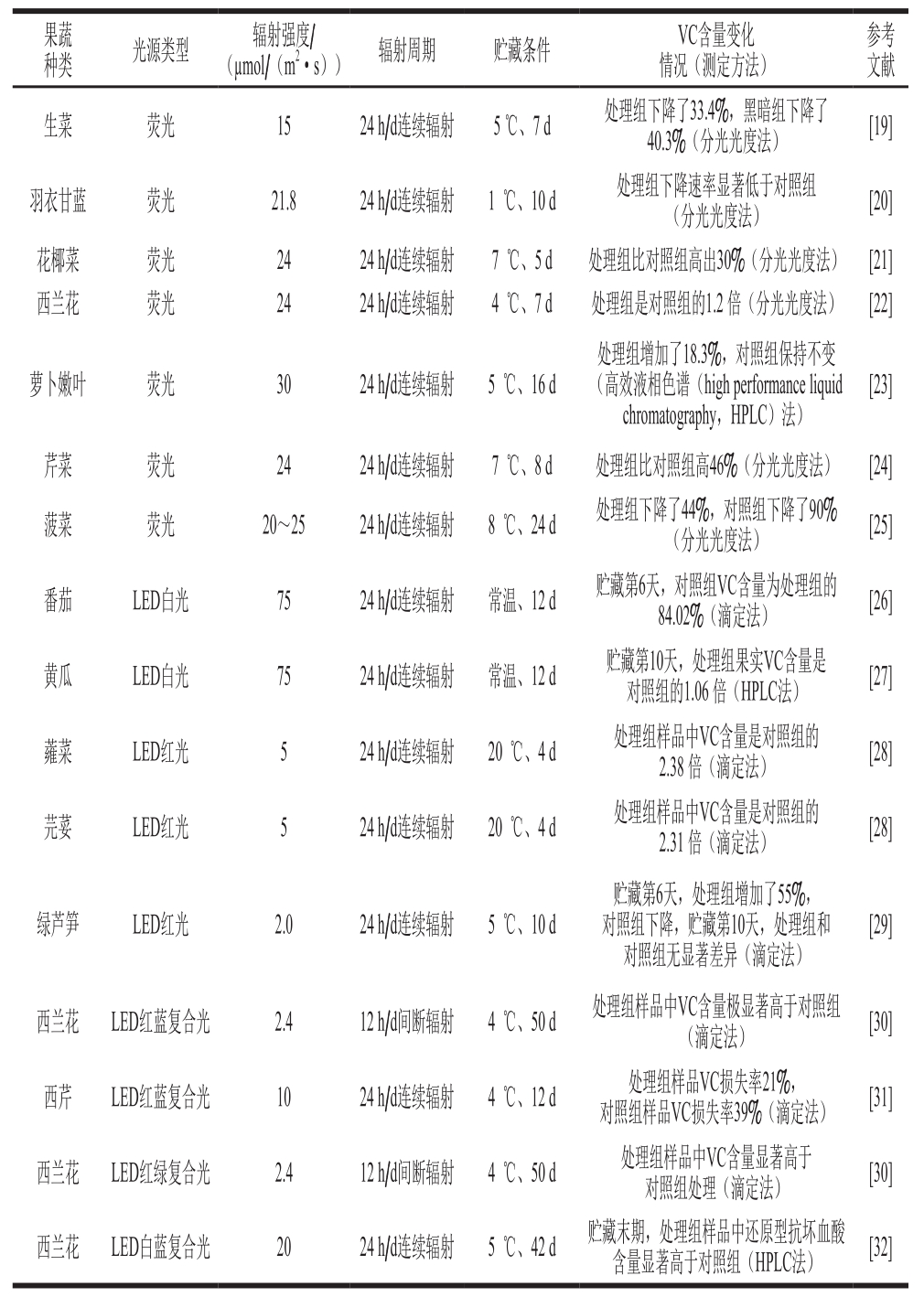
果蔬种类 光源类型 辐射强度/(µmol/(m2·s)) 辐射周期 贮藏条件 VC含量变化情况(测定方法)参考文献生菜 荧光 15 24 h/d连续辐射 5 ℃、7 d 处理组下降了33.4%,黑暗组下降了40.3%(分光光度法) [19]羽衣甘蓝 荧光 21.8 24 h/d连续辐射 1 ℃、10 d 处理组下降速率显著低于对照组(分光光度法) [20]花椰菜 荧光 24 24 h/d连续辐射 7 ℃、5 d 处理组比对照组高出30%(分光光度法) [21]西兰花 荧光 24 24 h/d连续辐射 4 ℃、7 d 处理组是对照组的1.2 倍(分光光度法) [22]萝卜嫩叶 荧光 30 24 h/d连续辐射 5 ℃、16 d处理组增加了18.3%,对照组保持不变(高效液相色谱(high performance liquid chromatography,HPLC)法)[23]芹菜 荧光 24 24 h/d连续辐射 7 ℃、8 d 处理组比对照组高46%(分光光度法) [24]菠菜 荧光 20~25 24 h/d连续辐射 8 ℃、24 d 处理组下降了44%,对照组下降了90%(分光光度法) [25]番茄 LED白光 75 24 h/d连续辐射 常温、12 d 贮藏第6天,对照组VC含量为处理组的84.02%(滴定法) [26]黄瓜 LED白光 75 24 h/d连续辐射 常温、12 d 贮藏第10天,处理组果实VC含量是对照组的1.06 倍(HPLC法) [27]蕹菜 LED红光 5 24 h/d连续辐射 20 ℃、4 d 处理组样品中VC含量是对照组的2.38 倍(滴定法) [28]芫荽 LED红光 5 24 h/d连续辐射 20 ℃、4 d 处理组样品中VC含量是对照组的2.31 倍(滴定法) [28]绿芦笋 LED红光 2.0 24 h/d连续辐射 5 ℃、10 d贮藏第6天,处理组增加了55%,对照组下降,贮藏第10天,处理组和对照组无显著差异(滴定法)[29]西兰花 LED红蓝复合光 2.4 12 h/d间断辐射 4 ℃、50 d 处理组样品中VC含量极显著高于对照组(滴定法) [30]西芹 LED红蓝复合光 10 24 h/d连续辐射 4 ℃、12 d 处理组样品VC损失率21%,对照组样品VC损失率39%(滴定法) [31]西兰花 LED红绿复合光 2.4 12 h/d间断辐射 4 ℃、50 d 处理组样品中VC含量显著高于对照组处理(滴定法) [30]西兰花 LED白蓝复合光 20 24 h/d连续辐射 5 ℃、42 d 贮藏末期,处理组样品中还原型抗坏血酸含量显著高于对照组(HPLC法) [32]
2.2 光辐射技术对果蔬采后多酚物质的调控作用
多酚类物质是果蔬最重要的抗氧化物质之一,也是果蔬抗氧化活性的主要来源。因其结构中的邻位酚羟基很容易被氧化成醌类结构,消耗环境中的氧,同时对活性氧等自由基具有很强的捕捉能力,使多酚具有较强的抗氧化活性以及清除自由基的能力。光辐射技术显著调控果蔬多酚含量变化(表2)。和黑暗对照相比,较高强度(12~24 μmol/(m2·s))的荧光辐射显著提高生菜[34]、西兰花[22,35]、花椰菜[21]和芹菜[36]中总酚含量,而较低强度(3 μmol/(m2·s))的荧光辐射则加速生菜[34]总酚降解;LED蓝光对草莓[37]、萝卜芽苗菜[38]及杨梅[17]采后贮藏期间总酚含量都有显著的增强作用,草莓经LED蓝光辐射4 d和12 d后,处理组样品中花青素含量显著高于对照组,杨梅经40 μmol/(m2·s)LED蓝光辐射后,在贮藏第8天,处理组果实中花青素含量是对照组的1.8 倍(表2)。球芽甘蓝经20 μmol/(m2·s)LED白蓝复合光辐射后,总黄酮含量显著增加[39],萝卜芽苗菜经强度为30 μmol/(m2·s)UV-B辐射11 d后,处理组样品中总酚含量比多照组高约50%[38](表2)。
光辐射对果蔬多酚调控主要机制目前尚无一致结论,但已有研究证实光辐射可诱导多酚合成关键限速酶-苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)活性上升,从而加速多酚合成,同时抑制多酚氧化酶和过氧化物酶(peroxidase,POD)活性,抑制多酚氧化降解[34];同时研究也发现光辐射通过上调多酚合成途径相关基因的表达,从而诱导多酚物质的合成,例如40 μmol/(m2·s)LED蓝光通过上调杨梅花青素合成相关基因MrCHI、MrF3H、MrF3’H、MrDFR1、MrDFR2和MrANS的表达提高花青素含量[17],类似的报道在荞麦幼苗研究中得到证实,50 µmol/(m2·s)的LED光照显著上调荞麦幼苗多酚合成基因FtPAL、FtF3’H、FtC4H、FtCHI、FtFLS-2和FtANS转录,导致其芦丁含量在处理4 d后显著增加,矢车菊云苷和儿茶酚含量在处理后10 d内显著增加[40]。由此可见,光辐射可通过调控多酚合成与降解相关酶活性及合成相关基因表达来调控多酚物质的变化。
表 2 光辐射技术对部分果蔬采后多酚含量变化的调控作用
Table 2 Regulatory effect of light irradiation on polyphenols content in selected fruits and vegetables during postharvest storage
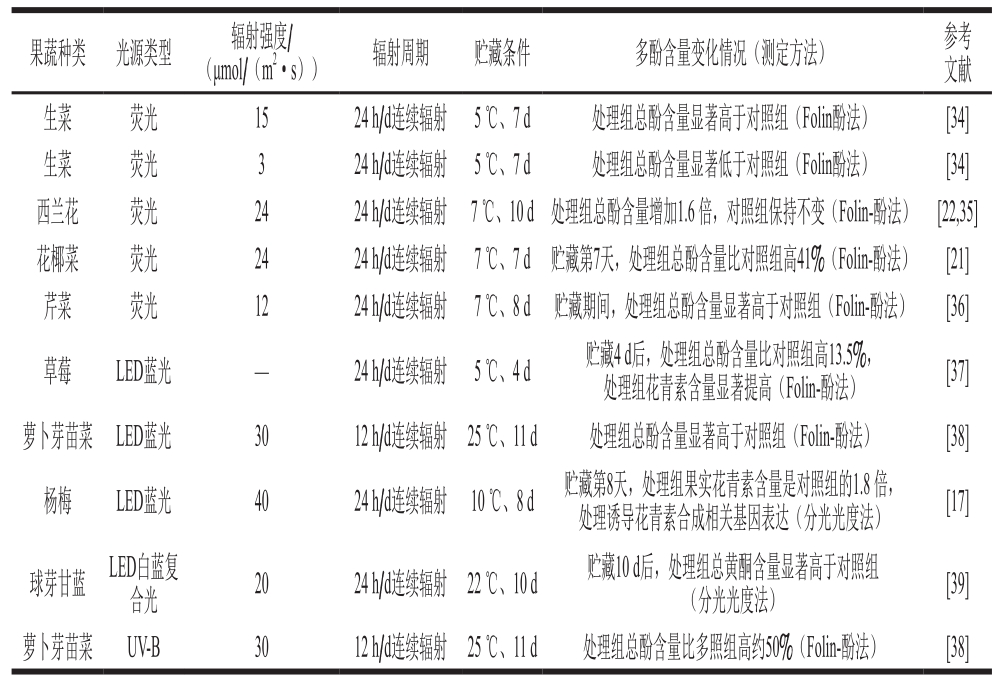
注:—.文献中未注明光照强度。
果蔬种类 光源类型 辐射强度/(μmol/(m2·s)) 辐射周期 贮藏条件 多酚含量变化情况(测定方法) 参考文献生菜 荧光 15 24 h/d连续辐射 5 ℃、7 d 处理组总酚含量显著高于对照组(Folin酚法) [34]生菜 荧光 3 24 h/d连续辐射 5 ℃、7 d 处理组总酚含量显著低于对照组(Folin酚法) [34]西兰花 荧光 24 24 h/d连续辐射 7 ℃、10 d 处理组总酚含量增加1.6 倍,对照组保持不变(Folin-酚法) [22,35]花椰菜 荧光 24 24 h/d连续辐射 7 ℃、7 d 贮藏第7天,处理组总酚含量比对照组高41%(Folin-酚法) [21]芹菜 荧光 12 24 h/d连续辐射 7 ℃、8 d 贮藏期间,处理组总酚含量显著高于对照组(Folin-酚法) [36]草莓 LED蓝光 — 24 h/d连续辐射 5 ℃、4 d 贮藏4 d后,处理组总酚含量比对照组高13.5%,处理组花青素含量显著提高(Folin-酚法) [37]萝卜芽苗菜 LED蓝光 30 12 h/d连续辐射 25 ℃、11 d 处理组总酚含量显著高于对照组(Folin-酚法) [38]杨梅 LED蓝光 40 24 h/d连续辐射 10 ℃、8 d 贮藏第8天,处理组果实花青素含量是对照组的1.8 倍,处理诱导花青素合成相关基因表达(分光光度法) [17]球芽甘蓝 LED白蓝复合光 20 24 h/d连续辐射 22 ℃、10 d 贮藏10 d后,处理组总黄酮含量显著高于对照组(分光光度法) [39]萝卜芽苗菜 UV-B 30 12 h/d连续辐射 25 ℃、11 d 处理组总酚含量比多照组高约50%(Folin-酚法) [38]
2.3 光辐射技术对果蔬采后类胡萝卜素的调控作用
类胡萝卜素类主要包括胡萝卜素(如β-胡萝卜素和番茄红素)和叶黄素(如叶黄素和虾青素),各种类胡萝卜素组成比例的变化赋予了不同果蔬特有的色泽,而果蔬色泽是果蔬采后主要的感官品质之一,也是消费者判断果蔬成熟度、新鲜度、商品可接受度及营养价值的重要参数[41]。现有文献主要集中研究LED光辐射对类胡萝卜素的调控作用(表3),低强度(1.4 μmol/(m2·s))LED白光循环间隔辐射野苣6 d后,处理组样品中类胡萝卜素含量显著高于对照组[42]。高强度(150 μmol/(m2·s))的LED红光辐射显著提高柑橘中β-隐黄质和叶黄素含量,并上调其相关合成基因[43]。LED红光辐射可显著提高番茄中番茄红素的含量,而对β-胡萝卜素含量无显著影响[44]。此外LED复合白蓝光连续辐射西蓝花[45]和芽球甘蓝[39]后,可显著提高其类胡萝卜素含量。光辐射可能通过上调类胡萝卜素合成途径相关基因的表达来调控果蔬采后类胡萝卜素含量,例如已有研究发现LED红光辐射可显著上调柑橘采后β-隐黄质和叶黄素合成相关基因CitPSY、CitPDS、CitZDS、CitLCYb1、CitLCYb2、CitHYb和CitZEP的表达[43],但鉴于关于光辐射对果蔬采后类胡萝素调控研究文献较少,鲜有研究对其调控机制进行报道,因此关于光辐射对类胡萝卜素含量的调控机理目前尚不清楚。
表 3 光辐射技术对部分果蔬采后类胡萝卜素变化的调控作用
Table 3 Regulatory effect of light irradiation on carotenoids content in selected fruits and vegetables during postharvest storage
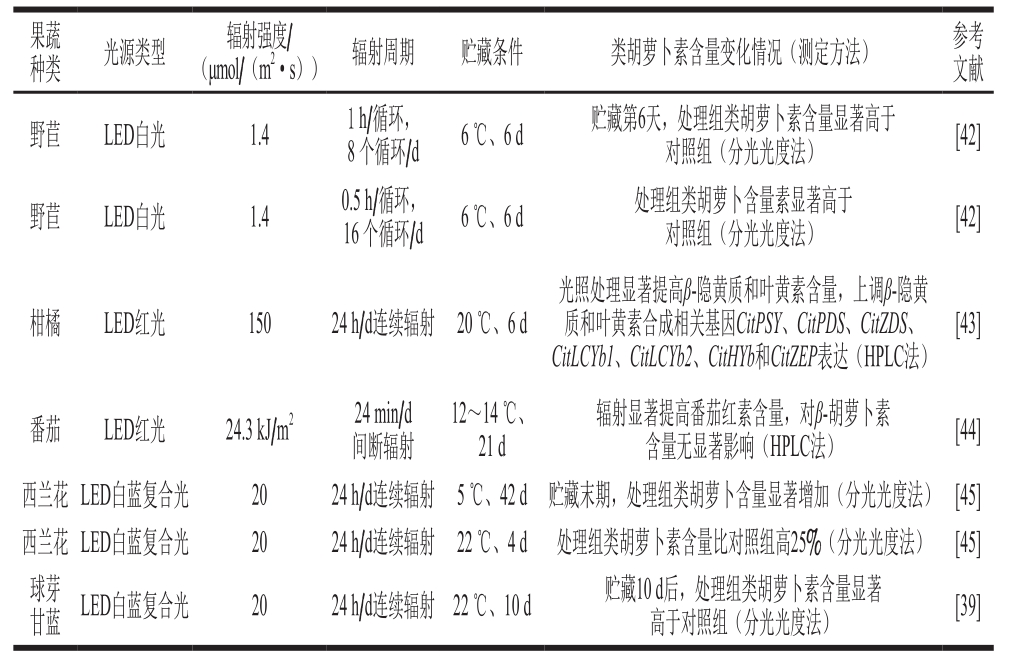
果蔬种类 光源类型 辐射强度/(μmol/(m2·s)) 辐射周期 贮藏条件 类胡萝卜素含量变化情况(测定方法) 参考文献野苣 LED白光 1.4 1 h/循环,8 个循环/d 6 ℃、6 d 贮藏第6天,处理组类胡萝卜素含量显著高于对照组(分光光度法) [42]野苣 LED白光 1.4 0.5 h/循环,16 个循环/d 6 ℃、6 d 处理组类胡萝卜含量素显著高于对照组(分光光度法) [42]柑橘 LED红光 150 24 h/d连续辐射 20 ℃、6 d光照处理显著提高β-隐黄质和叶黄素含量,上调β-隐黄质和叶黄素合成相关基因CitPSY、CitPDS、CitZDS、CitLCYb1、CitLCYb2、CitHYb和CitZEP表达(HPLC法)[43]番茄 LED红光 24.3 kJ/m2 24 min/d间断辐射12~14 ℃、21 d辐射显著提高番茄红素含量,对β-胡萝卜素含量无显著影响(HPLC法) [44]西兰花 LED白蓝复合光 20 24 h/d连续辐射 5 ℃、42 d 贮藏末期,处理组类胡萝卜含量显著增加(分光光度法) [45]西兰花 LED白蓝复合光 20 24 h/d连续辐射 22 ℃、4 d 处理组类胡萝卜素含量比对照组高25%(分光光度法) [45]球芽甘蓝 LED白蓝复合光 20 24 h/d连续辐射 22 ℃、10 d 贮藏10 d后,处理组类胡萝卜素含量显著高于对照组(分光光度法) [39]
2.4 光辐射技术对果蔬采后抗氧化活性的调控作用
荧光和LED辐射技术对果蔬采后抗氧化活性都有显著的调控作用(表4)。荧光光照强度对果蔬采后抗氧化活性有显著影响,较高强度(12~24 μmol/(m2·s))荧光连续辐射可显著增加生菜[34]、芹菜[36]和西蓝花[22,35]采后贮藏期间抗氧化活性(铁离子还原能力法(ferric ion reducing antioxidant power,FRAP)),而较低强度(3 μmol/(m2·s))荧光辐射则显著降低生菜[34]采后贮藏期间抗氧化活性(FRAP法)。不同于光照强度,光质对果蔬采后抗氧化活性调控作用相似,一般来说,不同光质辐射均能增加果蔬抗氧化活性。如LED蓝光和LED白-蓝复合光显著增加萝卜芽苗菜[38]、西蓝花[45]和球芽甘蓝[39]抗氧化活性;此外,不同蔬菜品种对相同的光辐射条件应答反应也不相同,例如,青椒、西蓝花和芦笋在相同的光辐射条件(强度20~112 μmol/(m2·s)LED绿光24 h/d连续辐射)处理6 d后,青椒中处理组抗氧化活性显著高于对照组,西蓝花中处理组抗氧化活性显著低于对照组,而芦笋中处理组抗氧活性和对照组无显著差异[46]。果蔬抗氧化活性主要来源于其抗氧化物质如维生素类、多酚类和类胡萝卜素,研究表明,大部分果蔬抗氧化活性与其VC、总酚、类胡萝卜素及类黄酮含量呈极显著正相关[47];因此光辐射增加果蔬抗氧化活性可能主要与其增加果蔬抗氧化物质含量有关。
表 4 光辐射技术对部分果蔬采后抗氧化活性变化的调控作用
Table 4 Regulatory effect of light irradiation on antioxidant activity of selected fruits and vegetables during postharvest storage
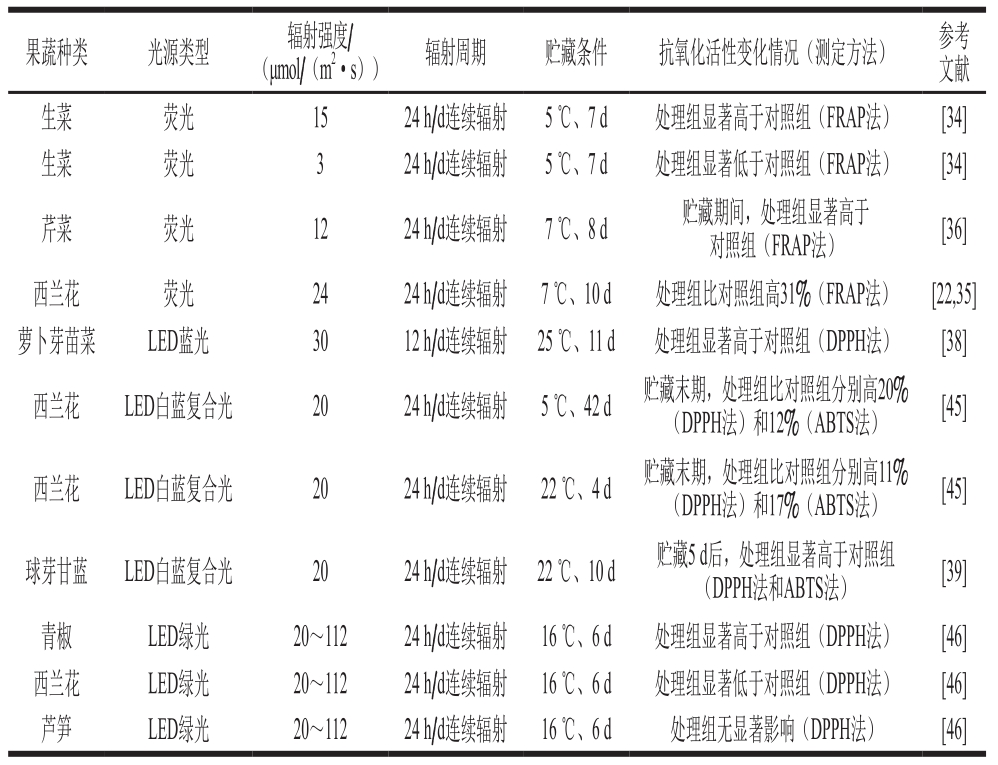
注:ABTS. 2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid));DPPH. 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl)。
果蔬种类 光源类型 辐射强度/(μmol/(m2·s)) 辐射周期 贮藏条件 抗氧化活性变化情况(测定方法) 参考文献生菜 荧光 15 24 h/d连续辐射 5 ℃、7 d 处理组显著高于对照组(FRAP法) [34]生菜 荧光 3 24 h/d连续辐射 5 ℃、7 d 处理组显著低于对照组(FRAP法) [34]芹菜 荧光 12 24 h/d连续辐射 7 ℃、8 d 贮藏期间,处理组显著高于对照组(FRAP法) [36]西兰花 荧光 24 24 h/d连续辐射 7 ℃、10 d 处理组比对照组高31%(FRAP法) [22,35]萝卜芽苗菜 LED蓝光 30 12 h/d连续辐射 25 ℃、11 d 处理组显著高于对照组(DPPH法) [38]西兰花 LED白蓝复合光 20 24 h/d连续辐射 5 ℃、42 d 贮藏末期,处理组比对照组分别高20%(DPPH法)和12%(ABTS法) [45]西兰花 LED白蓝复合光 20 24 h/d连续辐射 22 ℃、4 d 贮藏末期,处理组比对照组分别高11%(DPPH法)和17%(ABTS法) [45]球芽甘蓝 LED白蓝复合光 20 24 h/d连续辐射 22 ℃、10 d 贮藏5 d后,处理组显著高于对照组(DPPH法和ABTS法) [39]青椒 LED绿光 20~112 24 h/d连续辐射 16 ℃、6 d 处理组显著高于对照组(DPPH法) [46]西兰花 LED绿光 20~112 24 h/d连续辐射 16 ℃、6 d 处理组显著低于对照组(DPPH法) [46]芦笋 LED绿光 20~112 24 h/d连续辐射 16 ℃、6 d 处理组无显著影响(DPPH法) [46]
3 结 语
综上所述,光辐射技术作为一项绿色、节能和环保的保鲜新技术,可显著提高果蔬贮藏期间抗氧化物质如VC、酚类和类胡萝卜素类物质含量和抗氧化活性。光辐射对果蔬抗氧化物质调控的可能机制主要是通过调控抗氧化物质合成前体物质、合成或降解相关酶活性、合成代谢相关基因表达等。尽管如此,光辐射作为一项新兴的保鲜技术,其对果蔬保鲜的调控机制仍不明确。现有文献更多地是研究光辐射对果蔬采后生理生化和品质变化的影响,但对光辐射导致这些变化的机制讨论较少,而且研究文献所采用光源类型、光照强度、光质、贮藏条件等差异较大,从而导致光辐射对相同参数的调控作用结果较大差异,甚至相互矛盾,从而难以形成一致性结论;其次,研究中设定的光辐射强度和周期同实际生产有差异,研究多采用较高强度连续光辐射处理,而在实际生产中,果蔬采后贮藏和销售过程中的光照强度往往相对较低,光辐射时间也有间断,这都可能影响研究成果在实际生产应用中的转化和推广;最后,光辐射研究和应用缺乏专业标准的光辐射设施装备,目前研究中光辐射装置都是研究者根据需要自制或定制,设备参数无统一规范标准,且规模仅限实验研究,在贮运销售终端如贮藏库、超市货架、零售店和消费者冰箱终端设备中尚未见植入光辐射装置,这也限制了光辐射技术在实际蔬菜保鲜中的推广应用。
参考文献:
[1] PANDEY K H, MAHALINGAN K, SHARMA S, et al. Antioxidant properties of various fruits, herbs, spices and vegetables: a review[J].World Journal of Pharmacy and Pharmaceutical Sciences, 2014, 3(2):1101-1109.
[2] SZETO Y T, TOMLINSON B, BENZIE I F F. Total antioxidant and ascorbic acid content of fresh fruits and vegetables: implications for dietary planning and food preservation[J]. British Journal of Nutrition,2002, 87(1): 55-59. DOI:10.1079/BJN2001483.
[3] 张名位, 郭宝江. 果蔬抗氧化作用研究进展[J]. 华南师范大学学报(自然科学版), 2001(4): 115-121. DOI:10.6054/j.jscnun.2001.11.027.
[4] World Health Organization, Food and Agricultural Organization of the United Nations. Vitamin and mineral requirements in human nutrition[M]. 2nd ed. Geneva: WHO, 2004: 130-144.
[5] 詹丽娟, 李颖. 光照技术在果蔬采后贮藏保鲜中的应用[J]. 食品与发酵工业, 2016, 42(8): 268-272; 278. DOI:10.13995/j.cnki.11-1802/ts.201608045.
[6] 范林林, 左进华, 高丽朴, 等. LED应用于蔬菜保鲜领域的研究进展[J]. 安徽农业科学, 2017, 45(8): 89-92; 97. DOI:10.3969/j.issn.0517-6611.2017.08.031.
[7] MANZOCCO L, QUARTA B, DRI A. Polyphenoloxidase inactivation by light exposure in model systems and apple derivatives[J].Innovative Food Science and Emerging Technologies, 2009, 10(4):506-511. DOI:10.1016/j.ifset.2009.02.004.
[8] PEACOCK B C. Effect of light on initiation of fruit ripening[J].Nature New Biology, 1972, 235: 62-63.
[9] BISWAL U C, BERGFELD R, KASEMIR H. Phytochrome-mediated delay of plastid senescence in mustard cotyledons: changes in pigment contents and ultrastructure[J]. Planta, 1983, 157(1): 85-90.DOI:10.1007/BF00394545.
[10] GOLDTHWAITE J J, LAETSCH W M. Regulation of senescence in bean leaf discs by light and chemical growth regulators[J]. Plant Physiology, 1967, 42(12): 1757-1762. DOI:10.1104/pp.42.12.1757.
[11] THIMANN K V, TETLEY R M, KRIVAK B M. Metabolism of oat leaves during senescence: V. senescence in light[J]. Plant Physiology,1977, 59(3): 448-454. DOI:10.2307/4264757.
[12] 肖光辉, 郑素秋. 光与菠菜叶片衰老及其延衰机理的探讨[C]//中国园艺学会成立70周年纪念优秀论文选编. 北京: 中国科学技术出版社, 1999: 481-486.
[13] D’SOUZA C, YUK H G, KHOO G H, et al. Application of light emitting diodes in food production, postharvest preservation, and microbiological food safety[J]. Comprehensive Reviews in Food Science and Food Safety, 2015, 14(6): 719-740. DOI:10.1111/1541-4337.12155.
[14] 阎瑞香, 思希军, 刘然然. 低温条件下不同LED光源对芦笋颜色变化的影响[C]//第六届中国冷冻冷藏新技术、新设备研讨会论文集.北京: 中国制冷空调工业协会, 2013: 194-198.
[15] 周伟. 低温下单色LED和短波UV照射对上海青贮藏品质调控的研究[D]. 广州: 华南理工大学, 2016: 11-13.
[16] 伍新龄, 张娜, 张晓洁, 等. LED红蓝复合光间歇照射对西兰花贮藏品质的影响[J]. 保鲜与加工, 2015, 15(5): 6-10. DOI:10.3969/j.issn.1009-6221.2015.05.002.
[17] SHI L Y, CAO S F, CHEN W, et al. Blue light induced anthocyanin accumulation and expression of associated genes in Chinese bayberry fruit[J]. Scientia Horticulturae, 2014, 179: 98-102. DOI:10.1016/j.scienta.2014.09.022.
[18] KUMAR A, GHATE V, KIM M J, et al. Kinetics of bacterial inactivation by 405 nm and 520 nm light emitting diodes and the role of endogenous coproporphyrin on bacterial susceptibility[J]. Journal of Photochemistry and Photobiology B: Biology, 2015, 149: 37-44.DOI:10.1016/j.jphotobiol.2015.05.005.
[19] ZHAN L J, HU J Q, AI Z L, et al. Light exposure during storage preserving soluble sugar and L-ascorbic acid content of minimally processed romaine lettuce (Lactuca sativa L. var. longifolia)[J]. Food Chemistry, 2013, 136(1): 273-278. DOI:10.1016/j.foodchem.2012.07.123.
[20] NOICHINDA S, BODHIPADMA K, MAHAMONTRI C, et al.Light during storage prevents loss of ascorbic acid, and increases glucose and fructose levels in Chinese kale (Brassica oleracea var.alboglabra)[J]. Postharvest Biology & Technology, 2007, 44(3): 312-315. DOI:10.1016/j.postharvbio.2006.12.006.
[21] ZHAN L J, HU J Q, PANG L Y, et al. Light exposure reduced browning enzymes activity while accumulated total phenols in cauliflower heads during cool storage[J]. Postharvest Biology and Technology, 2014, 88(2): 17-20. DOI:10.1016/j.postharvbio.2013.09.006.
[22] 詹丽娟, 魏国强, 乔明武, 等. 光照处理提高鲜切西兰花贮藏品质[J].食品科学, 2012, 33(14): 296-300.
[23] XIAO Z L, LESTER G E, LUO Y G, et al. Effect of light exposure on sensorial quality, concentrations of bioactive compounds and antioxidant capacity of radish microgreens during low temperature storage[J]. Food Chemistry, 2014, 151: 472-479. DOI:10.1016/j.foodchem.2013.11.086.
[24] ZHAN L J, HU J Q, PANG L Y, et al. Effects of light exposure on chlorophyll, sugars and vitamin C content of fresh-cut celery (Apium graveolens var. dulce) petioles[J]. International Journal of Food Science and Technology, 2014, 49(2): 347-353. DOI:10.1111/ijfs.12292.
[25] TOLEDO M E A, UEDA Y, IMAHORI Y et al. L-Ascorbic acid metabolism in spinach (Spinacia oleracea L.) during postharvest storage in light and dark[J]. Postharvest Biology and Technology,2003, 28(1): 47-57. DOI:10.1016/S0925-5214(02)00121-7.
[26] 范林林, 左进华, 夏春丽, 等. LED白光处理对番茄贮藏品质的影响[J].北方园艺, 2016(17): 134-137. DOI:10.11937/bfyy.201617031.
[27] 范林林, 左进华, 史君彦, 等. LED白光照射对黄瓜贮藏过程中品质的影响[J]. 北方园艺, 2016(19): 156-159. DOI:10.11937/bfyy.201619039.
[28] 顾振新, 陆兆新, 韩永斌, 等. 光线照射下芫荽和蕹菜常温贮藏效果比较[J]. 食品科学, 2003, 24(11): 145-148. DOI:10.3321/j.issn:1002-6630.2003.11.038.
[29] 顾振新, 饭本光雄, 田川彰南, 等. 弱光照射和无机营养供给对冷藏绿芦笋品质变化的影响[J]. 南京农业大学学报, 2001, 24(4): 84-88.DOI:10.3321/j.issn:1000-2030.2001.04.020.
[30] 李宁, 阎瑞香, 张娜. LED复合光处理对西兰花低温保鲜效果的影响[J].华北农学报, 2015, 30(1): 188-193. DOI:10.7668/hbnxb.2015.01.032.
[31] 王超, 刘斌, 张娜, 等. LED红蓝光照射对采后西芹保鲜效果的影响[J]. 保鲜与加工, 2016, 16(1): 31-34. DOI:10.3969/j.issn.1009-6221.2016.01.007.
[32] HASPERUÉ J H, GUARDIANELLI L, RODONI L M, et al.Continuous white-blue LED light exposition delays postharvest senescence of broccoli[J]. LWT-Food Science and Technology, 2016,65: 495-502. DOI:10.1016/j.lwt.2015.08.041.
[33] MA G, ZHANG L C, SETIAWAN C K, et al. Effect of red and blue LED light irradiation on ascorbate content and expression of genes related to ascorbate metabolism in postharvest broccoli[J].Postharvest Biology and Technology, 2014, 94: 97-103. DOI:10.1016/j.postharvbio.2014.03.010.
[34] ZHAN L J, LI Y, HU J Q, et al. Browning inhibition and quality preservation of fresh-cut romaine lettuce exposed to high intensity light[J]. Innovative Food Science and Emerging Technologies, 2012,14(2): 70-76. DOI:10.1016/j.ifset.2012.02.004.
[35] ZHAN L J, HU J Q, LI Y. Combination of light exposure and low temperature in preserving quality and extending shelf-life of fresh-cut broccoli (Brassica oleracea L.)[J]. Postharvest Biology & Technology,2012, 72(5): 76-81. DOI:10.1016/j.postharvbio.2012.05.001.
[36] ZHAN L J, HU J Q, LIM L T, et al. Light exposure inhibiting tissue browning and improving antioxidant capacity of fresh-cut celery(Apium graveolens var. dulce)[J]. Food Chemistry, 2013, 141(3):2473-2478. DOI:10.1016/j.foodchem.2013.05.035.
[37] KIM B S, LEE H O, KIM J Y, et al. An effect of light emitting diode (LED) irradiation treatment on the amplification of functional components of immature strawberry[J]. Horticulture Environment &Biotechnology, 2011, 52(1): 35-39. DIO:10.1007/s13580-011-0189-2.
[38] 鲁燕舞, 张晓燕, 耿殿祥, 等. 光质对萝卜芽苗菜总酚类物质含量及抗氧化能力的影响[J]. 园艺学报, 2014, 41(3): 545-552.DOI:10.16420/j.issn.0513-353x.2014.03.016.
[39] HASPERUÉ J H, RODONI L M, GUARDIANELLI L M, et al.Use of LED light for Brussels sprouts postharvest conservation[J].Scientia Horticulturae, 2016, 213: 281-286. DOI:10.1016/j.scienta.2016.11.004.
[40] THWE A A, KIM Y B, LI X H, et al. Effects of light-emitting diodes on expression of phenylpropanoid biosynthetic genes and accumulation of phenylpropanoids in Fagopyrum tataricum sprouts[J].Journal of Agricultural and Food Chemistry, 2014, 62(21): 4839-4845.DOI:10.1021/jf501335q.
[41] 袁梓洢, 尹保凤, 邓丽莉, 等. 果蔬采后色素物质代谢调控研究进展[J].食品科学, 2016, 37(17): 236-244. DOI:10.7506/spkx1002-6630-201617040.
[42] BRAIDOT E, PETRUSSA E, PERESSON C, et al. Low-intensity light cycles improve the quality of lamb’s lettuce (Valerianella olitoria, [L]Pollich) during storage at low temperature[J]. Postharvest Biology and Technology, 2014, 90: 15-23. DOI:10.1016/j.postharvbio.2013.12.003.
[43] MA G, ZHANG L C, KATO M, et al. Effect of blue and red LED light irradiation on β-cryptoxanthin accumulation in the flavedo of citrus fruits[J]. Journal of Agricultural & Food Chemistry, 2012, 60(1): 197-201. DOI:10.1021/jf203364m.
[44] LIU L H, ZABARAS D, BENNETT L E, et al. Effects of UV-C, red light and sun light on the carotenoid content and physical qualities of tomatoes during post-harvest storage[J]. Food Chemistry, 2009,115(2): 495-500. DOI:10.1016/j.foodchem.2008.12.042.
[45] HASPERUÉ J H, GUARDIANELLI L, RODONI L M, et al.Continuous white-blue led light exposition delays postharvest senescence of broccoli[J]. LWT-Food Science and Technology, 2015,65: 495-502. DOI:10.1016/j.lwt.2015.08.041.
[46] 刘然然, 寇莉萍, 阎瑞香. 发光二极管绿光照射对精品蔬菜货架期品质的影响[J]. 北方园艺, 2013(8): 5-9.
[47] DENG G F, LIN X, XU X R, et al. Antioxidant capacities and total phenolic contents of 56 vegetables[J]. Journal of Functional Foods,2013, 5(1): 260-266. DOI:10.1016/j.jff.2012.10.015.
Progress in Understanding the Regulatory Effect and Mechanism of Fluorescent Light and Light-Emitting Diode Irradiation on Antioxidant Properties of Fruits and Vegetables during Postharvest Storage
MA Yadan, ZHANG Cuicui, LI Linjie, ZHAN Lijuan*
(College of Food Science and Technology, Henan Agricultural University, Zhengzhou 450002, China)
Abstract: How to maintain and/or increase antioxidant properties of postharvest fruits and vegetables is a hot topic among researchers. Light irradiation, a new physical preservation method, has significant effects on antioxidant properties of postharvest fruits and vegetables. In this paper, the major light source types and the possible underlying mechanism are reviewed, mainly focusing on the regulatory effect and mechanism of light irradiation on antioxidants (vitamin C,polyphenolic compounds, and carotenoids) and antioxidant capacity in postharvest fruits and vegetables. Finally, we conclude with a discussion of problems existing in the research and application of light irradiation technology in postharvest preservation of fruits and vegetables.
Keywords: light irradiation; antioxidant properties; preservation; polyphenol
收稿日期:2018-01-31
基金项目:国家自然科学基金青年科学基金项目(31201438);国家自然科学基金面上项目(31571903);河南省高校科技创新人才支持计划项目(14HASTIT025);河南省高等学校青年骨干教师培养计划项目(2017GGJS034);食品生产与安全河南省协同创新中心基金项目(FCIC201613)
第一作者简介:马亚丹(1993—)(ORCID: 0000-0001-8047-9522),女,硕士研究生,研究方向为果蔬采后贮藏保鲜与加工。E-mail: myd000329@hotmail.com
*通信作者简介:詹丽娟(1978—)(ORCID: 0000-0001-6463-6372),女,副教授,博士,研究方向为果蔬采后贮藏保鲜与加工。E-mail: ljzhan@hotmail.com
DOI:10.7506/spkx1002-6630-20180131-432
中图分类号:TS255.36
文献标志码:A
文章编号:1002-6630(2019)05-0276-06
引文格式:马亚丹, 张翠翠, 李林杰, 等. 荧光和发光二极管辐射技术调控果蔬采后抗氧化活性及其机制研究进展[J]. 食品科学,2019, 40(5): 276-281. DOI:10.7506/spkx1002-6630-20180131-432. http://www.spkx.net.cn
MA Yadan, ZHANG Cuicui, LI Linjie, et al. Progress in understanding the regulatory effect and mechanism of fl uorescent light and light-emitting diode irradiation on antioxidant properties of fruits and vegetables during postharvest storage[J].Food Science, 2019, 40(5): 276-281. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180131-432.http://www.spkx.net.cn



