
图 1 IgY(A)和IgG(B)分子结构[10]
Fig. 1 Molecular structures of IgY (A) and IgG (B)[10]
在食物和饲料中针对性地添加营养成分物质是降低毒素诱发危害的有效措施之一。卵黄免疫球蛋白(egg yolk immunogolbulin,IgY)又称卵黄抗体,是从特定抗原免疫禽类蛋黄中提取的抗体,与哺乳动物血清免疫球蛋白G(immunoglobulin G,IgG)具有相同特性,能与抗原特异性识别结合,但又不同于IgG,IgY不与细菌或哺乳动物的受体Fc结合,且不激活补体系统[1]。IgY来源方便、无需采血且无损伤,符合动物福利原则,具备成本低、易贮藏、易于规模化生产等优势[2-3];所以欧洲替代方法验证中心建议以IgY代替哺乳动物IgG作为生产抗体的来源。如今,IgY以其具有的生物学特点和应用方面的优势,已经应用于婴幼儿食品和牲畜饲料中,用于抵抗病毒和细菌性疾病的侵害[4]。另对IgY的研究发现,其还可以有效识别大分子蛋白毒素如蛇毒、细菌外毒素等,起到中和毒素、降低毒性的作用[5-6]。本文就IgY体内代谢和中和毒素的研究近况做简要阐述,以期为脱除食品和饲料中毒素提供新的思路。
禽类通过法氏囊控制体液免疫系统,当受到外界特异性抗原(尤其是灭活抗原)的刺激后,经体液免疫,在法氏囊内激活B细胞,激活的B细胞分化为浆细胞并分泌特异性抗体进入血液循环。当血液流经卵巢时,血液中的特异性抗体(IgG)主要在卵黄中蓄集起来,形成IgY[7-8]。如图1A所示,IgY由两条重链(H)和两条轻链(L)组成,分子质量约为180 kDa,重链分子质量为62~67 kDa,轻链为22~25 kDa,抗原结合片段(fragment antigen binding,Fab)部分分子质量约为45 kDa。如图1B所示,完整型IgY的重链由一个可变区(VH)和4 个恒定区(CH1、CH2、CH3、CH4)组成,由于其铰链区与IgG氨基酸序列不同,铰链区相对较短且柔性差;轻链由一个可变区(VL)和一个恒定区(CL)组成;抗体中的Fc片断是主要的疏水基团[9]。IgY和IgG的分子结构见图1[10]。对IgG和IgY分子恒定区氨基酸比对显示,IgG分子中Cγ2和Cγ3区分别与IgY分子中CH3和CH4具有很高的同源性[11]。Helm等[12]发现IgY的CH1—CH2和CH3—CH4之间有一段脯氨酸和甘氨酸残基区域,此区域能使IgY分子具有一定的可折叠性,并认为这个区域与IgY的功能形成有关。

图 1 IgY(A)和IgG(B)分子结构[10]
Fig. 1 Molecular structures of IgY (A) and IgG (B)[10]
综合经济性和可操作性考虑,多采用肌肉注射或胸部皮下多次注射两种急性方式免疫蛋鸡,初次免疫后200 d或整个产蛋期均能获得有效价的IgY[1]。目前广泛适用的IgY提取纯化方法往往受限于纯化步骤,而卵黄中的脂质和脂蛋白对纯化影响最大。IgY的初始提取步骤应尽量除去脂质和脂蛋白[13],现有商业化和实验中常用去脂方法包括有机溶剂提取法、盐析法、有机溶剂及有机物沉淀法、层析法、冻融法、膜过滤法和酸性条件下水稀释法[14]。提取后再经盐析法、凝胶过滤层析法、膜过滤法和离子交换层析法等进一步纯化[15]。不同的提取和纯化方法得到的IgY产量、纯度和活性亦不相同,有机溶剂提取法产率较高,但因上清液中有残留,对抗体活性有影响,同时有机溶剂造成的环境污染严重,此方法仅适合实验室少量制备;盐析法和沉淀法简单、经济,但提取的IgY纯度低;层析法能得到高纯度的特异性IgY,但因产率低、费用高而不能大规模应用,仅适用于科研;冻融法回收率偏低;膜过滤法成本偏高;水稀释法具有工艺简便、生产成本较低和回收率高等优点,比较适合大规模工业化生产。在实际制备纯化过程中,应优化组合各种提取、纯化和浓缩方法,使方法尽量经济、简便,且产率和活性高。
3.1.1 IgY的酸稳定性
IgY等电点在5.7~7.6之间,其在pH 4.0~11.0时稳定。在酸性条件下(pH 3.0~3.5)活性下降,且IgY的活性较其他抗体下降更快。通过色氨酸自然荧光变化跟踪酸性环境对抗体立体结构的影响,发现在酸性条件下,IgY比其他抗体更容易产生立体结构变化[16]。
3.1.2 IgY对酶的敏感性
在胃肠道消化过程中,IgY能抵抗胃肠道中胰蛋白酶和胰凝乳酶的分解,而胃蛋白酶和糜蛋白酶对其作用明显,能特异性降低IgY的活性。pH值在2.0以下时,IgY在胃蛋白酶作用下易失去活性;在pH 4.0的酸性条件下,胃蛋白酶作用4 h后IgY活力下降50%;而如果仅用胃蛋白酶酶解24 h,酶解片段仍具有抗体活性,保持中和抗原的特性;酸性条件对胃蛋白酶降低IgY活性影响较大,碱性(重碳酸钠盐)和高浓度蛋白质溶液能增加IgY抗酸和抗蛋白酶水解能力[17]。
3.1.3 IgY的热稳定性
低温状态下,IgY在4 ℃条件下能够贮存5 年,室温下能够存放6 个月,抗体活性不会发生变化[18]。高温状态下,通常IgY热稳定性的上限是60 ℃,当加入其他辅助试剂时,例如质量分数30%的蔗糖、海藻糖或乳糖,其耐热上限可以达到70 ℃。用胃蛋白酶酶解制备的活性片段Fab’在温度为65 ℃条件下加热15 min,结合抗原活性未发生改变;在低pH值和高盐浓度条件下,Fab’的活性也未受影响,说明Fab’的热、酸碱稳定性和对盐离子浓度的耐受性均高于IgY[19]。
3.1.4 IgY的沉淀和凝集作用
IgY仅在一定的盐浓度环境中产生沉淀反应。这可能与IgY的空间构象有关,IgY的两个Fab片段太靠近以致难以与两个大抗原结合,当在一定的盐浓度和酸性条件下,两个Fab片段得以释放,出现沉淀反应。在盐的诱导下,由Fc段介导的抗原抗体聚集反应原理尚不清楚,推测IgY的两个Fab’片段的CH2区可能与聚集作用的发生有关,另外碳水化合物残基闭合抗原结合位点,可导致其失去凝集抗原的能力[20]。
IgY在疾病治疗上的作用极大延伸了抗体应用范围。虽然利用口服方式发挥治疗作用的确切机制尚不清楚,但其根本是基于抗体抗原的相互作用[21]。蛋白质或多肽经口服以后,往往会在胃中较低pH值条件下被蛋白酶降解,形成小的片段被肠道吸收或失活。不同的研究发现婴儿和成人口服IgG后,其粪便仍然有19%~50%的抗体具有活性[22]。Reilly等[23]的研究发现,IgY在肠道中呈现出较其他抗体更强的耐受性,因此其在口服应用上具有一定的优势;且因其高特异性,口服IgY对细菌或病毒引起的非消化道和全身性疾病有显著的控制作用[24]。Yokoyama等[25]用质量浓度为100 mg/mL的抗-K88g IgY分别喂食不同日龄幼龄仔猪5 mL,检测饲喂后0、2、6、24 h抗-K88g IgY在幼龄仔猪血液和胃肠道中的分布情况,检测结果显示,幼龄仔猪未成熟的胃肠道环境不能破坏IgY活性,IgY能被胃肠道吸收转运至循环系统,其在血液中的半衰期为1.85 d。成熟机体摄入IgY后,因IgY不与细菌或哺乳动物的受体Fc结合,完整IgY不被机体所吸收[26]。在胃酸性条件下,IgY经胃蛋白酶和糜蛋白酶分解,部分失去活性,其余部分以活性片段(如:Fab和Fab’)和完整分子结构形式存在。少量活性片段经胃肠道吸收进入血液,在血液循环的带动下到达病灶处与病原菌结合,发挥其免疫学活性[27]。未被吸收的部分IgY在肠道中可有效抑制细菌的定植、增殖及分泌毒素,最后排出体外;因此,可以预期IgY经口摄入后,不会对人体系统产生危害影响[28],且能保持部分活性,发挥其对特定抗原的抑制作用。为更好增强IgY的口服稳定性,延缓IgY的释放,提高其生物利用度,国内外研究者采用混合添加剂法、多糖修饰法和包埋法等增强IgY对胃酸和胃蛋白酶的稳定性[29-30]。
据统计,全世界现有3 000余种蛇类,约650 种毒蛇,而这其中有近300 种毒蛇对人体有致命危险[31]。蛇毒是毒蛇的毒腺中分泌的一种天然的含有多种酶类、非酶类的毒性蛋白质和多肽类物质。毒蛇毒液注入人体后可引起外周神经毒、凝血障碍、肌肉毒性和肾功能衰竭;部分成分能诱发神经毒性、心脏毒性和组织坏死毒性而呈现致命性[32]。蛇毒的危害是全世界热带和亚热带地区主要公共卫生问题[33]。现在世界范围内主要通过注射动物源性抗蛇毒血清以中和蛇毒治疗蛇伤,其策略就是用抗体抗原结合中和蛇毒。抗体能与毒素形成复合物,改变活性蛇毒分子生物利用度,或利用抗体和抗原的结合干预毒素与受体的相互作用,达到抑制毒素毒性的作用[34]。1990年Thalley等[35]首次报道制备的抗蛇毒IgY能有效中和蛇毒对实验小鼠的致死毒性,其中和能力是商用马源型抗体的6.3 倍,IgY对蛇毒表现出很好的中和效果。近年来,研究者们已经开始研究用IgY替代针对不同种属蛇毒的抗蛇毒血清,研究结果见表1。由此可见,用蛇毒免疫蛋鸡可获得高活性的抗蛇毒IgY,它不仅能有效中和蛇毒的致死效应,也能中和蛇毒引起的多种毒理学效应。此外,卵黄中抗蛇毒IgY含量高,据报道,18 只免疫的鸡每年能够产出的抗蛇毒血清与1 匹马的产出量相当[34]。因此,IgY被认为是一种可能替代抗蛇毒血清的新型蛇毒解毒剂。
表 1 IgY对蛇伤治疗的相关研究
Table 1 Related applications of IgY against snake bites
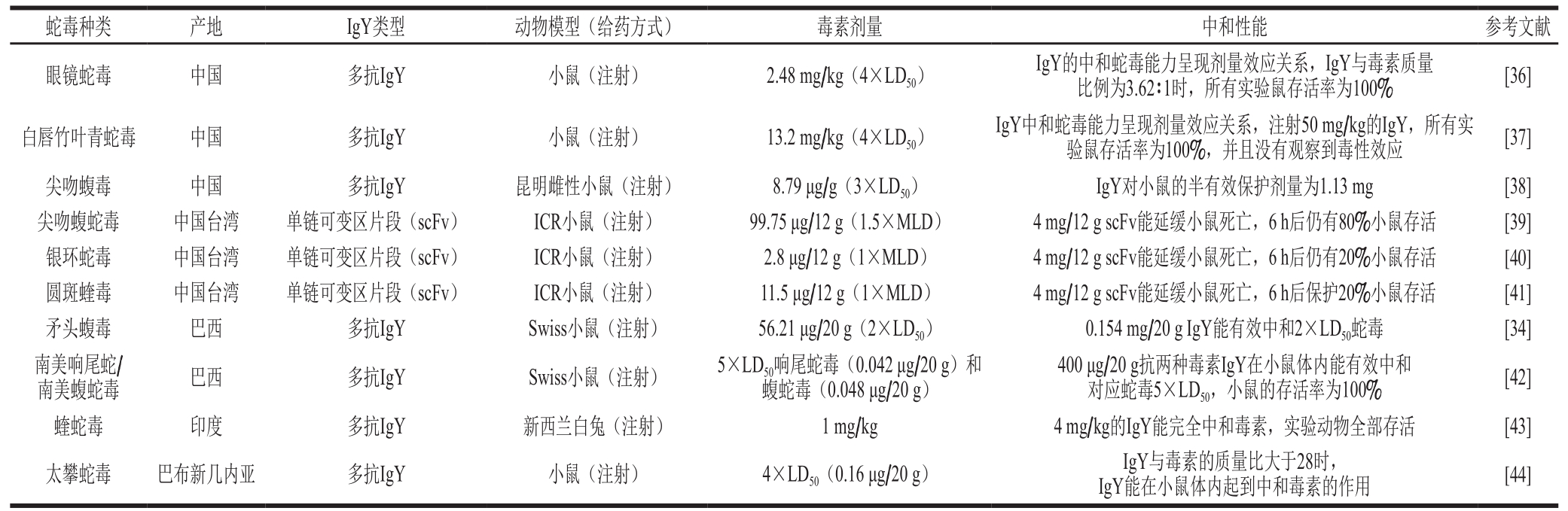
注:LD50.半致死量(median lethal dose);MLD.最低致死量(minimum lethal dose);scFv.单链可变区片段(single chain fragment variable)。
蛇毒种类 产地 IgY类型 动物模型(给药方式) 毒素剂量 中和性能 参考文献眼镜蛇毒 中国 多抗IgY 小鼠(注射) 2.48 mg/kg(4×LD50) IgY的中和蛇毒能力呈现剂量效应关系,IgY与毒素质量比例为3.62∶1时,所有实验鼠存活率为100% [36]白唇竹叶青蛇毒 中国 多抗IgY 小鼠(注射) 13.2 mg/kg(4×LD50) IgY中和蛇毒能力呈现剂量效应关系,注射50 mg/kg的IgY,所有实验鼠存活率为100%,并且没有观察到毒性效应 [37]尖吻蝮毒 中国 多抗IgY 昆明雌性小鼠(注射) 8.79 μg/g(3×LD50) IgY对小鼠的半有效保护剂量为1.13 mg [38]尖吻蝮蛇毒 中国台湾 单链可变区片段(scFv) ICR小鼠(注射) 99.75 μg/12 g(1.5×MLD) 4 mg/12 g scFv能延缓小鼠死亡,6 h后仍有80%小鼠存活 [39]银环蛇毒 中国台湾 单链可变区片段(scFv) ICR小鼠(注射) 2.8 μg/12 g(1×MLD) 4 mg/12 g scFv能延缓小鼠死亡,6 h后仍有20%小鼠存活 [40]圆斑蝰毒 中国台湾 单链可变区片段(scFv) ICR小鼠(注射) 11.5 μg/12 g(1×MLD) 4 mg/12 g scFv能延缓小鼠死亡,6 h后保护20%小鼠存活 [41]矛头蝮毒 巴西 多抗IgY Swiss小鼠(注射) 56.21 μg/20 g(2×LD50) 0.154 mg/20 g IgY能有效中和2×LD50蛇毒 [34]南美响尾蛇/南美蝮蛇毒 巴西 多抗IgY Swiss小鼠(注射) 5×LD50响尾蛇毒(0.042 μg/20 g)和蝮蛇毒(0.048 μg/20 g)400 μg/20 g抗两种毒素IgY在小鼠体内能有效中和对应蛇毒5×LD50,小鼠的存活率为100% [42]蝰蛇毒 印度 多抗IgY 新西兰白兔(注射) 1 mg/kg 4 mg/kg的IgY能完全中和毒素,实验动物全部存活 [43]太攀蛇毒 巴布新几内亚 多抗IgY 小鼠(注射) 4×LD50(0.16 μg/20 g) IgY与毒素的质量比大于28时,IgY能在小鼠体内起到中和毒素的作用 [44]
自然界许多动物、植物和细菌都能产生大分子蛋白毒素。大分子蛋白类毒素很难直接跨膜进入细胞,需通过内化由细胞膜外进入细胞,进而作用不同靶位发挥毒性作用,此过程往往借助受体完成,是蛋白毒素中毒的关键步骤[45]。利用IgY中和毒素的研究,目前大多限于大分子毒素。Leclaire等[46]用葡萄球菌分泌的肠毒素B(staphylococcal enterotoxin B,SEB)的两个重叠片段免疫蛋鸡产生IgY,该IgY可抑制被动免疫小鼠的细胞因子反应,使小鼠产生免疫保护力;且能使被动免疫的恒河猴在含有致命剂量SEB的气雾里存活4 h,对恒河猴起到一定的保护作用。陈翠萍等[47]采用幽门螺杆菌(helicobacter pylori,Hp)超声裂解物和该菌培养液离心上清液浓缩后免疫蛋鸡制备IgY,两种抗体均能中和Hp毒素,可降低Hp蛋白抗原对Vero细胞的毒性作用;感染小鼠经抗Hp-IgY口服治疗4 周后,其阴转率达100%,且肝脏病理切片显示炎症明显减轻。Pauly等[48]采用蓖麻毒素免疫蛋鸡得到高效价和特异性IgY,体外实验显示抗蓖麻毒素IgY能预防蓖麻毒素诱导Vero细胞死亡;体内实验用抗体与毒素室温孵育30 min的复合物注射BALB/c鼠,IgY与毒素复合物处理组大鼠存活率较毒素处理组升高。近几年,较多研究采用大肠杆菌产生的志贺毒素免疫蛋鸡制备IgY,探究其降毒效应和解毒机制。de Almeida等[49]采用大肠杆菌J5株、内毒素与类脂混合免疫蛋鸡制备IgY,该抗体效价高、特异性强,防治内毒素血症效果明显。此后,Wang Qin等[6]用志贺毒素亚型蛋白(StxB)免疫蛋鸡获得抗StxB-IgY,并采用体内和体外实验研究抗StxB-IgY降低StxB毒性的作用,发现抗StxB-IgY能阻断StxB与HeLa细胞膜上受体的结合,使共同孵育处理的HeLa细胞存活率增加;通过动物实验发现该抗体能降低Stx1对BALB/c鼠的毒性损伤。Parma等[50]用志贺毒素蛋白(Stx2)免疫蛋鸡获得抗体Stx2-IgY,中和毒性效应显示该抗体能很好地识别结合Stx2毒素,有效降低Stx2对Vero细胞的毒性,并且灌胃和注射IgY的方式可减轻Stx2对大鼠的毒性损伤。Neri等[51]用志贺毒素亚型蛋白(Stx1B和Stx2B)和两种毒素亚型重组体蛋白(rStx1B和rStx2B)免疫蛋鸡,得到相应的抗Stx1B-IgY、抗Stx2B-IgY、抗rStx1B-IgY和抗rStx 2B-IgY,研究结果表明重组蛋白免疫的抗体特异性强,不存在交叉识别,中和能力较原抗体分别增强10 倍和2.6 倍。体外实验结果显示,直接采用大分子蛋白毒素免疫蛋鸡获得的IgY,具备抗体与抗原特异性结合的特性,IgY能与大分子蛋白毒素结合在一起,阻断蛋白毒素与细胞表面的受体结合,减少细胞对毒素的摄入,起到对细胞的保护作用[52](图2)。

图 2 IgY中和蛋白毒素诱发的细胞毒性机制
Fig. 2 diagram of the mechanism of IgY for reducing macromolecular protein toxins-induced cytotoxicity
近十年来,脱除食品和饲料中毒素(特别是真菌小分子毒素)的方法主要包括:物理吸附法,化学法和生物酶解毒法[53],然而这些方法存在稳定性差、易导致营养物质损失、产生次生有毒物质、成本较高和运输条件苛刻等问题[54]。因此,利用新型生物技术开发稳定高效、无副作用以及环境友好的脱除方法是毒素脱除的一个重要发展方向。综上所述,IgY中和大分子蛋白毒素作用明显,相较于哺乳动物IgG,IgY的生产成本低、纯化工艺简单、产量大且稳定性好,引发副作用的可能性低,IgY是一种极富前景的中和毒素资源。尽管如此,目前的研究主要集中于降低大分子蛋白毒素毒性,自然界还存在种类繁多的小分子毒素,小分子毒素污染源广、毒性强,但目前鲜有IgY对小分子毒素中和作用的研究。因此,利用IgY的生物学优势和体内代谢特点,探索其对小分子毒素的降毒效应与解毒机制,能为开发生物友好的小分子毒素脱除方法提供一个崭新的思路。另外,IgY因其具有的生物学特点和开发应用方面的优势,已经作为添加剂应用于婴幼儿食品和牲畜饲料,用于抵抗病毒和细菌性疾病的侵害。利用其口服方面的优势,作为食品和饲料添加剂对控制小分子毒素对公众身体健康的影响具有重大意义。现阶段对于利用IgY中和毒素的研究还停留在实验室阶段,有必要推进IgY的耐受性和对人应用安全性的临床实验。
不合理的食品和饲料加工、运输和贮藏方式易产生各种毒素,随着人们对食品安全日益重视,降低食品和饲料中毒素毒性已经成为保障公众安全和畜禽健康的重要措施之一。IgY可有效识别大分子蛋白毒素,起到降低毒素毒性的作用。IgY作为婴幼儿食品和动物饲料添加剂已经得到开发应用,口服方面表现出明显优越性,成为国内外开发的一种重要、安全的营养添加剂。随着研究理论的不断深入及科学技术的进步,相信利用IgY与抗原特异性识别和结合的特性及其在应用方面的优势,势必能为降低食品和饲料中毒素毒性提供新的途径。
[1] MUNHOZ L S, VARGAS G D, FISCHER G, et al. Avian IgY antibodies: characteristics and applications in immunodiagnostic[J].Ciência Rural, Santa Maria, 2014, 44(1): 153-160.
[2] GADDE U, RATHINAM T, LILLEHOJ H S, et al. Passive immunization with hyperimmune egg-yolk IgY as prophylaxis and therapy for poultry diseases: a review[J]. Animal Health Research Reviews, 2015, 16(2): 163-176. DOI:10.1017/S1466252315000195.
[3] XU Y P, LI X Y, JIN L J, et al. Application of chicken egg yolk immunoglobulins in the control of terrestrial and aquatic animal diseases: a review[J]. Biotechnology Advances, 2011, 29(6): 860-868.DOI:10.1016/j.biotechadv.2011.07.003.
[4] DIRAVIYAM T, ZHAO B, WANG Y, et al. Effect of chicken egg yolk antibodies (IgY) against diarrhea in domesticated animals: a systematic review and meta-analysis[J]. PLoS ONE, 2014, 9(5): 1-14.DOI:10.1371/journal.pone.0097716.
[5] MÜLLER S, SCHUBERY A, ZAJAC J, et al. IgY antibodies in human nutrition for disease prevention[J]. Nutrition Journal, 2014, 14(1): 1-7.DOI:10.1186/s12937-015-0067-3.
[6] WANG Qin, HOU Xiaojun, CAI Kun, et al. Passive protection of purified yolk immunoglobulin administered against Shiga toxin 1 in mouse models[J]. Canadian Journal of Microbiology, 2010, 56(12):1003-1010. DOI:10.1139/W10-087.
[7] LOEKEN M R, ROTH T F. Analysis of maternal IgG subpopulations which are transported into the chicken oocyte[J]. Immunology, 1983,49(1): 21-28.
[8] HAMAL K R, BURGESS S C, PEVZNER I Y, et al. Maternal antibody transfer from dams to their egg yolks, egg whites, and chicks in meat lines of chickens[J]. Poultry Science, 2006, 85(8): 1364-1372.DOI:10.1093/ps/85.8.1364.
[9] SCHADE R, CALZADO E G, SARMIENTO R, et al. Chicken egg yolk antibodies (IgY-technology): a review of progress in production and use in research and human and veterinary medicine[J].Alternatives to Laboratory Animals, 2005, 33(2): 129-154.
[10] LEE W, SYED A A, TAN S C, et al. Insights into the chicken IgY with emphasis on the generation and applications of chicken recombinant monoclonal antibodies[J]. Journal of Immunological Methods, 2017, 447: 71-85. DOI:10.1016/j.jim.2017.05.001.
[11] TIAN Z H, ZHANG X Y. Progress on research of chicken IgY antibody-FcRY receptor combination and transfer[J]. Journal of Receptors and Signal Transduction Research, 2012, 32(5): 231-237.DOI:10.3109/10799893.2012.703207.
[12] HELM B A, LING Y, TEALE C, et al. The nature and importance of the inter-epsilon chain disulfide bonds in human IgE[J]. European Journal of Immunology, 1991, 21(6): 1543-1548. DOI:10.1002/eji.1830210631.
[13] TAN S H, MOHAMEDALI A, KAPUR A, et al. A novel, cost-effective and efficient chicken egg IgY purification procedure[J]. Journal of Immunological Methods, 2012, 380(1/2): 73-76. DOI:10.1016/j.jim.2012.03.003.
[14] DE MEULENAER B, HUYGHEBAERT A. Isolation and purification of chicken egg yolk immunoglobulins: a review[J].Food and Agricultural Immunology, 2001, 13(4): 275-288.DOI:10.1080/09540100120094537.
[15] PRIYANKA B S, ABHIJITH K S, RASTOGI K N, et al. Integrated approach for the extraction and purification of IgY from chicken egg yolk[J]. Separation Science and Technology, 2014, 49(4): 275-288.
[16] 李春晖, 郭立君, 于洪涛, 等. 胃蛋白酶对抗狂犬病毒IgY活性的影响[J]. 中国生物制品学杂志, 2002(1): 45-46; 54. DOI:10.3969/j.issn.1004-5503.2002.01.013.
[17] SHIMIZU M, NAGASHIMA H, SANO K, et al. Molecular stability of chicken and rabbit immunoglobulin G[J]. Bioscience Biotechnology and Biochemistry, 1992, 56(2): 270-274. DOI:10.1271/bbb.56.270.
[18] NILSSON E, STÅLBERG J, LARSSON A. IgY stability in eggs stored at room temperature or at +4 ℃[J]. British Poultry Science,2012, 53: 42-46. DOI:10.1080/00071668.2011.646951.
[19] LARSSON A, KARLSSON-PARRA A, SJOQUIST J. Use of Chicken antibodies in enzyme immunoassays to avoid interference by rheumatoid factors[J]. Clinical Chemistry, 1991, 31(3): 411-414.
[20] FERREIRA A J, SANTOS J P, BASSI P B, et al. IgY-Technology applied to studies of Toxoplasma gondii infection[M]// Toxoplasmosis,IntechOpen, 2017: 142-161. DOI: 10.5772/67997.
[21] RAHMAN S, VAN NGUYEN S, ICALTO F C, et al. Oral passive IgY-based immunotherapeutics: a novel solution for prevention and treatment of alimentary tract diseases[J]. Human Vaccines and Immunotherapeutics, 2013, 9(5): 1039-1048. DOI:10.4161/hv.23383.
[22] LOSONSKY G A, JOHNSON J P, WINKELSTEIN J A, et al. Oral administration of human serum immunoglobulin in immunodeficient patients with viral gastroenteritis. a pharmacokinetic and functional analysis[J]. Journal of Clinical Investigation, 1985, 76(6): 2362-2367.DOI:10.1172/JCI112248.
[23] REILLY R M, DOMINGOL R, SANDHU J. Oral delivery of antibodies[J]. Clinical Pharmacokinetics, 1997, 32(4): 313-323.DOI:10.2165/00003088-199732040-00004.
[24] IBRAHIM E, RAHMAN A K, ISODA R, et al. In vitro and in vivo effectiveness of egg yolk antibody against Candida albicans (anti-CA IgY)[J]. Vaccine, 2008, 26(17): 2073-2080. DOI:10.1016/j.vaccine.2008.02.046.
[25] YOKOYAMA H, PERALTA R C, DIAZ R, et al. Passive protective effect of chicken egg yolk against experimental enterotoxigenic Escherichia coli infection in neonatal piglets[J]. Infection and Immunity, 1992, 60: 998-1007.
[26] CARLANDER D. Avian IgY antibody. in vitro and in vivo[D].Uppsala: Uppsala University, 2002: 13-20.
[27] 张晓萍, 黄浩龙, 朱祖康, 等. 胆囊收缩素卵黄抗体在大鼠十二指肠的吸收[J]. 动物学报, 2004(3): 375-379. DOI:10.3969/j.issn.1674-5507.2004.03.010.
[28] ZEYNALIAN H, KAZEROUNI F, EBRAHIMI F, et al. Assessment of the safety of chicken egg yolk antibody (IgY) consumption by measuring the activity of antioxidant enzymes (superoxide dismutase,catalase, glutathione peroxidase) and malondialdehyde concentration as a lipid peroxidation marker in mice[J]. Journal of Paramedical Sciences, 2017, 8(3): 29-35.
[29] SUZUKI N, LEE Y C. Site-specific N-glycosylation of chicken serum IgG[J].Glycobiology, 2004, 14(3): 275-292. DOI:10.1093/glycob/cwh031.
[30] LI X Y, JIN L J, LU Y N, et al. Chitosan-alginate microcapsules for oral delivery of egg yolk immunoglobulin (IgY): effects of chitosan concentration[J]. Biotechnology and Applied Biochemistry, 2009,159(3): 778-787. DOI:10.1007/s12010-009-8628-6.
[31] 范泉水. 蛇毒主要成分研究进展[J]. 西南国防医药, 2017, 27(8):901-904. DOI:10.3969/j.issn.1004-0188.2017.08.047.
[32] 李江兵. 眼镜蛇神经毒镇痛小肽片段的作用机制研究[D]. 昆明: 昆明理工大学, 2017: 4-5.
[33] CHIPPAUX J P, GOYFFON M. Epidemiology of scorpionism: a global appraisal[J]. Acta Tropica, 2008, 107(2): 71-79. DOI:10.1016/j.actatropica.2008.05.021.
[34] ARAÚJO A S, LOBATO Z I P, CHÁVEZ-OLÓRTEGUI C, et al.Brazilian IgY-Bothrops antivenom: Studies on the development of a process in chicken egg yolk[J]. Toxicon, 2010, 55(4): 739-744.DOI:10.1016/j.toxicon.2009.11.004.
[35] THALLEY B S, CARROLL S B. Rattlesnake and scorpion antivenoms from the egg yolks of immunized hens[J]. Nature Biotechnology, 1990,8(10): 934-938.
[36] LIU S H, DONG W H, KONG T H. Preparation and characterization of immunoglobulin yolk against the venom of Naja naja atra[J].Indian Journal of Experimental Biology, 2010, 48(8): 778-785.
[37] DUAN H L, HE Q Y, ZHOU B, et al. Anti-Trimeresurus albolabris venom IgY antibodies: preparation, purification and neutralization efficacy[J]. Journal of Venomous Animals and Toxins Including Tropical Diseases, 2016, 22(1): 1-6. DOI:10.1186/s40409-016-0078-3.
[38] 刘锦花, 李恒, 和七一, 等. 抗蛇毒IgY对尖吻蝮(Deinagkistrodon acutus)蛇毒主要活性的中和作用研究[J]. 中国药理学通报, 2017,33(1): 58-62. DOI:10.3969/j.issn.1001-1978.2017.01.011.
[39] LEE C H, LEE Y C, LIANG M H, et al. Antibodies against venom of the snake Deinagkistrodon acutus[J]. Applied and Environmental Microbiology, 2015, 82(1): 71-80. DOI:10.1128/AEM.02608-15.
[40] LEE C H, LEE Y C, LEU S J, et al. Production and characterization of neutralizing antibodies against Bungarus multicinctus snake venom[J].Applied and Environmental Microbiology, 2016, 82(23): 6973-6982.DOI:10.1128/AEM.01876-16.
[41] LEE C H, LEE Y C, LEE Y L, et al. Single chain antibody fragment against venom from the snake Daboia russelii formosensis[J]. Toxins,2017, 9(11): 2-9. DOI:10.3390/toxins9110347.
[42] DA ROCHA D G, FERNANDEZ J H, DE ALMEIDA C M C, et al.Development of IgY antibodies against anti-snake toxins endowed with highly lethal neutralizing activity[J]. European Journal of Pharmaceutical Sciences, 2017, 106: 404-412. DOI:10.1016/j.ejps.2017.05.069.
[43] KRISHNAN L K, SAROJA J B, RAJALINGAM M, et al. Rabbit snake-bite model to assess safety and efficacy of anti viper chicken antibodies (IgY)[J]. American Journal of Clinical and Experimental Medicine, 2015, 3(1): 32-38. DOI:10.11648/j.ajcem.20150301.14.
[44] NAVARRO D, VARGAS M, HERRERA M, et al. Development of a chicken-derived antivenom against the taipan snake (Oxyuranus scutellatus) venom and comparison with an equine antivenom[J].Toxicon, 2016, 120: 1-8. DOI:10.1016/j.toxicon.2016.06.018.
[45] 熊建伟, 杜现礼, 车永胜, 等. 毒素-抗毒素系统及其典型模型研究进展[J]. 药物生物技术, 2017, 24(5): 421-425. DOI:10.19526/j.cnki.1005-8915.20170511.
[46] LECLAIRE R D, HUNT R E, BAVARI S. Protection against bacterial superantigen staphylococcal enterotoxin B by passive vaccination[J].Infection & Immunity, 2002, 70(5): 2278-2281. DOI:10.1128/IAI.70.5.2278-2281.2002.
[47] 陈翠萍, 杨朝晖, 王永谦. IgY抗体在体外和体内对幽门螺杆菌作用的研究[J]. 中华微生物学和免疫学杂志, 2002, 22(1): 37-40.DOI:10.3760/j:issn:0254-5101.2002.01.013.
[48] PAULY D, DORNER M, ZHANG X, et al. Monitoring of laying capacity, immunoglobulin Y concentration, and antibody titer development in chickens immunized with ricin and botulinum toxins over a two-year period[J]. Poultry Science, 2009, 88(2): 281-290.DOI:10.3382/ps.2008-00323.
[49] DE ALMEIDA C M C, QUINTANA-FLORES V M, MEDINAACOSTA E, et al. Egg yolk anti-BfpA antibodies as a tool for recognizing and identifying enteropathogenic Escherichia coli[J].Scandinavian Journal of Immunology, 2003, 57(6): 573-582.DOI:10.1046/j.1365-3083.2003.01243.x.
[50] PARMA Y R, CHACANA P A, ROGÉ A, et al. Antibodies anti-Shiga toxin 2 B subunit from chicken egg yolk: isolation, purification and neutralization efficacy[J]. Toxicon, 2011, 58(4): 380-388.DOI:10.1016/j.toxicon.2011.07.009.
[51] NERI P, TOKORO S, SUGIYAMA T, et al. Recombinant Shiga toxin B subunit can induce neutralizing immunoglobulin Y antibody[J].Biological & Pharmaceutical Bulletin, 2012, 35(6): 917-923.DOI:10.1248/bpb.35.917.
[52] NERI P, TOKORO S, KOBAYASHI R, et al. Specific egg yolk immunoglobulin as a new preventive approach for Shiga-toxinmediated diseases[J]. PLoS ONE, 2011, 6(10): e26526. DOI:10.1371/journal.pone.0026526.
[53] 乔宏兴, 姜亚乐, 王永芬, 等. 黄曲霉毒素的危害及其脱毒方法研究进展[J]. 动物医学进展, 2017, 38(1): 89-93. DOI:10.16437/j.cnki.1007-5038.2017.01.019.
[54] YANG X, LV Y J, HUANG K L, et al. Zinc inhibits aflatoxin B1-induced cytotoxicity and genotoxicity in human hepatocytes(HepG2 cells)[J]. Food and Chemical Toxicology, 2016, 92: 17-25.DOI:10.1016/j.fct.2016.03.012.
Progress in Egg Yolk Immunoglobulin Metabolism and Toxin Neutralization
QIU Taotao, XU Zhenlin, GAN Qingqing, et al. Progress in egg yolk immunoglobulin metabolism and toxin neutralization[J]. Food Science, 2019, 40(5): 303-308. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180122-300. http://www.spkx.net.cn