乳状液是一种非均多相分散体系,常见的乳状液由油水两相组成。乳状液通常有2 种类型,即水包油型乳状液和油包水型乳状液,其中水包油型乳状液在食品工业中应用广泛,如加工蛋黄酱、调味料、饮料、冰激凌等[1]。这些产品的加工可能会需要混合、剪切、加热、冷藏、冷冻、脱水处理。其中冷冻处理是食品抑制微生物、维持化学稳定性和延长货架期的重要手段之一[2]。水包油乳状液在冷藏、冷冻食品和药品中有许多应用,而在其使用前往往需要经历冷却和融化的过程[3-4]。因此,如何增强乳状液的冻融稳定性成为近年来的研究热点。
在植物源蛋白质中,大豆蛋白由于其广泛的功能特性和较高的营养价值在食品体系中得到广泛的应用[5-7]。然而大多数大豆蛋白乳状液在冷冻-解冻的过程中会形成冰晶,尖锐的冰晶对乳状液界面膜形成机械破坏,改变原有稳定体系的蛋白-蛋白交互作用,解冻后乳状液将发生聚结、出油和分层等失稳现象[8-9]。大豆分离蛋白(soybean protein isolated,SPI)的功能性质可以通过物理、化学、酶法进行修饰。酶法改性是在温和条件下利用酶制剂催化蛋白水解或聚合,改变SPI的氨基酸残基和多肽链、破坏蛋白质分子的空间结构、改变蛋白质分子的理化性质,从而获得具有较好功能特性和营养性的SPI[10]。目前国内外学者的研究主要集中在利用转谷氨酰胺酶(transglutaminase,TGase)提高蛋白质乳化性[11-13],对于利用TGase提高SPI冻融稳定性且在TGase改性SPI形成的乳化体系中对于乳状液冻融过程中结晶晶体形成及融化的热特性与冻融稳定性的关系研究报道较少。且已有研究表明添加乳化剂可有效改善冰激凌基料在贮运过程中的稳定性,而冰激凌在日常销售及家庭贮藏期间温度多为-18 ℃,研究利用优质蛋白资源SPI制备乳状液在该温度条件下进行冻融循环,以期具有实际意义。
本实验通过研究冻融循环次数、TGase交联时间、添加量对乳化体系的分层系数、出油率的影响,确定TGase交联时间及添加量,通过十二烷基硫酸钠-聚丙烯酰氨凝胶电泳确定酶促反应对于蛋白组成的影响,比较分析2 种乳状液体系显微结构、热特性,探究改性蛋白组成及热力学行为对体系冻融稳定的影响,从而为大豆蛋白在冷冻食品的应用提供理论依据。
大豆油 黑龙江省哈尔滨市九三集团;SPI 北京索莱宝科技有限公司;TGase 泰兴市东圣食品科技有限公司;十二烷基硫酸钠、苏丹III试剂 美国Sigma公司;其他试剂均为分析纯。
722-2000型分光光度计 山东高密彩虹分析仪器有限公司;Pyris6型差示扫描量热仪(differential scanning calorimeter,DSC) 美国PE公司;T18 Basic高速分散机/匀浆机 德国IKA公司;ChampGel 6000全自动凝胶成像分析仪 北京赛智创业科技有限公司。
1.3.1 TGase交联样品的制备
将SPI用去离子水配制成质量分数为1.0%溶液,调整温度为50 ℃,调整pH值至7.0,分别加入一定量的TGase,梯度为0.5%、1.5%、2.5%、3.5%、4.5%(酶/底物)开始交联,反应1~5 h后80 ℃加热5 min使酶失活,冷却至室温后调整pH值至7.0,离心,冻干。同时以未加TGase的SPI作为零交联时间、零添加量的对照。
1.3.2 乳状液的制备
参考Kimura等[14]方法进行制备。取15 mL的1% SPI或交联样品加入5 mL大豆油利用高速匀浆机于12 000 r/min均质2 min,制得水包油型乳状液。
1.3.3 冻融循环
将制备好的乳状液置于-18 ℃的冰箱中冷冻22 h后,取出置于40 ℃水浴锅中解冻2 h,此过程称为1个冻融周期。乳状液分别进行1、2、3 个冻融周期处理,并在每次循环后进行稳定性分析。
1.3.4 分层系数测定
取10 mL新鲜乳状液至离心管中,冻融循环后,乳状液开始分层,上层为不透明的乳化层,下层为透明的乳清层。分层系数按公式(1)计算:
式中:Hs为乳清层高度/cm;Ht为乳状液总高度/cm。
1.3.5 出油率测定
参考Palanuwech等[15]的 测定方法并 略加改动。苏丹III油 溶液的制备:精确称取 苏丹III色素0.015 g,加入1 000 g大豆油中在室温(25 ℃)条件下慢速 搅拌12 h左右,使苏丹III完全溶解,于波长508 nm处测定苏丹III油溶液的吸光度(A1)。准确称取 待测样品 乳状液16 g,制备好的苏丹III油溶液4 g,混合 均匀,1 000×g离心20 min,用移液枪吸取 乳状液上层,于15 000×g离心20 min,取上层清液 于波长508 nm处测定吸光度(A2)。原油为空白调零。出油率按公式(2)计算:
式中:φd为乳状液中脂肪质量分数/%;M0为加入的苏丹III油液的质量/g;Me为乳状液的质量/g;a=A1/A2。
1.3.6 乳状液的光学显微结构观察
吸取20 μL乳状液滴于带有凹槽的载玻片中心,盖上盖玻片,注意不要产生气泡,将载玻片置于载物台上观察,先在4 倍物镜下找到清晰的视野,然后再10 倍物镜下放大倍率(10×10)进行乳状液液滴显微结构观察。
1.3.7 DSC法测定
参考Noshad等[16]的 测定方法并略加改动。乳状液的热行为利用DSC进行表征。吸取10 μL依照1.3.2节方法制备的SPI新鲜乳状液、TGase改性SPI新鲜乳状液置于铝制坩埚中,然后密封,移至DSC样品池中,以1 个空铝制坩埚作为参比。样品在DSC中以5 ℃/min从20 ℃到-20 ℃进行降温,然后以相同的速率从-20 ℃到20 ℃进行升温。此温度循环重复3 次。
大豆油的热行为测定参考Magnusson等[17]的测定方法并略加改动。大豆油(10 μL)置于铝制坩埚中,然后密封,移至DSC样品池中,以1 个空铝制坩埚作为参比。样品在DSC中以5 ℃/min从30 ℃至-30 ℃进行降温。
1.3.8 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳测定
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳及考马斯亮蓝蛋白质染色[18]测定蛋白质的亚基组成及变化。用去离子水将SPI及TGase改性SPI配制成3 mg/mL的样品溶液,取蛋白样品溶液与上样缓冲液1∶1混合,电泳前沸水浴中煮沸5 min。进样量为标准蛋白每孔5 μL,样品每孔10 μL。实验中分离胶和浓缩胶分别为12%和5%。样品在浓缩胶时电压为60 V,分离胶电压为90 V。之后用考马斯亮蓝染色,最后脱色至条带清晰,于凝胶成像系统进行成像。
每个实验重复3 次。实验数据采用IBM SPSS 19.0软件进行统计分析。采用Origin 9软件作图。
2.1.1 TGase交联时间对分层系数和出油率的影响
如图1所示,在固定TGase添加量(2.5%)时,随着交联时间的延长,乳状液的出油率及分层系数均呈下降趋势,均低于SPI(交联时间0 h)。当交联时间达到3 h时,乳状液的出油率及分层系数最低,乳状液呈现出较好的抗冻融稳定性,而当交联时间超过3 h时,乳状液的分层系数及出油率有所增加,这可能是由于延长时间会导致大豆蛋白的大量聚集,乳状液体系发生絮凝,从而加剧乳状液分层、油滴的析出[19]。本实验选取交联时间为3 h。

图1 TGase交联时间对乳状液体系分层系数(A)和出油率(B)的影响
Fig. 1 Effect of TGase crosslinking time on creaming index (A) and oiling off (B)
2.1.2 TGase添加量对分层系数和出油率的影响
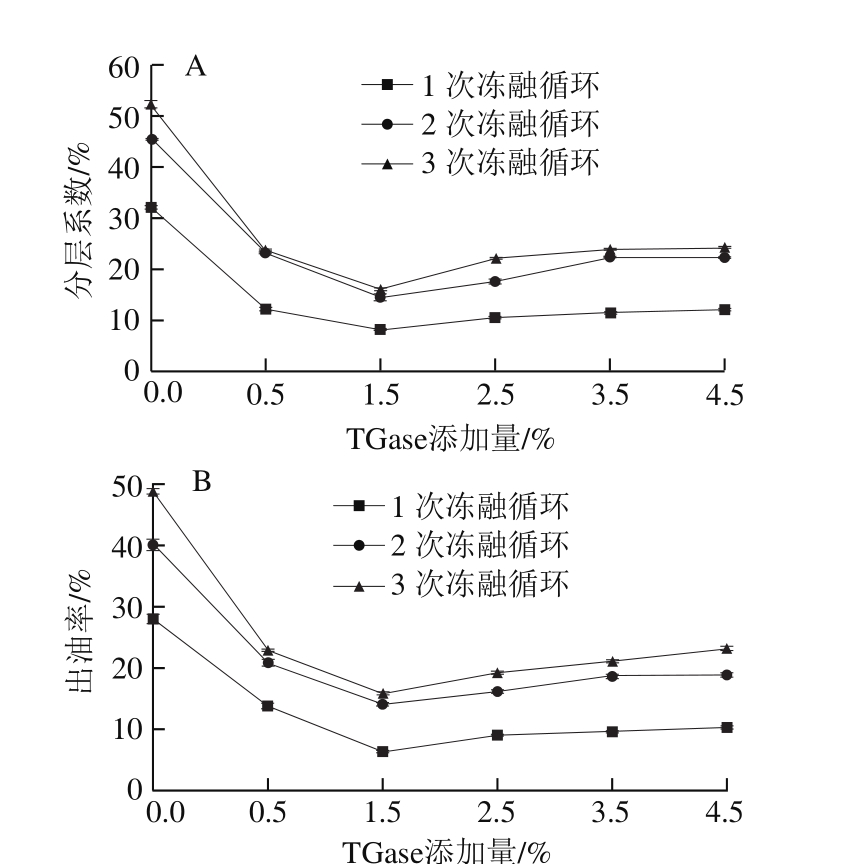
图2 TGase添加量对乳状液体系分层系数(A)和出油率(B)的影响
Fig. 2 Effect of TGase dosage on creaming index (A) and oiling off (B)
由图2可知,当交联时间为3 h时,随着TGase添加量的增加,乳状液的出油率及分层系数呈下降趋势,均低于SPI。当添加量为1.5%时,乳状液的出油率及分层系数最低,乳状液呈现出较好的抗冻融稳定性,而当添加量超过1.5%时,乳状液的分层系数及出油率有所增加,表明大豆蛋白的过度交联会使其乳化能力下降,油滴聚集。本实验选取TGase添加量为1.5%。即改性蛋白在制备条件为TGase交联时间3 h、添加量1.5%时稳定性较好,在3 次冻融循环后,该改性蛋白制备的乳化剂其分层系数、出油率分别为16.11%、15.59%,而SPI分层系数及出油率分别为52.15%、48.74%。
随着冻融循环次数的增加,乳状液出油率及分层系数增大,乳状液的稳定性逐渐下降。其原因主要是,在乳状液冷冻过程中,当冰晶开始形成时,在未冷冻的液相中分散的乳状液液滴会彼此靠近进而发生聚集,此现象的发生可能是由于界面膜被破坏进而促进了乳状液聚集。而在乳状液融化过程中,尖锐的冰晶可能会物理性的渗透破坏油滴并且打破乳状液油与水的界面膜,使油滴更加倾向于聚集[9]。另外,当乳状液冷冻时,SPI可能会变性进而降低其乳化性、保水性、保油性等功能特性[19]。因此,冷冻处理使蛋白的乳化性降低、油-水混合体系中界面膜变得不稳定,会加剧油滴之间的聚集和絮凝,是冻融循环使乳状液失稳的主要原因。
TGase的交联作用一定程度地提高了SPI乳状液的冻融稳定性,一些物理化学机制可以用于解释TGase提高了蛋白在冻融条件下的稳定性。TGase的适度添加提高了蛋白乳化性能,形成更加致密稳定的界面膜,从而提高蛋白乳状液的冻融稳定性[20]。SPI交联后蛋白-蛋白作用的提高、蛋白在界面吸附能力的改善都增强界面蛋白的强度,从而改善SPI的乳化能力[21]。已有研究表明TGase的适量添加可提高蛋白质的乳化性。Hu Xiao等[11]利用TGase提高了花生分离蛋白的乳化性能。徐莹[12]通过研究发现TGase对SPI乳化活性、乳化稳定性具有改善作用。黄志良等[13]研究β-酪蛋白经TGase不同程度的作用后乳化性质的变化。经TGase作用,β-酪蛋白所形成的乳化体系的稳定性明显提高。经处理,β-酪蛋白形成的乳化体系在30 h内未见油水分离,但当TGase处理时间过长,交联程度过高的情况下,乳蛋白质乳化能力会下降,乳化体系中油滴体积增大。这与本研究中当交联时间及酶量添加到一定程度时,其乳状液冻融稳定性会下降的结果相符。其原因可能为蛋白过度交联导致其在乳状液的均质过程中无法迅速迁移到油水界面[22],从而导致乳化能力的下降。另外蛋白的过度交联,会使蛋白大量聚结,聚合的蛋白质会吸附在液滴水膜的两侧,形成“桥连效应”,使乳状液体系发生絮凝,从而加剧乳状液分层[19]。其次是黏度的影响,TGase的交联增加乳状液中未冷冻水的量和水相的黏度,使油滴运动变得困难,降低油滴聚结现象的发生[23]。由于TGase部分脱酰胺基作用,其处理会降低蛋白分子表面疏水性、增加静电排斥[24]。
大豆蛋白的主要组分为7S球蛋白和11S球蛋白。7S球蛋白是由α、α′和β亚基构成;11S球蛋白是由酸性亚基和碱性亚基通过二硫键组成的六聚体[25-26]。电泳图谱是分析蛋白质亚基组分的重要手段。由图3可以看出,随着TGase添加量的提高,TGase改性SPI在116.0 kDa以上出现的新的蛋白条带颜色逐渐加深,而在45.0~66.2 kDa之间的条带逐渐消失,部分β-伴球蛋白通过TGase交联或聚合形成了较高分子质量的聚合物。这与Tang Chuanhe等[27]研究一致。结合图1、2可知,当TGase交联时间3 h、TGase添加量1.5%时制备的TGase改性SPI冻融稳定性最佳。条带3为该条件制备的改性SPI,此时交联程度居中,这也证明交联程度过高,反而使乳状液冻融稳定性下降。可以预料,TGase改性SPI改变其蛋白质组成,使其功能性质发生改变。

图3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳图
Fig. 3 SDS-PAGE analysis
M.蛋白Marker;1. SPI;2~6. TGase改性的SPI,交联时间为3 h,TGase添加量依次为0.5%、1.5%、2.5%、3.5%、4.5%。

图4 TGase改性对乳状液微观结构的影响
Fig. 4 Effect of TGase modification on the microstructure of the emulsion
a~d. SPI;e~h. TGase改性SPI;a和e未经历冻融循环;b和f经历1 次冻融循环;c和g经历2 次冻融循环;d和h经历3 次冻融循环。
如图4所示,新鲜SPI、TGase改性SPI乳状液油滴粒径较均一、稳定。当乳状液经冻融处理后,观察区域中出现了较大的球状颗粒,且有明显的聚结现象,这说明乳状液的稳定性遭到破坏,发生絮凝、聚结、油滴上浮。相对而言,TGase改性SPI与同次循环的SPI相比聚结程度相对较低,上述变化相对较小。这进一步印证了TGase改性大豆蛋白可有效抑制冻融过程中微观液滴的聚集现象,从而得到稳定性较好的乳状液。
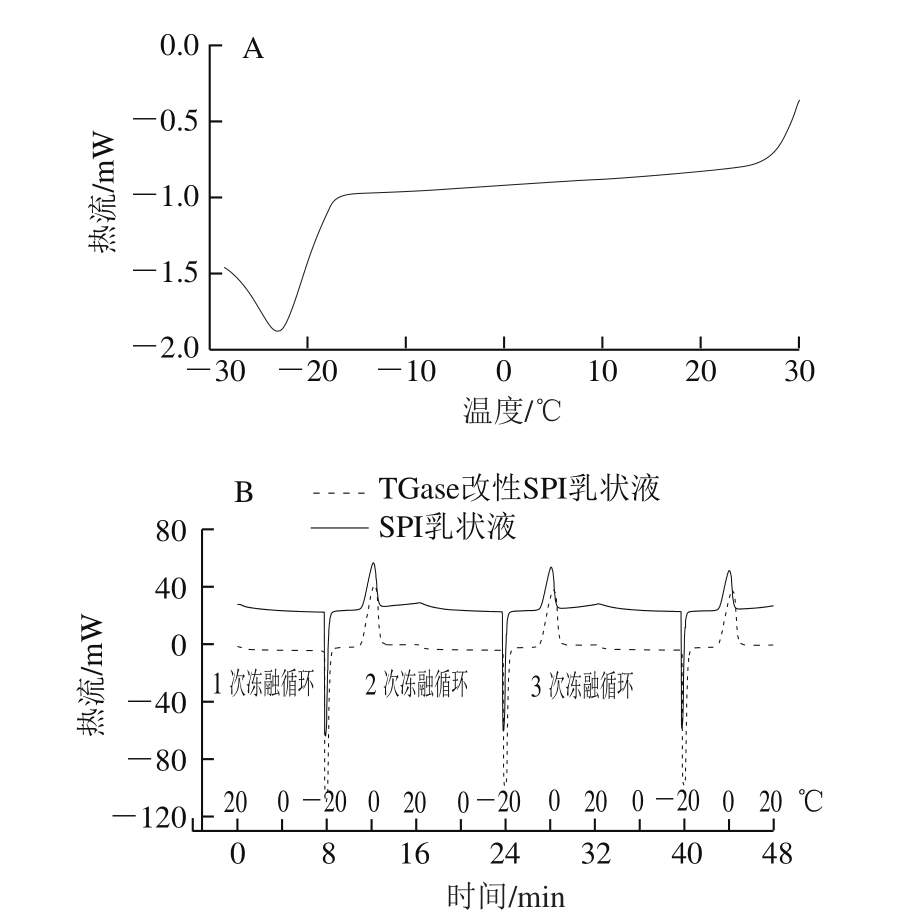
图5 大豆油(A)和SPI乳状液及TGase改性SPI乳状液(B)DSC曲线
Fig. 5 DSC curves of soybean oil (A), SPI emulsion and TGasemodified SPI emulsion (B)
利用DSC可以研究乳状液体系中油、水结晶对于其稳定性的影响,结晶、熔融曲线可用来区别被乳化的油和未被乳化的油[15]。利用DSC分析乳状液样品之前,本研究使用DSC测定大豆油在冷冻过程中的热行为,如图5A所示,大豆油开始结晶温度在-17 ℃左右。说明乳状液在-18 ℃进行冷冻时(仅比大豆油结晶温度低1 ℃),油相几乎保持为液体状态。
如图5B所示,在冷冻过程中,SPI及其改性产物乳状液只出现一个结晶峰。这是由于连续相(水相)造成的。基于以上的观察,可以确定乳状液微滴在-18 ℃冷冻22 h期间油在其中并没有结晶。所以水包油乳状液冻融条件下失稳主要是由于在冷冻阶段冰晶形成失稳造成的。
在SPI乳状液3 次冻融循环的过程中,其在20 ℃左右会观察到一个比较明显的放热峰,这表明游离脂肪的存在,出现该现象的原因是由于油滴的部分聚集[28],而在TGase改性产物乳状液3 次循环中,其在20 ℃左右出现的放热峰较缓。这也说明TGase改性产物在冻融循环中表现得更加稳定。
TGase对SPI的改性可以提高其乳状液体系的冻融稳定性。不同TGase交联时间、添加量改性的SPI乳状液具有不同的冻融稳定性。改性蛋白在制备条件为TGase交联时间3 h、添加量1.5%时稳定性较好,在3 次冻融循环后,该改性蛋白制备的乳化剂其分层系数、出油率分别为16.11%、15.59%,而SPI分层系数及出油率分别为52.15%、48.74%,所以相较于SPI作为乳化剂的乳化体系其冻融稳定性得到很大提高。TGase的改性会对SPI乳状液体系冻融过程中热特性产生影响,使SPI形成较大分子质量的蛋白质聚集体,蛋白组成的改变影响乳状液冻融稳定性。本研究拓宽了豆基食品在食品工业的应用范围。
[1] 简俊丽, 毛丽娟, 刘夫国, 等. 食品乳状液冻融稳定性的研究进展[J]. 食品与发酵工业, 2015, 41(4): 236-240. DOI:10.13995/j.cnki.11-1802/ts.201504044.
[2] MORENO F L, RAVENTOS M, HEMANDEZ E, et al. Rheological behaviour, freezing curve, and density of coffee solutions at temperatures close to freezing[J]. International Journal of Food Properties, 2015, 18(2): 426-438. DOI:10.1080/10942912.2013.833221.
[3] BAMBAJ, CAVE G, BENSOUDA Y, et al. Cryoprotection of emulsions in freeze-drying: freezing process analysis[J]. Drug Development & Industrial Pharmacy, 2008, 21(15): 1749-1760.DOI:10.3109/03639049509069262.
[4] MCCLEMENTS D J. Protein-stabilized emulsions[J]. Current Opinion in Colloid & Interface Science, 2005, 9(5): 305-313. DOI:10.1016/j.cocis.2004.09.003.
[5] 刘玉兰. 现代植物油料油脂加工技术[M]. 郑州: 河南科学技术出版社, 2015.
[6] ABIOSE S H, IKUJENLOLA A V, ABODENN F I. Nutritional quality assessment of complementary foods produced from fermented and malted quality protein maize fortified with soy bean flour[J].Polish Journal of Food & Nutrition Sciences, 2015, 65(1): 49-56.DOI:10.1515/pjfns-2015-0004.
[7] MOLINA E, PAPADOPOULOU A, LEDWARD D A. Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J]. Food Hydrocolloids, 2001, 15(3): 263-269. DOI:10.1016/S0268-005X(01)00023-6.
[8] THANASUKARN P, PONGSAWATMANIT R, MCCLEMENTS D J.Inf l uence of emulsifier type on freeze-thaw stability of hydrogenated palm oil-in-water emulsions[J]. Food Hydrocolloids, 2004, 18(6):1033-1043. DOI:10.1016/j.foodhyd.2004.04.010.
[9] GHOSH S, COUPLAND J N. Factors affecting the freeze-thaw stability of emulsions[J]. Food Hydrocolloids, 2008, 22(1): 105-111.DOI:10.1016/j.foodhyd.2007.04.013.
[10] 李彦萍, 许彬, 李斌. 食品化学理论与应用研究[M]. 北京: 中国水利水电出版社, 2015.
[11] HU X, REN J Y, ZHAO M M, et al. Emulsifying properties of the transglutaminase-treated crosslinked product between peanut protein and fi sh (Decapterus maruadsi) protein hydrolysates[J]. Journal of the Science of Food & Agriculture, 2011, 91(3): 578-585. DOI:10.1002/jsfa.4229.
[12] 徐莹. 高乳化稳定性大豆蛋白的酶法制备及在冰淇淋中的应用[D].无锡: 江南大学, 2013.
[13] 黄志良, 宁正祥. 转谷氨酰胺酶对乳蛋白质的改性作用[J]. 食品工业科技, 2002, 23(3): 77-79. DOI:10.3969/j.issn.1002-0306.2002.03.031.
[14] KIMURA A, FUKUDA T, ZHANG M, et al. Comparison of physicochemical properties of 7S and 11S globulins from pea, fava bean, cowpea, and French bean with those of soybean: French bean 7S globulin exhibits excellent properties[J]. Journal of Agricultural &Food Chemistry, 2008, 56(21): 10273-10279. DOI:10.1021/jf801721b.
[15] PALANUWECH J, POTINENI R, ROBERTS R F, et al. A method to determine free fat in emulsions[J]. Food Hydrocolloids, 2003, 17(1):55-62. DOI:10.1016/S0268-005X(02)00035-8.
[16] NOSHAD M, MOHEBBI M, SHAHIDI F, et al. Freeze-thaw stability of emulsions with soy protein isolate through interfacial engineering[J]. International Journal of Refrigeration, 2015, 58: 253-260. DOI:10.1016/j.ijrefrig.2015.05.007.
[17] MAGNUSSON E, ROSÉN C, NILSSON L. Freeze-thaw stability of mayonnaise type oil-in-water emulsions[J]. Food Hydrocolloids, 2011,25(4): 707-715. DOI:10.1016/j.foodhyd.2010.08.024.
[18] 于国萍. 食品生物化学实验[M]. 北京: 中国林业出版社, 2012.
[19] PALAZOLO G G, SOBRAL P A, WAGNER J R. Freeze-thaw stability of oil-in-water emulsions prepared with native and thermallydenatured soybean isolates[J]. Food Hydrocolloids, 2011, 25(3): 398-409. DOI:10.1016/j.foodhyd.2010.07.008.
[20] WANG Z J, HAN F F, SUI X N, et al. Effect of ultrasound treatment on the wet heating Maillard reaction between mung bean [Vigna radiate (L.)] protein isolates and glucose and on structural and physico-chemical properties of conjugates[J]. Journal of the Science of Food & Agriculture, 2016, 96(5): 1532-1540. DOI:10.1002/jsfa.7255.
[21] ANURADHA S N, PRAKASH V. Altering functional attributes of proteins through cross linking by transglutaminase: a case study with whey and seed proteins[J]. Food Research International, 2009, 42(9):1259-1265. DOI:10.1016/j.foodres.2009.06.012.
[22] BABIKER E E. Effect of transglutaminase treatment on the functional properties of native and chymotrypsin-digested soy protein[J].Food Chemistry, 2000, 70(2): 139-145. DOI:10.1016/S0308-8146(99)00231-9.
[23] DEGNER B M, CHUNG C, SCHLEGEL V, et al. Factors inf l uencing the freeze-thaw stability of emulsion-based foods[J]. Comprehensive Reviews in Food Science & Food Safety, 2014, 13(2): 98-113.DOI:10.1111/1541-4337.12050.
[24] BABIKER E F E, KHAN M A S N, MATSUDOMI N, et al.Polymerization of protease digests and SCID hydrolysate of soy protein by microbial transglutaminase for improvements of the functional properties[J]. Food Research International, 1996, 29(7):627-634. DOI:10.1016/S0963-9969(96)00069-5.
[25] UTSUMI S, MATSUMURA Y, MORI T. Food proteins and their application[M]. New York: Marcel Dekker, 1997: 257-291.
[26] THANASUKARN P, PONGSAWATMANIT R, MCCLEMENTS D J. Utilization of layer-by-layer interfacial deposition technique to improve freeze-thaw stability of oil-in-water emulsions[J].Food Research International, 2006, 39(6): 721-729. DOI:10.1016/j.foodres.2006.01.010.
[27] TANG C H, CHEN Z, LI L, et al. Effects of transglutaminase treatment on the thermal properties of soy protein isolates[J].Food Research International, 2006, 39(6): 704-711. DOI:10.1016/j.foodres.2006.01.012.
[28] VANAPALLI S A, PALANUWECH J, COUPLAND J N. Stability of emulsions to dispersed phase crystallization: effect of oil type,dispersed phase volume fraction, and cooling rate[J]. Colloids &Surfaces: a Physicochemical & Engineering Aspects, 2002, 204(1):227-237. DOI:10.1016/S0927-7757(01)01135-9.
Effect of Transglutaminase on Freeze-Thaw Stability of Soybean Protein Isolate Emulsion
YU Guoping, YUE Chonghui, CHEN Yuan, et al. Effect of transglutaminase on freeze-thaw stability of soybean protein isolate emulsion[J]. Food Science, 2019, 40(6): 22-27. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20171207-081. http://www.spkx.net.cn