凝乳酶(EC 3.4.23.4)是干酪加工时添加于牛乳中使乳液凝固的关键性酶[1],其凝乳及蛋白水解活力对干酪得率、质构和特殊风味有着非常重要的影响[2-5]。传统上凝乳酶是从牛犊皱胃中盐浸提取获得。近年来随着市场需求逐年增大和小牛宰杀量持续下降,传统凝乳酶的供应已无法满足干酪生产的需求,使得进一步开发凝乳酶成为目前乳品科技领域的研究热点之一。微生物具有生长不受气候和地域的限制,来源广泛且发酵容易控制,生长周期短、产酶量大、经济效益高等优势,是目前最有发展潜力的酶制剂来源[6-9]。在产凝乳酶的微生物中,细菌具有较真菌体积小、繁殖快、产物易于提取分离,适合高密度培养增殖产酶等优势[10-11]。本研究前期从中国传统酒曲中筛选得到1 株高产凝乳酶的优势细菌菌株,并鉴定命名为解淀粉芽孢杆菌GSBa-1(CGMCC No.13745)[12];进一步通过优化该菌株发酵产凝乳酶条件,使得其产酶活力得到较大幅度提升[13-14];对该菌株发酵液进行提取纯化凝乳酶,研究表明该凝乳酶具有优良的酶学性质[15],可进一步应用于干酪加工。
干酪营养非常丰富,有“奶黄金”的美称[16]。其中马苏里拉干酪,因其具有拉丝性能,在披萨中得到广泛应用,在中国市场占有量很大。本研究将解淀粉芽孢杆菌GSBa-1凝乳酶应用于马苏里拉干酪中,并与商品凝乳酶进行比较分析,研究该菌株凝乳酶是否具备应用于马苏里拉奶酪中的潜力,以期改善国产干酪大规模工业化生产依赖进口凝乳酶的现状,为该凝乳酶应用于干酪工业化生产提供理论和技术依据。
鲜牛奶(脂肪质量分数3.82%,蛋白质量分数3.62%,乳糖质量分数3.99%) 市售;发酵剂:XZ3303+QH27-1,由北京工商大学食品学院乳品实验室提供;商品凝乳酶 丹麦科汉森有限公司。
干酪槽 德国GEA公司;T25 Ultra-Turrax匀浆器德国IKA公司;Texture ProCTV1.8 Build31质构仪 美国Brookfield公司;U-3900紫外分光光度计 日本Hitachi公司;S7130氨基酸分析仪 德国Sykam公司;DVBCAR-PDMS手动固相微萃取进样器 美国Supelco公司;Kjeltec8100凯氏定氮仪 美国FOSS公司;7890A-7000气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用分析仪 美国Agilent公司。
1.3.1 马苏里拉干酪的制作流程
原料乳→过滤→7 2 ℃,1 5 s巴氏杀菌→冷却至32 ℃→加入发酵剂和辅助发酵剂(7.0~8.0(lg(CFU/mL))→32 ℃静置培养30 min→添加凝乳酶(10 000 SU/L(以牛乳计),中速搅拌5 min;其中菌株GSBa-1凝乳酶活力为1.54×105 SU/g,商业凝乳酶活力为3.16×105 SU/g)→32 ℃保温静置45 min→切割凝块(8 mm×8 mm×8 mm)→32 ℃保温静置15 min→热烫,30 min内缓慢升温至50 ℃→排乳清(pH 5.2~5.4)→重叠堆积,38 ℃每15 min翻转1~2 次→粉碎平铺于干酪槽底→70 ℃混揉→成形→浸渍盐化2 d(3%盐水)→真空包装→4 ℃成熟1 个月→马苏里拉干酪
以商品凝乳酶制作的干酪为对照组干酪(A),以解淀粉芽孢杆菌GSBa-1凝乳酶制作的干酪为实验组干酪(B)。
1.3.2 培养基的配制
M17培养基的配制参考杨亚威等[17]方法。
1.3.3 干酪理化成分的测定
1.3.3.1 干酪得率
在干酪制作过程中,准确称量并记录原料乳、发酵剂、食盐和干酪成品质量,用于干酪得率的计算。由干酪得率可以得知干酪的生产效益并能反映干酪生产时的各工艺参数经济合理性,在衡量提高产率工艺改进有效性等方面提供依据。计算方法见式(1):
1.3.3.2 干酪水分含量
根据GB 5009.003—2010《食品中水分的测定》测定干酪水分质量分数。
1.3.3.3 干酪蛋白质量分数
根据AOAC920.123(1990)凯氏定氮法测定干酪蛋白质量分数。
1.3.4 干酪理化指标的测定
1.3.4.1 干酪pH值
准确称取干酪样品10 g,磨碎后加入12 mL经50 ℃温浴的蒸馏水,Ultra-Turrax匀浆器处理1 min,将样品充分匀浆后,放置在50 ℃水浴中保温处理30 min,于5 000×g离心15 min(20 ℃),去除脂肪层,测定下层溶液的pH值。
1.3.4.2 干酪微生物指标
分别在干酪成熟的第0、5、10、15、20、25、30天取样测定样品的活菌数。准确称取干酪样品11 g加入到99 mL 2 g/100 mL柠檬酸钠溶液(40 ℃)中,匀浆器处理2 min,使样品充分匀浆,用0.9%生理盐水逐级稀释到适当倍数。吸取50 μL稀释液涂布于事先倒好的M17琼脂平板上,培养2~3 d后对乳酸乳球菌进行计数。
1.3.4.3 干酪pH 4.6可溶性蛋白
称取20 g干酪样品,磨碎后加入40 mL经50 ℃温浴的蒸馏水,匀浆器处理2 min,将样品充分匀浆,放置于40 ℃水浴中保温1 h。20 ℃、3 000×g离心15 min,滤除脂肪,用乙酸调节pH 4.6,离心后取上清液冷冻干燥成粉末,备用;高效液相色谱上样条件参考赵笑等[18]方法。
1.3.4.4 干酪氨基酸成分
利用氨基酸分析仪测定三氯乙酸(12%)可溶性氮溶液中的游离氨基酸含量。交换柱用标准氨基酸混合物矫正,在样品分析中添加亮氨酸为内标。在570 nm波长处,采用茚三酮柱后衍生化法测定氨基酸含量,其中脯氨酸于440 nm波长处检测。
1.3.4.5 干酪质构特性
用质构分析仪对干酪样品进行全质地剖面分析。去掉干酪样品上下及边缘约5 mm的部分,在同一水平线上用取样器取正方体样品,使样品长宽高均为1.5 cm。测试前将样品在室温条件下放置30 min,使其温度均衡。测试参数设定如下:测试前速率2.0 mm/s,测试速率0.4 mm/s,返回速率0.4 mm/s,循环2 次,数据频率20 点/s,触发点负载5 g,压缩比50%,探头型号TA-AACC3。每个样品平行3 次,取平均值。相应质构参数及定义见表1。
表1 干酪质构测试中的主要参数及定义
Table 1 The main test parameters of cheese texture and their definitions

参数 定义硬度 第1次压缩干酪样品过程中的最高峰值弹性 第1次压缩变形后的“弹回程度”,可用2 次压缩测量高度的比值表征胶黏性 第1次压缩后,探头从样品中拔出时与干酪样品的黏连而形成的负面积内聚性 第2次压缩和第1次压缩所形成的峰面积之比
1.3.4.6 干酪成熟中微观结构
样品处理方法参考赵笑等[18]方法。
1.3.5 干酪风味物质的测定
准确称量5 g干酪样品,磨碎后放于30 mL萃取瓶中,加盖密封置于水浴锅(50 ℃)中平衡20 min,固相微萃取50 ℃吸附40 min后插入GC进样口250 ℃解吸5 min。
GC条件:程序升温:设置初始温度为40 ℃,此温度下保持3 min,然后以5 ℃/min升温到200 ℃,保持0 min,再以10 ℃/min升温到250 ℃,保持3 min。之后运行3 min。载气(He),恒定流速1.2 mL/min,进样口温度250 ℃,分流比5∶1。
MS条件:电子电离源,电子能量70 eV,传输线温度280 ℃,离子源温度230 ℃,四极杆温度150 ℃,质量扫描范围m/z40~250。
1.3.6 干酪性能指标测定
1.3.6.1 保形性实验
将内径为15 mm的取样刀纵向插入样品,深度超过15 mm,旋转180°以上,抽出取样刀,取下小样,截取15 mm长度,得到底面直径15 mm、高15 mm的圆柱体样品,将样品置于高压灭菌釜中,121 ℃加热20 min,测量残留样品的高度,样品平行3 次,计算保形性。计算见式(2),结果取整数。
1.3.6.2 拉丝性实验
干酪拉丝性能的测定参考RHB 507—2015《匹萨用拉丝性干酪感官评鉴细则》。当干酪样品温度达到75 ℃[19]后,取一块观察并测量其拉丝长度和记录拉丝根数,样品平行3 次。
1.3.7 干酪感官评定
对成熟30 d的马苏里拉干酪进行取样,并进行感官评定。评定方法参考GB 5420—2010《干酪》、GB 25192—2010《再制干酪》和GB/T 13868—2013《感官分析 建立感官分析实验室的一般导则》,并稍有改动。将待检样品切成2 mm薄片,采用评分法。由经食品感官评鉴培训的10 人小组对实验组和对照组干酪进行评分。具体标准见表2。
表2 马苏里拉干酪感官评定指标及评分标准
Table 2 Criteria for sensory evaluation of Mozzarella cheese

指标 特征 评分拉丝性(25 分)拉丝优异,拉丝长200~300 mm,拉丝数≥4 根 20~25拉丝长100~200 mm,拉丝数2~3 根 14~19拉丝长25~100 mm,拉丝数1~2 根 8~13无拉丝性 0~7出油性(10 分)轻微,表面出现很少油斑 8~10表面出现数个油斑 6~7有较多油斑,但是不严重 4~5严重,出现大油斑,油在匹萨上流淌 0~3风味(15 分)风味良好,典型干酪气味,无异味 12~15轻微异味 8~11稍明显异味 4~7严重异味 0~3质构(15 分)光滑咀嚼口感 12~15轻微粗糙口感 8~11中等粗糙口感,有颗粒感,塑料感 4~7严重粗糙口感,有颗粒感,塑料感 0~3保形性(35 分)≥80% 31~35≥60%,<80% 21~30≥40%,<60% 11~20<40% 0~10
每组实验重复测定3 次,最后结果以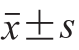 表示。采用SPSS 18.0软件对数据进行处理和分析。
表示。采用SPSS 18.0软件对数据进行处理和分析。
表3 Mozzarella干酪理化成分
Table 3 Chemical composition of Mozzarella cheese%

指标 干酪A 干酪B干酪得率 9.09±0.22 8.84±0.17水分质量分数 53.40±1.11 46.82±1.39盐质量分数 1.59±0.06 1.52±0.04蛋白质量分数 23.64±1.73 28.29±0.94脂肪质量分数 26.27±0.47 30.61±0.57
由表3可以看出,由于添加不同的凝乳酶,干酪理化成分稍有差异。添加菌株GSBa-1凝乳酶的干酪得率和水分质量分数略低于对照组干酪,而实验组干酪的蛋白质量分数稍高于对照组,表明该菌株GSBa-1凝乳酶对马苏里拉干酪的理化成分没有显著影响(P>0.05)。
2.2.1 干酪pH值
由图1可知,对照组和实验组干酪在0~10 d期间,pH值下降速率较快,这是因为大量乳酸菌分解利用干酪中残存的乳糖产生乳酸导致pH值迅速下降。而在干酪成熟中后期,随着乳糖逐渐被耗尽,又随时间的延长,乳蛋白发生水解游离出的NH+与乳酸结合,引起pH值有小幅上升的趋势。总体来看,2 组干酪在成熟过程中,由于添加不同的凝乳酶导致干酪pH值变化差异较小。因此,菌株GSBa-1凝乳酶对干酪成熟过程中pH值变化没有明显影响。
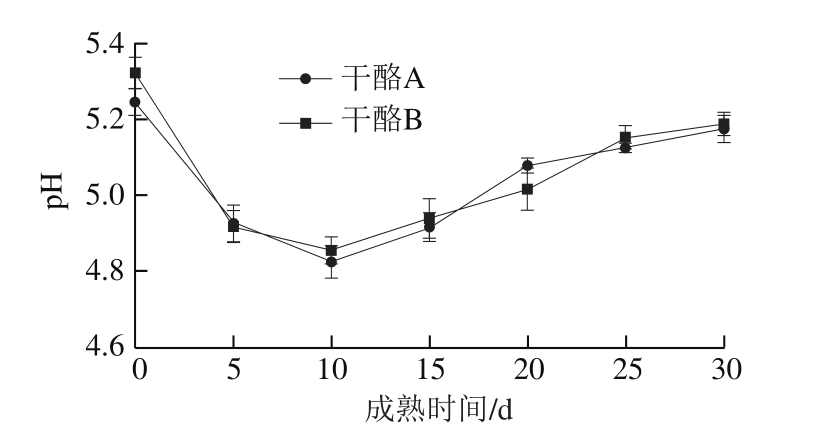
图1 干酪成熟期间的pH值变化
Fig. 1 Changes in pH value during ripening of Mozzarella cheese
2.2.2 干酪成熟过程中发酵剂乳酸乳球菌的存活情况

图2 马苏里拉干酪成熟过程发酵剂乳酸乳球菌的存活情况
Fig. 2 Survival ofLactococcus lactisduring ripening of Mozzarella cheese
由图2可知,在0~15 d内对照组和实验组干酪中的乳球菌菌落数均呈现缓慢增长,这是由于在成熟初期干酪中含有较多的乳糖,乳球菌可以利用乳糖生长繁殖。在之后的15~30 d,乳球菌菌落数开始减少,这是由于干酪中的乳糖不断被利用而减少,乳球菌出现死亡或自溶现象。此外,乳酸菌可促进乳糖发酵,其自溶后释放的各种蛋白酶,能加速干酪中蛋白质和脂肪等有机物降解,赋予干酪良好的风味和品质[20]。在整个干酪成熟过程中,对照组干酪中的菌落数略低于实验组干酪,可能是由于菌株GSBa-1凝乳酶具有较强的蛋白水解作用,其水解产物有利于乳球菌繁殖。但是在成熟结束时对照组和实验组干酪中乳酸菌的数量接近,均达到8.50~9.48(lg(CFU/g))。
2.2.3 干酪成熟过程中pH 4.6可溶性蛋白的变化
pH 4.6条件下可溶性蛋白中主要含有干酪成熟过程中产生的小分子肽和中等分子肽,蛋白含量的高低表明残存的凝乳酶对乳蛋白质水解程度的高低,可作为干酪成熟程度的标志之一。Diezhandino等[21]研究表明pH 4.6可溶性氮主要是由于残存的凝乳酶作用而产生,因在干酪制作过程中,添加的凝乳酶大部分会随乳清而排掉,在干酪中残留量大约占2%~6%。残留的凝乳酶会持续对干酪中乳蛋白质产生水解作用,实验组干酪菌株GSBa-1凝乳酶的pH 4.6可溶性蛋白含量较多,表明菌株GSBa-1凝乳酶对干酪乳蛋白的分解能力较强,可能呈现较多的风味前体物质。
2.2.4 干酪的游离氨基酸成分分析
表4 干酪在成熟30 d时的游离氨基酸组成和含量
Table 4 Free amino acid composition of cheeses after 30 d of ripening at 4 ℃

游离氨基酸 含量/(mg/100 g)干酪A 干酪B磷酸丝氨酸 1.4 7.8牛磺酸 0.4 1.4磷乙醇胺 0.3 0.5天冬氨酸 0.7 0苏氨酸 0.1 1.0丝氨酸 0.2 0.5天冬酰胺 1.8 2.8谷氨酸 7.0 7.7甘氨酸 0.4 0.3丙氨酸 1.9 1.9瓜氨酸 0 1.4缬氨酸 2.4 4.5蛋氨酸 0 1.1异亮氨酸 0.6 1.1亮氨酸 10.1 8.8酪氨酸 3.4 4.5苯丙氨酸 7.3 4.8 β-丙氨酸 0.2 1.0 β-氨基异丁酸 0.2 0.1 γ-氨基丁酸 0.2 0.3组氨酸 0.9 1.6肌肽 0.9 0.4色氨酸 2.5 2.2鸟氨酸 0.2 1.3赖氨酸 3.6 9.8精氨酸 7.0 3.0脯氨酸 1.6 6.2 α-氨基己二酸 0 0.2胱氨酸 0 0.9
干酪成熟后,干酪中游离氨基酸的含量与残留的凝乳酶活力有关,残留的凝乳酶可水解干酪中的酪蛋白生成大分子肽,进一步作用生成小分子肽、游离氨基酸以及风味化合物,而风味物质的前体物质是氨基酸。因此氨基酸含量的多少可作为乳蛋白质深度水解的标志。从表4可以看出,在2 组干酪中共检测到29 种氨基酸,但其含量差别很大,其中对照组干酪含有少量的天冬氨酸,而实验组干酪没有检测到;实验组干酪含有少量的瓜氨酸、蛋氨酸、α-氨基己二酸和胱氨酸,而在对照组干酪中未检测到。对照组干酪含量相对较高的氨基酸分别为苯丙氨酸、亮氨酸、肌肽和精氨酸,而实验组干酪中含量相对较高的氨基酸分别为磷酸丝氨酸、苏氨酸、组氨酸、鸟氨酸和赖氨酸。总体来看,实验组干酪游离氨基酸总量(76 mg/100 g)高于对照组干酪游离氨基酸总量(55.3 mg/100 g)。因为在干酪成熟过程中乳球菌菌体发生自溶后会释放出肽酶,可能是实验组干酪中乳球菌自溶产生的肽酶活力较高所致。游离氨基酸是风味物质的主要前体,这有助于干酪形成独特的风味,对干酪的滋味和香味都有促进作用[22]。
2.2.5 干酪成熟过程中质构的变化
在干酪成熟后,其质构特性如硬度、内聚性、弹性、咀嚼性和胶黏性等均有所变化。研究报道αS1-酪蛋白的分解是导致干酪的组织状态和质构产生差异的重要原因[23]。此外,在干酪成熟中后期过程中,随着pH值的升高,钙离子较易从凝胶网状结构中溶解出来,导致胶束的网状结构被破坏,使得干酪结构变得松散[24]。由表5可知,实验组干酪的硬度、内聚性、弹性、咀嚼性和胶黏性均大于对照组,其中咀嚼性和胶黏性差异较明显,其他差异不明显,说明实验组添加菌株GSBa-1凝乳酶的干酪质构品质优于对照组。
表5 干酪成熟后硬度、内聚性、弹性、咀嚼性和胶黏性的质构分析
Table 5 Hardness, cohesiveness, springiness, chewiness and adhesiveness of Mozzarella cheeses after ripening at 4 ℃

质构参数 干酪A 干酪B硬度/g 3 813.67±160.67 3 860.33±275.00内聚性/g 0.50±0.05 0.64±0.03弹性/mm 3.90±0.68 4.58±0.80咀嚼性/mJ 44.83±3.22 77.89±17.40胶黏性 0.11±0.02 0.38±0.44
2.2.6 干酪成熟前后微观结构的变化
在干酪成熟过程中,发酵剂中乳球菌发生自溶现象从而形成胞内和胞外酶,在这些酶以及残存的凝乳酶作用下,乳蛋白不断降解形成不同大小的孔洞,干酪中蛋白质和水分重新分布,从而对干酪微观结构造成影响[25]。由图3可知,菌株GSBa-1凝乳酶对干酪微观结构的形成作用很大。研究表明,2 组干酪成熟前期由于酪蛋白彼此结合聚集,凝胶结构形成大小不均一的空穴,在干酪成熟后,酪蛋白形成的凝胶网状结构发生变化,导致干酪的微观结构发生明显改变。对照组和实验组干酪从成熟前到成熟后,干酪的网状结构逐渐减弱,较大的孔洞逐渐消失,凝胶结构变得连续而紧密。有研究报道,孔周围的干酪组织结构主要是由钙磷酸盐和副酪蛋白组织、含有重叠和交错连接部分溶融的副酪蛋白聚合体构成[24]。这是由于在干酪中添加不同凝乳酶作用导致的,菌株GSBa-1凝乳酶和商品凝乳酶来源不同,其酶学性质和凝乳特性也不相同,导致其制作的干酪在成熟前后的微观结构也会有所差异。
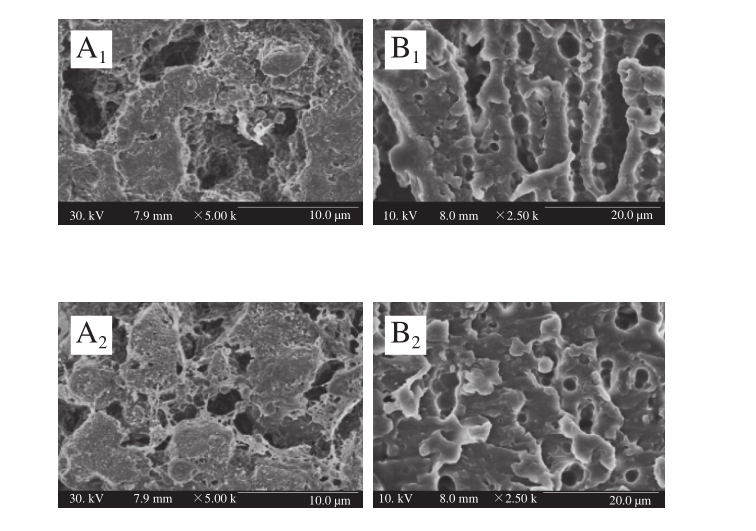
图3 干酪成熟过程中微观结构的变化
Fig. 3 Microstructure change of cheeses during the ripening period
A.干酪A;B.干酪B。下标1.成熟前(0 d);2.成熟后(30 d)。
表6 干酪成熟过程中挥发性风味物质的变化
Table 6 Change in volatile compounds during ripening of cheeses

注:—.未检测到。MS.在质谱谱库检索定性;RI.由保留指数定性。
保留时间/min 保留指数 结构式 匹配度 干酪A 干酪B 定性方法酮类11.47 718 C4H8O2 872 3-羟基-2-丁酮 3-羟基-2-丁酮 MS、RI 20.62 1 041 C8H8O 944 苯乙酮 苯乙酮 MS、RI醛类11.36 1 006 C8H16O 888 — 辛醛 MS、RI 14.24 1 104 C9H18O 800 壬醛 壬醛 MS、RI 17.02 1 209 C10H20O 875 癸醛 癸醛 MS、RI脂肪酸16.32 600 C2H4O2 900 — 乙酸 MS、RI 19.5 848 C4H8O2 852 丁酸 丁酸 MS、RI 29.55 1 279 C8H16O2 924 — 辛酸 MS、RI 31.6 1 275 C9H18O2 841 — 壬酸 MS、RI酯类2.51 628 C4H8O2 930 乙酸乙酯 乙酸乙酯 MS、RI 20.09 1 299 C4H6O2 878 丁内酯 — MS、RI醇类3.11 668 C2H6O 889 — 乙醇 MS、RI 17.47 1 187 C9H20O 950 — 2-壬醇 MS、RI 25.41 1 039 C7H8O 900 苯甲醇 苯甲醇 MS、RI 26.31 1 118 C8H10O 930 — 苯乙醇 MS、RI烷烃4.91 1 100 C11H24 879 十一烷 十一烷 MS、RI 11.66 1 400 C14H30 883 十四烷 十四烷 MS、RI 21.86 1 900 C19H40 894 十九烷 十九烷 MS、RI 24.07 1 500 C15H32 868 十五烷 十五烷 MS、RI 26.21 1 700 C17H36 871 — 十七烷 MS、RI其他10.46 893 C8H8 910 — 苯乙烯 MS、RI
由表6可以看出,2 组干酪样品在成熟后共检测出21 种化合物,其中烷烃类物质5 种、脂肪酸类4 种、酮类2 种、醛类3 种、醇类4 种、酯类物质2 种、其他含苯环化合物1 种。实验组干酪风味物质的种类多于对照组干酪,其中含量较高的是脂肪酸类、醇类和烷烃类化合物。这是由于添加不同凝乳酶的水解作用不同,菌株GSBa-1凝乳酶蛋白水解活力稍强,产生更多的风味物质。在发酵剂微生物和蛋白酶的共同作用下,干酪中的乳蛋白、乳脂肪和碳水化合物发生一系列错综复杂的生化反应,形成干酪独特的风味物质。
从表6可知,2 组干酪在成熟后都有较多的烃类化合物,它们主要来源于原料乳本身[26],而不是在干酪成熟过程中产生的,烃类化合物在所有干酪中都普遍存在,且种类较多,但由于烃类化合物的芳香阈值较高,因此这些化合物对风味的贡献较小。酮类化合物一般由多不饱和脂肪酸的氧化或热降解产生,也可由氨基酸降解或微生物代谢产生,其对于干酪的风味影响较大。2 组干酪中都有的酮类物质如3-羟基-2-丁酮,赋予干酪奶油的香味[27],一般是由柠檬酸代谢过程中产生的二乙酸转化而来。一般醛类物质的阈值较低,是食品氧化风味的主要来源。2 组干酪中都含有壬醛和癸醛,其中壬醛在干酪中较普遍存在,其能赋予干酪青草味和新鲜味。实验组干酪还检测到辛醛,而对照组干酪中未检测到,可能菌株凝乳酶蛋白水解活力稍强,生成某种中间产物,进而转化成辛醛,使得实验组干酪风味更独特。乙酸在实验组干酪中有检测到,其对干酪的风味影响较大,赋予干酪醋味,它是由乳酸或柠檬酸在发酵剂菌株的作用下生成的。丁酸在2 组干酪中均有检测到,赋予干酪奶油气味;实验组干酪中酸类物质含量较多,此外还检测到表现出体臭味的辛酸。醇类化合物一般具有水果芳香或植物香的香气,但一般醇类化合物的阈值较高,对干酪风味的贡献较小。但醇类化合物可与脂肪酸进一步反应形成酯类物质,因此可间接对干酪风味产生影响。实验组干酪中检测到的醇类物质明显多于对照组,可见菌株凝乳酶对干酪的风味影响较大。酯类是在干酪中很重要的呈香类物质,可赋予干酪独特的花草香味、水果香味以及甜味,此外还可缓和因中链、短链脂肪酸浓度较大引起的刺激性味道,从而使得干酪风味更加柔和[28]。2 组干酪在成熟后检测到的酯类物质为乙酸乙酯,对照组干酪检测到丁内酯,而实验组干酪中未检测到。乙酯类化合物是由乙醇和脂肪酸反应生成,因此干酪中的水果味可认为是由乙醇或它的前体物过量产生的。2 组干酪中含苯环的化合物种类较少,对照组干酪有0 种,实验组有1 种。
2.4.1 保形性实验结果
由图4可知,对照组干酪样品的保形性为(50.67±1.76)%,实验组干酪样品的保形性为(51.56±1.02)%,参照表2用于后续的综合评分。
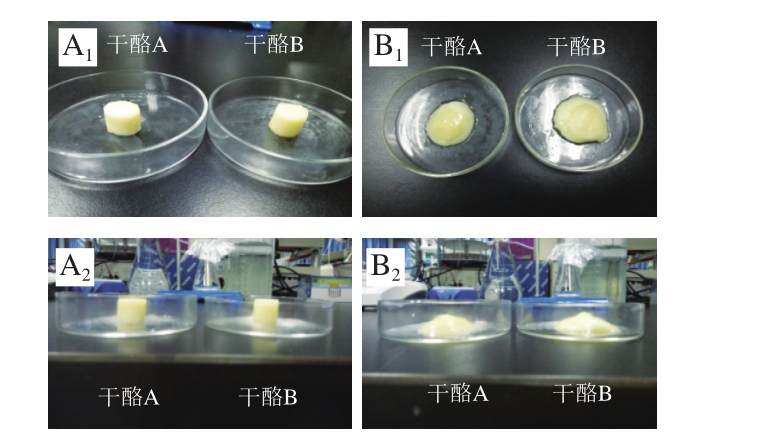
图4 干酪样品保形性效果
Fig. 4 Conformality of cheese samples
A.加热前;B.加热后;下标1.上方拍摄;2.侧面拍摄。
2.4.2 拉丝性实验结果

图5 干酪样品拉丝性效果
Fig. 5 Stringiness of cheese samples
由图5可知,2 组干酪样品从烘箱中取出时迅速进行拉丝性测试,准确量取拉丝后干酪丝的长度得出,对照组干酪拉丝后长度为(145.67±4.04)mm,实验组干酪拉丝后长度为(146±5.29)mm;此外,对照组拉丝后拉丝数为2 根,实验组拉丝后拉丝数为1 根。
表7 干酪感官评定结果
Table 7 Sensory evaluation of cheeses
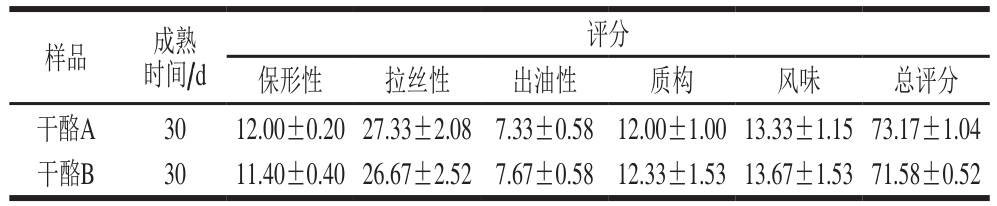
样品 成熟时间/d评分保形性 拉丝性 出油性 质构 风味 总评分干酪A 30 12.00±0.20 27.33±2.08 7.33±0.58 12.00±1.00 13.33±1.15 73.17±1.04干酪B 30 11.40±0.40 26.67±2.52 7.67±0.58 12.33±1.53 13.67±1.53 71.58±0.52
由表7可知,实验组干酪与对照组干酪相比,口感和风味较好,这也与前面风味物质的测定结果相一致。2 组干酪样品实验得到保形性、拉丝性、出油性和总评分相比较,对照组稍好,但差异不明显。总体来看,解淀粉芽孢杆菌GSBa-1凝乳酶能在一定程度上可以代替小牛凝乳酶应用于马苏里拉干酪的生产。
对照组和实验组干酪由于添加的凝乳酶不同,制作的干酪理化成分稍有差异。添加菌株凝乳酶制得的干酪得率为8.84%,水分质量分数为46.82%,盐质量分数为1.52%,蛋白质量分数为28.29%,脂肪质量分数为30.61%,与对照组干酪差异不大。实验组干酪的乳球菌菌落数略高于对照组干酪,可能是由于菌株GSBa-1凝乳酶的蛋白水解产物有利于乳球菌繁殖。对干酪成熟过程中pH 4.6可溶性氮的变化进行分析,实验组干酪pH 4.6可溶性蛋白含量较多,表明菌株GSBa-1凝乳酶对乳蛋白的分解能力较强,呈现较多的风味前体物质,实验组干酪的游离氨基酸总量(76 mg/100 g)高于对照组干酪(55.3 mg/100 g)。
通过对成熟后2 组干酪质构的测定,实验组干酪的质构特性均大于对照组,其中咀嚼性和胶黏性差异较明显。此外,实验组干酪所使用的菌株GSBa-1凝乳酶具有的蛋白水解能力稍强,导致实验组干酪风味物质的种类多于对照组干酪,其中含量较高的是脂肪酸类、醇类和烷烃类的化合物,使得实验组干酪的风味物质更加丰富。通过对干酪样品的保形性和拉丝性实验测定,结果表明,2 组干酪性能差异不大;进一步对2 种干酪进行感官评定,其总评分接近,表明2 种凝乳酶在用于马苏里拉干酪的制作中差异不明显。综上,解淀粉芽孢杆菌GSBa-1凝乳酶在一定程度上可代替小牛凝乳酶应用于马苏里拉干酪的生产。
[1] 李亮, 吴丹, 宿玲恰, 等. 重组毕赤酵母生产凝乳酶发酵优化[J]. 食品与生物技术学报, 2016, 35(5): 457-464. DOI:10.3969/j.issn.1673-1689.2016.05.002.
[2] 杭峰, 洪青, 王钦博, 等. 凝乳酶的研究进展[J]. 食品科学, 2016,37(3): 273-279. DOI:10.7506/spkx1002-6630-201603047.
[3] 普燕, 张富春. 干酪用牛凝乳酶替代品的研究进展[J]. 食品与发酵工业, 2015, 41(5): 227-234. DOI:10.13995/j.cnki.11-1802/ts.201505041.
[4] 潘道东, 韩玲玲. 根霉凝乳酶的分离纯化及其酶学特性研究[J]. 中国食品学报, 2011, 11(2): 53-59. DOI:10.3969/j.issn.1009-7848.2011.02.008.
[5] 宋曦, 甘伯中, 贺晓玲, 等. 天祝放牧牦牛生活环境土壤中一株产凝乳酶细菌的分离与鉴定[J]. 食品科学, 2009, 30(11): 158-162.DOI:10.3321/j.issn:1002-6630.2009.11.035.
[6] 丁明亮, 欧阳安然, 王望斐, 等. 枯草芽孢杆菌产凝乳酶发酵条件的优化[J]. 食品科学, 2011, 32(3): 156-160.
[7] 高维东, 甘伯中, 丁福军, 等. 微生物凝乳酶的研究进展[J]. 中国乳品工业, 2009, 37(5): 34-47. DOI:10.3969/j.issn.1001-2230.2009.05.010.
[8] 李学朋, 关明玲, 赵保堂, 等. 米黑毛霉酶凝干酪素生产工艺参数的优化研究[J]. 食品工业科技, 2016, 37(3): 191-195. DOI:10.13386/j.issn1002-0306.2016.03.032.
[9] ZHAO X, WANG J, ZHENG Z, et al. Production of a milk-clotting enzyme by glutinous rice fermentation and partial characterization of the enzyme[J]. Journal of Food Biochemistry, 2015, 39(1): 70-79.DOI:10.1111/jfbc.12108.
[10] DA SILVA R R, SOUTO T B, DE OLIVEIRA T B, et al. Evaluation of the catalytic specificity, biochemical properties, and milk clotting abilities of an aspartic peptidase fromRhizomucor miehei[J]. Journal of Industrial Microbiology & Biotechnology, 2016, 43(8): 1059-1069.DOI:10.1007/s10295-016-1780-4.
[11] 李建涛, 陈历俊, 姜铁民. 响应面法优化解淀粉芽孢杆菌发酵产凝乳酶的工艺条件[J]. 中国乳品工业, 2012, 40(6): 26-30.DOI:10.3969/j.issn.1001-2230.2012.06.007.
[12] 腾军伟, 赵笑, 杨亚威, 等. 酒曲中产凝乳酶微生物菌株的分离筛选及鉴定[J]. 食品科学, 2017, 38(16): 23-28. DOI:10.7506/spkx1002-6630-201716004.
[13] 腾军伟, 杨贞耐. 解淀粉芽孢杆菌GSBa-1产凝乳酶培养基组成的优化[J]. 食品科学技术学报, 2016, 34(4): 31-38. DOI:10.3969/j.issn.2095-6002.2016.04.006.
[14] 腾军伟, 余志坚, 陈超, 等. 影响解淀粉芽孢杆菌GSBa-1产凝乳酶的因素及发酵条件优化研究[J]. 中国食品添加剂, 2016(8): 53-62.DOI:10.3969/j.issn.1006-2513.2016.08.002.
[15] 腾军伟, 郑喆, 梅雪洋, 等. 解淀粉芽孢杆菌GSBa-1凝乳酶的生产及其酶学性质研究[J]. 食品与发酵工业, 2016, 42(12): 83-89.DOI:10.13995/j.cnki.11-1802/ts.201612015.
[16] JOHNSON M, LUCEY J. Major technological advances and trends in cheese[J]. Journal of Dairy Science, 2006, 89(4): 1174-1178.DOI:10.3168/jds.S0022-0302(06)72186-5.
[17] 杨亚威. 产胞外多糖乳酸菌的益生特性及其对成熟干酪品质的影响[D]. 北京: 北京工商大学, 2016.
[18] 赵笑. 酒曲中微生物产凝乳酶的特性及其应用研究[D]. 北京: 北京工商大学, 2015.
[19] YUN J J, KIELY L J, BARBANO D M, et al. Mozzarella cheese:impact of cooking temperature on chemical composition, proteolysis and functional properties 1[J]. Journal of Dairy Science, 1993, 76(12):3664-3673. DOI:10.3168/jds.S0022-0302(93)77708-5.
[20] FORTIN M H, CHAMPAGNE C P, ST-GELAIS D, et al. Effect of time of inoculation, starter addition, oxygen level and salting on the viability of probiotic cultures during Cheddar cheese production[J].International Dairy Journal, 2011, 21(2): 75-82. DOI:10.1016/j.idairyj.2010.09.007.
[21] DIEZHANDINO I, FERNANDEZ D, GONZALEZ L, et al.Microbiological, physico-chemical and proteolytic changes in a Spanish blue cheese during ripening[J]. Food Chemistry, 2015, 168:134-141. DOI:10.1016/j.foodchem.2014.07.039.
[22] BORSTING M W, OVIST K B, RASMUSSEN M, et al. Impact of selected coagulants and starters on primary proteolysis and amino acid release related to bitterness and structure of reduced-fat Cheddar cheese[J]. Dairy Science & Technology, 2012, 92(5): 593-612.
[23] O'MAHONY J A, LUCEY J A, MCSWEENEY P L H. Chymosinmediated proteolysis, calcium solubilization, and texture development during the ripening of Cheddar cheese[J]. Journal of Dairy Science,2005, 88(9): 3101-3114. DOI:10.3168/jds.S0022-0302(05)72992-1.
[24] SOODAM K, ONG L, POWELL I B, et al. Effect of calcium chloride addition and draining pH on the microstructure and texture of full fat Cheddar cheese during ripening[J]. Food Chemistry, 2015, 181: 111-118. DOI:10.1016/j.foodchem.2015.01.135.
[25] ONG L, DAGASTINE R R, KENTISH S E, et al. The effect of pH at renneting on the microstructure, composition and texture of Cheddar cheese[J]. Food Research International, 2012, 48(1): 119-130.DOI:10.1016/j.foodres.2012.02.020.
[26] 艾对, 张富新, 李延华, 等. 顶空固态微萃取-气质联用法分析羊乳和牛乳中挥发性化合物[J]. 食品与发酵工业, 2014, 40(10): 189-193.
[27] WOLfiV, PEROTTI M C, ZALAZAR C A. Composition and volatile profiles of commercial Argentinean blue cheeses[J]. Journal of the Science of Food and Agriculture, 2011, 91(2): 385-393.DOI:10.1002/jsfa.4198.
[28] 李良. 乳酸乳球菌发酵稀奶油过程中甲基酮的合成代谢调控[D].哈尔滨: 哈尔滨工业大学, 2015.
Application of Rennet from Bacillus amyloliquefaciens GSBa-1 in Mozzarella Cheese
TENG Junwei, LIU Zhenmin, SU Miya, et al. Application of rennet from Bacillus amyloliquefaciens GSBa-1 in Mozzarella cheese[J]. Food Science, 2019, 40(6): 85-92. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180128-383. http://www.spkx.net.cn