 。耐盐性分析结果采用OriginPro 8进行绘图。
。耐盐性分析结果采用OriginPro 8进行绘图。酱油是以大豆、面粉等为主要原料酿造而成的一种传统调味品[1]。随着人们消费水平的不断提高,对酱油风味提出了更高的要求[2]。近年来,在酱油风味物质的分析方法[3]、风味成分的组成[4-6]以及在酱油发酵各阶段风味成分的形成机理[7-8]等领域开展了广泛研究。酱油的呈味物质包括氨基酸、糖、有机酸、酯类、醇类、黄酮类等物质,其香气成分包括挥发性、半挥发性酸类、酯类、醇类、醛酮类、酚类、杂环类化合物等[9-11]。由于酵母的代谢作用,酱油中醇类物质的种类非常丰富,这些醇类成分对酱油独特风味的形成有重要作用[12]。
在酱油挥发性风味化合物研究中,2-苯乙醇作为一种常见香气成分被检出[5,13-14],2-苯乙醇特有的玫瑰样香气对酱油风味的形成起重要作用[15]。酵母菌合成2-苯乙醇的代谢途径主要有莽草酸途径和艾氏途径;莽草酸途径是酿酒酵母从头合成2-苯乙醇的代谢途径,底物是糖酵解途径的磷酸烯醇式丙酮酸和磷酸戊糖途径的4-磷酸赤藓糖;艾氏途径是酵母以L-苯丙氨酸为前体,通过氨基转移酶和脱羧酶合成2-苯乙醇[16]。吴雅男[17]研究发现鲁氏酵母是酱油中2-苯乙醇等化合物代谢合成的关键微生物;冯杰[18]报道了1 株耐高盐增香酵母菌埃切假丝酵母菌(Candida etchellsiiCICIM Y0600)在酱油发酵过程中可以合成2-苯乙醇。崔瑞迎等[19]发现耐盐酵母菌(Zygosaccharomyces rouxii CGMCC 3791)接种酱醪发酵,最终酱醪中的2-苯乙醇质量浓度显著增加。目前对于酱油特征风味成分2-苯乙醇的研究主要集中在该成分的检出[20-21]以及微生物添加引起的酱油风味成分(包含2-苯乙醇)变化[22-24]。对于以提升酱油2-苯乙醇含量为目的,对2-苯乙醇产生菌进行分离筛选和应用的报道较少。
本研究从发酵醪样品中分离筛选到1 株产2-苯乙醇的酵母922-1,并采用生理生化测试和分子生物学方法对其进行鉴定。研究922-1在不同盐度培养基中的生长情况,阐明922-1代谢2-苯乙醇的生化途径。922-1添加酱醪发酵实验显示出922-1在提升酱油发酵醪中2-苯乙醇质量浓度,改善酱油香气和口感方面具有广阔应用前景。
酱油发酵醪样品取自李锦记(新会)食品有限公司。
麦芽汁培养基:5%麦芽浸粉,1%酵母抽提物;酱醪发酵液培养基:取发酵2 周酱油发酵醪,200 目纱网过滤,过滤清液5 000 r/min离心10 min,上清液即为酱醪发酵培养基。
酵母筛选平板 广东环凯微生物科技有限公司;生理生化实验试剂、苯乙醇(色谱纯) 生工生物工程(上海)股份有限公司;麦芽浸粉、琼脂粉 北京陆桥技术股份有限公司;其他生化试剂均为分析纯 广州化学试剂厂。
7820A-5977B气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)联用分析系统(色谱柱DB-WA×U2(30 m×0.32 mm,0.25 µm)) 美国安捷伦公司;5732-U固相微萃取小柱(50/30 µm,DVB/CAR/PDMS) 美国色谱科公司。
1.3.1 产香酵母的分离
取不同发酵阶段的酱油发酵醪,生理盐水梯度稀释后涂布酵母筛选平板,30 ℃静置培养72 h,挑取单菌落进行进一步划线分离纯化。纯化后菌株接种麦芽汁培养基,30 ℃、150 r/min振荡培养96 h,进行香气鉴评,将具有独特花香发酵液对应的酵母菌株命名为922-1。
1.3.2 产香酵母922-1风味成分分析
挑取922-1单菌落接种于麦芽汁培养基,30 ℃、200 r/min振荡培养48 h,得到922-1种子培养液。将种子培养液按5%接种到酱醪发酵液培养基,30 ℃、100 r/min振荡培养14 d,发酵液顶空固相微萃取(solidphase microextraction,SPME)样品进行GC-MS分析,具体方法如下:
取2 mL样品于4 mL样品瓶,采用固相微萃取小柱顶空萃取30 min,然后立即进样进行GC-MS分析。气相色谱载气为氦气,流速1.0 mL/min,固相微萃取小柱进样时间为2 min,不分流,吹扫流量15 mL/min,吹扫2 min,色谱柱升温程序为:40 ℃保持5 min;以2 ℃/min升温到150 ℃,保留0 min;再以5 ℃/min升温到240 ℃,保留10 min。质谱采用电子电离方式,电离能为70 eV,检测器电压为857 V,扫描范围为m/z 20~350,扫描速率为2.00 scans/s;进样口和离子源温度分别为250 ℃和230 ℃。
1.3.3 生理生化实验
参考《酵母菌的特征与鉴定手册》[25]对922-1进行生理生化实验。
1.3.4 转录间隔区(internal transcribed spacer,ITS)序列聚合酶链式反应(polymerase chain reaction,PCR)扩增与系统进化树构建
自菌株9 2 2-1基因组P C R扩增r D N A-I T S序列。3 0 μ L P C R体系:2 0 n g D N A模板(菌株9 2 2-1基因组),2 5 p m o l通用引物(I T S 1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′),100 μmol/L dNTP,1 mmol/L MgCl2和2.5 U HiFi DNA聚合酶,PCR产物由华大基因测序。通过BLAST(http://blast.ncbi.nlm.nih.gov/)数据库获得来源于不同菌株的ITS rDNA同源序列,采用Clustal X[26]对上述序列进行多重序列比对,比对结果用MEGA 4软件,采用邻接法构建系统进化树[27-28]。
1.3.5 922-1耐盐性实验
挑取922-1单菌落接种于麦芽汁培养基,30 ℃、200 r/min振荡培养48 h,得到922-1种子培养液。将种子培养液按5%分别接种含0%、5%、10%、14%、16%、18% NaCl的麦芽汁培养基,30 ℃、200 r/min振荡培养,按一定时间间隔取培养液在600 nm波长处测定OD值。
1.3.6 922-1添加不同培养基发酵实验
挑取922-1单菌落接种于麦芽汁培养基,30 ℃、200 r/min振荡培养48 h,得到922-1种子培养液。取200 mL种子培养液4 000 r/min离心8 min,菌体沉淀采用0.85%生理盐水洗涤3 遍,再用0.85%生理盐水重悬,并定容到200 mL。种子悬液按5%分别接种到两组培养基,对照组不接种。第1组包括以苯丙氨酸为唯一氮源、以硫酸铵为唯一氮源、麦芽汁培养基、麦芽汁培养基添加苯丙氨酸4 种培养基;第2组包括酱油发酵醪、酱油发酵醪加苯丙氨酸2 种培养基。30 ℃、200 r/min振荡培养24 h,将转速降为80 r/min,继续培养28 d。取5 mL培养液,加入30 mL乙醚,萃取3 次;收集上层萃取液真空浓缩,并溶于无水乙醇,根据浓度合理稀释并用GC-MS进行定量分析。GC-MS具体操作方法如下:
气相色谱载气为氦气,流速1.0 mL/min,进样量1.0 µL,分流比为10∶1,色谱柱升温程序为:60 ℃,保留1 min;以8 ℃/min升温到220 ℃,保留0 min;再以4 ℃/min升温到250 ℃,保留2 min。质谱采用电子电离方式,电离能为70 eV,检测器电压为857 V,扫描范围为m/z 50~400,扫描速率为2.00 scans/s;进样口和离子源温度分别为250 ℃和230 ℃。采用SIM模式,以m/z 91.1和122.0两个离子为定量离子进行分析。2-苯乙醇标准曲线方法为:取色谱纯苯乙醇梯度稀释到质量浓度10、20、50、80、100 mg/L,采用上述色谱和质谱条件检测不同质量浓度苯乙醇的定量离子峰面积,线性回归得到标准曲线方程为:y=4.514×104x-1.312×105(R2=0.999 59)。进而以标准曲线计算样品中2-苯乙醇含量。
1.3.7 感官评价
由10 位在酱油风味鉴评方面具有丰富经验的技术人员,对不同生酱油样品进行盲评。香气方面分别从酸味、豆香、麦芽香、焦香、醇香、综合香气6 个维度对样品进行评分;口感方面分别从咸味、鲜味、苦味、甜味、酸味、厚味、综合口感7 个维度对样品进行评分。取各维度评分的平均数,用Microsoft Office Excel绘制雷达图。
GC-MS总离子流图为GC-MS数据处理软件导出,并将主要检出峰的鉴定结果标注在离子流图上。耐盐性分析实验及苯乙醇测定均设置3 个平行样,结果显示为 。耐盐性分析结果采用OriginPro 8进行绘图。
。耐盐性分析结果采用OriginPro 8进行绘图。
酱油发酵液接种922-1种子培养液连续发酵28 d,采用SPME-GC-MS对挥发性风味成分进行检测,结果如图1所示。实验组挥发性成分中醇类物质种类和含量相对对照组明显增加,特别是乙醇、异戊醇、2-苯乙醇增加显著,其中2-苯乙醇增幅最大(表1);小分子有机酸醋酸和异丁酸的含量也明显增加。表明在有氧的情况下922-1可在酱油发酵醪中代谢产生醇类物质和少量有机酸,2-苯乙醇是其主要代谢产物。
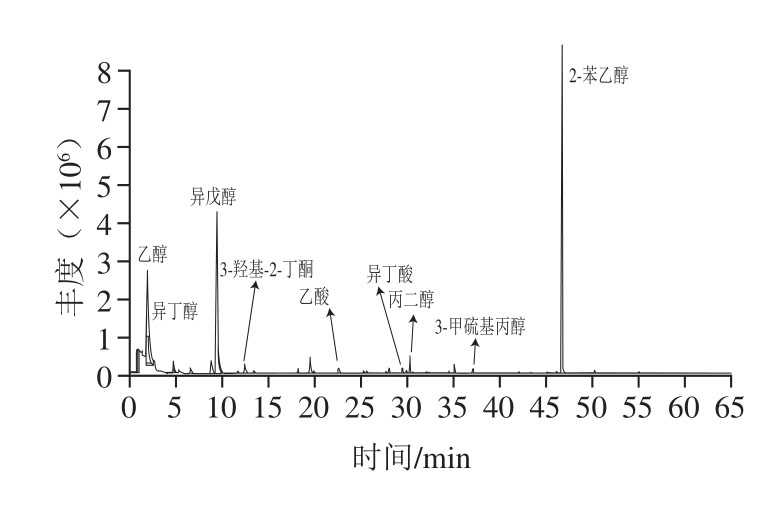
图1 产香酵母922-1风味成分GC-MS分析
Fig. 1 Analysis of fl avor components from 922-1 by GC-MS
表1 产香酵母922-1挥发性风味成分相对定量分析
Table 1 Relative quantitative analysis of volatile fl avor compounds from 922-1
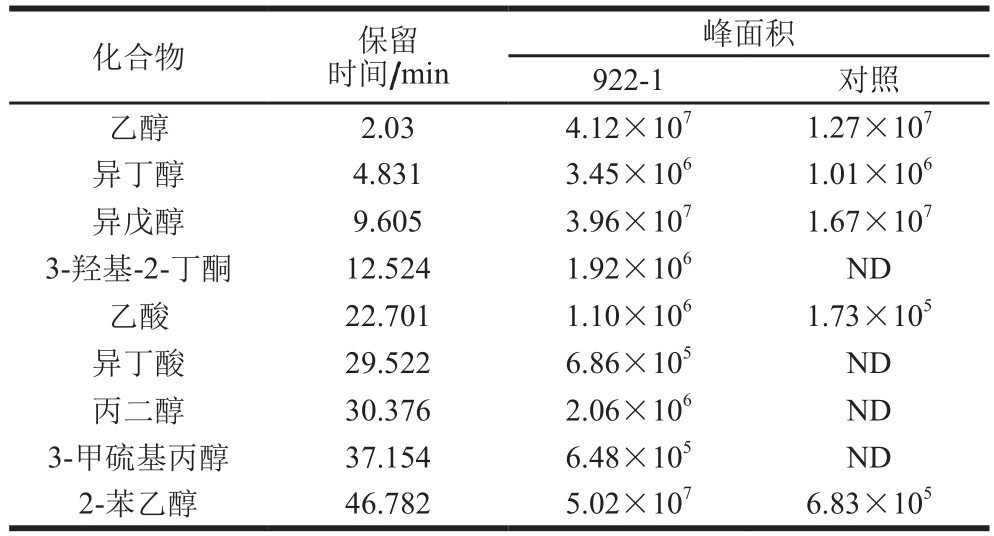
注:ND.未检测到。
峰面积922-1 对照乙醇 2.03 4.12×107 1.27×107异丁醇 4.831 3.45×106 1.01×106异戊醇 9.605 3.96×107 1.67×107 3-羟基-2-丁酮 12.524 1.92×106 ND乙酸 22.701 1.10×106 1.73×105异丁酸 29.522 6.86×105 ND丙二醇 30.376 2.06×106 ND 3-甲硫基丙醇 37.154 6.48×105 ND 2-苯乙醇 46.782 5.02×107 6.83×105化合物 保留时间/min
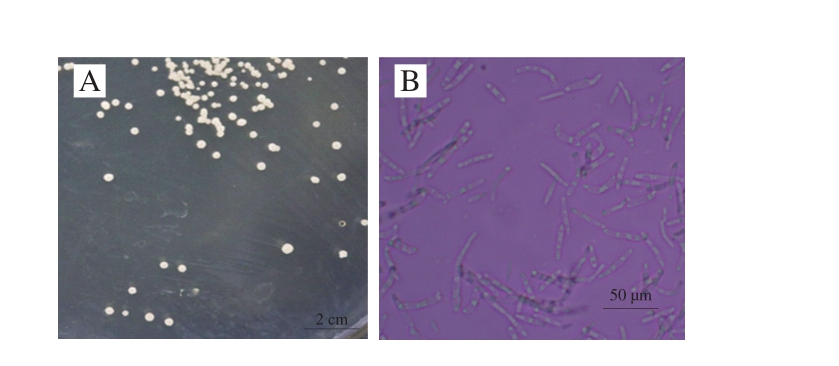
图2 产香酵母922-1菌落形态(A)与菌体形态(B)
Fig. 2 Colonial morphology (A) and thallus morphology (B) of 922-1
如图2A所示,产香酵母922-1在麦芽汁平板上菌落浅黄色,奶酪状,边缘光滑,微隆起。显微镜观察发现922-1菌体具有椭球状和丝状两种存在状态,大部分以丝状存在,并可见明显分枝(图2B)。根据922-1菌落特征和菌丝状态推测其为假丝酵母属微生物。
如表2所示,922-1发酵葡萄糖、半乳糖和木糖的能力较弱,不能发酵麦芽糖、阿拉伯糖等糖类物质,与已报道Candida oceaniMo39[29]糖发酵测试结果相似。922-1同化糖类物质的能力较强,除乳糖和淀粉外,其可以同化已测试全部糖类;C. oceaniMo39不能同化蜜三糖,其他测试结果与922-1相同。922-1与C. oceaniMo39均不能同化肌醇、DL-乳酸,但均可以同化赤藓醇、甘露醇、山梨醇、甘油、乙醇、柠檬酸盐和水杨苷。922-1可同化琥珀酸盐,微弱同化葡萄糖酸盐,但C. oceaniMo39同化琥珀酸盐的能力较弱,不能同化葡萄糖酸盐。922-1可以同化硝酸钠,脲酶测试为阳性,可在18%氯化钠中增殖,50%葡萄糖中增殖缓慢,1%乙酸测试为阴性;C. oceani Mo39脲酶测试为阴性。上述测试结果表明,922-1与C. oceaniMo39的生理生化特性具有较大的相似性。
表2 产香酵母922-1生理生化测试结果
Table 2 Physiological and biochemical identi fi cation of 922-1

注:+.阳性;-.阴性;w.弱;s.慢;nd.未检测。
碳源发酵实验结果922-1 Mo39[29] 922-1 Mo39[29] 922-1 Mo39[29] 922-1 Mo39[29]葡萄糖 w w 葡萄糖 + + 蔗糖 + + 甘油 + +半乳糖 w - 半乳糖 + + 麦芽糖 + + 山梨醇 + nd木糖 w nd 果糖 + nd 乳糖 - - 乙醇 + +阿拉伯糖 - - 阿拉伯糖 + s 松三糖 + + 琥珀酸盐 + s, w麦芽糖 - - 核糖 + s 蜜三糖 w - 柠檬酸盐 + +蔗糖 - - 鼠李糖 + + 可溶性淀粉 - -DL-乳酸 - -乳糖 - - 木糖 + + 赤藓醇 + + 葡萄糖酸盐 w -海藻糖 - - 海藻糖 + + 甘露醇 + + 水杨苷 + +蜜三糖 - nd 纤维二糖 + + 肌醇 - -结果 碳源同化实验结果 碳源同化实验结果 碳源同化实验氮源同化实验结果 结果结果922-1 Mo39[29] 922-1 Mo39[29] 922-1 Mo39[29] 922-1 Mo39[29]硝酸钠 + nd 脲酶 + - 37°C - - 1%乙酸 - nd 30 ℃ + nd 50%葡萄糖 w nd 无维生素培养 - -35°C w + 18%氯化钠 + nd结果其他实验 其他实验 其他实验
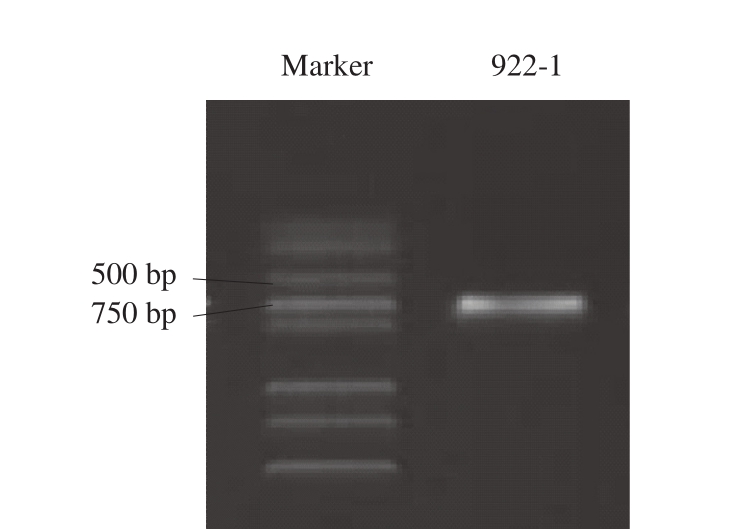
图3 琼脂糖凝胶电泳检测922-1 ITS rDNA序列PCR产物
Fig. 3 Agarose gel electrophoresis of PCR products of ITS rDNA sequence from 922-1
为进一步鉴定922-1的分类学地位,对其ITS rDNA序列进行克隆,PCR扩增产物琼脂糖凝胶电泳结果如图3所示,显示其片段长度约750 bp。DNA测序结果表明PCR扩增到的ITS rDNA序列长度为665 bp。该序列提交GenBank(登录号:MH493725)并进行BLAST分析,选取同源序列进行系统进化树构建,结果显示922-1与C. oceani聚为一支,表明其与C. oceani亲缘关系较近。Burgaud等[29]在研究大西洋深海微生物C. oceani时发现了相似规律。综合形态学观察、生理生化测试和分子生物学鉴定,初步确定922-1为C. oceani。
如图4所示,NaCl质量分数对C. oceani922-1生长曲线影响显著,随着NaCl质量分数的升高,C. oceani922-1稳定期细胞浓度降低,NaCl质量分数超过14%时,生长延迟期明显延长,NaCl质量分数为18%时,延迟期达到30 h。说明C. oceani922-1具有一定的耐盐性,可以在高含盐发酵食品(18% NaCl)中生长,但细胞增殖速率受到一定程度抑制,稳定期细胞浓度显著降低。
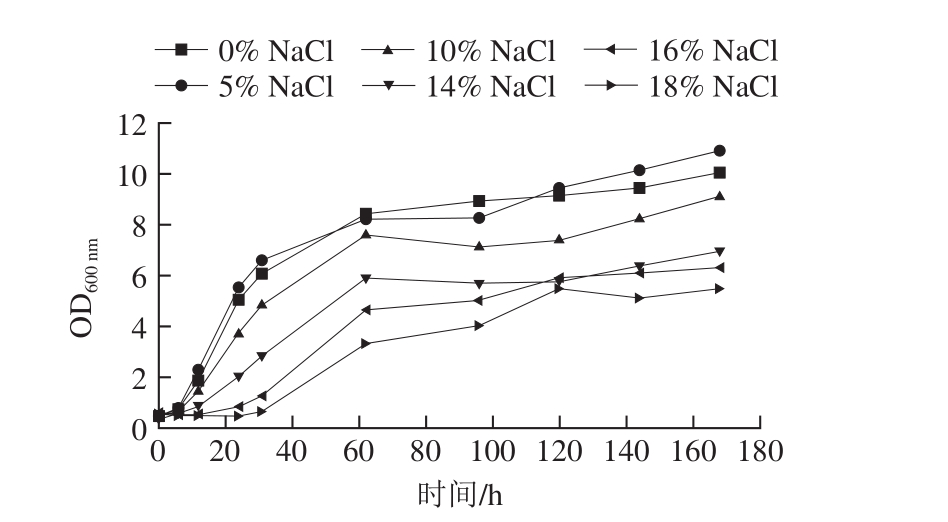
图4C. oceani922-1在不同质量分数NaCl中生长曲线分析
Fig. 4 Growth curves of C. oceani 922-1 at various NaCl concentrations
表3C. oceani 922-1在不同培养基中2-苯乙醇合成质量浓度
Table 3 Production of 2-phenethyl alcohol byC. oceani 922-1 in various media

实验 2-苯乙醇质量浓度/(mg/L)苯丙氨酸为唯一氮源 968.60±19.94硫酸铵为唯一氮源 4.07±0.26麦芽汁培养基 85.60±2.69麦芽汁培养基+苯丙氨酸 620.85±34.86
如表3所示,C. oceani922-1可利用苯丙氨酸作为唯一氮源代谢合成2-苯乙醇,2-苯乙醇质量浓度达到968.60 mg/L;而以硫酸铵为唯一氮源的培养基中2-苯乙醇质量浓度仅为4.07 mg/L,这一结果表明C. oceani922-1主要通过艾氏途径,利用苯丙氨酸作为底物合成苯丙氨酸[16];在麦芽汁培养基上得到了相似的结果。在不加苯丙氨酸的情况下,C. oceani922-1可以在硫酸铵为唯一氮源的培养基中少量合成2-苯乙醇(4.07 mg/L),说明其同时可以通过草莽酸途径合成2-苯乙醇。在不加苯丙氨酸的情况下,C. oceani922-1在麦芽汁培养基中合成2-苯乙醇质量浓度为85.60 mg/L,说明C. oceani922-1艾氏途径代谢所需酶蛋白为组成型表达。但是,在麦芽汁培养基加入苯丙氨酸实验组2-苯乙醇质量浓度低于以苯丙氨酸为唯一氮源实验组,推测C. oceani922-1在其他氮源存在的情况下,2-苯乙醇合成途径受到一定的抑制。
表4C. oceani922-1添加对酱油发酵醪理化指标的影响
Table 4 Effect ofC. oceani922-1 on physicochemical indexes

总酸质量浓度/(g/100 mL)样品 发酵时间/h氨基酸态氮质量浓度/(g/100 mL) pH 可溶性固形物质量分数/%盐分质量浓度/(g/100 mL)还原糖质量浓度/(g/100 mL)实验组 4.5 h 0.83 0.89 5.68 32.1 16.19 4.45对照组 0.84 0.92 5.66 32.7 17.18 4.50实验组 70 d 1.04 1.18 5.36 31.0 17.43 1.95对照组 1.07 1.14 5.39 31.2 17.17 2.40
表5C. oceani922-1添加对酱油发酵醪2-苯乙醇含量的影响
Table 5 Effect ofC. oceani922-1 on content of 2-phenethyl alcohol
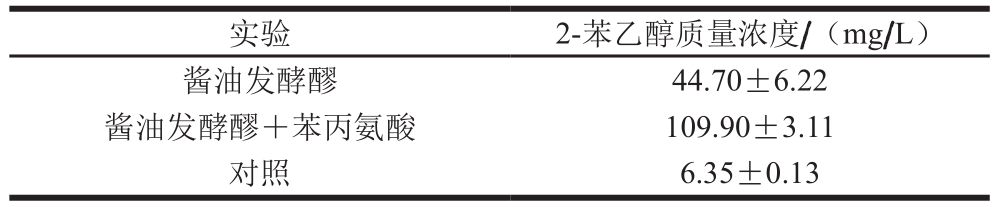
实验 2-苯乙醇质量浓度/(mg/L)酱油发酵醪 44.70±6.22酱油发酵醪+苯丙氨酸 109.90±3.11对照 6.35±0.13
由于C. oceani 922-1具有利用普通培养基代谢合成2-苯乙醇的能力,并能耐受18% NaCl,因此其具有在酱油发酵中应用的潜力。添加C. oceani 922-1种子培养液进行酱油发酵实验,理化指标测定结果如表4所示。发酵70 d后,实验组总酸、氨基酸态氮、pH值和固形物含量情况与对照组相近,还原糖较对照组有一定幅度降低,推测其主要被C. oceani 922-1代谢利用。C. oceani 922-1添加酱油发酵醪发酵28 d,2-苯乙醇质量浓度为44.70 mg/L,较对照组提高了6 倍;添加苯丙氨酸后2-苯乙醇质量浓度进一步提高到109.9 mg/L(表5)。这一结果证实C. oceani 922-1可以在酱油发酵醪中大量合成2-苯乙醇,苯丙氨酸的添加可以将酱油发酵醪中2-苯乙醇质量浓度进一步提高到对照组的17.3 倍。
如图5所示。香气鉴评表明,C. oceani922-1添加发酵可以提升酱油醇香,豆香、麦芽香和焦香差异不显著;添加苯丙氨酸强化2-苯乙醇代谢后,豆香和焦香减弱,推测主要由2-苯乙醇香气的掩盖效应引起。口感方面,由于还原糖的消耗,C. oceani922-1添加发酵生酱油甜味有所降低、酸味减弱。一定程度提升了厚味,咸味、鲜味和苦味变化不显著,综合口感得分明显提高,说明2-苯乙醇质量浓度的变化对味觉提升有一定的辅助作用。添加苯丙氨酸强化2-苯乙醇代谢后,厚味和综合口感得分均有所降低,说明高质量浓度2-苯乙醇不利于酱油口感的改善。
提升和优化酱油风味是满足消费者不断升级的消费需求的重要手段。C. oceani922-1添加发酵提升酱油醇香,对于迎合消费者对酱油香气浓郁、口感醇厚的需求有重要意义;也为特殊香型酱油的开发提供了新的思路。同时,C. oceani922-1在提升其他高盐发酵调味品(如腐乳、豆豉、发酵酱等)的风味品质方面也有较大的应用前景。

图5C. oceani922-1添加对酱油发酵醪风味的影响
Fig. 5 Effect ofC. oceani922-1 on fl avor of soy sauce
A.香气鉴评结果;B.口感鉴评结果。
从酱油发酵醪中分离筛选到1 株可代谢合成2-苯乙醇的酵母,经形态学观察、生理生化测试和分子生物学鉴定,初步确定为C. oceani。C. oceani 922-1可以耐受18%NaCl;其主要通过艾氏途径合成2-苯乙醇,在以苯丙氨酸为唯一氮源的培养基中2-苯乙醇代谢质量浓度可达968.60 mg/L,但在其他氮源存在的情况下,2-苯乙醇合成途径受到一定的抑制。C. oceani 922-1添加酱油发酵醪可一定程度降低发酵液还原糖含量,对其他理化指标影响不显著。C. oceani 922-1添加酱油发酵可使2-苯乙醇代谢量较对照组提高6倍,外加苯丙氨酸后2-苯乙醇含量进一步提高到对照组的17.3 倍。鉴评发现C. oceani 922-1添加发酵生酱油醇香和厚味明显改善,说明其在酱油等高盐发酵调味品风味改善方面有较大的应用前景。
[1] CUI C, ZHAO M M, LI D, et al. Biochemical changes of traditional Chinese-type soy sauce produced in four seasons during processing[J].CyTA-Journal of Food, 2014, 12(2): 166-175. DOI:10.1080/19476337.2013.810673.
[2] 林祖申. 21世纪酱油调味品的发展方向[J]. 中国调味品, 2001(3):6-8. DOI:10.3969/j.issn.1000-9973.2001.03.002.
[3] 陈敏, 蒋予箭, 张海珍, 等. 酿造酱油挥发性风味成分测定方法的建立与组成比较[J]. 中国食品学报, 2011, 11(3): 197-204. DOI:10.3969/j.issn.1009-7848.2011.03.033.
[4] 刘贞诚. 传统酿造酱油风味成分的研究[D]. 广州: 华南理工大学,2012.
[5] 冯云子. 高盐稀态酱油关键香气物质的变化规律及形成机理的研究[D]. 广州: 华南理工大学, 2015.
[6] KIM Y S, KIM E Y, SON H J, et al. Identification of a key umamiactive fraction in modernized Korean soy sauce and the impact thereof on bitter-masking[J]. Food Chemistry, 2017, 233: 256-262.DOI:10.1016/j.foodchem.2017.04.123.
[7] FENG Y Z, CUI C, ZHAO H F, et al. Effect of koji fermentation on generation of volatile compounds in soy sauce production[J].International Journal of Food Science & Technology, 2013, 48(3): 609-619. DOI:10.1111/ijfs.12006.
[8] FENG Y Z, CHEN Z Y, LIU N, et al. Changes in fatty acid composition and lipid profile during koji fermentation and their relationships with soy sauce flavour[J]. Food Chemistry, 2014, 158:438-444. DOI:10.1016/j.foodchem.2014.02.147.
[9] 童佳, 赵国忠, 赵建新, 等. 米曲霉发酵高盐稀态酱油过程中典型挥发性风味物质的形成[J]. 中国酿造, 2017, 36(5): 22-29.DOI:10.11882/j.issn.0254-5071.2017.05.006.
[10] 朱新贵, 李学伟, 曾小波. 典型广式酱油与日式酱油的风味物质差异研究[J]. 中国酿造, 2016, 35(7): 30-35. DOI:10.11882/j.issn.0254-5071.2016.07.007.
[11] GAO X L, ZHAO H F, ZHAO M M, et al. Comparative study on volatile flavor compounds of traditional Chinese-type soy sauces prepared with soybean and defatted soy meal[J]. Food Science &Biotechnology, 2009, 18(6): 1447-1458.
[12] 张博华. 高盐稀态酱油中主要风味物质的研究[D]. 天津: 天津科技大学, 2010.
[13] 包启安. 关于酱油香气成固的研究: 一[J]. 食品科学, 1982, 3(10):3-8; 45.
[14] 冯笑军, 吴惠勤, 黄晓兰, 等. 气相色谱-质谱对天然酿造酱油与配制酱油香气成分的分析比较[J]. 分析测试学报, 2009, 28(6): 661-665.DOI:10.3969/j.issn.1004-4957.2009.06.006.
[15] 济南市轻工研究所. 合成实用香料手册[M]. 北京: 化学工业出版社,1985.
[16] 陈先锐, 王肇悦, 何秀萍. 酵母菌合成2-苯乙醇的研究进展[J]. 生物工程学报, 2016, 32(9): 1151-1163. DOI:10.13345/j.cjb.150539.
[17] 吴雅男. 酱油鲁氏酵母S、S3-2关键风味代谢物对比研究[D]. 天津:天津科技大学, 2015.
[18] 冯杰. 埃切假丝酵母产香机理及其对酱油风味的影响[D]. 无锡:江南大学, 2012.
[19] 崔瑞迎, 郑佳, 何菲, 等. 耐盐乳酸菌和酵母菌强化技术对高盐稀态发酵酱醪品质的影响[J]. 食品与发酵工业, 2013, 39(2): 1-6.DOI:10.13995/j.cnki.11-1802/ts.2013.02.020.
[20] SUN S Y, JIANG W G, ZHAO Y P. Profile of volatile compounds in 12 Chinese soy sauces produced by a high-salt-diluted state fermentation[J]. Journal of the Institute of Brewing, 2010, 116(3): 316-328. DOI:10.1002/j.2050-0416.2010.tb00437.x.
[21] GAO X L, CUI C, ZHAO H F, et al. Changes in volatile aroma compounds of traditional Chinese-type soy sauce during moromi fermentation and heat treatment[J]. Food Science and Biotechnology,2010, 19(4): 889-898. DOI:10.1007/s10068-010-0126-7.
[22] WAH T T, WALAISRI S, ASSAVANIG A, et al. Co-culturing of Pichia guilliermondii enhanced volatile flavor compound formation byZygosaccharomyces rouxii in the model system of Thai soy sauce fermentation[J]. International Journal of Food Microbiology, 2013,160(3): 282-289. DOI:10.1016/j.ijfoodmicro.2012.10.022.
[23] HARADA R, YUZUKI M, ITO K, et al. Influence of yeast and lactic acid bacterium on the constituent profile of soy sauce during fermentation[J]. Journal of Bioscience and Bioengineering, 2017,123(2): 203-208. DOI:10.1016/j.jbiosc.2016.08.010.
[24] DEVANTHI P V P, LINFORTH R, ONYEAKA H, et al. Effects of coinoculation and sequential inoculation ofTetragenococcus halophilus andZygosaccharomyces rouxiion soy sauce fermentation[J]. Food Chemistry, 2018, 240: 1-8. DOI:10.1016/j.foodchem.2017.07.094.
[25] 巴尔特 J A. 酵母菌的特征与鉴定手册[M]. 青岛: 青岛海洋大学出版社, 1991.
[26] LARKIN M A, BLACKSHIELDS G, BROWN N P, et al. Clustal W and Clustal X version 2.0[J]. Bioinformatics, 2007, 23(21): 2947-2948.DOI:10.1093/bioinformatics/btm404.
[27] SAITOU N, NEI M. The neighbor-joining method: a new method for reconstructing phylogenetic trees[J]. Molecular Biology and Evolution,1987, 4(4): 406-425. DOI:10.1093/oxfordjournals.molbev.a040454.
[28] TAMURA K, DUDLEY J, NEI M, et al. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0[J].Molecular Biology and Evolution, 2007, 24(8): 1596-1599.DOI:10.1093/molbev/msm092.
[29] BURGAUD G, ARZUR D, SAMPAIO J P, et al.Candida oceani sp.nov. a novel yeast isolated from a Mid-Atlantic ridge hydrothermal vent (-2300 meters)[J]. Antonie Van Leeuwenhoek, 2011, 100(1): 75-82. DOI:10.1007/s10482-011-9566-1.
Identification of 2-Phenethyl Alcohol-Producing Yeast and Its Application in Soy Sauce Fermentation
ZOU Mouyong, ZHU Xingui, LIU Dan, et al. Identification of 2-phenethyl alcohol-producing yeast and its application in soy sauce fermentation[J]. Food Science, 2019, 40(6): 217-222. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180420-264. http://www.spkx.net.cn