花色苷是一大类水溶性植物色素,拥有抗氧化、抗癌、改善肝功能、抗心血管疾病、抗炎、保护视力等多种生理作用[1-4]。尽管花色苷已被报道具有多种生物活性,但其生物活性非常低[5]。花色苷是一大类多酚类化合物的总称,具有很活跃的反应特性,稳定性差,一旦与原来周围环境即植物细胞分离,很快就会降解[6-7]。在众多影响因素中,pH值对花色苷的影响最为显著。花色苷的稳定性会随着pH值的升高而降低,当pH≤2时,花色苷具有较高的稳定性,当pH≥7时,稳定性非常低[8]。但是,人类小肠肠腔内pH值在7.4左右,花色苷会迅速分解,生物利用度大大降低。因此研究者需要创造一个能使花色苷稳定的酸性环境,使其能到达小肠吸收部位。
将花色苷进行包埋是提高花色苷稳定性和生物利用度的重要途径之一。目前对花色苷的包埋途径主要有3 种:一是利用脂质体进行包埋,但脂质体仍旧存在一些问题,如包封率较低、无法控制释放药物的速率和时间、稳定性易受环境影响等[9-10];二是通过微囊包埋,如利用明胶、海藻酸钠等各种生物大分子进行包埋,但微囊体系粒径较大、缓释效果不理想,不利于花色苷在体内的靶向释放[11-13];三是通过复乳体系对花色苷进行包埋。W/O/W型复乳是指将内水相分散在油相中,再将这个包有水滴的油相分散在水中,以此形成一个两面三相的结构[14-15]。复乳特殊的结构赋予其优良的性能:一是可创造一个物质所需要的内水相微环境,同时隔绝氧、光、酶等,提高内水相物质的稳定性;二是具有一定的缓释靶向作用,可将内水相物质靶向释放;三是可以减少某些食品配料用量,如冰激凌等中脂肪的用量[16]。但是复乳本身是一个热力学不稳定体系[17],易受到制备方法、乳化剂、各相比例、渗透压等因素的影响。
目前有少量报道认为复乳体系可促进花色苷在小肠部位的释放[18],但是所制备的花色苷包封率较低、稳定性差。本研究在前期实验的基础上,内水相以柠檬酸创造pH 2的酸性环境,提高花色苷的稳定性,以聚甘油蓖麻醇酯(polyglyceryl-3 polyricinoleate,PGPR)为油相乳化剂、Span-80/Tween-80复配为亲水性乳化剂、黄原胶为稳定剂,用两步法制备复乳,并对其制备工艺、乳化剂配方进行优化,再用制备的复乳包埋矢车菊素-3-葡萄糖苷(cyanidin-3-glucoside,C-3-G),以期制备高稳定性的C-3-G纳米包埋体系,促进花色苷类物质的广泛应用。
C-3-G(纯度≥90%) 上海精方科学仪器有限公司;黄原胶 上海源叶生物科技有限公司;葵花子油上海福临门食品有限公司;PGPR 上海佑创实业有限公司;一水合柠檬酸、氯化钠、Span-80、Tween-80、无水乙醇、丙酮(均为分析纯) 国药集团化学试剂有限公司。
T25分散仪 德国IKA公司;万分之一天平、电子称德国赛多利斯公司;85-1磁力搅拌器 金坛市医疗仪器厂;TGL-16gR飞鸽牌系列离心机 上海安亭科学仪器厂;UV1600紫外-可见分光光度计 北京瑞利分析仪器公司;DISCOVERY HR-1流变仪 美国TA仪器公司;90PLUS高灵敏度Zeta电位及粒度分析仪 美国布鲁克海文公司;FE 20 pH计 梅特勒-托利多仪器(上海)有限公司;光学显微镜 上海光学仪器厂。
1.3.1 制备工艺对复乳性质的影响
在前期预实验的基础上,采用两步法制备复乳。先将内水相与含有乳化剂的油相高速剪切均质,制备初乳。再将初乳与含有乳化剂的外水相剪切均质,制备复乳。复乳制备的初始工艺和配方为:初乳搅拌速率7 000 r/min、复乳搅拌速率3 500 r/min、内水相为pH 2的柠檬酸溶液、初乳水-油质量比3∶7、油相为葵花籽油、油相乳化剂为质量分数10% PGPR、外水相为蒸馏水、外水相亲水乳化剂为Span-80/Tween-80复配、亲水亲油平衡(hydrophile lipophilic balance,HLB)值为10、质量分数10%、初乳与外水相质量比3∶7。
1.3.1.1 初乳搅拌速率对复乳性质的影响
控制其他因素如初始工艺和配方不变,设置初乳搅拌速率为7 000、11 000、15 500、20 000 r/min,考察初乳搅拌速率对初乳离心保留率、初乳流变性、复乳离心保留率、复乳流变性和复乳显微结构等性质的影响,并选出最优初乳搅拌速率。
1.3.1.2 复乳搅拌速率对复乳性质的影响
控制其他因素如初始工艺和配方不变,复乳搅拌速率为3 500、7 000、11 000 r/min,初乳搅拌速率为15 500 r/min,考察复乳搅拌速率对复乳离心保留率、复乳流变性和复乳显微结构等性质的影响,并选出最优复乳搅拌速率。
1.3.2 乳化剂对复乳性质的影响
1.3.2.1 油相PGPR添加量对复乳性质的影响
油相乳化剂P G P R添加量(质量分数,以下同)为6%、8%、10%、12%、14%,初乳搅拌速率15 500 r/min、复乳搅拌速率7 000 r/min、初乳水-油质量比3∶7、内水相NaCl质量分数0.1%、内水相黄原胶添加量0.2%,控制其他因素如初始工艺和配方不变,考察PGPR添加量对初乳离心保留率、初乳流变性、复乳离心保留率、复乳流变性和复乳显微结构等性质的影响,并选出最优PGPR添加量。
1.3.2.2 外水相乳化剂HLB值对复乳性质的影响
外水相乳化剂HLB值为7.5、8、8.5、9.5、10、12、14,初乳搅拌速率15 500 r/min、复乳搅拌速率7 000 r/min、初乳水-油质量比3∶7、内水相NaCl质量分数0.1%、内水相黄原胶添加量0.2%、PGPR添加量14%,控制其他因素如初始工艺和配方不变,考察外水相乳化剂HLB值对复乳离心保留率、复乳流变性和复乳显微结构等性质的影响,并选出最优HLB值。
1.3.2.3 外水相乳化剂添加量对复乳性质的影响
外水相乳化剂添加量为4%、7%、10%、13%、16%,初乳搅拌速率15 500 r/min、复乳搅拌速率7 000 r/min、初乳水-油质量比3∶7、内水相NaCl质量分数0.1%、内水相黄原胶添加量0.2%、PGPR添加量14%、外水相乳化剂HLB值9.5,控制其他因素如初始工艺和配方不变,考察外水相乳化剂添加量对复乳离心保留率、复乳流变性和复乳显微结构等性质的影响,并选出外水相乳化剂最优添加量。
1.3.3 乳化剂均匀设计优化试验
在单因素试验基础上,初乳搅拌速率15 500 r/min、复乳搅拌速率7 000 r/min、初乳水-油质量比3∶7、内水相NaCl质量分数0.1%、内水相黄原胶添加量0.2%、PGPR添加量14%、外水相乳化剂HLB值9.5、外水相乳化剂添加量13%、外水相黄原胶添加量2%,初乳与外水相质量比5∶5,采用均匀设计试验组合,对油相乳化剂和外水相乳化剂对复乳稳定性综合影响进行研究,按均匀设计试验U7(74)对油相乳化剂PGPR添加量、外水相乳化剂(Span-80/Tween-80)HLB值、外水相乳化剂(Span-80/Tween-80)添加量进行优化。
1.3.4 复乳离心保留率
单因素试验时,将制备的复乳1 500 r/min离心15 min,测定乳化层的体积。均匀设计试验时,将复乳3 000 r/min离心15 min,测定乳化层的体积。离心保留率根据公式(1)计算:
1.3.5 流变性测定
选择40 mm平行夹具,设置间距为1 000 μm,选择Flow-Sweep模式,剪切速率范围为1~100 s-1,剪切时间为60 s,温度为25 ℃,将样品置于样品台上,修边后进行测量。
1.3.6 显微结构观察
单因素试验时取少量制备好的复乳于载玻片上,盖上盖玻片,调节显微镜观察复乳结构,并用显微镜自带拍摄系统拍照。
C-3-G包埋实验时取少量复乳稀释20 倍再于载玻片上,盖上盖玻片,调节显微镜观察复乳结构,并用显微镜自带拍摄系统拍照。
1.3.7 C-3-G含量测定
取一定量不含C-3-G的复乳,用蒸馏水稀释2 倍,500 r/min离心30 min,弃去上层,取下层水相,将下层水相按质量比1∶1与有机试剂混合破乳,振荡5 min(其中有机试剂为无水乙醇与丙酮按体积比1∶1配制)。破乳后4 ℃、9 000 r/min离心30 min,取上层,按质量比1∶1用pH 2柠檬酸溶液酸化制得对照组溶剂。准确称取1 mg C-3-G溶于溶剂,并定容至10 mL,分别取不同质量的上述C-3-G溶液稀释,得到质量浓度为50、25、10、5、1 mg/L和0.5 mg/L的C-3-G溶液,在波长533 nm处测定吸光度,以质量浓度为横坐标、吸光度为纵坐标,得到回归方程:y=0.023 1x+0.049 6,相关系数R2=0.994 3,表明C-3-G质量浓度和吸光度在0.5~100 mg/L范围内呈良好的线性关系。
1.3.8 包封率的计算
取一定量复乳,用蒸馏水稀释,500 r/min离心30 min,弃去上层,取下层水相,将下层水相按质量比1∶1与有机试剂混合破乳,振荡5 min(其中有机试剂为无水乙醇与丙酮按体积比1∶1配制)。破乳后4 ℃、9 000 r/min离心30 min,取上层,按质量比1∶1用pH 2柠檬酸溶液酸化,于533 nm波长处测定吸光度,根据标准曲线计算C-3-G含量。包封率根据公式(2)、(3)进行计算:
外水相泄露的C-3-G的量/μg=C测量值×n1×n2×m1 (3)
式中:n1为C-3-G溶液在黄烊盐化时被稀释的倍数,本实验中为2;n2为破乳时C-3-G溶液被稀释的倍数,本实验中为2;C测量值为C-3-G含量/(μg/g);m1为复乳稀释后外水相加蒸馏水的质量/g。
1.3.9 电位、粒径的测定
制备样品后,用蒸馏水稀释1 000 倍后立即测定粒径和电位,参数设置为:He-Ne光源,功率为5 mW,波长为640 nm,散射角90°,测试时间3 min,测定温度25 ℃。
利用SPSS 16.0软件进行数据处理,所有实验均最少为3 次重复,计算结果均以 ±s表示。图像采用显微镜配套的ScopeImage 9.0(H5D)软件进行处理。
2.1.1 初乳搅拌速率对乳液性质的影响
表1 初乳搅拌速率对乳液离心保留率的影响
Table 1 Effect of stirring rate for fi rst emulsification on retention rate of emulsions after centrifugation

注:同一指标字母不同,表示差异显著(P<0.05),下同。
指标 初乳搅拌速率/(r/min)7 000 11 000 15 500 20 000初乳离心保留率/% 90.21±1.25a 95.41±1.22b 99.04±1.00c 99.30±0.61c复乳离心保留率/% 52.07±1.00A 53.32±1.17A 57.82±2.36B 54.47±1.10AB

图1 初乳搅拌速率对初乳流变性的影响
Fig. 1 Effect of stirring rate for fi rst emulsification on emulsion viscosity
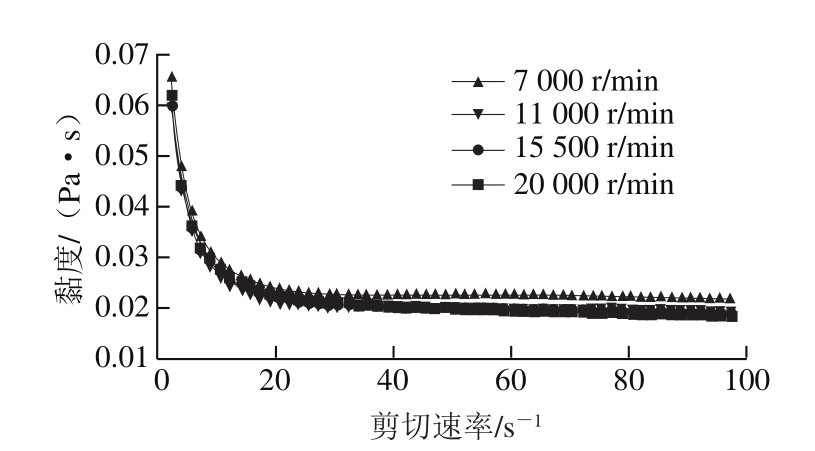
图2 初乳搅拌速率对复乳流变性的影响
Fig. 2 Effect of stirring rate for second emulsification on emulsion viscosity

图3 初乳搅拌速率对复乳显微结构的影响(10×40)
Fig. 3 Effect of stirring rate for fi rst emulsification on microstructure of multiple emulsions (10 × 40)
A~D.初乳搅拌速率分别为7 000、11 000、15 500、20 000 r/min。
初乳搅拌速率会影响内水相的粒径从而对复乳性质产生影响。如表1所示,随初乳搅拌速率的增加初乳的离心保留率增加,当初乳搅拌速率达到15 500 r/min时离心保留率最大,达到99.04%,当初乳搅拌速率继续增加,初乳离心保留率不再增加。由图1~3可看出,随初乳搅拌速率增加,初乳粒径减小,黏度增加。乳化过程的本质是剪切力所产生的黏力克服拉普拉斯压力梯度,使分散相发生形变[19]。拉普拉斯压力梯度与粒径有关,粒径越小,拉普拉斯压力梯度越大,则分散速率增加,产生的黏性力增加,所能克服的拉普拉斯压力梯度越大,粒径越小。随初乳搅拌速率的增加,复乳离心保留率出现先上升后下降的趋势,在初乳搅拌速率为15 500 r/min时达到最高,为57.82%,可见此时初乳的搅拌速率制备复乳最为合适。Yang Yang等[20]研究也表明,初乳搅拌速率与内水相液滴分散程度密切相关,直接影响初乳和复乳的性质。初乳搅拌速率降低,则初乳粒径较大,黏度减小,制备复乳时容易被破坏,而初乳搅拌速率增加,初乳黏度则过大不适于制备复乳时的分散。
2.1.2 复乳搅拌速率对乳液性质的影响
表2 复乳搅拌速率对乳液离心保留率的影响
Table 2 Effect of stirring rate for second emulsification on the retention of emulsions

指标 复乳搅拌速率/(r/min)3 500 7 000 11 000复乳离心保留率/% 55.83±1.47a 59.25±0.69b 59.64±0.74b
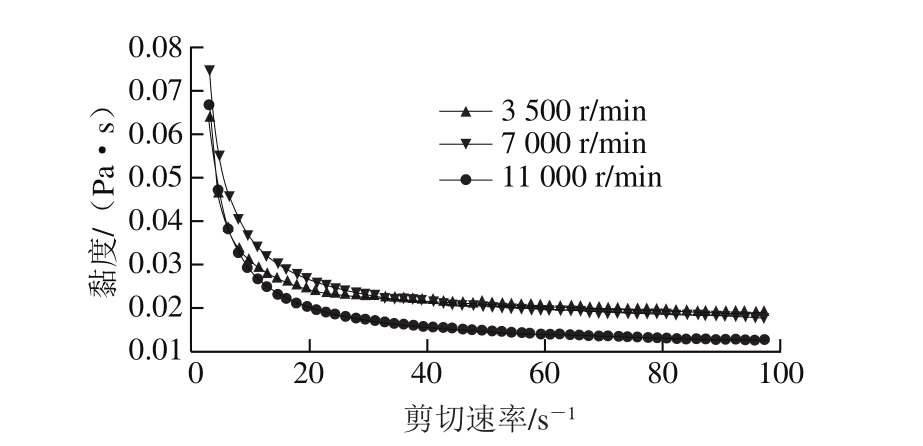
图4 复乳搅拌速率对复乳流变性的影响
Fig. 4 Effect of stirring rate for second emulsification on viscosity of multiple emulsions

图5 复乳搅拌速率对复乳显微结构的影响(10×40)
Fig. 5 Effect of stirring rate for second emulsification on microstructure of multiple emulsions (10 × 40)
A~C.复乳搅拌速率分别为3 500、7 000、11 000 r/min。
如图5所示,搅拌速率越大油滴越小。Schuch等[21]研究表明油滴的大小会影响复乳的包封率,油滴越大包封率越高。同时复乳搅拌速率也会影响乳液的流变性(图4),随剪切速率的增加,复乳黏度呈先平稳后下降。根据球形颗粒悬浮剪切黏度半经验方程,复乳的黏度会随着体系中内水相和油相所占比例的增加而增加[22]。当复乳搅拌速率小于7 000 r/min时,初乳结构未遭到破坏,黏度变化不大,当复乳搅拌速率为11 000 r/min时,可能是因为部分初乳被破坏,内水相合并到外水相中,使体系中内水相和油相所占比例减小,导致黏度降低。而复乳的粒径和黏度又会影响复乳的稳定性,如表2所示,随复乳搅拌速率增加,复乳的离心稳定性先上升后趋于平稳。由此可见,复乳搅拌速率可能是通过影响油滴大小影响体系的稳定性。但这并不意味着制备复乳时搅拌速率越高越好,过高的搅拌速率会破坏初乳的结构,最终形成水包油型单层乳液。从图5可以看出,复乳搅拌速率达到11 000 r/min时,部分颗粒已经失去内水相,说明复乳搅拌速率过大已经破坏了初乳的结构,Vilanova等[23]研究结果也表明复乳搅拌速率应低于初乳,可防止对初乳结构的破坏。综上,本实验条件下复乳搅拌速率为7 000 r/min最合适。
2.2.1 PGPR添加量对乳液性质的影响
表3 PGPR添加量对乳液离心保留率的影响
Table 3 Effect of PGPR content on retention rate of emulsions after centrifugation

指标 PGPR添加量/%6 8 10 12 14 16初乳离心保留率/% 99±0.54a 99±0.78a 99±0.12a 99±0.41a 99±0.65a 99±0.38a复乳离心保留率/%67.16±0.91CD65.16±1.16D68.55±1.11C72.40±1.11B76.17±1.57A73.22±0.88AB
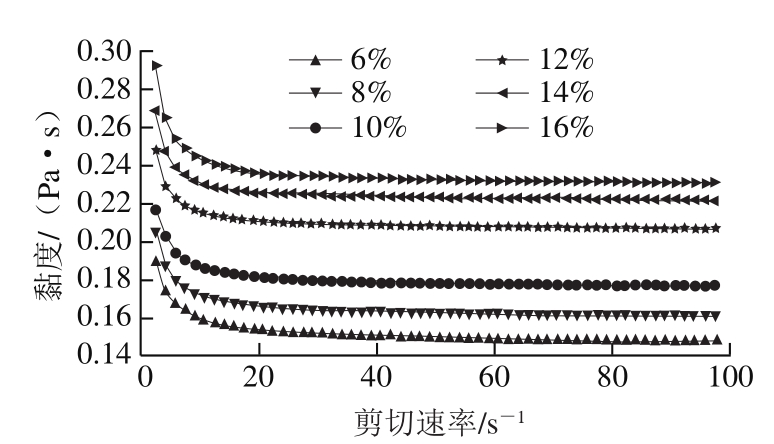
图6 PGPR添加量对初乳流变性的影响
Fig. 6 Effect of PGPR content on viscosity of primary emulsions
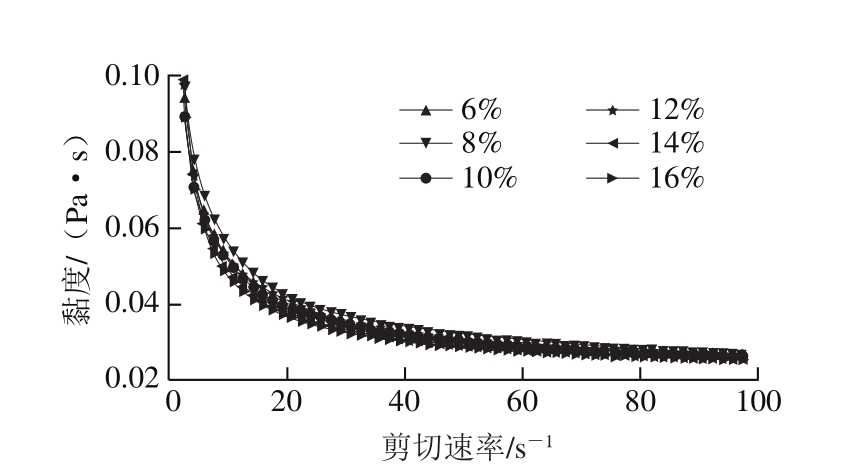
图7 PGPR添加量对复乳流变性的影响
Fig. 7 Effect of PGPR content viscosity of multiple emulsions

图8 PGPR添加量对复乳显微结构的影响(10×40)
Fig. 8 Effect of PGPR content on microstructure of multiple emulsions (10 × 40)
A~F. PGPR添加量分别为 6%、8%、10%、12%、14%、16%。
PGPR是一种常用的亲脂性乳化剂,其含量对复乳性质有显著影响,含量过低时界面膜极性较大,不能形成复乳,含量过高导致初乳黏度过高,不利于复乳的制备[24]。如表3所示,在实验PGPR添加量范围内,PGPR添加量虽然对初乳的离心保留率影响不大,都保持在99%,但随其添加量的增加,复乳离心保留率出现先上升后平稳的趋势,在14%时已达到最高(76.17%),因此14%已经满足形成复乳的条件。
由图6可知,PGPR添加量对初乳黏度影响显著,初乳黏度随着PGPR添加量的增加而增加,因为PGPR本身黏度较高,增加整个油相的黏度。同样根据球形颗粒悬浮剪切黏度半经验方程,体系的黏度会随连续相黏度的增加而增加[22]。油相黏度增加,即初乳中连续相黏度增加,所以初乳黏度增加。但PGPR添加量对复乳黏度影响不大(图7)。
由图8可知,PGPR添加量会对内水相粒径和复乳粒径产生影响。内水相粒径随PGPR添加量的增减而减小,因为在一定范围内PGPR添加量的增加,可降低内水相的相互聚集,从而使内水相粒径减小,提高复乳稳定性[25]。复乳粒径随PGPR添加量增加呈现先减小后增大的趋势。PGPR添加量处于较低水平时,其添加量的增加降低界面极性,利于复乳的制备;当PGPR添加量过高时会在脂层中形成胶束,使初乳的黏度增大,不利于复乳的制备[26]。
2.2.2 外水相乳化剂HLB值对乳液性质的影响
表4 外水相乳化剂的HLB值对乳液离心保留率的影响
Table 4 Effect of external water phase emulsifier HLB on retention rate of emulsions after centrifugation
外水相乳化剂HLB值 7.5 8 8.5 9 9.5 10 12 14复乳离心保留率/% 66.83±1.67c64.49±0.87cd67.81±0.97bc71.46±1.24ab74.67±1.68a70.98±1.38ab65.15±0.92c60.85±1.75d

图9 外水相乳化剂的HLB值对复乳流变性的影响
Fig. 9 Effect of external water phase emulsifier HLB on viscosity of multiple emulsions
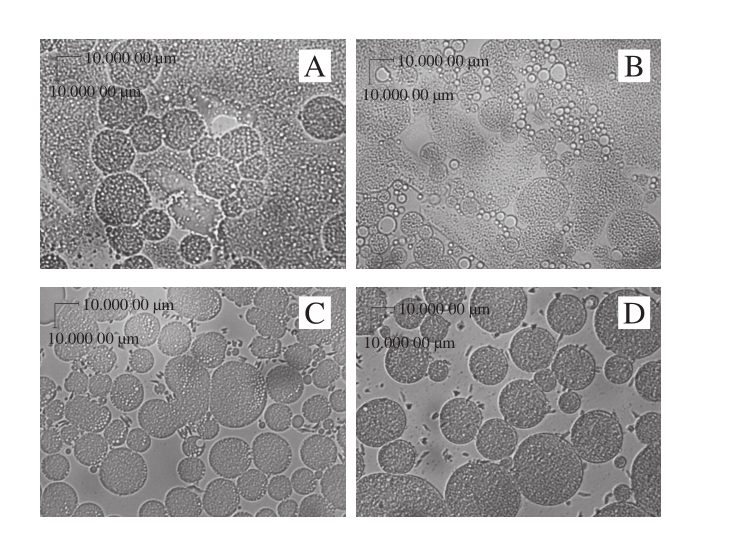

图10 外水相乳化剂HLB值对复乳显微结构的影响(10×40)
Fig. 10 Effect of external water phase emulsifier HLB on microstructure of multiple emulsions (10 × 40)
A~H.外水相乳化剂HLB值分别为7.5、8、8.5、9、9.5、10、12、14。
HLB值是对乳化剂亲油亲水性质的描述,值越低亲油性越强,值越高亲水性越强。复合乳化剂有更广泛的HLB值域,所形成的界面膜更致密[27],本实验选择Span-80和Tween-80的复配作为亲水性乳化剂。如表4所示,随HLB值的增加,复乳离心保留率出现先上升再下降的趋势,在9.5时达到最高,为74.67%,因为当HLB值过低时界面极性较大不能形成复乳,乳液大部分还是W/O型简单乳液;HLB值过高时,一方面形成的复乳颗粒较大,另一方面可能破坏复乳的结构[28]。如图9所示,随着HLB值越高,复乳黏度减小,因为HLB值升高,乳液整体亲水性增加,流动性增加。从图10可以看出,当HLB值低于8.5时,不能形成复乳,大部分乳液还是简单的W/O型,当HLB值继续增加,复乳粒径呈现先减小后增大的趋势,与Schmidts等[28]的研究结果一致,在9.5时,粒径达到最低。当HLB≥9.5时,离心保留率变化趋势与粒径变化趋势一致。综上,本实验外水相HLB值选为9.5。
2.2.3 外水相乳化剂添加量对乳液性质的影响
表5 外水相乳化剂添加量对乳液离心保留率的影响
Table 5 Effect of external water phase emulsifier contents on retention rate of emulsions after centrifugation

10 13 16复乳离心保留率/% 63.54±1.63d66.56±0.69c70.38±1.01b77.2±0.98a76.82±1.06a指标 外水相乳化剂添加量/%4 7
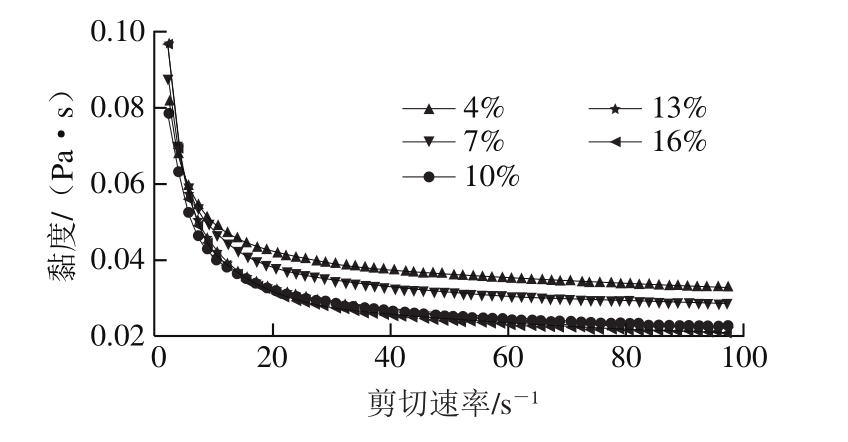
图11 外水相乳化剂添加量对复乳流变性的影响
Fig. 11 Effect of external water phase emulsifier contents on viscosity of multiple emulsions
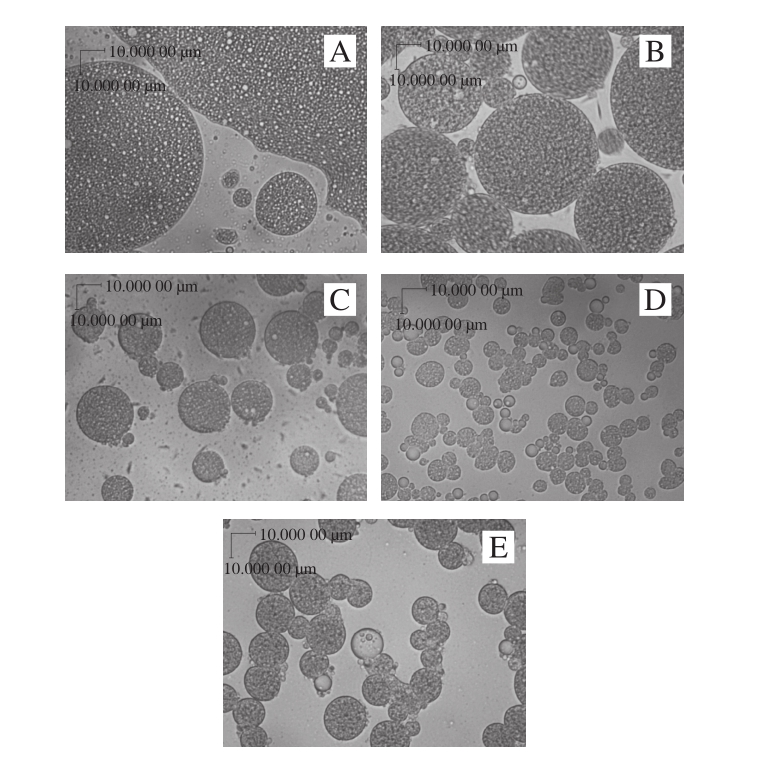
图12 外水相乳化剂添加量对复乳显微结构的影响(10×40)
Fig. 12 Effect of external water phase emulsifier content on microstructure of multiple emulsions (10 × 40)
A~E.外水相乳化剂添加量分别为4%、7%、10%、13%、16%。
如表5所示,外水相乳化剂添加量对复乳的形成影响较大,随外水相乳化剂增加,复乳离心保留率先上升后平稳的趋势,当乳化剂含量增加到13%时,复乳离心保留率为(77.2±0.98)%,之后乳化剂添加量继续增加,复乳离心保留率变化不大,乳化剂添加量在一定范围内增加可促进乳液稳定性。
如图11所示,当乳化剂添加量低于10%时,复乳的黏度随外水相乳化剂添加量增加而降低,此时,界面膜较薄、弹性低、稳定性差;当乳化剂添加量高于10%时,形成的复乳界面膜较厚,弹性较高,稳定性较高,而此时黏度变化不大,可能是10%已满足复乳形成的最低剂量需要。
如图12所示,当其添加量较低形成的复乳直径较大,有部分并没有形成复乳,还是W/O型乳液。当其添加量增加,形成复乳粒径逐渐减小。乳化剂添加量增加,可形成界面膜的面积增加,而初乳总体积不变,引起复乳粒径减小,颗粒数增加[29],乳化剂添加量增加到13%时粒径达到最低。若添加量继续增加,多余的乳化剂会先在界面堆积,使复乳粒径增大,当含量高到一定程度后,会在外水相形成胶束,而胶束会吸引一部分乳化剂从界面膜上脱离,不利于乳液的稳定[26]。
油相和外水相乳化剂的亲油亲水性和添加量对复乳产生重要的影响,它们之间的相互作用不可忽视,有研究表明,亲水亲油乳化剂HLB值之间比例即亲水疏水加权值对复乳的稳定性有显著影响[30],因此在单因素试验基础上对油相乳化剂PGPR添加量、亲水性乳化剂Span-80和Tween-80复配的HLB值和添加量进行均匀设计试验,以复乳离心保留率为响应值,具体设计与结果见表6。
表6 均匀设计试验U7(74)因素水平设计与结果
Table 6 Uniform design in terms of coded and experimental levels with response

试验号X1 PGPR添加量/%复乳离心保留率/%1 3(13.32) 5(9.64) 7(16) 66.875 2 6(15.30) 2(9.16) 6(15) 62.010 3 1(12.00) 7(9.96) 5(14) 68.200 4 4(13.98) 4(9.48) 4(13) 62.275 5 7(15.96) 1(9.00) 3(12) 63.550 6 2(12.66) 6(9.80) 2(11) 61.350 7 5(14.64) 3(9.32) 1(10) 61.825 X2亲水性乳化剂HLB值X3亲水性乳化剂添加量/%
利用SPSS 16.0对试验结果进行二项回归分析,得方程拟合相关系数R值为1,决定系数R2值为1,调整 值为0.98,认为方程拟合度良好。对模型系数进行检验,PGPR添加量和亲水性乳化剂添加量交互项(P=0.021<0.05)、亲水性乳化剂的HLB值和亲水性乳化剂添加量交互项(P=0.043<0.05)、亲水性乳化剂HLB值的平方项(P=0.025<0.05)影响显著,以PGPR添加量为X1、亲水性乳化剂的HLB值为X2、亲水性乳化剂添加量为X3,得复乳离心保留率回归方程为:Y=-5 084.13X1X3+68.084X2X3+4 147.448X12。
值为0.98,认为方程拟合度良好。对模型系数进行检验,PGPR添加量和亲水性乳化剂添加量交互项(P=0.021<0.05)、亲水性乳化剂的HLB值和亲水性乳化剂添加量交互项(P=0.043<0.05)、亲水性乳化剂HLB值的平方项(P=0.025<0.05)影响显著,以PGPR添加量为X1、亲水性乳化剂的HLB值为X2、亲水性乳化剂添加量为X3,得复乳离心保留率回归方程为:Y=-5 084.13X1X3+68.084X2X3+4 147.448X12。
对方程进行显著性分析检验,分析结果如表7所示,F值为11.254,P值为0.003,回归模型显著。根据方程求解得到最优条件:PGPR添加量16%、外水相乳化剂HLB值10、外水相乳化剂添加量10%,复乳离心保留率为85.17%。根据所得优化条件进行优化验证实验重复3 次,得复乳离心保留率为80.25%。
表7 方程显著性检验
Table 7 Significance test
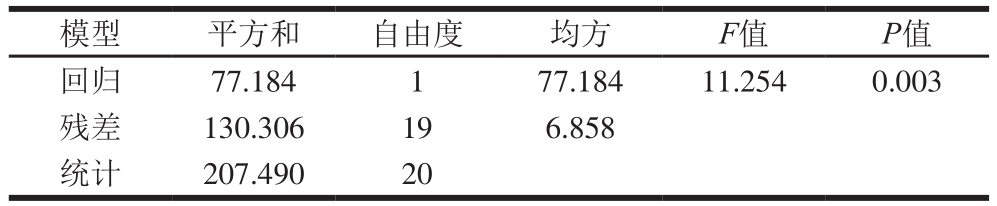
模型 平方和 自由度 均方F值P值回归 77.184 1 77.184 11.254 0.003残差 130.306 19 6.858统计 207.490 20
2.4.1 C-3-G复乳的载药量和包封率
表8 C-3-G复乳的载药量和包封率
Table 8 Drug-loading rate and encapsulation ef fi ciency of C-3-G multiple emulsion

注:—.未检测到。
指标 内水相C-3-G质量浓度/(mg/L)100 500 1 000 1 500 2 000包封率/% — — 93.46±1.89a 98.08±2.56b 93.30±1.34a
C-3-G在pH 2的条件下是一种阳离子型,包埋C-3-G可增加复乳内水相的渗透压。Neumann等[32]指出内水相渗透压随着内水相离子浓度的增加而增加,则内水相渗透压会随内水相C-3-G质量浓度增加而增加。Leong等[31]指出内水相渗透压是外水相10 倍时复乳才能达到稳定。从表8可以看出,当内水相中C-3-G质量浓度高于1 000 mg/L时,随质量浓度的增加包封率呈现先上升后下降的趋势,在载药量为1 500 mg/L时,包封率达到最高,为(98.08±1.56)%。因为当C-3-G质量浓度低于1 500 mg/L时渗透压较低,容易导致内水外渗,降低包封率;质量浓度高于1 500 mg/L时,内水相渗透压过高,引起外水内渗,最终使复乳粒破裂,降低包封率。当质量浓度低于1 000 mg/L时,内水相渗透压更低,更多的内水相渗透到外水相中,可推测其包封率应低于质量浓度为1 000 mg/L时样品的包封率,由于内水相C-3-G添加量低,同时外水相C-3-G在检测时又被不断稀释,故导致检测结果不准确。综上,C-3-G复乳最适的载药量为1 500 mg/L。
2.4.2 包埋C-3-G对复乳特性的影响
表9 包埋C-3-G对复乳粒径、电位、离心稳定性的影响
Table 9 Effect of C-3-G loading on particle size, potential and centrifugal stability of multiple emulsion

指标 内水相不加C-3-G复乳 内水相加C-3-G复乳粒径/nm 517.20±25.09a 688.99±30.91b电位/mV -28.93±1.32A -27.61±0.78A离心保留率/% 82.74±2.86m 93.05±4.89n
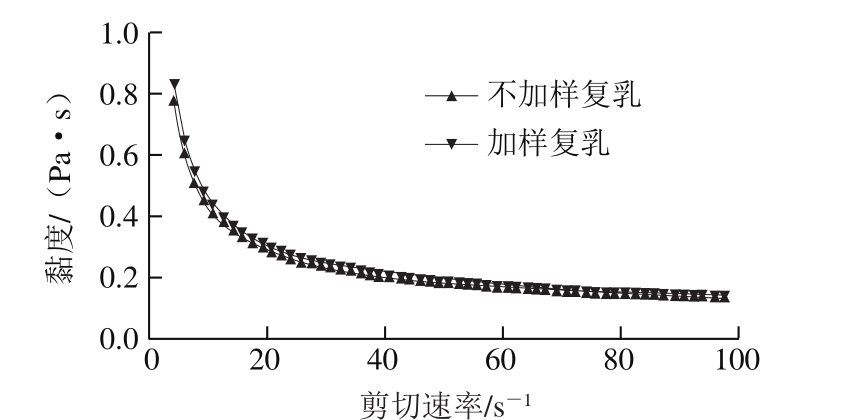
图13 包埋C-3-G对复乳流变性的影响
Fig. 13 Effect of C-3-G loading on viscosity of multiple emulsions
由表9可知,内水相添加C-3-G后,对复乳电位影响不显著(P>0.05),对体系黏度影响也不明显(图13),但对复乳粒径和离心保留率有显著影响。粒径从517.20 nm增加到688.99 nm,离心保留率从82.74%上升到93.05%。花色苷的加入提高了内水相的渗透压,阻止内水相向外渗透,提高了粒径和稳定性[32]。
2.4.3 包埋C-3-G对复乳显微结构的影响

图14 包埋C-3-G对复乳对复乳显微结构的影响(10×100)
Fig. 14 Effect of C-3-G loading on microstructure of multiple emulsions (10 × 100)
如图14所示,未包埋C-3-G复乳和包埋C-3-G复乳均呈完整的W/O/W型,表明内水相包埋C-3-G并未对复乳结构产生明显影响。从图14也可以看出,复乳粒径显著小于单因素试验时的粒径,可能有两方面原因,一是乳化剂进行均匀设计优化对复乳粒径有影响,使粒径降低;二是此处是将复乳稀释20 倍后再观察。
2.4.4 C-3-G复乳稳定性的影响因素结果
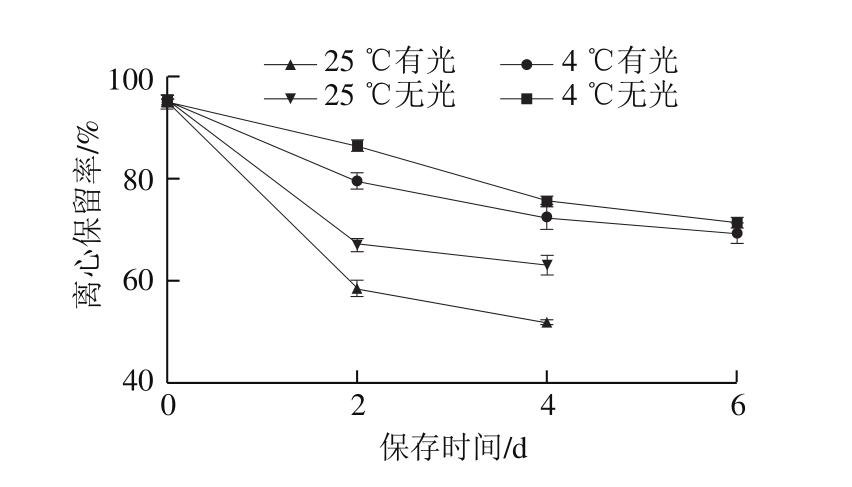
图15 C-3-G复乳稳定性的影响因素
Fig. 15 Factors affecting C-3-G multiple emulsion stability
如图15所示,25 ℃时复乳离心保留率随时间延长明显降低,第2天25 ℃无光条件下已经下降到67.03%,25 ℃有光条件下降到58.45%,第6天时,25 ℃条件下复乳已经分层。而4 ℃下第6天离心保留率依然保持在70%以上的高水平,表明复乳对温度有着较高的敏感性。Shakeel等[33]研究也表明室温不利于复乳的稳定性。有光条件下复乳离心保留率下降速率明显高于无光条件下。25 ℃时第4天有光条件下离心保留率为51.39%,无光条件下为63.08%,差异显著(P<0.05)。可能是因为C-3-G具有光敏感性,光照条件下易降解,产生醛类和酚酸类产物对复乳体系产生影响,影响体系稳定。

图16 C-3-G复乳不同保存条件下外观形态随时间的变化
Fig. 16 Appearance changes of C-3-G double emulsion under different storage conditions
1.新鲜样品;2.第6天常温无光;3.第6天4 ℃有光;4.第6天4 ℃无光;5. 2 周4 ℃有光;6. 2 周4 ℃无光。
由图16可知,从外观形态上看,C-3-G复乳呈粉红色。当在常温下保存到第6天时,复乳已经分层,体系破坏。而在4 ℃下保存的样品,到2 周时形态未发生变化,表明复乳在4 ℃下可稳定保存2 周。
通过单因素试验及均匀设计试验,以复乳离心保留率为考察指标,确定W/O/W复乳制备最优工艺条件为:初乳搅拌速率15 500 r/min、复乳搅拌速率7 000 r/min、油相乳化剂PGPR添加量16%、亲水性乳化剂HLB值10、亲水性乳化剂添加量10%。利用上述复乳体系包埋C-3-G,所得复乳体系载药量为1 500 mg/L,包封率为98.08%,粒径为688.99 nm,电位为-27.61 mV,离心保留率为93.05%,达到稳定状态。本实验表明复乳体系很好地包裹PGPR,为花色苷类产品开展更广泛的应用提供理论基础。
[1] GABETTA B, FUZZATI N, GRIFFNI A, et al. Characterization of proanthocyanidins from grape seeds[J]. Fitoterapia, 2000, 71(2): 162-175.
[2] BONTEMPO P, MASI L D, CARAFA V, et al. Anticancer activities of anthocyanin extract from genotypedSolanum tuberosum L.“Vitelotte”[J]. Journal of Functional Foods, 2015, 19: 584-593.DOI:10.1016/jff.2015.09.063.
[3] MORAIS C A, ROSSO V V D, ESTADELLA D, et al. Anthocyanins as inflammatory modulators and the role of the gut microbiota[J].Journal of Nutritional Biochemistry, 2016, 33: 1-7. DOI:10.1016/j.juntbio.2015.11.008.
[4] KUBOW S, ISKANDAR M M, SABALLY K, et al. Biotransformation of anthocyanins from two purple-f l eshed sweet potato accessions in a dynamic gastrointestinal system[J]. Food Chemistry, 2016, 192: 171-177. DOI:10.1016/j.food.chem.2015.06.105.
[5] DEL B C, CIAPPELLANO S, KLIMISZACAS D, et al. Anthocyanin absorption, metabolism, and distribution from a wild blueberryenriched diet (Vaccinium angustifolium) is affected by diet duration in the Sprague-Dawley rat[J]. Journal of Agricultural & Food Chemistry,2010, 58(4): 2491-2497. DOI:10.1021/jf903472x.
[6] BROUILLARD R. Anthocyanins in fruits, vegetables and grains[M].Boca Raton: CRC Press, 1993: 362.
[7] POJER E, MATTIVI F, DAN J, et al. The Case for anthocyanin consumption to promote human health: a review[J]. Comprehensive Reviews in Food Science & Food Safety, 2013, 12(5): 483-508.DOI:10.1111/1541-4337.12024.
[8] TORSKANGERPOLL K, ØYVIND M, ANFERSE N. Colour stability of anthocyanins in aqueous solutions at various pH values[J]. Food Chemistry, 2005, 89(3): 427-440. DOI:10.1016/j.foodchem.2004.03.002.
[9] 赵圣书, 王振宇. 响应面法优化黑加仑花色苷脂质体制备工艺的研究[J]. 食品工业科技, 2012, 33(23): 258-262. DOI:10.13386/j.issn1002-0306.2012.23.048.
[10] 傅罗伟, 姚志钢. 紫甘薯花青素脂质体制备工艺的优化[J]. 山东化工, 2014(11): 45-47.
[11] 刘云海, 刘瑛, 曹小红, 等. 天然食用色素花青素的微胶囊化[J].食品工业科技, 2004(12): 109-110.
[12] LU M, LI Z, LIANG H, et al. Controlled release of anthocyanins from oxidized konjac glucomannan microspheres stabilized by chitosan oligosaccharides[J]. Food Hydrocolloids, 2015, 51: 476-485.DOI:10.1016/j.foodhyd.2015.05.036.
[13] AKHAVAN M S, JAFARI S M, ASSADPOOR E, et al.Microencapsulation optimization of natural anthocyanins with maltodextrin, gum Arabic and gelatin[J]. International Journal of Biological Macromolecules, 2016, 85(7): 379-385. DOI:10.1016/j.ijbiomac.2016.01.011.
[14] COLE M L, WHATELEY T L. Release rate profiles of theophylline and insulin from stable multiple W/O/W emulsions[J]. Journal of Controlled Release, 1997, 49(1): 51-58. DOI:10.1016/s0168-3659(97)00056-4.
[15] COURNARIE F, SAVELLI M P, ROSILIO V, et al. Insulin-loaded W/O/W multiple emulsions: comparison of the performances of systems prepared with medium-chain-triglycerides and fish oil[J].European Journal of Pharmaceutics & Biopharmaceutics, 2004, 58(3):477-482. DOI:10.1016/j.ejpb.2004.03.024.
[16] JIMENEZCOLMENERO F. Potential applications of multiple emulsions in the development of healthy and functional foods[J]. Food Research International, 2013, 52(1): 64-74.
[17] SAPEI L, NAQVI M A, ROUSSEAU D. Stability and release properties of double emulsions for food applications[J].Food Hydrocolloids, 2012, 27(2): 316-323. DOI:10.1016/j.foodhyd.2011.10.008.
[18] FRANK K, WALZ E, GRAF V, et al. Stability of anthocyanin-rich W/O/W-emulsions designed for intestinal release in gastrointestinal environment[J]. Journal of Food Science, 2012, 77(12): N50-N57.DOI:10.1111/j.1750-3481.2012.02982.x.
[19] 魏慧贤, ZHONG F, 麻建国. 初乳乳化工艺对W/O/W型复乳稳定性和药物包埋率的影响研究[J]. 高校化学工程学报, 2008, 22(4): 659-665. DOI:10.3321/j.issn:1003-9015.2008.04.021
[20] YANG Y, GAO Y, MEI X. Effects of formulation parameters on encapsulation efficiency and release behavior of thienorphine loaded PLGA microspheres[J]. Pharmaceutical Development & Technology,2013, 18(5): 1169-1174. DOI:10.3109/10837450.2011.618948.
[21] SCHUCH A, WRENGER J, SCHUCHMANN H P. Production of W/O/W double emulsions. Part II: Influence of emulsification device on release of water by coalescence[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2014, 461(3): 344-351.DOI:10.1016/j.colsurfa.2013.11.044.
[22] LARSON R G. The structure and rhology of complex fuids[M]. New York: Oxford University Press, 1998.
[23] VILANOVA N, SOLANS C, RODRÍGUEZ-ABREU C. Preparation of novel silicone multicompartment particles by multiple emulsion templating and their use as encapsulating systems[J]. Langmuir the ACS Journal of Surfaces & Colloids, 2013, 29(49): 15414-15422.DOI:10.1021/la403134c.
[24] SAEHUN M, YONGDOO C, SHINJOUNG R, et al. Preparation and characterization of water/oil/water emulsions stabilized by polyglycerol polyricinoleate and whey protein isolate[J]. Journal of Food Science,2010, 75(2): 116-125. DOI:10.1111/j.1750-3841.2009.01487.x.
[25] SAWANT K K, MUNDADA V P, PATEL V J. Development and optimization of W/O/W multiple emulsion of lisinopril dihydrate using Plackett Burman and Box-Behnken designs[J].Journal of Nanomedicine & Nanotechnology, 2017, 8(1): 1-11.DOI:10.4172/2157-7439.1000422.
[26] FRANK K, KOHLER K, SCHUCHMANN H P, et al. Formulation of labile hydrophilic ingredients in multiple emulsions: influence of the formulation's composition on the emulsion's stability and on the stability of entrapped bioactives[J]. Journal of Dispersion Science &Technology, 2011, 32(12): 1753-1758.
[27] 许晓鹏. 稳定的W/O/W型复乳的研制及其胰岛素包埋性质的研究[D].无锡: 江南大学, 2006.
[28] SCHMIDTS T, DOBLER D, NISSING C, et al. Influence of hydrophilic surfactants on the properties of multiple W/O/W emulsions[J]. Journal of Colloid & Interface Science, 2009, 338(1):184-192. DOI:10.1016/j.jcis.2009.06.033.
[29] ASSADPOUR E, MAGHSOUDLOU Y, JAFARI S M, et al.Optimization of folic acid nano-emulsification and encapsulation by maltodextrin-whey protein double emulsions[J]. International Journal of Biological Macromolecules, 2016, 86: 197-207. DOI:10.1016/j.ijbiomac.2016.01.064.
[30] MORAIS J M, SANTOS O D H, NUNES J R L, et al. W/O/W Multiple emulsions obtained by one-step emulsification method and evaluation of the involved variables[J]. Journal of Dispersion Science &Technology, 2008, 29(1): 63-69. DOI:10.1080/01932690701688391.
[31] LEONG T S H, ZHOU M, KUKAN N, et al. Preparation of waterin-oil-in-water emulsions by low frequency ultrasound using skim milk and sunflower oil[J]. Food Hydrocolloids, 2017, 63: 685-695.DOI:10.1016/j.foodhyd.2016.10.017.
[32] NEUMANM S M, SCHERBEJ I, SCHAAF U S V D, et al.Investigations on the influence of osmotic active substances on the structure of water in oil emulsions for the application as inner phase in double emulsions[J]. Colloids & Surfaces A: Physicochemical &Engineering Aspects, 2018, 538: 56-62. DOI:10.1016/j.colsurfa.2017.10.073.
[33] SHAKEEL F, HAQ N, AL-DHFYAN A, et al. Double W/O/W nanoemulsion of 5-fluorouracil for self-nanoemulsifying drug delivery system[J]. Journal of Molecular Liquids, 2014, 200: 183-190.DOI:10.1016/j.molliq.2014.10.013.
Optimization of Preparation of W/O/W Multiple Emulsion and Evaluation of Its Ability to Encapsulate Cyanidin-3-Glucoside
YUAN Li, SUN Chuchu, DANG Qingling, et al. Optimization of preparation of W/O/W multiple emulsion and evaluation of its ability to encapsulate cyanidin-3-glucoside[J]. Food Science, 2019, 40(6): 272-280. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-20180211-123. http://www.spkx.net.cn