近年来,对多糖的研究一直是个热点,并且主要集中在提取和活性分析方面。目前多糖的提取方法主要有溶剂提取法(热水浸提[1]、碱液提取[2]、酸液提取[3]等)、辅助提取法(微波辅助提取[4]、超声辅助提取[5]、高压辅助提取[6]、酶辅助提取[7]等)以及联合提取法[8]等。研究表明,不同的提取方法不但影响多糖的提取效率,而且影响多糖的分子质量、单糖组成、结构以及生物活性[9-10]。如Zhu Zhenyuan等[11]比较了冷水、热水、超声、微波、纤维素酶5 种提取方法对古尼虫草多糖的影响,结果表明,微波提取多糖提取率和抗肿瘤活性均最高;Wang Junlong等[12]研究发现,微波辅助提取过程中白沙蒿多糖的分子发生了降解,但微波辅助提取法提取的多糖比热水提取法具有较高的抗氧化活性;Zhao Chengcheng等[13]比较了冷水、温水、热水、超声辅助提取4 种提取方法对黏山药多糖特征和生物活性的影响,发现热水提取多糖提取率最高、分子质量最大,冷水提取多糖分子质量最小、糖醛酸含量高、1,1-二苯基-2-三硝基苯肼自由基清除活性和降血糖活性较高,而超声辅助提取多糖分子质量较小、亚铁还原力最强;而Yan Yajuan等[14]在比较热水、微波、超声、酶4 种不同方法提取砂仁多糖的研究中发现,超声提取多糖提取率、糖醛酸和硫酸基含量均最高,其抗氧化活性也最强。由此可见,在多糖提取中,不同提取方法对同种原料产生效果不同,而同种方法对不同原料产生的效果也不同,没有规律可循。
昆布是褐藻门海带目海带科植物海带(Laminaria japonicaAresch)或翅藻科植物昆布(Ecklonia kurome Okam)的干燥叶状体[15],其不仅营养丰富,味道鲜美,而且具有较高的药用价值,是药食两用物质之一。现代研究表明,昆布含有藻胶酸、氨基酸、多糖、甘露醇等多种有效成分以及丰富的碘,其中昆布多糖是昆布的主要活性成分之一,与昆布的许多生理效应有关,如抗糖尿病[16]、调节血脂[17-18]、抗菌[19]、提高机体免疫、抗肿瘤[20-21]等作用。目前已有的文献中,虽然对昆布多糖提取方法和生物活性的研究较多,但鲜见全面地比较不同提取方法对昆布多糖的性质和生物活性影响方面的报道。因此,本实验采用热水浸提、超声辅助提取以及复合酶提取3 种方法提取昆布多糖,并对其理化性质和抗肿瘤活性进行比较分析,以期为进一步探明不同提取方法与多糖结构和抗肿瘤活性的关系,寻求适合昆布多糖的最佳提取工艺,为昆布多糖的深入开发利用提供一定的理论依据。
昆布购自南京鹿江中药饮片厂,经粉碎后过60 目筛备用。
纤维素酶(1 800 U/mg)、果胶酶(1 000 U/mg)上海金穗生物科技有限公司;木瓜蛋白酶(3 U/mg)阿拉丁试剂(上海)有限公司;小牛血清 美国Gibco公司;DMEM/F12(1∶1)培养液 美国HyClone公司;噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT) 江苏凯基生物技术股份有限公司;刚果红、盐酸阿霉素(doxorubicin hydrochloride,DOX) 北京博奥拓达科技有限公司;其余试剂均为国产分析纯。
DFY-500摇摆式高速中药粉碎机 温岭市林大机械有限公司;TU-1901紫外-可见分光光度计 北京普析通用仪器有限责任公司;LXJ-IIB离心机 上海安亭科学仪器厂;JY-92IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;SHJ-4水浴恒温磁力搅拌器 常州亚特实验仪器有限公司;PD-1C-50真空冷冻干燥机 北京博医康实验仪器有限公司;ATX224分析天平 日本岛津仪器公司;RE-5205旋转蒸发器 上海亚荣生化仪器厂;Elx800TM酶标仪 美国BioTek公司;CO2生化培养箱 赛默飞世尔科技(中国)有限公司。
1.3.1 热水浸提法提取昆布多糖工艺优化
称取一定量昆布粉,固定反应条件料液比1∶60(g/mL)、提取时间2 h、考察不同提取温度(25、35、45、55、65、75、85 ℃)对昆布多糖提取率的影响;固定反应条件料液比1∶60(g/mL)、提取温度80 ℃,考察不同提取时间(1、2、3、4、5、6 h)对昆布多糖提取率的影响;固定反应条件提取时间2 h、提取温度80 ℃,考察不同料液比(1∶20、1∶30、1∶40、1∶50、1∶60、1∶70、1∶80(g/mL))对昆布多糖提取率的影响。
在单因素试验的基础上,选取3 个单因素试验中测得的最佳条件正交试验,以多糖的提取率为指标,优化提取工艺参数。
1.3.2 超声辅助提取法提取昆布多糖工艺优化
称取一定量昆布粉,固定反应条件料液比1∶60(g/mL)、超声时间5 min,考察超声功率(100、200、300、400、500 W)对昆布多糖提取率的影响;固定反应条件料液比1∶60(g/mL)、超声功率200 W,考察不同超声时间(2、4、6、8、10、12 min)对昆布多糖提取率的影响;固定反应条件超声功率200 W、超声时间5 min,考察料液比(1∶30、1∶40、1∶50、1∶60、1∶70、1∶80、1∶90、1∶100(g/mL))对昆布多糖提取率的影响。
在单因素试验的基础上,选取3 个单因素试验中测得的最佳条件进行正交试验,以多糖的提取率为指标,优化提取工艺参数。
1.3.3 复合酶法提取昆布多糖工艺优化
称取一定量昆布粉,固定反应条件pH 5、水浴提取温度50 ℃、水浴提取时间3 h、料液比1∶70(g/mL)、木瓜蛋白酶30 U/g、果胶酶10 000 U/g,考察不同纤维素酶用量(18 000、36 000、54 000、72 000、90 000、108 000、126 000 U/g)对昆布多糖提取率的影响;固定反应条件pH 5、水浴提取温度50 ℃、水浴提取时间3 h、料液比1∶70(g/mL),木瓜蛋白酶30 U/g、纤维素酶18 000 U/g,考察不同果胶酶用量(5 000、10 000、15 000、20 000、25 000、30 000 U/g)对昆布多糖提取率的影响;固定反应条件pH 5、水浴提取温度50 ℃、水浴提取时间3 h、料液比1∶70(g/mL)、果胶酶10 000 U/g、纤维素酶18 000 U/g,100 ℃灭酶10 min,考察不同木瓜蛋白酶用量(45、60、75、90、105 U/g)对昆布多糖提取率的影响。
在单因素试验的基础上,选取3 个单因素试验测得的最佳条件进行正交试验,以多糖提取率为指标,优化提取工艺参数。
1.3.4 粗多糖干品的制备
根据正交试验最优提取条件进行多糖提取,4 000 r/min离心20 min,得到上清液,用Sevag法[22]除去蛋白质后,用无水乙醇进行沉淀,然后用乙醇、丙酮洗涤,真空干燥,分别得到3 种昆布粗多糖干品。
1.3.5 多糖溶解性测定
昆布多糖(0.1 g)置于150 mL烧杯内,加入100 mL蒸馏水使之在不同温度(20、40、60、80、100 ℃)条件下水浴溶解,用磁力搅拌,记录从开始到昆布粗多糖完全溶解所需时间[23]。
1.3.6 刚果红实验
称取4 mg多糖样品,加入2 mL蒸馏水和2 mL刚果红试剂(80 µg/mL),加入1 mol/L的NaOH溶液,调节NaOH溶液终浓度分别为0.1、0.2、0.3、0.4 mol/L和0.5 mol/L,紫外分光光度计扫描,测得不同浓度条件下溶液的最大吸收波长。与刚果红对比,判断昆布多糖是否具有三股螺旋结构[24]。
1.3.7 紫外光谱特征
配制200 µg/mL的昆布多糖溶液,以蒸馏水为空白,利用紫外分光光度计在波长190~400 nm范围内测定吸光度,间隔1 nm,绘制昆布多糖紫外光谱特征曲线,判断所提取的昆布多糖中是否含有蛋白质和核酸。
1.3.8 MTT法测定肿瘤细胞的抑制率
将处于对数期的MCF-7和A549细胞用胰酶消化后配制成浓度为1×104 个/mL的细胞悬液,每孔100 µL加入到96 孔板内。次日加入含有DOX或不同药物浓度和相应溶剂对照的新鲜培养基,每孔加100 µL。每种药物设4 个剂量组,即DOX(1、0.8、0.6、0.4 µg/mL),多糖组(560、420、280、140 µg/mL),每组6 个平行孔,给药后在37 ℃、5% CO2的细胞培养箱内培养72 h。培养结束后每孔加10 µL新鲜配制的5 mg/mL MTT溶液,继续培养4 h,弃去上清液,每孔加入200 µL二甲基亚砜溶解沉淀,恒温振荡培养箱摇匀,用酶标仪在波长570 nm处测定吸光度,计算样品的肿瘤细胞抑制率,并由SPSS 22.0软件计算半抑制浓度(the half maximal inhibitory concentration,IC50)[25]。
实验数据以 ±s表示,采用SPSS 22软件进行方差分析。
2.1.1 单因素试验结果

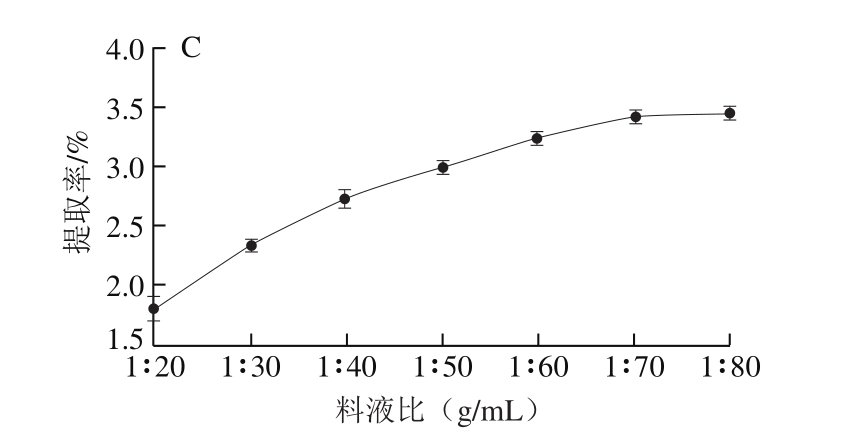
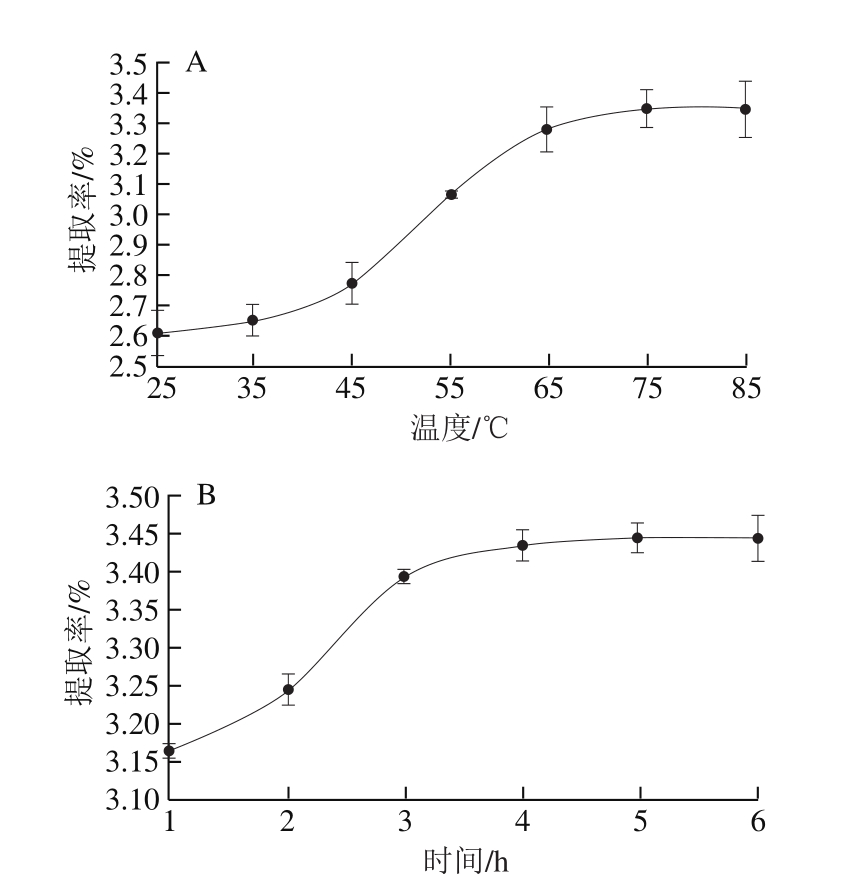
图1 提取温度(A)、提取时间(B)和料液比(C)对昆布多糖提取率的影响
Fig. 1 Effects of temperature (A), extraction time (B) and solid-tosolvent ratio (C) on the extraction efficiency of polysaccharides by HWE
从图1A可以看出,随着提取温度的逐渐升高,溶液中的昆布多糖提取率先缓慢增长,在高于45 ℃时,有一个较快增长,在75 ℃时达到极值,随后不再增长。因此,在本实验条件下,昆布多糖的最适提取温度为75 ℃。从图1B可以看出,随着提取时间的延长,昆布多糖提取率逐渐升高,在4 h时达到极值,后趋于平缓。因此选择4 h为最佳提取时间。由图1C可知,随着料液比的增加,昆布多糖提取率一直呈现上升趋势,直到在料液比1∶70(g/mL)时达到极值,之后趋于平缓,因此选择料液比1∶70为最佳提取条件。
2.1.2 正交试验结果
表1 热水浸提法L9(33)正交试验设计与结果
Table 1 Orthogonal array design L9 (33) with experimental results for optimization of HWE conditions
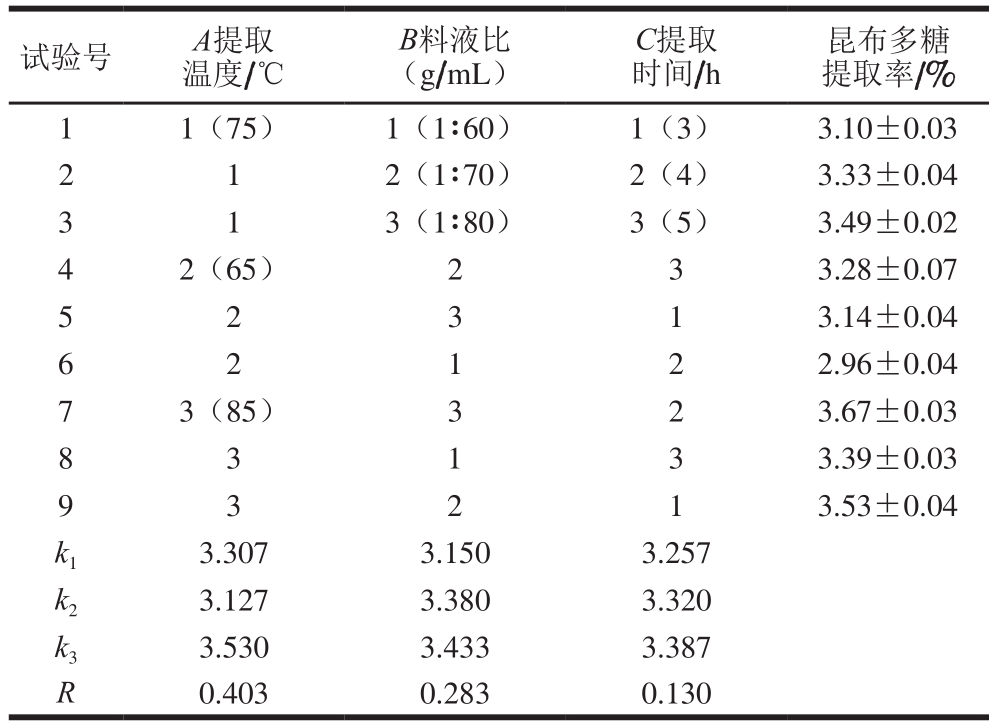
试验号A提取温度/℃昆布多糖提取率/%1 1(75) 1(1∶60) 1(3) 3.10±0.03 2 1 2(1∶70) 2(4) 3.33±0.04 3 1 3(1∶80) 3(5) 3.49±0.02 B料液比(g/mL)C提取时间/h 4 2(65) 2 3 3.28±0.07 5 2 3 1 3.14±0.04 6 2 2.96±0.04 7 3(85) 3 2 3.67±0.03 8 3 1 3 3.39±0.03 2 1 1 3.53±0.04 k1 3.307 3.150 3.257 k2 3.127 3.380 3.320 k3 3.530 3.433 3.387 R 0.403 0.283 0.130 9 3 2
如表1所示,影响昆布多糖提取率的最主因素是提取温度,主次因素依次为A>B>C,最优水平组合为A3B3C3,即提取温度85 ℃、料液比1∶80(g/mL)、提取时间5 h。对最优试验条件进行3 组平行实验验证,在最优条件下,昆布多糖提取率为(5.97±0.04)%。可见,该正交试验结果可靠。
热水浸提是提取多糖的传统方法,其提取效果主要受提取温度、提取时间以及料液比等因素等影响。本实验结果符合文献报道的一般结论。如魏晓梅等[26]在云南松茸多糖提取方案优化及测定中,得到最佳水提条件为温度80 ℃、时间3 h、料液比1∶15(g/mL);朱振元等[27]的滑子菇多糖提取工艺优化中,得到最佳提取条件为温度85 ℃、提取2 h、料液比1∶40(g/mL)。可见,多糖多在温度较高时容易提取出来,不同原料的提取最优料液比与时间有差别,这与不同原料自身的性质有关。
2.2.1 单因素试验结果
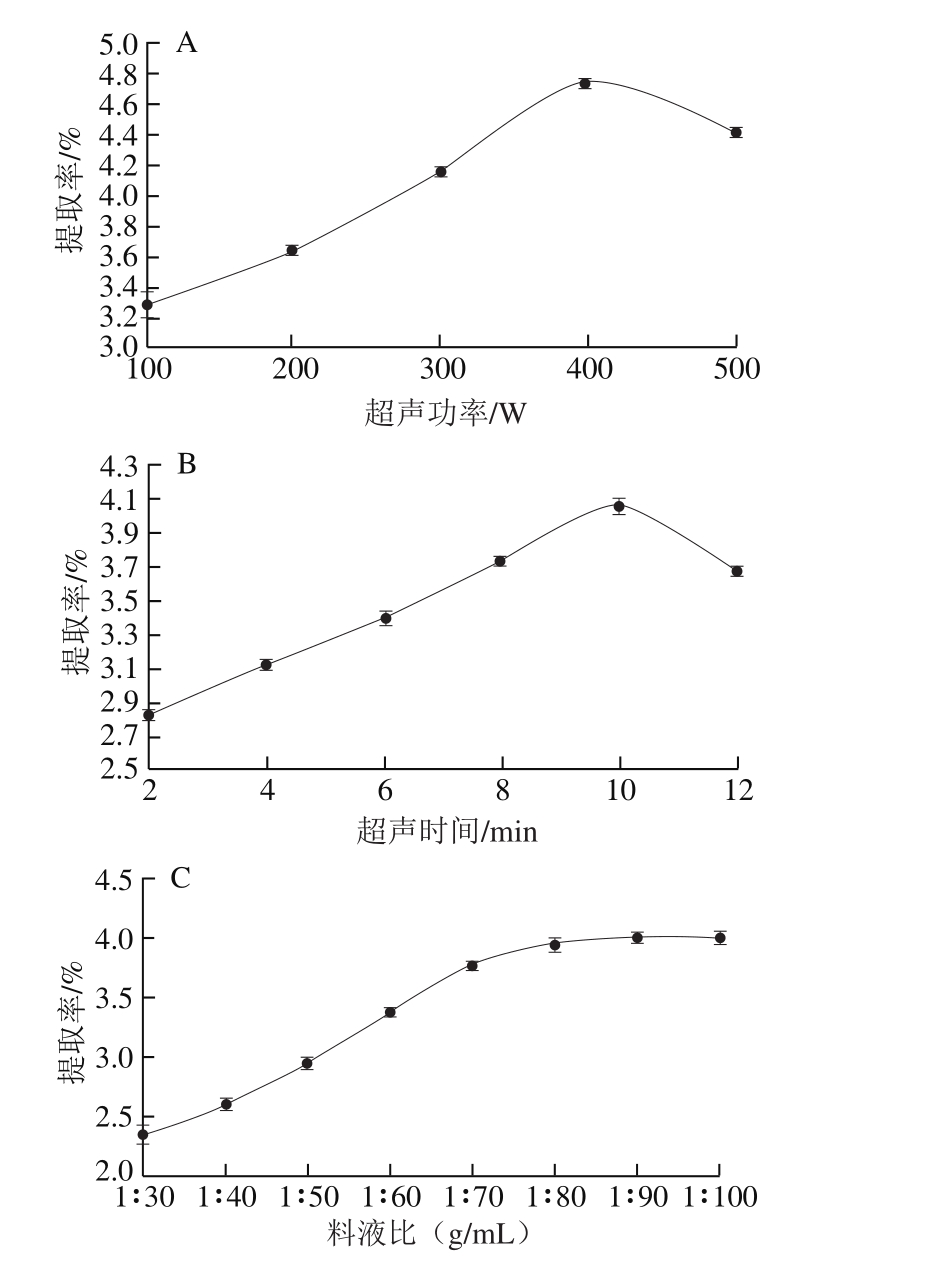
图2 超声功率(A)、超声时间(B)和料液比(C)对昆布多糖提取率的影响
Fig. 2 Effects of ultrasonic power (A), irradiation time (B) and solid-tosolvent ratio (C) on the extraction efficiency of polysaccharides by UAE
由图2A可知,从100 W开始,随着超声功率的增加,昆布多糖提取率快速增加,但在超声功率为400 W时达到最高点,之后开始下降。超声功率的增加使得同样时间内对细胞壁的作用增强,多糖分子可以更顺利的从细胞内进入到溶液中,从而在一定范围内,昆布多糖提取率一直在增加,但当达到最高点后,过大的超声功率可能会对多糖分子产生破坏作用,使多糖提取率下降。从图2B可以看出,随着超声时间的延长,昆布多糖提取率几乎以直线形式增加,但在第10分钟时达到最高点,之后开始下降。这可能由于随着超声时间的延长,多糖以至单糖的结构发生了变化,化学键如C—O—C和C—O—H键断裂导致不能发生显色反应,从而造成苯酚-硫酸法测定的总糖含量降低[28-29]。从图2C可以看出,随着料液比的增大,昆布多糖提取率逐渐增多,在料液比为1∶80(g/mL)时达到最高点,然后趋于平缓。可见料液比越大,可容纳的多糖分子越多,但并不能无限增多,溶液会达到饱和。因此,在本实验条件下,分别选择超声功率400 W、超声时间10 min和料液比1∶80(g/mL)为最佳提取参数。
2.2.2 正交试验结果
表2 超声辅助提取法正交试验设计与结果
Table 2 Orthogonal array design L9 (33) with experimental results for optimization of UAE conditions
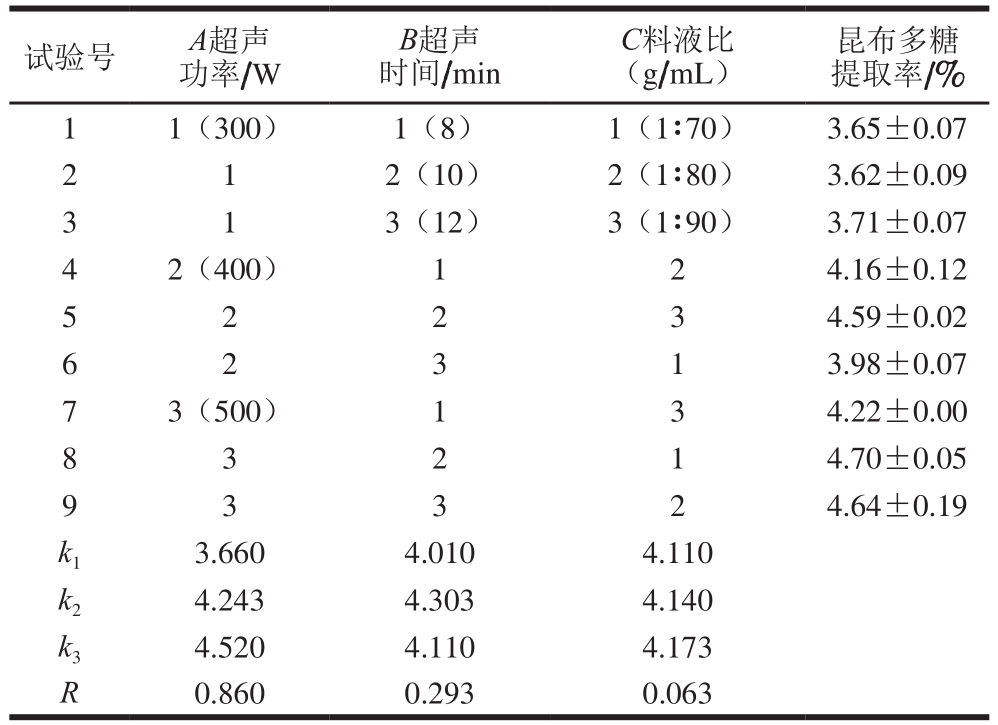
试验号A超声功率/W昆布多糖提取率/%1 1(300) 1(8) 1(1∶70) 3.65±0.07 2 1 2(10) 2(1∶80) 3.62±0.09 3 1 3(12) 3(1∶90) 3.71±0.07 B超声时间/min C料液比(g/mL)4 2(400) 1 2 4.16±0.12 5 2 2 3 4.59±0.02 6 2 3 1 3.98±0.07 7 3(500) 1 3 4.22±0.00 8 3 2 1 4.70±0.05 9 3 3 2 4.64±0.19 k1 3.660 4.010 4.110 k2 4.243 4.303 4.140 k3 4.520 4.110 4.173 R 0.860 0.293 0.063
如表2所示,影响昆布多糖提取率的最主因素为超声功率,主次因素依次为A>B>C,最优水平组合为A3B2C3,即超声功率500 W、超声时间10 min、料液比1∶90(g/mL)。对最优条件进行3 组平行实验验证,昆布多糖的提取率为(5.81±0.00)%。可见,该正交试验优化结果可靠。
2.3.1 单因素试验结果
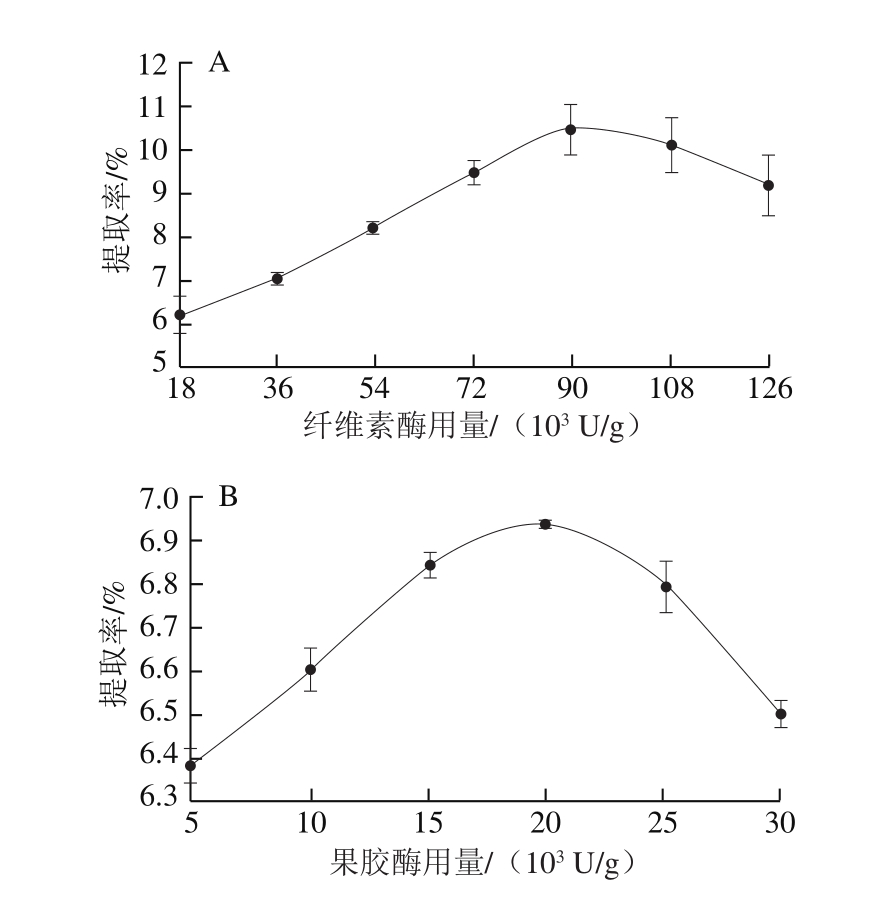

图3 纤维素酶(A)、果胶酶(B)和木瓜蛋白酶(C)用量对昆布多糖提取率的影响
Fig. 3 Effects of cellulase (A), pectinase (B), and papain (C) dosage on the extraction efficiency of polysaccharides by MEE
由图3A可以看出,随着纤维素酶用量的增加,昆布多糖提取率逐渐增加,当加入90 000 U/g的纤维素酶时,昆布多糖含量达到最大,当继续增加纤维素酶的用量,昆布多糖提取率则开始下降。从图3B可以看出,随着果胶酶的加入,昆布多糖提取率也是呈现先增加后减少的趋势,最高点是果胶酶加入量20 000 U/g。由图3C可知,昆布多糖提取率随着木瓜蛋白酶的增加而增多,在木瓜蛋白酶的量为90 U/g时达到最大,然后趋于平缓。因此,选择纤维素酶、果胶酶和木瓜蛋白酶的最适用量分别为90 000、20 000 U/g和90 U/g。
2.3.2 正交试验结果
表3 复合酶提取法正交试验设计与结果
Table 3 Orthogonal array design L9 (33) with experimental results for optimization of MEE conditions
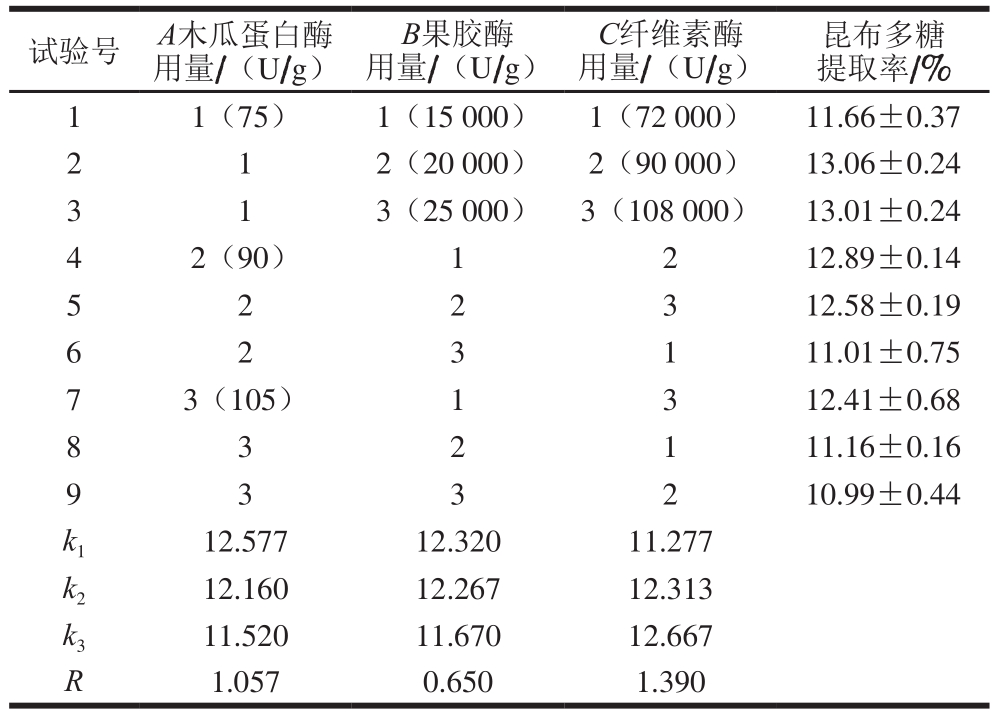
试验号A木瓜蛋白酶用量/(U/g)昆布多糖提取率/%1 1(75) 1(15 000) 1(72 000) 11.66±0.37 2 1 2(20 000) 2(90 000) 13.06±0.24 3 1 3(25 000) 3(108 000) 13.01±0.24 4 2(90) 1 2 12.89±0.14 5 2 2 3 12.58±0.19 6 2 3 1 11.01±0.75 B果胶酶用量/(U/g)C纤维素酶用量/(U/g)7 3(105) 1 3 12.41±0.68 8 3 2 1 11.16±0.16 2 10.99±0.44 k1 12.577 12.320 11.277 k2 12.160 12.267 12.313 k3 11.520 11.670 12.667 R 1.057 0.650 1.390 9 3 3
在固定pH 5、温度50 ℃、料液比1∶70(g/mL)及时间3 h条件下,考察3 种酶不同配比对昆布多糖提取率的影响,如表3所示。影响昆布多糖提取率最显著的酶是纤维素酶,然后依次是木瓜蛋白酶和果胶酶。最优水平组合为A1B1C3,即木瓜蛋白酶75 U/g、果胶酶15 000 U/g、纤维素酶108 000 U/g。对最优复合酶组合条件进行3 组平行实验验证,昆布多糖的提取率为(14.29±0.02)%,提示该正交试验优化结果可靠。
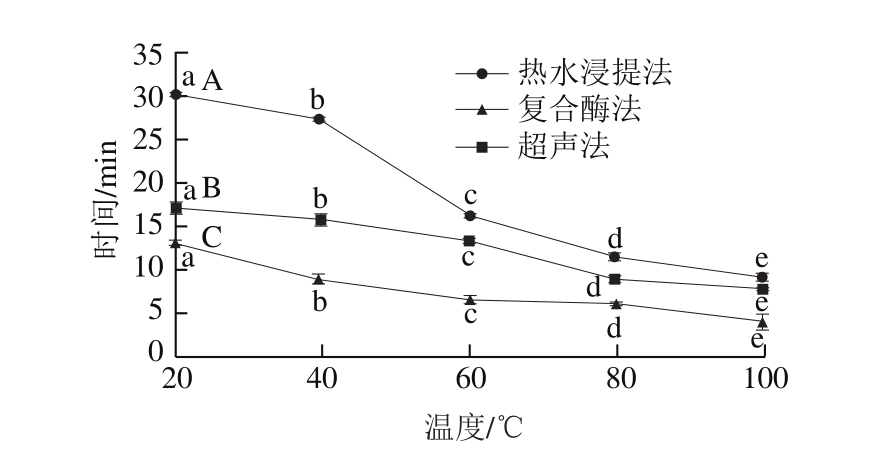
图4 提取方法对昆布多糖溶解性的影响
Fig. 4 Effects of extraction methods on solubility of polysaccharides fromL. japonica
不同大写字母表示组间差异显著(P<0.05);不同小写字母表示组内差异显著(P<0.05)。
从图4可以看出,不同提取方法提取的多糖的溶解性有着显著差异(P<0.05)。溶解时间随着溶解温度的升高而降低。复合酶法的溶解时间显著低于热水浸提法和超声提取法(P<0.05)。可能是由于复合酶使得多糖的结构疏松,部分糖蛋白中的蛋白质分解,分子质量更小,所以更容易溶解。
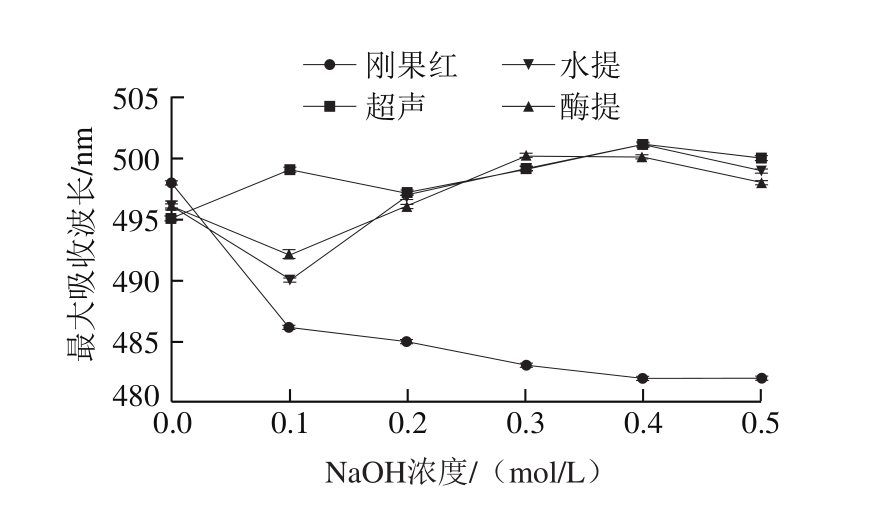
图5 NaOH溶液浓度对刚果红-昆布多糖络合物最大吸收波长的影响
Fig. 5 Maximum absorption wavelength of Congo red complexes of polysaccharides fromL. japonica at various NaOH concentrations
多糖的抗肿瘤活性不仅与多糖分子的一级结构有关,还与多糖分子的高级结构有关,而其中三股螺旋结构是多糖分子中最具有活性的空间构象[30]。通过刚果红实验,具有三股螺旋结构的多糖会与刚果红形成络合物,使得溶液的最大吸收波长发生变化,由此推测多糖是否具有三股螺旋结构。由图5可以看出,随着NaOH溶液浓度的增加,热水浸提的多糖和复合酶法提取的多糖均是先降低再升高再降低,说明在低浓度NaOH溶液和高浓度NaOH溶液条件下,样品的螺旋结构解体,是以无规则线团的形式存在,而在浓度0.3 mol/L左右的NaOH溶液条件下,是其三股螺旋结构与刚果红形成了络合物,使得最大吸收波长向长波方向移动。

图6 提取方法对昆布多糖紫外光谱的影响
Fig. 6 UV absorption spectra of polysaccharides from L. japonica extracted by three extraction methods
从图6可以看出,3 种不同提取方法的昆布多糖的紫外光谱是大体相同的,在波长280 nm处略有吸收峰,说明样品中含有较少的蛋白质或多肽,这与以上粗多糖中蛋白质含量的测定结果一致。
表4 不同提取方法的昆布多糖的抗肿瘤活性
Table 4 Antitumor activity of polysaccharides fromL. japonica
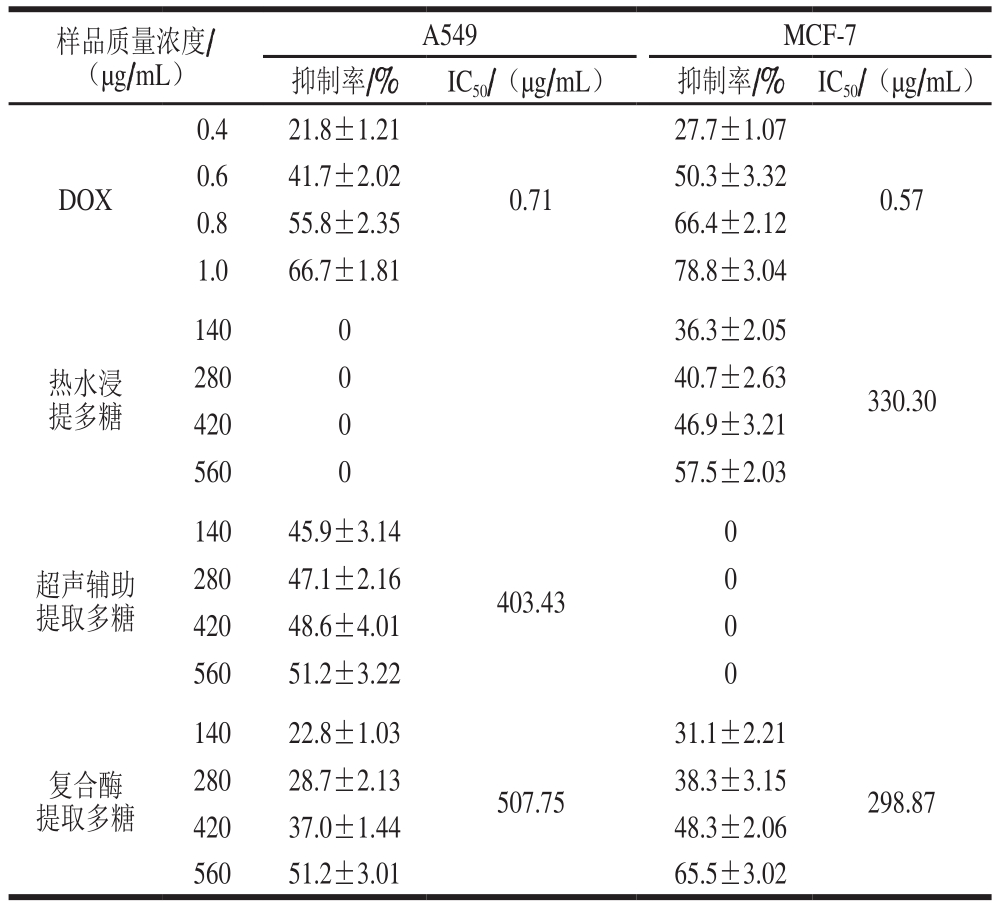
样品质量浓度/(µg/mL)A549 MCF-7抑制率/% IC50/(µg/mL) 抑制率/% IC50/(µg/mL)0.4 21.8±1.2127.7±1.07 DOX 0.6 41.7±2.02 50.3±3.32 0.8 55.8±2.35 66.4±2.12 1.0 66.7±1.81 78.8±3.04 0.710.57 140 0 36.3±2.05热水浸提多糖280 0 40.7±2.63 420 0 46.9±3.21 560 0 57.5±2.03 330.30 140 45.9±3.140超声辅助提取多糖280 47.1±2.16 0 420 48.6±4.01 0 560 51.2±3.22 0 403.43 140 22.8±1.0331.1±2.21复合酶提取多糖280 28.7±2.13 38.3±3.15 420 37.0±1.44 48.3±2.06 560 51.2±3.01 65.5±3.02 507.75298.87
多糖在抗肿瘤药物的研究中占有一定的比例,研究表明多种多糖对肿瘤细胞都有一定的效果[31-32]。MTT实验表明,昆布多糖可以对人乳腺癌细胞MCF-7和人肺癌细胞A549产生抑制作用,并且不同提取方法的昆布多糖的抗癌活性并不相同,结果如表4所示。可见热水浸提昆布多糖对人肺癌细胞A549无抑制作用,对于人乳腺癌细胞有一定抑制效果,超声提取昆布多糖正好相反,而酶法提取昆布多糖对2 种肿瘤细胞均具有抑制作用。总体来说,对于人肺癌细胞A549,超声提取的昆布多糖的IC50最小,说明其对该肿瘤细胞的抑制效果最好,而对于人乳腺癌细胞MCF-7,复合酶法提取而昆布多糖抑制效果最好。该实验结果表明不同方法提取的多糖结构或包含的活性基团不同,也可能是由于复合酶法提取的昆布多糖杂质含量较少,多糖纯度更高以致其生物活性更高。
通过3 种不同提取方法的条件优化,表明复合酶法的昆布粗多糖提取率最高,是由于酶对植物细胞壁发挥了作用,使细胞中的多糖更容易分离出来,进入到溶液中。超声提取法的提取率稍小于热水浸提,可能是由于超声时间相较于热水浸提的时间较短,并且超声处理的过程始终是在冰水浴中进行,温度较低,不利于多糖的溶出。通过3 种方法提取率的比较,为以后昆布多糖的大量提取可靠依据。不同提取方法对昆布多糖的化学组成和溶解性等理化性质以及抗肿瘤活性有显著的影响,不同提取方法所得多糖的分离纯化、结构表征及其与抗肿瘤活性的关系有待进一步深入研究。
[1] 王丽波, 程龙, 徐雅琴, 等. 南瓜籽多糖热水提取工艺优化及其抗氧化活性[J]. 农业工程学报, 2016, 32(9): 284-290. DOI:10.11975/j.issn.1002-6819.2016.09.040.
[2] 李奎, 李雪玲. 响应面法优化碱液提取百蕊草多糖的工艺研究[J].食品工业科技, 2015, 36(7): 204-207; 213. DOI:10.13386/j.issn1002-0306.2015.07.035.
[3] 税丹, 王立峰, 袁建, 等. 酸法提取菜籽多糖的抗氧化活性研究[J].食品科学, 2011, 32(21): 98-101.
[4] CHEN C, ZHANG B, HUANG Q, et al. Microwave-assisted extraction of polysaccharides from Moringa oleiferaLam. leaves:characterization and hypoglycemic activity[J]. Industrial Crops and Products, 2017, 100: 1-11. DOI:10.1016/j.indcrop.2017.01.042.
[5] 邱现创, 赵宁, 李晨, 等. 铁皮石斛多糖提取工艺优化及对果蝇抗氧化能力的影响[J]. 食品科学, 2018, 39(2): 273-280. DOI:10.7506/spkx1002-6630-201802043.
[6] 赵亚红, 王文侠, 张显斌, 等. 高温高压提取甜菜废粕多糖的工艺及其抗氧化性研究[J]. 食品与发酵工业, 2015, 41(4): 230-235.DOI:10.13995/j.cnki.11-1802/ts.201504043.
[7] BHOTMANGE U D, WALLENIUS H J, SINGHAL S R, et al.Enzymatic extraction and characterization of polysaccharide from Tuber aestivum[J]. Bioactive Carbohydrates and Dietary Fibre, 2017,10: 1-9. DOI:10.1016/j.bcdf.2017.02.001.
[8] 张帅, 郑宝东, 林良美, 等. 笋壳多糖的微波-超声波联合辅助提取工艺优化及其抗氧化活性[J]. 食品科学, 2015, 36(16): 72-76.DOI:10.7506/spkx1002-6630-201516013.
[9] 万宇俊, 殷军艺, 聂少平, 等. 微波提取对胡萝卜中的多糖基本结构特征及固体形貌的影响[J]. 食品科学, 2017, 38(7): 1-5.DOI:10.7506/spkx1002-6630-201707001.
[10] SUN Y, HOU S, SONG S, et al. Impact of acidic, water and alkaline extraction on structural features, antioxidant activities of Laminaria japonica polysaccharides[J]. International Journal of Biological Macromolecules, 2018, 112: 985-995. DOI:10.1016/j.ijbiomac.2018.02.066.
[11] ZHU Z Y, DONG F, LIU X, et al. Effects of extraction methods on the yield, chemical structure and anti-tumor activity of polysaccharides fromCordyceps gunnii mycelia[J]. Carbohydrate Polymers, 2016, 140:461-471. DOI:10.106/j.carbpol.2015.12.053.
[12] WANG J L, ZHANG J, WANG X F, et al. Comparison study on microwave-assisted extraction ofArtemisia sphaerocephala polysaccharides with conventional method: molecule structure and antioxidant activities evaluation[J]. International Journal of Biological Macromolecules, 2009, 45(5): 483-492. DOI:10.1016/j.ijbiomac.2009.09.004.
[13] ZHAO C L, LI X, MIAO J, et al. The effect of different extraction techniques on property and bioactivity of polysaccharides from Dioscorea hemsleyi[J]. International Journal of Biological Macromolecules, 2017, 102: 847-856. DOI:10.1016/j.ijbiomac.2017.04.031.
[14] YAN Y J, LI X, WAN M, CHEN J, et al. Effect of extraction methods on property and bioactivity of water-soluble polysaccharides from Amomum villosum[J]. Carbohydrate Polymers, 2015, 117: 632-635.DOI:10.1016/j.carbpol.2014.09.070.
[15] 国家药典委员会编. 药典: 一部[S]. 北京: 化学工业出版社, 2010.
[16] XU H L, KITAJIMA C, ITO H, et al. Antidiabetic effect of polyphenols from brown algaEcklonia kurome in genetically diabetic KK-A(y) mice[J]. Pharmaceutical Biology, 2011, 50(3): 393-400.DOI:10.3109/13880209.2011.60146.
[17] SIN S S, YOON M. The herbal composition GGEx18 from Laminaria japonica,Rheum palmatum, andEphedra sinica inhibits highfat diet-induced hepatic steatosis via hepatic PPARα activation[J].Pharmaceutical Biology, 2012, 50(10): 1261-1268. DOI:10.3109/1388 0209.2012.666982.
[18] HUANG L, WEN K, GAO X, et al. Hypolipidemic effect of fucoidan fromLaminaria japonicain hyperlipidemic rats[J]. Pharmaceutical Biology, 2010, 48(4): 422-426. DOI:10.3109/13880200903150435.
[19] CHOI J S, BAE H J, KIM S J, et al.In vitro antibacterial and antiinflammatory properties of seaweed extracts against acne inducing bacteria,Propionibacterium acnes[J]. Journal of Environmental Biology, 2011, 32(3): 313-318.
[20] 季宇彬, 娄艳华, 高世勇. 昆布多糖分离纯化及其抗肿瘤活性的研究[J]. 中草药杂志, 2009(1): 132-135.
[21] ZENG M, WU X, LI F, et al.Laminaria japonica polysaccharides effectively inhibited the growth of nasopharyngeal carcinoma cellsin vivoand in vitrostudy[J]. Experimental and Toxicologic Pathology,2017, 69(7): 527-532.
[22] 万琴, 萧伟, 王振中, 等. 女贞子多糖除蛋白工艺的研究[J]. 中草药,2010, 41(3): 407-410.
[23] KONG L S, YU L, FENG T, et al. Physicochemical characterization of the polysaccharide from Bletilla striata: effect of drying methods[J]. Carbohydrate Polymers, 2015, 125: 1-8. DOI: 10.1016/j.carbpol.2015.02.042.
[24] 徐雅琴, 刘菲, 郭莹莹, 等. 黑穗醋栗果实超声波降解多糖的结构及抗糖基化活性[J]. 农业工程学报, 2017, 33(5): 295-300.
[25] 于曼曼, 夏光华, 李川, 等. 罗非鱼头长链碱的分离纯化及抗肿瘤活性[J]. 食品科学, 2018, 39(5): 166-172. DOI:10.7506/spkx1002-6630-201805025.
[26] 魏晓梅, 吴丽芳, 柏旭, 等. 云南松茸多糖提取方案优化及其测定[J]. 中国食用菌, 2018(1): 46-49. DOI:10.13629/j.cnki.53-1054.2018.01.012.
[27] 朱振元, 韩丹. 滑子菇多糖提取工艺优化[J]. 食品研究与开发, 2018,39(4): 68-72. DOI:10.3969/j.issn.1005-6521.2018.04.012.
[28] 王振斌, 刘加友, 马海乐, 等. 无花果多糖提取工艺优化及其超声波改性[J]. 农业工程学报, 2014, 30(10): 262-269. DOI:10.3969/j.issn.1002-6819.2014.10.033.
[29] 刘娜女, 张静, 李岱, 等. 利用傅立叶红外光谱和原子力显微镜研究超声提取对鸡腿菇多糖结构的影响[J]. 生物加工过程, 2010(1): 56-60. DOI:10.3969/j.issn.1672-3678.2010.01.011.
[30] MENG X, LIANG H, LUO L. Antitumor polysaccharides from mushrooms: a review on the structural characteristics, antitumor mechanisms and immunomodulating activities[J]. Carbohydrate Research, 2016, 424: 30-41. DOI:10.1016/j.carres.2016.02.008.
[31] 丁振东, 张玉影, 张宇, 等. 五味子多糖对脑肿瘤干细胞的凋亡诱导及生长抑制作用[J]. 吉林大学学报(医学版), 2018(2): 305-309.DOI:10.13481/j.1671-587x.20180218.
[32] CHEN YJ, JIANG X, XIE H Q, et al. Structural characterization and antitumor activity of a polysaccharide fromRamulus mori[J].Carbohydrate Polymers, 2018, 190: 232-239. DOI:10.1016/j.carbpol.2018.02.036.
Polysaccharides from Laminaria japonica:Optimization of Different Extraction Processes and Comparison of Physicochemical Properties and Antitumor Activity
LI Ying, HUANG Dechun, CHEN Guitang, et al. Polysaccharides from Laminaria japonica:optimization of different extraction processes and comparison of physicochemical properties and antitumor activity[J]. Food Science, 2019, 40(6):289-295. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180312-147. http://www.spkx.net.cn