黑莓果实富含花色苷等多酚类物质,具有较强的抗氧化、抗炎、抗癌、保护血管、减缓衰老等作用[1-4]。由于黑莓组织娇嫩,水分含量高,不易贮藏,通常以果汁、果酒、蜜饯等加工产品食用。其果汁产品最大程度保留其汁液营养成分,是理想的加工产品。目前,黑莓果汁加工领域仍存在出汁率低、贮藏过程容易产生沉淀分层、浑浊等问题[5]。因此,提高黑莓果汁,尤其是清汁出汁效率和果汁品质,仍是黑莓深加工业要解决的重要问题。
黑莓果实含有丰富的果胶和纤维素,果浆黏度高,不易出汁。研究表明,采用酶解技术条件反应温和,可以大大提高果汁的出汁率,尤其果胶酶和果浆酶复合使用,能够加速汁液的流出,并可以有效控制悬浮颗粒,提高果汁的稳定性[6-9]。除酶作用之外,一些非传统加工技术如微波、超声波等由于其高效、环保不断被应用于食品原料的降解、制备等加工过程[11-12]。其中,基于空化效应的超声波辅助技术应用于原料处理,可破坏细胞壁和细胞膜的结构,加速内容物的流出,提高原料的加工效率[13-15]。若将其与酶联用,可能会出现协同效应,提高黑莓果汁的品质。因此,采用响应面试验设计优化超声辅助酶解制备黑莓清汁的工艺条件,对优化条件下黑莓果汁的品质和贮藏稳定性进行评价,并对超声波辅助酶作用的协同机理进行探讨,以期为黑莓果汁的综合深加工提供参考。
黑莓(-20 ℃贮存) 江苏惠田农业科技开发有限公司;果胶酶(6×104 U/g)、果浆酶(含纤维素酶、半纤维素酶和果胶酶,4×104 U/g) 宁夏夏盛实业集团有限公司。所有试剂均为国产分析纯。
KQ-2500E型超声波清洗器 昆山禾创仪器有限公司;UV-3802H紫外-可见分光光度仪 上海尤尼柯仪器有限公司;WSC-S测色色差计 上海精科科学仪器有限公司;真空冷冻干燥机 上海比朗仪器制造有限公司;EVOLS10扫描电子显微镜 德国卡尔·蔡司公司。
1.3.1 黑莓清汁的制备工艺
黑莓冻果4 ℃解冻→热烫→冷却→匀浆→酶解(果胶酶酶解、果浆酶酶解、复合酶酶解、超声辅助酶解)→灭酶→离心→黑莓清汁
将冷冻保存的黑莓在4 ℃解冻10 h,蒸汽热烫3 min,冷却后匀浆,得到黑莓浆15 kg,备用。果胶酶和果浆酶按照1∶1比例组合成复合酶,按照试验设计用量加入到100 g黑莓浆中,超声条件下进行酶解反应,酶解结束后,加热到90 ℃灭酶5 min,冷却后于5 000 r/min离心15 min,取上清液,计算出汁率(式(1)),并以蒸馏水为参照,测定其在660 nm波长处的透光率。对照组(果胶酶、果浆酶、复合酶)进行水浴实验,其他条件与超声辅助酶解相同。
1.3.2 单因素试验
根据黑莓清汁的制备工艺,设定超声功率200 W、酶解温度45 ℃、酶解时间1.5 h、加酶量0.2%为固定条件,分别研究超声功率(100、200、300、400 W)、酶解温度(35、40、45、50 ℃)、酶解时间(1.0、1.5、2.0、2.5 h)及加酶量(0.1%、0.2%、0.3%、0.4%)对出汁率和透光率的影响。
1.3.3 响应面试验
在单因素试验结果基础上,采用响应面分析法优化超声辅助酶解制备黑莓清汁的工艺条件。以出汁率和透光率为响应值,以超声功率、酶解时间、酶解温度、加酶量4 个因素为自变量进行响应面优化设计,见表1,其中-1、0、1分别代表自变量的低、中、高3 个水平。3 次平行实验所得的平均值采用二次多项式模型分析,见式(2):
式中:Y为响应值;α0为常数项;αi、αii和αij分别为一次项、二次项和交互项的回归方程系数;Xi和Yj为自变量。F检验和P值用于检验回归模型的显著性。
表1 响应面设计因素与水平
Table 1 Coded levels and corresponding actual levels of independent variables used in response surface analysis

水平 因素X1超声功率/WX2酶解时间/hX3酶解温度/℃X4加酶量/%-1 200 1.0 40 0.1 0 300 1.5 45 0.2 1 400 2.0 50 0.3
1.3.4 黑莓果汁品质指标测定
分别设置超声辅助酶解组、果胶酶组、果浆酶组、复合酶组4 个处理组,对果汁的色度、花色苷含量、总酚含量、贮藏稳定性等测定,进行黑莓果汁品质的评价。
色度:将适量样品于5 000 r/min离心15 min,取上清液1 mL,用WSC-S测色色差计测定黑莓果汁的L*、a*、b*值。L*表示亮度,a*表示红/绿,b*表示黄/蓝。
花色苷含量:参照文献[16-17],分别配制pH 1.0缓冲液(将0.2 mol/L KCl与0.2 mol/L HCl以25∶67的比例配制)和pH 4.5缓冲液(将1 mol/L NaAc、1 mol/L HCl与H2O以100∶60∶90的比例配制)。取2 个10 mL棕色容量瓶,加入1 mL蒸馏水,分别加入9 mL pH 1.0缓冲液和pH 4.5缓冲液,摇匀,放置2 h,分别测定510 nm和700 nm波长处的吸光度,作为对照组。测定样品时,取1 mL果汁,操作同上。花色苷含量测定见式(3):
式中:A=(A510 nm-A700 nm)pH 1.0-(A510 nm-A700 nm)pH 4.5;Mr为矢车菊素-3-葡萄糖苷相对分子质量(449.2);DF为稀释倍数;ε为矢车菊素-3-葡萄糖苷的摩尔消光系数(取26 900);1为比色皿光程(1 cm)。
总酚含量:采用福林-酚法测定样品的总酚含量,参照文献[18]并适当调整。用10.0 mL乙醇溶解0.500 0 g没食子酸,定容至100 mL,分别移取0、1.0、2.0、3.0、5.0、10.0 mL到100 mL容量瓶中,用去离子水定容,没食子酸质量浓度分别为0、50、100、150、250、500 mg/L。从上述不同质量浓度的标准溶液中分别移取1.0 mL加入到10 mL容量瓶中,分别加入1.5 mL去离子水,混合均匀;加入0.5 mL 1 mol/L福林-酚试剂,混合均匀;1 min之后,加入1.0 mL 20%碳酸钠溶液,混合。将上述标准溶液20 ℃放置2 h后,在765 nm波长处测定吸光度。取黑莓果汁,稀释到适宜质量浓度。取1.0 mL稀释后的黑莓汁,按照上述标准曲线测定方法,测定其吸光度。根据标准曲线方程求出样品中总酚含量。
贮藏稳定性:将不同处理条件得到的黑莓清汁在室温见光条件下贮藏6 周,每1 周取样。利用色差计测定其色度值(L*、a*、b*)的变化,比较分析超声辅助酶解组、果胶酶组、果浆酶组、复合酶组果汁色泽的稳定性。同时测定贮藏期间花色苷含量、总酚含量和透光率的变化。
1.3.5 扫描电子显微镜观察
取适量黑莓果浆酶解、离心后的沉淀,真空冷冻干燥,将冻干样品黏附在具有双面导电性的铝箔纸上,喷金镀膜,加速电压为10.0 kV,在扫描电子显微镜下观察样品的形貌,分析超声协同酶解对黑莓果浆微观结构的影响。
所有样品重复测定3 次,利用SPSS 18.0和Design-Expert V8.0.5软件进行数据处理及统计分析。
从图1可以看出,当超声功率达到200~400 W时,黑莓清汁的出汁率最大,而当其大于300 W时,透光率有所降低,可能是较大功率的超声波引起黑莓残余组织的破坏,导致清汁出现浑浊。因此选定300 W为最佳处理功率。当酶解温度为45 ℃时,出汁率达到最大,此温度下复合酶具有较高的酶活力,有利于底物的转化,而且得到的果汁具有较好透光率。当酶解温度为50 ℃时,虽然得到的果汁有较高透光率,但花色苷可能会随温度升高而出现降解[19]。已有研究证明,超声可能会引起水浴实际温度高于设定值的“附加效应”,逐渐升高的内部温度会引起果汁品质发生变化[20],且在提取过程中,酶与温度的交互作用对花色苷影响较大[13]。因此,选择45 ℃作为最优酶解温度。当酶解时间为1.5~2.5 h,加酶量为0.2%~0.3%时,黑莓果浆的出汁率较高,清汁透光率较好,综合考虑花色苷的损失程度及加工成本,选择酶解时间1.5 h、加酶量0.2%作为最佳条件。

图1 超声功率、酶解温度、酶解时间和加酶量对黑莓清汁的出汁率和透光率的影响
Fig. 1 Effects of ultrasonic power, hydrolysis temperature, time and enzyme concentration on the yield and transmittance of blackberry juice
2.2.1 回归模型的建立及其显著性检验
为有效考察超声和酶解协同作用于黑莓果汁的效果,本试验分别以出汁率Y1和透光率Y2为响应值,分析X1超声功率、X2酶解时间、X3酶解温度、X4加酶量对响应值的影响。响应面设计方案和结果见表2。对表中的数据进行多元回归拟合,获得二次多项回归模拟方程分别为:Y1=78.61-0.44X1+0.99X2+3.13X3+4.16X4+1.4X1X2+0.27X1X3+1.71X1X4+3.98X2X3-0.91X2X4+2.26X3X4-0.13 -2.38
-2.38 4.2
4.2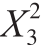 -4.45
-4.45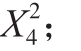 Y2=63.46-0.082X1-0.47X2+1.71X3+3.07X4+1.9X1X2+0.023X1X3-0.32X1X4+1.41X2X3-0.15X2X4+3.29X3X4-2.24
Y2=63.46-0.082X1-0.47X2+1.71X3+3.07X4+1.9X1X2+0.023X1X3-0.32X1X4+1.41X2X3-0.15X2X4+3.29X3X4-2.24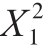 -2.55
-2.55 -1.74
-1.74 -5.5
-5.5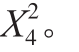
表2 响应面试验设计及结果
Table 2 Experimental design and results for response surface analysis
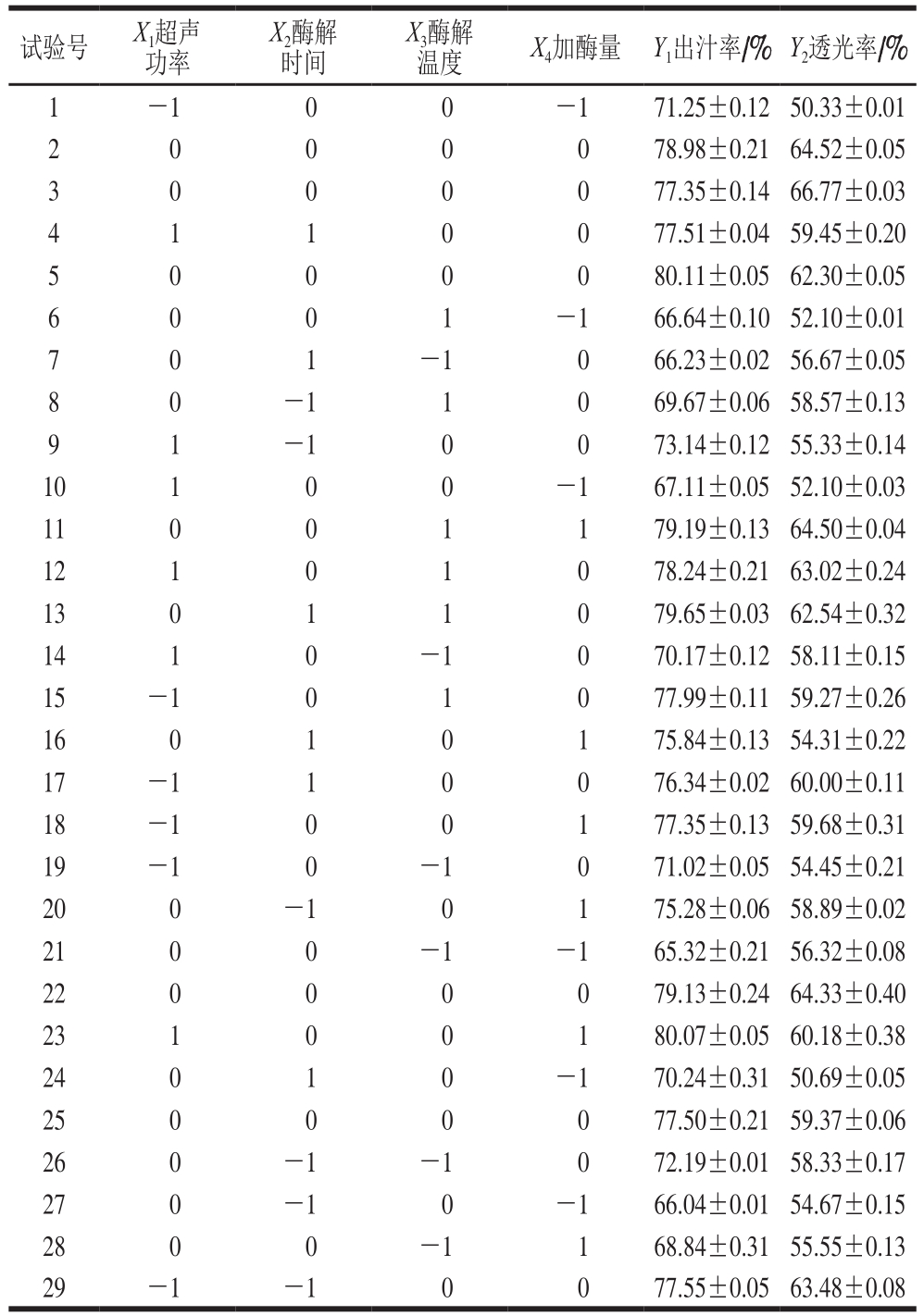
试验号X1超声功率X2酶解时间X3酶解温度X4加酶量Y1出汁率/%Y2透光率/%1 -1 0 0 -1 71.25±0.12 50.33±0.01 2 0 0 0 0 78.98±0.21 64.52±0.05 3 0 0 0 0 77.35±0.14 66.77±0.03 4 1 1 0 0 77.51±0.04 59.45±0.20 5 0 0 0 0 80.11±0.05 62.30±0.05 6 0 0 1 -1 66.64±0.10 52.10±0.01 7 0 1 -1 0 66.23±0.02 56.67±0.05 8 0 -1 1 0 69.67±0.06 58.57±0.13 9 1 -1 0 0 73.14±0.12 55.33±0.14 10 1 0 0 -1 67.11±0.05 52.10±0.03 11 0 0 1 1 79.19±0.13 64.50±0.04 12 1 0 1 0 78.24±0.21 63.02±0.24 13 0 1 1 0 79.65±0.03 62.54±0.32 14 1 0 -1 0 70.17±0.12 58.11±0.15 15 -1 0 1 0 77.99±0.11 59.27±0.26 16 0 1 0 1 75.84±0.13 54.31±0.22 17 -1 1 0 0 76.34±0.02 60.00±0.11 18 -1 0 0 1 77.35±0.13 59.68±0.31 19 -1 0 -1 0 71.02±0.05 54.45±0.21 20 0 -1 0 1 75.28±0.06 58.89±0.02 21 0 0 -1 -1 65.32±0.21 56.32±0.08 22 0 0 0 0 79.13±0.24 64.33±0.40 23 1 0 0 1 80.07±0.05 60.18±0.38 24 0 1 0 -1 70.24±0.31 50.69±0.05 25 0 0 0 0 77.50±0.21 59.37±0.06 26 0 -1 -1 0 72.19±0.01 58.33±0.17 27 0 -1 0 -1 66.04±0.01 54.67±0.15 28 0 0 -1 1 68.84±0.31 55.55±0.13 29 -1 -1 0 0 77.55±0.05 63.48±0.08
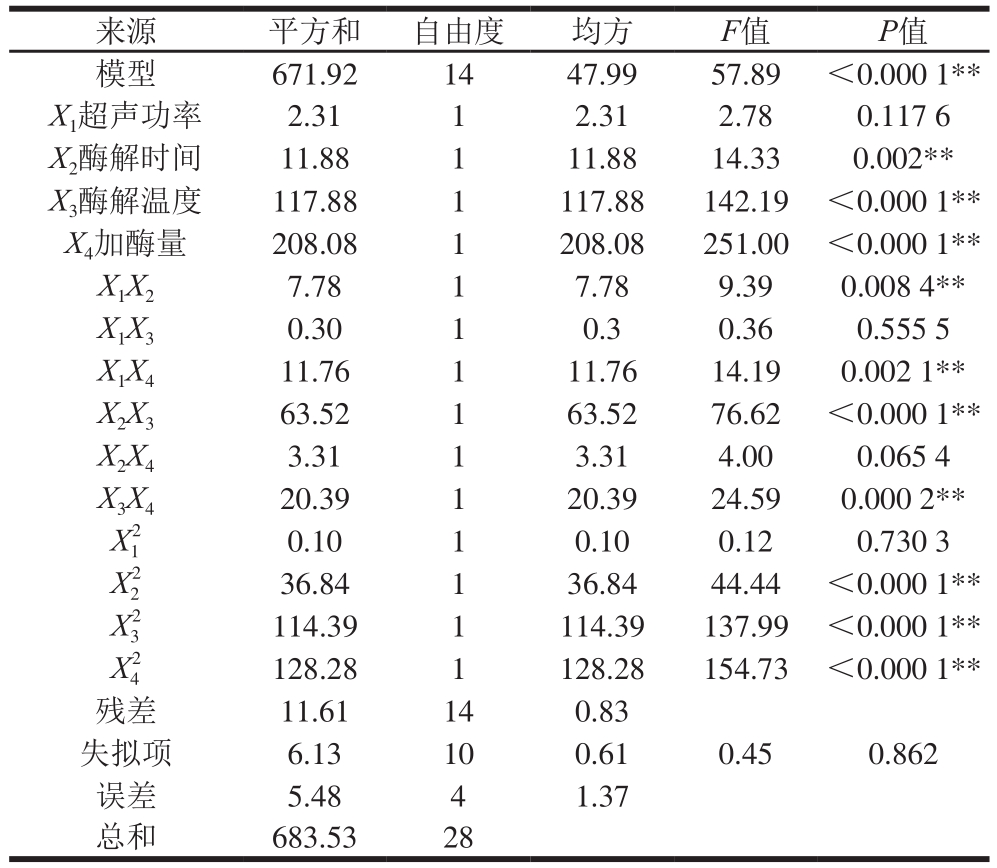
从表3、4可以看出,所获得的回归模型极显著,失拟项不显著,说明模型有效,能够较好地预测试验值。其中,酶解温度、加酶量和酶解时间对出汁率影响极显著(P<0.01),超声功率对其影响不显著。酶解时间、加酶量、酶解温度的二次项影响极显著(P<0.01),说明这3 个因素对黑莓清汁的出汁率有极大影响。加酶量对透光率的影响极显著,其他因素对透光率影响不大。
表3 回归模型出汁率方差分析
Table 3 Analysis of variance (ANOVA) of response surface model for juice yield (Y1)
注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。下同。
来源 平方和 自由度 均方F值P值模型 671.92 14 47.99 57.89 <0.000 1**X1超声功率 2.31 1 2.31 2.78 0.117 6 X2酶解时间 11.88 1 11.88 14.33 0.002**X3酶解温度 117.88 1 117.88 142.19 <0.000 1**X4加酶量 208.08 1 208.08 251.00 <0.000 1**X1X2 7.78 1 7.78 9.39 0.008 4**X1X3 0.30 1 0.3 0.36 0.555 5 X1X4 11.76 1 11.76 14.19 0.002 1**X2X3 63.52 1 63.52 76.62 <0.000 1**X2X4 3.31 1 3.31 4.00 0.065 4 X3X4 20.39 1 20.39 24.59 0.000 2**X12 0.10 1 0.10 0.12 0.730 3 X22 36.84 1 36.84 44.44 <0.000 1**X32 114.39 1 114.39 137.99 <0.000 1**X42 128.28 1 128.28 154.73 <0.000 1**残差 11.61 14 0.83失拟项 6.13 10 0.61 0.45 0.862误差 5.48 4 1.37总和 683.53 28
表4 回归模型透光率方差分析
Table 4 ANOVA of response surface model for transmittance (Y2)
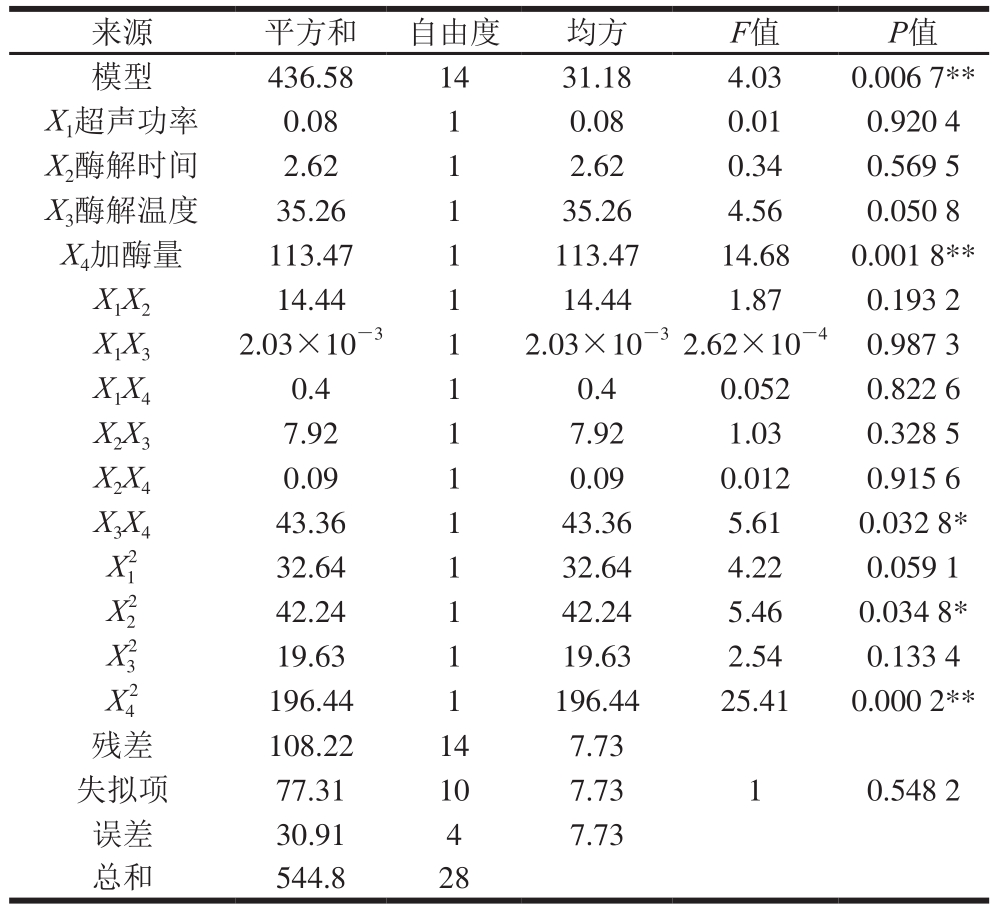
来源 平方和 自由度 均方F值P值模型 436.58 14 31.18 4.03 0.006 7**X1超声功率 0.08 1 0.08 0.01 0.920 4 X2酶解时间 2.62 1 2.62 0.34 0.569 5 X3酶解温度 35.26 1 35.26 4.56 0.050 8 X4加酶量 113.47 1 113.47 14.68 0.001 8**X1X2 14.44 1 14.44 1.87 0.193 2 X1X3 2.03×10-3 1 2.03×10-32.62×10-4 0.987 3 X1X4 0.4 1 0.4 0.052 0.822 6 X2X3 7.92 1 7.92 1.03 0.328 5 X2X4 0.09 1 0.09 0.012 0.915 6 X3X4 43.36 1 43.36 5.61 0.032 8*X12 32.64 1 32.64 4.22 0.059 1 X22 42.24 1 42.24 5.46 0.034 8*X32 19.63 1 19.63 2.54 0.133 4 X42 196.44 1 196.44 25.41 0.000 2**残差 108.22 14 7.73失拟项 77.31 10 7.73 1 0.548 2误差 30.91 4 7.73总和 544.8 28
2.2.2 响应面分析及优化结果
由图2可以看出,超声功率、酶解温度、酶解时间、加酶量4 个因素中任何两个交互因素对出汁率和透光率的响应面都存在最高点。通过Design-Expert V8.0软件分析得到黑莓果浆的最佳超声辅助酶解条件为超声功率200 W、酶解时间1.5 h、酶解温度45 ℃、加酶量0.3%,在此优化条件下所得出汁率预测值为(81.58±0.47)%,透光率为(69.02±0.26)%。为验证模型预测值的准确性,在上述优化条件下进行3 次平行验证实验,所得出汁率平均值为(80.89±0.65)%,透光率为(68.21±0.78)%,接近于模型预测值,说明本试验优化模型结果可靠。

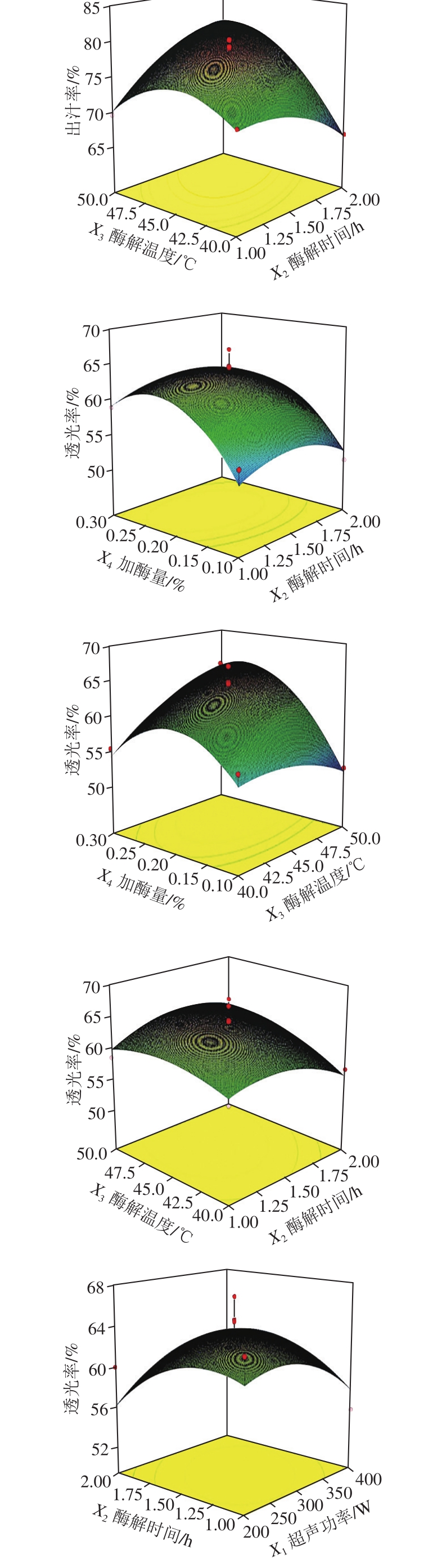
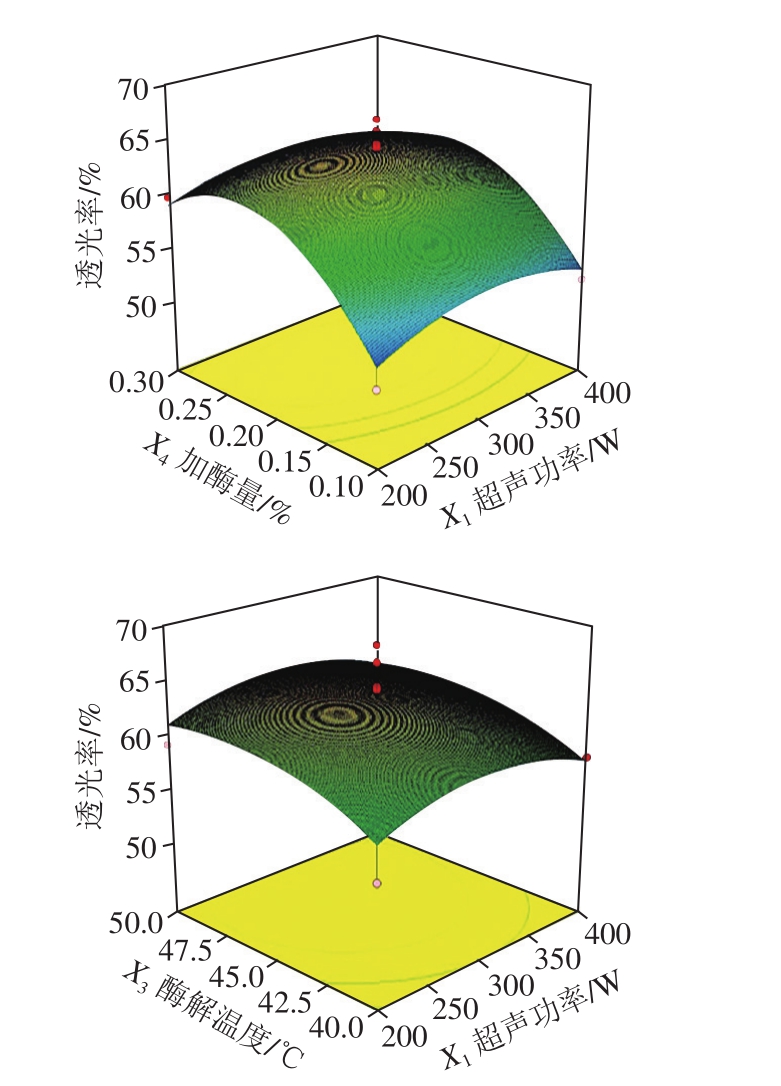
图2 交互作用对黑莓果汁出汁率和透光率的影响
Fig. 2 Response surface plots for the interactive effects of variables on blackberry juice yield and transmittance
表5 不同处理条件下黑莓果汁品质比较
Table 5 Comparison of blackberry juice quality with different treatments

注:同列不同小写字母表示差异显著(P<0.05)。下表同。
总酚质量浓度/(mg/L)超声酶解 81.05±0.12a 67.38±0.32a 668.33±1.02a 987.35±5.21a复合酶解 77.32±0.15b 63.34±0.38b 641.05±0.98e 730.65±6.15b果胶酶 67.37±0.24c 54.66±0.21d 648.35±1.35b736.98±12.42b果浆酶 66.57±0.31c56.30±0.02cd645.14±1.04bc745.60±10.30b匀浆离心 55.48±0.42d 50.30±0.39e 642.03±1.56d 718.57±6.84c处理条件 出汁率/% 透光率/% 花色苷质量浓度/(mg/L)
从表5可以看出,单一果胶酶或果浆酶处理的黑莓果汁出汁率、透光率显著小于超声酶解和复合酶解处理所得到的结果,说明超声处理和复合酶处理有助于提高底物转化率,促使黑莓果汁从大量果胶、纤维中溶出,并有助于提高出汁率和透光率。从表5还可以看出,超声辅助酶解处理后的果汁总酚含量明显高于其他处理组(P<0.05),可见,超声波能够促进酚类物质的溶出。此外,比较4 组花色苷含量可以看出,超声辅助酶解组结果明显高于其他3 组,说明低功率、低温、短时间的超声处理并不会影响黑莓花色苷的降解,反而有助于花色苷的溶出。与已有报道相比[7-8],超声波辅助复合酶解不仅缩短反应时间,提高果汁的出汁率,而且有助于营养成分的保持。
从图3a~c可以看出,L*、a*、b*值随贮藏时间发生变化。其中,L*值随时间延长逐渐增大,a*值和b*值随时间延长缓慢变小,这说明果汁中色素含量逐渐降低,即主要呈色物质花色苷发生部分降解。总体来看,超声辅助酶解处理的果汁样品相较于其他4 组处理样品的L*、a*、b*值变化较小,说明此果汁样品透光性较低,颜色呈红色,贮藏稳定性较好。这可能由于超声辅助酶解处理提高黑莓果汁中花色苷和其他多酚类物质的溶出量,而酚类物质能够与花色苷发生分子间辅色作用,提高花色苷的稳定性,最终使得果汁色泽稳定[21-24]。
从图3d、e可以看出,不同处理条件下的黑莓清汁花色苷和总酚在贮藏过程中含量呈降低趋势,说明花色苷可能发生降解。通过拟合曲线得出各处理条件下方程的斜率(表6)不同,即降解速率存在差异。其中超声辅助酶解组拟合方程的斜率绝对值小于其他组,可见超声辅助酶解后的黑莓清汁花色苷降解速率小于其他处理组,而花色苷降解的同时,其总酚含量也随之减少,这进一步验证色度变化的结果和结论。
从图3f可以看出,黑莓清汁在贮藏过程中的透光率呈缓慢下降趋势,其中超声辅助酶解处理组较其他处理组降低慢(斜率绝对值最小)。随着时间的延长,黑莓清汁中存在未被酶解的果胶、纤维素以及蛋白质等大分子物质易与花色苷、酚类发生聚合而降低果汁透光率[25-27]。而超声辅助酶解会提高果胶、纤维素等物质的水解效率,减少清汁中大分子含量,降低其聚合速率,同时,酚类与花色苷分子间的辅色作用提高了花色苷的稳定性,使得透光率降低变缓,黑莓清汁呈现出较好的稳定性。


图3 黑莓果汁色度的L*(a)、a*(b)和b*(c)、花色苷含量(d)、总酚含量(e)和透光率(f)随贮藏时间的变化
Fig. 3 Changes in color parametersL* (a),a* (b) andb* (c),anthocyanin content (d), total phenol content (e) and transmittance (f) in blackberry juice with storage time
表6 花色苷含量、总酚含量和透光率随贮藏时间的变化曲线拟合方程斜率
Table 6 Slopes of the fi tting equations of anthocyanin content, total phenol content and transmittance as a function of storage time

处理条件 拟合方程(y=a+bx)的斜率花色苷质量浓度 总酚质量浓度 透光率超声酶解 -3.71±0.33a -10.10±1.38a -0.53±0.17a果胶酶 -6.95±0.43c -20.93±1.65d -1.01±0.15c果浆酶 -5.66±0.24b -16.48±1.35c -1.12±0.11d复合酶 -5.95±0.33b -14.14±0.14b -0.86±0.09b匀浆离心 -6.58±0.41c -17.07±1.08c -1.21±0.14d
从图4a、b可以看出,与未处理原料(图4d)相比,经超声和酶解处理后的黑莓原料结构发生变化,由于组织细胞中的内容物质溶出,原料呈较大多孔状,并且超声辅助酶解处理(图4b)后的原料结构上坍塌,呈现出较大程度的破坏。这是由于在超声过程中,液体中压力发生变化,超声波能产生空化效应,加速热量和能量在介质中的传递速率,而这个过程中由空泡辐射出的冲击波足以使黑莓组织细胞发生破壁效应[28-29]。此外,低频率的超声波能够强化酶的活性[30-31]。本实验所优化的反应条件(超声功率200 W、酶解温度45 ℃)可有效促进体系中果胶酶和果浆酶的激活,加之超声波对此介质传质过程的影响,能够增强酶与底物的接触效率,提高底物转化率,即提高果汁的出汁率和透光率。
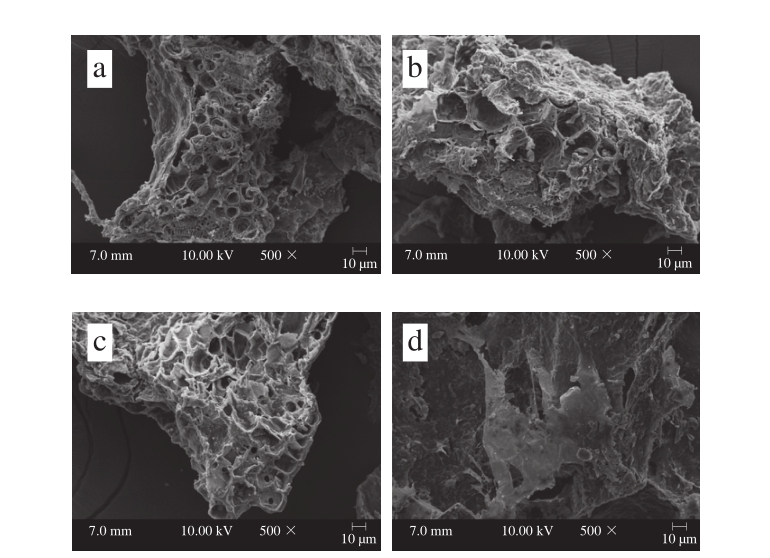
图4 不同条件处理的黑莓浆原料扫描电子显微镜图
Fig. 4 Scanning electron micrographs of blueberries with different treatments
a.超声处理;b.超声辅助酶解处理;c.复合酶处理;d.未处理。
本实验运用响应面法研究超声波协同复合酶(果胶酶+果浆酶)制备黑莓清汁的优化工艺条件,结果表明,最佳工艺条件为超声功率200 W、加酶量0.3%、酶解时间1.5 h、酶解温度45 ℃,此优化条件下制备的黑莓清汁出汁率为80.89%,透光率为68.21%。对黑莓清汁的营养成分和贮藏稳定性分析得出,花色苷含量和总酚含量明显高于单一酶解组,且果汁色泽呈红色,具有较好的贮藏稳定性。进一步对超声波辅助酶解提高黑莓果汁品质的机理进行分析得出,在反应介质中,超声波与酶会产生协同效应,通过空化作用,引起黑莓组织细胞壁的坍塌,加速花色苷和酚类物质的溶出,并且激活酶的催化作用,提高底物转化率,进而提升黑莓清汁的品质。因此,超声辅助酶解制备黑莓清汁是一种高效手段。
[1] NATHAN B S, LUKE R H, RONALD L P, et al. Stabilization of anthocyanins in blackberry juice by glutathione fortification[J]. Food &Function, 2017, 8(10): 3459-3468. DOI:10.1039/C7FO00801E.
[2] SARIBURUN E, ŞAHIN S, DEMIR C, et al. Phenolic content and antioxidant activity of raspberry and blackberry cultivars[J].Journal of Food Science, 2010, 75(4): 328-335. DOI:10.1111/j.1750-3841.2010.01571.
[3] TAVARES L, FIGUEIRA I, MACEDO D, et al. Neuroprotective effect of blackberry (Rubus sp.) polyphenols is potentiated after simulated gastrointestinal digestion[J]. Food Chemistry, 2012, 131(4):1443-1452. DOI:10.1016/j.foodchem.2011.10.025.
[4] CHEN W, XU Y, ZHANG L X, et al. Blackberry subjected toin vitro gastrointestinal digestion affords protection against ethyl carbamateinduced cytotoxicity[J]. Food Chemistry, 2016, 212: 620-627.DOI:10.1016/j.foodchem.2016.06.031.
[5] 金田辉. 黑莓果汁的研制[D]. 无锡: 江南大学, 2006: 4-5.
[6] 丁爱凤, 黄卉卉, 孙嘉文, 等. 响应面法优化固定化果胶酶制备黑莓汁工艺[J]. 食品研究与开发, 2015, 36(18): 115-119. DOI:10.3969/j.issn.1005-6521.2015.18.029.
[7] 张丽霞, 周剑忠, 刘红锦, 等. 双酶水解制备黑莓澄清汁的工艺优化[J]. 农业工程学报, 2010, 26(10): 372-376. DOI:10.3969/j.issn.1002-6819.2010.10.062.
[8] 周剑忠, 张丽霞, 单成俊. 黑莓清汁生产中酶解工艺优化[J].江苏农业科学, 2012, 40(6): 233-235. DOI:10.15889/j.issn.1002-1302.2012.06.023.
[9] SOTO M, ACOSTA O, VAILLANT F, et al. Effects of mechanical and enzymatical pretreatments on extraction of polyphenols from blackberry fruits[J]. Journal of Food Process Engineering, 2016, 39(5):492-500. DOI:10.1111/jfpe.12240.
[10] TAO Y, WU D, ZHANG Q A, et al. Ultrasound-assisted extraction of phenolics from wine lees: modeling, optimization and stability of extracts during storage[J]. Ultrasonics Sonochemistry, 2014, 21(2):706-715. DOI:10.1016/j.ultsonch.2013.09.005.
[11] KRISHNASWAMY K, ORSAT V, GARIÉPY Y, et al. Optimization of microwave-assisted extraction of phenolic antioxidants from grape seeds (Vitis vinifera)[J]. Food Bioprocess Technology, 2013, 6: 441-455. DOI:10.1007/s11947-012-0800-2.
[12] YANG Y S, WANG Z M, HU D, et al. Efficient extraction of pectin from sisal waste by combined enzymatic and ultrasonic process[J]. Food Hydrocolloids, 2018, 79: 189-196. DOI:10.1016/j.foodhyd.2017.11.051.
[13] 李亚辉, 马艳弘, 黄开红, 等. 超声波辅助酶法提取黑莓酒渣中花色苷工艺优化及其生物活性[J]. 食品科学, 2015, 36(6): 63-68.DOI:10.7506/spkx1002-6630-201506012.
[14] CERVANTES-ELIZARRARAS A, PILONI-MARTINI J, RAMIREZMORENO E. Enzymatic inactivation and antioxidant properties of blackberry juice after thermoultrasound: optimization using response surface methodology[J]. Ultrasounics Sonochemistry, 2017, 34:371-379. DOI:10.1016/j.ultsonch.2016.06.009.
[15] AZMIR J, ZAIDUL I S M, RAHMAN M M, et al. Techniques for extraction of bioactive compounds from plant materials: a review[J].Journal of Food Engineering, 2013, 117(4): 426-436. DOI:10.1016/j.jfoodeng.2013.01.014.
[16] KAMILOGLU S, PASLI A A, OZCELIK B, et al. Colour retention,anthocyanin stability and antioxidant capacity in black carrot (Daucus carota) jams and marmalades: effect of processing, storage conditions andin vitro gastrointestinal digestion[J]. Journal of Functional Foods,2015, 13: 1-10. DOI:10.1016/j.jff.2014.12.021.
[17] 张丽霞, 周剑忠, 顾振新, 等. 黑莓花色苷的分离纯化与抗氧化活性研究[J]. 江苏农业科学, 2012, 40(8): 244-247. DOI:10.15889/j.issn.1002-1302.2012.08.140.
[18] HOSSAIN M A, RAHMAN S M M. Total phenolics, flavonoids and antioxidant activity of tropical fruit pineapple[J]. Food Research International, 2011, 44(3): 672-676. DOI:10.1016/j.foodres.2010.11.036.
[19] 李恩惠, 矫馨瑶, 王晨歌, 等. 蓝莓花色苷降解动力学及稳定性[J].食品科学, 2018, 39(5): 1-7. DOI:10.7506/spkx1002-6630-201805001.
[20] ANAYA-ESPARZA L M, VELÁZQUEZ-EATRADA R M, ROIG A X, et al. Thermosonication: an alternative processing for fruit and vegetable juices[J]. Trends in Food Science & Technology, 2017, 61:26-37. DOI:10.1016/j.tifs.2016.11.020.
[21] WEBER F, BOCH K, SCHIEBER A. Influence of copigmentation on the stability of spray dried anthocyanins from blackberry[J].LWT-Food Science and Technology, 2017, 75: 72-77. DOI:10.1016/j.lwt.2016.08.042.
[22] 彭常安, 卢锋波, 袁晔, 等. 外源咖啡酸和阿魏酸对黑莓汁中花色苷的辅色研究[J]. 天然产物研究与开发, 2012, 24(1): 94-97.DOI:10.16333/j.1001-6880.2012.01.019.
[23] EIRO M J, HEINONEN M. Anthocyanin color behavior and stability during storage: effect of intermolecular copigmentation[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25): 7461-7466.DOI:10.1021/jf0258306.
[24] 邹宇晓, 王思远, 刘凡, 等. 花色苷基于分子辅色机制的稳态化制备与应用技术研究进展[J]. 现代食品科技, 2016, 32(6): 328-339.DOI:10.13982/j.mfst.1673-9078.2016.6.050.
[25] ESTERUELAS M, KONTOUDAKIS N, GIL M, et al. Phenolic compounds present in natural haze protein of Sauvignon white wine[J]. Food Research International, 2011, 44: 77-83. DOI:10.1016/j.foodres.2010.11.010.
[26] GONÇALVESAB F J, FERNANDESA P A R, WESSEL D F, et al. Interaction of wine mannoproteins and arabinogalactans with anthocyanins[J]. Food Chemistry, 2018, 243: 1-10. DOI:10.1016/j.foodchem.2017.09.097.
[27] RØDTJER A, SKIBSTED L H, ANDERSEN M L. The role of phenolic compounds during formation of turbidity in an aromatic bitter[J]. Food Chemistry, 2010, 123: 1035-1039. DOI:10.1016/j.foodchem.2010.05.056.
[28] TIWARI B K, O'DONNELL C P, PATRAS A, et al. Stability of anthocyanins and ascorbic acid in sonicated strawberry juice during storage[J]. European Food Research and Technology, 2009, 228:717-724. DOI:10.1007/s00217-008-0982-z.
[29] PÉREZ-GRIJALVA B, HERRERA-SOTERO M, MORAESCOBEDO R, et al. Effect of microwaves and ultrasound on bioactive compounds and microbiological quality of blackberry juice[J]. LWT-Food Science and Technology, 2018, 87: 47-85.DOI:10.1016/j.lwt.2017.08.059.
[30] XU L, HE W J, LU M, et al. Enzyme-assisted ultrasonic-microwave synergistic extraction and UPLC-QTOF-MS analysis of flavonoids from Chinese water chestnut peels[J]. Industrial Crops and Products,2018, 117: 179-186. DOI:10.1016/j.indcrop.2018.03.012.
[31] WU H, DAI X, ZHOU S L, et al. Ultrasound-assisted alkaline pretreatment for enhancing the enzymatic hydrolysis of rice straw by using the heat energy dissipated from ultrasonication[J]. Bioresource Technology, 2017, 241: 70-74. DOI:10.1016/j.biortech.2017.05.090.
Ultrasonic-Assisted Enzymatic Hydrolysis of Blackberry Juice and Synergistic Effect
FAN Linlin, WANG Ying, CHENG Xianling, et al. Ultrasonic-assisted enzymatic hydrolysis of blackberry juice and synergistic effect[J]. Food Science, 2019, 40(6): 304-311. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180413-172. http://www.spkx.net.cn