表1 HAV实时荧光RT-PCR检测的引物及探针
Table 1 Primers and probes used for RT-PCR ampli fi cation of HAV RNA
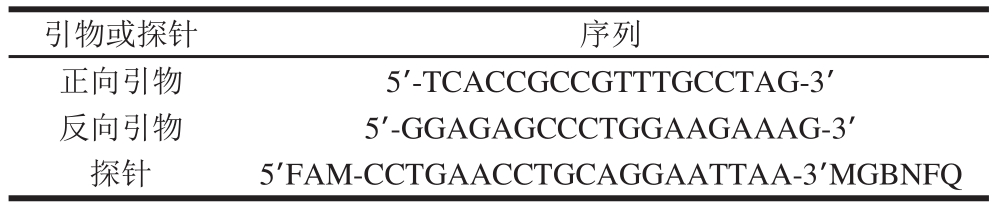
引物或探针 序列正向引物 5′-TCACCGCCGTTTGCCTAG-3′反向引物 5′-GGAGAGCCCTGGAAGAAAG-3′探针 5′FAM-CCTGAACCTGCAGGAATTAA-3′MGBNFQ
甲型病毒性肝炎是由甲型肝炎病毒引起的急性肠道传染病,呈世界范围的分布,中国为高发区,其发病居各型肝炎之首[1]。在我国,甲型肝炎的流行不仅是一个重要的公共卫生问题,也是一个值得关注的社会问题[2-4]。1988年上海暴发的生食毛蚶引起的甲型病毒肝炎暴发流行事件[5-6],2013年欧盟、日本等抽检检测中国食品中的甲肝病毒事件[7-9],2015年于澳洲、新西兰暴发的浆果中含甲肝病毒事件[10-11],都为我国食品中甲肝病毒的安全检测工作敲响了警钟,开展食品中甲型肝炎病毒的检测研究刻不容缓。
在食源性病毒的检测中,病毒RNA的提取是一个关键步骤,所提取的RNA的质量决定了能够转录到cDNA上的序列信息量的最大值,良好的RNA提取方法可以获得无核糖核酸酶(RNA酶)污染的全长RNA,这对进行复杂成分的食品基质中的病毒的RNA提取十分关键。另外,食品中病毒核酸的量相对于食品样品而言微乎其微,抽提出来的核酸主要为食品样品或者抽提试剂加入的载体核酸,而采用A260 nm/A280 nm评估食源性病毒核酸抽提效果价值较小,因此采用灵敏度高,检测动态范围广的实时荧光逆转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)用于食品中病毒核酸的抽提效果评估具有很好的应用价值。早期,病毒RNA的提取主要采用Trizol法[12-13]、异硫氰酸胍法[14-15]等,这些传统提取方法操作步骤繁琐、易污染,且核酸提取效率较低。近年来市场上可供使用的RNA商业提取试剂盒日益增加,极大地简化了核酸提取操作步骤,有效提高了核酸检测灵敏度和提取效率,同时也给操作人员提供了多种选择。针对这种情况,开展核酸提取试剂盒的提取效果评估工作,为使用者根据检测样本的实际情况和使用目的合理选择核酸提取试剂盒提供帮助。目前,针对不同类型病毒的核酸抽提方法的比较评估已有许多研究,但是鲜有针对食源性甲型肝炎病毒核酸提取方法的比较研究[16-18]。因此,本研究采用实时荧光RT-PCR法对市售的比较权威的3 种商用RNA提取试剂盒在常见的水产品、果蔬类制品等食品中甲型肝炎病毒RNA的提取效果进行综合评价与比较,为实验人员合理选择RNA提取方法提供参考。
草莓50 份、树莓10 份、黑莓10 份、鹅莓10 份、圆葱10 份,文蛤10 份、蓝靛果1 份均来自辽宁出入境检验检疫局丹东分局进出口样品及基地监测样品;贝类、圆葱等样品采购于辽宁丹东市农业贸易市场。
ABI AgPath-IDTM One-step RT-PCR Kit(货号:AM1005)、MagMAX™-96 Viral RNA Isolation Kit(货号:AM1836)(简称ABI AM1836) 美国应用生物系统公司;QIAamp Viral RNA Mini Kit(货号:74104)(简称QIAGEN 74104) 德国凯杰公司;High Pure Viral RNA isolation Kit(货号:11858882001)(简称ROCHE 11858882001) 豪夫迈·罗氏公司;过程控制对照为甲型肝炎病毒减毒疫苗(滴定度106.5 CCID50/mL)长春长生生物科技股份有限公司。
检测甲型肝炎病毒的引物探针序列[19]见表1,由上海Invitrogen公司合成。
表1 HAV实时荧光RT-PCR检测的引物及探针
Table 1 Primers and probes used for RT-PCR ampli fi cation of HAV RNA

引物或探针 序列正向引物 5′-TCACCGCCGTTTGCCTAG-3′反向引物 5′-GGAGAGCCCTGGAAGAAAG-3′探针 5′FAM-CCTGAACCTGCAGGAATTAA-3′MGBNFQ
1.2.1 人工污染样本的制备
分别剪取(20±0.1)g已知甲型肝炎病毒阴性的草莓、树莓、黑莓、圆葱样品和(2±0.1)g已知甲型肝炎病毒阴性的贝类样品于离心管中,每种样品各20 份,每份加入10 μL的甲型肝炎病毒减毒疫苗,室温静置20 min,使病毒充分吸附于食品样品中[19-20]。
1.2.2 食品样品中病毒的富集
按照ISO方法[19]中关于软质水果、沙拉蔬菜、贝类等食品样品的病毒富集方法进行人工污染食品样品的病毒富集。
1.2.3 病毒RNA提取方法比较
1.2.3.1 核酸提取效率的评价
对人工污染样品进行病毒富集后,分别采用ABI AM1836、QIAGEN 74104和ROCHE 11858882001三种甲型肝炎病毒试剂盒进行草莓、树莓、黑莓、贝类、圆葱5 种食品中的甲型肝炎病毒RNA的提取,每个样品做两个平行,根据实时荧光RT-PCR的Ct值对3 种核酸提取试剂盒的提取效率进行比较。
1.2.3.2 抽提核酸稳定性的评价
将同一食品样品中提取的甲型肝炎病毒核酸分成两份,一份于室温(20~25 ℃)放置24 h,另一份按照核酸保存方法于-20 ℃放置,根据实时荧光RT-PCR的扩增Ct值评价3 种核酸提取试剂盒的核酸抽提稳定性。
1.2.3.3 抑制剂去除效率的评价
每份样品中取10 μL甲型肝炎病毒RNA原液进行10 倍稀释,同时与未稀释的核酸一起进行实时荧光RT-PCR扩增。10 倍稀释RNA的Ct值与原倍RNA的Ct值之差大约为 3.3,如差值小于3.3甚至负数(稀释的样品扩增曲线反而在前面),则说明该核酸提取试剂盒对食品中甲型肝炎病毒的抑制剂去除的效果较差。
1.2.3.4 检测灵敏度的评价
将甲型肝炎病毒减毒疫苗分别进行2×10-2、2×10-3、2×10-4和2×10-5稀释,按照1.2.2节中的方法分别制备贝类和树莓人工污染样品,每个样品做3 个平行,采用3 种核酸试剂盒进行病毒富集液中病毒RNA的提取,采用实时荧光RT-PCR确定每种核酸提取方法的检测灵敏度。
1.2.4 实时荧光RT-PCR
甲型肝炎病毒的实时荧光RT-PCR体系包括:1×RT-PCR酶预混液1 μL、2×RT-PCR缓冲液12.5 μL、甲型肝炎病毒正向引物0.625 μL(20 μmol/L)、甲型肝炎病毒反向引物1.125 μL(20 μmol/L)、甲型肝炎病毒荧光探针0.312 5 μL(20 μmol/L)、RNA模板5 μL,补充水至25 μL;反应参数参照试剂盒说明书。
1.2.5 实际样品检测
采用优化后的核酸提取方法,对送检的101 份食品样品进行病毒RNA的提取,同时设立阴性对照和过程控制对照,以验证该提取方法对实际样品的检测能力。
制图采用GraphPad Prism 6,统计分析采用SPSS 20.0,P<0.05,差异显著。
3 种核酸提取试剂盒对草莓、树莓、黑莓、贝类、圆葱等样品中甲型肝炎病毒的实时荧光RT-PCR扩增结果显示,不同核酸提取方法在不同样品中的提取效率差异显著(P<0.05)。其中ROCHE 11858882001的Ct值最高,其次为QIAGEN 74104和ABI AM1836(图1)。
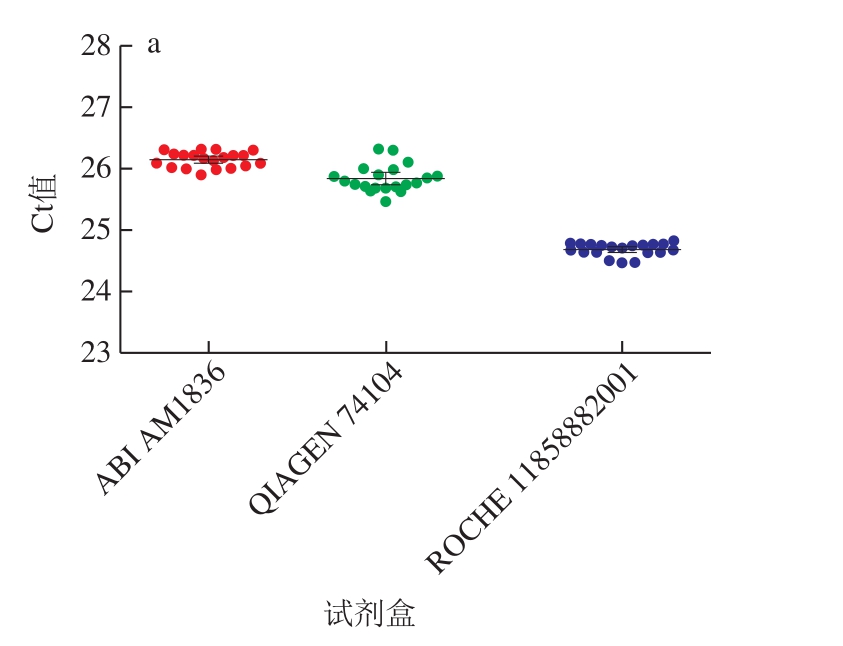
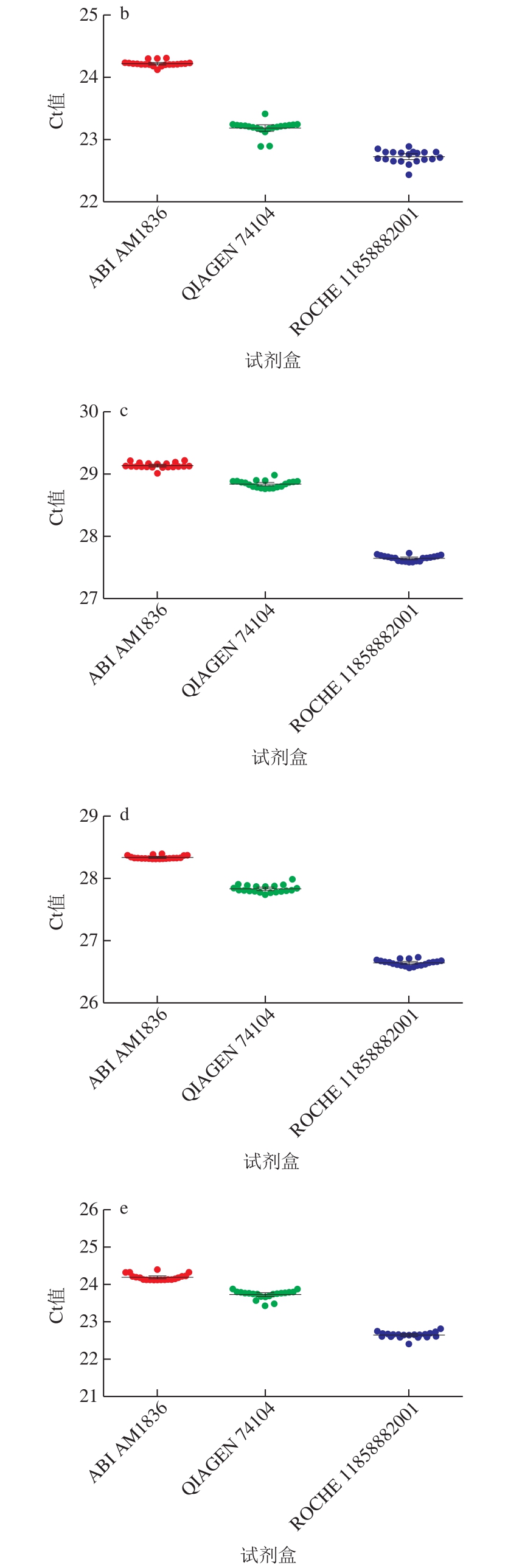
图1 3 种核酸提取食品样品中甲型肝炎病毒RNA提取效率比较
Fig. 1 Extraction efficiencies of RNA from HAV in different food samples with different extraction kits
a.草莓;b.树莓;c.黑莓;d.贝类;e.圆葱。
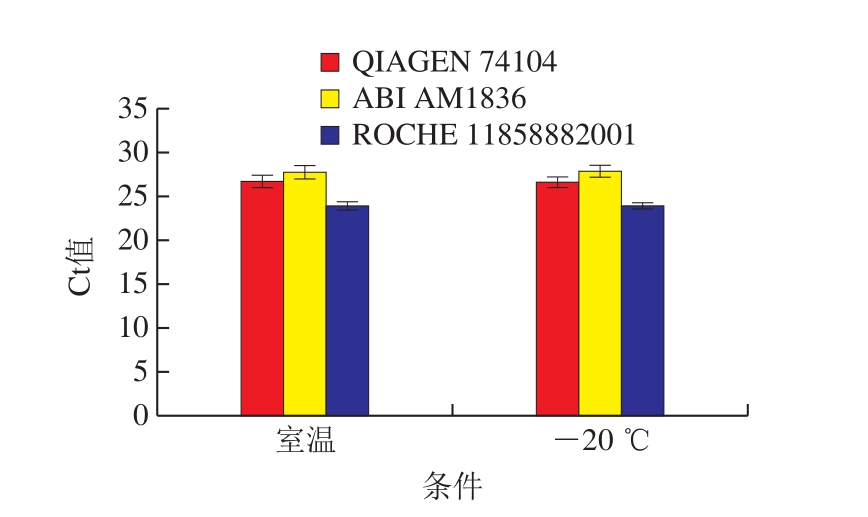
图2 3 种核酸提取方法提取甲型肝炎病毒RNA的稳定性
Fig. 2 Stability of three extraction kits
如图2所示,3 种试剂盒提取的甲型肝炎病毒RNA的Ct值在室温和-20 ℃条件下差异显著(P<0.05),表明3 种核酸提取方法均具有良好的核酸抽提稳定性。
3 种核酸抽提试剂盒对草莓、树莓、黑莓、贝类和圆葱样品中甲型肝炎病毒的抑制剂去除效率结果见表2,其中QIAGEN 74104的病毒RNA原倍与10 倍稀释Ct值差值为3.133,ABI AM1836的病毒RNA原倍与10 倍稀释Ct值差值为2.996,ROCHE 11858882001的病毒RNA原倍与10 倍稀释Ct值差值为3.225,且差异显著(F值:21.991、18.660、26.802、22.888、21.349,P<0.05),表明ROCHE 11858882001具有较好的抑制剂去除效率(更接近于3.3)。
表2 3 种核酸提取方法对食品样品中甲型肝炎病毒RNA的抑制剂去除效果
Table 2 Effect of three extraction kits on removal of HAV RNA inhibitors from food samples
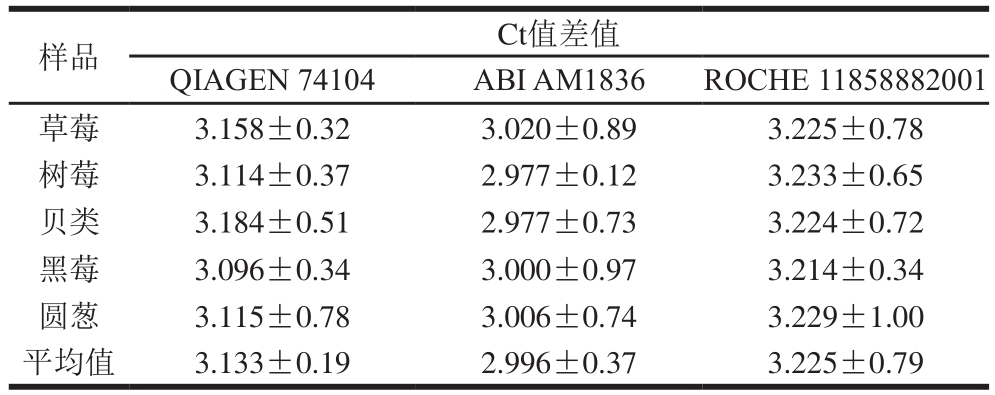
样品 Ct值差值QIAGEN 74104 ABI AM1836 ROCHE 11858882001草莓 3.158±0.32 3.020±0.89 3.225±0.78树莓 3.114±0.37 2.977±0.12 3.233±0.65贝类 3.184±0.51 2.977±0.73 3.224±0.72黑莓 3.096±0.34 3.000±0.97 3.214±0.34圆葱 3.115±0.78 3.006±0.74 3.229±1.00平均值 3.133±0.19 2.996±0.37 3.225±0.79
采用3 种核酸提取方法对软质蔬菜水果和贝类样品中具有代表性的树莓和贝类样品的检测灵敏度结果显示(表3),3 种核酸提取试剂盒在贝类样品中的检测灵敏度分别为6.32(ROCHE 11858882001)、63.2(ABI AM1836)、63.2 CCID50/2 g(QIAGEN 74104);3 种核酸提取试剂盒在树莓样品中的检测灵敏度分别为0.63(ROCHE 11858882001)、6.32(ABI AM1836)、6.32 CCID50/20 g(QIAGEN 74104)。结果表明,ROCHE 11858882001的检测灵敏度最高。
表3 3 种核酸提取方法对食品样品中HAV RNA的检测灵敏度结果
Table 3 Sensitivity of three RNA extraction kits for HAV detection in food samples
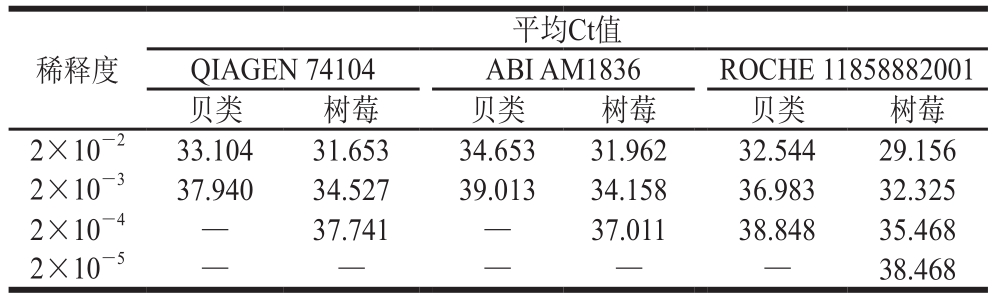
注:—.未检出。
平均Ct值QIAGEN 74104 ABI AM1836 ROCHE 11858882001贝类 树莓 贝类 树莓 贝类 树莓2×10-2 33.104 31.653 34.653 31.962 32.544 29.156 2×10-3 37.940 34.527 39.013 34.158 36.983 32.325 2×10-4 — 37.741 — 37.011 38.848 35.468 2×10-5 — — — — — 38.468稀释度
3 种RNA提取方法中,QIAGEN 74104和ROCHE 11858882001均为手动提取,提取24 份样品需要2 h左右,ABI AM1836为封闭状态自动化提取,提取时间最短;ABI AM1836可提取次数最多,其次为ROCHE 11858882001和QIAGEN 74104;QIAGEN 74104在RNA提取时所需病毒悬液的量最大,其次为ROCHE 11858882001;而在实验成本方面,ROCHE 11858882001的成本最低,其次为QIAGEN 74104和ABI AM1836。因此,本实验选取的最优方法为ROCHE 11858882001(表4)。
表4 3 种核酸提取方法进行RNA提取的综合应用结果
Table 4 Comparison of three RNA extraction kits

可提取次数QIAGEN 74104 100 手工 较高 >400 50 ABI AM1836 60 自动 高 50 96 ROCHE 11858882001 100 手工 较低 >200 100试剂盒 4 份样品RNA提取时间/min提取方式成本高低所需病毒悬液/μL
采用优化好的RNA提取方法对送检的101 份食品样品的检测结果(图3)显示,一份蓝靛果样品为甲型肝炎病毒核酸阳性(平均Ct值为29.50),其余样品为甲型肝炎病毒阴性,过程控制对照(平均Ct值为23.67)、PCR阳性对照(平均Ct值为18.97)和阴性对照(无典型扩增曲线)均为正常。对蓝靛果样品中的阳性病毒RNA进行克隆测序后,基因比对结果进一步确证该病毒为甲型肝炎病毒。研究结果证明本研究中优化的核酸提取方法适用于食品样品中甲型肝炎病毒RNA的提取和检测。
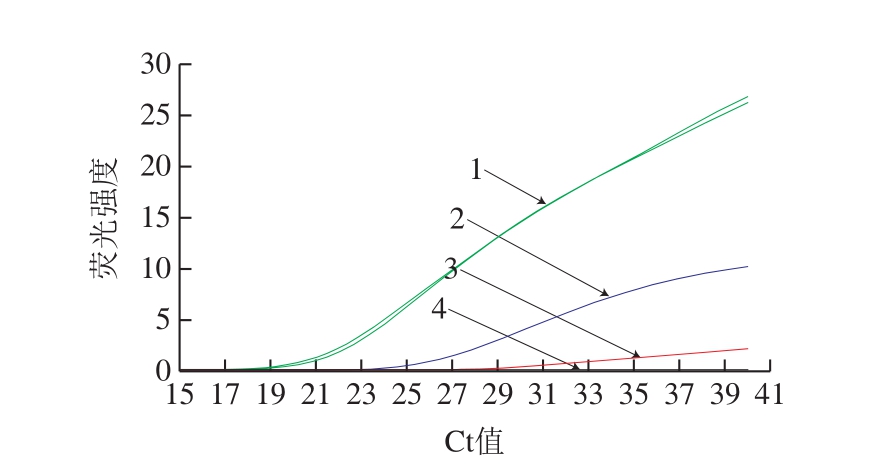
图3 蓝靛果样品中检出甲型肝炎病毒的实时荧光RT-PCR实验结果
Fig. 3 Real-time fl uorescence RT-PCR detection of HAV in blue honeysuckle sample
1.甲型肝炎病毒PCR阳性对照;2.甲型肝炎病毒过程控制对照;3.蓝靛果阳性样品;4.阴性对照。
甲型肝炎病毒为引起食源性疾病的重要病原之一,但是该病毒在食品样品中的检测方法仍未成熟。在甲型肝炎病毒暴发的许多案例中,对可疑的食物确认成为了最大的难点,原因为:1)食品中甲型肝炎病毒含量较低;2)甲肝病毒培养周期较长,难以实现快速检测;3)从食品基质中纯化病毒遗传物质的方法效率较低;4)食品基质中含有大量干扰物质。因此,高特异性和灵敏度的PCR技术开始广泛应用于浆果、蔬菜、水果、贝类等食品基质中甲型肝炎病毒的检测研究中[21-24]。现有的分子诊断方法中,病毒RNA提取是分子生物学检测的关键环节之一,RNA的提取效率和质量直接影响最终检测结果的准确性[23,25]。因此,选择一种高效的RNA提取方法,对食品中甲型肝炎病毒的核酸进行检测至关重要。目前,市售的核酸提取试剂盒主要采用膜吸附、纸片法、磁珠吸附等技术进行RNA提取,这些试剂盒在检测时限、检测准确性、核酸提取效率等方面存在巨大差异[23,25]。对病毒核酸提取方法比较研究方面,吕艳等[25]对新城疫病毒的5种核酸提取方法的提取效率进行了比较研究。王赤华等[26]仅对甲型H1N1流感病毒的3 种核酸提取方法进行提取率的比较,而鲜有针对这些病毒核酸提取试剂盒进行全面的分析比较研究的报道[22,27]。此外,对于食源性病毒检测工作者来说,花费大量的时间和精力在众多的商品化核酸提取试剂盒中选择一种检测效率高的试剂盒严重影响工作效率,也降低了实验室检测准确性,增加了检测风险。本研究采用实时荧光RT-PCR技术检测甲型肝炎病毒的RNA,通过PCR扩增Ct值对3 种常用的商用病毒RNA提取试剂盒的提取效率、核酸抽提稳定性、抑制剂去除效率、检测灵敏度、综合应用等指标进行评价,以找到食品中甲型肝炎病毒RNA的最佳提取方法。
本研究发现,在提取效率方面,ROCHE试剂盒要明显优于其他两种试剂盒;在核酸抽提稳定性方面,3 种核酸提取试剂盒均有良好的核酸抽提稳定性;在抑制剂去除效率方面,3 种核酸提取试剂盒提取对于甲型肝炎病毒抑制剂的去除差异显著,其中ROCHE 11858882001>QIAGEN 74104>ABI AM1836;在检测灵敏度方面,饶红等[28-29]对蔬菜、水果、贝类中甲型肝炎病毒进行检测研究,其中蔬菜中甲型肝炎的检测灵敏度为30 TCID50/1.5 g,草莓中甲型肝炎的检测灵敏度为48 TCID50/100 g,贝类中甲型肝炎的检测灵敏度为10 TCID50/100 g。在本研究中,采用ROCHE 11858882001对贝类和树莓样品中的甲型肝炎病毒进行检测,检测灵敏分别为6.32 CCID50/2 g和0.63 CCID50/20 g,检测灵敏度均优于报道方法。此外,在病毒RNA提取过程中,所取的病毒悬浮液量过大,会使提取液中残留的抑制剂浓度过高,从而降低了病毒的检测灵敏度,而取样量过少,悬浮液中病毒含量过低也会降低病毒的检测灵敏度[30],本研究中,ABI AM1836提取所需病毒悬液仅为50 μL,这可能是ABI AM1836检测效果较差的原因。在本研究中,ROCHE 11858882001具有较好的提取效果,表明在食源性甲型肝炎病毒检测中,RNA提取的试样量为200 μL就已经足够了。而综合操作时间及成本等因素,ROCHE 11858882001具有良好的使用价值。
目前,从贝类样品检出甲型肝炎病毒的报道较多,而从草莓、树莓、苹果等水果蔬菜中检出甲型肝炎病毒报道较少。莫雪梅等[31]从45 份草莓样品检出3 份甲型肝炎病毒阳性样品。房保海等[21]从216 个果蔬样品种冷冻草莓、冷冻蓝莓、冷冻土豆丁、冷冻苹果丁和冷冻树莓检出了6 个甲型肝炎病毒阳性样品。Li Dan等[32]从2 015 个浆果样品中检出草莓和红加仑2 个甲型肝炎病毒阳性样本。而本研究采用优化好的RNA提取方法实际样品进行检测,于一份蓝靛果样品中检出甲型肝炎病毒,对于研究小浆果中甲型肝炎病毒检测方法具有重要意义。
[1] 王静. 甲型肝炎病毒检测方法研究进展[J]. 旅行医学科学, 2007,13(3): 1-3. DOI:10.3969/j.issn.1006-7159.2010.02.007.
[2] 訾梅, 蔡皓东. 甲肝疫苗的不良反应综合报道[J]. 药物流行病学杂志, 2006, 15(4): 218-222. DOI:10.3969/j.issn.1005-0698.2006.04.011.
[3] 施建平, 杨锦玲. 某农村幼儿园52 例病毒性甲型肝炎暴发的流行病学分析[J]. 宁夏医学杂志, 2010, 32(9): 856-857. DOI:10.3969/j.issn.1001-5949.2010.09.062.
[4] 张艺, 许大庆, 张雪峰, 等. 2005-2015年安陆市甲型病毒性肝炎流行病学分析[J]. 应用预防医学, 2016, 22(6): 509-510. DOI:10.3969/j.issn.1673-758X.2016.06.012.
[5] 焦永真, 韩剑秋, 王宪明, 等. 1988年上海甲型肝炎暴发流行中从毛蚶分离到甲型肝炎病毒[J]. 病毒学报, 1990(4): 312-315.DOI:10.13242/j.cnki.bingduxuebao.000621.
[6] 俞顺章. 甲型肝炎流行促进了“大卫生”的诞生[J]. 上海预防医学,2017, 29(1): 1-3. DOI:10.19428/j.cnki.sjpm.2017.01.001.
[7] 李楠, 王佳慧, 李凤琴, 等. 检测鲜草中G II型诺如病毒的两种富集方法比较[J]. 中国食品卫生杂志, 2015, 27(3): 242-246.DOI:10.13590/j.cjfh.2015.03.005.
[8] 房保海, 岳志芹, 赵玉然, 等. 果蔬生产用水中甲肝病毒检测方法和质控体系的研究[J]. 卫生研究, 2017, 46(1): 99-102. DOI:1000-8020(2017)01-0099-05.
[9] 中国质量新闻网. 山东检验检疫局: 冷冻草莓别样甜[R/OL].(2015-02-27) [2018-03-19]. http://www.cqn.com.cn/news/zggmsb/diyi/1008917.html.
[10] 新华网. 冷冻草莓澳洲陷甲肝病毒“乌龙”中国企业损失惨重[R/OL]. (2015-12-9) [2015-12-9]. http://www.xinhuanet.com/overseas/2015-12/15/c_128531031_3.htm.
[11] 国际果蔬报道. 山东草莓雪上加霜: 被新西兰初级产业-部召回[R/OL]. (2015-12-9) [2018-03-19]. http://www.guojiguoshu.com/article/1759?qt-popular_content=3.
[12] SINCERO T C, LEVIN D B, SIMÕES C M, et al. Detection of hepatitis A virus (HAV) in oysters (Crassostrea gigas)[J]. Water Research, 2006, 40(5): 895-902. DOI:10.1016/j.watres.2005.12.005.
[13] DE PAULA V S, VILLAR L M, COIMBRA GASPAR A M.Comparison of four extraction methods to detect hepatitis A virus RNA in serum and stool samples[J]. Brazilian Journal of Infectious Diseases an Official Publication of the Brazilian Society of Infectious Diseases,2003, 7(2): 135-141. DOI:10.1590/S1413-86702003000200007.
[14] CHIRGWIN J M, PRZYBYLA A E, MACDONALD R J, et al.Isolation of biologically active ribonucleic acid from sources enriched in ribonuclease[J]. Biochemistry, 1979, 18(24): 5294-5299.DOI:10.1021/bi00591a005.
[15] 张丽, 杨莲茹, 吴绍强. 核酸提取方法的研究进展[J]. 中国动物检疫,2011, 28(12): 75-78. DOI:10.3969/j.issn.1005-944X.2011.12.032.
[16] 吴星, 黄维金, 周诚, 等. 五种乙型肝炎病毒核酸荧光定量检测试剂盒的比较[J]. 中华传染病杂志, 2009, 27(3): 142-146. DOI:10.3760/cma.j.issn.1000-6680.2009.03.004.
[17] 王聪, 陈之遥, 武海萍, 等. 三种核酸共提取试剂盒对血液病毒提取效能的比较研究[J]. 临床误诊误治, 2011, 24(8): 6-9. DOI:10.3969/j.issn.1002-3429.2011.08.003.
[18] XU R, SHIEH Y C, STEWART D S. Comparison of RNA extraction kits for the purification and detection of an enteric virus surrogate on green onions via RT-PCR[J]. Journal of Virological Methods, 2017,239: 61-68. DOI: 10.1016/j.jviromet.2016.10.016.
[19] International Organization for Standards. Microbiology of food and animal feed-horizontal method for determination of hepatitis A virus and norovirus in food using real-time RT-PCR: Part 2: method for qualitative detection: ISO/TS 15216-2[S]. Geneva: International Organization for Standardization, 2013: 1-27.
[20] 高世光, 王海燕, 郭慧, 等. 草莓中甲型肝炎病毒检测[J]. 食品科学,2014, 35(24): 213-218. DOI:10.7506/spkx1002-6630-201424041.
[21] 房保海, 岳志芹, 孙涛, 等. 果蔬产品中甲型肝炎病毒风险评估和基因分型研究[J]. 病毒学报, 2016, 32(4): 484-489. DOI:10.13242/j.cnki.bingduxuebao.002990.
[22] 雷永良, 王晓光, 梅少林, 等. 食品中食源性病毒快速检测方法的建立研究[J]. 中国卫生检验杂志, 2014(6): 855-857. DOI:1004-8685(2014)06-0855-03.
[23] 徐蕾蕊, 魏海燕, 马丹, 等. MS2噬菌体在贝类食源性病毒检测中过程质控应用[J]. 中国公共卫生, 2016, 32(11): 1584-1590.DOI:10.11847/zgggws2016-32-11-37.
[24] TERZI G, ALBAYRAK H, SIRIKEN B, et al. Detection of enteroviruses and hepatitis A virus RNA in cow milk by RT-PCR[J].Acta Veterinaria, 2010, 60(2/3): 197-204. DOI:10.2298/AVB1003197T.
[25] 吕艳, 王静静, 罗瑶瑶, 等. 五种核酸提取试剂盒对新城疫病毒RNA提取效率的比较[J]. 中国动物检疫, 2017, 34(6): 98-101.DOI:10.3969/j.issn.1005-944X.2017.06.028.
[26] 王赤华, 曾勇. 甲型H1N1流感病毒采用不同核酸提取方法的比较研究[J]. 临床和实验医学杂志, 2017, 16(3): 230-232. DOI:10.3969/j.issn.1671-4695.2017.03.007.
[27] 赵怡, 陈苏红, 刘志红, 等. 6 种核酸提取试剂盒对甲型H1N1流感病毒核酸提取效果的比较[J]. 军事医学, 2010, 34(2): 111-114.DOI:10.3969/j.issn.1674-9960.2010.02.003.
[28] 饶红, 陈广全, 曾静, 等. RT-PCR法检测贝类中的甲肝病毒的研究[J].食品与发酵工业, 2006, 32(9): 122-125. DOI:10.3321/j.issn:0253-990X.2006.09.030.
[29] 饶红, 陈广全, 冯骞, 等. 蔬菜及水果中NLVs和HAV检测的研究[J].中国食品卫生杂志, 2007, 19(2): 131-134. DOI:10.3969/j.issn.1004-8456.2007.02.010.
[30] DUBOIS E, AGIER C, TRAORÉ O, et al. Modified concentration method for the detection of enteric viruses on fruits and vegetables by reverse transcriptase-polymerase chain reaction or cell culture[J]. Journal of Food Protection, 2002, 65(12): 1962-1969.DOI:10.4315/0362-028X-65.12.1962.
[31] 莫雪梅, 高东微. 运用SYBR Green I 荧光实时RT-PCR法检测草莓中甲肝病毒[J]. 食品科学, 2010, 31(14): 153-157.
[32] LI D, BUTOT S, ZUBER S, et al. Monitoring of foodborne viruses in berries and considerations on the use of RT-PCR methods in surveillance[J]. Food Control, 2018, 89: 235-240. DOI:10.1016/j.foodcont.2018.02.024.
Comparison and Application of RNA Extraction Methods for Detection of Hepatitis A Virus in Food Samples
FENG Huawei, YAN Pingping, AI Haixin, et al. Comparison and application of RNA extraction methods for detection of hepatitis A virus in food samples[J]. Food Science, 2019, 40(6): 325-330. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180111-131. http://www.spkx.net.cn