假单胞菌是一种能在低温下生长、可利用多种有机物、分解能力强、可产生氨等腐败产物的低温食品腐败菌。因此,假单胞菌污染乳制品、肉制品、禽蛋类和蔬菜等食品后极易引起腐败变质,是使这些食品腐败变质的重要微生物[1]。铜绿假单胞菌(Pseudomonas aeruginosa)是假单胞菌中最常见的一个种,又称绿脓杆菌,广泛分布于水、空气、土壤以及人体的呼吸道、皮肤和肠道等处,尤其在潮湿的自然环境中更易生长繁殖,所以其传播途径广泛[2]。铜绿假单胞菌是一种条件致病菌,可引起人类急性肠道炎、皮肤炎、败血病和脑膜炎等疾病,其产生的内、外毒素均具有致病性:内毒素能引起系统炎症反应综合征,对老人、小孩等抵抗力较弱的群体危害较大;外毒素侵入敏感细胞后,引起哺乳动物蛋白合成受阻,临床上常引起继发性感染[3-4]。2014年之前,在食品卫生监测工作中对铜绿假单胞菌监控较少,与其食物中毒相关的报道也较少,但由于其对抗生素等化学治疗剂有较强的抵抗性[5]且分布广,在食品中污染机会较多,有报道建议将其列入食物中毒致病菌目录[6]。2003年,黄美子等[7]报道了食用新鲜猪肉后出现腹痛、腹泻、呕吐等症状的案例,经卫生防疫部门鉴定是由铜绿假单胞菌引起的。2010年,沈瑛等[8]也报道了铜绿假单胞菌引起食物中毒的事件。2014年,我国对瓶装饮用水等卫生检测标准进行了修订,增加了对铜绿假单胞菌的监测检验,并将其确认为食源性和水源性致病菌。
随着人们对食品安全的重视,食品微生物安全预测逐渐成为人们关注的热点[9]。食品微生物预测学是一门基于微生物学、应用计算机学、工程数学及统计学等的综合学科。微生物预测模型的建立有利于对食品在贮藏、运输和销售期间微生物变化的监测,了解其存活信息[10],为食品微生物安全控制提供科学的理论依据[11]。微生物生长预测模型主要有一级模型和二级模型。一级模型描述微生物数量对时间的响应,常见的一级模型有Linear模型、Logistic模型[12]和Gompertz模型[13]等。Linear模型的操作简便,但预测数据的精确度不高;Logistic模型在数学上是用于描述一个普通笛卡尔平面上的S形曲线,有人用其研究细菌生长曲线,但其不能完整显示S形曲线,是一个无滞后期的S形曲线[12];而Gompertz模型克服了这些缺点,在目前应用较多[9]。Gompertz模型能够较好地用于研究单细胞微生物生长的典型生长曲线,在研究细菌生长的延滞期、指数期和稳定期时,分别用延滞时间(λ)、最大比生长速率(μmax)、最大菌落数(b)来描述这3 个阶段的特征。在食品贮藏期间:λ可用于分析食品货架期的参数,表示食品安全贮存时间的长短;μmax是微生物生长动力学参数,表示食品腐败变质的速率;b表示在腐败变质的食品中微生物的最大生长量。目前,国内外对一些食品基质中微生物生长模型的建立已有一些报道,但是对于铜绿假单胞菌在食品中预测模型的研究鲜有报道。邹宇等[14]运用Gompertz模型、Logistic模型建立了在低温下牛乳中李斯特氏菌的生长模型,发现Gompertz模型为李斯特氏菌在牛乳中生长的最适模型;Møller等[15]在新鲜牛肉中建立了沙门氏菌的生长模型;Lee等[13]用Gompertz模型和Logistic模型拟合了生猪肉中李斯特氏菌的生长曲线。目前,用来研究微生物生长常用的二级模型有修正Ratkowsky模型[16-17]、二次多项数学模型[18]、Arrhenius模型[9,19]。二次多项数学模型研究多种因素对微生物生长的影响,其中的参数没有明确的物理意义;Arrhenius模型最初是用来表征化学反应中反应速率与温度之间的关系,有人曾把它引入微生物预测模型中,但因误差较大,目前应用较少;通常采用修正Ratkowsky模型研究温度对微生物生长速率的影响。目前,对于新增的食源致病性铜绿假单胞菌在食品中安全预测的研究鲜见报道。本研究基于Gompertz模型、修正Ratkowsky模型、Hyperbola模型[20]研究铜绿假单胞菌6~48 ℃的生长情况和生长温度对铜绿假单胞菌μmax与λ的影响;将μmax与λ的乘积定义为菌体细胞的初始生理状态参数(h0),研究生长温度对h0的影响;建立牛乳中铜绿假单胞菌生长的一级预测模型和生长温度对μmax、λ影响的二级模型,为牛乳的安全贮藏及控制提供理论依据。
铜绿假单胞菌(Pseudomonas aeruginosa)ATCC27853购自北京微生物研究所,采用胰蛋白胨大豆肉汤(trypticase soy broth,TSB)培养基培养。供试菌经活化后,接入TSB液体培养基,于37 ℃、140 r/min振荡培养48 h,备用。
TSB培养基、胰蛋白胨大豆琼脂(trypticase soy agar,TSA)培养基 南京丁贝生物科技有限公司;超高温灭菌全脂牛乳 南京市仙林大学城苏果超市;其他试剂均为国产分析纯。
BSC-1300IIA2型生物安全柜 上海博讯实业有限公司医疗设备厂;Scan1200型自动影像分析菌落计数仪法国Intersicence公司;UV-9100型紫外分光光度计美国Beckman公司;ZQTY-70S型大容量低温摇床 上海知楚仪器有限公司;HZQ-F160全温振荡培养箱 太仓市实验设备厂;101-3AS电热鼓风干燥箱 上海苏进仪器设备厂;GNP-9160型隔水式恒温培养箱 上海三发科学仪器有限公司;SX-500高压灭菌锅 日本TOMY公司;精密电子天平 北京塞多利斯天平有限公司;BCD-196T型冰箱 青岛海尔股份有限公司。
1.3.1 不同温度下铜绿假单胞菌ATCC27853在牛乳中生长的平板菌落计数
将按1.1节方法制备的ATCC27853菌悬液按体积分数1%接种于超高温灭菌全脂牛乳和TSB培养基(对照组)中,使初始菌落数在102~103 CFU/mL范围内,分别置于6、10、16、22、28、36、42、45、48、50 ℃下140 r/min振荡培养,每个温度在不同时间点取样,并在TSA平板上进行菌落计数。时间间隔的选取根据预实验组TSB培养基上ATCC27853的生长情况决定,ATCC27853的生长情况通过紫外分光光度计测定的吸光度来测定,采用平板菌落记数法进行菌落计数[21],检测限为1 CFU/mL。牛乳中ATCC27853的生长量表示为每毫升牛乳中活菌数量的对数。
1.3.2 铜绿假单胞菌ATCC27853在牛乳中生长的一级Gompertz模型的建立
拟合ATCC27853在6、10、16、22、28、36、42、45、48 ℃下的生长曲线,建立ATCC27853在牛乳中生长的一级Gompertz模型,如式(1)所示。
式中:Nt表示在某时间(t/h)时ATCC27853菌落数的对数(lg(CFU/mL));a表示t=0 h时ATCC27853菌落数的对数(lg(CFU/mL));b表示ATCC27853最大菌落数的对数(lg(CFU/mL));d表示达到最大生长速率时所用的时间(即生长曲线的拐点)/h;c表示ATCC27853在d时刻的最大生长速率/h-1。
细菌的μmax和λ是用来描述其生长的两个关键参数。ATCC27853的μmax、λ与Gompertz模型的相关参数之间的关系分别见式(2)、(3)[22]。
式中:e为自然常数(2.718 28)。
将式(2)、(3)式代入式(1)中,则Gompertz模型可转化为式(4)。
式中:N0表示t=0 h时ATCC27853初始菌落数的对数(lg(CFU/mL));Nmax表示ATCC27853最大菌落数的对数(lg(CFU/mL))。
微生物生长的λ是指微生物接种到新鲜培养液后的一段时间内,因代谢系统适应新环境的需要,使得核糖体、酶类和ATP等的合成加速、RNA含量增加、新的细胞成分被合成,从而导致细胞体积变大,但这一阶段细胞数目没有增加。本研究将这一阶段的这种生理、代谢状态称为细胞的初始生理状态,用h0来表示[13],用来描述细胞适应新环境的能力,h0与λ和μmax的关系见式(5)[23]。
1.3.3 铜绿假单胞菌ATCC27853在牛乳中生长的二级修正Ratkowsky模型和Hyperbola模型的建立
在一级模型的基础上建立二级模型,研究生长温度对一级模型参数的影响。利用修正Ratkowsky模型研究μmax与温度的关系,如式(6)所示。
式中:µmax表示在温度T/℃下的最大比生长速率/h-1;Tmin表示ATCC27853生长代谢活力为零时的最低温度/℃;Tmax表示ATCC27853生长代谢活力为零时的最高温度/℃;m/(℃-1·h-0.5)、n/℃-1为常数。
基于Hyperbola模型,将ATCC27853的λ取自然对数转化成ln λ,研究λ和T之间的关系,如式(7)所示。
式中:T1表示ATCC27853的最低生长温度/℃;T2表示当生长温度大于最低生长温度时,λ减少的时间所对应的温度的升高量/℃。
1.3.4 模型的评价及其验证
采用Matlab 2016b软件对实验数据分别进行Gompertz模型、修正Ratkowsky模型和Hyperbola模型的建立。模型的评价采用决定系数(R2)、均方根误差(RMSE)、准确因子(Af)和偏差因子(Bf)。其中,R2和RMSE表示模型的精确度、可靠性,R2越接近于1,RMSE越小,模型拟合度越高[24-25]。Af用于衡量预测值与观测值之间的接近程度:Af越接近于1表示模型的拟合度越高,Af越小表明模型预测值与实测值越接近,模型越精确。Bf>1表示模型预测值比实测值高,Bf<1表示模型预测值比实测值低,Bf越接近1表示模型拟合度越高[26]。
模型的验证采用R2、Af和Bf。一级模型的验证:使ATCC27853在6、10、16、22、28、36、42、45、48 ℃下生长,每个生长温度取不同于模型建立的时间点进行取样验证。二级模型的验证:在ATCC27853不同的生长温度12、19、25、39、44 ℃进行取样,每次实验重复3 次。R2、RMSE、Af和Bf的计算见式(8)~(11)。

式中:n表示测定值的个数。
数据处理及作图通过Matlab 2016b软件,用Gompertz模型拟合铜绿假单胞菌ATCC27853在不同温度下的生长曲线,用修正Ratkowsky模型和Hyperbola模型分别拟合牛乳中ATCC27853的生长温度对μmax和λ之间的二级模型,计算各个参数值并进行多重比较,结果以 表示,P<0.05为差异显著。
表示,P<0.05为差异显著。
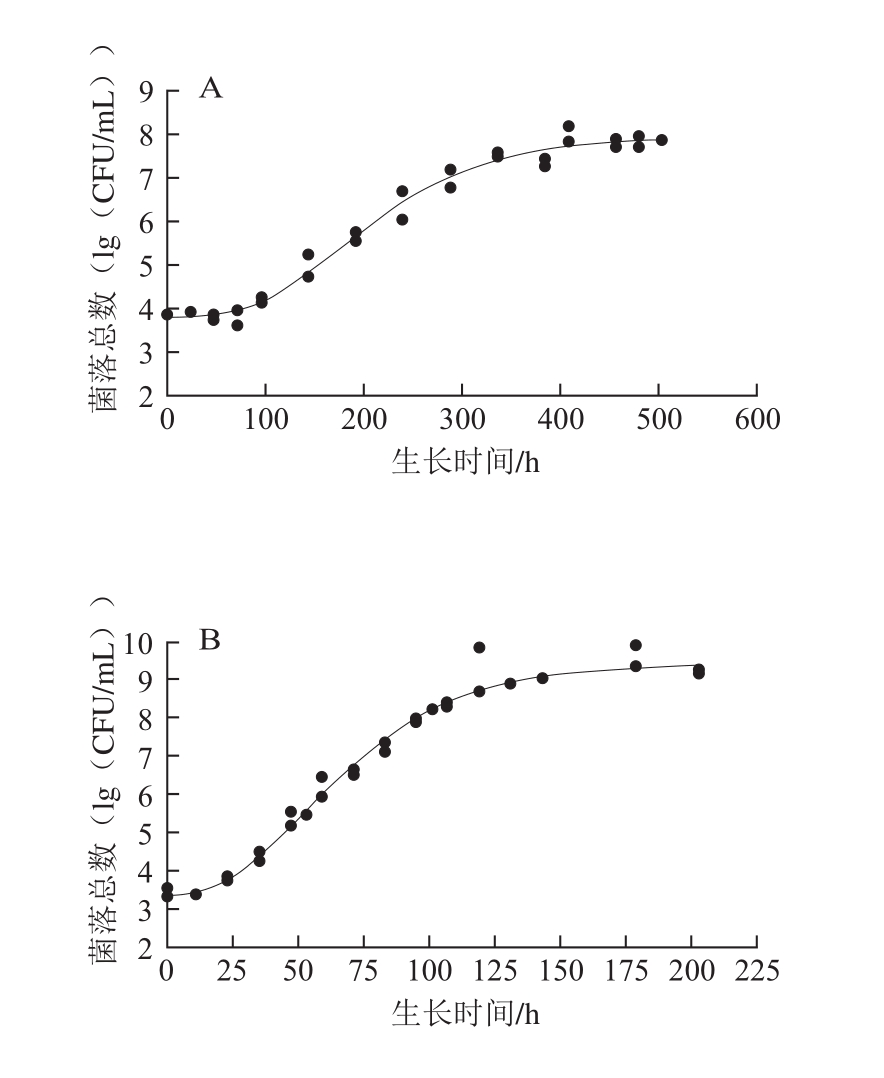

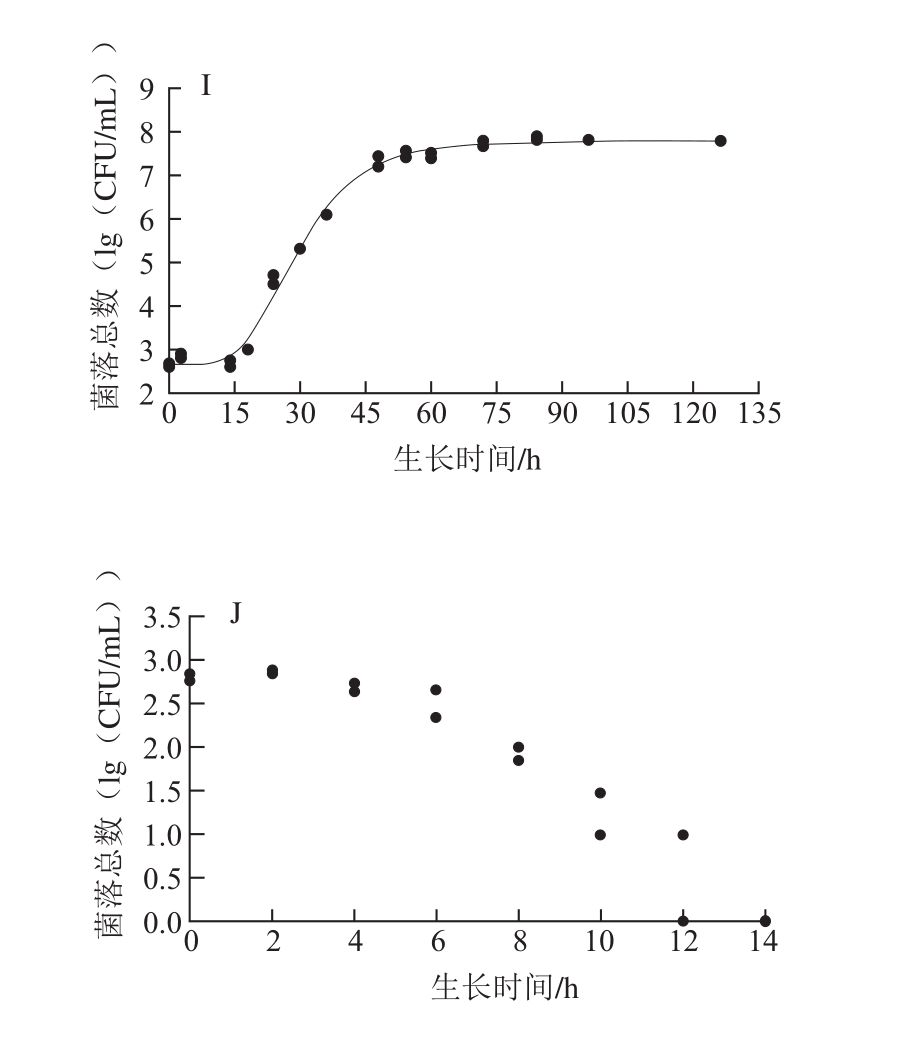
图1 铜绿假单胞菌ATCC27853在牛乳中的Gompertz模型曲线以及失活情况
Fig. 1 Gompertz growth curves for P. aeruginosa ATCC27853 in milk and inactivation
A~J.分别为6、10、16、22、28、36、42、45、48、50 ℃。
由图1可以看出,除50 ℃外,其余温度的实测值皆比较均匀地分布于预测生长曲线的两侧,说明利用Gompertz模型能较好地拟合ATCC27853在牛乳中6~48 ℃的生长曲线,从低到高这9 个温度下,ATCC27853在牛乳中的生长曲线基本均呈现S形,有延滞期、对数期、稳定期3 个部分。在低温度下λ较为明显,如在10 ℃下λ约为25 h;当生长温度超过28 ℃后,λ就变得很短,如在28、36、42 ℃下,仅用约1 h就能进入对数生长期,菌体能很快适应新的环境。进入对数期后,不同生长温度下ATCC27853对数期差异明显,如6 ℃时对数期约100 h,而36 ℃时只需约10 h,表明ATCC27853在不同温度下的生长速率不同。进入稳定期后,在10~42 ℃下,菌体最大生长量为9.25~9.78(lg(CFU/mL)),差异不明显。在6、45、48 ℃下的菌体最大生长量明显降低。ATCC27853在50 ℃时随着时间的延长菌落数降低,到14 h后低于检测限,说明ATCC27853在50 ℃时不生长,已经失活。综上,生长温度是ATCC27853在牛乳中生长繁殖的关键因素。
由表1可以看出,9 个温度下a在2.65~3.60(lg(CFU/mL))之间,相差小于1(lg(CFU/mL))。在10~42 ℃时,ATCC27853的b均可达到109 CFU/mL,表明在10~42 ℃时ATCC27853所能达到的最大菌落数并不随温度的变化而变化。当温度为6、45、48 ℃时,ATCC27853的b分别为7.78、8.85、7.77(lg(CFU/mL)),与10~42 ℃时相比差异显著(P<0.05),菌体的生长受到明显的抑制。6~48 ℃时,c随温度的升高先增大后减小,36 ℃时c最大。d随温度的升高呈先缩短再延长的趋势,从172.95 h缩短到4.77 h再延长到25.60 h,36 ℃时d最短。
表1 铜绿假单胞菌ATCC27853在牛乳中于不同温度下生长的一级Gompertz模型参数值
Table 1 Estimated parameter values in Gompertz growth curves for P. aeruginosa ATCC27853 in milk at different temperatures
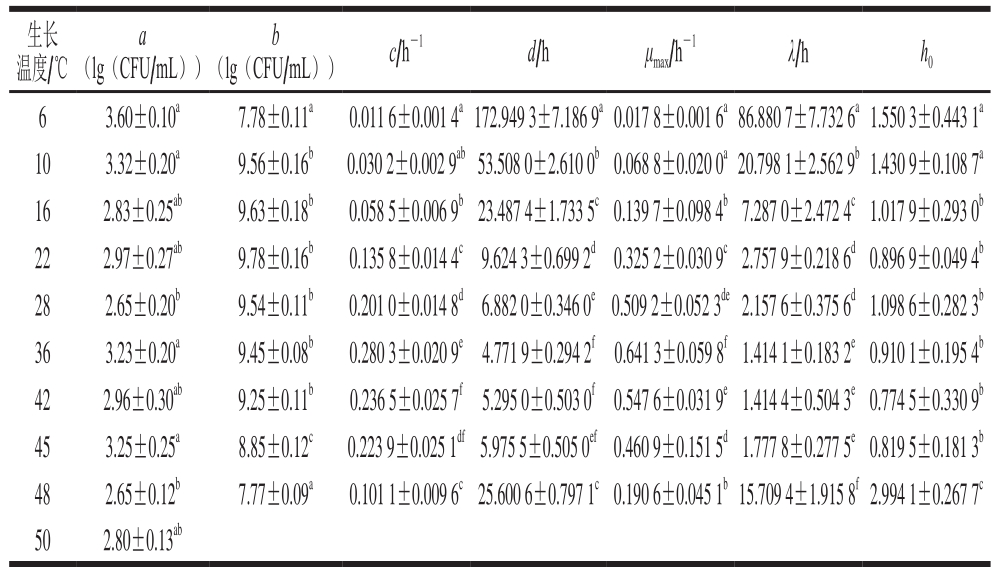
注:同列上标小写字母不同表示差异显著(P<0.05)。
生长温度/℃a(lg(CFU/mL))c/h-1 d/hμmax/h-1 λ/hh0 b(lg(CFU/mL))6 3.60±0.10a 7.78±0.11a 0.011 6±0.001 4a172.949 3±7.186 9a0.017 8±0.001 6a86.880 7±7.732 6a1.550 3±0.443 1a 10 3.32±0.20a 9.56±0.16b 0.030 2±0.002 9ab53.508 0±2.610 0b0.068 8±0.020 0a20.798 1±2.562 9b1.430 9±0.108 7a 16 2.83±0.25ab 9.63±0.18b 0.058 5±0.006 9b23.487 4±1.733 5c0.139 7±0.098 4b7.287 0±2.472 4c1.017 9±0.293 0b 22 2.97±0.27ab 9.78±0.16b 0.135 8±0.014 4c9.624 3±0.699 2d0.325 2±0.030 9c2.757 9±0.218 6d0.896 9±0.049 4b 28 2.65±0.20b 9.54±0.11b 0.201 0±0.014 8d6.882 0±0.346 0e0.509 2±0.052 3de2.157 6±0.375 6d1.098 6±0.282 3b 36 3.23±0.20a 9.45±0.08b 0.280 3±0.020 9e4.771 9±0.294 2f0.641 3±0.059 8f1.414 1±0.183 2e0.910 1±0.195 4b 42 2.96±0.30ab 9.25±0.11b 0.236 5±0.025 7f5.295 0±0.503 0f0.547 6±0.031 9e1.414 4±0.504 3e0.774 5±0.330 9b 45 3.25±0.25a 8.85±0.12c 0.223 9±0.025 1df5.975 5±0.505 0ef0.460 9±0.151 5d1.777 8±0.277 5e0.819 5±0.181 3b 48 2.65±0.12b 7.77±0.09a 0.101 1±0.009 6c25.600 6±0.797 1c0.190 6±0.045 1b15.709 4±1.915 8f2.994 1±0.267 7c 50 2.80±0.13ab
在6~36 ℃的生长温度范围内,µmax由0.017 8增长到0.641 3,因为随着温度的升高,ATCC27853的代谢反应及生长速率在加快,最适生长温度36 ℃也是该菌生长速率最快的温度;当生长温度为48 ℃时,µmax显著降低到0.190 6(P<0.05)。生长温度上升到50 ℃时,可能是因为ATCC27853菌体内的核酸、蛋白质、细胞膜等热敏性大分子物质在高温下发生变性,细胞的生理代谢功能急剧下降,菌体死亡;对应的λ也发生相应的变化,从86.88 h缩短到1.41 h,之后又延长到15.71 h,ATCC27853在最适生长温度36 ℃时λ最短。牛乳在贮藏期间,一旦由微生物引起腐败变质,微生物的λ与其货架期有关,λ越长货架期越长;在较低温度和较高温度下微生物的λ较长,会延长牛乳的货架期。ATCC27853细胞的h0描述了细胞适应新环境的能力,h0越高细胞适应环境的能力越弱。由表1可以看出,温度为6、10、48 ℃时的h0比较高;16~45 ℃时h0基本保持不变,且差异不显著(P>0.05)。此外,50 ℃与6~48 ℃菌体的初始菌落数基本相同,50 ℃下,随着培养时间的延长,ATCC27853菌体细胞不能忍受此高温,数量呈下降趋势,并于14 h后低于检测线,表明ATCC27853菌体死亡。
由表2可知,在6~4 8 ℃时,模型的RMSE≤0.219 2,R2≥0.991 9,说明模型拟合效果较好。Af和Bf皆接近于1,也表明该模型的拟合度较好,ATCC27853的一级Gompertz模型的预测值与实测值之间偏差很小,基本没有系统偏差,不会产生安全性危害的情况。Ross等[27]认为Bf在0.90~1.05的范围内时模型拟合好;Bf在0.70~0.90与1.06~1.15之间模型拟合效果可以接受;Bf<0.70或Bf>1.15时,存在系统偏差,模型拟合不可接受。综上,本研究建立的一级Gompertz模型能很好地预测ATCC27853在牛乳中6~48 ℃下的生长,拟合效果好,且有效、可靠。
表2 铜绿假单胞菌ATCC27853在牛乳中生长的Gompertz模型的评价结果
Table 2 Fitness evaluation of Gompertz model for P. aeruginosa ATCC27853 growth in milk
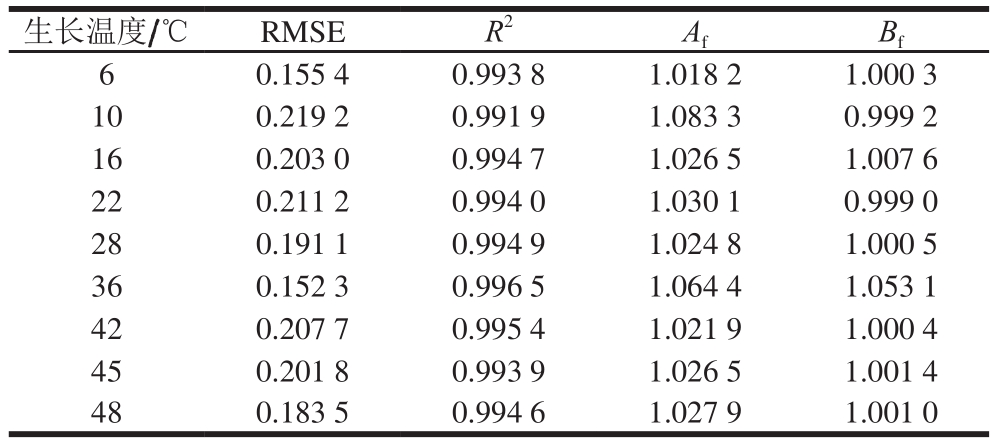
生长温度/℃ RMSER2 Af Bf 6 0.155 4 0.993 8 1.018 2 1.000 3 10 0.219 2 0.991 9 1.083 3 0.999 2 16 0.203 0 0.994 7 1.026 5 1.007 6 22 0.211 2 0.994 0 1.030 1 0.999 0 28 0.191 1 0.994 9 1.024 8 1.000 5 36 0.152 3 0.996 5 1.064 4 1.053 1 42 0.207 7 0.995 4 1.021 9 1.000 4 45 0.201 8 0.993 9 1.026 5 1.001 4 48 0.183 5 0.994 6 1.027 9 1.001 0
利用Matlab软件对表3中实测值及一级模型的预测值进行相关性分析,R2=0.993 6,Af=1.018 2,Bf=0.999 6,也表明Gompertz模型的有效性,可以利用Gompertz模型对牛乳中的ATCC27853生长进行预测。
表3 铜绿假单胞菌ATCC27853在牛乳中生长的Gompertz模型的验证
Table 3 Validation of Gompertz model for P. aeruginosa ATCC27853 growth in milk
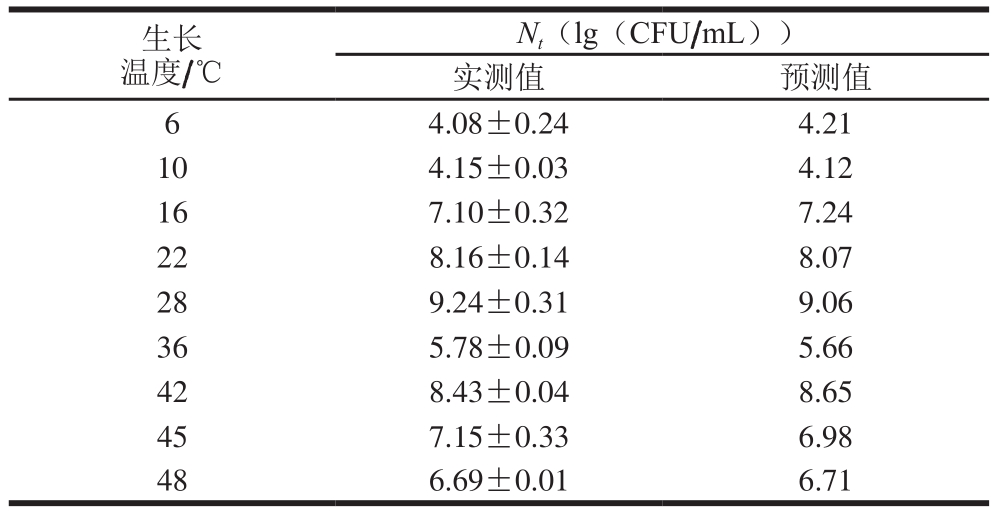
生长温度/℃Nt(lg(CFU/mL))实测值 预测值6 4.08±0.24 4.21 10 4.15±0.03 4.12 16 7.10±0.32 7.24 22 8.16±0.14 8.07 28 9.24±0.31 9.06 36 5.78±0.09 5.66 42 8.43±0.04 8.65 45 7.15±0.33 6.98 48 6.69±0.01 6.71
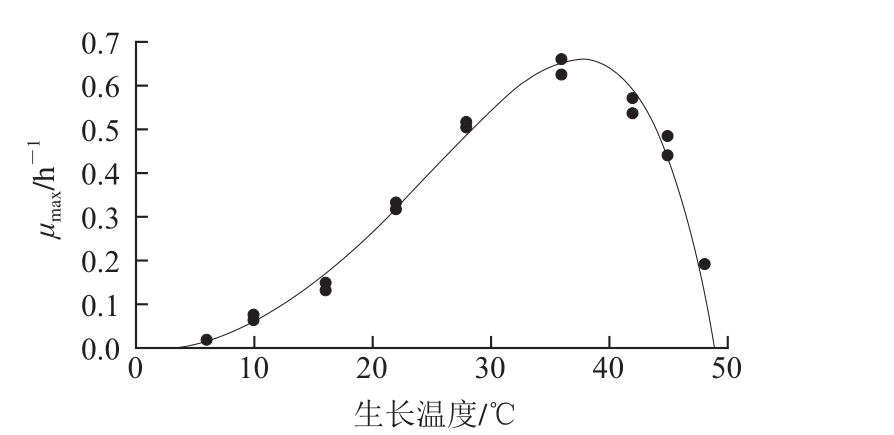
图2 牛乳中铜绿假单胞菌ATCC27853生长温度对μmax的影响
Fig. 2 Effect of growth temperature on the maximum specific growth rate ofP. aeruginosa ATCC27853 in milk
为了进一步了解温度对牛乳中ATCC27853生长速率的影响,基于2.1节建立的一级Gompertz模型,利用修正Ratkowsky模型研究生长温度对µmax的影响。由图2可知,随着温度的升高,ATCC27853的µmax逐渐增加,直至最适生长温度36 ℃;当温度超过36 ℃后µmax开始下降直至为零。微生物生长的λ是指微生物接种到新鲜培养液后,最初一段时间要适应新环境,一时还缺乏分解或催化有关底物的酶或者足够的中间代谢物,其细胞数目不会发生变化,但对于不同的生长温度这个适应期是不相同的。由图3可知,随着生长温度的升高,ATCC27853的λ逐渐缩短,lnλ缩短,说明随着生长温度的升高,ATCC27853细胞的代谢系统适应温度变化的时间在缩短。但是,当温度升到48 ℃后,λ明显延长,Hyperbola模型不再适合拟合生长温度与lnλ的关系。
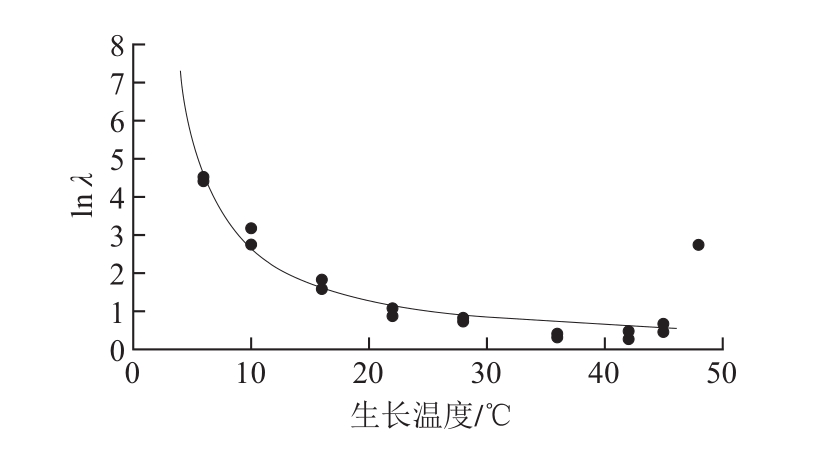
图3 牛乳中铜绿假单胞菌ATCC27853生长温度对λ的影响
Fig. 3 Effect of growth temperature on the lag phase duration of P. aeruginosa ATCC27853 in milk
表4 二级模型参数的估计值和95%置信区间值
Table 4 Estimates and 95% confidence level of parameters in secondary model
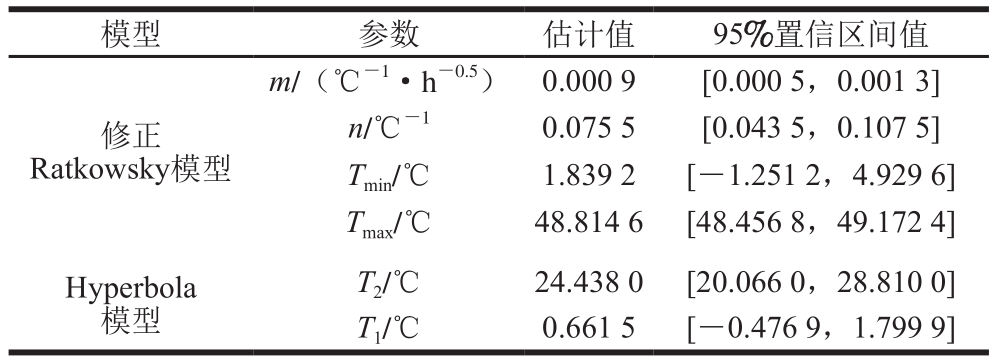
模型 参数 估计值 95%置信区间值修正Ratkowsky模型m/(℃-1·h-0.5) 0.000 9 [0.000 5,0.001 3]n/℃-1 0.075 5 [0.043 5,0.107 5]Tmin/℃ 1.839 2 [-1.251 2,4.929 6]Tmax/℃ 48.814 6 [48.456 8,49.172 4]Hyperbola模型T2/℃ 24.438 0 [20.066 0,28.810 0]T1/℃ 0.661 5 [-0.476 9,1.799 9]
如表4所示,TCC27853的修正Ratkowsky模型中Tmin为1.8 ℃,Tmax为48.8 ℃,可为该菌在牛乳中的安全控制提供理论依据。ATCC27853的Hyperbola模型中T1为0.7 ℃,是ATCC27853的生长最低温度;参数Tmin和T1皆表示理论最低生长温度,实验表明ATCC27853在4 ℃下不生长(实验数据未显示),修正Ratkowsky模型中最低温度的理论值与实际值更接近,而Hyperbola模型拟合的最低温度略低于实际情况;利用Hyperbola模型,能够快速预测牛乳的安全贮存时间,确定其货架期。
修正Ratkowsky模型和Hyperbola模型的评价结果为:RMSE≤0.256 7,R2≥0.974 1,1.087 0≤Af≤1.152 0,1.052 8≤Bf≤1.0721,R2、Af和Bf皆接近于1,说明二级模型拟合度较好。
表5 铜绿假单胞菌ATCC27853在牛乳中生长的二级模型的验证结果
Table 5 Validation of secondary models forP. aeruginosa ATCC27853 growth in milk
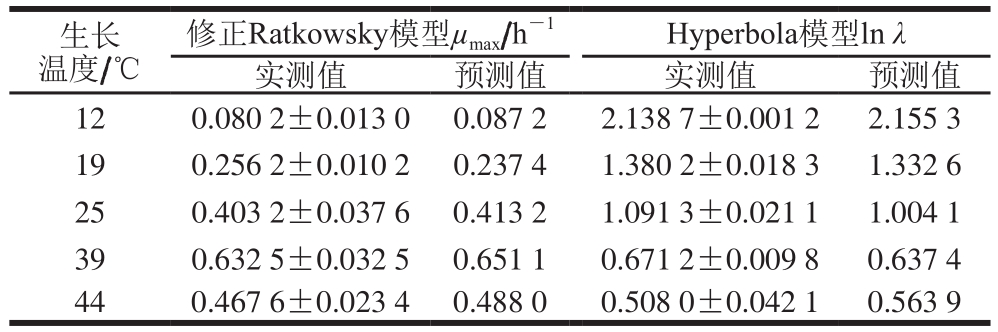
生长温度/℃修正Ratkowsky模型µmax/h-1 Hyperbola模型lnλ实测值 预测值 实测值 预测值12 0.080 2±0.013 0 0.087 2 2.138 7±0.001 2 2.155 3 19 0.256 2±0.010 2 0.237 4 1.380 2±0.018 3 1.332 6 25 0.403 2±0.037 6 0.413 2 1.091 3±0.021 1 1.004 1 39 0.632 5±0.032 5 0.651 1 0.671 2±0.009 8 0.637 4 44 0.467 6±0.023 4 0.488 0 0.508 0±0.042 1 0.563 9
如表5所示,利用Matlab软件将实验所得μmax的实测值与修正Ratkowsky模型的预测值进行相关性分析,R2=0.996 5,Af=1.052 8,Bf=1.021 2。对lnλ的实测值与Hyperbola模型预测值的相关性进行分析,R2=0.992 5,Af=1.058 1,Bf=0.988 5。表明本研究所建立的二级修正Ratkowsky模型和Hyperbola模型是有效且可靠的。
牛乳的营养价值较高,在加工、运输、贮藏和销售的过程中微生物对其污染是很难避免的,极易因污染铜绿假单胞菌而引起腐败变质。本研究建立了6~48 ℃下ATCC27853在牛乳中生长的一级和二级模型,发现ATCC27853能在6 ℃的低温下生长,最高生长温度为48 ℃;研究了牛乳中温度对ATCC27853生长的影响及预测,为其安全贮藏及控制提供理论依据。
本研究首先利用Gompertz模型建立了ATCC27853的一级生长模型,基于一级生长模型的参数,再结合修正Ratkowsky模型与Hyperbola模型,分别建立了ATCC27853的µmax、λ与生长温度之间的二级模型。发现修正Ratkowsky模型与Hyperbola模型能分别较好地建立ATCC27853在牛乳中生长温度与μmax、生长温度与λ的关系。
由h0可以确定ATCC27853的初始生理状态[25]。Baranyi[28]、Gospavic[23]和Velugoti[29]等的研究认为不同温度下菌体细胞的h0基本保持恒定。Mellefont等[30]在研究生长温度对大肠杆菌和克雷伯氏菌的影响时发现,h0不是恒定不变的,温度的变化还会影响λ;Delignette-Muller等[31]的研究发现,单增李斯特氏菌接种前的培养温度与接种后生长温度的变化幅度与h0有一定的相关性;Xanthiakos等[25]研究了1.5~16 ℃下单增李斯特氏菌的生长情况,发现在1.5~8.0 ℃下h0明显高于在8~16 ℃。
在ATCC27853的初始菌量基本相同的情况下,本研究发现在16~45 ℃的范围内,牛乳中ATCC27853菌体h0基本保持恒定,随温度变化h0变化不显著(P>0.05),这与Gospavic等[23]的研究结果一致;在6 ℃和10 ℃时,h0明显高于16~45 ℃,此结果与Xanthiakos等[25]的研究结果相似,原因可能是低温(6 ℃和10 ℃)限制了菌体细胞内核酸、蛋白质和细胞膜等大分子物质的合成。
Baranyi等[28]的研究认为h0=µmax×λ、α0=exp(-h0)。当ATCC27853的生长温度在16 ℃时h0=1.017 9(表1),则α0=36.14%,表明在此温度下ATCC27853菌体细胞的比生长速率为μmax的36.14%;在16~45 ℃时α0平均值约为40.11%,6、10、48 ℃时α0分别为21.22%、23.91%和5.01%,可以看出6、10、48 ℃的α0明显低于16~45 ℃。生长温度为6、10、48 ℃时生长速率明显较低,推测可能是ATCC27853接种前的培养温度(36 ℃)与被接种后的生长温度(6、10、48 ℃)之间存在较大的差异,导致h0较大的改变,生长温度对初始生理状态的影响为预测微生物生长研究提供理论依据。
综上,本研究采用Gompertz模型建立了6~48 ℃下牛乳中铜绿假单胞菌ATCC27853的一级生长模型,结合修正Ratkowsky模型与Hyperbola模型分别建立了ATCC27853的生长温度对其μmax和λ影响的二级模型;用R2、RMSE、Af和Bf评价模型拟合并验证模型的有效性和可靠性,结果表明:用Gompertz模型、修正Ratkowsky模型与Hyperbola模型建立的一级生长模型和二级模型拟合度高;ATCC27853的生长温度对h0的影响表明菌株培养温度(36 ℃)与被接种后的生长温度(6、10、48 ℃)之间存在较大的差异时会导致h0发生较大的改变。ATCC27853生长温度对μmax、λ和h0影响的预测模型的建立为其在牛乳中的安全控制提供理论依据。
[1] 李晓东. 乳品工艺学[M]. 北京: 科学出版社, 2011: 54-70.
[2] MORADALI M F, GHODS S, REHM B H.Pseudomonas aeruginosa lifestyle: a paradigm for adaptation, survival, and persistence[J].Frontiers in Cellular and Infection Microbiology, 2017, 7(4): 1-20.DOI:10.3389/fcimb.2017.00039.
[3] PORRAS-GÓMEZ M, VEGA-BAUDRIT J, GARCÍA F, et al.Evaluation of the synergistic effect of edta-functionalized chitosan nanoparticles on imipenem delivery inPseudomonas aeruginosa carbapenem-resistant strain AG1[J]. Journal of Biomaterials and Nanobiotechnology, 2018, 9(1): 64-78. DOI:10.4236/jbnb.2018.91006.
[4] IMANAH E O, BESHIRU A, IGBINOSA E O. Antibiogram profile ofPseudomonas aeruginosa isolated from some selected hospital environmental drains[J]. Asian Pacific Journal of Tropical Disease,2017, 7(10): 604-609. DOI:10.12980/apjtd.7.2017D6-468.
[5] 郝士卿, 杨浩宁, 尤文文, 等. 372 株铜绿假单胞菌的临床分布特点及耐药性分析[J]. 临床合理用药杂志, 2017, 10(1): 154-155; 158.DOI:10.5887/j.cnki.13-1389/r.2017.01.096.
[6] 张翔, 浦政轶. 一起绿脓杆菌引起食物中毒的调查分析[J]. 交通医学, 2002, 16(5): 465. DOI:10.3969/j.issn.1006-2440.2002.05.015.
[7] 黄美子, 赵花子, 李风善, 等. 食物中毒标本检出绿脓杆菌[J]. 中国卫生工程学, 2003, 2(4): 221. DOI:10.3969/j.issn.1671-4199.2003.04.036.
[8] 沈瑛, 杨正林, 岳凤. 食物中毒标本中检出铜绿假单胞菌[J]. 浙江预防医学, 2010, 22(3): 45-46. DOI:10.19485/j.cnki.issn1007-0931.2010.03.023.
[9] 滕葳. 食品中微生物危害控制与风险评估[M]. 北京: 化学工业出版社, 2012: 210-235.
[10] DUBOIS-BRISSONNET F, GUILLIER L, NAÏTALI M. Teaching microbiological food safety through case studies[J]. International Journal of Food Studies, 2015, 4(2): 134-140. DOI:10.7455/ijfs/4.2.2015.a2.
[11] HUANG L H. IPMP global fit: a one-step direct data analysis tool for predictive microbiology[J]. International Journal of Food Microbiology, 2017, 262(20): 38-48. DOI:10.1016/j.ijfoodmicro.2017.09.010.
[12] VADASZ A S, VADASZ P, ABASHAR M E, et al. Recovery of an oscillatory mode of batch yeast growth in water for a pure culture[J].International Journal of Food Microbiology, 2001, 71(2/3): 219-234.DOI:10.1016/S0168-1605(01)00618-3.
[13] LEE Y J, JUNG B S, YOON H J, et al. Predictive model for the growth kinetics of Listeria monocytogenes in raw pork meat as a function of temperature[J]. Food Control, 2014, 44(46): 16-21. DOI:10.1016/j.foodcont.2014.03.024.
[14] 邹宇, 胡立明, 胡文忠, 等. 单增李斯特菌在牛奶中生长曲线的拟合和预测模型的建立[J]. 食品工业科技, 2014, 35(11): 69-73.DOI:10.13386/j.issn1002-0306.2014.11.006.
[15] MØLLER C O A, ILG Y, AABO S, et al. Effect of natural microbiota on growth of Salmonella spp. in fresh pork: a predictive microbiology approach[J]. Food Microbiology, 2013, 34(2): 284-295. DOI:10.1016/j.fm.2012.10.010.
[16] LI L, CEPEDA J, SUBBIAH J, et al. Dynamic predictive model for growth of Salmonella spp. in scrambled egg mix[J]. Food Microbiology, 2017, 64: 39-46. DOI:10.1016/j.fm.2016.12.007.
[17] JUNEJA V K, VALENZUELA M M, HUANG L H, et al. Modeling the effect of temperature on growth of Salmonella in chicken[J]. Food Microbiology, 2007, 24(4): 328-335. DOI:10.1016/j.fm.2006.08.004.
[18] GAO Y L, QIU W F, WU D, et al. Assessment of Clostridium perfringens spore response to high hydrostatic pressure and heat with nisin[J]. Applied Biochemistry and Biotechnology, 2011, 164(7):1083-1095. DOI:10.1007/s12010-011-9196-0.
[19] JUNEJA V K, MARKS H, THIPPAREDDI H. Predictive model for growth of Clostridium perfringens during cooling of cooked uncured beef[J]. Food Microbiology, 2008, 25(1): 42-55. DOI:10.1016/j.fm.2007.08.004.
[20] ZWIETERING M H, DE KOOS J T, HASENACK B E, et al.Modeling of bacterial growth as a function of temperature[J].Applied and Environmental Microbiology, 1991, 57(4): 1094-1101.DOI:10.1002/bit.260370814.
[21] 沈萍, 范秀容, 李广武. 微生物学实验[M]. 3版. 北京: 高等教育出版社, 2000: 92-94.
[22] JUNEJA V K, MISHRA A, PRADHAN A K. Dynamic predictive model for growth of Bacillus cereus from spores in cooked beans[J].Journal of Food Protection, 2018, 81(2): 308-315. DOI:10.4315/0362-028X.JFP-17-391.
[23] GOSPAVIC R, KREYENSCHMIDT J, BRUCKNER S, et al.Mathematical modelling for predicting the growth of Pseudomonas spp. in poultry under variable temperature conditions[J]. International Journal of Food Microbiology, 2008, 127(3): 290-297. DOI:10.1016/j.ijfoodmicro.2008.07.022.
[24] ROSS T. Indices for performance evaluation of predictive models in food microbiology[J]. Journal of Applied Bacteriology, 1996, 81(5):501-508. DOI:10.1111/j.1365-2672.1996.tb03539.x.
[25] XANTHIAKOS K, SIMOS D, ANGELIDIS A S, et al. Dynamic modeling of Listeria monocytogenes growth in pasteurized milk[J].Journal of Applied Microbiology, 2006, 100(6): 1289-1298.DOI:10.1111/j.1365-2672.2006.02854.x.
[26] IANNETTI L, SALINI R, SPERANDII A F, et al. Predicting the kinetics of Listeria monocytogenes and Yersinia enterocolitica under dynamic growth/death-inducing conditions, in Italian style fresh sausage[J]. International Journal of Food Microbiology, 2017, 240(2):108-114. DOI:10.1016/j.ijfoodmicro.2016.04.026.
[27] ROSS T, DALGAARD P, TIENUNGOON S. Predictive modelling of the growth and survival of Listeria in fishery products[J]. International Journal of Food Microbiology, 2000, 62(3): 231-245. DOI:10.1016/S0168-1605(00)00340-8.
[28] BARANYI J, ROBERTS T A. A dynamic approach to predicting bacterial growth in food[J]. International Journal of Food Microbiology, 1994, 23(3/4): 277-294. DOI:10.1016/0168-1605(94)90157-0.
[29] VELUGOTI P R, BOHRA L K, JUNEJA V K, et al. Dynamic model for predicting growth of Salmonella spp. in ground sterile pork[J].Food Microbiology, 2011, 28(4): 796-803. DOI:10.1016/j.fm.2010.05.007.
[30] MELLEFONT L A, ROSS T. The effect of abrupt shifts in temperature on the lag phase duration of Escherichia coli and Klebsiella oxytoca[J].International Journal of Food Microbiology, 2003, 83(3): 295-305.DOI:10.1016/S0168-1605(02)00378-1.
[31] DELIGNETTE-MULLER M L, BATY F, CORNU M, et al. Modelling the effect of a temperature shift on the lag phase duration of Listeria monocytogenes[J]. International Journal of Food Microbiology, 2005,100(1/2/3): 77-84. DOI:10.1016/j.ijfoodmicro.2004.10.021.
Prediction ofPseudomonas aeruginosaGrowth in Milk
ZHU Lei, ZHANG Aijing, WANG Pengjie, et al. Prediction of Pseudomonas aeruginosa growth in milk[J]. Food Science,2019, 40(7): 1-8. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180316-217. http://www.spkx.net.cn