无核白葡萄干制过程中酚类物质的变化及其与褐变的关系
李晓丽1,2,3,4,陈计峦4,范盈盈1,2,3,何伟忠1,2,3,王 智1,2,3,刘峰娟1,2,3,*
(1.新疆农业科学院农业质量标准与检测技术研究所,新疆 乌鲁木齐 830091;2.农业部农产品质量安全风险评估实验室(乌鲁木齐),新疆 乌鲁木齐 830091;3.新疆农产品质量安全重点实验室,新疆 乌鲁木齐 830091;4.石河子大学食品学院,新疆 石河子 832000)
摘 要:为研究无核白葡萄干制过程中酚类物质变化及其与褐变的关系,将无核白葡萄进行荫干处理,测定其脱水干制过程中总酚含量、褐变度、酚类物质组成和含量,并鉴定酶促褐变底物。结果表明:无核白葡萄在干制过程中总酚含量总体呈降低趋势,在无核白葡萄出现明显褐变时总酚含量有所增加,同时褐变度明显上升。无核白葡萄中主要的酚类物质有14 种,其中6 种是酶促褐变的底物,分别为原花青素B2、对羟基肉桂酸、儿茶素、反式-咖啡酸、顺式-白藜芦醇、阿魏酸,最主要的酶促褐变底物为儿茶素。干制过程中无核白葡萄褐变度与总酚、原花青素B2、对羟基肉桂酸、儿茶素、反式-咖啡酸、顺式-白藜芦醇含量呈显著或极显著相关(P<0.05,P<0.01)。本研究结果为提高无核白葡萄干的品质提供理论依据。
关键词:干制;无核白葡萄;酚类物质;褐变
目前,新疆吐鲁番地区已成为中国最大的葡萄干加工生产基地,该地区的绿葡萄干已成为中国葡萄干的特色产品并享誉全球[1]。生产绿葡萄干的主要葡萄品种为无核白葡萄,而无核白葡萄在脱水干制过程中极易发生褐变,严重影响了葡萄干的品质[2-3]。因此,干制褐变已成为制约无核白葡萄干产业持续健康发展的关键问题[4-5]。
褐变是果蔬及其制品在加工和贮藏的过程中,在内、外因素的综合作用下表面颜色发生改变的现象[6]。大多数研究认为果蔬加工和贮藏过程中的褐变主要是酶促褐变[7-8]。酶促褐变是在氧气存在的条件下多酚氧化酶催化酚类物质向醌及其聚合物转变的过程,反应生成褐色素或黑色素,造成褐变现象[9-10]。无核白葡萄采后脱水干制过程中的褐变主要为酶促褐变[11-12]。酶促褐变的三大关键因素之一即为酚类物质,目前关于葡萄中酚类物质的研究主要集中在葡萄成熟过程及酿造过程中酚类物质种类和含量的变化[13-14]、不同品种和不同产区葡萄中酚类物质组成及其与抗氧化活性的关系等方面[15-17]。对于干制过程中葡萄酚类物质种类和含量的变化及其与褐变的关系的研究还相对较少。无核白葡萄采后干制过程中,在很长一段时间内仍然保持着生命活力,对脱水胁迫仍能做出一定的反应,也会通过一系列代谢来适应这种胁迫。而这些改变很可能会对其次生代谢产物——酚类物质产生影响,从而影响褐变的发生。
由于无核白葡萄中主要的酚类物质以及这些酚类物质如何参与酶促褐变等均未明确,为探讨其在干制过程中酚类物质的变化,本实验以无核白葡萄为研究对象,研究脱水干制过程中其酚类物质组成的变化以及主要酚类物质与多酚氧化酶的反应,以期揭示无核白葡萄在采后脱水干制过程中酚类物质的变化及其与褐变的关系,为提高无核白葡萄干品质提供理论依据。
1 材料与方法
1.1 材料与试剂
无核白葡萄采自新疆吐鲁番市。挑选成熟、无病虫害、无损伤、大小均匀的果实为实验材料。葡萄果实可溶性固形物质量分数为19%~22%,湿基水分质量分数为(79.00±0.11)%,果实直径为(11.17±0.45)mm,长度为(15.25±0.23)mm。
磷酸氢二钠、磷酸二氢钠、盐酸、甲醇、福林-肖卡试剂(均为分析纯) 北京索莱宝科技有限公司;槲皮素、邻羟基苯甲酸、咖啡酸、对羟基肉桂酸、原花青素B2、山柰酚、白藜芦醇、异鼠李素、芦丁、儿茶素、阿魏酸、杨梅素、香草酸(均为标准品) 上海安谱实验科技股份有限公司。
1.2 仪器与设备
FA2104N电子天平 上海民桥精密科学仪器有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;SK2200H超声波清洗器 上海科导超声仪器有限公司;全能台式高速冷冻离心机 美国赛默飞世尔公司;超高效液相色谱-离子淌度飞行时间质谱仪(ultra performance liquid chromatography-ion mobility quadrupole-time of flight mass spectrometer,UPLC-IMQTOF-MS) 美国Waters公司。
1.3 方法
1.3.1 样品处理
将无核白葡萄置于阴凉干燥处,环境平均温度为25 ℃,平均相对湿度45%,在无核白葡萄脱水质量损失率[18]0%、10%、20%、30%、40%、50%、60%、70%和80%时取样,测定各项指标。
1.3.2 无核白葡萄褐变度的测定
取干质量3 g无核白葡萄按料液比1∶10加蒸馏水,匀浆后在4 ℃下9 000 r/min离心30 min,褐变度以上清液在420 nm波长处的吸光度表示[19]。
1.3.3 酚类提取液制备
准确称取5.00 g不同质量损失率的无核白葡萄,用30 mL酸化甲醇溶液在100 W、25 ℃条件下超声辅助提取30 min,然后于9 000×g、4 ℃离心10 min,收集上清液,重复2 次,合并提取液。
1.3.4 总酚含量的测定
采用福林-肖卡法[20],以没食子酸标准溶液建立标准曲线,回归方程为y=0.821x+0.070(R2=0.994 8)。式中:x为没食子酸质量浓度/(mg/mL);y为没食子酸含量/(mg/g)。结果以每克样品中没食子酸干质量表示。
1.3.5 酚类物质组成的测定
参照Kolniak-Ostek等[21]的方法,采用UPLC-IMQTOF-MS进行酚类物质单体测定。UPLC条件为:色谱柱采用UPLC BEH C18柱(50 mm×2.1 mm,1.7 μm),流动相由溶剂A(体积分数0.1%甲酸)和溶剂B(乙腈)组成。梯度洗脱:0~1 min,99%溶剂A;1~12 min,99%~0%溶剂A;12~13.5 min,0%~99%溶剂A。流速0.45 mL/min,进样量10 μL,柱温45 ℃,进样室温度10 ℃。质谱条件为:毛细管电压2 500 V,锥形电压30 V,离子源温度100 ℃,去溶剂化温度300 ℃,脱溶剂气体(氮气)流速300 L/h,电压斜坡循环0.3~2.0 V。对比自建数据库进行定性分析。
数据库中酚类物质包括:表没食子儿茶素没食子酸酯、表棓儿茶素、棓儿茶素、儿茶酸没食子酸酯、原花青素B2、原矢车菊素B2、咖啡酸乙酯、顺式-白藜芦醇、芹菜苷、黄岑苷元、安息香酸、咖啡酸、绿原酸、白杨素、肉桂酸、香豆酸、矢车菊素、花青素-3-葡萄糖苷、儿茶素、飞燕草素、二氢山柰酚、二氢槲皮素、二氢槲皮素-3-O-鼠李糖苷、圣草酸、香豆酸乙酯、没食子酸乙酯、阿魏酸、没食子酸、龙胆酸、橙皮苷、邻羟基苯甲酸、对羟基肉桂酸、金丝桃苷、异鼠李素、异槲皮素、异鼠李素-3-葡糖苷、山柰酚、山柰酚-3-葡糖苷、山柰酚-3-芸香糖苷、锦葵素、锦葵花素-3-葡萄糖苷、二甲基花翠素葡萄糖苷、没食子酸甲酯、没食子酸甲酯-咖啡酸、杨梅素、杨梅酮-3-木糖苷、杨梅酮-3-鼠李糖苷、柚皮素、芍药素、甲基花青素葡萄糖苷、矮牵牛素、对羟基苯甲酸、原花青素B1、柚皮苷、原矢车菊素B1、原矢车菊素B3、原儿茶酸、槲皮素、槲皮素-D-木糖苷、槲皮素-3-半乳糖苷、槲皮素-3-葡萄糖苷、槲皮素-3-芸香糖苷、反式-白藜芦醇、鼠李黄素、芦丁、水杨酸、介子酸、丁香亭-3-葡萄糖苷、丁香酸、反式-咖啡酸、香草酸。
1.3.6 酚类物质分离与标准曲线建立
利用UPLC-IM-QTOF-MS在无核白葡萄中鉴定到主要的14 种酚类物质,通过标准品确定线性回归方程,如表1所示。该检测体系分离度、线性关系良好,R2均达到0.99以上。鉴定出的酚类物质有槲皮素、邻羟基苯甲酸、反式-咖啡酸、对羟基肉桂酸、原花青素B2、山柰酚、顺式-白藜芦醇、异鼠李素、芦丁、儿茶素、阿魏酸、杨梅素、香草酸、山柰酚-3-葡萄糖苷。
表1 无核白葡萄中14 种酚类物质标准品的线性回归方程
Table 1 Linear regression equations for 14 phenolics standards of Thompson seedless grapes
注:x.标准品质量浓度/(μg/mL);y.标准品含量/(μg/g)。
标准品 线性方程R2原花青素B2 y=3 570x-108 0.999 4山柰酚y=337x+124 0.998 3山柰酚-3-葡萄糖苷y=2 332x-10 631 0.999 1槲皮素y=9 621.5x-16 950 0.998 2对羟基肉桂酸y=924.2x-11.15 0.994 4异鼠李素y=2 042.85x+132 0.991 3芦丁y=2 076.66x-578 0.996 4儿茶素y=1 426.04x-1 189 0.995 9顺式-白藜芦醇y=2 737.42x-296 0.998 7邻羟基苯甲酸y=2 2048x-207.2 0.997 5阿魏酸y=763.7x-400.2 0.999 5杨梅黄素y=88.41x-258 0.997 5反式-咖啡酸y=532.7x-155 0.996 7香草酸y=148.1x+126.9 0.994 7
1.3.7 无核白葡萄酶促褐变底物的鉴定
多酚氧化酶提取:准确称取10.0 g无核白葡萄,加入18 mL 0.2 mol/L pH 5.8预冷的磷酸盐缓冲液,用均质机磨成匀浆,在4 ℃冰箱中浸提2.9 h,在4 ℃以9 000 r/min离心15 min,去除沉淀,取上清液,重复1 次,得到无核白葡萄多酚氧化酶提取液。
多酚氧化酶活力测定:在试管中加入3 mL 0.2 mol/L pH 6.8磷酸盐缓冲液、1 mL 0.1 mol/L不同标准品(原花青素B2、山柰酚-3-葡糖苷、槲皮素、邻羟基苯甲酸、山柰酚、对羟基肉桂酸、异鼠李素、芦丁、儿茶素、顺式-白藜芦醇、阿魏酸、杨梅黄素、香草酸、反式-咖啡酸)溶液和1 mL多酚氧化酶提取液,混合均匀,在420 nm波长处测定其4 min内的吸光度变化,每隔30 s测一次吸光度[22],按下式计算酶活力。通过酚类物质与多酚氧化酶是否发生反应确定无核白葡萄酶促褐变底物。
式中:Vr为磷酸盐缓冲液体积/mL;Vs为标准品溶液体积/mL;m为样品质量/g;t为测定时间/min;△A为4 min内吸光度变化量。
1.4 数据统计与分析
实验数据采用Origin 8.5软件作图,并采用SPSS 20.0软件进行单因素方差分析和相关性分析,采用邓肯氏多重比较法进行差异分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
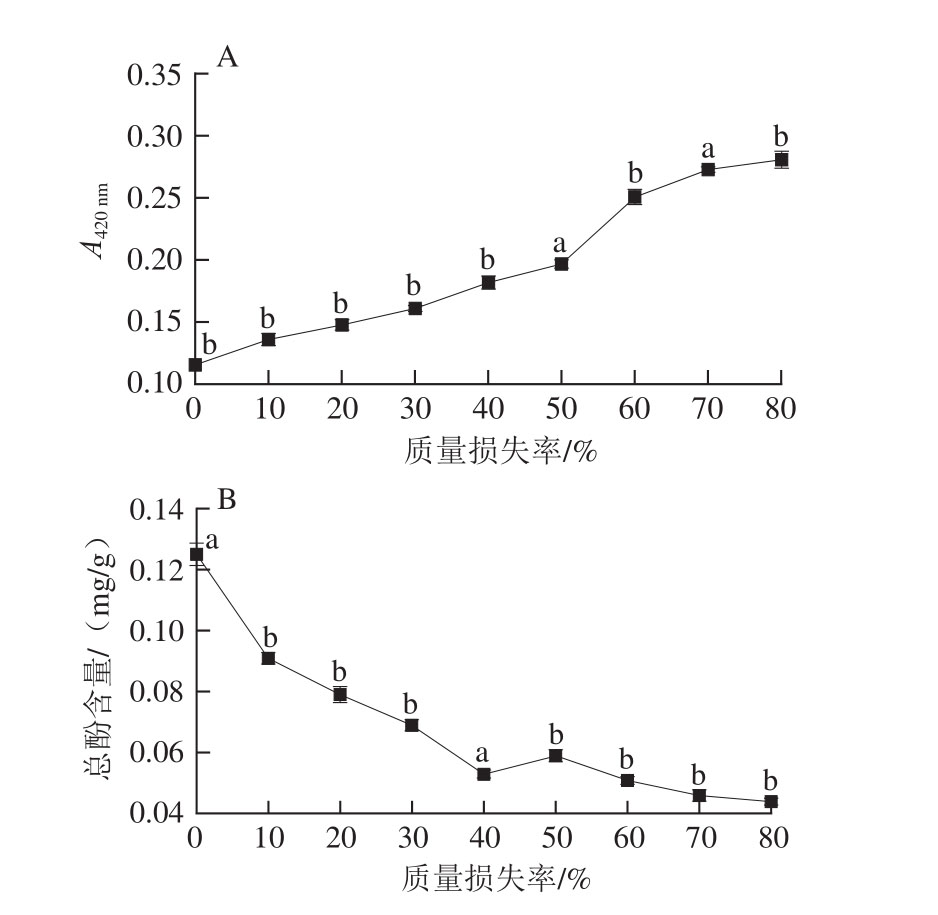
2.1 无核白葡萄干制过程中褐变度和总酚含量的变化
由图1A可知,无核白葡萄在脱水过程中褐变度总体呈现上升的趋势。褐变度在质量损失50%~70%这一阶段显著增加(P<0.05),随着质量损失率的增加,褐变程度越来越严重。在脱水结束时,无核白葡萄褐变度为0.297,为初始值的2.7 倍。由图1B可知,无核白葡萄在脱水过程中总酚含量总体呈现下降的趋势,无核白葡萄在质量损失率40%~50%阶段总酚含量显著增加(P<0.05),这与葡萄开始出现明显褐变现象的时间相符。前人研究发现30 ℃热风干制第8天总酚含量突然增加,此时葡萄开始出现明显褐变现象[23],与本研究结果相同。
2.2 无核白葡萄干制过程中酚类物质组成、含量的变化
表2 无核白葡萄干制过程中单体酚类物质组成和含量
Table 2 Loss of phenolic substances in Thompson seedless grapes during dehydration process
μg/g
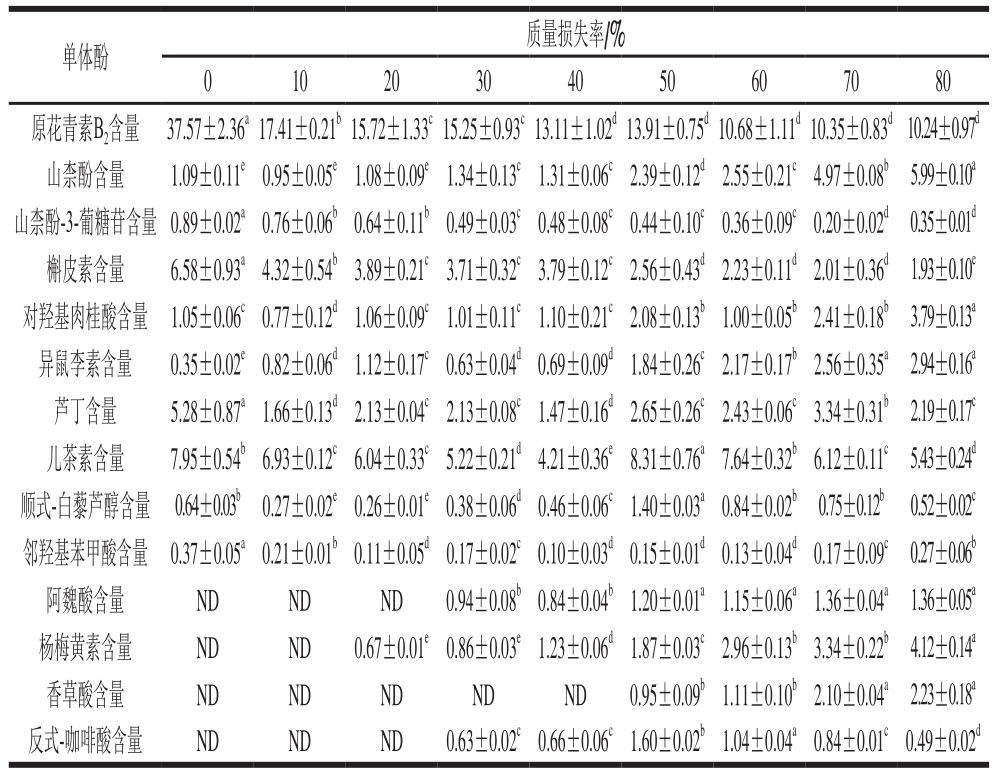
注:同行肩标小写字母不同表示差异显著(P<0.05)。ND.未检出。
质量损失率/%0 10 20 30 40 50 60 70 80原花青素B2含量 37.57±2.36a17.41±0.21b15.72±1.33c15.25±0.93c13.11±1.02d13.91±0.75d10.68±1.11d10.35±0.83d10.24±0.97d山柰酚含量 1.09±0.11e0.95±0.05e1.08±0.09e1.34±0.13c1.31±0.06c2.39±0.12d2.55±0.21c4.97±0.08b 5.99±0.10a山柰酚-3-葡糖苷含量 0.89±0.02a0.76±0.06b0.64±0.11b0.49±0.03c0.48±0.08c0.44±0.10c0.36±0.09c0.20±0.02d0.35±0.01d槲皮素含量 6.58±0.93a4.32±0.54b3.89±0.21c3.71±0.32c3.79±0.12c2.56±0.43d2.23±0.11d2.01±0.36d 1.93±0.10e对羟基肉桂酸含量 1.05±0.06c0.77±0.12d1.06±0.09c1.01±0.11c1.10±0.21c2.08±0.13b1.00±0.05b2.41±0.18b 3.79±0.13a异鼠李素含量 0.35±0.02e0.82±0.06d1.12±0.17c0.63±0.04d0.69±0.09d1.84±0.26c2.17±0.17b2.56±0.35a 2.94±0.16a芦丁含量 5.28±0.87a1.66±0.13d2.13±0.04c2.13±0.08c1.47±0.16d2.65±0.26c2.43±0.06c3.34±0.31b 2.19±0.17c儿茶素含量 7.95±0.54b6.93±0.12c6.04±0.33c5.22±0.21d4.21±0.36e8.31±0.76a7.64±0.32b6.12±0.11c5.43±0.24d顺式-白藜芦醇含量 0.64±0.03b 0.27±0.02e0.26±0.01e0.38±0.06d0.46±0.06c1.40±0.03a0.84±0.02b0.75±0.12b 0.52±0.02c邻羟基苯甲酸含量 0.37±0.05a0.21±0.01b0.11±0.05d0.17±0.02c0.10±0.03d0.15±0.01d0.13±0.04d0.17±0.09c0.27±0.06b阿魏酸含量 ND ND ND 0.94±0.08b0.84±0.04b1.20±0.01a1.15±0.06a1.36±0.04a 1.36±0.05a杨梅黄素含量 ND ND 0.67±0.01e0.86±0.03e1.23±0.06d1.87±0.03c2.96±0.13b3.34±0.22b 4.12±0.14a香草酸含量 ND ND ND ND ND 0.95±0.09b1.11±0.10b2.10±0.04a 2.23±0.18a反式-咖啡酸含量 ND ND ND 0.63±0.02c0.66±0.06c1.60±0.02b1.04±0.04a0.84±0.01c0.49±0.02d单体酚
如表2所示,无核白葡萄脱水干制过程中原花青素B2、槲皮素、芦丁含量整体呈现显著下降趋势,其中在鲜无核白葡萄中原花青素B2含量为37.57 μg/g,在脱水结束时只有10.24 μg/g,降低了72.74%,降低幅度最大。邻羟基苯甲酸从最开始的0.37 μg/g降低至0.27 μg/g,降低速率最慢。山柰酚、对羟基肉桂酸、异鼠李素、阿魏酸、杨梅黄素、香草酸含量整体呈现上升趋势,其中山柰酚在鲜样中的含量是1.09 μg/g,质量损失率80%时增加了4.90 μg/g;阿魏酸含量上升最慢,从质量损失率30%时的0.94 μg/g上升至1.36 μg/g,仅上升了0.42 μg/g。在质量损失率50%时,原花青素B2、对羟基肉桂酸、儿茶素、顺式-白藜芦醇、阿魏酸、反式-咖啡酸含量突然升高后再下降,与无核白葡萄在质量损失率50%时褐变度、总酚含量明显上升的结果相符。杨梅黄素、香草酸分别在质量损失率20%和40%时才开始出现,且其含量随着质量损失率的增加而增加,这是因为杨梅黄素和香草酸自身为淡黄色,随着质量不断地损失,无核白葡萄褐变程度也在不断加深,而杨梅黄素、香草酸含量不断增加,加速了无核白葡萄表皮颜色的变化。
2.3 无核白葡萄多酚氧化酶底物鉴定
表3 无核白葡萄多酚氧化酶对不同底物催化褐变活性
Table 3 Browning activity of polyphenol oxidase in Thompson seedless grapes to different substrates
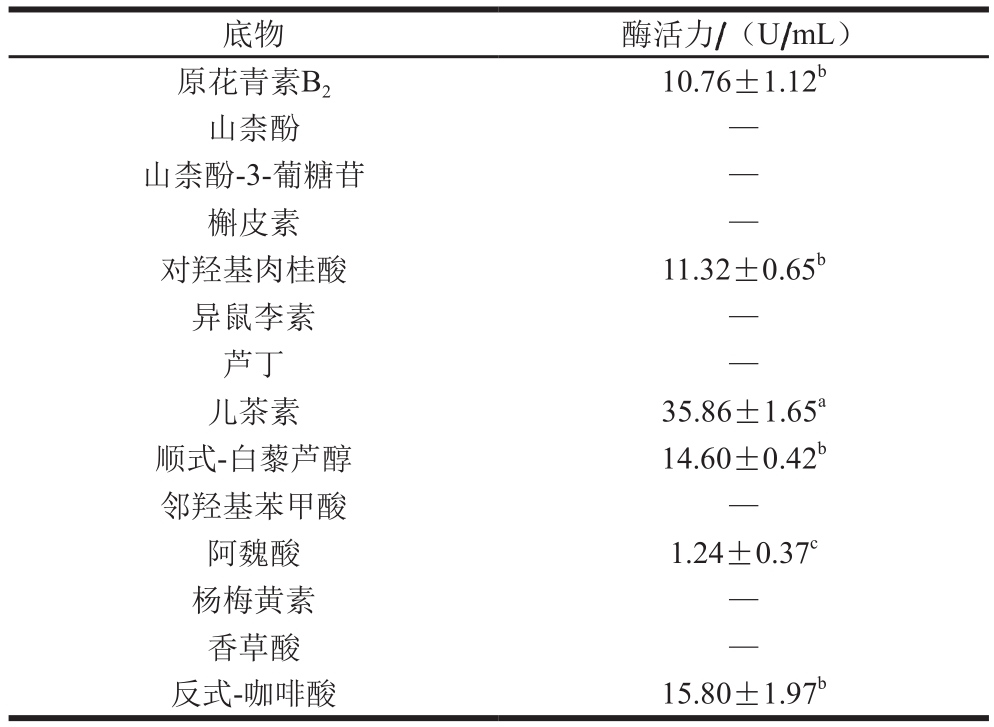
注:—.无反应活性。肩标小写字母不同表示差异显著(P<0.05)。
底物 酶活力/(U/mL)原花青素B2 10.76±1.12b山柰酚 —山柰酚-3-葡糖苷 —槲皮素 —对羟基肉桂酸 11.32±0.65b异鼠李素 —芦丁 —儿茶素 35.86±1.65a顺式-白藜芦醇 14.60±0.42b邻羟基苯甲酸 —阿魏酸 1.24±0.37c杨梅黄素 —香草酸 —反式-咖啡酸 15.80±1.97b
不同植物所含的酚类物质含量和种类各不同,参与褐变过程的主要酚类物质也不同[21]。由表3可知,多酚氧化酶催化儿茶素褐变的酶活力是35.86 U/mL,是催化阿魏酸褐变的酶活力(1.24 U/mL)的28.92 倍(P<0.05)。无核白葡萄多酚氧化酶对主要酚类物质催化褐变的酶活力大小依次为:儿茶素>反式-咖啡酸>顺式-白藜芦醇>对羟基肉桂酸>原花青素B2>阿魏酸,而无核白葡萄多酚氧化酶对山柰酚、山柰酚-3-葡糖苷、槲皮素、异鼠李素、芦丁、邻羟基苯甲酸、杨梅黄素和香草酸无反应活性。说明无核白葡萄酶促褐变的底物主要是儿茶素,其次是反式-咖啡酸和顺式-白藜芦醇。
2.4 总酚及部分酚类物质含量与褐变度间的相关性分析
表4 总酚及部分酚类物质含量与褐变度之间的相关性
Table 4 Correlation between total and individual phenolics contents and browning degree
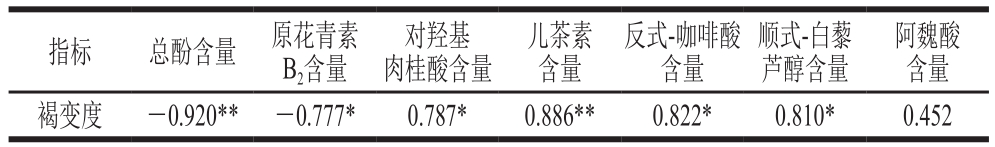
注:*.显著相关(P<0.05);**.极显著相关(P<0.01)。
阿魏酸含量褐变度 -0.920** -0.777* 0.787* 0.886** 0.822* 0.810* 0.452指标 总酚含量 原花青素B2含量对羟基肉桂酸含量儿茶素含量反式-咖啡酸含量顺式-白藜芦醇含量
由表4可知,无核白葡萄褐变度与总酚含量相关性最高,为-0.920;与阿魏酸含量相关性最小,为0.452。相关性由高到低为:总酚含量>儿茶素含量>反式-咖啡酸含量>顺式-白藜芦醇含量>对羟极肉桂酸含量>原花青素B2含量>阿魏酸含量。脱水干制过程中无核白葡萄褐变度与总酚含量呈极显著负相关,与儿茶素含量呈极显著正相关(P<0.01);与反式-咖啡酸和顺式-白藜芦醇含量呈显著正相关(P<0.05);与阿魏酸含量相关性不显著。无核白葡萄脱水干制过程中,总酚、原花青素B2含量与褐变度呈显著负相关(P<0.05),说明随着干制时间的延长和褐变度的提高,总酚和原花青素B2含量在逐渐减少,总酚和原花青素B2参与酶促褐变的发生。
3 讨 论
3.1 无核白葡萄酚类物质组成特征
酚类物质是葡萄中重要的次生代谢产物,与葡萄的抗病性、采后运输、贮存、保鲜及葡萄汁、葡萄酒的色泽、风味、褐变等密切相关[24]。前人测定了无核白营养系W1、W2、W3、W5、W6、W7、W8和长粒无核白、长穗无核白、大粒无核白10 种不同营养系的无核白葡萄的酚类物质组成,共检测出19 种酚类物质[17],本研究中检测出主要的14 种酚类物质。同一品种葡萄不同种及处理方式不同会导致其酚类物质组成、含量的差异。无核白葡萄果实中主要存在酚酸类、黄酮醇类、黄酮类、花色苷类物质。本研究检测到无核白葡萄中存在酚酸类5 种(反式-咖啡酸、阿魏酸、香草酸、邻羟基苯甲酸、对羟基肉桂酸)、黄酮类6 种(儿茶素、原花青素B2、槲皮素、杨梅黄素、芦丁、山柰酚)、黄酮糖苷类1 种(山柰酚-3-葡萄糖苷)、黄酮醇类1 种(异鼠李素)、芪类1 种(顺式-白藜芦醇)。验证了前人的结果,并进一步证明了原花青素B2、儿茶素、山柰酚在无核白葡萄中含量较多。
3.2 葡萄干制过程中酚类物质含量与褐变度的关系
褐变与酚类物质密切相关[25-27]。Singleton等的研究证明无核白葡萄在晒干过程中咖啡酸消失,但是如果葡萄在室温、遮光的条件下干燥,咖啡酸含量在最初一段时间内基本保持不变,然后突然消失,同时葡萄开始褐变[28]。María等[29]在研究葡萄晒干过程中酚类物质与褐变的关系时,认为干燥过程中对羟基肉桂酸酯和黄烷-3-醇衍生物发生氧化降解是导致葡萄褐变的重要原因。Karadeniz等[30]也发现葡萄干多酚类成分中黄酮醇化合物对酶促褐变的反应不如羟基肉桂酸化合物(肉桂酸、咖啡酸、p-香豆酸、阿魏酸等)敏感,但在干制过程中原花青素和黄烷-3-醇类基本降解完全。Hogan等[31]认为葡萄的褐变度与总酚、原花青素、儿茶素和根皮苷含量相关性较高。在本研究中,无核白葡萄主要酚类物质中有6 种与多酚氧化酶发生反应,即原花青素B2、对羟基肉桂酸、儿茶素、反式-咖啡酸、顺式-白藜芦醇、阿魏酸。在干制过程中的褐变度与总酚、原花青素B2、对羟基肉桂酸、儿茶素、反式-咖啡酸、顺式-白藜芦醇含量显著相关,这与前人的研究结果有相同之处也有不同之处:相同之处为本研究中咖啡酸参与了酶促褐变,但是并未消失,只是含量呈现降低的趋势,羟基肉桂酸化合物(咖啡酸、阿魏酸)对酶促褐变较为敏感,且总酚、原花青素B2、儿茶素含量与褐变度相关性高;不同之处为无核白葡萄在干制过程中原花青素B2和黄酮类(儿茶素)未降解完全,且含量很高,这可能是葡萄品种和处理方式不同所致。本研究中发现无核白葡萄干制过程中出现明显褐变现象时,这6 种酚类物质含量都突然增加随后减少,这与汪淼等[32]研究甘蔗茎尖在组织培养过程中褐变时酚类物质的变化情况相同。说明酚类物质在参与酶促褐变时会聚合产生较多的酚类单体,从而导致酶促褐变的发生。非酶促褐变是酚类物质等在非酶促条件下被氧化而发生的颜色加深的现象[33]。无核白葡萄在干制过程中只有原花青素B2、槲皮素、芦丁含量呈现显著下降趋势,而总酚含量减少了80%左右,说明酚类物质可能部分参与了非酶促褐变,导致总酚含量急剧减少以及无核白葡萄干颜色的加深;也有可能是因为脱水过程本身就是一种胁迫,为缓解脱水胁迫引起的膜脂过氧化、保护细胞膜免受或减少损伤导致总酚含量减少以起到保护作用[34],具体原因需进一步实验验证。
综上,本研究检测到无核白葡萄中主要的酚类物质有14 种,其中原花青素B2、对羟基肉桂酸、儿茶素、顺式-白藜芦醇、阿魏酸、反式-咖啡酸可作为酶促褐变的底物,除阿魏酸以外,其他5 种酚类物质含量在无核白葡萄干制过程中与褐变度呈现显著相关性,说明这几种酚类物质与无核白葡萄干制过程中的酶促褐变密切相关。另外,实验中检测到的杨梅黄素、香草酸因其本身颜色淡黄,且随着干制的进行含量增加,推测这两种酚类物质在无核白葡萄干制褐变中也起到了一定的作用。本研究结果可为阐释无核白葡萄干制过程中褐变机理以及提高无核白葡萄干品质提供理论依据。
参考文献:
[1] 唐莎莎. 无核白葡萄果实品质评价研究[D]. 乌鲁木齐: 新疆农业大学, 2013: 1-32.
[2] 林向东, 张琪, 李冀新, 等. 无核白葡萄多酚氧化酶特性研究[J]. 食品科学, 2000, 21(12): 43-45. DOI:10.3321/j.issn:1002-6630.2000.12.014.
[3] 董艳华. 无核白葡萄干燥过程特性及其变色机理研究[D]. 青岛: 中国海洋大学, 2015: 4-12.
[4] 刘峰娟, 孟阳, 白羽嘉, 等. 快速脱水抑制葡萄干制过程中膜脂过氧化及褐变[J]. 农业工程学报, 2014, 30(17): 285-294. DOI:10.3969/j.issn.1002-6819.2014.17.036.
[5] 朱文慧, 车凤斌, 郑素慧, 等. 不同贮藏温度对无核白葡萄干贮期颜色变化的影响[J]. 新疆农业科学, 2015, 52(12): 2208-2214.DOI:10.6048/j.issn.1001-4330.2015.12.008.
[6] MISHRA B B, GAUTAM S, SHARRMA A. Free phenolics and polyphenol oxidase (PPO): the factors affecting post-cut browning in eggplant (Solanum melongena)[J]. Food Chemistry, 2013,139(1/2/3/4): 105-114. DOI:10.1016/j.foodchem.2013.01.074.
[7] WU S. Glutathione suppresses the enzymatic and non-enzymatic browning in grape juice[J]. Food Chemistry, 2014, 160: 8-10.DOI:10.1016/j.foodchem.2014.03.088.
[8] ZHOU D, LI L, WU Y W, et al. Salicylic acid inhibits enzymatic browning of fresh-cut Chinese chestnut (Castanea mollissima) by competitively inhibiting polyphenol oxidase[J]. Food Chemistry, 2015,171: 19-25. DOI:10.1016/j.foodchem.2014.08.115.
[9] ANNA L, FEDERICA T, MARINO N. UV-A light treatment for controlling enzymatic browning of fresh-cut fruits[J]. Innovative Food Science and Emerging Technologies, 2016, 34: 141-147. DOI:10.1016/j.ifset.2015.12.029.
[10] 张百刚. 红枣多酚氧化酶(PPO)特性及抑制其酶促褐变的研究[D]. 西安: 陕西师范大学, 2006: 9-20.
[11] 林向东, 张琪, 李冀新, 等. 无核白葡萄荫干过程中褐变原因探析[J].食品科学, 1999, 20(6): 72-74. DOI:10.3321/j.issn:1002-6630.1999.06.025.
[12] 郑永菊. 绿葡萄干加工的关键技术研究[D]. 杨凌: 西北农林科技大学, 2012: 1-17.
[13] GIUFFRÈ A M. HPLC-DAD detection of changes in phenol content of red berry skins during grape ripening[J]. European Food Research and Technology, 2013, 237(4): 555-564. DOI:10.1007/s00217-013-2033-7.
[14] PENA-NEIRA A, DUENAS M, DUARTE A, et al. Effects of ripening stages and of plant vegetative vigor on the phenolic composition of grapes (Vitis vinifera L.) cv. Cabernet Sauvignon in the Maipo Valley(Chile)[J]. Vitis-Journal of Grapevine Research, 2004, 43(2): 51-58.DOI:10.1017/S0269915X02002021.
[15] MENG J F, FANG Y L, QIN M Y, et al. Varietal differences among the phenolic profiles and antioxidant properties of four cultivars of spine grape (Vitis davidii Foex) in Chongyi County (China)[J]. Food Chemistry, 2012, 134(4): 2049-2056.
[16] 杨成涛, 孙丽平, 孙云, 等. 云南省4 个主产区无核白鸡心葡萄果皮组成成分及抗氧化能力分析[J]. 食品科学, 2015, 36(22): 85-89.DOI:10.7506/spkx1002-6630-201522015.
[17] 张宗勤. 欧洲葡葡‘无核白’10 个营养系的性状研究[D]. 杨凌: 西北农林科技大学, 2011: 1-26.
[18] 刘峰娟, 冯作山, 孟阳, 等. 脱水速度对‘无核白’葡萄果皮褐变和细胞超微结构的影响[J]. 食品科学, 2016, 37(6): 220-225.DOI:10.7506/spkx1002-6630-201606040.
[19] LEE C Y, JAWORSKI A W. Phenolics and browning potential of white grapes grown in New York[J]. American Journal of Enology &Viticulture, 1988, 39(4): 337-340.
[20] JAVANMARDI J, STUSHNOFF C, LOCKE E, et al. Antioxidant activity and total phenolic content of Iranian Ocimum accessions[J].Food Chemistry, 2003, 83(4): 547-550. DOI:10.1016/S0308-8146(03)00151-1.
[21] KOLNIAK-OSTEK J, OSZMIANSKI J. Characterization of phenolic compounds in different anatomical pear (Pyruscommunis L.) parts by ultra-performance liquid chromatography photodiode detectorquadrupole/time of flight-mass spectrometry (UPLC-PDA-Q/TOFMS)[J]. International Journal of Mass Spectrometry, 2015, 392: 154-163. DOI:10.1016/ j.ijms. 2015.10.004.
[22] 周燕燕. 金银花多酚氧化酶提取纯化、酶学性质及抑制效应研究[D].洛阳: 河南科技大学, 2014: 9-38.
[23] 张利娟, 师俊玲. 无核白葡萄热风干燥过程中总酚与抗氧化活性的变化[J]. 食品科学, 2013, 34(5): 55-59. DOI:10.7506/spkx1002-6630-201305012.
[24] LIANG Z C, WU B H, FAN P G, et al. Anthocyanin composition and content in grape berry skin in Vitis, germplasm[J]. Food Chemistry,2008, 111(4): 837-844. DOI:10.1016/j.foodchem.2008.04.069.
[25] 邹丽红, 张玉星. 砂梨果肉褐变与酚类物质及相关酶活性的相关分析[J]. 果树学报, 2012, 29(6): 1022-1026. DOI:10.13925/j.cnki.gsxb.2012.06.017.
[26] 谢乐芳, 王力, 李健, 等. 果蔬褐变度的研究进展[J]. 内蒙古农业大学学报(自然科学版), 2017, 32(1): 24-27. DOI:10.14045/j.cnki.15-1220.2017.01.006.
[27] SUKHONTHARA S, KAEWKA K, THEERAKULKAIT C. Inhibitory effect of rice bran extracts and its phenolic compounds on polyphenol oxidase activity and browning in potato and apple puree[J]. Food Chemistry, 2016, 190: 922-928. DOI:10.1016/j.foodchem.2015.06.016.
[28] SINGLETON V L, TROUSDALE E, ZAYA J. One reason sundried raisins brown so much[J]. American Journal of Enology and Viticulture, 1985, 36(2): 111-113.
[29] MARÍA P S, AZAHARA L, JULIETA M, et al. Changes in color and phenolic compounds during the raisining of grape cv. Pedro Ximenez[J]. Journal of Agriculture and Food Chemistry, 2008, 56(8):2810-2816. DOI:10.1021/jf073278k.
[30] KARADENIZ F, DURST R W, WROLSTAD R E. Polyphenolic composition of raisins[J]. Journal of Agricultural and Food Chemistry,2000, 48(11): 5343-5350. DOI:10.1021/jf071468p.
[31] HOGAN S, ZHANG L, LI J R, et al. Antioxidant properties and bioactive components of Norton (Vitis aestivalis) and Cabernet Franc(Vitis vinifera) wine grapes[J]. LWT-Food Science and Technology,2009, 42(7): 1269-1274. DOI:10.1016/j.lwt.2009.02.006.
[32] 汪淼, 唐云仙, 杨柳, 等. 甘蔗茎尖组织培养过程酚类物质变化及其与褐变的关系[J]. 南方农业学报, 2016, 47(5): 622-626.DOI:10.3969/j:issn.2095-1191.2016.05.622.
[33] 张文娜. 枇杷果实酚类物质组分分析及其生物活性评价[D]. 杭州:浙江大学, 2015: 1-7.
[34] 蒲飞. 柿果实酚类物质含量、生物活性及其相关酶的研究[D].杨凌: 西北农林科技大学, 2014: 3-9.
Relationship between Changes of Phenolic Substances and Browning during Drying of Thompson Seedless Grapes
LI Xiaoli1,2,3,4, CHEN Jiluan4, FAN Yingying1,2,3, HE Weizhong1,2,3, WANG Zhi1,2,3, LIU Fengjuan1,2,3,*
(1. Institute of Quality Standards and Testing Technology for Agro-products, Xinjiang Academy of Agricultural Sciences,Ürümqi 830091, China; 2. Laboratory of Quality and Safety Risk Assessment for Agro-products (Ürümqi), Ministry of Agriculture,Ürümqi 830091, China; 3. Key Laboratory of Agro-products Quality and Safety of Xinjiang, Ürümqi 830091, China;4. Food College, Shihezi University, Shihezi 832000, China)
Abstract: The objective of this study was to investigate the changes of phenols and their relationship with browning during shade drying of Thompson seedless grapes. We determined total phenolic content, phenolic composition and browning degree, and identifyied substrates for enzymatic browning. The results showed that total phenolic content in Thompson seedless grapes decreased during the drying process and that browning degree increased progressively. Totally 14 phenolic compounds were detected in Thompson seedless grapes, six of which such as proanthocyanidin B2, p-hydroxycinnamic acid,catechin, trans-caffeic acid, cis-resveratrol and ferulic acid were substrates for enzymatic browning. The most important substrate was catechin. The browning degree of Thompson seedless grapes was significantly correlated with the contents of total phenols, procyanidin B2, p-hydroxycinnamic acid, catechin, trans-caffeic acid and cis-resveratrol (P < 0.05, P < 0.01).The results of thisse studyies provide a theoretical basis for improving the quality of seedless raisins.
Keywords: drying; Thompson seedless grapes; phenolic substrates; browning
收稿日期:2018-03-15
基金项目:国家自然科学基金地区科学基金项目(31660466);国家果品质量安全风险评估重大专项(GJFP2018003);新疆维吾尔自治区“百名青年博士引进计划”项目;新疆农业科学院青年基金项目(xjnkq-2016015)
第一作者简介:李晓丽(1991—)(ORCID: 0000-0002-1772-9581),女,硕士研究生,研究方向为农产品质量安全。E-mail: lixiaolit@163.com
*通信作者简介:刘峰娟(1985—)(ORCID: 0000-0001-9814-1693),女,副研究员,博士,研究方向为农产品加工及质量安全。E-mail: liufengjuan2050@126.com
DOI:10.7506/spkx1002-6630-20180315-198
中图分类号:S663.1;TS225
文献标志码:A
文章编号:1002-6630(2019)07-0027-06
引文格式:李晓丽, 陈计峦, 范盈盈, 等. 无核白葡萄干制过程中酚类物质的变化及其与褐变的关系[J]. 食品科学, 2019, 40(7):27-32. DOI:10.7506/spkx1002-6630-20180315-198. http://www.spkx.net.cn
LI Xiaoli, CHEN Jiluan, FAN Yingying, et al. Relationship between changes of phenolic substances and browning during drying of Thompson seedless grapes[J]. Food Science, 2019, 40(7): 27-32. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180315-198. http://www.spkx.net.cn