鳝鱼(Monopterus albus)是一种蛋白质含量高、脂肪含量低的典型经济鱼类,广受消费者喜爱[1]。鳝鱼除营养丰富外,还具有较高的药用价值,是整个亚洲最具经济价值的淡水养殖鱼之一[2]。据报道,近年来我国市场每年对鳝鱼的需求量达300万 t[3],很多餐饮企业直接买入鳝鱼肉冷藏待加工,很多超市都在流通售卖冷藏调制鳝鱼肉制品。但鱼肉在宰杀后以及冷藏过程中,由于微生物、内源性酶、蛋白质降解和变性等作用,其品质和食用价值均会降低[4-5]。因此,研究不同新鲜度鳝鱼肉品质变化规律具有重要意义。
鱼肉在贮藏过程中会发生劣变,进而影响其熟化后的品质,而鱼肉熟化后的质构品质是加热过程中蛋白经过一系列变化而形成的。Dima[6]、Verhaeghe[7]等研究证明,鱼肉在加热过程中蛋白质的变性聚集是蒸煮损失和品质形成的主要原因。曹雷鹏等[8]研究发现草鱼在热加工过程中,其肉色逐渐变白,蒸煮损失率、收缩面积比和色差ΔE值均随贮藏时间的延长而缓慢下降。缪函霖等[9]研究表明,蛋白质的分解主要是由于鱼肉中内源性酶和微生物的作用,鱼肉蛋白结构更易改变,使得冷藏时间越长的鱼肉其蛋白在加热过程中收缩得越强烈,进而造成蒸煮后鱼肉的水分含量、硬度、内聚性和咀嚼性都呈现显著下降趋势,失水率和质量损失率呈显著上升趋势,从而证实了加热前金枪鱼肉的蛋白存在状态(即鱼肉新鲜度)会在一定程度上影响熟化后鱼肉品质。因此,鱼肉熟化后的品质实际上同其加热前鱼肉蛋白的存在状态有关,即与鱼肉的新鲜度相关。
前期研究表明,鳝鱼肉冷藏货架期为4 d,随贮藏时间延长,鳝鱼肉蛋白间主要内部作用力被破坏,蛋白结构逐渐松散,蛋白质开始降解,导致鳝鱼肉品质逐渐劣变;不同新鲜度鳝鱼肉熟化后其持水性降低,弹性、咀嚼性和回复性呈不同变化趋势,主要是由于鳝鱼肉熟化后蛋白价键发生变化,蛋白无序化程度增加,蛋白空间结构改变,进而造成不同贮藏时间的熟化鳝鱼肉品质劣变[10-11]。由此可见,不同新鲜度鳝鱼肉中蛋白结构的差异性导致了熟化后鳝鱼肉品质差异的产生。因此,有必要对不同新鲜度鳝鱼肉加热过程中品质产生差异的原因进行系统研究,以明确鳝鱼肉品质变化和蛋白结构变化在贮藏期间与熟化后之间的关系。
本研究主要通过测定货架期内不同新鲜度鳝鱼肉加热过程的品质和蛋白结构变化,分析不同新鲜度鳝鱼肉加热过程中品质形成差异的原因,为明确货架期内不同新鲜度鳝鱼肉熟化后品质劣变机制及相关制品研发提供理论依据。
鳝鱼购自北碚区天生菜市场,体长30 cm左右,质量60~70 g。
盐酸、氯化钠、氢氧化钠、硫酸铜、无水乙醇、尿素成都市科龙化工试剂厂;过硫酸铵、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三羟甲基氨基甲烷(Tris)、β-巯基乙醇、四甲基乙二胺、考马斯亮蓝R-250 美国Bio Basic公司;三氯乙酸(trichloroacetic acid,TCA) 天津市鑫源化工有限公司;质量分数30%的丙烯酰胺工作液 北京索莱宝科技有限公司;标准蛋白(分子质量10~200 kDa) 美国赛默飞世尔科技公司。其中Tris、考马斯亮蓝R-250、质量分数30%丙烯酰胺工作液为优级纯,其他试剂均为分析纯。
JA3003B电子天平 上海精天电子仪器有限公司;QL901漩涡混合器 海门市其林贝尔仪器制造有限公司;UV-2450紫外分光光度计 日本岛津公司;8002型温控水浴锅 北京永光明医疗仪器厂;DGG-9140A电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;Power PacTM基础电泳仪 美国Bio-Rad公司;G:BOX EF型凝胶成像系统 英国Syngene公司;5810型台式高速离心机 德国Eppendorf公司;DXR激光共聚焦显微拉曼光谱仪 美国赛默飞世尔科技公司。
1.3.1 鱼肉处理
参照郑红等[11]的方法处理新鲜鳝鱼。分别取4 ℃条件下贮藏第1、2、3、4、5天的鳝鱼肉样品(挥发性盐基氮含量分别为10.47、11.52、12.13、14.08、16.49 mg/100 g[10]),并分别在100 ℃条件下加热0.5、1.0、1.5、2.0、4.0 min,自然冷却后进行指标测定。
1.3.2 蒸煮失水率的测定
将加热(100 ℃、5 min)前后的鳝鱼肉分别绞碎,蒸煮失水率的测定参照郑红等[11]的方法进行,按下式进行计算。
1.3.3 化学作用力的测定
参照郑红等[11]的方法测定化学作用力。以蛋白相对含量表示。
1.3.4 TCA-可溶性氮含量的测定
样品处理参考Benjakul等[12]的方法并稍有改动。取鳝鱼肉3.0 g,加入27 mL 5% TCA溶液,均质2 min后冰浴1 h,5 000×g、4 ℃条件下离心5 min并取上清液。通过Lowry法[13]测定TCA-可溶性氮含量,以每克鱼肉中酪氨酸的物质的量表示TCA-可溶性氮含量。
1.3.5 电泳分析
电泳胶的制备参照杨晖等[14]的方法进行,制备质量分数10%分离胶、质量分数5%浓缩胶,按郑红等[11]的方法对样品进行前处理并电泳。用凝胶成像系统拍摄电泳图,再通过Gene Tools分析结果。
1.3.6 拉曼光谱分析
拉曼光谱测量条件与测定步骤参照郑红等[11]的方法。
采用Microsoft Excel 2016软件对数据进行处理分析,采用SPSS 19.0软件的Duncan检验进行多重比较,并用Origin 9.0软件作图。所有实验均重复3 次,数据以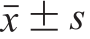 表示。
表示。
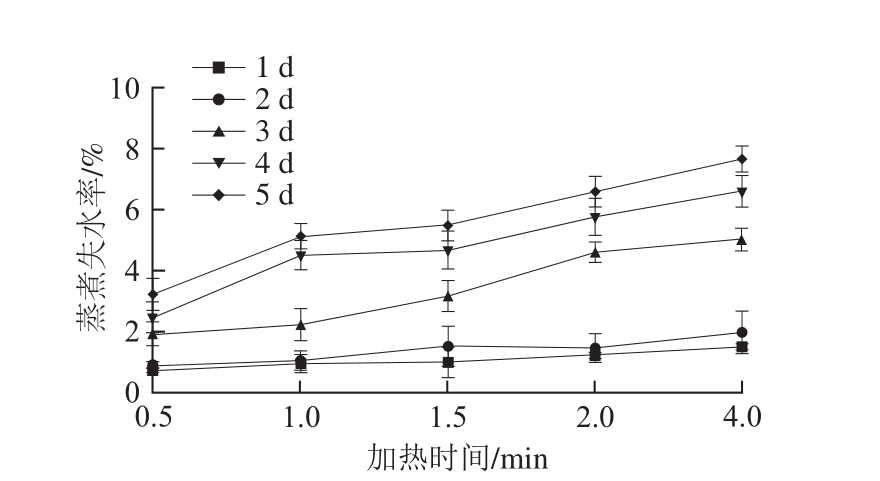
图1 冷藏时间和加热时间对鳝鱼肉蒸煮失水率的影响
Fig. 1 Effect of refrigeration time and heating time on moisture loss of Monopterus albus
由图1可知,鳝鱼肉蒸煮失水率随加热时间延长而增加。贮藏时间越长的鳝鱼肉,加热过程中失水越严重。随着贮藏时间的延长,鳝鱼肉部分蛋白会发生降解,使鳝鱼肉自身持水性变差[10],从而导致加热过程中鳝鱼肉蒸煮失水率增加;此外,随着贮藏时间的延长,鳝鱼肉蛋白结构展开[15],也会导致加热过程中蛋白收缩更加强烈进而造成失水更加严重。Cao Leipeng[16]、Shi Ce[17]等研究表明,随贮藏时间和加热时间的延长,鱼肉蒸煮失水率呈上升趋势,与本实验结果一致。
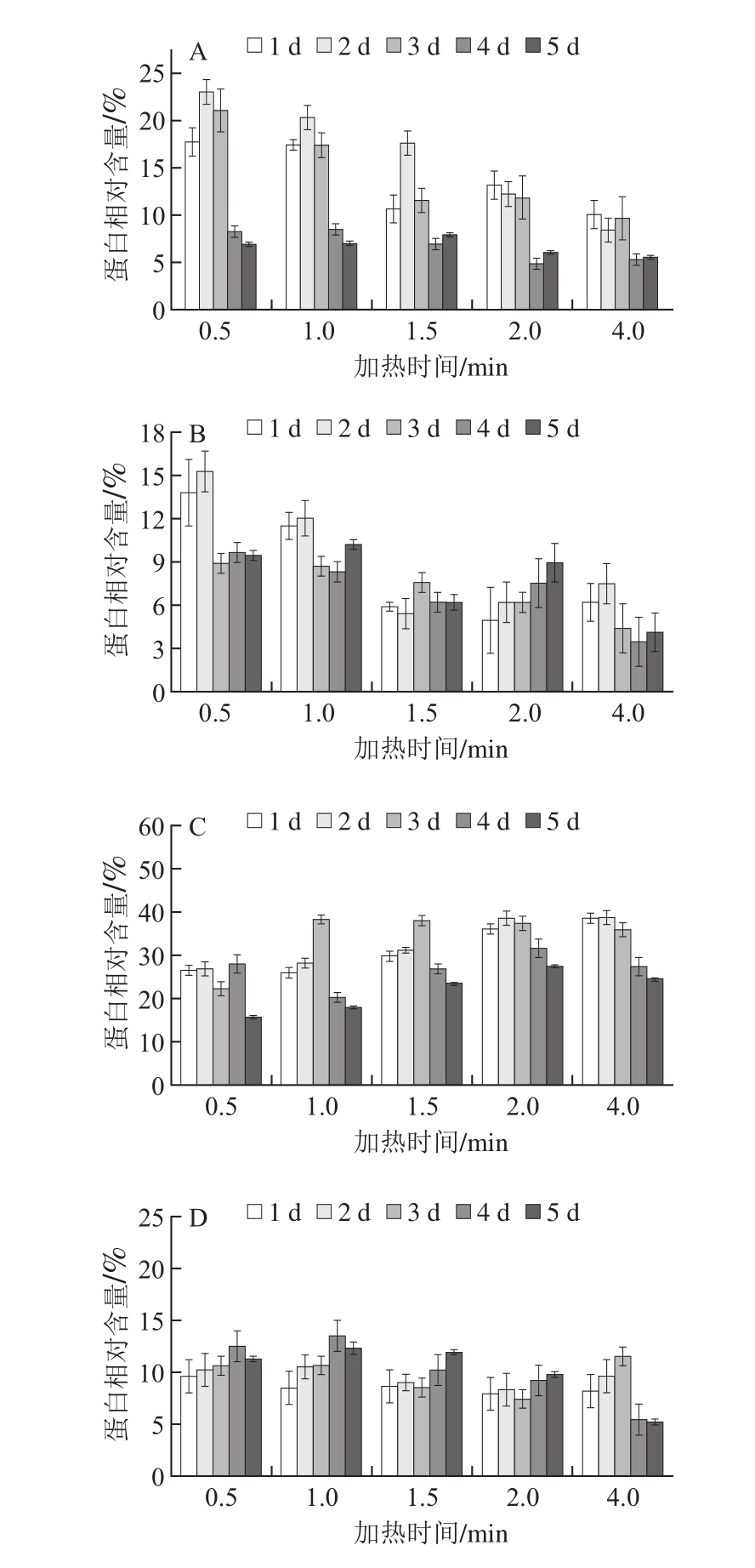
图2 不同冷藏时间鳝鱼肉加热过程中化学作用力的变化
Fig. 2 Changes in chemical forces of Monopterus albus proteins as affected by storage time and cooking time
A~D.分别表示离子键、氢键、疏水相互作用和二硫键含量。
新鲜鳝鱼蛋白空间结构的主要作用力为离子键和氢键,其含量在贮藏过程中随时间的延长逐渐降低,疏水相互作用和二硫键含量逐渐增加[10]。由图2A、B可知,离子键和氢键随加热的进行而逐渐被破坏,熟化鳝鱼肉中蛋白间相互作用以疏水相互作用为主。由图2C可知,随着加热时间的延长,新鲜的鳝鱼肉(贮藏1~2 d)疏水相互作用含量逐渐增加,但贮藏时间较长的鳝鱼肉中疏水相互作用含量则呈现先上升后下降的趋势。这可能是因为新鲜鳝鱼肉中蛋白展开程度低,加热过程中蛋白逐渐展开,疏水基团充分暴露,疏水相互作用含量逐渐增加[18-20];而贮藏时间较长的鳝鱼肉中蛋白展开程度较高,加热过程前期,蛋白肽链已经充分展开,疏水作用达到最大值,后期在热力作用下部分疏水作用被破坏,导致疏水作用下降[21]。疏水作用的降低说明蛋白间相互作用力下降,这可能会导致鱼肉质构特性下降[11,22-24]。
由图2D可知,新鲜的鳝鱼肉(贮藏1~3 d),在加热初始,二硫键含量上升,随着加热的继续进行变化不大,而贮藏时间较长(4~5 d)的鳝鱼肉在加热后期二硫键含量降低,这可能是因为蛋白充分展开后二硫键被热力破坏。本课题组前期研究[11]发现,二硫键含量同熟化鳝鱼肉的口感高度相关,因此,贮藏时间过长的鳝鱼肉可能会在加热过程中因二硫键被破坏而口感下降。对于贮藏时间较长的鳝鱼肉,在保证微生物安全的前提下,适当地缩短加热时间可以改善鳝鱼肉的口感。
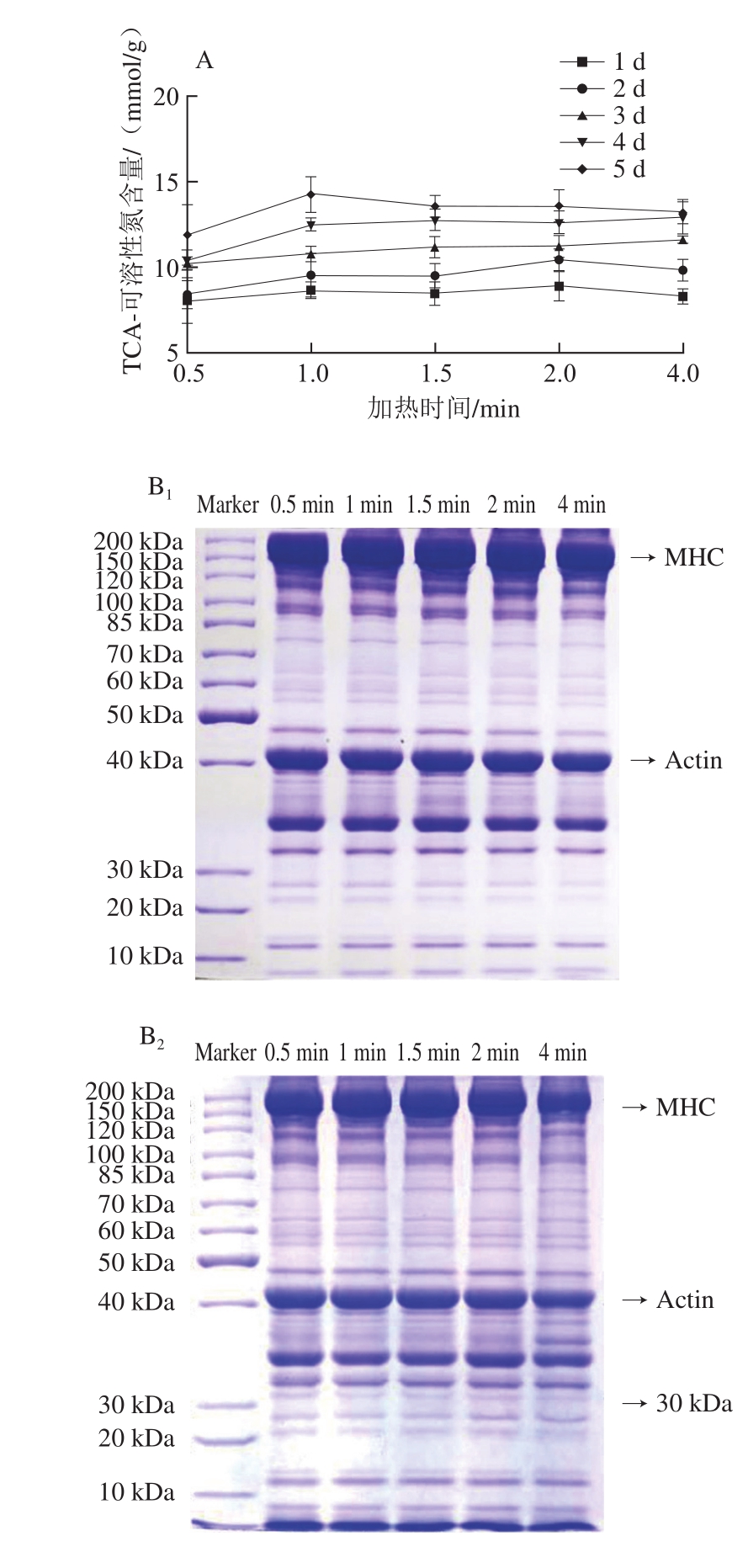
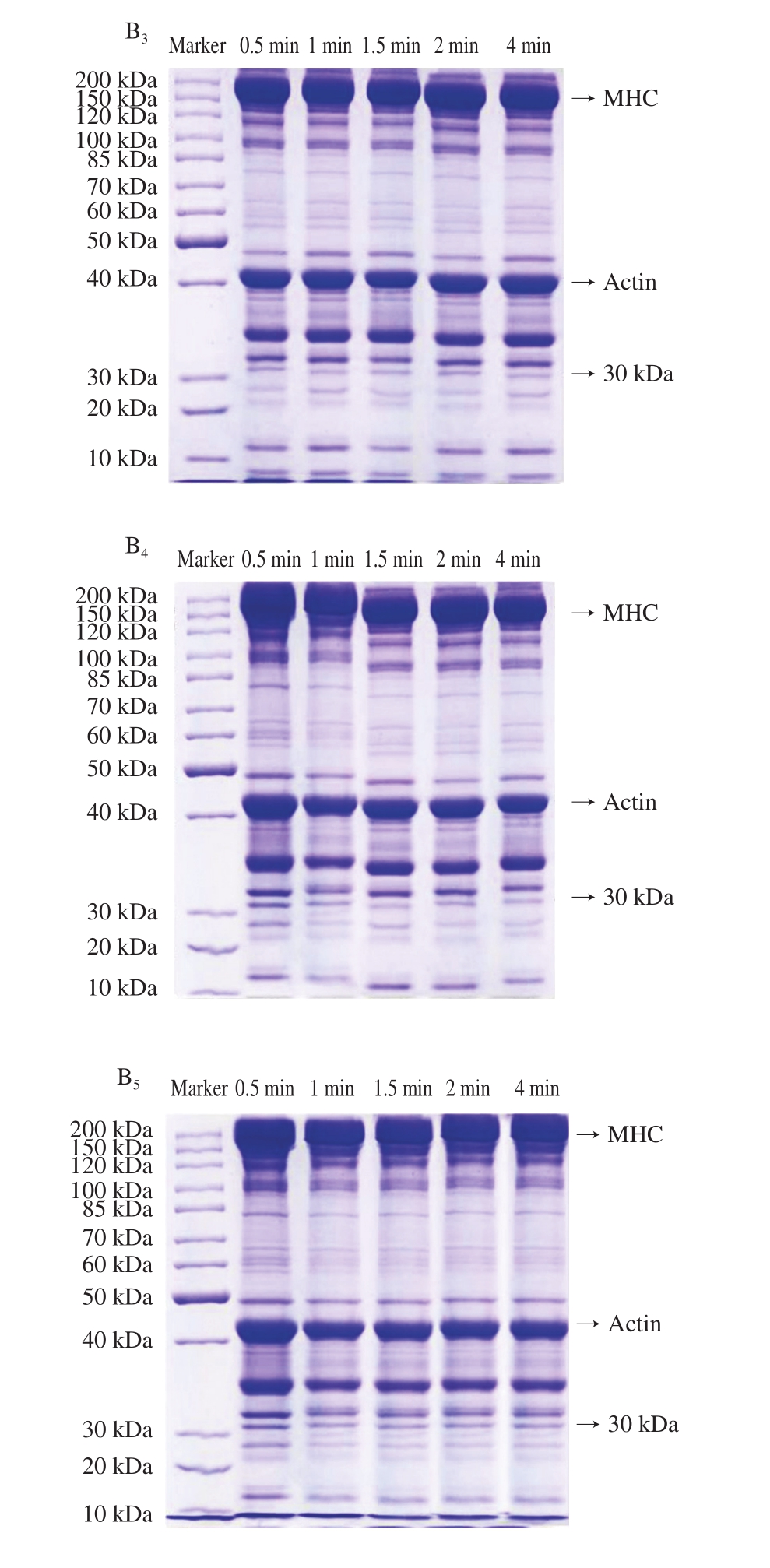
图3 不同冷藏时间鳝鱼肉加热过程中TCA-可溶性氮含量(A)和全蛋白的SDS-聚丙烯酰胺凝胶电泳图(B)的变化
Fig. 3 Change in TCA-soluble nitrogen (A) and sodium dodecyl sulfate-polyacrylamide gel electrophoresis analysis of total protein (B) of Monopterus albus as affected by storage time and cooking time
MHC.肌球蛋白重链;Actin.肌动蛋白;下标1~5.分别表示冷藏1~5 d。
由图3A可知,不同新鲜度鳝鱼肉TCA-可溶性氮含量在加热过程中变化不大,说明加热过程并未明显造成鳝鱼肉中蛋白质的降解。贮藏时间越长的生鳝鱼肉,TCA-可溶性氮含量越高,说明蛋白降解越严重,且这一现象并未随着加热的进行而改变。
由图3B可知,加热过程中,鳝鱼肉蛋白图谱没有明显的蛋白条带加深或变淡,进一步说明加热没有造成蛋白明显降解。贮藏2~5 d的样品中,观察到一条分子质量约30 kDa的蛋白条带,且随着贮藏时间延长,其蛋白条带颜色加深,结合TCA-可溶性氮含量结果,说明该组分可能是贮藏过程中的蛋白降解产物。
2.4.1 蛋白质微环境的变化
如图4所示,拉曼光谱中760 cm-1谱峰是关于色氨酸环的伸缩振动,当包埋在疏水微环境中的色氨酸残基暴露在极性环境时,760 cm-1处峰强度下降[25]。而被称为费米共振双峰的850 cm-1和830 cm-1谱峰与酪氨酸残基对位取代苯振动有关,采用I850/I830以表征酪氨酸残基的暴露与包埋情况,当I850/I830的比值为0.9~2.5时表明酪氨酸残基暴露[26]。由表1可知,在加热过程中,I760从加热1 min开始下降(P<0.05),I850/I830的比值随加热的进行呈现增加的趋势(P<0.05),说明加热会促进色氨酸、酪氨酸残基暴露[27-28]。加热初期的鳝鱼肉,随着贮藏时间的延长,I760和I850/I830的比值无显著变化(P>0.05);而加热后期,随着贮藏时间的延长,I760显著增加(P<0.05),I850/I830的比值呈先增加后下降的趋势(P<0.05),说明随着鱼肉新鲜度降低,加热时间过长则会导致暴露的色氨酸、酪氨酸残基重新被包埋。结合前期实验中化学作用力的变化,说明随着蛋白链之间化学相互作用力降低,蛋白构象更容易改变;同时,鳝鱼肉新鲜度越低,其降解程度越高。因此,贮藏时间较长的鳝鱼肉在加热后期肽链的改变向亲水基团暴露、疏水基团被包埋的趋势发展,这与疏水作用的降低趋势一致。
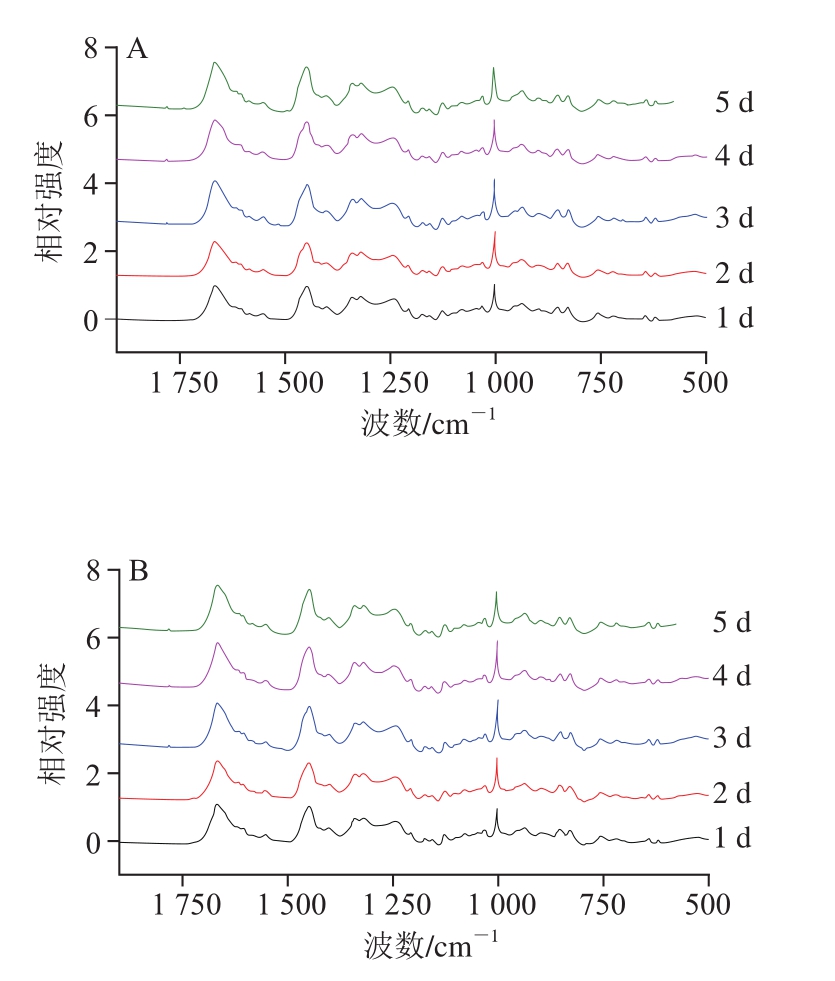
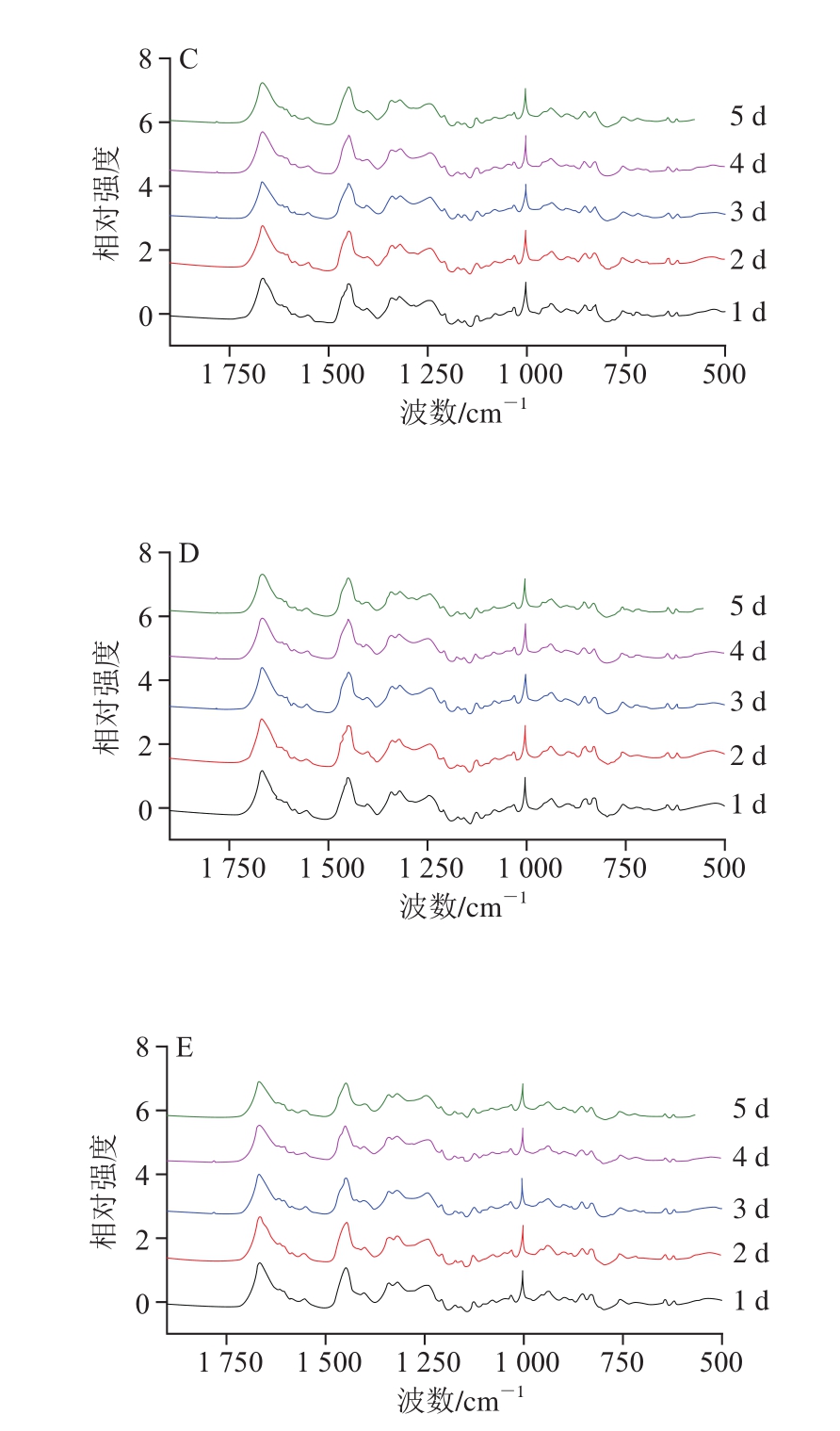
图4 不同冷藏时间鳝鱼肉加热过程中的拉曼光谱(500~2 000 cm-1)
Fig. 4 Raman spectra in 500-2 000 cm-1 region ofMonopterus albus proteins as affected by storage time and cooking time
A~E.分别表示加热0.5、1.0、1.5、2.0、4.0 min。图5同。
表1 不同冷藏时间鳝鱼熟化过程中I760和I850/I830比值归一化强度的变化
Table 1 Changes in normalizedI760 andI850/I830 ratio in Raman spectroscopic analysis ofMonopterus albus proteins as affected by storage time and cooking time
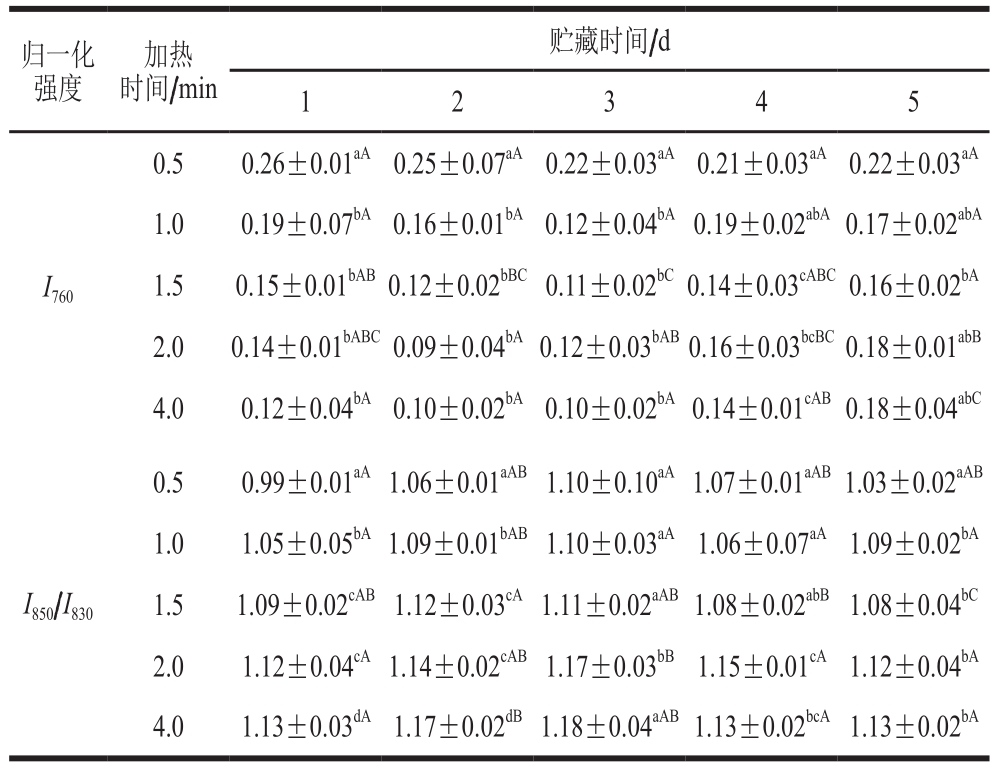
注:对于同一指标,同列肩标小写字母不同表示差异显著(P<0.05);同行肩标大写字母不同表示差异显著(P<0.05)。
归一化强度加热时间/min贮藏时间/d 1 2 3 4 5 I760 0.5 0.26±0.01aA 0.25±0.07aA 0.22±0.03aA 0.21±0.03aA 0.22±0.03aA 1.0 0.19±0.07bA0.16±0.01bA0.12±0.04bA0.19±0.02abA0.17±0.02abA 1.5 0.15±0.01bAB0.12±0.02bBC0.11±0.02bC0.14±0.03cABC0.16±0.02bA 2.0 0.14±0.01bABC0.09±0.04bA0.12±0.03bAB0.16±0.03bcBC0.18±0.01abB 4.0 0.12±0.04bA0.10±0.02bA0.10±0.02bA0.14±0.01cAB0.18±0.04abC 0.5 0.99±0.01aA1.06±0.01aAB1.10±0.10aA1.07±0.01aAB1.03±0.02aAB 1.0 1.05±0.05bA1.09±0.01bAB1.10±0.03aA 1.06±0.07aA 1.09±0.02bA 1.5 1.09±0.02cAB1.12±0.03cA1.11±0.02aAB1.08±0.02abB1.08±0.04bC 2.0 1.12±0.04cA1.14±0.02cAB1.17±0.03bB1.15±0.01cA 1.12±0.04bA 4.0 1.13±0.03dA1.17±0.02dB1.18±0.04aAB1.13±0.02bcA1.13±0.02bA I850/I830
2.4.2 蛋白质二级结构的变化
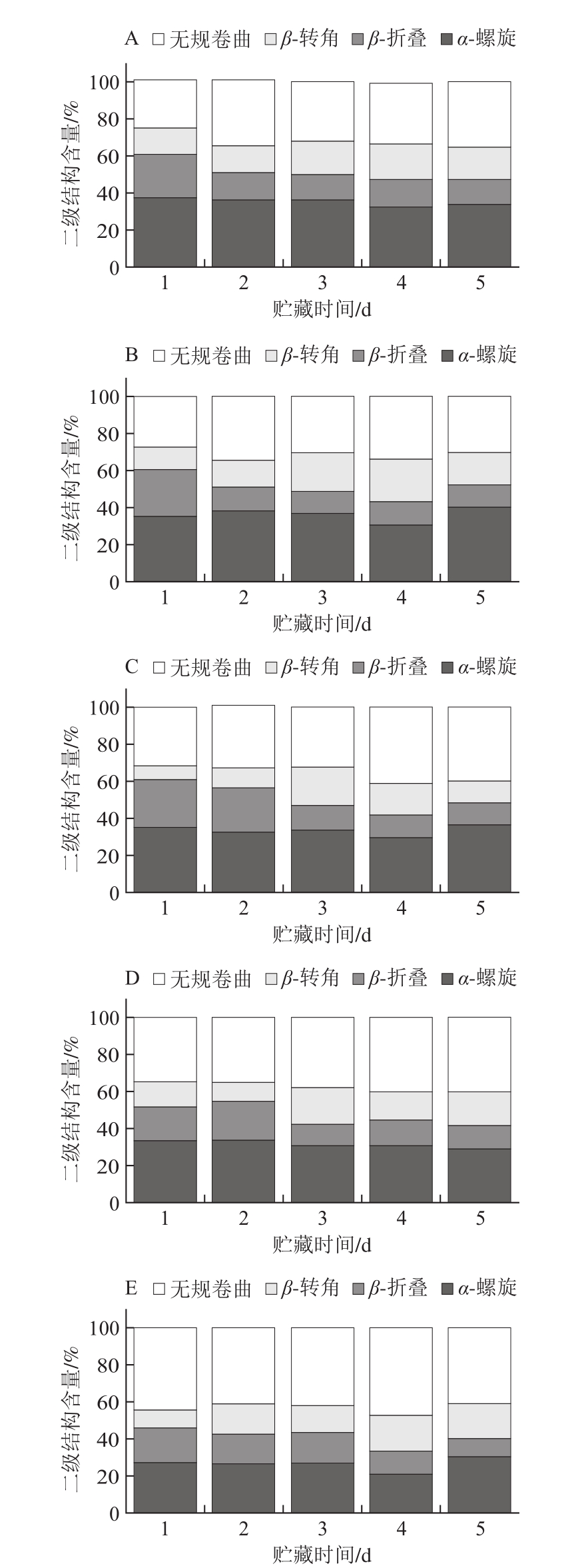
图5 不同冷藏时间鳝鱼加热过程中蛋白二级结构含量
Fig. 5 Changes in contents of secondary structures in Monopterus albus protein as affected by storage time and cooking time
酰胺I带(1 640~1 680 cm-1)主要源于肽键C=O的面内伸缩振动及N—H的面内弯曲振动,常常被用来估算蛋白质的二级结构信息[29]。酰胺I带拉曼光谱峰的结构主要由1 645~1 660 cm-1(α-螺旋)、1 660~1 665 cm-1(无规卷曲)、1 665~1 680 cm-1(β-折叠)和1 680 cm-1附近(β-转角)等重叠的谱带构成[30]。各二级结构含量变化情况通过对酰胺I带的计算结果进行去卷积和高斯拟合得到。由图5可知,贮藏1~5 d内,随着加热时间的延长,肽链逐渐解旋,无规卷曲含量增加,蛋白结构逐渐向无序化转变。贮藏时间越长的鳝鱼肉,加热过程中蛋白展开程度越大,这可能是因为生鲜鳝鱼肉中蛋白展开程度较高,加热过程中鱼肉蛋白逐渐展开,蛋白结构紧密程度和构象稳定性明显降低,蛋白无序化程度增加,从而导致α-螺旋和β-折叠逐渐转化为β-转角和无规卷曲[31-32]。加热5 min时,贮藏5 d的鳝鱼肉α-螺旋含量高于贮藏4 d,说明贮藏5 d的鳝鱼肉在加热后期蛋白结构倾向于有序化,这可能是其加热后期部分肽链形成了一定的空间结构。
鳝鱼肉蒸煮失水率随加热时间延长而增加。贮藏时间越长的鳝鱼肉,加热过程中失水越严重;鳝鱼肉中离子键和氢键随加热时间延长而逐渐被破坏;新鲜鳝鱼肉(1~2 d)在加热过程中,疏水相互作用含量逐渐增加,二硫键含量在加热初期增加,后期则变化不大;贮藏时间较长的鳝鱼肉(3~5 d),在加热过程中疏水相互作用含量则总体呈现先上升后下降的趋势,二硫键含量在加热前期变化不大,加热后期则降低;不同新鲜度的鳝鱼肉在加热过程中蛋白均未发生明显降解,熟化鳝鱼肉中蛋白降解程度的差异主要由贮藏过程中蛋白降解造成;新鲜度越低的鳝鱼肉,加热过程中蛋白二级结构展开程度越高,且在加热后期随着鳝鱼肉新鲜度降低,更多暴露的色氨酸、酪氨酸残基重新被包埋,导致了疏水作用降低。
[1] LIANG H W, GUO S S, LI Z, et al. Assessment of genetic diversity and population structure of swamp eel Monopterus albus in China[J].Biochemical Systematics and Ecology, 2016, 68: 81-87. DOI:10.1016/j.bse.2016.06.006.
[2] GAO W H, FANG L, YANG D Q, et al. Cloning and expression of Asian swamp eel (Monopterus albus) cxcr4 paralogues, and their modulation by pathogen infection[J]. Aquaculture, 2016, 457: 50-60.DOI:10.1016/j.aquaculture.2016.02.021.
[3] SUN L D, TU J G, YI L Z, et al. Pathogenicity of snakehead vesiculovirus in rice field eels (Monopterus albus)[J].Microbial Pathogenesis, 2017, 110: 578-585. DOI:10.1016/j.micpath.2017.07.042.
[4] TSIGHE N, WAWIRE M, BEREKET A, et al. Physicochemical and microbiological characteristics of fresh Indian mackerel, spotted sardine and yellowtail scad, from Eritrea Red Sea waters[J]. Journal of Food Composition and Analysis, 2018, 70: 98-104.
[5] 李学鹏, 李聪, 王金厢, 等. 中国对虾冷藏过程中肌肉蛋白质的降解规律[J]. 中国食品学报, 2015, 15(6): 59-68. DOI:10.16429/j.1009-7848.2015.06.008.
[6] DIMA J B, BARON P J, ZARITZKY N E. Mathematical modeling of the heat transfer process and protein denaturation during the thermal treatment of Patagonian marine crabs[J]. Journal of Food Engineering,2012, 113(4): 623-634. DOI:10.1016/j.jfoodeng.2012.07.007.
[7] VERHAEGHE T, VLAEMYNCK G, DE BLOCK J, et al. Kinetics of heat induced muscle protein denaturation of brown shrimp(Crangon crangon)[J]. Journal of Food Engineering, 2016, 191: 88-94.DOI:10.1016/j.jfoodeng.2016.07.010.
[8] 曹雷鹏, 牛丽红, 孙晓华, 等. 草鱼冰藏期间新鲜度及热加工性质的变化[J]. 食品科学, 2016, 37(12): 267-272. DOI:10.7506/spkx1002-6630-201612048.
[9] 缪函霖, 蒋璐, 王锡昌, 等. 不同新鲜度金枪鱼肉蒸煮品质的研究[J]. 食品工业科技, 2014, 35(13): 80-84; 295. DOI:10.13386/j.issn1002-0306.2014.13.008.
[10] 郑红, 苏现波, 马良, 等. 货架期冷藏过程中鳝鱼肉理化指标及蛋白质变化规律[J]. 食品科学, 2018, 39(7): 215-220. DOI:10.7506/spkx1002-6630-201807032.
[11] 郑红, 苏现波, 马良, 等. 不同冷藏时间的鳝鱼肉经熟化后质构特性变化及其机理[J]. 食品科学, 2018, 39(23): 199-204. DOI:10.7506/spkx1002-6630-201823030.
[12] BENJAKUL S, VISESSANGUAN W, TUEKSUBAN J. Changes in physico-chemical properties and gel-forming ability of lizardfish(Saurida tumbil) during post-mortem storage in ice[J]. Food Chemistry,2003, 80(4): 535-544. DOI:10.1016/S0308-8146(02)00339-4.
[13] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with Folin-phenol reagent[J]. Journal of Biological Chemistry, 1951, 193: 265-275.
[14] 杨晖, 马良, 韩霜, 等. 甘油添加量对兔皮明胶膜性能与结构的影响[J]. 食品科学, 2016, 37(17): 14-18. DOI:10.7506/spkx1002-6630-201617003.
[15] 邓丽, 李岩, 董秀萍, 等. 热加工过程中鲍鱼腹足蛋白间作用力及其质构特性[J]. 农业工程学报, 2014, 30(18): 307-316. DOI:10.3969/j.issn.1002-6819.2014.18.038.
[16] CAO Leipeng, RASCO B A, TANG Juming, et al. Effects of freshness on the cook loss and shrinkage of grass carp(Ctenopharyngodon idellus) fillets following pasteurization[J].International Journal of Food Properties, 2016, 19(10): 2297-2306.DOI:10.1080/10942912.2015.1123271.
[17] SHI Ce, CUI Jianyun, LUO Yongkang, et al. Post-mortem changes of silver carp (Hypophthalmichthys molitrix) stored at 0 ℃ assessed by electrical conductivity[J]. International Journal of Food Properties,2015, 18(2): 415-425. DOI:10.1080/10942912.2013.833220.
[18] XU Y S, XIA W S, YANG F, et al. Protein molecular interactions involved in the gel network formation of fermented silver carp mince inoculated with Pediococcus pentosaceus[J]. Food Chemistry, 2010,120(3): 717-723. DOI:10.1016/j.foodchem.2009.10.068.
[19] HAMAGUCHI P Y, WENG W Y, TANAKA M. Effect of pH on the formation of edible films made from the muscle proteins of Blue marlin (Makaira mazara)[J]. Food Chemistry, 2007, 100(3): 914-920.DOI:10.1016/j.foodchem.2005.10.045.
[20] TRAORE S, AUBRY L, GATELLIER P, et al. Effect of heat treatment on protein oxidation in pig meat[J]. Meat Science, 2012, 91(1): 14-21.DOI:10.1016/j.meatsci.2011.11.037.
[21] 刘海梅, 熊善柏, 谢笔钧, 等. 鲢鱼糜凝胶形成过程中化学作用力及蛋白质构象的变化[J]. 中国水产科学, 2008, 15(3): 469-475.DOI:10.3321/j.issn:1005-8737.2008.03.013.
[22] 邓丽, 李岩, 董秀萍, 等. 热加工过程中鲍鱼腹足蛋白间作用力及其质构特性[J]. 农业工程学报, 2014, 30(18): 307-316. DOI:10.3969/j.issn.1002-6819.2014.18.038.
[23] RIEBROY S, BENJAKUAL S, VISESSANGUAN W, et al. Acidinduced gelation of natural actomyosin from Atlantic cod (Gadus morhua) and burbot (Lota lota)[J]. Food Hydrocolloids, 2009, 23(1):26-39. DOI:10.1016/j.foodhyd.2007.11.010.
[24] HE J, ZHOU G H, BAI Y, et al. The effect of meat processing methods on changes in disulfide bonding and alteration of protein structures:impact on protein digestion products[J]. RSC Advances, 2018, 8:17595-17605. DOI:10.1039/c8ra02310g.
[25] 张兴, 杨玉玲, 马云, 等. pH对肌原纤维蛋白及其热诱导凝胶非共价键作用力与结构的影响[J]. 中国农业科学, 2017, 50(3): 564-573.DOI:10.3864/J.ISSN.0578-1752.2017.03.015.
[26] BADII F, HOWELL N K. Fish gelatin: structure, gelling properties and interaction with egg albumen proteins[J]. Food Hydrocolloids,2006, 20(5): 630-640. DOI:10.1016/j.foodhyd.2005.06.006.
[27] CHEN H Y, HAN M Y. Raman spectroscopic study of the effects of microbial transglutaminase on heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristics[J].Food Research International, 2011, 44(5): 1514-1520. DOI:10.1016/j.foodres.2011.03.052.
[28] BERHE D T, ENGELSEN S B, HVIID M S, et al. Raman spectroscopic study of effect of the cooking temperature and time on meat proteins[J]. Food Research International, 2014, 66: 123-131.DOI:10.1016/j.foodres.2014.09.010.
[29] ALIX A J P, PEDANOU G, BERJOTM. Fast determination of the quantitative secondary structure of proteins by using some parameters of the Raman amide I band[J]. Journal of Molecular Structure, 1988,174: 159-164.
[30] 王中江, 江连洲. 大豆分离蛋白在不同pH下的拉曼光谱分析[J].食品工业科技, 2012, 33(11): 63-66.
[31] MORIYAMA Y, KAWASAKA Y, TAKEDA K. Protective effect of small amounts of sodium dodecyl sulfate on the helical structure of bovine serum albumin in thermal denaturation[J]. Journal of Colloid &Interface Science, 2003, 257(1): 41-46. DOI:10.1016/S0021-9797(02)00017-6.
[32] 高瑞昌, 李雯雯, 孙璐, 等. 凡纳滨对虾肌肉蛋白质的热变性及其对品质的影响[J]. 中国食品学报, 2014, 14(7): 73-78. DOI:10.16429/j.1009-7848.2014.07.020.
Effect of Freshness of Monopterus albus on Protein Changes during Heating
TANG Mi, ZHENG Hong, MA Liang, et al. Effect of freshness of Monopterus albus on protein changes during heating[J].Food Science, 2019, 40(7): 47-53. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180901-005.http://www.spkx.net.cn