
茶多酚占茶叶干物质质量的18%~36%[1],是茶叶中重要的组成成分。目前茶多酚已实现了工业化生产,所用原料一般为低档绿茶,且茶多酚产品已有相应的国家标准GB/T 31740.2—2015《茶制品 第2部分:茶多酚》。据不完全统计,全国每年生产茶多酚的总量为3 000 t左右[2]。目前从茶叶中生产制备茶多酚仍主要依赖于溶剂萃取法,即利用水或乙醇浸提,经氯仿或二氯甲烷萃取以脱除咖啡碱,再经乙酸乙酯萃取得到茶多酚。现有方法存在不同程度的食品安全隐患和环保压力,随着消费者对茶多酚产品安全性要求越来越高,新的生产工艺也在涌现,例如以不同类型吸附材料为基础的吸附分离法[3-12]、超临界萃取法[13-16]等。但超临界萃取等新技术要求高、设备昂贵,距离工厂化生产应用尚待时日。另外,目前茶多酚的制备研究主要集中在提高多酚纯度,较少关注其中酯型或非酯型儿茶素的比例。大孔树脂作为一种吸附材料,具有价格适宜、可再生、热及化学稳定性较优、选择性较好等优点,研究表明适宜的大孔树脂可以实现分离制备茶多酚[3-4,17-20],且使用的溶剂以水和/或乙醇为主;因此大孔树脂具备工厂化、绿色化生产茶多酚的可行性。本实验所用的LP-8大孔树脂为自制材料,基于对茶多酚有特异吸附性的大孔树脂,通过优化树脂成粒工艺,引入对酚羟基具有较强吸附作用的聚酰胺基吸附基团,制得优选粒径树脂,既提高大孔树脂对茶多酚的负载量(提高46.2%),亦不影响常压下上样、洗脱流速,实现酯型儿茶素(表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、表儿茶素没食子酸酯(epicatechin gallate,ECG))与简单儿茶素的较好分离[1]。综上所述,本实验采用LP-8大孔树脂制备高含量酯型儿茶素茶多酚,探讨大孔树脂制备茶多酚的技术可行性,以期获得有别于现市场流通的差异化茶多酚样品。
LP-8大孔树脂,自制;儿茶素、咖啡碱标准品(纯度≥98%) 中国药品生物制品检定所;湖北恩施大宗绿茶 杭州远圣茶能科技有限公司;无水乙醇、冰醋酸、盐酸、氢氧化钠(分析纯) 国药集团化学试剂有限公司;乙腈(色谱纯) 天津四友精细化学品有限公司。
YF-20型提取罐 北京东华原医疗设备有限公司;YC-015型喷雾干燥机 上海雅程仪器设备有限公司;TU1901型紫外-可见分光光度计 北京普析通用仪器有限公司;分析天平 梅特勒-托利多仪器(上海)有限公司;1525型高效液相色谱仪 美国Waters公司;φ 4 cm×50 cm玻璃层析柱 华东医药股份有限公司;RE-52A型旋转蒸发器 上海亚荣生化仪器厂;ALPHA 1-2 LD plus型冷冻干燥机 德国Christ公司。
1.3.1 绿茶水提取物的制备
准确称取0.5 kg碾碎的绿茶,按固液比1∶15(m/V)加去离子水,置于提取罐中混匀。设定浸提温度85 ℃,浸提时间30 min,收集滤液。保留滤渣,同一条件进行二次浸提,收集滤液。合并滤液,浓缩、干燥,得绿茶水提取物固体粉末。
1.3.2 茶多酚、儿茶素、咖啡碱质量分数的测定
参照GB/T 8313—2008《茶叶中茶多酚和儿茶素类质量分数的检测方法》对茶多酚、儿茶素、咖啡碱质量分数进行测定,该方法中儿茶素类质量分数=表儿茶素质量分数+表没食子儿茶素质量分数+没食子儿茶素质量分数+EGCG质量分数+ECG质量分数,因此本实验所述酯型儿茶素质量分数是指:EGCG质量分数+ECG质量分数。
1.3.3 LP-8大孔树脂对茶多酚的吸附及洗脱能力测定
准确称取湿质量2.0 g的LP-8大孔树脂,装入100 mL锥形瓶中,加入6 mg/mL绿茶水提取物溶液200 mL,室温下振荡12 h进行充分吸附后测定溶液中茶多酚、酯型儿茶素(EGCG、ECG)及咖啡碱含量,并计算LP-8大孔树脂对茶多酚的吸附量(式(1))。同时,在吸附结束时,取出大孔树脂,用滤纸吸干表面水后置于锥形瓶中,加入100 mL的体积分数70%乙醇溶液,室温下恒温振荡12 h进行洗脱,洗脱结束后测定溶液中的茶多酚、酯型儿茶素(EGCG、ECG)及咖啡碱含量,并计算LP-8大孔树脂的洗脱率(式(2))。

1.3.4 LP-8大孔树脂静态吸附实验
1.3.4.1 静态吸附动力学实验
准确称取湿质量2 g的LP-8大孔树脂,装入500 mL锥形瓶中,加入240 mL的10 mg/mL绿茶水提取物溶液,室温下恒温振荡。在吸附2、6、10、20、30、40、50、60、90、120 min时测定大孔树脂对茶多酚的吸附量,并绘制静态吸附动力学曲线。
1.3.4.2 LP-8大孔树脂静态吸附等温线
准确称取湿质量2 g的LP-8大孔树脂6 份,装入锥形瓶中。分别添加质量浓度为4、5、6、7、8、9 mg/mL的绿茶水提取物溶液各100 mL。25 ℃下恒温振荡。待平衡后,测定溶液中茶多酚含量,并计算吸附量,绘制25 ℃吸附等温线,并进行Langmuir方程拟合。
1.3.5 LP-8大孔树脂动态吸附实验
当吸附过程中层析柱流出液内的茶多酚质量浓度达到上样样品中茶多酚质量浓度的10%时视为泄漏点[21-22],判定为吸附饱和。
1.3.5.1 吸附流速对吸附泄漏点的影响
准确量取50 mL湿树脂,进行湿法装柱。绿茶水提取物上样质量浓度为10 mg/mL,控制吸附流速分别为1、2 BV/h以及3 BV/h。收集每一床层体积流出液,并对流出液中的茶多酚含量进行测定。以流出液体积为横坐标,流出液中茶多酚质量浓度占上样样品中茶多酚质量浓度的比例为纵坐标,作动态吸附曲线。
1.3.5.2 上样质量浓度对吸附泄漏点对应的吸附量的影响
准确量取50 mL湿树脂,进行湿法装柱。配制上样质量浓度分别为10、20、30 mg/mL以及40 mg/mL的溶液,控制吸附流速为1 BV/h。收集每一床层体积流出液,并对流出液中的茶多酚含量进行测定。计算达到泄漏点时,不同上样质量浓度下的吸附量。
1.3.6 LP-8大孔树脂动态洗脱实验
采用湿法装柱。配制0%、10%、20%、30%、40%、50%、60%系列体积分数的乙醇溶液,各2 BV。以1 BV/h的流速进行梯度洗脱。每0.5 BV收集洗脱液,并测定茶多酚、酯型儿茶素、EGCG及咖啡碱的含量,绘制动态洗脱曲线。以酯型儿茶素含量为指标,确定适宜的乙醇洗脱体积分数梯度,以制得高含量酯型儿茶素茶多酚。
所有实验重复3 次,数据处理采用SAS 9.1软件,进行单因素方差分析(One-way analysis of variance,One-way ANOVA)和Tukey多重比较,P<0.05表示差异显著。
经测定,本实验中的原料茶——湖北恩施大宗绿茶中茶多酚质量分数为14.7%,咖啡碱质量分数为3.1%,儿茶素质量分数为10.6%,EGCG质量分数为6.3%,ECG质量分数为1.6%。
从图1可以看出,LP-8大孔树脂对茶多酚具有极好的吸附效果,吸附量为64.6 mg/g,且对咖啡碱的吸附作用较弱,吸附量为2.3 mg/g。此外,吸附的茶多酚中,酯型儿茶素占了较大的比例,为69%。

图1 LP-8大孔树脂对茶多酚、酯型儿茶素、EGCG、ECG及咖啡碱的吸附能力
Fig. 1 Adsorption capacity of resin LP-8 for tea polyphenols, esterified catechins, EGCG, ECG and caffeine

图2 茶多酚、酯型儿茶素、EGCG、ECG及咖啡碱在LP-8大孔树脂中的洗脱率
Fig. 2 Desorption rates of tea polyphenols, esteri fied catechins, EGCG,ECG and caffeine on resin LP-8
小写字母不同表示差异显著(P<0.05)。图7同。
从图2中可以看出,体积分数70%乙醇溶液对LP-8大孔树脂所吸附的茶多酚及酯型儿茶素具有较好的洗脱效果(洗脱率分别为93%、85%);而对咖啡碱的洗脱效果则较弱,洗脱率约42%。
以上结果与已有的选择性吸附洗脱茶多酚的大孔树脂研究结果[17-20]类似。因此LP-8大孔树脂具有用于分离制备绿茶高酯型儿茶素茶多酚的可行性。
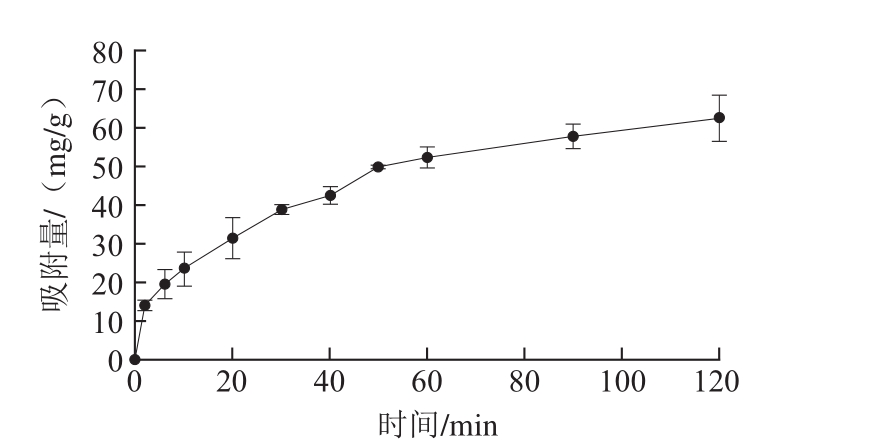
图3 茶多酚在LP-8大孔树脂中静态吸附量随时间变化曲线
Fig. 3 Static absorption curve for tea polyphenols on resin LP-8
从图3可以看到,在0~120 min内茶多酚在LP-8大孔树脂中的静态吸附量随着时间的延长而提高,但在60 min后变缓,且60 min与90、120 min时的吸附量无显著差异。因此判断60 min时,LP-8大孔树脂对茶多酚吸附接近饱和,近似平衡。
LP-8大孔树脂对茶多酚的静态等温吸附曲线(图4)描述的是茶多酚在LP-8大孔树脂中的平衡质量浓度与平衡吸附量的关系,可以看出平衡吸附量随着平衡质量浓度的增加而提升,随后在近50 mg/g时逐渐趋缓。

图4 LP-8大孔树对茶多酚的脂静态吸附等温线(25 ℃)
Fig. 4 Adsorption isotherm of resin LP-8 at 25 ℃ for tea polyphenols
Langmuir方程模型是一种平衡模型,可用以拟合被吸附物在吸附剂上的等温平衡吸附情况[23]。该模型有一个假设,即吸附剂表面均一,为单分子层对被吸附物的等温吸附,各处的吸附能相等。该方程模型表达式如式(3)所示。
式中:ρe为被吸附物的平衡质量浓度/(mg/mL);qe为吸附剂的平衡吸附量/(mg/g);qm为吸附剂的饱和吸附量(假定为单分子层)/(mg/g);K为能量常数。
用该模型对实验得到的吸附等温线进行拟合,得到相应的回归方程,如图5所示。

图5 LP-8大孔树脂吸附茶多酚的Langmuir方程模型(25 ℃)
Fig. 5 Linear correlation for adsorption of tea polyphenols on LP-8 resin at 25 ℃ based on the Langmuir model
从拟合方程的R2=0.991 6可以看出,该模型与LP-8大孔树脂等温吸附情况能较好拟合。根据拟合方程推算出LP-8大孔树脂在25 ℃下的单分子层饱和吸附量qm为70.9 mg/g,该吸附量进一步验证了LP-8大孔树脂对茶多酚具有较好的吸附效果。

图6 流出液中茶多酚质量浓度占上样初始质量浓度的比例在不同上样流速条件下随上样体积的变化
Fig. 6 Elution recovery of tea polyphenols as a function of loading volume at different loading fl ow rates
如图6所示,在不同流速下,流出液中茶多酚质量浓度所占比例随着流出液体积的增加而升高,且不同流速间有所差异。流速越大,相同流出体积下流出液中茶多酚质量浓度所占比例越高,即说明有更多的茶多酚未被LP-8大孔树脂吸附。以出现所占比例超过10%的体积为泄漏点,由图6可知,绿茶水提取物在LP-8大孔树脂中以1 BV/h吸附流速在8 BV时出现泄漏点,以2 BV/h吸附流速在6 BV时出现泄漏点,以3 BV/h吸附流速在5 BV时出现泄漏点,即吸附流速越大,泄漏点越提前出现。在动态吸附中,以不同吸附流速过柱,茶多酚与大孔树脂的接触时间存在差异。流速越小,茶多酚与大孔树脂的接触时间越长,大孔树脂对茶多酚的吸附越充分,即吸附量更高,吸附效果更佳[24]。因此,此后将1 BV/h设定为上样流速。
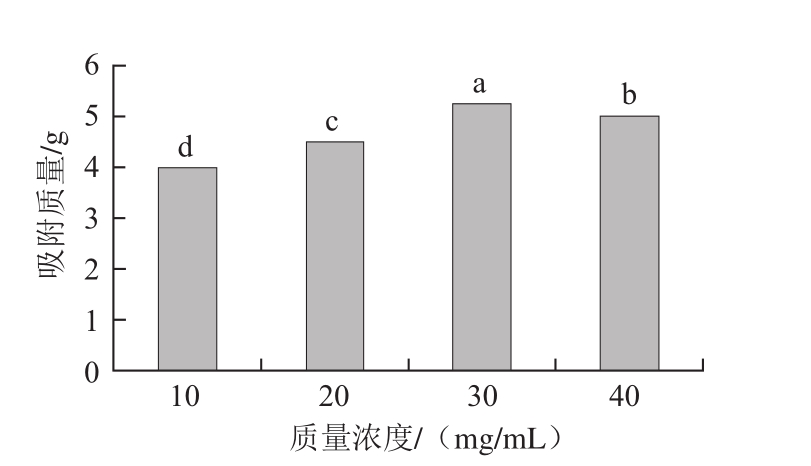
图7 不同上样质量浓度下LP-8大孔树脂对茶多酚的饱和吸附质量
Fig. 7 Saturated adsorption capacity of tea polyphenols onto LP-8 resin at different loading concentrations
如图7所示,不同上样质量浓度下,LP-8大孔树脂对茶多酚的饱和吸附质量存在差异,且30 mg/mL具有更高的吸附量,为5.25 g。所以后续实验以30 mg/mL的绿茶水提取物水溶液作为最佳上样质量浓度。
在上述吸附实验结果基础上,选择环境友好且易获得的乙醇作为洗脱剂,以实现高含量酯型儿茶素茶多酚的环境友好型制备。
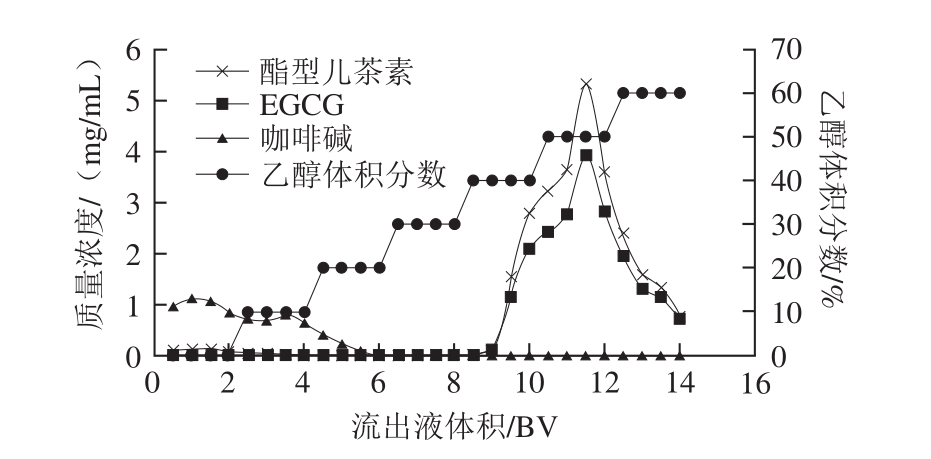
图8 不同乙醇体积分数下茶多酚的梯度洗脱曲线
Fig. 8 Dynamic desorption curves of tea polyphenols with different ethanol concentrations
从图8中可以看出,咖啡碱在乙醇体积分数大于20%的梯度洗脱液中均未检出,表明其在0~20%体积分数乙醇梯度洗脱时已基本被洗脱完全;酯型儿茶素(EGCG+ECG)在0~30%体积分数乙醇溶液中几乎未被洗脱,在乙醇体积分数不小于40%时逐渐被洗脱下来,且洗脱体积分数集中在40%~60%。合并40%~60%的洗脱液,测得其中酯型儿茶素在茶多酚中的比例为78.0%、EGCG为61.0%、ECG为17.0%,与原料相比,酯型儿茶素、EGCG、ECG在茶多酚中的比例分别提高了45.1%、42.2%和56.0%,无咖啡碱检出。将洗脱液进行旋转蒸发脱乙醇后干燥,得到高含量酯型儿茶素茶多酚样品。
茶多酚作为茶叶中最主要的功能活性成分,具有抗氧化、抗肿瘤、抗菌、抗病毒等多种功能活性[25-29]。其中EGCG、ECG等酯型儿茶素具有比其他茶多酚组分更强的活性[1],其含量常作为茶多酚品质的评判指标。鉴于传统的制备技术(金属离子沉淀法、溶剂萃取法等)无法实现酯型儿茶素等特异成分的定向富集[2],有研究者通过吸附分离法等技术对酯型儿茶素进行分离制备[30-31],但规模化制备技术尚未普遍,填料筛选、工艺优化等相关研究仍是当前热点。温尧林等[32]采用ADS-F8大孔树脂对茶多酚进行富集,制得低咖啡碱、高茶多酚的茶粉,其中茶多酚质量分数不小于85%,儿茶素质量分数不小于60%,EGCG质量分数不小于35%,咖啡碱质量分数不大于1%;李翠芹等[33]公开了一种无咖啡碱茶多酚分离纯化的方法,利用LX-8大孔树脂制备茶多酚质量分数大于96%、EGCG质量分数大于60%的茶多酚产品;综上,有关大孔树脂分离茶多酚乃至EGCG的研究相对已成熟,尚缺少针对酯型儿茶素特异吸附相关的研究,尤其是特异性吸附材料的筛选应用研究。
本实验以便于工业化生产为目标,应用LP-8大孔树脂对绿茶提取物进行分离,经静态、动态吸附实验,系统研究LP-8树脂对茶多酚、咖啡碱、EGCG、ECG、酯型儿茶素的吸附、洗脱特性,结果表明:LP-8树脂对茶多酚、咖啡碱、酯型儿茶素有选择性吸附、洗脱特性,通过工艺优化可实现酯型儿茶素含量高、脱咖啡碱茶多酚的制备。在吸附流速1 BV/h、上样质量浓度30 mg/mL的动态吸附和40%~60%乙醇梯度动态洗脱条件下,获得了酯型儿茶素比例为78.0%的茶多酚,实现了高含量酯型儿茶素茶多酚的制备,该含量优于现有一些相关研究结果[23-34],本方法可获得有别于目前市场流通的差异化茶多酚样品,为工业化推广提供参考。后续大量工作仍需继续开展,如进一步优化吸附洗脱条件、干燥方式等。
[1] 宛晓春. 茶叶生物化学[M]. 北京: 中国农业出版社, 2008: 9.
[2] 王洪新, 马朝阳, 吕文平, 等. 茶多酚工业化制备工艺发展历程及现状[J]. 中国茶叶加工, 2015(4): 15-18. DOI:10.15905/j.cnki.33-1157/ts.2015.04.003.
[3] 叶俭慧, 梁月荣. 大孔吸附树脂分离茶多酚的研究[J]. 茶叶, 2006,32(3): 128-132. DOI:10.3969/j.issn.0577-8921.2006.03.002.
[4] 纪小燕, 王玉, 丁兆堂, 等. 大孔吸附树脂对茶多酚和咖啡碱吸附及洗脱性能的研究[J]. 食品工业科技, 2011, 32(2): 118-120.DOI:10.13386/j.issn1002-0306.2011.02.027.
[5] 唐课文, 周春山, 钟世安, 等. 聚酰胺树脂对茶多酚和咖啡因吸附选择性研究[J]. 光谱学与光谱分析, 2003, 23(1): 143-145.DOI:10.3321/j.issn:1000-0593.2003.01.040.
[6] 吴唯, 薛扬, 徐嘉良, 等. 层析聚酰胺树脂对茶叶中茶多酚的吸附分离[J]. 高分子材料科学与工程, 2009, 25(4): 123-126.DOI:10.16865/j.cnki.1000-7555.2009.04.034.
[7] 罗志敏, 薛丽群, 张婷, 等. 珠状壳聚糖树脂对绿茶中茶多酚的吸附研究[J]. 食品科学, 2009, 30(1): 86-89. DOI:10.3321/j.issn:1002-6630.2009.01.020.
[8] 薛丽群, 罗志敏, 陈盛. 超声波浸提-壳聚糖吸附分离茶末中茶多酚[J]. 食品研究与开发, 2013, 34(8): 39-43. DOI:10.3969/j.issn.1005-6521.2013.08.011.
[9] 吴培龙, 张黎明, 杨鑫, 等. 玉米多孔淀粉对茶多酚的吸附性能研究[J]. 现代食品科技, 2010, 26(9): 938-941. DOI:10.13982/j.mfst.1673-9078.2010.09.004.
[10] 骆慧敏, 宁敏, 徐迎波, 等. 多孔淀粉对茶多酚的吸附性能及其复合物抗氧化能力的研究[J]. 茶叶科学, 2015(5): 473-480.DOI:10.13305/j.cnki.jts.2015.05.011.
[11] 王毓, 旺密, 夏卉芳, 等. PVPP/麦饭石复合凝胶吸附茶多酚的研究[J]. 湖北农业科学, 2015(10): 2374-2376. DOI:10.14088/j.cnki.issn0439-8114.2015.10.017.
[12] 王秀萍, 朱海燕, 谢苏平. 木质纤维素吸附分离法纯化茶多酚研究[J]. 茶叶学报, 2015, 56(4): 223-231. DOI:10.3969/j.issn.1007-4872.2015.04.005.
[13] 王朝瑾, 马红青, 陈温娴. 超临界萃取茶叶中茶多酚的提取与应用[J].分析科学学报, 2009, 25(3): 281-284.
[14] 李文婷, 车振明, 罗梦莹. 超临界CO2萃取绿茶中茶多酚工艺的研究[J].食品工业, 2011, 32(7): 22-24.
[15] 尹志芳, 彭晓赟, 杨宇强, 等. 黑茶中茶多酚的醇水-超临界CO2流体联合提取[J]. 食品工业科技, 2015, 36(5): 194-197. DOI:10.13386/j.issn1002-0306.2015.05.032.
[16] 高阳, 赵生, 许式强, 等. 茶多酚的提取纯化及在卷烟减害中的应用[J].食品工业, 2015, 36(4): 58-61.
[17] 王同宝, 张效林, 张卫红. 阶段洗脱吸附层吸法分离茶多酚咖啡碱[J].离子交换与吸附, 2005, 21(4): 329-334. DOI:10.16026/j.cnki.iea.2005.04.007.
[18] 董文宾, 胡英, 张建华. 吸附树脂法制备茶多酚精品的工艺研究[J]. 食品科学, 2002, 23(11): 68-73. DOI:10.3321/j.issn:1002-6630.2002.11.015.
[19] 孙健. 茶多酚的定性定量分析方法及大孔吸附树脂纯化工艺条件优化的研究[D]. 大连: 大连理工大学, 2002: 52.
[20] 张琪. 绿茶中茶多酚的提取分离及其对慢性胃炎大鼠胃粘膜的保护作用[D]. 西安: 陕西师范大学, 2015: 39-40.
[21] JIN X, LIU M, CHEN Z, et al. Separation and purification of epigallocatechin-3-gallate (EGCG) from green tea using combined macroporous resin and polyamide column chromatography[J].Journal of Chromatography B, 2015, 1002: 113-122. DOI:10.1016/j.jchromb.2015.07.055.
[22] LIU W, ZHANG S, ZU Y G, et al. Preliminary enrichment and separation of genistein and apigenin from extracts of pigeon pea roots by macroporous resins[J]. Bioresource Technology, 2010, 101(12):4667-4675. DOI:10.1016/j.biortech.2010.01.058.
[23] 姜绍通, 董新昕, 黄静. PA、H103及XAD-4树脂在茶多酚吸附工艺中的特性研究[J]. 食品科学, 2003, 24(12): 40-43. DOI:10.3321/j.issn:1002-6630.2003.12.004.
[24] 王丽丽. 茶多酚及其单体EGCG的分离纯化研究[D]. 济南: 山东大学, 2008: 45.
[25] HIGDON J V, FREI B. Tea catechins and polyphenols: health effects, metabolism, and antioxidant functions[J]. Critical Reviews in Food Science and Nutrition, 2003, 43(1): 89-143.DOI:10.1080/10408690390826464.
[26] JOSEPH A, MOHAN N. Antioxidant activity and phytochemical screening of different varieties of tea[J]. The Indian Journal of Nutrition and Dietetics, 2017, 54(3): 366-373. DOI:10.21048/ijnd.2017.54.3.16051.
[27] YANG C S, LI G, YANG Z, et al. Cancer prevention by tocopherols and tea polyphenols[J]. Cancer Letters, 2013, 334(1): 79-85.DOI:10.1016/j.canlet.2013.01.051.
[28] KOECH R K, WANYOKO J, WACHIRA F. Antioxidant,antimicrobial and synergistic activities of tea polyphenols[J].International Journal of Infectious Diseases, 2014, 21(Suppl 1): 98.DOI:10.1016/j.ijid.2014.03.631.
[29] 周先云. 茶多酚辅助治疗慢性乙型肝炎的临床效果[J]. 广州医科大学学报, 2016, 44(1): 53-55.
[30] 王兆丰. 茶多酚纯化及酯型儿茶素单体分离研究[D]. 兰州: 西北师范大学, 2013: 34-53.
[31] 仉燕崃. 酯型儿茶素的分离纯化工艺研究[D]. 大连: 大连理工大学,2006: 27-45.
[32] 温尧林, 李坤. 一种低咖啡因、高茶多酚茶粉的制备方法:CN101986855A[P]. 2011-03-23[2017-12-20].
[33] 李翠芹, 张琪, 刘希. 无咖啡因茶多酚分离纯化的方法:CN104398669A[P]. 2014-10-31[2017-12-20].
[34] 刘忠英. 普洱茶萃取液风味组分分段截留工艺优化研究[D]. 重庆:西南大学, 2015: 40-41.
Use of Macroporous Resin LP-8 for Preparing Tea Polyphenols Rich in Esterified Catechins
CHEN Lin, LÜ Yangjun, ZHANG Haihua, et al. Use of macroporous resin LP-8 for preparing tea polyphenols rich in esterified catechins[J]. Food Science, 2019, 40(7): 68-73. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20180125-318. http://www.spkx.net.cn